Fotoquímica da Atmosfera
|
|
|
- Maria Vitória Mendes de Carvalho
- 7 Há anos
- Visualizações:
Transcrição
1 Faculdade de Ciências da Universidade do Porto Departamento de Química Seminário de Química Fotoquímica da Atmosfera Trabalho Realizado por: Sofia Isabel da Costa Gomes Brandão Com a orientação de: Professor Doutor Carlos Gomes Porto, 7 de Maio de 2008
2 Agradecimentos Queria agradecer à minha família e a todos os meus amigos que, durante este estágio, me apoiaram e me ajudaram a manter motivada em todos os momentos. Um agradecimento muito especial ao José Carlos pelo seu apoio total e incondicional e por toda a paciência e tempo dispendidos. Queria também agradecer à minha orientadora, Mestre Teresa Costa, pela partilha de ideias e experiências e pela completa disponibilidade e apoio. Por último, queria agradecer ao meu orientador, Professor Doutor Carlos Gomes. Obrigado pela orientação, disponibilidade e opiniões que me ajudaram a evoluir, ao longo deste ano lectivo, como professora e como pessoa. 1
3 Índice 1. A Atmosfera Terrestre Evolução Estrutura Composição Ozono Breve referência histórica A Camada de Ozono Fotoquímica da Estratosfera Reacções Fotoquímicas Mecanismo de Chapman Ciclos de HO x Ciclos de NO x Ciclos de ClO x Reservatório de espécies e acoplamento dos ciclos Diminuição da concentração de ozono estratosférico (buraco na camada de ozono) Nuvens polares estratosféricas Nuvens polares estratosféricas e diminuição da concentração de ozono estratosférico Fotoquímica da Troposfera Ciclo fotoquímico de NO 2, NO e O A química atmosférica do CO e NO x a importância do radical HO A química atmosférica do formaldeído e NO x A química da troposfera de fundo Fotólise do ozono Oxidação do metano Peróxido de hidrogénio Radical hidroxilo Radical nitrato Smog fotoquímico Origem do smog fotoquímico
4 Redução do smog fotoquímico Propostas pedagógicas Literatura Orientações curriculares Portugal Reino Unido Conclusão Bibliografia
5 1. A Atmosfera Terrestre 1.1. Evolução O Sistema Solar ter-se-á formado, há cerca de 4500 milhões de anos, a partir da nebulosa solar, uma nebulosa interestelar primitiva composta por gases e poeiras em rotação. A atmosfera original da Terra, resultante da condensação desta nebulosa, terá sido varrida para o espaço exterior pelos ventos solares. Uma nova atmosfera terrestre terá então surgido mais tarde, como resultado de processos semelhantes às erupções vulcânicas, onde o dióxido de carbono, o azoto e o vapor de água eram os seus principais constituintes. Com o arrefecimento da superfície terrestre, formaram-se grandes oceanos, resultantes de chuvas torrenciais. O dióxido de carbono dissolvido nas chuvas começou a incorporar-se nas rochas carbonatadas sedimentares, através de reacções químicas, o que levou a uma drástica diminuição da concentração deste gás na atmosfera. O azoto, por sua vez, sendo insolúvel na água e apenas condensando a baixas temperaturas, permaneceu na fase gasosa na atmosfera, passando a ser o seu maior constituinte. Contudo, grandes diferenças existem entre esta atmosfera inicial e a atmosfera actual. Inicialmente, a atmosfera era bastante redutora, no entanto actualmente, ela tem carácter oxidante. O aumento da concentração de oxigénio deve-se à fotossíntese, processo através do qual o dióxido de carbono e a água se combinam para produzir matéria orgânica, libertando como produto secundário o oxigénio. O nível actual de oxigénio terá sido alcançado há aproximadamente 400 milhões de anos e é mantido devido ao balanço entre a fotossíntese, a respiração e a decomposição de matéria orgânica Estrutura A atmosfera terrestre é caracterizada por variações de temperatura, pressão e composição com a altitude. Um perfil vertical da temperatura média global permite dividir a atmosfera em várias camadas com características distintas, em seguida enunciadas. 4
6 Troposfera: É a camada compreendida entre a superfície e cerca de 12 km de altitude. Devido ao facto de a superfície terrestre absorver energia solar, actuando como radiador de calor, nesta camada a temperatura decresce com a altitude. Esta camada é a responsável pela preservação da humidade (vapor de água) dado que à medida que o ar quente sobe, arrefece e condensa, voltando eventualmente à superfície terrestre sob a forma de precipitação. A fronteira superior desta camada designa-se por tropopausa, tratando-se de uma superfície isobárica e cuja altura decresce, embora de modo não gradual, do equador em direcção aos pólos. Figura 1 Atmosfera terrestre [3] Estratosfera: É a camada situada deste a tropopausa até cerca de 50 km de altitude. É nesta camada que se situa a camada do ozono, que protege a biosfera dos efeitos nocivos da radiação ultra-violeta e que influencia a estrutura térmica de toda a atmosfera. Nesta camada a temperatura aumenta com a altitude até ao seu limite superior, designado por estratopausa. O referido aumento de temperatura deve-se ao 5
7 aquecimento resultante da absorção de raios ultra-violeta pela camada do ozono e contribui para a capacidade da Terra reter a humidade (vapor de água). Figura 2 Localização da camada do ozono [3] Mesosfera: É a camada acima da estratopausa e estende-se, aproximadamente, até aos 85 km de altitude. Nesta camada observa-se uma nova diminuição da temperatura com a altitude, devido à menor influência do ozono. O seu limite superior é designado por mesopausa. Termosfera: É a camada situada acima da mesopausa e estende-se até cerca de 500 km de altitude. Esta camada é caracterizada por uma elevada rarefacção do ar e pela sua grande reactividade à radicação. Devido à existência de ozono e oxigénio que absorvem a radiação, a temperatura desta camada volta a aumentar com a altitude, sendo no entanto sensível aos ventos solares, atingindo valores mais elevados quando existe grande actividade nas manchas solares. Esta camada é também designada por ionosfera, devido às suas propriedades eléctricas. A ionosfera, região electrificada da atmosfera, inicia-se na verdade na mesosfera, a cerca de 60 km de altitude, estendendose para cima até ao limite da atmosfera Composição A composição química da atmosfera até à mesopausa é praticamente uniforme face às concentrações de azoto, oxigénio e outros gases inertes, pelo que esta zona é designada por homosfera. 6
8 O vapor de água predomina na troposfera e o ozono na estratosfera intermédia. O dióxido de carbono encontra-se muito bem misturado abaixo da mesopausa. Existem também substâncias em suspensão na atmosfera, como água líquida e sólida, poeiras, aerossóis e cinzas vulcânicas. Embora a concentração de vapor de água e de ozono sejam diminutas quando comparadas com outros gases, estes têm um papel crucial no balanço energético da Terra, devido ao seu envolvimento nos processos radiativos. Acima da mesopausa, não existe uma uniformização da distribuição de moléculas e iões, pelo que esta zona é designada de heterosfera. Apesar de a atmosfera apresentar um carácter aparentemente estático, ela é na verdade dinâmica, havendo uma constante permuta de componentes gasosos entre esta e a biosfera (vegetação, oceanos e organismos vivos). É apenas a partir do estudo químico dos processos de eliminação e produção destes componentes, da atmosfera e para a atmosfera, que nos é possível detectar e analisar a sua evolução e prever consequências futuras das acções do Homem. 2. Ozono 2.1. Breve referência histórica O ozono foi descoberto em meados do século XIX por C. F. Schönbein e a sua importância na constituição atmosférica foi amplamente evidenciada no século XX. O ozono (O 3 ) é um gás oxidante e reactivo e um dos componentes mais importantes da estratosfera (onde se encontra 90% da sua quantidade atmosférica total) mesmo sendo um componente minoritário (0,001%) quando comparado com o azoto (79%) e o oxigénio (21%). Em 1930 foi proposto por S. Chapman um mecanismo de formação cíclica de ozono na atmosfera, iniciado por um processo de fotólise do oxigénio (O 2 ) na estratosfera (a cerca de 30 km de altitude). Este processo fotoquímico é conhecido por mecanismo de Chapman. Contudo este mecanismo previa uma concentração de ozono acima da observada experimentalmente, motivo pelo qual foram propostas algumas 7
9 reacções químicas paralelas ao referido mecanismo que levavam à destruição do ozono estratosférico. Com a evolução do estudo da química da atmosfera foi possível fazer novas descobertas acerca dos mecanismos químicos que envolviam o ozono estratosférico. Em 1970 P. Crutzen descobriu a função dos óxidos de azoto nos mecanismos de destruição do ozono e em 1974 M. Molina e F. S. Rowland previram o efeito nocivo do cloro libertado dos clorofluorcarbonetos (CFC s), compostos amplamente utilizados pelo Homem, nesses mesmos mecanismos. Contudo a evidência definitiva da existência de uma diminuição da quantidade de ozono estratosférico apenas surgiu em 1985, quando um grupo de cientistas liderado por Farman, descobriu o buraco na camada de ozono na Antárctida A Camada de Ozono Define-se como camada de ozono, o ozono estratosférico que actua como um filtro que protege a vida na Terra da radiação ultra-violeta nociva do Sol. É todavia evidente que esta função protectora está ameaçada, devido a diminuição da camada de ozono. A camada de ozono desempenhou provavelmente um papel crucial na evolução da vida na Terra, não só como filtro protector mas também como factor determinante na circulação da água no ciclo hidrológico e na estabilidade térmica da Terra. Desde os anos 60 do século XX que os níveis de ozono na estratosfera são monitorizados na Antárctida, contudo o facto de estes níveis baixarem de forma dramática sazonalmente (entre Setembro e Novembro) só foi conhecido em No início dos anos 90 do século passado foi registada uma diminuição de 60% dos níveis de ozono sobre a Antárctida. Contudo esta diminuição não está limitada à Antárctida. Nos anos 80 do século XX registou-se uma diminuição de 3% do valor médio global de ozono estratosférico. Para fazer face a este problema vinte e quatro países assinaram, em 1987, o Protocolo de Montreal, cujo principal objectivo era reduzir a produção e o consumo de CFC s até Todavia, em 1992, em Copenhaga este Protocolo foi reformulado de modo a que até 1996 toda a produção e consumo fosse eliminada. 8
10 Contudo este problema continuará neste século, dado que mesmo eliminando a emissão e produção de CFC s, os constituintes químicos que levam à destruição da camada de ozono podem permanecer activos na estratosfera por mais de duzentos anos. 3. Fotoquímica da Estratosfera 3.1. Reacções Fotoquímicas Nas reacções fotoquímicas, o fotão é considerado um reagente e é representado por hν. Segundo a Lei de Planck esta é a energia de um fotão com frequência ν. Comparando as energias das ligações químicas moleculares com as energias dos fotões, conclui-se que os fotões de menor energia, mas com capacidade de desencadear reacções químicas, apresentam comprimentos de onda na região do visível do espectro electromagnético. Esta gama de comprimentos de onda coincide, aproximadamente, com as energias a que ocorrem transições electrónicas. As moléculas mais pequenas têm, de um modo geral, absorções electrónicas intensas a comprimentos de onda menores, quando comparadas com moléculas maiores. forma: O primeiro passo de uma reacção fotoquímica pode ser escrito da seguinte A + hν A* onde A* representa uma molécula que se encontra num estado electrónico excitado. Seguidamente A* pode participar em diferentes tipos de reacções: 1. Dissociação: A* B 1 + B 2 2. Reacção directa: A* + B C 1 + C 2 3. Fluorescência: A* A + hν 4. Desactivação colisional: A* + M A + M 5. Ionização: A* A + + e - 9
11 Uma molécula pode sofrer fotodissociação se a energia do fotão exceder a energia de ligação de uma dada ligação química. Deste modo, as moléculas excitadas A* podem conservar-se acima do limite de dissociação da molécula, assim como um ou mais produtos de reacção de fotodissociação podem permanecer em níveis electrónicos excitados Mecanismo de Chapman A radiação solar que penetra na estratosfera, com comprimentos de onda inferiores a 242 nm, provoca a lenta dissociação do oxigénio molecular: O 2 + hν O + O (λ < 242 nm) o átomo de oxigénio resultante reage prontamente com o oxigénio molecular na presença de uma terceira molécula, M (usualmente M é uma molécula de O 2 ou N 2 ), formando o ozono: O + O 2 + M O 3 + M Esta é a única reacção que conduz à produção de ozono na atmosfera. A molécula de ozono, absorve fortemente a radiação com comprimentos de onda entre 240 e 320 nm, decompondo-se em oxigénio molecular e oxigénio atómico: O 3 + hν O 2 + O (240 <λ < 320 nm) O ozono pode também dissociar-se ao reagir com o oxigénio atómico, levando à formação de duas moléculas de oxigénio molecular: O 3 + O 2 O 2 Este mecanismo foi aceite como representativo das reacções de formação e destruição do ozono na estratosfera até cerca de Porém, cálculos realizados nessa época previam uma maior quantidade de ozono do que a calculada anteriormente e medições da concentração de ozono mostravam que a sua quantidade real era duas 10
12 vezes inferior à prevista. Concluiu-se assim que deveriam existir outras reacções químicas que levariam à destruição do ozono. Estes novos processos de destruição do ozono, sob a forma de um ciclo catalítico geral, são assim associados ao mecanismo de Chapman: X + O 3 XO + O 2 XO + O X + O 2 Onde X é um radical livre catalisador, podendo representar H, OH, NO, Cl ou Br. A reacção global deste ciclo pode ser descrita como: O 3 + O 2 O Ciclos de HO x Denomina-se HO x ao grupo de radicais livres H, HO e HO 2. Existem vários ciclos possíveis para a família HO x : Ciclo 1: H + O 3 HO + O 2 HO + O H + O 2 Global O 3 + O 2 O 2 Ciclo 2: HO + O 3 HO 2 + O 2 HO 2 + O HO + O 2 Global O 3 + O 2 O 2 Ciclo 3: HO + O H + O 2 H + O 2 + M HO 2 + M 11
13 HO 2 + O HO + O 2 Global 2 O + M O 2 + M Ciclo 4: HO + O 3 HO 2 + O 2 HO 2 + O 3 HO + 2 O 2 Global 2 O 3 3 O 2 A importância relativa de cada um dos ciclos a uma dada altitude da estratosfera depende das concentrações relativas dos radicais O, HO e HO Ciclos de NO x Denomina-se NO x ao grupo de radicais livres NO e NO 2. O ciclo seguinte ocorre em toda a extensão da estratosfera: Ciclo 1: NO + O 3 NO 2 + O 2 NO 2 + O NO + O 2 Global O 3 + O 2 O 2 Contudo, na baixa estratosfera, onde a concentração de ozono é superior, um outro ciclo ocorre: Ciclo 2: NO + O 3 NO 2 + O 2 NO 2 + O 3 NO 3 + O 2 NO 3 + hν NO + O 2 Global 2 O 3 3 O 2 O radical nitrato formado é contudo rapidamente fotolizado durante o dia. Esta fotólise pode ocorrer como resultado de duas reacções distintas: 12
14 Reacção 1: NO 3 + hν NO 2 + O Reacção 2: NO 3 + hν NO + O 2 O radical nitrato pode também reagir com o dióxido de azoto, produzindo assim pentóxido de diazoto: NO 3 + NO 2 + M N 2 O 5 + M Este composto decompõe-se termicamente ou por fotólise, regenerando os reagentes. Como a sua formação não implica uma perda permanente de NO x, o pentóxido de diazoto é considerado um reservatório de NO x. A reacção: N 2 O 5 + H 2 O (s) 2 HNO 3 (s) onde H 2 O (s) representa uma molécula de água absorvida numa partícula sólida, é uma reacção muito lenta em fase gasosa, mas que ocorre eficazmente nas partículas dos aerossóis, sendo por este motivo, uma reacção importante na estratosfera Ciclos de ClO x Em 1974 verificou-se que os clorofluorcarbonetos não eram destruídos na troposfera, persistindo na atmosfera até alcançarem a estratosfera onde ocorria a sua fotólise, provocada pela radiação solar UV: CFCl 3 + hν CFCl 2 + Cl CF 2 Cl 2 + hν CF 2 Cl + Cl Estas reacções são exemplos da dissociação dos CFC s que são fotolisados entre 185 e 210 nm, razão pela qual não necessitam de subir acima do oxigénio molecular e 13
15 do ozono. O átomo de cloro é extremamente reactivo com o ozono e estabiliza um ciclo de destruição do ozono: Ciclo 1: Cl + O 3 ClO + O 2 ClO + O Cl + O 2 Global O 3 + O 2 O 2 Outras reacções envolvendo os radicais CFCl 2 e CF 2 Cl conduzem à libertação dos restantes átomos de cloro, que fomentam o ciclo anterior Reservatório de espécies e acoplamento dos ciclos Analisando os ciclos anteriores poderíamos supor que estes levariam a perdas significativas e permanentes de ozono. Todavia, estes ciclos podem ser interrompidos quando a espécie reactiva HO, NO 2, Cl e ClO participa noutras reacções químicas, deixando de estar acessíveis. Como exemplos de reacções químicas que conduzem à interrupção dos ciclos temos: HO + NO 2 + Μ HNO 3 + M Cl + CH 4 HCl + CH 3 Tanto os ácidos nítrico como clorídrico são espécies estáveis na estratosfera. As espécies reactivas podem também sofrer remoções temporárias dos ciclos catalíticos, sendo guardadas em reservatórios de espécies. Isto significa que a espécie reactiva é modificada para uma forma não reactiva não sendo contudo retirada da atmosfera. Uma das mais importantes espécies reservatório da estratosfera é o nitrato de cloro, formada segundo a reacção: ClO + NO 2 + Μ ClONO 2 + M Esta espécie reservatório é especialmente importante pois acumula dois agentes catalíticos, o NO 2 e o ClO. 14
16 O nitrato de cloro sofre fotólise de dois modos distintos, ocorrendo a libertação do átomo de cloro e do óxido de cloro, espécies activas do ciclo ClO x : Reacção 1: ClONO 2 + hν ClO + NO 2 Reacção 2: ClONO 2 + hν Cl + NO 3 A distribuição das espécies de cloro entre as formas reactivas e não reactivas depende da temperatura, altitude e latitude e a importância do nitrato de cloro como espécie reservatório depende da concentração de NO 2 e ClO na estratosfera. Verifica-se assim um acoplamento dos ciclos HO x, NO x e ClO x, que condiciona a química do ozono estratosférico. O acoplamento dos ciclos HO x e NO x ocorre da seguinte forma: HO 2 + NO NO 2 + HO HO + NO 2 + Μ HNO 3 + M HNO 3 + hν HO + NO 2 HNO 3 + HO H 2 O + NO 3 O acoplamento dos ciclos HO x e ClO x ocorre do seguinte modo: HO + HCl H 2 O + Cl HO 2 + ClO HOCl + O 2 O aumento da concentração de HO produz, nos ciclos NO x e ClO x efeitos opostos. No caso dos ciclos ClO x, este aumento conduz à produção de Cl, aumentando o poder destruidor do ozono do ciclo. No caso dos ciclos NO x, este aumento conduz à produção de HNO 3, o que corresponde a um abrandamento destes ciclos, ou seja, corresponde a um abrandamento da destruição do ozono. 15
17 3.7. Diminuição da concentração de ozono estratosférico (buraco na camada de ozono) A Antárctida é o local do planeta que apresenta as concentrações mais elevadas de ozono durante grande parte do ano. Este ozono é sintetizado nos trópicos e enviado, juntamente com os reservatórios de cloro molecular, para a Antárctida através de movimentações maciças de ar. A estratosfera da Antárctida apresenta contudo concentrações diminutas de oxigénio atómico, pois neste local as radiações UV são pouco intensas. Durante o Inverno, na Antárctida, surgem colunas descendentes de ar que se deslocam para oeste, devido ao arrefecimento observado. Este ciclone polar é extremamente estável no Inverno e início da Primavera, protegendo o núcleo de ar muito frio do ar exterior. Este ciclone retém, durante vários meses, o ozono que viajou dos trópicos até à Antárctida. Com a chegada do mês de Setembro, quando o Sol volta a brilhar sobre a Antárctida, a temperatura sobe e o ciclone começa a perder intensidade, podendo mesmo desaparecer em Novembro. É também nesta altura que a quantidade de ozono existente no ciclone polar começa a diminuir. Contudo, informações recolhidas nas últimas décadas indicam que os níveis de ozono estratosférico, durante a Primavera, têm vindo a diminuir drasticamente. Surgiram várias explicações sugerindo que esta diminuição de ozono se poderia dever unicamente ao ciclo solar. Todavia, nenhuma destas explicações conseguia interpretar correctamente as alterações observadas. Numa tentativa de compreender os mecanismos que estavam a despoletar tal diminuição da quantidade de ozono, foram propostas explicações que se baseavam nos ciclos catalíticos descritos anteriormente. Devido à fraca intensidade da radiação solar sobre a Antárctida, a fotodissociação do oxigénio ocorre numa escala reduzida, pelo que a produção de ozono nesta área é diminuta. Por este motivo, os ciclos catalíticos que necessitam de átomos de oxigénio, não podem explicar a diminuição da quantidade de ozono. A diminuição da quantidade de ozono verifica-se para altitudes compreendidas entre os 12 e 24 km. Dado que os CFC s e halogéneos são mais eficientes a destruir o ozono para altitudes superiores a 40 km, estes compostos não poderiam explicar por si só esta diminuição. Além deste facto, a quantidade existente de CFC s e halogéneos só poderia destruir cerca de 5 a 10% do ozono presente acima dos 40 km de altitude. Foi proposto então o seguinte mecanismo: 16
18 ClO + ClO + M Cl 2 O 2 + M Cl 2 O 2 + hν Cl + Cl + O 2 2 (Cl + O 3 ClO + O 2 ) Global 2 O 3 + hν 3 O 2 A fotólise do Cl 2 O 2 pode ocorrer segundo duas vias: Reacção 1: Cl 2 O 2 + hν Cl + ClOO Reacção 2: Cl 2 O 2 + hν ClO + ClO Apenas a primeira reacção pode conduzir a ciclos de destruição de ozono. O produto ClOO decompõe-se rapidamente segundo a reacção: ClOO + M Cl + O 2 + M Se a quantidade de ClO for suficiente, pode-se formar um ciclo de reacções de destruição substancial de ozono. Porém, a química em fase gasosa do sistema ClO x não produz a quantidade necessária de ClO para justificar totalmente a diminuição drástica de ozono observada na estratosfera Nuvens polares estratosféricas A noite polar é caracterizada por temperaturas muito baixas, da ordem dos 183 K para altitudes compreendidas entre 15 e 20 km. A estas temperaturas o pouco vapor de água existente na estratosfera condensa, formando-se as denominadas nuvens polares estratosféricas, que se encontram a altitudes compreendidas entre os 10 e 25 km. A composição das nuvens polares estratosféricas é ainda incerta, assim como os mecanismos que levam à sua formação Nuvens polares estratosféricas e diminuição da concentração de ozono estratosférico A química em fase gasosa dos ciclos ClO x e NO x não permite explicar o fenómeno da diminuição da concentração de ozono estratosférico. Contudo, as reacções 17
19 em fase heterogénea que ocorrem nas nuvens polares estratosféricas são de extrema importância no mecanismo de destruição do ozono. Existe na estratosfera uma camada de aerossóis a altitudes de 12 a 30 km. Estes aerossóis são compostos por pequenas gotas de ácido sulfúrico, apresentando diâmetros da ordem dos 0,2 µm e concentrações da ordem de 1 a 10 cm -3. Para latitudes médias na estratosfera baixa (aproximadamente 16 km) a temperatura é de cerca de 220 K e as partículas em equilíbrio com 5 ppm de água apresentam composições de 70 a 75 % (em massa) de ácido sulfúrico. Com a diminuição da temperatura, estas partículas absorvem água para manter o equilíbrio e a 195 K elas apresentam composições de 40 % (em massa) de ácido sulfúrico. De um modo geral, a libertação de cloro activo das espécies HCl e ClONO 2 é um processo lento, contudo as nuvens polares estratosféricas promovem a sua conversão em cloro fotoquimicamente activo. O primeiro passo do processo é a absorção dos gases nas nuvens polares estratosféricas, passo que é extremamente eficiente. O passo seguinte é a reacção heterogénea do gás ClONO 2 com o HCl que se encontra na superfície do gelo: HCl (s) + ClONO 2 Cl 2 + HNO 3 (s) onde (s) representa a superfície do gelo. Esta é a reacção de activação de cloro estratosférico polar mais importante. A solubilidade do HCl no aerossol estratosférico com concentrações de 50 a 80 % de ácido sulfúrico é relativamente baixa. Todavia quando as temperaturas estratosféricas descem para valores inferiores a 200 K, as partículas estratosféricas absorvem água, facto que permite a absorção do HCl. O Cl 2 libertado sofre fotólise rapidamente, produzindo átomos de Cl, ao passo que o HNO 3 permanece no gelo, originando uma remoção dos óxidos de azoto da fase gasosa. A retenção do HNO 3 propicia a contínua destruição catalítica do ozono por remoção de NO x do sistema, que poderia reagir com o ClO formando ClONO 2. Este ciclo pode ser descrito da seguinte forma: HCl (s) + ClONO 2 Cl 2 + HNO 3 (s) Cl 2 + hν 2 Cl 2 (Cl + O 3 ClO + O 2 ) ClO + NO 2 + M ClONO 2 + M 18
20 Global HCl (s) + NO O 3 + hν HNO 3 (s) + 2 O 2 A reacção entre ClONO 2 e H 2 O (s), que é mais lenta em fase gasosa, pode também ocorrer: ClONO 2 + H 2 O (s) HOCl + HNO 3 (s) O HOCl gasoso sofre fotólise rapidamente, dando origem a cloro livre. O HOCl pode reagir também com o HCl (s): HOCl + HCl (s) Cl 2 + H 2 O No caso de existir N 2 O 5, uma outra reacção heterogénea poderá ocorrer, reacção essa que conduz à reconversão de HCl em cloro activo: N 2 O 5 + HCl (s) ClNO 2 + HNO 3 (s) O ClNO 2 gasoso sofre também uma rápida fotólise, originando cloro activo. Para que ocorra o mecanismo de destruição do ozono estratosférico polar é necessário que as temperaturas sejam muito baixas e que exista radiação solar. A ausência de um destes parâmetros evita a ocorrência do mecanismo. As temperaturas baixas são necessárias à formação das nuvens polares estratosféricas que facultam a superfície na qual as reacções heterogéneas ocorrem. A radiação é necessária para que ocorra a fotólise das diferentes espécies gasosas de cloro, produzidas nas reacções heterogéneas. Num período inicial existe acumulação de ClO. Contudo, quando a sua concentração é suficientemente elevada, ocorre o seguinte ciclo catalítico: ClO + ClO + M Cl 2 O 2 + M Cl 2 O 2 + hν Cl + ClOO ClOO + M Cl + O 2 + M 2 (Cl + O 3 ClO + O 2 ) 19
21 Global 2 O 3 + hν 3 O 2 Visto que grande parte de NO x está presente nas nuvens polares estratosféricas sob a forma de HNO 3, o efeito moderador de NO x, através da formação de ClONO 2, não é verificado. Para que ocorra a destruição de ozono em grande escala é necessário que a concentração de HNO 3 seja muito baixa. O principal processo que promove a remoção de HNO 3 da fase gasosa a temperaturas inferiores a 195 K é a formação de ácido nítrico tri-hidratado nas nuvens polares estratosféricas. Uma pequena fracção do HNO 3 é removida segundo a reacção esquematizada em seguida: HCl (s) + ClONO 2 Cl 2 + HNO 3 (s) A desnitrificação acontece assim por precipitação de partículas suficientemente grandes que constituem as nuvens polares estratosféricas, que arrastam consigo o HNO 3 absorvido. A extensão da precipitação destas partículas é, no entanto, ainda desconhecida. Quando as massas de ar começam a aquecer devido à dissipação do ciclone polar e à absorção de radiação, as nuvens polares estratosféricas podem eventualmente evaporar-se, libertando HNO 3. Este sofre fotólise e reage com o HO, regenerando o NO x em fase gasosa: HNO 3 + hν HO + NO 2 HNO 3 + HO H 2 O + NO 2 Posteriormente o NO 2 gasoso reage com o ClO, retendo o cloro sob a forma inactiva ClONO 2. A razão ClO/HO é um indicador da evolução da destruição do ozono. Quando todo o cloro é convertido pelas nuvens polares estratosféricas, a quantidade de HCl volta a ser a original. Estima-se que sejam necessários noventa meios-dias para que esta conversão seja completada, assumindo uma temperatura de 200 K, uma concentração média de cloro de 0,015 ppt e uma concentração média de metano de 0,8 ppm. Uma vez que a absorção da radiação pelo ozono contribui para o aquecimento da estratosfera e devido à rarefacção do ozono, o processo usual de 20
22 aquecimento é mais lento, prolongando a duração temporal da diminuição da concentração de ozono. 4. Fotoquímica da Troposfera A troposfera é um reservatório químico bastante diferente da estratosfera. O transporte de espécies entre a troposfera e a estratosfera é muito mais lento do que as misturas que se observam na troposfera. As espécies emitidas pela superfície terrestre cujos tempos de vida são inferiores a um ano são destruídas na troposfera. Embora a estratosfera funcione como filtro das radiações mais energéticas, as radiações que atingem a troposfera são suficientemente energéticas para promover um conjunto de reacções fotoquímicas. Um factor chave da química da troposfera é a existência de grandes quantidades de vapor de água. Tal como sucede na estratosfera o ozono tem um papel central na química da troposfera, onde ocorrem reacções que conduzem à sua formação e destruição Ciclo fotoquímico de NO 2, NO e O 3 A formação de ozono ocorre após a fotólise do NO 2, para comprimentos de onda inferiores a 424 nm: NO 2 + hν NO + O (λ < 424 nm) O + O 2 + M O 3 + M M representa as moléculas N 2 ou O 2, ou outra molécula capaz de absorver o excesso de energia vibracional, estabilizando a molécula de O 3 formada. Uma vez formada, a molécula de O 3 reage com NO, regenerando o NO 2 : O 3 + NO NO 2 + O 2 21
23 4.2. A química atmosférica do CO e NO x a importância do radical HO A química do radical HO é de extrema importância para a compreensão da química da troposfera. Este radical não é reactivo com o oxigénio, motivo pelo qual subsiste para reagir com grande parte das espécies vestigiais presentes na atmosfera. O radical hidroxilo reage com o monóxido de carbono segundo a reacção: CO + HO CO 2 + H O átomo de hidrogénio formado combina-se rapidamente com o oxigénio molecular, formando o radical hidroperoxilo: H + O 2 + Μ HO 2 + M A reacção global pode ser descrita do seguinte modo: O 2 CO + HO CO 2 + HO 2 A adição de um átomo de H ao O 2 enfraquece a ligação O-O no O 2, pelo que o radical hidroperoxilo resultante é muito mais reactivo do que o próprio O 2. A reacção atmosférica mais importante que ocorre com o radical HO 2 é entre este e o NO. Pelo que, quando este está presente na atmosfera, ocorre a reacção seguidamente descrita: HO 2 + NO NO 2 + HO A oxidação atmosférica do CO pode ser resumida segundo o seguinte esquema: CO + HO CO 2 + H HO 2 + NO NO 2 + HO NO 2 + hν NO + O O + O 2 + M O 3 + M Global CO + 2O 2 + hν CO 2 + O 3 22
24 Como podemos ver nem o HO nem o HO 2 são consumidos neste ciclo que pode ser considerado o ciclo catalítico de oxidação do CO a CO 2. Este ciclo continua repetidamente até que uma das moléculas é removida por uma reacção de terminação. As características qualitativas do conjunto de reacções CO/NO x podem ser descritas como se segue. A fotólise do NO 2 produz NO e O. O átomo de O combina-se prontamente com o oxigénio molecular formando O 3. Posteriormente o ozono reage com o NO, regenerando o NO 2. O ciclo químico destas três reacções pode ser esquematizado do seguinte modo (o O 2 não é indicado): hν NO 2 NO + O 3 Dado que este ciclo de reacções é mais rápido do que as reacções concorrentes, o estado estacionário é atingido rapidamente. Considerando agora as reacções que ocorrem devido à existência de CO, o ciclo reversível anterior é modificado da seguinte forma: hν NO 2 NO + O 3 HO 2 O radical HO 2 que converte NO de novo em NO 2 é transformado em HO, que fica disponível para reagir com o CO. Obtemos assim dois ciclos interligados, onde o mecanismo CO/NO x é uma reacção em cadeia onde o HO é o transportador dessa mesma cadeia: hν CO + OH HO 2 NO 2 NO + O 3 NO 4.3. A química atmosférica do formaldeído e NO x O formaldeído é emitido por diversas fontes mas é também um dos produtos da oxidação de hidrocarbonetos. O formaldeído sofre duas reacções importantes na atmosfera, a fotólise: 23
25 Reacção 1: HCHO + hν H + HCO Reacção 2: HCHO + hν H 2 + CO e a reacção com HO: HCHO + HO HCO + H 2 O Como já referido anteriormente, o átomo de hidrogénio combina-se prontamente com o O 2 formando HO 2. O radical formilo, HCO, também reage rapidamente com o O 2 originando o radical hidroperoxilo e CO: HCO + O 2 HO 2 + CO Devido à grande velocidade destas reacções, as reacções do formaldeído podem ser apresentadas do seguinte modo: O 2 HCHO + hν 2HO 2 + CO H 2 + CO O 2 HCHO + HO HO 2 + CO + H 2 O Se considerarmos agora estas reacções conjuntamente com as do ciclo CO/NO x, podemos concluir que: - cada molécula de HCHO que sofre fotólise conduz à conversão de duas moléculas de NO em NO 2, gerando simultaneamente dois radicais HO; - a reacção HCHO-OH conduz à conversão de uma molécula de NO em NO 2, gerando simultaneamente um radical HO. 24
26 4.4. A química da troposfera de fundo Consideremos agora o alcano mais simples, o metano. O estudo da sua química na atmosfera conduzir-nos-á à química da troposfera de fundo Fotólise do ozono A reacção chave da química da troposfera de fundo é a fotólise do ozono a comprimentos de onda inferiores a 319 nm. Esta reacção origina um átomo de oxigénio excitado que posteriormente reage com a água originando radicais hidroxilo. Embora o ozono troposférico seja apenas 10% do ozono total existente na atmosfera, através da formação de HO, ele determina a eficiência de oxidação da troposfera. Por este motivo o ozono é o responsável último pela manutenção da composição da troposfera Oxidação do metano A reacção entre o radical hidroxilo e o CH 4 pode ser descrita do seguinte modo: CH 4 + HO CH 3 + H 2 O Tal como sucede com o átomo de hidrogénio, o radical metilo reage prontamente com o O 2, originando o radical peróxido de metilo: CH 3 + O 2 + M CH 3 O 2 + M Globalmente, podemos escrever as equações anteriores da seguinte forma: O 2 CH 4 + HO CH 3 O 2 + H 2 O Nas condições existentes na troposfera, o radical peróxido de metilo pode reagir com NO, NO 2, HO 2 e outros radicais peróxido orgânicos (RO 2 ). As reacções com NO e HO 2 são, contudo, as mais importantes. A reacção com o NO conduz à formação do radical metoxilo (CH 3 O), segundo a reacção: CH 3 O 2 + NO CH 3 O + NO 2 25
27 A reacção entre o HO 2 e o NO regenera o radical HO: HO 2 + NO HO + NO 2 O radical peróxido de metilo pode também reagir com o NO 2 : CH 3 O 2 + NO 2 + M CH 3 OONO 2 + M O peroxonitrato de metilo, CH 3 OONO 2, pode actuar como um reservatório temporário de NO 2 e CH 3 O 2 na alta troposfera. A reacção entre CH 3 O 2 e o radical HO 2 conduz à formação de hidroperóxido de metilo: CH 3 O 2 + HO 2 CH 3 OOH + O 2 que pode sofrer fotólise ou reagir com o radical HO: CH 3 OOH + hν CH 3 O + HO CH 3 OOH + HO H 2 O + CH 3 O 2 H 2 O + CH 2 OOH rápido HCHO + HO O hidroperóxido de metilo é assim um reservatório temporário de radicais, sendo a sua deposição, húmida ou seca, um processo de perda troposférica de radicais. A principal reacção do radical metoxilo, em condições troposféricas, é a reacção com o O 2, formando formaldeído e o radical HO 2 : CH 3 O + O 2 HCHO + HO 2 O formaldeído continua a reagir, por fotólise e por reacção com o radical HO e é o produto principal da oxidação do metano. O ciclo de oxidação do metano pode ser descrito como: O 2 CH 4 + HO CH 3 O 2 + H 2 O 26
28 CH 3 O 2 + NO CH 3 O + NO 2 CH 3 O + O 2 HCHO + HO 2 HO 2 + NO HO + NO 2 2 ( NO 2 + hν NO + O) 2 (O + O 2 + M O 3 + M) Global CH 4 + 4O hν HCHO + 2 O 3 + H 2 O Como podemos observar, a oxidação do formaldeído conduz à produção adicional de ozono, sendo produzidas duas moléculas de ozono por cada molécula de metano Peróxido de hidrogénio O peróxido de hidrogénio é a espécie oxidante que predomina nas nuvens, nevoeiros ou chuva, na atmosfera. A actividade fotoquímica determina a variação diurna, sazonal e latitudinal da concentração de H 2 O 2. Os processos de degradação de H 2 O 2 em fase gasosa são a sua reacção com o radical HO e a sua fotólise: H 2 O 2 + HO H 2 O + HO 2 H 2 O 2 + hν 2 HO A degradação de H 2 O 2 em fase aquosa ocorre principalmente por reacção com o SO 2 dissolvido - produção de chuva ácida: HSO H 2 O 2 SO 2 OOH - + H 2 O SO 2 OOH - + H + H 2 SO Radical hidroxilo Apesar de o radical hidroxilo ser a espécie mais reactiva da troposfera, este não reage com nenhum dos principais constituintes da atmosfera tais como N 2, O 2, CO 2 ou H 2 O. Na verdade o radical hidroxilo reage com a maioria das espécies químicas vestigiais da atmosfera. A extrema importância deste radical prende-se quer com a sua grande reactividade quer com a sua elevada concentração. As principais fontes de produção do radical HO na troposfera são: 27
29 i) fotólise de O 3 ; ii) fotólise do ácido nitroso: HO + NO + M HONO + M HONO + hν HO + NO iii) reacção dos radicais HO 2 com NO. (formação do ácido nitroso) (fotólise do ácido nitroso) 4.6. Radical nitrato As reacções de síntese do radical nitrato, NO 3, são: NO 2 + O 3 NO 3 + O 2 M NO 2 + NO 3 N 2 O 5 O NO 3 é uma espécie oxidante e reage com outras espécies da atmosfera. O requisito necessário para que haja formação deste radical é a presença de NO 2 e O 3 na mesma massa de ar. O radical NO 3 sofre rápida fotólise, durante o dia, segundo duas vias diferentes: Reacção 1: Reacção 2: NO 3 + hν NO + O 2 NO 3 + hν NO 2 + O (λ < 700 nm) (λ < 580 nm) Reage também com o NO, sendo esta reacção de tal forma rápida que NO e NO 3 não coexistem em razões de alguns ppt ou superiores: NO 3 + NO 2 NO 2 Durante a noite, quando a concentração de NO tende para zero devido às reacções com O 3, as razões de NO 3 podem atingir valores de 100 ppt. As reacções em fase homogénea entre N 2 O 5 com vapor de água e outros gases vestigiais são muito lentas, ao contrário das reacções em fase heterogénea, que podem ser de extrema importância, como é o caso da hidrólise do N 2 O 5, que ocorre em partículas de aerossóis ou em gotas de nuvens: 28
30 N 2 O 5 + H 2 O (s) 2 HNO 3 Esta reacção não é contudo importante durante o dia, pois o NO 3, que é um dos reagentes na reacção de síntese de N 2 O 5, sofre rapidamente fotólise Smog fotoquímico Origem do smog fotoquímico Em muitos locais do planeta são registados fenómenos de poluição atmosférica em que os níveis de concentração de ozono são elevados. Este ozono é o resultado das reacções que ocorrem entre os poluentes atmosféricos e a radiação. A este fenómeno dáse o nome de smog fotoquímico. Os principais reagentes que originam o smog fotoquímico são o NO e os hidrocarbonetos não queimados que são emitidos para a atmosfera. A concentração destes compostos nas atmosferas poluídas é muito superior à observada em regiões de ar limpo. Verificou-se que os hidrocarbonetos gasosos existem no ar urbano, em consequência da evaporação de solventes, combustíveis líquidos e outros compostos orgânicos. Dá-se o nome de compostos orgânicos voláteis (COV) ao conjunto destes compostos. A radiação é um elemento chave na formação do smog fotoquímico na medida em que provoca um aumento da concentração de radicais livres que estão envolvidos nos processos químicos de formação do smog. Os produtos finais do smog fotoquímico são o ozono, o ácido nítrico e compostos orgânicos: COV + NO + hν O 3 + HNO 3 + compostos orgânicos Os poluentes primários são todas as substâncias que são inicialmente emitidas para a atmosfera, como é o caso do NO, de hidrocarbonetos e outros compostos orgânicos voláteis. Os poluentes secundários, são as substâncias que derivam dos poluentes primários, sendo exemplos o O 3 e o HNO 3. Os compostos orgânicos voláteis mais reactivos são os hidrocarbonetos que contêm uma ligação dupla C=C, dado que podem receber radicais livres. 29
31 Sempre que um combustível é queimado ao ar e com uma chama a altas temperaturas, existe produção de óxidos de azoto. A tais temperaturas, algum azoto e oxigénio do ar reagem, formando NO: N 2 + O 2 NO 2 Quanto maior for a temperatura da chama, maior é a quantidade de NO produzido. Este NO é gradualmente oxidado a dióxido de azoto, NO 2. Este por sua vez reage com NO, formando NO x. Contudo, nem todas as cidades estão expostas a fenómenos de smog fotoquímico, pois são necessárias certas condições para que tal ocorra. Primeiro, é necessário que o fluxo de tráfego automóvel seja elevado, de modo a que as quantidades emitidas de NO, hidrocarbonetos e outros compostos orgânicos voláteis sejam significativas. Segundo, é necessário que a cidade apresente temperaturas elevadas, e que a intensidade solar que incide sobre esta seja grande de modo a que as reacções ocorram rapidamente. Por último a movimentação do ar deve ser diminuta, para que não haja diluição dos reagentes. Todavia, devido ao transporte de longo alcance de massas de ar, muitas áreas que por si só não geram poluentes gasosos, estão sujeitas a elevadas concentrações de ozono e outros oxidantes Redução do smog fotoquímico Com o intuito de melhorar a qualidade do ar das cidades sujeitas a episódios de smog fotoquímico é necessário reduzir as concentrações de reagentes no ar, nomeadamente de NO x, de hidrocarbonetos contendo ligação dupla C=C e dos compostos orgânicos voláteis. Por razões económicas, técnicas e políticas, a estratégia mais utilizada foi a redução dos hidrocarbonetos. Contudo, na generalidade dos casos, a percentagem de redução de ozono e outros oxidantes foi muito inferior à percentagem de redução dos hidrocarbonetos. Isto deve-se ao facto de os reagentes limitantes deste processo serem os óxidos de azoto. No entanto, globalmente, tem-se observado uma diminuição dos níveis de ozono. Outra estratégia utilizada por algumas cidades foi construir no seu interior ou na periferia, áreas densamente arborizadas, cujas árvores emitem hidrocarbonetos 30
32 suficientemente reactivos para suster o smog fotoquímico e, consequentemente, a produção de ozono. A evolução dos catalisadores dos veículos automóveis nos últimos anos contribuiu para a diminuição da concentração de óxidos de azoto. Os catalisadores mais recentes convertem primeiramente os óxidos de azoto em azoto e oxigénio, utilizando hidrocarbonetos não queimados e CO e H 2 como agentes redutores. Posteriormente os gases contendo carbono são praticamente todos oxidados a CO 2 e água. Um sistema externo regula a razão ar/combustível, assegurando uma elevada conversão dos reagentes. 5. Propostas pedagógicas O ensino da ciência deve promover a literacia científica e a cidadania dos alunos assim como fomentar a sua participação activa na sociedade. As metodologias de ensino devem por isso ser diversificadas e devem promover tanto a inter como a transdisciplinaridade do conhecimento. O recurso a temas e situações-problema actuais tais como o aquecimento global, ou o aumento da poluição, devem promover o debate e tomada de consciência da posição fulcral da ciência, nomeadamente a química, no dia-a-dia e na resolução dos problemas ao mesmo tempo que promovem o desenvolvimento de conceitos químicos centrais. A aprendizagem de conceitos e processos, que é de importância fundamental, deve assim ser vista como um ponto de chegada e não como o ponto de partida do processo de aprendizagem. A apresentação dos conceitos deve surgir associada à relevância e ligação que estes têm com a situações-problema em estudo. Esta é a base do ensino CTSA (Ciência Tecnologia Sociedade Ambiente), um ensino contextualizado, com debate em torno de questões com implicações sociais, económicas, politicas, ambientais e tecnológicas que promovem um melhor conhecimento e compreensão da ciência. Este tipo de ensino privilegia o conhecimento em acção e está estruturado em torno de duas ideias fundamentais: - compreensão do mundo na sua globalidade e complexidade, o que requer o recurso à interdisciplinaridade com vista a conciliar as análises fragmentadas que as visões analíticas dos saberes disciplinares fomentam e fundamentam, pelo que estas visões disciplinares serão sempre complementares. 31
33 - escolha de situações-problema do quotidiano familiar dos alunos, a partir das quais se organizam estratégias de ensino e de aprendizagem que irão reflectir a necessidade de esclarecer conteúdos e processos da Ciência e da Tecnologia, bem como das suas inter-relações com a Sociedade e o Ambiente, proporcionando o desenvolvimento de atitudes e de valores. Esta contextualização está hoje presente nas nossas orientações curriculares e é a base de inúmeras investigações pedagógicas. Seguidamente fazer-se-á uma breve análise de literatura pedagógica sobre a Atmosfera, bem como uma descrição das orientações curriculares de Portugal e Reino Unido subordinadas ao mesmo tema Literatura Segundo Trogler [15], a química atmosférica dos gases vestigiais ilustra princípios fundamentais da cinética, ligações químicas, mecanismos de reacção, fotoquímica, espectroscopia e ciclos geoquímicos. Esta temática é de grande utilidade em cursos de química introdutória, química analítica, química física e espectroscopia ( ) e relata factos e conceitos fundamentais da química relacionados com problemas ambientais que são de interesse geral. Adelhelm e Höhn [1], apresentam uma actividade experimental simples, para realizar em contexto de sala de aula, com o objectivo de demonstrar os princípios do efeito de estufa e investigar o potencial de diferentes gases que accionam o efeito de estufa. Andino et al [2], propõem também uma actividade experimental cujo objectivo é contextualizar e debater tópicos relacionados com a poluição atmosférica tais como a formação de aerossóis primários e secundários, a distribuição das partículas na atmosfera, as reacções químicas do ozono e dos hidrocarbonetos e a dispersão da radiação. Uma actividade investigativa para alunos de níveis académicos superiores é proposta por Klemm [9]. O objectivo principal desta actividade é estudar a formação de ozono atmosférico e compreender a dinâmica das reacções químicas do ozono, a nível local e regional. Com esta finalidade os estudantes monitorizaram a concentração de ozono local e regionalmente assim como outros parâmetros atmosféricos e levaram a cabo um conjunto de experiências no terreno. Esta actividade permite também o desenvolvimento de outras competências como a formulação e teste de hipóteses, 32
34 recolha e selecção de informação e divulgação das conclusões finais às autoridades locais e à comunidade científica através da redacção de um artigo científico. Seeley et al [12], propõem a realização de uma actividade experimental que permite medir a concentração de ozono ao nível do solo e que tem como principal finalidade introduzir e contextualizar conceitos fundamentais como reacções de oxidação-redução, lei dos gases perfeitos e análise espectroscópica. Os alunos desenvolvem também competências no âmbito da construção de instrumentação simples e da recolha e tratamento de amostras e dados. Com o intuito de fomentar o interesse, conhecimento e compreensão dos alunos pela química física, concretamente pela dinâmica das reacções químicas do ciclo de Chapman, Zielinski [16], propõe a utilização de um programa computacional no contexto de sala de aula. Para além das finalidades já referidas, salienta-se ainda que o programa computacional permite uma mais fácil apreensão do conhecimento por parte dos alunos assim como permite inserir num contexto mais relevante, aos olhos dos alunos, o estudo da química física. Pirjola [10], apresenta um programa computacional que tem como objectivo simular a química da troposfera, com especial ênfase para o ozono troposférico. Este programa permite simular diferentes características de um determinado dia, compreender a ligação dos diferentes parâmetros e prever os impactos de problemas ambientais tais como o aumento da poluição e a diminuição da camada do ozono. Colodner et al [5], reportam uma maneira diferente e original de fazer e estudar ciência. A Biosfera 2 é o maior laboratório fechado do planeta e apresenta um conjunto de diferentes cursos com uma perspectiva de educação em contexto. Durante algumas semanas, os estudantes vivem dentro deste laboratório estudando disciplinas como Ciências da Terra, Ecologia e Política Ambiental, entre outras Orientações curriculares Portugal Focando-se essencialmente nos processos fotoquímicos do ozono que ocorrem na estratosfera e na troposfera, este seminário aprofunda parte dos conteúdos leccionados no 10º ano de escolaridade na Unidade II Na atmosfera da Terra: radiação, matéria e estrutura da disciplina de Ciências físico-químicas A (CFQ A) e na Unidade I Atmosfera e Ambiente: uma perspectiva Química da disciplina de 33
35 Ciências físico-químicas B (CFQ B). Os conteúdos programáticos inseridos nestes contextos são os mesmos em ambas as disciplinas, embora as unidades sejam diferentes. A fotoquímica da atmosfera permite-nos apresentar aos alunos numa perspectiva CTSA (Ciência Tecnologia Sociedade Ambiente) temáticas como: - atmosfera como filtro de radiações solares; - formação de radicais livres na estratosfera e na troposfera; - ozono como filtro protector da Terra; - formação e decomposição do ozono na atmosfera; - camada do ozono; - problema científico e social da diminuição da camada do ozono; - efeitos dos CFC s no ozono estratosférico; - nomenclatura dos alcanos e derivados; - modelo covalente da ligação química; - energia de ligação; - comprimento de ligação; - ângulo de ligação; - geometria molecular; - formação de iões na termosfera e mesosfera; - energia de ligação por molécula e energia de ionização por mole de moléculas. Segundo um contexto mais alargado, subordinado ao tema Atmosfera, são focadas as seguintes temáticas: - evolução e composição da atmosfera; - volume molar; - constante de Avogadro; - densidade de um gás; - soluções e colóides; - concentração mássica; - percentagem em volume e percentagem em massa; - concentração em partes por milhão; - fracção molar. Também no 8º ano de escolaridade, no tema Sustentabilidade na Terra a temática da atmosfera é abordada com o intuito de contextualizar e desenvolver os seguintes pontos: 34
36 - descrição e previsão do tempo atmosférica; - influência da actividade humana na atmosfera terrestre e no clima Reino Unido O programa Salters Advanced Chemistry, desenvolvido pela Universidade de York, apresenta também o tema Atmosfera com o intuito de contextualizar e leccionar os seguintes conteúdos: - efeito dos CFC s na camada de ozono; - efeito de estuda; - espectro electromagnético; - ligações covalentes; - química das moléculas orgânicas; - concentração molar; - entalpia; - energias de ligação; - catálise; - interacção da matéria com a radiação electromagnética; - reacções envolvendo radicais; - propriedades de compostos orgânicos halogenados; - factores que influenciam a velocidade da reacção; - natureza dinâmica do equilíbrio químico; 5.3. Conclusão Os professores desempenham um papel importante na produção e estruturação do conhecimento não só pela interacção que se gera entre o conhecimento científico e a sua aquisição por parte do aluno mas também pela própria interacção entre o professor e o aluno assim como a interacção entre a instituição escola e a sociedade. É por este motivo importante que o professor adeqúe as suas estratégias de ensino ao contexto social, cultural e económico onde a instituição escola se insere. As orientações curriculares nacionais promovem a concepção CTSA, onde os alunos devem ser encorajados a identificar, analisar e aplicar conceitos científicos em situações-problema reais. Esta contextualização torna o ensino da química mais motivador e interessante para o aluno. 35
Sumário. Atmosfera da Terra. Interação Radiação-Matéria 27/02/2013
 Sumário Na : Radiação, Matéria e Estrutura Unidade temática 2 : A atmosfera e a radiação solar. As reações fotoquímicas e a formação de radicais livres. Formação de iões na termosfera e na mesosfera. Os
Sumário Na : Radiação, Matéria e Estrutura Unidade temática 2 : A atmosfera e a radiação solar. As reações fotoquímicas e a formação de radicais livres. Formação de iões na termosfera e na mesosfera. Os
Sumário. Atmosfera da Terra. Interação Radiação-Matéria 04/02/2015
 Sumário Na : Radiação, Matéria e Estrutura Unidade temática 2 : A atmosfera e a radiação solar. As reações fotoquímicas e a formação de radicais livres. Formação de iões na termosfera e na mesosfera. Os
Sumário Na : Radiação, Matéria e Estrutura Unidade temática 2 : A atmosfera e a radiação solar. As reações fotoquímicas e a formação de radicais livres. Formação de iões na termosfera e na mesosfera. Os
Química da Atmosfera
 Química da Atmosfera Capítulos 1 ao 4 do Colin Baird Capítulo 1 Química Estratosférica: A camada de ozônio Troposfera: *15km altitude *85% da massa H 2 O quantidades variáveis; CO 2 0,04% 1 Regiões da
Química da Atmosfera Capítulos 1 ao 4 do Colin Baird Capítulo 1 Química Estratosférica: A camada de ozônio Troposfera: *15km altitude *85% da massa H 2 O quantidades variáveis; CO 2 0,04% 1 Regiões da
2.3.2 Reações fotoquímicas na atmosfera
 2.3.2 Reações fotoquímicas na atmosfera Adaptado pelo Prof. Luís Perna Reações fotoquímicas As transformações químicas desencadeadas pela luz (ultravioleta, visível ou infravermelha) são chamadas reações
2.3.2 Reações fotoquímicas na atmosfera Adaptado pelo Prof. Luís Perna Reações fotoquímicas As transformações químicas desencadeadas pela luz (ultravioleta, visível ou infravermelha) são chamadas reações
No início. Desgaseificação do seu interior de gases voláteis. Os gases libertados constituíram a atmosfera primitiva da Terra.
 A Atmosfera A Terra tem aproximadamente 4,5 biliões de anos e quando se formou era bastante diferente da Terra que conhecemos hoje. Assim também aconteceu com a atmosfera terrestre que nem sempre apresentou
A Atmosfera A Terra tem aproximadamente 4,5 biliões de anos e quando se formou era bastante diferente da Terra que conhecemos hoje. Assim também aconteceu com a atmosfera terrestre que nem sempre apresentou
Ozônio estratosférico
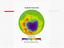 Ozônio estratosférico Formação 2,3 bilhões de anos atrás com o começo do processo fotossintético que liberava oxigênio 400 milhões de anos atrás evolução das plantas verdes, a taxa de mistura do oxigênio
Ozônio estratosférico Formação 2,3 bilhões de anos atrás com o começo do processo fotossintético que liberava oxigênio 400 milhões de anos atrás evolução das plantas verdes, a taxa de mistura do oxigênio
A TERRA E SUA ATMOSFERA
 A TERRA E SUA ATMOSFERA REFERÊNCIAS BIBLIOGRÁFICAS: Ahrens, C. D. Meteorology Today Trewartha & Horn An Introduction to Climate Varejão-Silva, M. A. Meteorologia e Climatologia Tamanho relativo dos planetas
A TERRA E SUA ATMOSFERA REFERÊNCIAS BIBLIOGRÁFICAS: Ahrens, C. D. Meteorology Today Trewartha & Horn An Introduction to Climate Varejão-Silva, M. A. Meteorologia e Climatologia Tamanho relativo dos planetas
2.3.2 Reações fotoquímicas na atmosfera
 2.3.2 Reações fotoquímicas na atmosfera Reações fotoquímicas As transformações químicas desencadeadas pela luz (ultravioleta, visível ou infravermelha) são chamadas reações fotoquímicas. As reações fotoquímicas
2.3.2 Reações fotoquímicas na atmosfera Reações fotoquímicas As transformações químicas desencadeadas pela luz (ultravioleta, visível ou infravermelha) são chamadas reações fotoquímicas. As reações fotoquímicas
Atmosfera terrestre. Camada fina, gasosa, sem cheiro, sem cor e sem gosto, presa à Terra pela força da gravidade.
 Atmosfera terrestre Camada fina, gasosa, sem cheiro, sem cor e sem gosto, presa à Terra pela força da gravidade. Atmosfera terrestre - Composição 99,9% da atmosfera é constituída por apenas quatro gases:
Atmosfera terrestre Camada fina, gasosa, sem cheiro, sem cor e sem gosto, presa à Terra pela força da gravidade. Atmosfera terrestre - Composição 99,9% da atmosfera é constituída por apenas quatro gases:
Reações fotoquímicas na atmosfera
 Fotodissociação e fotoionização Fotodissociação e fotoionização na atmosfera terrestre Ozono estratosférico Formação e destruição do ozono estratosférico Substitutos dos clorofluorocarbonetos Qual a importância
Fotodissociação e fotoionização Fotodissociação e fotoionização na atmosfera terrestre Ozono estratosférico Formação e destruição do ozono estratosférico Substitutos dos clorofluorocarbonetos Qual a importância
Escola Secundária de Lagoa. Correção da Ficha de Trabalho 14. Física e Química A pontos
 Escola Secundária de Lagoa Física e Química A 10º Ano Turmas A e B Paula Silva e Emília Correia Correção da Ficha de Trabalho 14 2014/2015 1. 1.1.. 12 pontos O buraco da camada de ozono consiste na baixa
Escola Secundária de Lagoa Física e Química A 10º Ano Turmas A e B Paula Silva e Emília Correia Correção da Ficha de Trabalho 14 2014/2015 1. 1.1.. 12 pontos O buraco da camada de ozono consiste na baixa
Problemas ambientais globais
 Problemas ambientais globais! Camada de Ozono 1º Ano Eng.ª Ambiente - 2016/2017 A atmosfera Diâmetro da terra: 12 742 km Em relação a este diâmetro a Termosfera representa: 4% a Troposfera representa:
Problemas ambientais globais! Camada de Ozono 1º Ano Eng.ª Ambiente - 2016/2017 A atmosfera Diâmetro da terra: 12 742 km Em relação a este diâmetro a Termosfera representa: 4% a Troposfera representa:
No início. Desgaseificação do seu interior de gases voláteis. Os gases libertados constituíram a atmosfera primitiva da Terra.
 A Atmosfera A Terra tem aproximadamente 4,5 biliões de anos e quando se formou era bastante diferente da Terra que conhecemos hoje. Assim também aconteceu com a atmosfera terrestre que nem sempre apresentou
A Atmosfera A Terra tem aproximadamente 4,5 biliões de anos e quando se formou era bastante diferente da Terra que conhecemos hoje. Assim também aconteceu com a atmosfera terrestre que nem sempre apresentou
Principais Problemas Ambientais
 Universidade Federal de Juiz de Fora Instituto de Ciências Exatas Departamento de Química Química Ambiental (2017/2) Química Atmosférica (Parte 2) Principais Problemas Ambientais Felipe Dias dos Reis Principais
Universidade Federal de Juiz de Fora Instituto de Ciências Exatas Departamento de Química Química Ambiental (2017/2) Química Atmosférica (Parte 2) Principais Problemas Ambientais Felipe Dias dos Reis Principais
Reações Fotoquímicas
 Reações Fotoquímicas O que é e qual a origem de: Camada de O 3 O 3 troposférico Chuva ácida Buraco de O 3 Smog fotoquímico (smoke+fog) Atmosfera Terrestre H - 1 (>3500 km) Onde está a Camada de Ozônio?
Reações Fotoquímicas O que é e qual a origem de: Camada de O 3 O 3 troposférico Chuva ácida Buraco de O 3 Smog fotoquímico (smoke+fog) Atmosfera Terrestre H - 1 (>3500 km) Onde está a Camada de Ozônio?
ATIVIDADE AVALIATIVA
 Climatologia 2. Atmosfera Terrestre ATIVIDADE AVALIATIVA Valor: 1,0 Tempo para responder: 15min 1) Qual a importância da concentração dos gases que compõe a atmosfera terrestre, em termos físicos e biológicos?
Climatologia 2. Atmosfera Terrestre ATIVIDADE AVALIATIVA Valor: 1,0 Tempo para responder: 15min 1) Qual a importância da concentração dos gases que compõe a atmosfera terrestre, em termos físicos e biológicos?
Interacção da Radiação com a Matéria. Maria do Anjo Albuquerque
 Interacção da Radiação com a Matéria Radiação ultravioleta Radiação infravermelha Parte da radiação IV é filtrada pelo vapor de água e dióxido de carbono. Estes dois gases desempenham um papel fundamental
Interacção da Radiação com a Matéria Radiação ultravioleta Radiação infravermelha Parte da radiação IV é filtrada pelo vapor de água e dióxido de carbono. Estes dois gases desempenham um papel fundamental
METAIS COMO CATALIZADORES METAIS AMBIENTE E VIDA
 METAIS COMO CATALIZADORES METAIS AMBIENTE E VIDA Se somarmos as duas equações, a equação global é O bromo não se consome na reacção, sendo regenerado indefinidamente 2 Decomposição do peróxido de hidrogénio
METAIS COMO CATALIZADORES METAIS AMBIENTE E VIDA Se somarmos as duas equações, a equação global é O bromo não se consome na reacção, sendo regenerado indefinidamente 2 Decomposição do peróxido de hidrogénio
Ao aplicar o operador matemático logaritmo, obtém-se a seguinte expressão: ph= - log [H + ]
![Ao aplicar o operador matemático logaritmo, obtém-se a seguinte expressão: ph= - log [H + ] Ao aplicar o operador matemático logaritmo, obtém-se a seguinte expressão: ph= - log [H + ]](/thumbs/50/27307300.jpg) SIMULAR A OCORRÊNCIA DE CHUVAS ÁCIDAS DEVIDA A ÓXIDOS DE ENXOFRE INTRODUÇÃO Um ácido pode ser definido como uma espécie química que doa protões H + numa reacção química. A espécie química que aceita esses
SIMULAR A OCORRÊNCIA DE CHUVAS ÁCIDAS DEVIDA A ÓXIDOS DE ENXOFRE INTRODUÇÃO Um ácido pode ser definido como uma espécie química que doa protões H + numa reacção química. A espécie química que aceita esses
ATMOSFERA TEPERATURA, PRESSÃO E DENSIDADE EM FUNÇÃO DA ALTITUDE
 ATMOSFERA TEPERATURA, PRESSÃO E DENSIDADE EM FUNÇÃO DA ALTITUDE . 2 Variação da Temperatura e Estrutura Regiões de transição as pausas Nomenclatura introduzida na década de 1950 baseia-se no perfil de
ATMOSFERA TEPERATURA, PRESSÃO E DENSIDADE EM FUNÇÃO DA ALTITUDE . 2 Variação da Temperatura e Estrutura Regiões de transição as pausas Nomenclatura introduzida na década de 1950 baseia-se no perfil de
Química Orgânica Ambiental
 Química Orgânica Ambiental Aula 17 Smog fotoquímico Prof. Dr. Leandro Vinícius Alves Gurgel 1. Introdução A poluição das grandes cidades 300.000 chineses morrem por ano de doenças respiratórias SMOG NO
Química Orgânica Ambiental Aula 17 Smog fotoquímico Prof. Dr. Leandro Vinícius Alves Gurgel 1. Introdução A poluição das grandes cidades 300.000 chineses morrem por ano de doenças respiratórias SMOG NO
ATMOSFERA Temperatura, pressão, densidade e grandezas associadas.
 ATMOSFERA Temperatura, pressão, densidade e grandezas associadas. As camadas na atmosfera são: Troposfera. Estratosfera. Mesosfera Termosfera Exosfera As camadas na atmosfera são definidas a partir de
ATMOSFERA Temperatura, pressão, densidade e grandezas associadas. As camadas na atmosfera são: Troposfera. Estratosfera. Mesosfera Termosfera Exosfera As camadas na atmosfera são definidas a partir de
3ª Ficha de Avaliação de Conhecimentos Turma: 10ºB. Física e Química A 10ºAno
 3ª Ficha de Avaliação de Conhecimentos Turma: 10ºB Física e Química A 10ºAno Professora Paula Melo Silva Data: 8 fevereiro Ano Letivo: 2017/2018 135 + 15 min 1. O iodo, I2 (g), reage com o hidrogénio,
3ª Ficha de Avaliação de Conhecimentos Turma: 10ºB Física e Química A 10ºAno Professora Paula Melo Silva Data: 8 fevereiro Ano Letivo: 2017/2018 135 + 15 min 1. O iodo, I2 (g), reage com o hidrogénio,
EXERCÍCIOS. Química 10. e problemas Exames Testes intermédios Professor Luís Gonçalves
 Química 10 EXERCÍCIOS e problemas Exames 2006 2007 2008 2009 2010 2011 Testes intermédios 2008 2009 2010 2011 Escola Técnica Liceal Salesiana do Estoril Professor Luís Gonçalves 2 3 4 UNIDADE 1 Das estrelas
Química 10 EXERCÍCIOS e problemas Exames 2006 2007 2008 2009 2010 2011 Testes intermédios 2008 2009 2010 2011 Escola Técnica Liceal Salesiana do Estoril Professor Luís Gonçalves 2 3 4 UNIDADE 1 Das estrelas
Programação do Curso. Disposição I Atmosfera DISPOSIÇÃO NO MEIO-AMBIENTE
 Programação do Curso Carga horária Formação Específica Tecnologias limpas 48 Gerenciamento das emissões 96 Disposição no meio ambiente 36 Análise de risco e segurança industrial 36 Gerenciamento estratégico
Programação do Curso Carga horária Formação Específica Tecnologias limpas 48 Gerenciamento das emissões 96 Disposição no meio ambiente 36 Análise de risco e segurança industrial 36 Gerenciamento estratégico
Reações Fotoquímicas
 Reações Fotoquímicas O que é e qual a origem de: Camada de O 3 O 3 troposférico Chuva ácida Buraco de O 3 Smog fotoquímico (smoke+fog) Atmosfera Terrestre H - 1 (>3500 km) Onde está a Camada de Ozônio?
Reações Fotoquímicas O que é e qual a origem de: Camada de O 3 O 3 troposférico Chuva ácida Buraco de O 3 Smog fotoquímico (smoke+fog) Atmosfera Terrestre H - 1 (>3500 km) Onde está a Camada de Ozônio?
Notas de aula Ozônio troposférico
 Notas de aula - 018 - Ozônio troposférico Eventos de poluição por alta concentração de ozônio estão associados principalmente com temperaturas altas e radiação solar, e ainda com ventos calmos e condições
Notas de aula - 018 - Ozônio troposférico Eventos de poluição por alta concentração de ozônio estão associados principalmente com temperaturas altas e radiação solar, e ainda com ventos calmos e condições
QUESTÕES DE EXAME 6. Física e Química A. Domínio 2 - Propriedades e transformações da matéria Transformações químicas
 QUESTÕES DE EXAME 6 Física e Química A Questões de provas nacionais realizadas entre 2008 e 2014 organizados por subdomínio e por secção, por ordem cronológica. Os itens estão identificados por data e
QUESTÕES DE EXAME 6 Física e Química A Questões de provas nacionais realizadas entre 2008 e 2014 organizados por subdomínio e por secção, por ordem cronológica. Os itens estão identificados por data e
QUÍMICA ATMOSFÉRICA. (Qualidade do ar e emissões atmosféricas)
 QUÍMICA ATMOSFÉRICA (Qualidade do ar e emissões atmosféricas) Inundações Seca Névoa fotoquímica: São Paulo Problemas respiratórios O estudo químico da atmosfera busca compreender este complexo sistema
QUÍMICA ATMOSFÉRICA (Qualidade do ar e emissões atmosféricas) Inundações Seca Névoa fotoquímica: São Paulo Problemas respiratórios O estudo químico da atmosfera busca compreender este complexo sistema
Departamento de Matemática e Ciências Experimentais Planificação Anual. Física e Química A 10º ano 2014 / º Período
 Departamento de Matemática e Ciências Experimentais Planificação Anual Física e Química A 10º ano 01 / 01 1º Período ( minutos) Apresentação QUÍMICA 0. MATERIAIS: DIVERSIDADE E CONSTITUIÇÃO 0.1. Materiais
Departamento de Matemática e Ciências Experimentais Planificação Anual Física e Química A 10º ano 01 / 01 1º Período ( minutos) Apresentação QUÍMICA 0. MATERIAIS: DIVERSIDADE E CONSTITUIÇÃO 0.1. Materiais
ATMOSFERA Temperatura, pressão, densidade e volume molar
 ATMOSFERA Temperatura, pressão, densidade e volume molar As camadas na atmosfera são: Troposfera. Estratosfera. Mesosfera Termosfera Exosfera A variação da temperatura com a altitude permite definir 5
ATMOSFERA Temperatura, pressão, densidade e volume molar As camadas na atmosfera são: Troposfera. Estratosfera. Mesosfera Termosfera Exosfera A variação da temperatura com a altitude permite definir 5
Anexo 6. Anexo 6. Questionário
 Anexo 6 Anexo 6 Questionário 199 Anexo 6 QUESTIONÁRIO IDENTIFICAÇÃO Este é um questionário com 35 questões relacionadas com a atmosfera do planeta Terra. INSTRUÇÕES: - Para cada questão selecciona a alternativa
Anexo 6 Anexo 6 Questionário 199 Anexo 6 QUESTIONÁRIO IDENTIFICAÇÃO Este é um questionário com 35 questões relacionadas com a atmosfera do planeta Terra. INSTRUÇÕES: - Para cada questão selecciona a alternativa
Escola Básica e Secundária Gonçalves Zarco Física e Química A, 10º ano. Ano lectivo 2008/2009
 Escola Básica e Secundária Gonçalves Zarco Física e Química A, 10º ano Ano lectivo 2008/2009 Teste de Avaliação Sumativa (1/2/2009) Nome: Nº de Aluno: Turma: Classificação: Professor: Tabela de Constantes
Escola Básica e Secundária Gonçalves Zarco Física e Química A, 10º ano Ano lectivo 2008/2009 Teste de Avaliação Sumativa (1/2/2009) Nome: Nº de Aluno: Turma: Classificação: Professor: Tabela de Constantes
Atmosfera. 10º ano. [Imagem: Christoph Hormann]
![Atmosfera. 10º ano. [Imagem: Christoph Hormann] Atmosfera. 10º ano. [Imagem: Christoph Hormann]](/thumbs/83/88288769.jpg) [Imagem: Christoph Hormann] Atmosfera primitiva A idade da Terra é de cerca de 4,5 mil milhões de anos. O H 2 e o He, oriundos da nebulosa que deu origem ao Sistema Solar, escapam para o espaço! A atmosfera
[Imagem: Christoph Hormann] Atmosfera primitiva A idade da Terra é de cerca de 4,5 mil milhões de anos. O H 2 e o He, oriundos da nebulosa que deu origem ao Sistema Solar, escapam para o espaço! A atmosfera
FÍSICA E QUÍMICA A 10º ANO
 Departamento de Matemática e Ciências Experimentais FÍSICA E QUÍMICA A 10º ANO PLANIFICAÇÃO 011 / 01 PLANIFICAÇÃO A LONGO PRAZO Período 1º 1/09 a 1/1 º 03/01 a 3/03 3º 10/0 a 08/0 Nº Semanas Nº aulas totais
Departamento de Matemática e Ciências Experimentais FÍSICA E QUÍMICA A 10º ANO PLANIFICAÇÃO 011 / 01 PLANIFICAÇÃO A LONGO PRAZO Período 1º 1/09 a 1/1 º 03/01 a 3/03 3º 10/0 a 08/0 Nº Semanas Nº aulas totais
Na Atmosfera da Terra: Radiação, Matéria e Estrutura Unidade temática 2
 Sumário Na Atmosfera da Terra: Radiação, Matéria e Estrutura Unidade temática 2 Breve história. Composição média da atmosfera atual. Agentes de alteração da concentração de constituintes vestigiais da
Sumário Na Atmosfera da Terra: Radiação, Matéria e Estrutura Unidade temática 2 Breve história. Composição média da atmosfera atual. Agentes de alteração da concentração de constituintes vestigiais da
2. Enquadramento da problemática:
 2. Enquadramento da problemática: Diminuição da Espessura da Camada de Ozono na Estratosfera 4 2. Enquadramento da problemática: Diminuição da Espessura da Camada de Ozono na Estratosfera O presente estudo,
2. Enquadramento da problemática: Diminuição da Espessura da Camada de Ozono na Estratosfera 4 2. Enquadramento da problemática: Diminuição da Espessura da Camada de Ozono na Estratosfera O presente estudo,
UNIVERSIDADE DE SÃO PAULO DEPARTAMENTO DE GEOGRAFIA ATMOSFERA TERRESTRE. Professor: Emerson Galvani
 UNIVERSIDADE DE SÃO PAULO DEPARTAMENTO DE GEOGRAFIA Disciplina: FLG 0253 - CLIMATOLOGIA I ATMOSFERA TERRESTRE Professor: Emerson Galvani Aula Anterior: - Apresentação do programa, bibliografia, conceitos
UNIVERSIDADE DE SÃO PAULO DEPARTAMENTO DE GEOGRAFIA Disciplina: FLG 0253 - CLIMATOLOGIA I ATMOSFERA TERRESTRE Professor: Emerson Galvani Aula Anterior: - Apresentação do programa, bibliografia, conceitos
MATRIZ DE EXAME (Avaliação em regime não presencial 2015/2016) Disciplina: Física e Química A Módulo 2
 Agrupamento de Escolas de Rio Tinto nº 3 ENSINO SECUNDÁRIO RECORRENTE POR MÓDULOS MATRIZ DE EXAME (Avaliação em regime não presencial 2015/2016) Disciplina: Física e Química A Módulo 2 Duração da prova:
Agrupamento de Escolas de Rio Tinto nº 3 ENSINO SECUNDÁRIO RECORRENTE POR MÓDULOS MATRIZ DE EXAME (Avaliação em regime não presencial 2015/2016) Disciplina: Física e Química A Módulo 2 Duração da prova:
Reações fotoquímicas na atmosfera
 Reações fotoquímicas na atmosfera Miguel Neta, janeiro de 2019 [Imagem: NASA] Interação entre a radiação solar e a atmosfera A energia solar interage com as partículas da atmosfera provocando vários efeitos:
Reações fotoquímicas na atmosfera Miguel Neta, janeiro de 2019 [Imagem: NASA] Interação entre a radiação solar e a atmosfera A energia solar interage com as partículas da atmosfera provocando vários efeitos:
INTRODUÇÃO AOS CONCEITOS DE TEMPO E CLIMA
 INTRODUÇÃO AOS CONCEITOS DE TEMPO E CLIMA Glauber Lopes Mariano Faculdade de Meteorologia Universidade Federal de Pelotas E-mail: glauber.mariano@ufpel.edu.br Meteorologia Ciência que estuda os fenômenos
INTRODUÇÃO AOS CONCEITOS DE TEMPO E CLIMA Glauber Lopes Mariano Faculdade de Meteorologia Universidade Federal de Pelotas E-mail: glauber.mariano@ufpel.edu.br Meteorologia Ciência que estuda os fenômenos
UNIVERSIDADE FEDERAL DE OURO PRETO PRÉ-VESTIBULAR RUMO À UNIVERSIDADE CAMPUS JOÃO MONLEVADE QUÍMICA AMBIENTAL
 UNIVERSIDADE FEDERAL DE OURO PRETO PRÉ-VESTIBULAR RUMO À UNIVERSIDADE CAMPUS JOÃO MONLEVADE QUÍMICA AMBIENTAL ORIENTADORA: PROF.ª DRA. KARLA VIEIRA P R OF. LUCAS SIQUEIRA CAMADA DE OZÔNIO (I) A camada
UNIVERSIDADE FEDERAL DE OURO PRETO PRÉ-VESTIBULAR RUMO À UNIVERSIDADE CAMPUS JOÃO MONLEVADE QUÍMICA AMBIENTAL ORIENTADORA: PROF.ª DRA. KARLA VIEIRA P R OF. LUCAS SIQUEIRA CAMADA DE OZÔNIO (I) A camada
Ozônio estratosférico:
 ACA0415 O clima da Terra: processos, mudanças e impactos Ozônio estratosférico: - o que é a camada de ozônio? - quais processos (físicos e químicos) afetam a [O 3 ] 3 de setembro de 2014 Ozônio na Atmosfera
ACA0415 O clima da Terra: processos, mudanças e impactos Ozônio estratosférico: - o que é a camada de ozônio? - quais processos (físicos e químicos) afetam a [O 3 ] 3 de setembro de 2014 Ozônio na Atmosfera
Troposfera: é a camada que se estende do solo terrestre (nível do mar) até atingir 12 quilômetros de altitude. Conforme a altitude se eleva, a
 ATMOSFERA A atmosfera é uma camada formada por argônio, hélio, dióxido de carbono, ozônio, vapor de água e, principalmente, por nitrogênio e oxigênio. Essa camada é de fundamental importância para a manutenção
ATMOSFERA A atmosfera é uma camada formada por argônio, hélio, dióxido de carbono, ozônio, vapor de água e, principalmente, por nitrogênio e oxigênio. Essa camada é de fundamental importância para a manutenção
ATIVIDADE AVALIATIVA
 ATIVIDADE AVALIATIVA Valor: 2,0 Tempo para responder: 20min Sabendo que o clima não é algo estático, mas sim, um complexo e intrincado sistema de infinitas variáveis agindo simultaneamente e considerando
ATIVIDADE AVALIATIVA Valor: 2,0 Tempo para responder: 20min Sabendo que o clima não é algo estático, mas sim, um complexo e intrincado sistema de infinitas variáveis agindo simultaneamente e considerando
PERFIS HORÁRIOS DOS PRINCIPAIS POLUENTES NA REGIÃO DO NORTE
 PERFIS HORÁRIOS DOS PRINCIPAIS POLUENTES NA REGIÃO DO NORTE RUA RAINHA D. ESTEFÂNIA, 251 415-34 PORTO WWW.CCDR-N.PT TEL.: 226 86 3 FAX: 226 86 31 E-MAIL: GERAL@CCDR-N.PT Monóxido de Carbono CO Concentração
PERFIS HORÁRIOS DOS PRINCIPAIS POLUENTES NA REGIÃO DO NORTE RUA RAINHA D. ESTEFÂNIA, 251 415-34 PORTO WWW.CCDR-N.PT TEL.: 226 86 3 FAX: 226 86 31 E-MAIL: GERAL@CCDR-N.PT Monóxido de Carbono CO Concentração
Escola: Nome: Turma: N.º: Data: / / FICHA DE TRABALHO 1. troposfera a radiação termosfera. gasosa estratosfera os fenómenos. mesosfera o ar O ozono
 Conteúdo: Camadas da Atmosfera FICHA DE TRABALHO 1 troposfera a radiação termosfera gasosa estratosfera os fenómenos mesosfera o ar O ozono A atmosfera terrestre, camada que envolve a Terra, com cerca
Conteúdo: Camadas da Atmosfera FICHA DE TRABALHO 1 troposfera a radiação termosfera gasosa estratosfera os fenómenos mesosfera o ar O ozono A atmosfera terrestre, camada que envolve a Terra, com cerca
3.º Teste de Física e Química A 10.º A Jan minutos /
 3.º Teste de Física e Química A 10.º A Jan. 2013 90 minutos / Nome: n.º Classificação Professor E.E. GRUPO I As seis questões deste grupo são todas de escolha múltipla. Para cada uma delas são indicadas
3.º Teste de Física e Química A 10.º A Jan. 2013 90 minutos / Nome: n.º Classificação Professor E.E. GRUPO I As seis questões deste grupo são todas de escolha múltipla. Para cada uma delas são indicadas
Na Atmosfera da Terra: Radiação, Matéria e Estrutura Unidade temática 2
 Sumário Na : Radiação, Matéria e Estrutura Unidade temática 2 Atmosfera: temperatura, pressão e densidade em função da.. - Transferência de energia. - Principais características das camadas da atmosfera.
Sumário Na : Radiação, Matéria e Estrutura Unidade temática 2 Atmosfera: temperatura, pressão e densidade em função da.. - Transferência de energia. - Principais características das camadas da atmosfera.
Na Atmosfera da Terra: Radiação, Matéria e Estrutura Unidade temática 2
 Sumário Na Atmosfera da Terra: Radiação, Matéria e Estrutura Unidade temática 2 Breve história. Composição média da atmosfera atual. Agentes de alteração da concentração de. - Contaminação e toxicidade.
Sumário Na Atmosfera da Terra: Radiação, Matéria e Estrutura Unidade temática 2 Breve história. Composição média da atmosfera atual. Agentes de alteração da concentração de. - Contaminação e toxicidade.
Fluxos de Energia e de Materiais nos Ecossistemas
 Fluxos de Energia e de Materiais nos Ecossistemas Uma vez que o fluxo de materiais é um fluxo cíclico nos ecossistemas, é possível analisar estes fluxos usando as técnicas de balanço de materiais: [Taxa
Fluxos de Energia e de Materiais nos Ecossistemas Uma vez que o fluxo de materiais é um fluxo cíclico nos ecossistemas, é possível analisar estes fluxos usando as técnicas de balanço de materiais: [Taxa
Questões de Exame Resolvidas. Física e Química A. 11. ano. Química
 Questões de Exame Resolvidas Física e Química A 11. ano Química Índice Apresentação 3 Questões de Exame e de Testes Intermédios Química 10.º ano Domínio 1 Elementos químicos e sua organização 7 Subdomínio
Questões de Exame Resolvidas Física e Química A 11. ano Química Índice Apresentação 3 Questões de Exame e de Testes Intermédios Química 10.º ano Domínio 1 Elementos químicos e sua organização 7 Subdomínio
ESTUDO DA CONCENTRAÇÃO DE OZÔNIO DE SUPERFÍCIE, PRODUZIDO NA USINA TERMELÉTRICA WILLIAN ARJONA- CAMPO GRANDE-MS
 ESTUDO DA CONCENTRAÇÃO DE OZÔNIO DE SUPERFÍCIE, PRODUZIDO NA USINA TERMELÉTRICA WILLIAN ARJONA- CAMPO GRANDE-MS H.G.Pavão (UFMS) e A Thielle (TRACTEBEL ENERGIA S/A) Resumo: Neste trabalho apresentaremos
ESTUDO DA CONCENTRAÇÃO DE OZÔNIO DE SUPERFÍCIE, PRODUZIDO NA USINA TERMELÉTRICA WILLIAN ARJONA- CAMPO GRANDE-MS H.G.Pavão (UFMS) e A Thielle (TRACTEBEL ENERGIA S/A) Resumo: Neste trabalho apresentaremos
Reações fotoquímicas na atmosfera
 [Imagem: NASA] Interação entre a radiação solar e a atmosfera A energia solar interage com as partículas da atmosfera provocando vários efeitos: Térmicos: Químicos: Aumento da energia cinética das partículas.
[Imagem: NASA] Interação entre a radiação solar e a atmosfera A energia solar interage com as partículas da atmosfera provocando vários efeitos: Térmicos: Químicos: Aumento da energia cinética das partículas.
TEMPO E CLIMA AULA 6
 TEMPO E CLIMA AULA 6 ATMOSFERA Composição Camadas Troposfera Camada onde se dão a vida e os fenômenos meteorológicos. As temperaturas são menores quanto maiores forem as altitudes. Estratosfera Camada
TEMPO E CLIMA AULA 6 ATMOSFERA Composição Camadas Troposfera Camada onde se dão a vida e os fenômenos meteorológicos. As temperaturas são menores quanto maiores forem as altitudes. Estratosfera Camada
Tópico I - Composição da atmosfera da Terra. Notas de aula de Meteorologia Ambiental Profa. Maria de Fatima Andrade
 Tópico I - Composição da atmosfera da Terra Notas de aula de Meteorologia Ambiental 2014 Profa. Maria de Fatima Andrade A composição da atmosfera da Terra é o resultado de vários processos que ocorreram
Tópico I - Composição da atmosfera da Terra Notas de aula de Meteorologia Ambiental 2014 Profa. Maria de Fatima Andrade A composição da atmosfera da Terra é o resultado de vários processos que ocorreram
Inicialmente a oxidação do metano em altas temperaturas pode ser realizada através da reação: CH 4 + O2 = CH 3 + HO 2 Ou por: CH 4 + M = CH 3 + H + M
 1 1. Introdução O aumento da produção mundial de aço aliada à crescente preocupação com questões ambientais, tem exigido do setor siderúrgico a melhoria dos processos já existentes e o desenvolvimento
1 1. Introdução O aumento da produção mundial de aço aliada à crescente preocupação com questões ambientais, tem exigido do setor siderúrgico a melhoria dos processos já existentes e o desenvolvimento
Matriz do Teste de Avaliação de Física e Química A - 11.º ano 3 de maio de minutos
 Ano Letivo 2015/ 2016 Objeto de avaliação Matriz do Teste de Avaliação de Física e Química A - 11.º ano 3 de maio de 2016 120 minutos O teste tem por referência o programa de Física e Química A para o
Ano Letivo 2015/ 2016 Objeto de avaliação Matriz do Teste de Avaliação de Física e Química A - 11.º ano 3 de maio de 2016 120 minutos O teste tem por referência o programa de Física e Química A para o
Escola Secundária de Lagoa. Ficha de Trabalho 18. Chamadas de Atenção. Física e Química A 11º Ano Turma A Paula Melo Silva
 Escola Secundária de Lagoa Física e Química A 11º Ano Turma A Paula Melo Silva Chamadas de Atenção Ficha de Trabalho 18 Atmosfera (Unidade 2 de Química do 10ºano) A atmosfera não teve sempre a mesma composição.
Escola Secundária de Lagoa Física e Química A 11º Ano Turma A Paula Melo Silva Chamadas de Atenção Ficha de Trabalho 18 Atmosfera (Unidade 2 de Química do 10ºano) A atmosfera não teve sempre a mesma composição.
Origem da atmosfera. Fim da acresção material; Gases foram liberados e ficaram presos à Terra pela ação da gravidade; e
 Páginas 02 à 20. Origem da atmosfera Fim da acresção material; Gases foram liberados e ficaram presos à Terra pela ação da gravidade; e Vapor d água também se desprendeu, dando origem às chuvas que ajudaram
Páginas 02 à 20. Origem da atmosfera Fim da acresção material; Gases foram liberados e ficaram presos à Terra pela ação da gravidade; e Vapor d água também se desprendeu, dando origem às chuvas que ajudaram
Agrupamento de Escolas Luís António Verney. Ano lectivo de 2012/13. Ciências Físico Químicas - 8ºAno de Escolaridade
 Substâncias Químicas Natureza corpuscular da matéria Corpúsculos constituintes das substâncias: átomos, iões, moléculas Noção de T.P 3 8 Tema C - Sustentabilidade na Terra Inferir sobre a pequenez dos
Substâncias Químicas Natureza corpuscular da matéria Corpúsculos constituintes das substâncias: átomos, iões, moléculas Noção de T.P 3 8 Tema C - Sustentabilidade na Terra Inferir sobre a pequenez dos
AGRUPAMENTO DE ESCOLAS SEBASTIÃO DA GAMA
 AGRUPAMENTO DE ESCOLAS SEBASTIÃO DA GAMA ESCOLA SECUNDÁRIA SEBASTIÃO DA GAMA Cursos Científico-Humanísticos de Ciências e Tecnologias Ensino Recorrente de Nível Secundário Física e Química A 10ºano MÓDULO
AGRUPAMENTO DE ESCOLAS SEBASTIÃO DA GAMA ESCOLA SECUNDÁRIA SEBASTIÃO DA GAMA Cursos Científico-Humanísticos de Ciências e Tecnologias Ensino Recorrente de Nível Secundário Física e Química A 10ºano MÓDULO
Biologia 12º Ano Preservar e Recuperar o Ambiente
 Escola Secundária com 2º e 3º Ciclos Prof. Reynaldo dos Santos Biologia 12º Ano Preservar e Recuperar o Ambiente 1. Há alguns dias atrás um geólogo austríaco alertava para um potencial impacto da erupção
Escola Secundária com 2º e 3º Ciclos Prof. Reynaldo dos Santos Biologia 12º Ano Preservar e Recuperar o Ambiente 1. Há alguns dias atrás um geólogo austríaco alertava para um potencial impacto da erupção
UNIVERSIDADE DE SÃO PAULO DEPARTAMENTO DE GEOGRAFIA ATMOSFERA TERRESTRE. Professor: Emerson Galvani
 UNIVERSIDADE DE SÃO PAULO DEPARTAMENTO DE GEOGRAFIA Disciplina: FLG 0253 - CLIMATOLOGIA I ATMOSFERA TERRESTRE Professor: Emerson Galvani Aula Anterior: - Apresentação do programa, bibliografia, conceitos
UNIVERSIDADE DE SÃO PAULO DEPARTAMENTO DE GEOGRAFIA Disciplina: FLG 0253 - CLIMATOLOGIA I ATMOSFERA TERRESTRE Professor: Emerson Galvani Aula Anterior: - Apresentação do programa, bibliografia, conceitos
ESCOLA SECUNDÁRIA DE CASQUILHOS 6.º Teste sumativo de FQA 26. Abril Versão 1 11.º Ano Turmas A e B
 ESCOLA SECUNDÁRIA DE CASQUILHOS 6.º Teste sumativo de FQA 26. Abril. 2016 Versão 1 11.º Ano Turmas A e B Duração da prova: 90 minutos. Este teste é constituído por 8 páginas e termina na palavra FIM Nome:
ESCOLA SECUNDÁRIA DE CASQUILHOS 6.º Teste sumativo de FQA 26. Abril. 2016 Versão 1 11.º Ano Turmas A e B Duração da prova: 90 minutos. Este teste é constituído por 8 páginas e termina na palavra FIM Nome:
ATMOSFERA é o nome dado à camada gasosa que envolve os planetas. No caso da atmosfera terrestre ela é composta por
 ATMOSFERA é o nome dado à camada gasosa que envolve os planetas. No caso da atmosfera terrestre ela é composta por inúmeros gases que ficam retidos por causa da força da gravidade e do campo magnético
ATMOSFERA é o nome dado à camada gasosa que envolve os planetas. No caso da atmosfera terrestre ela é composta por inúmeros gases que ficam retidos por causa da força da gravidade e do campo magnético
Gabarito Prova Primeira Fase
 VIII OLIMPÍADA REGIONAL DE CIÊNCIAS 2006 Gabarito Prova Primeira Fase Cruzadinha Vertical 1. Força por unidade de área. 2. Principal fonte de energia da atmosfera e superfície da terra. 3. Substância responsável
VIII OLIMPÍADA REGIONAL DE CIÊNCIAS 2006 Gabarito Prova Primeira Fase Cruzadinha Vertical 1. Força por unidade de área. 2. Principal fonte de energia da atmosfera e superfície da terra. 3. Substância responsável
Características particulares da Terra: composição química
 Características particulares da Terra: composição química Predomínio de carbono, oxigénio, azoto, enxofre e fósforo Abundância de água Elementos químicos essenciais a todos os seres vivos Características
Características particulares da Terra: composição química Predomínio de carbono, oxigénio, azoto, enxofre e fósforo Abundância de água Elementos químicos essenciais a todos os seres vivos Características
Departamento de Matemática e Ciências Experimentais FÍSICA E QUÍMICA A 10º ANO
 PLANIFICAÇÃO A LONGO PRAZO Nº aulas/semana: 7 x min Gestão dos tempos letivos Departamento de Matemática e Ciências Experimentais FÍSICA E QUÍMICA A 10º ANO 1º Período 16/09 a 17/1 01 / 01 º Período 06/01
PLANIFICAÇÃO A LONGO PRAZO Nº aulas/semana: 7 x min Gestão dos tempos letivos Departamento de Matemática e Ciências Experimentais FÍSICA E QUÍMICA A 10º ANO 1º Período 16/09 a 17/1 01 / 01 º Período 06/01
0.2. Soluções Quais e quantos componentes O que são soluções aquosas Composição quantitativa de soluções
 QUÍMICA 0. Materiais: diversidade e constituição 0.1. Materiais Qual a origem Que constituição e composição Como se separam constituintes Como se explica a sua diversidade 0.2. Soluções Quais e quantos
QUÍMICA 0. Materiais: diversidade e constituição 0.1. Materiais Qual a origem Que constituição e composição Como se separam constituintes Como se explica a sua diversidade 0.2. Soluções Quais e quantos
Funções da Atmosfera. pág Q
 A Atmosfera A atmosfera é a mistura de gases que envolve a Terra; O seu limite situa-se a cerca de 1000 Km acima do nível do mar, mas 99% da massa que constitui a atmosfera localiza-se a menos de 40 km
A Atmosfera A atmosfera é a mistura de gases que envolve a Terra; O seu limite situa-se a cerca de 1000 Km acima do nível do mar, mas 99% da massa que constitui a atmosfera localiza-se a menos de 40 km
PROVAS DE ACESSO AO ENSINO SUPERIOR PARA MAIORES DE 23 ANOS PROGRAMA DA PROVA ESPECÍFICA FÍSICA/QUÍMICA
 PROVAS DE ACESSO AO ENSINO SUPERIOR PARA MAIORES DE 23 ANOS PROGRAMA DA PROVA ESPECÍFICA FÍSICA/QUÍMICA 2012 Componente de Física 1. Mecânica da Partícula 1.1 Cinemática e dinâmica da partícula em movimento
PROVAS DE ACESSO AO ENSINO SUPERIOR PARA MAIORES DE 23 ANOS PROGRAMA DA PROVA ESPECÍFICA FÍSICA/QUÍMICA 2012 Componente de Física 1. Mecânica da Partícula 1.1 Cinemática e dinâmica da partícula em movimento
Teste de Física e Química A 10º A Jan minutos /
 Teste de Física e Química A 10º A Jan. 2012 90 minutos / Nome: nº Classificação Professor E.E. GRUPO I As seis questões deste grupo são todas de escolha múltipla. Para cada uma delas são indicadas quatro
Teste de Física e Química A 10º A Jan. 2012 90 minutos / Nome: nº Classificação Professor E.E. GRUPO I As seis questões deste grupo são todas de escolha múltipla. Para cada uma delas são indicadas quatro
Unidade 4 Perturbações no equilíbrio dos ecossistemas. Planeta Terra 8.º ano
 Unidade 4 Perturbações no equilíbrio dos ecossistemas Quais são as causas das perturbações dos ecossistemas? Causas naturais Causas humanas Quais são as fontes de alteração da atmosfera? A atmosfera é
Unidade 4 Perturbações no equilíbrio dos ecossistemas Quais são as causas das perturbações dos ecossistemas? Causas naturais Causas humanas Quais são as fontes de alteração da atmosfera? A atmosfera é
SISTEMAS DA TERRA. Os sistemas da Terra são: Biosfera Atmosfera Litosfera Hidrosfera ATMOS- FERA LITOSFERA BIOSFERA HIDROS- FERA
 DESAFIOS AMBIENTAIS SISTEMAS DA TERRA Os sistemas da Terra são: Biosfera Atmosfera Litosfera Hidrosfera HIDROS- FERA ATMOS- FERA LITOSFERA BIOSFERA ATMOSFERA Funções A atmosfera: Filtra e absorve radiações
DESAFIOS AMBIENTAIS SISTEMAS DA TERRA Os sistemas da Terra são: Biosfera Atmosfera Litosfera Hidrosfera HIDROS- FERA ATMOS- FERA LITOSFERA BIOSFERA ATMOSFERA Funções A atmosfera: Filtra e absorve radiações
Escola Secundária de Lagoa. Ficha de Trabalho 16. Exercícios. Física e Química A 11º Ano Paula Melo Silva
 Escola Secundária de Lagoa Física e Química A 11º Ano Paula Melo Silva Exercícios Ficha de Trabalho 16 Global 1. Um certo ião negativo, X 3-, tem um número total de eletrões de 18 e o seu número de massa
Escola Secundária de Lagoa Física e Química A 11º Ano Paula Melo Silva Exercícios Ficha de Trabalho 16 Global 1. Um certo ião negativo, X 3-, tem um número total de eletrões de 18 e o seu número de massa
Escola Secundária de Alcácer do Sal Química 12º ano teste 5 25/05/2004
 Escola Secundária de Alcácer do Sal Química 12º ano teste 5 25/05/2004 I Escreva na sua folha de respostas a letra correspondente à alternativa correcta que seleccionar para cada item. A indicação de mais
Escola Secundária de Alcácer do Sal Química 12º ano teste 5 25/05/2004 I Escreva na sua folha de respostas a letra correspondente à alternativa correcta que seleccionar para cada item. A indicação de mais
Mudanças as Ambientais Globais PROPRIEDADE REGISTRADA
 Mudanças as Ambientais Globais PROPRIEDADE REGISTRADA O que é a Camada de Ozônio? A camada de Ozônio É uma camada formada pelo composto O 3 (gás s ozônio) na partes altas da atmosfera. Após s sua formação
Mudanças as Ambientais Globais PROPRIEDADE REGISTRADA O que é a Camada de Ozônio? A camada de Ozônio É uma camada formada pelo composto O 3 (gás s ozônio) na partes altas da atmosfera. Após s sua formação
ATENÇÃO: assinale ou apresente cuidadosamente as respostas e apresente TODOS os cálculos efectuados.
 Prova de Acesso de Química Maiores de 23 Anos Candidatura 2015-2016 / Candidatos oriundos de outros sistemas de ensino 2015/2016 15 de Junho de 2016 10h00 12h30 ATENÇÃO: assinale ou apresente cuidadosamente
Prova de Acesso de Química Maiores de 23 Anos Candidatura 2015-2016 / Candidatos oriundos de outros sistemas de ensino 2015/2016 15 de Junho de 2016 10h00 12h30 ATENÇÃO: assinale ou apresente cuidadosamente
C2EF.6 CIÊNCIAS GRACE K. ESTUDO DIRIGIDO- ATMOSFERA
 C2EF.6 CIÊNCIAS GRACE K. ESTUDO DIRIGIDO- ATMOSFERA Atmosfera é o nome dado à camada gasosa que envolve os planetas. No caso da atmosfera terrestre ela é composta por inúmeros gases que ficam retidos por
C2EF.6 CIÊNCIAS GRACE K. ESTUDO DIRIGIDO- ATMOSFERA Atmosfera é o nome dado à camada gasosa que envolve os planetas. No caso da atmosfera terrestre ela é composta por inúmeros gases que ficam retidos por
COLÉGIO NOVO ANGLO DE JABOTICABAL (QUÍMICA) PROFESSOR: JOÃO MEDEIROS
 COLÉGIO NOVO ANGLO DE JABOTICABAL (QUÍMICA) ATMOSFERA TERRESTRE: TROPOSFERA PROFESSOR: JOÃO MEDEIROS 2012 Atmosfera terrestre Dividida em 5 camadas: Exosfera Ionosfera Mesosfera Estratosfera Troposfera
COLÉGIO NOVO ANGLO DE JABOTICABAL (QUÍMICA) ATMOSFERA TERRESTRE: TROPOSFERA PROFESSOR: JOÃO MEDEIROS 2012 Atmosfera terrestre Dividida em 5 camadas: Exosfera Ionosfera Mesosfera Estratosfera Troposfera
Lei de Avogadro, volume molar e massa volúmica. Vm= V n. (dm3 /mol) Volume molar
 2.2.1 Lei de Avogadro, volume molar e massa volúmica Adaptado pelo Prof. Luís Perna Volume molar O estudo do estado gasoso é particularmente interessante porque nele as moléculas podem ser consideradas
2.2.1 Lei de Avogadro, volume molar e massa volúmica Adaptado pelo Prof. Luís Perna Volume molar O estudo do estado gasoso é particularmente interessante porque nele as moléculas podem ser consideradas
ATENÇÃO: assinale ou apresente cuidadosamente as respostas e apresente TODOS os cálculos efectuados.
 Prova de Acesso de Química Maiores de 23 Anos Candidatura 2014-2015 18 de Junho de 2015 10h00 12h30 Nome CCnº ATENÇÃO: assinale ou apresente cuidadosamente as respostas e apresente TODOS os cálculos efectuados.
Prova de Acesso de Química Maiores de 23 Anos Candidatura 2014-2015 18 de Junho de 2015 10h00 12h30 Nome CCnº ATENÇÃO: assinale ou apresente cuidadosamente as respostas e apresente TODOS os cálculos efectuados.
5) A atmosfera é constituída de cinco camadas: troposfera, estratosfera, mesosfera, termosfera e exosfera.
 GABARITO 1ª LISTA DE EXERCÍCIOS 1) Apesar de sua baixa concentração, o vapor d água é um constituinte atmosférico importantíssimo por interferir na distribuição da temperatura: em primeiro lugar, porque
GABARITO 1ª LISTA DE EXERCÍCIOS 1) Apesar de sua baixa concentração, o vapor d água é um constituinte atmosférico importantíssimo por interferir na distribuição da temperatura: em primeiro lugar, porque
UNIVERSIDADE FEDERAL DE SANTA MARIA CENTRO DE CIÊNCIAS NATURAIS E EXTAS CURSO DE GRADUAÇÃO EM GEOGRAFIA Disciplina: Climatologia Geográfica I
 UNIVERSIDADE FEDERAL DE SANTA MARIA CENTRO DE CIÊNCIAS NATURAIS E EXTAS CURSO DE GRADUAÇÃO EM GEOGRAFIA Disciplina: Climatologia Geográfica I Unidade II Controle primário do tempo e clima parte 2 Patricia
UNIVERSIDADE FEDERAL DE SANTA MARIA CENTRO DE CIÊNCIAS NATURAIS E EXTAS CURSO DE GRADUAÇÃO EM GEOGRAFIA Disciplina: Climatologia Geográfica I Unidade II Controle primário do tempo e clima parte 2 Patricia
Nome Completo : Prova de Acesso de Química para Maiores de 23 Anos. Candidatura de Junho de 2013, 10: h
 Nome Completo : B. I. n.º Prova de Acesso de Química para Maiores de 23 Anos Candidatura 2013-2014 18 de Junho de 2013, 10:00 12.30 h Respostas às perguntas de escolha múltipla: assinale a resposta certa
Nome Completo : B. I. n.º Prova de Acesso de Química para Maiores de 23 Anos Candidatura 2013-2014 18 de Junho de 2013, 10:00 12.30 h Respostas às perguntas de escolha múltipla: assinale a resposta certa
CONCENTRAÇÃO DE OZÔNIO DE SUPERFÍCIE, PRODUZIDO NA ÁREA DE INFLUÊNCIA DA USINA TERMELÉTRICA WILLIAN ARJONA- CAMPO GRANDE-MS
 CONCENTRAÇÃO DE OZÔNIO DE SUPERFÍCIE, PRODUZIDO NA ÁREA DE INFLUÊNCIA DA USINA TERMELÉTRICA WILLIAN ARJONA- CAMPO GRANDE-MS H.G.Pavão (UFMS) e A Thielle (TRACTEBEL ENERGIA S/A) Resumo: Neste trabalho apresentaremos
CONCENTRAÇÃO DE OZÔNIO DE SUPERFÍCIE, PRODUZIDO NA ÁREA DE INFLUÊNCIA DA USINA TERMELÉTRICA WILLIAN ARJONA- CAMPO GRANDE-MS H.G.Pavão (UFMS) e A Thielle (TRACTEBEL ENERGIA S/A) Resumo: Neste trabalho apresentaremos
7ª Ficha de Avaliação de Conhecimentos Turma: 10ºA Física e Química A 10ºAno (VERSÃO 1)
 Página1 7ª Ficha de Avaliação de Conhecimentos Turma: 10ºA Física e Química A 10ºAno (VERSÃO 1) Professora Paula Melo Silva Data: 22 de março Ano Letivo: 2018/2019 135 + 15 min 1. Um aluno A leva a sua
Página1 7ª Ficha de Avaliação de Conhecimentos Turma: 10ºA Física e Química A 10ºAno (VERSÃO 1) Professora Paula Melo Silva Data: 22 de março Ano Letivo: 2018/2019 135 + 15 min 1. Um aluno A leva a sua
CEC- Centro Educacional Cianorte ELEMENTOS CLIMÁTICOS
 CEC- Centro Educacional Cianorte ELEMENTOS CLIMÁTICOS PROFESSOR: JOÃO CLÁUDIO ALCANTARA DOS SANTOS A atmosfera A atmosfera constitui uma transição gradual entre o ambiente em que vivemos e o restante do
CEC- Centro Educacional Cianorte ELEMENTOS CLIMÁTICOS PROFESSOR: JOÃO CLÁUDIO ALCANTARA DOS SANTOS A atmosfera A atmosfera constitui uma transição gradual entre o ambiente em que vivemos e o restante do
Lei de Avogadro, volume molar e massa volúmica. Volume molar
 2.2.1 Lei de Avogadro, volume molar e massa volúmica Volume molar O estudo do estado gasoso é particularmente interessante porque nele as moléculas podem ser consideradas como entidades que não interagem
2.2.1 Lei de Avogadro, volume molar e massa volúmica Volume molar O estudo do estado gasoso é particularmente interessante porque nele as moléculas podem ser consideradas como entidades que não interagem
Camadas da Atmosfera (características físico químicas)
 Camadas da Atmosfera (características físico químicas) Gradiente médio negativo temperatura aumenta conforme aumenta a altitude. Gradiente médio positivo temperatura diminui conforme aumenta a altitude.
Camadas da Atmosfera (características físico químicas) Gradiente médio negativo temperatura aumenta conforme aumenta a altitude. Gradiente médio positivo temperatura diminui conforme aumenta a altitude.
Componentes do Ambiente. Leonardo Rodrigues EEEFM GRAÇA ARANHA
 Componentes do Ambiente Leonardo Rodrigues EEEFM GRAÇA ARANHA Bióticos: Seres vivos Microorganismos Animais Plantas Bióticos: Seres vivos Microorganismos Animais Plantas Abióticos: Físico Químico Luz Temperatura
Componentes do Ambiente Leonardo Rodrigues EEEFM GRAÇA ARANHA Bióticos: Seres vivos Microorganismos Animais Plantas Bióticos: Seres vivos Microorganismos Animais Plantas Abióticos: Físico Químico Luz Temperatura
EXAME NACIONAL DO ENSINO SECUNDÁRIO VERSÃO 2
 EXAME NACIONAL DO ENSINO SECUNDÁRIO 12.º Ano de Escolaridade (Decreto-Lei n.º 286/89, de 29 de Agosto) Cursos Gerais Agrupamentos 1 e 2 PROVA 142/12 Págs. Duração da prova: 120 minutos 2005 2.ª FASE PROVA
EXAME NACIONAL DO ENSINO SECUNDÁRIO 12.º Ano de Escolaridade (Decreto-Lei n.º 286/89, de 29 de Agosto) Cursos Gerais Agrupamentos 1 e 2 PROVA 142/12 Págs. Duração da prova: 120 minutos 2005 2.ª FASE PROVA
2. A pressão atmosférica no cume do monte McKinley é 606 mmhg num determinado dia. Qual é o valor dessa pressão em atm e kpa?
 EB: QUÍMICA GERAL/ EQB: QUÍMICA GERAL I Capítulo 5. Gases Ficha de Exercícios 1. Converta 562 mmhg em atm. 2. A pressão atmosférica no cume do monte McKinley é 606 mmhg num determinado dia. Qual é o valor
EB: QUÍMICA GERAL/ EQB: QUÍMICA GERAL I Capítulo 5. Gases Ficha de Exercícios 1. Converta 562 mmhg em atm. 2. A pressão atmosférica no cume do monte McKinley é 606 mmhg num determinado dia. Qual é o valor
ACA0410 Introdução à química atmosférica
 Universidade de São Paulo Instituto de Astronomia, Geofísica e Ciências Atmosféricas Departamento de Ciências Atmosféricas DCA/IAG/USP ACA0410 Introdução à química atmosférica Composição química da atmosfera
Universidade de São Paulo Instituto de Astronomia, Geofísica e Ciências Atmosféricas Departamento de Ciências Atmosféricas DCA/IAG/USP ACA0410 Introdução à química atmosférica Composição química da atmosfera
5ª Ficha de Avaliação de Conhecimentos Turma: 10ºA. Física e Química A - 10ºAno. Data: 11 março 2015 Ano Letivo: 2014/ min.
 5ª Ficha de Avaliação de Conhecimentos Turma: 10ºA Física e Química A - 10ºAno Professora Paula Melo Silva Data: 11 março 2015 Ano Letivo: 2014/2015 135 min Grupo I 1. A Terra é o único planeta do sistema
5ª Ficha de Avaliação de Conhecimentos Turma: 10ºA Física e Química A - 10ºAno Professora Paula Melo Silva Data: 11 março 2015 Ano Letivo: 2014/2015 135 min Grupo I 1. A Terra é o único planeta do sistema
Escola Secundária de Lagoa. Ficha de Trabalho 14. Física e Química A. 1. Leia atentamente o seguinte texto:
 Escola Secundária de Lagoa Física e Química A 10º Ano Turmas A e B Paula Silva e Emília Correia Ficha de Trabalho 14 Componente de Química 10ºAno 2014/2015 1. Leia atentamente o seguinte texto: Portugal
Escola Secundária de Lagoa Física e Química A 10º Ano Turmas A e B Paula Silva e Emília Correia Ficha de Trabalho 14 Componente de Química 10ºAno 2014/2015 1. Leia atentamente o seguinte texto: Portugal
Escola Secundária de Alcácer do Sal Química 12º ano teste 1 15/10/2003
 Escola Secundária de Alcácer do Sal Química 12º ano teste 1 15/10/2003 I Escreva na sua folha de respostas a letra correspondente à alternativa correcta que seleccionar para cada item. A indicação de mais
Escola Secundária de Alcácer do Sal Química 12º ano teste 1 15/10/2003 I Escreva na sua folha de respostas a letra correspondente à alternativa correcta que seleccionar para cada item. A indicação de mais
FORMAÇÃO DE OZÔNIO. Luciana V. Rizzo - UNIFESP
 FORMAÇÃO DE OZÔNIO Luciana V. Rizzo - UNIFESP Exemplo: produção de O 3 na troposfera O 3 Estratosfera: (~10 ppm) Troposfera: (~10 ppb) Produzido naturalmente pela fotólise do O Produzido a partir de emissões
FORMAÇÃO DE OZÔNIO Luciana V. Rizzo - UNIFESP Exemplo: produção de O 3 na troposfera O 3 Estratosfera: (~10 ppm) Troposfera: (~10 ppb) Produzido naturalmente pela fotólise do O Produzido a partir de emissões
MATRIZ DA PROVA DE EXAME A NÍVEL DE ESCOLA AO ABRIGO DO DECRETO-LEI Nº
 MATRIZ DA PROVA DE EXAME A NÍVEL DE ESCOLA AO ABRIGO DO DECRETO-LEI Nº 357 / 2007, de 29 de Outubro (Duração: 90minutos + 30 minutos de tolerância) 10º ano Física e Química A (Cursos Científico-Humanísticos
MATRIZ DA PROVA DE EXAME A NÍVEL DE ESCOLA AO ABRIGO DO DECRETO-LEI Nº 357 / 2007, de 29 de Outubro (Duração: 90minutos + 30 minutos de tolerância) 10º ano Física e Química A (Cursos Científico-Humanísticos
