Por quê a agulha flutua sobre a água?
|
|
|
- Vitorino Alvarenga Leveck
- 7 Há anos
- Visualizações:
Transcrição
1 Por quê a agulha flutua sobre a água?
2 Por que o inseto pode andar sobre a água?
3 As moléculas no interior sofrem forças atrativas em todas as direções. As moléculas da superfície só têm moléculas vizinhas do lado interno e, portanto, só experimentam forças que tendem a puxa-las para dentro. Qual é a resultante desta compensação de forças assimétricas? A superfície do líquido tomará forma de maneira que a menor quantidade de moléculas permaneçam na superfície. A área superficial tende a diminuir.
4 As moléculas no interior sofrem forças atrativas em todas as direções. As moléculas da superfície só têm moléculas vizinhas do lado interno e, portanto, só experimentam forças que tendem a puxa-las para dentro. Qual é a resultante desta compensação de forças assimétricas? A superfície do líquido tomará forma de maneira que a menor quantidade de moléculas permaneçam na superfície. A área superficial tende a diminuir.
5 A forma esférica é a que apresenta menor relação superfície/volume
6 O empacotamento das moléculas da superfície será maior que das moléculas do interior do líquido. As moléculas da superfície formarão uma espécie de pele que será mais resistente a perturbações moleculares. A força que deve ser realizada para quebrar esta estrutura coesa e, portanto, aumentar a área da superfície é chamada de Tensão Superficial.
7 Tensão superficial é o trabalho necessário para aumentar a área superficial (σ) de um líquido numa determinada quantidade (dσ). dw = d
8 Interações do tipo ligações de H alta tensão superficial a 20 C = 72 Dyn/cm ou 0,072 N/m
9 Substância Benzeno Mercúrio Metanol Água Γ (mn/m) 28, ,6 72,75 Hg Interações intermoleculares metálicas muito fortes
10 Como determinar experimentalmente a tensão superficial na interface líquido-ar?
11
12
13 Du Noüy Ring Method
14 Du Noüy Ring with liquid lamella force (F) contact angle (q) wetted length (L) air air ( r A ) liquid ( r L ) liquid V = volume of liquid being weighed at measurement F V = g V ( r L -r A ) θ=0 at F=F max = F - F V L cos q
15 1 = 1 d + 1 p Liquid Name N,N-dimethyl-Formamid n-decane n-heptane n-hexane n-octane n-tetradecane nitro-ethane (Schultz) nitro-methane (Schultz) Phthalic-acid-diethylester 22 sym-tetrabromo-ethane (Ström) sym-tetrachloro-ethane (Ström) tetrachloro-methane (Schultz) Toluene (Schultz) Tricresyl-phosphate (Fowkes) Water Water (Busscher) Water (Rabel) 22 Water (Ström) 20 a-bromo-naphthalene (Busscher) a-brom-naphthalene (Ström)20 Surface Tension Disperse Part Polar Part
16
17 O que são surfactantes? Cauda hidrofóbica Cabeça hidrofílica
18 Diminui a tensão superficial!! O que acontece quando colocado em água?
19 Quando um surfactante é adicionado à água suas moléculas tentam se arranjar de modo à minimizar a repulsão entre grupos hidrofóbicos e a água: os grupos polares ficam na solução aquosa, próximo à superfície, e os grupos apolares ficam na interface àgua-ar, minimizando o contato com a água. Isto gera uma diminuição na tensão superficial da água, pois provoca um desarranjo de sua superfície.
20 Uma das características comum a todos os surfactantes é a capacidade de formar agregados em solução aquosa a partir de uma determinada concentração. Estes agregados são denominados micelas. A concentração onde inicia o processo de formação das micelas (micelização) é chamada de concentração crítica micelar, cmc, que é uma propriedade intrínseca e característica do surfactante.
21 Por que micelas são formadas espontaneamente?
22 Por que micelas são formadas espontaneamente? Micela esférica SDS a 25 o C G mic = -21 kj/mol H mic = +2,54 kj/mol S mic = +81,9 kj/mol G mic = RT ln cmc
23 surface tension (mn/m) Determinação da concentração micelar crítica (cmc) surfactant in water at 20 C critical micelle concentration (CMC) air surface surfactant at Surface surface saturated micelles formed 30 water ,000 Concentration (mg/l)
24 Após a CMC As micelas, ao contrário dos monômeros, ficam dispersas em toda a solução, não apresentando efeito sobre a tensão superficial da água
25 Time dependence of surface tension mn/m 2. Rühren mn/m mn/m mn/m
26
27
28 Tipos de tensoativos Cabeça Aniônica: dodecil benzeno sulfonato de sódio Aniônica: dodecil sulfato de sódio Catiônica: cloreto de cetiltrimetil amônio Neutra: Álcool láurico etoxilado Nonilfenol etoxilado sabão em pó xampu Aplicação condicionador de cabelo e Amaciantes de roupas produtos para limpeza industrial prod. p/ limpeza domestica n S S n n = número de agregação
29 log (cmc, mol/l) Efeitos da estrutura química do tensoativo na cmc e em n Influência do tamanho da cadeia alquílica Tensoativo cmc (mmo/l) n Brometo de deciltrimel amônio C 10 TAB Brometo de dodeciltrimel amônio C 12 TAB 15,3 50 Brometo de tetradeciltrimel amônio C 14 TAB 3,02 75 Brometo de cetiltrimel amônio C 16 TAB B Linear Fit of Data1_B C n
30 Efeitos da estrutura química do tensoativo na cmc Influência da adição de eletrólitos na cmc e no número de agregação de tensoativos iônicos Tensoativo NaCl cmc n (mmo/l) (mmol/l) Dodecil sulfato de sódio 0 8, , , ,83 118
31 Efeitos da estrutura química do tensoativo na cmc Tensoativos neutros geralmente apresentam valores de cmc menores que os tensoativos carregados. Ex.: Tween 20 (monolaurato de sorbitano polietileno glicol) Tween 20 cmc ~ 0,08 mmol/l a 21 C 2 ordens de grandeza menor que a cmc do SDS!
32 Estruturas auto-associadas
33
34 Micelas Micelas reversas n menor
35 Bolha de sabão
36 O parâmetro de empacotamento (P) e seu efeito na forma das estruturas auto-associadas a l c Geometria = resultado do balanço entre interações hidrofóbicas (caudas) e repulsões eletrostáticas ou estéricas (cabeças) P = V l c a V = volume da cauda hidrofóbica l c = comprimento da causa hidrofóbica a = área da cabeça hidrofílica na interface J. N. Israelachvili, Intermolecular and Surface Forces, 2nd ed. Academic Press, N.Y., 1991
37 P < 1/3 Micelas esféricas em meio aquoso cone Exemplo: SDS em água V = nm² l c = 1,67 nm a = 0,57 nm² P = 0,37 ( levemente elíptica)
38 1/3 < P < 1/2 Micelas cilíndricas em meio aquoso Cone truncado 1/2 < P < 1 Vesículas (bicamadas flexíveis) Cone truncado Exemplo: fosfatidil colina (PC) em água V = 1,036 nm³ l c = 1,75 nm a = 0,717 nm² P = 0,85
39 P ~ 1 Bicamadas planares Cilindro Cone truncado invertido P > 1 Micelas reversas
40 Concentração do tensoativo
41 Isoterma de adsorção de Gibbs Ar Ar Adição de tensoativo Interface Líquido Líquido Concentração superficial em excesso ( ) = Número de moléculas de tensoativo adsorvidas na interface Área
42 , mn/m Isoterma de adsorção de Gibbs: relaciona e = - 1 RT ( d dlnc ) P,T T = 25 o C Hexokinase: catalisa a fosforilação da glicose 0,0 0,5 1,0 1,5 2,0 2,5 [HK], g/l
43 , mn/m, mn/m Isoterma de adsorção de Gibbs: relaciona e = - 1 RT ( d dlnc ) P,T Γ = 8, moléculas/m 2 70 T = 25 o C ,0 0,5 1,0 1,5 2,0 2,5 [HK], g/l ln[hk] ln [HK] Área de 1 molécula de HK = 1,14 x m² Área calculada = 3, m 2
Distância x Potencial. Tipo de interação. Energia típica (kj/mol) Íon íon. Íon-dipolo permanente. 1 a 2. Dipolo induzido - dipolo induzido (London)
 Tipo de interação Íon íon Íon-dipolo permanente Distância x Potencial Energia típica (kj/mol) 250 15 Dipolo perman. - dipolo permanente (Keesom) Dipolo perman. - dipolo induzido (Debye) Dipolo induzido
Tipo de interação Íon íon Íon-dipolo permanente Distância x Potencial Energia típica (kj/mol) 250 15 Dipolo perman. - dipolo permanente (Keesom) Dipolo perman. - dipolo induzido (Debye) Dipolo induzido
) T, p. Processos Superficiais Tensão Superficial. Efeito de substâncias dissolvidas na tensão superficial de um solvente. RT ln (C 2 /C )) T, p
 - Lembrando da isoterma de Gibbs: para uma solução com dois componente Γ 2 = 1 RT ( γ ln a 2 ) T, p Considerando solução diluída ideal Γ 2 = 1 ( γ RT ln (C 2 /C )) T, p Γ 2 = C 2 RT ( γ C 2 ) T, p - de
- Lembrando da isoterma de Gibbs: para uma solução com dois componente Γ 2 = 1 RT ( γ ln a 2 ) T, p Considerando solução diluída ideal Γ 2 = 1 ( γ RT ln (C 2 /C )) T, p Γ 2 = C 2 RT ( γ C 2 ) T, p - de
SABÕES E DETERGENTES. Laboratório de Química dos Elementos QUI Figura 1: Representação esquemática de um tensoativo
 SABÕES E DETERGENTES Os sabões e os detergentes são constituídos de compostos orgânicos com grupamentos polares (carboxílicos - sabões, sulfônicos - detergentes e etc.) e apolares (hidrocarbonetos) na
SABÕES E DETERGENTES Os sabões e os detergentes são constituídos de compostos orgânicos com grupamentos polares (carboxílicos - sabões, sulfônicos - detergentes e etc.) e apolares (hidrocarbonetos) na
INGREDIENTE ATIVO é o composto responsável pela eficácia biológica.
 ADJUVANTES DEFINIÇÕES INGREDIENTE ATIVO é o composto responsável pela eficácia biológica. ADJUVANTES - é qualquer substância contida numa formulação ou adicionada ao tanque que modifica a atividade herbicida
ADJUVANTES DEFINIÇÕES INGREDIENTE ATIVO é o composto responsável pela eficácia biológica. ADJUVANTES - é qualquer substância contida numa formulação ou adicionada ao tanque que modifica a atividade herbicida
Figura 1: Forças de atração atuando sobre as moléculas da interface água / ar e no interior do líquido.
 Tensão Superficial 1. Introdução A tensão superficial surge nos líquidos como resultado do desequilíbrio entre as forças intermoleculares (atração de van der Waals) que agem sobre as moléculas da superfície
Tensão Superficial 1. Introdução A tensão superficial surge nos líquidos como resultado do desequilíbrio entre as forças intermoleculares (atração de van der Waals) que agem sobre as moléculas da superfície
A missão do agente tensioativo
 A missão do agente tensioativo Uma aventura no Laboratório Professoras orientadoras: Célia Faustino Isabel Ribeiro Catarina Vaz Teresa Rebelo O que é um tensioativo? São moléculas que têm a capacidade
A missão do agente tensioativo Uma aventura no Laboratório Professoras orientadoras: Célia Faustino Isabel Ribeiro Catarina Vaz Teresa Rebelo O que é um tensioativo? São moléculas que têm a capacidade
05/08/2016 SISTEMAS HETEROGÊNEOS - FORMA FARMACÊUTICA: EMULSÃO - Iônicas. Não iônicas. Óleo em água: O/A Água em óleo: A/O Múltiplas: A/O/A ou O/A/O
 SISTEMAS HETEROGÊNEOS - FORMA FARMACÊUTICA: EMULSÃO - EMULSÕES Definição: São dispersões de dois líquidos não miscíveis entre si, que com a ajuda de um agente emulsionante formam um sistema homogêneo.
SISTEMAS HETEROGÊNEOS - FORMA FARMACÊUTICA: EMULSÃO - EMULSÕES Definição: São dispersões de dois líquidos não miscíveis entre si, que com a ajuda de um agente emulsionante formam um sistema homogêneo.
Smart Drugs Teacher Guide. Determinação da concentração micelar crítica de um detergente, usando uma sonda fluorescente
 Determinação da concentração micelar crítica de um detergente, usando uma sonda fluorescente Índice 1. Sumário.. 4 2. Introdução...4 3. Material e Procedimento experimental... 5 4. Resultados e discussão
Determinação da concentração micelar crítica de um detergente, usando uma sonda fluorescente Índice 1. Sumário.. 4 2. Introdução...4 3. Material e Procedimento experimental... 5 4. Resultados e discussão
Atividade prática - Estudando a água Parte 9
 Atividade prática - Estudando a água Parte 9 9º ano do Ensino Fundamental e 1º ano do Ensino Médio Objetivo Diversos experimentos, usando principalmente água e materiais de fácil obtenção, são possíveis
Atividade prática - Estudando a água Parte 9 9º ano do Ensino Fundamental e 1º ano do Ensino Médio Objetivo Diversos experimentos, usando principalmente água e materiais de fácil obtenção, são possíveis
QFL Instruções para elaboração dos relatórios 2013
 GERAL QFL 2453 - Instruções para elaboração dos relatórios 2013 Todos os relatórios devem apresentar: 1) Capa contendo os nomes dos alunos, número USP, a turma da qual fazem parte, título e número da experiência,
GERAL QFL 2453 - Instruções para elaboração dos relatórios 2013 Todos os relatórios devem apresentar: 1) Capa contendo os nomes dos alunos, número USP, a turma da qual fazem parte, título e número da experiência,
INTERFACES SÓLIDO-LÍQUIDO E LÍQUIDO- LÍQUIDO
 1 INTERFACES SÓLIDO-LÍQUIDO E LÍQUIDO- LÍQUIDO INTERFACE SÓLIDO-LÍQUIDO: RECORDE O QUE É ADSORÇÃO.. Adsorção nº moles de adsorvato 2 g ou unidade de área (cm )de adsorvente Como avaliar? T n cm T, P 2
1 INTERFACES SÓLIDO-LÍQUIDO E LÍQUIDO- LÍQUIDO INTERFACE SÓLIDO-LÍQUIDO: RECORDE O QUE É ADSORÇÃO.. Adsorção nº moles de adsorvato 2 g ou unidade de área (cm )de adsorvente Como avaliar? T n cm T, P 2
Prof. Dra. Lisandra Ferreira de Lima PROPRIEDADES FÍSICAS PARTE II VISCOSIDADE; TENSÃO SUPERFICIAL E PRESSÃO DE VAPOR
 PROPRIEDADES FÍSICAS PARTE II VISCOSIDADE; TENSÃO SUPERFICIAL E PRESSÃO DE VAPOR SUBSTÂNCIA PURA Densidade - revisão Tensão superficial forças de adesão Tensão superficial As moléculas volumosas (no líquido)
PROPRIEDADES FÍSICAS PARTE II VISCOSIDADE; TENSÃO SUPERFICIAL E PRESSÃO DE VAPOR SUBSTÂNCIA PURA Densidade - revisão Tensão superficial forças de adesão Tensão superficial As moléculas volumosas (no líquido)
UNIVERSIDADE FEDERAL DO RIO GRANDE DO NORTE - UFRN CENTRO DE CIÊNCIAS EXATAS E DA TERRA - CCET PROGRAMA DE PÓS-GRADUAÇÃO EM QUÍMICA - PPGQ
 UNIVERSIDADE FEDERAL DO RIO GRANDE DO NORTE - UFRN CENTRO DE CIÊNCIAS EXATAS E DA TERRA - CCET PROGRAMA DE PÓS-GRADUAÇÃO EM QUÍMICA - PPGQ DISSERTAÇÃO DE MESTRADO CARACTERIZAÇÃO FÍSICO-QUÍMICA DE SISTEMAS
UNIVERSIDADE FEDERAL DO RIO GRANDE DO NORTE - UFRN CENTRO DE CIÊNCIAS EXATAS E DA TERRA - CCET PROGRAMA DE PÓS-GRADUAÇÃO EM QUÍMICA - PPGQ DISSERTAÇÃO DE MESTRADO CARACTERIZAÇÃO FÍSICO-QUÍMICA DE SISTEMAS
MINHA VISÃO DO CAP 6 - COLÓIDES MICELARES
 6 - COLÓIDES MICELARES Existem várias classificações de sistemas coloidais. A classificação dos sistemas coloidais quanto à estrutura da partícula, os separa em dois grupos: os moleculares e os micelares.
6 - COLÓIDES MICELARES Existem várias classificações de sistemas coloidais. A classificação dos sistemas coloidais quanto à estrutura da partícula, os separa em dois grupos: os moleculares e os micelares.
BCL 0307 Transformações Químicas
 BCL 0307 Transformações Químicas Prof. Dr. André Sarto Polo Bloco B S. 1014 ou L202 andre.polo@ufabc.edu.br Aula 02 Determinar a polaridade de cada ligação e da molécula como um todo CCl 4 HCCl 3 C 2 H
BCL 0307 Transformações Químicas Prof. Dr. André Sarto Polo Bloco B S. 1014 ou L202 andre.polo@ufabc.edu.br Aula 02 Determinar a polaridade de cada ligação e da molécula como um todo CCl 4 HCCl 3 C 2 H
TERMODINÂMICA DE MICELIZAÇÃO: DISTRIBUIÇÕES DE TAMANHO E TRANSIÇÃO ENTRE GEOMETRIAS
 TERMODINÂMICA DE MICELIZAÇÃO: DISTRIBUIÇÕES DE TAMANHO E TRANSIÇÃO ENTRE GEOMETRIAS M. S. SANTOS 1, F. W. TAVARES,1, e E. C. BISCAIA Jr 1 1 Universidade Federal do Rio de Janeiro, Instituto Alberto Luiz
TERMODINÂMICA DE MICELIZAÇÃO: DISTRIBUIÇÕES DE TAMANHO E TRANSIÇÃO ENTRE GEOMETRIAS M. S. SANTOS 1, F. W. TAVARES,1, e E. C. BISCAIA Jr 1 1 Universidade Federal do Rio de Janeiro, Instituto Alberto Luiz
Evaluación del efecto de los surfactantes en la tensión superficial en el proceso de flotación
 Evaluación del efecto de los surfactantes en la tensión superficial en el proceso de flotación Evaluation of surfactants effect on surface tension in the flotation process 196 Santos, A.L.A. 1 Tavares,
Evaluación del efecto de los surfactantes en la tensión superficial en el proceso de flotación Evaluation of surfactants effect on surface tension in the flotation process 196 Santos, A.L.A. 1 Tavares,
Forças Intermoleculares
 Forças Intermoleculares Você já se perguntou por que a água forma gotas ou como os insetos conseguem caminhar sobre a água? Gota d'água caindo sobre a superfície da água. Inseto pousado sobre a superfície
Forças Intermoleculares Você já se perguntou por que a água forma gotas ou como os insetos conseguem caminhar sobre a água? Gota d'água caindo sobre a superfície da água. Inseto pousado sobre a superfície
Soluções UNIVERSIDADE FEDERAL DO RIO DE JANEIRO UFRJ INSTITUTO DE QUÍMICA IQG127. Prof. Antonio Guerra
 UNIVERSIDADE FEDERAL DO RIO DE JANEIRO UFRJ INSTITUTO DE QUÍMICA IQG127 Prof. Antonio Guerra Soluções Departamento de Química Geral e Inorgânica - DQI Soluções Definição: Mistura Homogênea de duas ou mais
UNIVERSIDADE FEDERAL DO RIO DE JANEIRO UFRJ INSTITUTO DE QUÍMICA IQG127 Prof. Antonio Guerra Soluções Departamento de Química Geral e Inorgânica - DQI Soluções Definição: Mistura Homogênea de duas ou mais
Universidade do Estado de Santa Catarina UDESC - CCT Química Geral Profª Fabíola Corrêa viel
 Ligações químicas Universidade do Estado de Santa Catarina UDESC - CCT Química Geral Profª Fabíola Corrêa viel Ligações Químicas Sacarina Vitamina E Amônia Fulereno LIGAÇÕES IÔNICAS Acontece por atração
Ligações químicas Universidade do Estado de Santa Catarina UDESC - CCT Química Geral Profª Fabíola Corrêa viel Ligações Químicas Sacarina Vitamina E Amônia Fulereno LIGAÇÕES IÔNICAS Acontece por atração
O processo de dissolução
 SOLUBILIDADE Sabemos que um soluto altera as propriedades do solvente. Solução sólida: silício dopado com fósforo eletrônica. indústria Sal sobre o gelo abaixa o ponto e congelamento se a temperatura é
SOLUBILIDADE Sabemos que um soluto altera as propriedades do solvente. Solução sólida: silício dopado com fósforo eletrônica. indústria Sal sobre o gelo abaixa o ponto e congelamento se a temperatura é
SURFACTANTES. Prof. Harley P. Martins Filho. Sabões, detergentes, álcoois de cadeia longa e outras moléculas relacionadas são anfifílicas.
 SURFTNTES Prof. Harley P. Martins Filho Surfactantes Sabões, detergentes, álcoois de cadeia longa e outras moléculas relacionadas são anfifílicas. Estrutura básica: Grupo polar hidrófilo (SO 3-, OO -,
SURFTNTES Prof. Harley P. Martins Filho Surfactantes Sabões, detergentes, álcoois de cadeia longa e outras moléculas relacionadas são anfifílicas. Estrutura básica: Grupo polar hidrófilo (SO 3-, OO -,
AVALIAÇÃO DOS MÉTODOS DE MEDIÇÃO DA TENSÃO INTERFACIAL DO SISTEMA ÁGUA/HEPTOL
 AVALIAÇÃO DOS MÉTODOS DE MEDIÇÃO DA TENSÃO INTERFACIAL DO SISTEMA ÁGUA/HEPTOL Aluno: Pedro Henrique de Lima Ripper Moreira Orientador: Paulo Roberto de Souza Mendes Introdução Tensão superficial ou interfacial
AVALIAÇÃO DOS MÉTODOS DE MEDIÇÃO DA TENSÃO INTERFACIAL DO SISTEMA ÁGUA/HEPTOL Aluno: Pedro Henrique de Lima Ripper Moreira Orientador: Paulo Roberto de Souza Mendes Introdução Tensão superficial ou interfacial
Solução surfactante para substituição de solventes. Daniela Tristão Stepan Química
 Solução surfactante para substituição de solventes Daniela Tristão Stepan Química Agenda INTRODUÇÃO E OBJETIVO PARCERIA STEPAN / ELEVANCE STEPOSOL MET 10-U A primeira geração solvosurfactant Características
Solução surfactante para substituição de solventes Daniela Tristão Stepan Química Agenda INTRODUÇÃO E OBJETIVO PARCERIA STEPAN / ELEVANCE STEPOSOL MET 10-U A primeira geração solvosurfactant Características
FCAV/ UNESP. Assunto: Equilíbrio Químico e Auto-ionização da Água. Docente: Prof a. Dr a. Luciana M. Saran
 FCAV/ UNESP Assunto: Equilíbrio Químico e Auto-ionização da Água Docente: Prof a. Dr a. Luciana M. Saran 1 1. Introdução Existem dois tipos de reações: a) aquelas em que, após determinado tempo, pelo menos
FCAV/ UNESP Assunto: Equilíbrio Químico e Auto-ionização da Água Docente: Prof a. Dr a. Luciana M. Saran 1 1. Introdução Existem dois tipos de reações: a) aquelas em que, após determinado tempo, pelo menos
QB70C:// Química (Turmas S71/S72) Ligação Química
 QB70C:// Química (Turmas S71/S72) Ligação Química Prof. Dr. Eduard Westphal (http://paginapessoal.utfpr.edu.br/eduardw) Formação das Ligações O modelo RPECV, baseado principalmente nas estruturas de Lewis,
QB70C:// Química (Turmas S71/S72) Ligação Química Prof. Dr. Eduard Westphal (http://paginapessoal.utfpr.edu.br/eduardw) Formação das Ligações O modelo RPECV, baseado principalmente nas estruturas de Lewis,
Aula de Bioquímica I. Tema: Água. Prof. Dr. Júlio César Borges
 Aula de Bioquímica I Tema: Água Prof. Dr. Júlio César Borges Depto. de Química e Física Molecular DQFM Instituto de Química de São Carlos IQSC Universidade de São Paulo USP E-mail: borgesjc@iqsc.usp.br
Aula de Bioquímica I Tema: Água Prof. Dr. Júlio César Borges Depto. de Química e Física Molecular DQFM Instituto de Química de São Carlos IQSC Universidade de São Paulo USP E-mail: borgesjc@iqsc.usp.br
FCAV/ UNESP. Assunto: Equilíbrio Químico e Auto-ionização da Água. Docente: Prof a. Dr a. Luciana M. Saran
 FCAV/ UNESP Assunto: Equilíbrio Químico e Auto-ionização da Água Docente: Prof a. Dr a. Luciana M. Saran 1 1. Introdução Existem dois tipos de reações: a) aquelas em que, após determinado tempo, pelo menos
FCAV/ UNESP Assunto: Equilíbrio Químico e Auto-ionização da Água Docente: Prof a. Dr a. Luciana M. Saran 1 1. Introdução Existem dois tipos de reações: a) aquelas em que, após determinado tempo, pelo menos
OBTENÇÃO DE ESPUMAS ESTÁVEIS A PARTIR DE FORMULAÇÕES CONTENDO SURFACTANTES E NANOPARTÍCULAS INORGÂNICAS
 OBTENÇÃO DE ESPUMAS ESTÁVEIS A PARTIR DE FORMULAÇÕES CONTENDO SURFACTANTES E NANOPARTÍCULAS INORGÂNICAS Aluna: Beatriz Ribeiro Souza de Azevedo Orientadora: Aurora Pérez Gramatges Introdução As espumas
OBTENÇÃO DE ESPUMAS ESTÁVEIS A PARTIR DE FORMULAÇÕES CONTENDO SURFACTANTES E NANOPARTÍCULAS INORGÂNICAS Aluna: Beatriz Ribeiro Souza de Azevedo Orientadora: Aurora Pérez Gramatges Introdução As espumas
RESOLUÇÃO DE EXERCÍCIOS PROPOSTOS AULA 10 TURMA ANUAL
 RESOLUÇÃO DE EXERCÍCIOS PROPOSTOS AULA 10 TURMA ANUAL 01. Item B I Correto. A energia para quebrar a ligação H F (568 kj/mol) é a maior da tabela. Isto torna mais difícil a sua quebra, portanto ionizando
RESOLUÇÃO DE EXERCÍCIOS PROPOSTOS AULA 10 TURMA ANUAL 01. Item B I Correto. A energia para quebrar a ligação H F (568 kj/mol) é a maior da tabela. Isto torna mais difícil a sua quebra, portanto ionizando
Disciplina: Química A
 Disciplina: Química A EXTENSIVO E TERCEIRÃO PÁGINA: 6 EXERCÍCIO: 28.01 O álcool apresenta interações por ligações de hidrogênio, enquanto o hidrocarboneto interage por forças de dipolo induzido, dessa
Disciplina: Química A EXTENSIVO E TERCEIRÃO PÁGINA: 6 EXERCÍCIO: 28.01 O álcool apresenta interações por ligações de hidrogênio, enquanto o hidrocarboneto interage por forças de dipolo induzido, dessa
FLOCULAÇÃO E DISPERSÃO DAS ARGILAS
 1 FLOCULAÇÃO E DISPERSÃO DAS ARGILAS PROF. GILSON MOURA FILHO/SER/UFAL CURSO DE PÓSGRADUAÇÃO EM AGRONOMIA DISCIPLINA: FÍSICA DO SOLO 1. FORÇAS E ENERGIA NO SISTEMA SOLOÁGUA Forças de coesão e adesão Forças
1 FLOCULAÇÃO E DISPERSÃO DAS ARGILAS PROF. GILSON MOURA FILHO/SER/UFAL CURSO DE PÓSGRADUAÇÃO EM AGRONOMIA DISCIPLINA: FÍSICA DO SOLO 1. FORÇAS E ENERGIA NO SISTEMA SOLOÁGUA Forças de coesão e adesão Forças
COLÓIDES. Prof. Harley P. Martins filho SISTEMAS COLOIDAIS. Colóide: dispersão de pequenas partículas de um material em outro
 COLÓIDES Prof. Harley P. Martins filho SISTEMAS COLOIDAIS Colóide: dispersão de pequenas partículas de um material em outro Faixa de tamanho das partículas coloidais 10-9 a 10-6 m Classificação geral:
COLÓIDES Prof. Harley P. Martins filho SISTEMAS COLOIDAIS Colóide: dispersão de pequenas partículas de um material em outro Faixa de tamanho das partículas coloidais 10-9 a 10-6 m Classificação geral:
Físico-Química I. Profa. Dra. Carla Dalmolin. Misturas Simples. Termodinâmica das Misturas Propriedades das Soluções Atividade
 Físico-Química I Profa. Dra. Carla Dalmolin Misturas Simples Termodinâmica das Misturas Propriedades das Soluções Atividade Misturas Simples Misturas de substâncias que não reagem Modelo simples para posteriormente
Físico-Química I Profa. Dra. Carla Dalmolin Misturas Simples Termodinâmica das Misturas Propriedades das Soluções Atividade Misturas Simples Misturas de substâncias que não reagem Modelo simples para posteriormente
Monografia de Graduação
 Monografia de Graduação ESTUDO DO EFEITO DAS TENSÕES INTERFACIAIS EM SISTEMAS ÁGUA/TENSOATIVO/ÓLEOS PESADOS Antonia Beatriz Viana Oliveira Natal, fevereiro de 2010 5 Antonia Beatriz Viana Oliveira ESTUDO
Monografia de Graduação ESTUDO DO EFEITO DAS TENSÕES INTERFACIAIS EM SISTEMAS ÁGUA/TENSOATIVO/ÓLEOS PESADOS Antonia Beatriz Viana Oliveira Natal, fevereiro de 2010 5 Antonia Beatriz Viana Oliveira ESTUDO
INTERFACES : GÁS-LÍQUIDO E LÍQUIDO - LÍQUIDO
 INTERFACES : GÁS-LÍQUIDO E LÍQUIDO - LÍQUIDO INTERFACE LÍQUIDO-GÁS Líquidos permanecem coesos Membrana elástica Como explicar a existência de uma membrana elástica? INTERFACE LÍQUIDO-GÁS Nas interfaces
INTERFACES : GÁS-LÍQUIDO E LÍQUIDO - LÍQUIDO INTERFACE LÍQUIDO-GÁS Líquidos permanecem coesos Membrana elástica Como explicar a existência de uma membrana elástica? INTERFACE LÍQUIDO-GÁS Nas interfaces
Forças de van der Waals e Estabilidade Coloidal
 Pós-Graduação em Ciência de Materiais Faculdade UnB - Planaltina Forças de van der Waals e Estabilidade Coloidal Prof. Alex Fabiano C. Campos, Dr Balanço de Interações em Colóides Convencionais Balanço
Pós-Graduação em Ciência de Materiais Faculdade UnB - Planaltina Forças de van der Waals e Estabilidade Coloidal Prof. Alex Fabiano C. Campos, Dr Balanço de Interações em Colóides Convencionais Balanço
Eletroquímica. Métodos/Técnicas - Eletroquímicas. Físico-química III/DAQBI/UTFPR - João Batista Floriano. Técnicas Eletroquímicas
 Métodos/Técnicas - s Técnicas s Interface Eletrodo/ solução Solução Eletrolítica Dupla Camada Elétrica Métodos Estacionários (I = 0) Métodos Dinâmicos (I 0) Titração Potenciométrica Potenciometria Potencial
Métodos/Técnicas - s Técnicas s Interface Eletrodo/ solução Solução Eletrolítica Dupla Camada Elétrica Métodos Estacionários (I = 0) Métodos Dinâmicos (I 0) Titração Potenciométrica Potenciometria Potencial
O Ângulo de Contato e a Tensão Superficial - INTRO QMC5406.20081
 O Ângulo de Contato e a Tensão Superficial - INTRO QMC5406.008 ÂNGULO DE CONTATO Imagens de gotas de água na superfície dos filmes. Contact angle measurements on PTFE-modified with a radionuclides conjugate
O Ângulo de Contato e a Tensão Superficial - INTRO QMC5406.008 ÂNGULO DE CONTATO Imagens de gotas de água na superfície dos filmes. Contact angle measurements on PTFE-modified with a radionuclides conjugate
COLÓIDES. Colóide: partícula com uma dimensão linear entre 1nm e 1µm (1000 nm).
 COLÓIDES Colóide: partícula com uma dimensão linear entre 1nm e 1µm (1000 nm). Dispersão coloidal: Sistema heterogéneo de partículas coloidais (colóides) dispersas num fluido Dispersão coloidal (2 fases)
COLÓIDES Colóide: partícula com uma dimensão linear entre 1nm e 1µm (1000 nm). Dispersão coloidal: Sistema heterogéneo de partículas coloidais (colóides) dispersas num fluido Dispersão coloidal (2 fases)
!"#$%&'()*+,-'#&*'!-./0+-+*'11! '829':/;/*.0/<!
 !"#$%&'()*+,-'#&*'!-./0+-+*'11! 234562347'829':/;/*.0/+#-#/'?$00+,$%-0'@=A!1?B'C' (A:1?B'DE:'!BFCG1B1:'11! Programa! "#!$%&'(%&)*!+%!*,-%./01%!!23,43*!56!! 7%&*8)!*,-%.90134!! $).(3:8)!+%!(%&1*0)*!!
!"#$%&'()*+,-'#&*'!-./0+-+*'11! 234562347'829':/;/*.0/+#-#/'?$00+,$%-0'@=A!1?B'C' (A:1?B'DE:'!BFCG1B1:'11! Programa! "#!$%&'(%&)*!+%!*,-%./01%!!23,43*!56!! 7%&*8)!*,-%.90134!! $).(3:8)!+%!(%&1*0)*!!
Ângulos de Contato. Universidade de São Paulo Instituto de Química. Disciplina PAE QFL2453 Físico-Química Experimental. Experimento Proposto:
 Universidade de São Paulo Instituto de Química Disciplina PAE QFL2453 Físico-Química Experimental Experimento Proposto: Ângulos de Contato Aluna: Thais Lucy Ogeda NºUSP: 6750982 1 Introdução Já observou
Universidade de São Paulo Instituto de Química Disciplina PAE QFL2453 Físico-Química Experimental Experimento Proposto: Ângulos de Contato Aluna: Thais Lucy Ogeda NºUSP: 6750982 1 Introdução Já observou
2. Num capilar de vidro, a água sobe enquanto o mercúrio desce. Porquê? 3. O que entende por surfactante e por concentração micelar crítica?
 Perguntas e Problemas retirados de Testes anteriores Cap. 1 1. Esboce e explique o diagrama de energia potencial de uma molécula de O 2 em função da distância a uma superfície de tungsténio (W), sabendo
Perguntas e Problemas retirados de Testes anteriores Cap. 1 1. Esboce e explique o diagrama de energia potencial de uma molécula de O 2 em função da distância a uma superfície de tungsténio (W), sabendo
RESOLUÇÃO DE EXERCÍCIOS PROPOSTOS AULA 02 TURMA INTENSIVA
 RESOLUÇÃO DE EXERCÍCIOS PROPOSTOS AULA 02 TURMA INTENSIVA 01. Item B I Correto. A energia para quebrar a ligação H (568 kj/mol) é a maior da tabela. Isto torna mais difícil a sua quebra, portanto ionizando
RESOLUÇÃO DE EXERCÍCIOS PROPOSTOS AULA 02 TURMA INTENSIVA 01. Item B I Correto. A energia para quebrar a ligação H (568 kj/mol) é a maior da tabela. Isto torna mais difícil a sua quebra, portanto ionizando
ÓLEOS GELIFICADOS & TENSÕES SUPERFICIAIS E INTERFACIAIS DE FLUIDOS
 ÓLEOS GELIFICADOS & TENSÕES SUPERFICIAIS E INTERFACIAIS DE FLUIDOS Aluna: Viviam Cintra de Alencastro Guimarães Orientador: Paulo Roberto de Souza Mendes Introdução Um obstáculo enfrentado pela Indústria
ÓLEOS GELIFICADOS & TENSÕES SUPERFICIAIS E INTERFACIAIS DE FLUIDOS Aluna: Viviam Cintra de Alencastro Guimarães Orientador: Paulo Roberto de Souza Mendes Introdução Um obstáculo enfrentado pela Indústria
RESOLUÇÃO DE EXERCÍCIOS PROPOSTOS AULA 02 TURMA FMJ
 RESOLUÇÃO DE EXERCÍCIOS PROPOSTOS AULA 02 TURMA FMJ 03. Item C O equador da figura mostrada pode ser representado como abaixo. 01. Item B I Correto. A energia para quebrar a ligação H F (568 kj/mol) é
RESOLUÇÃO DE EXERCÍCIOS PROPOSTOS AULA 02 TURMA FMJ 03. Item C O equador da figura mostrada pode ser representado como abaixo. 01. Item B I Correto. A energia para quebrar a ligação H F (568 kj/mol) é
2ª SÉRIE roteiro 1 SOLUÇÕES
 2ª SÉRIE roteiro 1 SOLUÇÕES 1.1) Os íons Íons são elementos químicos que possuem carga elétrica resultante, positiva ou negativa. O íon positivo é denominado cátion (Na +1, Ca +2...). O íon negativo é
2ª SÉRIE roteiro 1 SOLUÇÕES 1.1) Os íons Íons são elementos químicos que possuem carga elétrica resultante, positiva ou negativa. O íon positivo é denominado cátion (Na +1, Ca +2...). O íon negativo é
TENSÃO INTERFACIAL DINÂMICA DE SOLUÇÕES CONTENDO ASFALTENOS DO PETRÓLEO E ÁLCOOIS
 TENSÃO INTERFACIAL DINÂMICA DE SOLUÇÕES CONTENDO ASFALTENOS DO PETRÓLEO E ÁLCOOIS L. S. MARTINS 1, R. G. SANTOS 1 1 Centro Universitário da FEI, Departamento de Engenharia Química E-mail para contato:
TENSÃO INTERFACIAL DINÂMICA DE SOLUÇÕES CONTENDO ASFALTENOS DO PETRÓLEO E ÁLCOOIS L. S. MARTINS 1, R. G. SANTOS 1 1 Centro Universitário da FEI, Departamento de Engenharia Química E-mail para contato:
Química Analítica I Tratamento dos dados analíticos Soluções analíticas
 Química Analítica I Tratamento dos dados analíticos Soluções analíticas Profª Simone Noremberg Kunz 2 Mol Medidas em química analítica É a quantidade de uma espécie química que contém 6,02x10 23 partículas
Química Analítica I Tratamento dos dados analíticos Soluções analíticas Profª Simone Noremberg Kunz 2 Mol Medidas em química analítica É a quantidade de uma espécie química que contém 6,02x10 23 partículas
INTERFACE SÓLIDO - LÍQUIDO
 INTERFACE SÓLIDO - LÍQUIDO ADSORÇÃO DE LÍQUIDOS EM SUPERFÍCIES SÓLIDAS Física Aplicada 2017/18 MICF FFUP 1 ADSORÇÃO DE LÍQUIDOS NA SUPERFÍCIE DE UM SÓLIDO Na interface sólido-líquido as moléculas têm tendência
INTERFACE SÓLIDO - LÍQUIDO ADSORÇÃO DE LÍQUIDOS EM SUPERFÍCIES SÓLIDAS Física Aplicada 2017/18 MICF FFUP 1 ADSORÇÃO DE LÍQUIDOS NA SUPERFÍCIE DE UM SÓLIDO Na interface sólido-líquido as moléculas têm tendência
Química Fascículo 02 Elisabeth Pontes Araújo Elizabeth Loureiro Zink José Ricardo Lemes de Almeida
 Química Fascículo 02 Elisabeth Pontes Araújo Elizabeth Loureiro Zink José Ricardo Lemes de Almeida Índice Ligação Covalente...1 Ligação Iônica...3 Teoria de Lewis...5 Ligações Intermoleculares...6 Exercícios...7
Química Fascículo 02 Elisabeth Pontes Araújo Elizabeth Loureiro Zink José Ricardo Lemes de Almeida Índice Ligação Covalente...1 Ligação Iônica...3 Teoria de Lewis...5 Ligações Intermoleculares...6 Exercícios...7
Por que água e óleo não se misturam?
 Por que água e óleo não se misturam? Por que água e óleo não se misturam? Água Molécula PLAR Óleo (hidrocarboneto) Molécula APLAR REGRA DE SLUBILIDADE Substância Polar dissolve Substância Polar. Substância
Por que água e óleo não se misturam? Por que água e óleo não se misturam? Água Molécula PLAR Óleo (hidrocarboneto) Molécula APLAR REGRA DE SLUBILIDADE Substância Polar dissolve Substância Polar. Substância
Estudo de superfícies de sólidos Maria da Conceição Paiva 1
 Estudo de superfícies de sólidos 18-12-2006 Maria da Conceição Paiva 1 Estudo de Superfícies de Sólidos - XPS Métodos de caracterização química e físico-química de superfícies: Espectroscopia fotoelectrónica
Estudo de superfícies de sólidos 18-12-2006 Maria da Conceição Paiva 1 Estudo de Superfícies de Sólidos - XPS Métodos de caracterização química e físico-química de superfícies: Espectroscopia fotoelectrónica
Introdução à Bioquímica
 Introdução à Bioquímica Água Dra. Fernanda Canduri Laboratório de Sistemas BioMoleculares. Departamento de Física. UNESP São José do Rio Preto. SP. A água é fundamental para os seres vivos, atua como solvente
Introdução à Bioquímica Água Dra. Fernanda Canduri Laboratório de Sistemas BioMoleculares. Departamento de Física. UNESP São José do Rio Preto. SP. A água é fundamental para os seres vivos, atua como solvente
PROPRIEDADES FÍSICAS DOS COMPOSTOS ORGÂNICOS
 PROPRIEDADES FÍSICAS DOS COMPOSTOS ORGÂNICOS As propriedades físicas dos compostos orgânicos podem ser interpretadas, e muitas vezes até previstas, a partir do conhecimento das ligações químicas que unem
PROPRIEDADES FÍSICAS DOS COMPOSTOS ORGÂNICOS As propriedades físicas dos compostos orgânicos podem ser interpretadas, e muitas vezes até previstas, a partir do conhecimento das ligações químicas que unem
Palavras Chave: inibidores de corrosão, adsorção, tensoativos, método galvanostático e microemulsão. 1. INTRODUÇÃO
 21-24 de Outubro de 27 3. 1. 36-3-1 INIBIÇÃO À CORROSÃO: COMPARAÇÃO ENTRE AS ISOTERMAS DE ADSORÇÃO DO DODECILBENZENO SULFONATO DE SÓDIO EM SOLUÇÃO E MICROEMULSIONADO EM INTERFACES AÇO-SOLUÇÃO E NITROGÊNIO-
21-24 de Outubro de 27 3. 1. 36-3-1 INIBIÇÃO À CORROSÃO: COMPARAÇÃO ENTRE AS ISOTERMAS DE ADSORÇÃO DO DODECILBENZENO SULFONATO DE SÓDIO EM SOLUÇÃO E MICROEMULSIONADO EM INTERFACES AÇO-SOLUÇÃO E NITROGÊNIO-
Tensão Superficial INTRODUÇÃO
 Tensão Superficial INTRODUÇÃO enômenos de superfície têm interesse multidisciplinar e são importantes tanto para a ísica quanto para a Química, a Biologia e as Engenharias. Além disso, há vários efeitos
Tensão Superficial INTRODUÇÃO enômenos de superfície têm interesse multidisciplinar e são importantes tanto para a ísica quanto para a Química, a Biologia e as Engenharias. Além disso, há vários efeitos
CQ110 : Princípios de FQ
 Fenômenos de Interface Devido às diferentes interações, as moléculas superficiais possuem uma maior energia, dessa forma, para deslocar uma molécula do interior do sistema para sua superfície, uma energia
Fenômenos de Interface Devido às diferentes interações, as moléculas superficiais possuem uma maior energia, dessa forma, para deslocar uma molécula do interior do sistema para sua superfície, uma energia
Dilatação dos sólidos e dos líquidos
 Dilatação dos sólidos e dos líquidos Dilatação dos sólidos e dos líquidos Dilatação dos sólidos e dos líquidos Dilatação dos sólidos e dos líquidos Dilatação dos sólidos e dos líquidos Dilatação dos sólidos
Dilatação dos sólidos e dos líquidos Dilatação dos sólidos e dos líquidos Dilatação dos sólidos e dos líquidos Dilatação dos sólidos e dos líquidos Dilatação dos sólidos e dos líquidos Dilatação dos sólidos
ESTABILIDADE DE ESPUMAS LÍQUIDAS DE SOLUÇÕES DE SURFACTANTES: EFEITO DE MISTURAS E ADIÇÃO DE NANOPARTÍCULAS
 54 ESTABILIDADE DE ESPUMAS LÍQUIDAS DE SOLUÇÕES DE SURFACTANTES: EFEITO DE MISTURAS E ADIÇÃO DE NANOPARTÍCULAS STABILITY OF LIQUID FOAMS FROM SURFACTANT SOLUTIONS: EFFECT OF MIXTURES AND ADDITION OF NANOPARTICLES
54 ESTABILIDADE DE ESPUMAS LÍQUIDAS DE SOLUÇÕES DE SURFACTANTES: EFEITO DE MISTURAS E ADIÇÃO DE NANOPARTÍCULAS STABILITY OF LIQUID FOAMS FROM SURFACTANT SOLUTIONS: EFFECT OF MIXTURES AND ADDITION OF NANOPARTICLES
Ligações Interatômicas: IÔNICA = metal + não-metal COVALENTE = não-metais METÁLICA = metais
 Ligações Químicas Ligações Interatômicas: IÔNICA = metal + não-metal COVALENTE = não-metais METÁLICA = metais Ligação iônica Transferência de elétrons de um átomo para outro Íons de cargas opostas Forças
Ligações Químicas Ligações Interatômicas: IÔNICA = metal + não-metal COVALENTE = não-metais METÁLICA = metais Ligação iônica Transferência de elétrons de um átomo para outro Íons de cargas opostas Forças
FORMAÇÃO DE ESPUMAS EM SOLUÇÕES MICELARES: EFEITOS DE MISTURAS DE SURFACTANTES IÔNICOS E SAIS INORGÂNICOS
 FORMAÇÃO DE ESPUMAS EM SOLUÇÕES MICELARES: EFEITOS DE MISTURAS DE SURFACTANTES IÔNICOS E SAIS INORGÂNICOS Aluna: Beatriz Ribeiro Souza de Azevedo (IC) Orientadora: Aurora PérezGramatges (PQ) Introdução
FORMAÇÃO DE ESPUMAS EM SOLUÇÕES MICELARES: EFEITOS DE MISTURAS DE SURFACTANTES IÔNICOS E SAIS INORGÂNICOS Aluna: Beatriz Ribeiro Souza de Azevedo (IC) Orientadora: Aurora PérezGramatges (PQ) Introdução
PROPRIEDADES FÍSICAS DOS COMPOSTOS ORGÂNICOS
 PROPRIEDADES FÍSICAS DOS COMPOSTOS ORGÂNICOS As propriedades físicas dos compostos orgânicos podem ser interpretadas, e muitas vezes até previstas, a partir do conhecimento das ligações químicas que unem
PROPRIEDADES FÍSICAS DOS COMPOSTOS ORGÂNICOS As propriedades físicas dos compostos orgânicos podem ser interpretadas, e muitas vezes até previstas, a partir do conhecimento das ligações químicas que unem
1. Algumas Propriedades dos Líquidos
 1. Algumas Propriedades dos Líquidos 1.1 Viscosidade Alguns líquidos, como o melaço e o óleo de motor, fluem lentamente; enquanto que outros, como a água e a gasolina, fluem rapidamente. A resistência
1. Algumas Propriedades dos Líquidos 1.1 Viscosidade Alguns líquidos, como o melaço e o óleo de motor, fluem lentamente; enquanto que outros, como a água e a gasolina, fluem rapidamente. A resistência
MANUAL DO USUÁRIO. Para começar sua interação clique no botão azul central.
 Tela inicial Para começar sua interação clique no botão azul central. Figura 1. Tela inicial Menu Após optar pelo início da interação com o OA (Figura 1) será exibida a tela com a representação das espécies
Tela inicial Para começar sua interação clique no botão azul central. Figura 1. Tela inicial Menu Após optar pelo início da interação com o OA (Figura 1) será exibida a tela com a representação das espécies
CQ110 : Princípios de FQ
 CQ 110 Princípios de Físico Química Curso: Farmácia 1º semestre de 2011 Quartas / Quintas: 9:30 11:30 Prof. Dr. Marcio Vidotti www.quimica.ufpr.br/mvidotti mvidotti@ufpr.br criação de modelos CQ110 : Princípios
CQ 110 Princípios de Físico Química Curso: Farmácia 1º semestre de 2011 Quartas / Quintas: 9:30 11:30 Prof. Dr. Marcio Vidotti www.quimica.ufpr.br/mvidotti mvidotti@ufpr.br criação de modelos CQ110 : Princípios
Lista mensal de documentos normativos editados
 Lista mensal de documentos normativos editados Data de edição: 2018-12-28 NP 160:1983 (reimpressão) Definição e classificação 4 IPQ NP 161:1983 (reimpressão) comuns Barras e blocos Tipos e características
Lista mensal de documentos normativos editados Data de edição: 2018-12-28 NP 160:1983 (reimpressão) Definição e classificação 4 IPQ NP 161:1983 (reimpressão) comuns Barras e blocos Tipos e características
EXPERIMENTO A TEMA: MEDIDA DE CMC POR MEDIDAS DE CONDUTIVIDADE E EFEITOS DA FORÇA IÔNICA.
 1 EXPERIMENTO A TEMA: MEDIDA DE CMC POR MEDIDAS DE CONDUTIVIDADE E EFEITOS DA FORÇA IÔNICA. APÓS O EXPERIMENTO, OS MATERIAIS UTILIZADOS DEVEM ESTAR LIMPOS!!!!! Materiais Agitador magnético (com aquecimento)
1 EXPERIMENTO A TEMA: MEDIDA DE CMC POR MEDIDAS DE CONDUTIVIDADE E EFEITOS DA FORÇA IÔNICA. APÓS O EXPERIMENTO, OS MATERIAIS UTILIZADOS DEVEM ESTAR LIMPOS!!!!! Materiais Agitador magnético (com aquecimento)
QUI219 QUÍMICA ANALÍTICA (Farmácia) Prof. Mauricio X. Coutrim
 QUI219 QUÍMICA ANALÍTICA (Farmácia) Prof. Mauricio X. Coutrim (mcoutrim@iceb.ufop.br) SOLUÇÕES AQUOSAS Equilíbrios químicos A água e os eletrólitos (solutos que forma íons quando dissolvidos em água):
QUI219 QUÍMICA ANALÍTICA (Farmácia) Prof. Mauricio X. Coutrim (mcoutrim@iceb.ufop.br) SOLUÇÕES AQUOSAS Equilíbrios químicos A água e os eletrólitos (solutos que forma íons quando dissolvidos em água):
FORÇAS INTERMOLECULARES
 FORÇAS INTERMOLECULARES O O Forças Intermoleculares Forças intermoleculares são as forças que ocorrem entre uma molécula e a molécula vizinha. A existência de substâncias nos estados gasoso, líquido e
FORÇAS INTERMOLECULARES O O Forças Intermoleculares Forças intermoleculares são as forças que ocorrem entre uma molécula e a molécula vizinha. A existência de substâncias nos estados gasoso, líquido e
DISSERTAÇÃO DE MESTRADO ESTUDO DA FORMAÇÃO DE MICELAS REVERSAS EM SISTEMAS DE TENSOATIVOS NÃO IÔNICOS/SOLVENTES ORGÂNICOS
 UNIVERSIDADE FEDERAL DO RIO GRANDE DO NORTE CENTRO DE TECNOLOGIA DEPARTAMENTO DE ENGENHARIA QUÍMICA PROGRAMA DE PÓS-GRADUAÇÃO EM ENGENHARIA QUÍMICA DISSERTAÇÃO DE MESTRADO ESTUDO DA FORMAÇÃO DE MICELAS
UNIVERSIDADE FEDERAL DO RIO GRANDE DO NORTE CENTRO DE TECNOLOGIA DEPARTAMENTO DE ENGENHARIA QUÍMICA PROGRAMA DE PÓS-GRADUAÇÃO EM ENGENHARIA QUÍMICA DISSERTAÇÃO DE MESTRADO ESTUDO DA FORMAÇÃO DE MICELAS
RESOLUÇÃO DE EXERCÍCIOS PROPOSTOS AULA 13 TURMA INTENSIVA
 RESOLUÇÃO DE EXERCÍCIOS PROPOSTOS AULA 13 TURMA INTENSIVA 01. Item B I Correto. A energia para quebrar a ligação H F (568 kj/mol) é a maior da tabela. Isto torna mais difícil a sua quebra, portanto ionizando
RESOLUÇÃO DE EXERCÍCIOS PROPOSTOS AULA 13 TURMA INTENSIVA 01. Item B I Correto. A energia para quebrar a ligação H F (568 kj/mol) é a maior da tabela. Isto torna mais difícil a sua quebra, portanto ionizando
Bioquímica PROFESSOR GILDÃO
 Gildão e WBio Bioquímica PROFESSOR GILDÃO Dica 1: Ácidos graxos 1) Saturado: gordura; IUPAC: C10 : 0 2) Insaturado: óleo; IUPAC: C18 : 3-9,12,15 Ômega: ω 3 Ponto de Fusão: gordura > óleo Questão 01 Os
Gildão e WBio Bioquímica PROFESSOR GILDÃO Dica 1: Ácidos graxos 1) Saturado: gordura; IUPAC: C10 : 0 2) Insaturado: óleo; IUPAC: C18 : 3-9,12,15 Ômega: ω 3 Ponto de Fusão: gordura > óleo Questão 01 Os
Ligações Interatômicas: IÔNICA = metal + não-metal COVALENTE = não-metais METÁLICA = metais
 Ligações Químicas Ligações Interatômicas: IÔNICA = metal + não-metal COVALENTE = não-metais METÁLICA = metais Ligação iônica Transferência de elétrons de um átomo para outro Íons de cargas opostas Forças
Ligações Químicas Ligações Interatômicas: IÔNICA = metal + não-metal COVALENTE = não-metais METÁLICA = metais Ligação iônica Transferência de elétrons de um átomo para outro Íons de cargas opostas Forças
SOLUÇÃO PRATIQUE EM CASA - QUÍMICA
 SOLUÇÃO PC. Percebe-se pela geometria apresentada, que: 3 2 () A hibridização de é sp d. 2 2 6 2 6 2 0 6 2 0 6 Xe (Z 54) : s 2s 2p 3s 3p 4s 3d 4p 5s 4d 5p Xe (camada de valência): SOLUÇÃO PRATIQUE EM CASA
SOLUÇÃO PC. Percebe-se pela geometria apresentada, que: 3 2 () A hibridização de é sp d. 2 2 6 2 6 2 0 6 2 0 6 Xe (Z 54) : s 2s 2p 3s 3p 4s 3d 4p 5s 4d 5p Xe (camada de valência): SOLUÇÃO PRATIQUE EM CASA
1 Introdução. 1.1 Fluorquinolonas
 1 Introdução As fluorquinolonas são uma classe relativamente recente de antibióticos sintéticos com um alto potencial bactericida e com um amplo espectro de atuação contra conhecidos patógenos. São amplamente
1 Introdução As fluorquinolonas são uma classe relativamente recente de antibióticos sintéticos com um alto potencial bactericida e com um amplo espectro de atuação contra conhecidos patógenos. São amplamente
UNIVERSIDADE FEDERAL DE SANTA CATARINA - UFSC PROGRAMA DE PÓS-GRADUAÇÃO EM QUÍMICA
 UNIVERSIDADE FEDERAL DE SANTA CATARINA - UFSC PROGRAMA DE PÓS-GRADUAÇÃO EM QUÍMICA AUTO-ASSOCIAÇÃO DO COLATO DE SÓDIO (NaC) EM MISTURAS COM O SURFACTANTE ANIÔNICO DODECIL SULFATO DE SÓDIO (SDS) E O POLÍMERO
UNIVERSIDADE FEDERAL DE SANTA CATARINA - UFSC PROGRAMA DE PÓS-GRADUAÇÃO EM QUÍMICA AUTO-ASSOCIAÇÃO DO COLATO DE SÓDIO (NaC) EM MISTURAS COM O SURFACTANTE ANIÔNICO DODECIL SULFATO DE SÓDIO (SDS) E O POLÍMERO
ESTUDO REOLÓGICO DE MICROEMULSÕES UTILIZADAS PARA RECUPERAÇÃO DE PETRÓLEO
 STUDO ROLÓGICO D MICROMULSÕS UTILIZADAS PARA RCUPRAÇÃO D PTRÓLO. A. ARAÚJO 1, F. D. S. CURBLO 1, A. I. C. GARNICA 1 1 Universidade Federal da Paraíba, Centro de Tecnologia, Departamento de ngenharia Química
STUDO ROLÓGICO D MICROMULSÕS UTILIZADAS PARA RCUPRAÇÃO D PTRÓLO. A. ARAÚJO 1, F. D. S. CURBLO 1, A. I. C. GARNICA 1 1 Universidade Federal da Paraíba, Centro de Tecnologia, Departamento de ngenharia Química
ESTABILIDADE DE ESPUMAS LÍQUIDAS EM MISTURAS DE SURFACTANTES: EFEITO DE NANOPARTÍCULAS E SAIS INORGÂNICOS
 ESTABILIDADE DE ESPUMAS LÍQUIDAS EM MISTURAS DE SURFACTANTES: EFEITO DE NANOPARTÍCULAS E SAIS INORGÂNICOS Aluna: Beatriz Ribeiro Souza de Azevedo Orientadora: Aurora Pérez Gramatges Introdução O estudo
ESTABILIDADE DE ESPUMAS LÍQUIDAS EM MISTURAS DE SURFACTANTES: EFEITO DE NANOPARTÍCULAS E SAIS INORGÂNICOS Aluna: Beatriz Ribeiro Souza de Azevedo Orientadora: Aurora Pérez Gramatges Introdução O estudo
Gabarito Química Volume 1
 Gabarito Química Volume 1 Química 1 Capítulo 1 01. D 05. A 06. C 07. A 08. C 09. E 10. C 11. E 12. D 13. D 14. C 15. D 16. A 17. A 19. A 21. B 23. C 24. D 25. B 26. D 27. A 28. C 29. D 30. E 31. C 33.
Gabarito Química Volume 1 Química 1 Capítulo 1 01. D 05. A 06. C 07. A 08. C 09. E 10. C 11. E 12. D 13. D 14. C 15. D 16. A 17. A 19. A 21. B 23. C 24. D 25. B 26. D 27. A 28. C 29. D 30. E 31. C 33.
Capacitores. - 3) A experiência mostra que a carga acumulada é diretamente proporcional a diferença de potencial aplicada nas placas, ou seja
 Capacitores - 1) Capacitores são dispositivos utilizados para armazenar cargas elétricas. Como a energia potencial é proporcional ao número de cargas elétricas, estes dispositivos também são reservatórios
Capacitores - 1) Capacitores são dispositivos utilizados para armazenar cargas elétricas. Como a energia potencial é proporcional ao número de cargas elétricas, estes dispositivos também são reservatórios
INFLUÊNCIA DA CONCENTRAÇÃO DE SAL NA ADSORÇÃO DE TENSOATIVOS IÔNICOS EM ARENITOS
 INFLUÊNCIA DA CONCENTRAÇÃO DE SAL NA ADSORÇÃO DE TENSOATIVOS IÔNICOS EM ARENITOS F. D. S. CURBELO 1, A. I. C. GARNICA 1, G. Z. CLERICUZI 1, R. S. CARDOSO 1, J. C. O. FREITAS 2 e D. M. A. MELO 2 1 Universidade
INFLUÊNCIA DA CONCENTRAÇÃO DE SAL NA ADSORÇÃO DE TENSOATIVOS IÔNICOS EM ARENITOS F. D. S. CURBELO 1, A. I. C. GARNICA 1, G. Z. CLERICUZI 1, R. S. CARDOSO 1, J. C. O. FREITAS 2 e D. M. A. MELO 2 1 Universidade
Perguntas e Problemas retirados de Testes anteriores
 Perguntas e Problemas retirados de Testes anteriores 1. Esboce e explique o diagrama de energia potencial de uma molécula de O2 em função da distância a uma superfície de tungsténio (W), sabendo que ocorre
Perguntas e Problemas retirados de Testes anteriores 1. Esboce e explique o diagrama de energia potencial de uma molécula de O2 em função da distância a uma superfície de tungsténio (W), sabendo que ocorre
06) Considere a aparelhagem desenhada a seguir, empregada para testes de condutividade elétrica. O teste deu positivo com qual dos líquidos?
 TEORIA DE ARRHENIUS 01) (Puc-SP) Dados os compostos A: CH 3 COONa (Sal: acetato de sódio) B: CH 3 COOH (ácido acético) C: CH 3 CH 2 OH (álcool etílico) D: C 6 H 12 O 6 (glicose) Pede-se: a) Quais os que
TEORIA DE ARRHENIUS 01) (Puc-SP) Dados os compostos A: CH 3 COONa (Sal: acetato de sódio) B: CH 3 COOH (ácido acético) C: CH 3 CH 2 OH (álcool etílico) D: C 6 H 12 O 6 (glicose) Pede-se: a) Quais os que
LIPOFILIA LIPOFILIA COEFICIENTE DE PARTIÇÃO.
 LIPOFILIA A lipofilia de um composto é comumente estimada usando Log P a partir da partição de um sistema octanol/água aandrico@ifsc.usp.br A lipofilia é uma das propriedades mais importantes relacionadas
LIPOFILIA A lipofilia de um composto é comumente estimada usando Log P a partir da partição de um sistema octanol/água aandrico@ifsc.usp.br A lipofilia é uma das propriedades mais importantes relacionadas
UFSC. Resposta: = 40. Comentário
 Resposta: 08 + 32 = 40 01. Incorreta. O butano não possui isomeria óptica, pois não possui carbono assimétrico. 02. Incorreta. Ao serem liberados para a atmosfera os gases sofrem expansão de volume. 04.
Resposta: 08 + 32 = 40 01. Incorreta. O butano não possui isomeria óptica, pois não possui carbono assimétrico. 02. Incorreta. Ao serem liberados para a atmosfera os gases sofrem expansão de volume. 04.
QUÍMICA. Interações Atômicas: Geometria Molecular, Polaridade da Ligação e da Molécula, Forças Intermoleculares e Número de Oxidação Parte 2
 QUÍMICA Interações Atômicas: Geometria Molecular, Polaridade da Ligação e da Molécula, Forças Intermoleculares e Número de Oxidação Parte 2 Prof a. Giselle Blois Forças ou Ligações Intermoleculares Em
QUÍMICA Interações Atômicas: Geometria Molecular, Polaridade da Ligação e da Molécula, Forças Intermoleculares e Número de Oxidação Parte 2 Prof a. Giselle Blois Forças ou Ligações Intermoleculares Em
Processos Superficiais Adsorção
 Adsorção em Sólidos - quando se mistura um sólido finamente dividido em uma solução diluída de corante, observamos que a intensidade da coloração decresce pronunciadamente; - se é sólido e gás a pressão
Adsorção em Sólidos - quando se mistura um sólido finamente dividido em uma solução diluída de corante, observamos que a intensidade da coloração decresce pronunciadamente; - se é sólido e gás a pressão
Ligação química. 10º ano. [Imagem:
 [Imagem: www.antidopingresearch.org] Ligação química A ligação química é o que permite que: Átomos se liguem a outros átomos, em moléculas; em agregados de átomos; Iões se liguem a outros iões; Moléculas
[Imagem: www.antidopingresearch.org] Ligação química A ligação química é o que permite que: Átomos se liguem a outros átomos, em moléculas; em agregados de átomos; Iões se liguem a outros iões; Moléculas
Ligações Químicas. Profª. Ms. Loraine Cristina do Valle Jacobs DAQBI.
 Ligações Químicas Profª. Ms. Loraine Cristina do Valle Jacobs lorainejacobs@utfpr.edu.br http://paginapessoal.utfpr.edu.br/lorainejacobs DAQBI Propriedades das Ligações Químicas TEORIA DA REPULSÃO DOS
Ligações Químicas Profª. Ms. Loraine Cristina do Valle Jacobs lorainejacobs@utfpr.edu.br http://paginapessoal.utfpr.edu.br/lorainejacobs DAQBI Propriedades das Ligações Químicas TEORIA DA REPULSÃO DOS
Parte 1. Diagrama de fases ternário
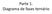 Parte 1. Diagrama de fases ternário Três componentes : água, citrato e poli(etileno glicol) 400 g/mol Observar passagem de sistema homogêneo para turvo cloud-point ou ponto de névoa em função da variação
Parte 1. Diagrama de fases ternário Três componentes : água, citrato e poli(etileno glicol) 400 g/mol Observar passagem de sistema homogêneo para turvo cloud-point ou ponto de névoa em função da variação
QUÍMICA PRIMEIRA ETAPA
 QUÍMICA PRIMEIRA ETAPA - 1999 QUESTÃO 46 Um limão foi espremido num copo contendo água e as sementes ficaram no fundo do recipiente. A seguir, foi adicionado ao sistema um pouco de açúcar, que se dissolveu
QUÍMICA PRIMEIRA ETAPA - 1999 QUESTÃO 46 Um limão foi espremido num copo contendo água e as sementes ficaram no fundo do recipiente. A seguir, foi adicionado ao sistema um pouco de açúcar, que se dissolveu
1) Definir flotação, evidenciando as principais etapas envolvidas no processo.
 1 a Lista de exercícios Processamento Mineral II 1) Definir flotação, evidenciando as principais etapas envolvidas no processo. 2) O que são forças intermoleculares? Como são classificadas? 3) Definir:
1 a Lista de exercícios Processamento Mineral II 1) Definir flotação, evidenciando as principais etapas envolvidas no processo. 2) O que são forças intermoleculares? Como são classificadas? 3) Definir:
FCAV/UNESP. ASSUNTO: Forças Intermoleculares. Prof a. Dr a. Luciana Maria Saran
 FCAV/UNESP ASSUNTO: Forças Intermoleculares Prof a. Dr a. Luciana Maria Saran 1 2 FLUXOGRAMA PARA RECONHECER OS PRINCIPAIS TIPOS DE FORÇAS INTERMOLECULARES 3 ENERGIA TÍPICA REQUERIDA PARA O ROMPIMENTO
FCAV/UNESP ASSUNTO: Forças Intermoleculares Prof a. Dr a. Luciana Maria Saran 1 2 FLUXOGRAMA PARA RECONHECER OS PRINCIPAIS TIPOS DE FORÇAS INTERMOLECULARES 3 ENERGIA TÍPICA REQUERIDA PARA O ROMPIMENTO
Dispersões. União de duas ou mais espécies químicas de tal forma que uma se distribui no interior da outra. Água salgada Gelatina Água barrenta
 Dispersões União de duas ou mais espécies químicas de tal forma que uma se distribui no interior da outra Água salgada Gelatina Água barrenta Existem 2 fases distintas: disperso e dispersante. Tipo de
Dispersões União de duas ou mais espécies químicas de tal forma que uma se distribui no interior da outra Água salgada Gelatina Água barrenta Existem 2 fases distintas: disperso e dispersante. Tipo de
Cinética Química. Prof. Alex Fabiano C. Campos
 Cinética Química Prof. Alex Fabiano C. Campos Rapidez Média das Reações A cinética é o estudo da rapidez com a qual as reações químicas ocorrem. A rapidez de uma reação pode ser determinada pela variação
Cinética Química Prof. Alex Fabiano C. Campos Rapidez Média das Reações A cinética é o estudo da rapidez com a qual as reações químicas ocorrem. A rapidez de uma reação pode ser determinada pela variação
Biocatálise em Fase orgânica
 Biocatálise em Fase orgânica O porque? Conceito de biocatálise associado uso de biocatalisadores, nas quais a água é o solvente preponderante.(meio convencional). Uso exclusivo de água como solvente restringe
Biocatálise em Fase orgânica O porque? Conceito de biocatálise associado uso de biocatalisadores, nas quais a água é o solvente preponderante.(meio convencional). Uso exclusivo de água como solvente restringe
Aula 6. Forças Intermoleculares
 ACH5521 - Química Geral Aula 6. Forças Intermoleculares Profa Káthia M. Honório (kmhonorio@usp.br) Quais são as forças envolvidas em cada caso? Questões Por que a água é encontrada na forma líquida e não
ACH5521 - Química Geral Aula 6. Forças Intermoleculares Profa Káthia M. Honório (kmhonorio@usp.br) Quais são as forças envolvidas em cada caso? Questões Por que a água é encontrada na forma líquida e não
