DEFICIÊNCIA DO COMPLEXO PIRUVATO DESIDROGENASE
|
|
|
- Osvaldo Baltazar Azenha Peres
- 5 Há anos
- Visualizações:
Transcrição
1 DEFICIÊNCIA DO COMPLEXO PIRUVATO DESIDROGENASE Uma criança do sexo masculino, nascida a termo, não estava ganhando peso, tinha episódios de vômitos e apresentou acidose metabólica no período neonatal. Ao exame físico aos 8 meses mostrou uma deficiência no desenvolvimento, hipotonia, pequena massa muscular, severo retardo no desenvolvimento mental e uma acidose persistente (ph do sangue 7,00 a 7,20; normal: 7,35-7,45). As concentrações de lactato (9mM; normal: 0,5-2,2mM), piruvato (2,4mM; normal: 0,03-0,08mM) e alanina (1,36mM; normal: 0,39-0,47mM) no sangue estavam muito aumentadas. Como essas alterações sugerem um defeito genético no metabolismo do piruvato, amostras de sangue e biopsias da pele (fibroblastos), foram enviadas para um laboratório de diagnóstico de doenças mitocondriais de origem genética. Os testes de atividades das enzimas da cadeia respiratória apresentaram valores normais, entretanto os resultados da avaliação da atividade enzimática do complexo piruvato desidrogenase, mostraram uma redução significativa na atividade do complexo piruvato desidrogenase tanto nos linfócitos obtidos do sangue periférico, como também na cultura de fibroblastos. Além disso, a medida da atividade individual das enzimas do complexo sugere uma deficiência na subunidade da primeira enzima do complexo (E1, piruvato descarboxilase). Os resultados estão sumarizados na tabela abaixo. Atividade residual do complexo piruvato desidrogenase em linfocitos sanguineos e cultura de fibroblastos da pele Componente Enzimático Atividade Residual (% do normal) Linfócitos Fibroblastos PHD (atividade total) 55% 28% E1 (piruvato descarboxilase) 34% 10% E2 (dihidrolipoil transacetilase) Normal Normal E3 (dihidrolipoil desidrogenase) Normal Normal
2 QUESTÕES 1. Por que as concentrações de piruvato, lactato e alanina estavam anormalmente altas? 2. Neste paciente, como estariam os destinos alternativos do piruvato? E a via gliconeogênica? 3. Quais são as coenzimas do complexo PDH 4. Baseando-se na figura 3, como estaria o controle do complexo PDH durante uma refeição e no jejum? 5. O que é dieta cetogência. O que se espera desta dieta neste paciente? REFERÊNCIAS 1. Fuerhlein, B.S. et al. (2004) Differential metabolic effects of saturated versus polyunsaturated fats in ketogenic diets. J. Clin. Endocrinol. Metabo. 89: Holness, M.J.; Sugden, M.C. (2003) Regulation of pyruvate dehydrogenase complex activity by reversible phosphorilation. Biochem. Soc. Trans. 31: Zhou, Z.H. et al. (2001) The remarkable structural and functional organization of the eukaryotic pyruvate dehydrogenase complexes. Proc. Natl. Acad. Sci. USA 98: De Meirleir, L. et al. (1993) Pyruvate dehydrogenase deficiency: clinical and biochemical diagnosis. Ped. Neurol. 9: Jackson, D.W.; Hays, W.S. (1997) Pyruvate dehydrogenase complex deficiency. Em Glew, R.H.; Ninomiya, Y. (eds) Clinical studies in Medical Biochemistry. Oxford 6. Stacpoole, P.W.; Gilbert, L.R. (2007) Pyruvate dehydrogenase complex deficiency Em Glew, R.H.; Rosenthal, M.D. (Eds.) Clinical studies in Medical Biochemistry. Oxford. Third Edition. 7. Champe, P.C. (2006) Bioquímica Ilustrada. 3a. edição. ArtMed. 8. Campbell, M. (2000) Bioquímica. 3ª. Edição. ArtMed Fundamentação Bioquímica Para entender as conseqüências neurológicas e metabólicas da deficiência do complexo piruvato desidrogenase, é necessário analisar: 1. O metabolismo do piruvato
3 2. O papel do complexo piruvato desidrogenase no metabolismo dos carboidratos, lipídeos e aminoácidos (fig.1) 3. A dependência do sistema nervoso central da glicose e produção aeróbica de energia O complexo piruvato desidrogenase (PDH) é um complexo multienzimático localizado na membrana interna da mitocôndria. O piruvato originado da glícolise é convertido em acetil-coenzimaa (CoA) na mitocôndria via o complexo piruvato desidrogenase (PDH) como mostra a figura 1. Em geral, este passo ocorre quando os níveis intracelulares de acetil-coa, ATP e NADH estão baixos. O acetil-coa produzido pelo complexo piruvato desidrogenase alimenta o ciclo de Krebs e as moléculas reduzidas na forma de NADH e FADH2, geradas pelas reações catalisadas pelo complexo PDH e por várias desidrogenases no ciclo de Krebs, fornecem elétrons para a cadeia respiratória com a redução do oxigênio molecular na forma de água e síntese de ATP (Fig. 1). O piruvato originado do esqueleto de carbonos dos aminoácidos é carboxilado pela enzima mitocondrial piruvato carboxilase produzindo oxaloacetato (fig. 1). Este é o primeiro passo na gliconeogenese o qual ocorre exclusivamente no fígado e nos rins. A deficiência na atividade enzimática do complexo piruvato desidrogenase (PDH), limita a quantidade de acetil-coa disponível para entrar no ciclo de Krebs, com isto, reduz a quantidade de NADH e FADH2 e conseqüentemente reduz a quantidade de ATP gerado na cadeia transportadora de elétrons, dependente da fosforilação oxidativa. Enquanto o cérebro tem uma demanda constante de ATP oriundo da glicolise e do complexo piruvato desidrogenase, os tecidos periféricos na ausência de glicose podem usar uma variedade de substratos como combustível para o ciclo de Krebs (por ex. ácidos graxos). Esta dependência do cérebro pela glicose é a base para as alterações do sistema nervoso central na deficiência do complexo piruvato desidrogenase. O complexo piruvato desidrogenase apresenta um peso molecular de 8,5x10 6 Dalton e apresenta 3 atividades enzimáticas. A piruvato desidrogenase também conhecida como piruvato descarboxilase (E1), a diidrolipoil transacetilase (E2) e a diidrolipoildesidrogenase ou lipoamida desidrogenase (E3). A enzima E1 apresenta 30 subunidades formando um tetrâmero α2β2 com e Dalton para a α e a β respectivamente. A E2 é um monômero com peso molecular de Dalton e composta de 60 subunidades. A E3 é um dímero α2 com Dalton de peso molecular para cada subunidade e possui 6 subunidades e uma proteína X, com Dalton e está envolvida na ligação da E3 ao complexo. As etapas das reações de transformação do piruvato a acetil-coa, são mostradas na figura 2. O piruvato é descarboxilado pela enzima piruvato decarboxilase (E1) na presença da coenzima pirofosfato de tiamina (TPP). O complexo resultante hidroxietil- TPP reage com a lipoamida oxidada (LipS2), que é o grupo prostético da enzima dihidrolipoamida transacetilase (E2), foramando o acetil lipoamida. Este intermediário reage com a coenzima A (CoASH) produzindo o acetil-coa e lipoamida reduzida (LipSH2). O ciclo da reação termina quando a lipoamida reduzida é re-oxidada pela flavoproteina dihidrolipoamida desidrogenase (E3). Finalmente a flavoproteina reduzida (FADH2) é oxidada pelo NAD+, formando o NADH2 que é transferido para a cadeia respiratória.
4 O complexo piruvato desidrogenase permanece inativo entre as refeições e no jejum, com exceção do cérebro onde o complexo esta permanentemente ativo obtendo ATP a partir da glicose. O controle que mantém o complexo piruvato desidrogenase (PDH) na forma ativa ou inativa é resultante do processo de fosforilação/defosforilação de resíduos de serina no sitio catalítico da Enzima E1. A fosforilação do complexo piruvato desidrogenase pela enzima PDH quinase torna o complexo inativo. Esta quinase é estimulada pelas concentrações de acetil-coa, ATP e NADH (fig. 3). Por outro lado, a ativação do complexo é desencadeada pela defosforilação da forma inativa, realizada pela enzima PDH fosfatase. Esta enzima é estimulada pela alta concentração de cálcio intramitocondrial, resultante do aumento da concentração de insulina circulante. A deficiência do complexo piruvato desidrogenase é uma doença metabólica heterogênea, cujo desenvolvimento pode ir desde uma acidose lática neonatal fulminante até o desenvolvimento progressivo de alterações no sistema nervoso central. A causa mais freqüente são mutações que ocorrem no gene E1α localizado no cromossomo X. Estas mutações determinam alterações na atividade da enzima piruvato descarboxilase (E1). No homem que apresenta somente um cromossomo X, dependendo da mutação pode ocorrer a perda total da atividade do complexo e apresentar uma forma fatal da deficiência. Na mulher que apresenta dois cromossomos X, um alelo estando normal, geralmente ela desenvolve uma forma de deficiência neurológica crônica. Em adição às mutações no gene E1α, menos freqüentemente podem ocorrer mutações nos genes para as enzimas E2, E3 e mesmo na proteína X. Não existe uma terapia eficaz para pessoas que apresentam deficiência do complexo priruvato desidrogenase. Atualmente, a estratégia mais utilizada é uma combinação de uma dieta alimentar especifica combinada com a administração de algumas drogas. Pacientes com deficiência do PDH não oxida carboidratos eficientemente e a maioria do piruvato produzido é desviado para formar lactato. Nestes casos, a introdução de uma dieta rica em gorduras que induz a cetogênese promove uma fonte alternativa de acetil-coa a partir dos corpos cetônicos, especialemte para o cérebro que passa a utilizar os corpos cetônicos para o seu metabolismo energético. Paralelamente, a administração de altas doses (2g/dia) de tiamina beneficia alguns pacientes, pois o pirofosfato de tiamina (TPP) é um cofator obrigatório para a enziam E1. O dicloro acetato (DCA) é uma droga que esta sendo investigada em detalhes para o tratamento da deficiência do PDH. Esta droga é um inibidor da piruvato desidrogenase quinase, conseqüentemente mantém o complexo PDH na sua forma defosforilada que é a sua forma cataliticamente ativa. O racional para o uso do DCA é que estimularia a atividade residual da enzima E1 em pacientes com deficiência parcial do complexo PDH, como nos heterozigotos. Recentemente, alguns estudos estão sendo realizados para avaliar o potencial da transferência gênica (terapia gênica) para defeitos no gene que expressa a enzima E1.
5 Figura 1 As relações entre o metabolismo do piruvato, lipídeos, carboidratos e alanina (modificado da ref. 4) Figura 2 Etapas das reações do complexo piruvato desidrogenase (PHD) (mod. da ref. 6) Figura 3 Mecanismo de controle do complexo piruvato desidrogenase (modificado da ref. 7)
Acetil CoA e Ciclo de Krebs. Prof. Henning Ulrich
 Acetil CoA e Ciclo de Krebs Prof. Henning Ulrich Glicose + Consumo de 2 ATP 2 Ácidos Pirúvicos + 4H + + Produção de 4 ATP (2C 3 H 4 O 3 ) 2H + são Transportados pelo NAD passando Para o estado reduzido
Acetil CoA e Ciclo de Krebs Prof. Henning Ulrich Glicose + Consumo de 2 ATP 2 Ácidos Pirúvicos + 4H + + Produção de 4 ATP (2C 3 H 4 O 3 ) 2H + são Transportados pelo NAD passando Para o estado reduzido
12/11/2015. Disciplina: Bioquímica Prof. Dr. Vagne Oliveira
 Disciplina: Bioquímica Prof. Dr. Vagne Oliveira 2 1 ATP ADP Glicose (6C) C 6 H 12 O 6 ATP ADP P ~ 6 C ~ P 3 C ~ P 3 C ~ P Pi NAD NADH P ~ 3 C ~ P ADP P ~ 3 C ATP ADP ATP NAD Pi NADH P ~ 3 C ~ P ADP ATP
Disciplina: Bioquímica Prof. Dr. Vagne Oliveira 2 1 ATP ADP Glicose (6C) C 6 H 12 O 6 ATP ADP P ~ 6 C ~ P 3 C ~ P 3 C ~ P Pi NAD NADH P ~ 3 C ~ P ADP P ~ 3 C ATP ADP ATP NAD Pi NADH P ~ 3 C ~ P ADP ATP
Aula de Bioquímica II SQM Ciclo do Ácido Cítrico
 Aula de Bioquímica II SQM04242015201 Bacharelado em Ciências Físicas e Biomoleculares Tema: Ciclo do Ácido Cítrico Prof. Dr. Júlio César Borges Depto. de Química e Física Molecular DQFM Instituto de Química
Aula de Bioquímica II SQM04242015201 Bacharelado em Ciências Físicas e Biomoleculares Tema: Ciclo do Ácido Cítrico Prof. Dr. Júlio César Borges Depto. de Química e Física Molecular DQFM Instituto de Química
Aula de Bioquímica II. Ciclo do Ácido Cítrico
 Aula de Bioquímica II Tema: Ciclo do Ácido Cítrico Prof. Dr. Júlio César Borges Depto. de Química e Física Molecular DQFM Instituto de Química de São Carlos IQSC Universidade de São Paulo USP E-mail: borgesjc@iqsc.usp.br
Aula de Bioquímica II Tema: Ciclo do Ácido Cítrico Prof. Dr. Júlio César Borges Depto. de Química e Física Molecular DQFM Instituto de Química de São Carlos IQSC Universidade de São Paulo USP E-mail: borgesjc@iqsc.usp.br
Resumo esquemático da glicólise
 Resumo esquemático da glicólise Destino do piruvato em condições aeróbicas e anaeróbicas Glicólise Fermentação Oxidação completa Em condições aeróbicas o piruvato é oxidado a acetato que entra no ciclo
Resumo esquemático da glicólise Destino do piruvato em condições aeróbicas e anaeróbicas Glicólise Fermentação Oxidação completa Em condições aeróbicas o piruvato é oxidado a acetato que entra no ciclo
5/4/2011. Metabolismo. Vias Metabólicas. Séries de reações consecutivas catalisadas enzimaticamente, que produzem produtos específicos (metabólitos).
 Metabolismo Vias Metabólicas Séries de reações consecutivas catalisadas enzimaticamente, que produzem produtos específicos (metabólitos). 1 Endergônico Exergônico Catabolismo Durante o catabolismo de carboidratos,
Metabolismo Vias Metabólicas Séries de reações consecutivas catalisadas enzimaticamente, que produzem produtos específicos (metabólitos). 1 Endergônico Exergônico Catabolismo Durante o catabolismo de carboidratos,
Acetil CoA e Ciclo de Krebs. Prof. Henning Ulrich
 Acetil CoA e Ciclo de Krebs Prof. Henning Ulrich No citossol Na mitocôndria Descarboxilação do piruvato: H 3 C- Piruvato Coenzima A Acetil CoA Redução de 1 NAD + Formação de acetil CoA (rica em energia)
Acetil CoA e Ciclo de Krebs Prof. Henning Ulrich No citossol Na mitocôndria Descarboxilação do piruvato: H 3 C- Piruvato Coenzima A Acetil CoA Redução de 1 NAD + Formação de acetil CoA (rica em energia)
Bibliografia. BIOQUÍMICA I 2010/2011 Ensino teórico - 1º ano Mestrado Integrado em Medicina. Stryer, Biochemistry, 5ª Ed, 2006, Capítulo 17
 BIOQUÍMICA I 2010/2011 Ensino teórico - 1º ano Mestrado Integrado em Medicina 14ª aula teórica Complexo da piruvato desidrogenase (PDH) e ciclo de Krebs. 15/11/2010 Bibliografia Stryer, Biochemistry, 5ª
BIOQUÍMICA I 2010/2011 Ensino teórico - 1º ano Mestrado Integrado em Medicina 14ª aula teórica Complexo da piruvato desidrogenase (PDH) e ciclo de Krebs. 15/11/2010 Bibliografia Stryer, Biochemistry, 5ª
Universidade Federal do Pampa Campus Itaqui Bioquímica GLICÓLISE AERÓBICA. Ciclo de Krebs e Fosforilação Oxidativa. Profa.
 Universidade Federal do Pampa Campus Itaqui Bioquímica GLICÓLISE AERÓBICA Ciclo de Krebs e Fosforilação Oxidativa Profa. Marina Prigol 1 Glicólise Anaeróbica RESPIRAÇÃO CELULAR ou GLICÓLISE AERÓBICA:
Universidade Federal do Pampa Campus Itaqui Bioquímica GLICÓLISE AERÓBICA Ciclo de Krebs e Fosforilação Oxidativa Profa. Marina Prigol 1 Glicólise Anaeróbica RESPIRAÇÃO CELULAR ou GLICÓLISE AERÓBICA:
Ciclo de Krebs ou Ciclo do ácido cítrico. Prof. Liza Felicori
 Ciclo de Krebs ou Ciclo do ácido cítrico Prof. Liza Felicori VISÃO GERAL Em circunstâncias aeróbicas piruvato é descarboxilado CO 2 C4 + C2 C6 C6 C6 C6 C5 CO 2 CO 2 C5 C4 C4 C4 C4 NAD+ & FAD 3 Íons H-
Ciclo de Krebs ou Ciclo do ácido cítrico Prof. Liza Felicori VISÃO GERAL Em circunstâncias aeróbicas piruvato é descarboxilado CO 2 C4 + C2 C6 C6 C6 C6 C5 CO 2 CO 2 C5 C4 C4 C4 C4 NAD+ & FAD 3 Íons H-
BIOLOGIA. Moléculas, células e tecidos. Respiração celular e fermentação Parte 1. Professor: Alex Santos
 BIOLOGIA Moléculas, células e tecidos Parte 1 Professor: Alex Santos Tópicos em abordagem: Parte 1 Respiração celular I Conceitos fundamentais; II Etapas da respiração celular; Parte 2 Respiração celular
BIOLOGIA Moléculas, células e tecidos Parte 1 Professor: Alex Santos Tópicos em abordagem: Parte 1 Respiração celular I Conceitos fundamentais; II Etapas da respiração celular; Parte 2 Respiração celular
30/05/2017. Metabolismo: soma de todas as transformações químicas que ocorrem em uma célula ou organismo por meio de reações catalisadas por enzimas
 Metabolismo: soma de todas as transformações químicas que ocorrem em uma célula ou organismo por meio de reações catalisadas por enzimas Metabolismo energético: vias metabólicas de fornecimento de energia
Metabolismo: soma de todas as transformações químicas que ocorrem em uma célula ou organismo por meio de reações catalisadas por enzimas Metabolismo energético: vias metabólicas de fornecimento de energia
PRINCIPAIS VIAS METABÓLICAS
 PRINCIPAIS VIAS METABÓLICAS DEGRADAÇÃO DO GLIGOGÊNIO GLICÓLISE VIA DAS PENTOSES FOSFATO GLICONEOGÊNESE SÍNTESE DE CORPOS CETÔNICOS DEGRADAÇÃO DE AMINOÁCIDOS E CICLO DA URÉIA CICLO DE KREBS Β-OXIDAÇÃO DE
PRINCIPAIS VIAS METABÓLICAS DEGRADAÇÃO DO GLIGOGÊNIO GLICÓLISE VIA DAS PENTOSES FOSFATO GLICONEOGÊNESE SÍNTESE DE CORPOS CETÔNICOS DEGRADAÇÃO DE AMINOÁCIDOS E CICLO DA URÉIA CICLO DE KREBS Β-OXIDAÇÃO DE
METABOLISMO ENERGÉTICO integração e regulação alimentado jejum catabólitos urinários. Bioquímica. Profa. Dra. Celene Fernandes Bernardes
 METABOLISMO ENERGÉTICO integração e regulação alimentado jejum catabólitos urinários Bioquímica Profa. Dra. Celene Fernandes Bernardes REFERÊNCIA: Bioquímica Ilustrada - Champe ESTÁGIOS DO CATABOLISMO
METABOLISMO ENERGÉTICO integração e regulação alimentado jejum catabólitos urinários Bioquímica Profa. Dra. Celene Fernandes Bernardes REFERÊNCIA: Bioquímica Ilustrada - Champe ESTÁGIOS DO CATABOLISMO
Profª Eleonora Slide de aula. Metabolismo de Carboidratos
 Metabolismo de Carboidratos Metabolismo de Carboidratos Profª Eleonora Slide de aula Condições de anaerobiose Glicose 2 Piruvato Ciclo do ácido cítrico Condições de anaerobiose 2 Etanol + 2 CO 2 Condições
Metabolismo de Carboidratos Metabolismo de Carboidratos Profª Eleonora Slide de aula Condições de anaerobiose Glicose 2 Piruvato Ciclo do ácido cítrico Condições de anaerobiose 2 Etanol + 2 CO 2 Condições
Sistema glicolítico ou metabolismo anaeróbio lático
 Sistema glicolítico ou metabolismo anaeróbio lático Quando a molécula de glicose entra na célula para ser utilizada como energia, sofre uma série de reações químicas que coletivamente recebe o nome de
Sistema glicolítico ou metabolismo anaeróbio lático Quando a molécula de glicose entra na célula para ser utilizada como energia, sofre uma série de reações químicas que coletivamente recebe o nome de
Respiração Celular. Ciclo de Krebs Ciclo do ácido Tricarboxílico Ciclo do ácido Cítrico. Prof. Ana Paula Jacobus
 Respiração Celular Ciclo de Krebs Ciclo do ácido Tricarboxílico Ciclo do ácido Cítrico Prof. Ana Paula Jacobus GLICOSE VIAS LINEARES (glicólise e gliconeogênese) PIRUVATO Ciclo do ácido cítrico ou
Respiração Celular Ciclo de Krebs Ciclo do ácido Tricarboxílico Ciclo do ácido Cítrico Prof. Ana Paula Jacobus GLICOSE VIAS LINEARES (glicólise e gliconeogênese) PIRUVATO Ciclo do ácido cítrico ou
Metabolismo de Carboidratos
 Metabolismo de Carboidratos Curso de Bioqímica para Saúde Coletiva- UFRJ Profa. Dra. Mônica Santos de Freitas 1 Carboidratos Três maiores classes de carboidratos Monossacarídeos- são carboidratos não polimerizados;
Metabolismo de Carboidratos Curso de Bioqímica para Saúde Coletiva- UFRJ Profa. Dra. Mônica Santos de Freitas 1 Carboidratos Três maiores classes de carboidratos Monossacarídeos- são carboidratos não polimerizados;
MAPA II POLISSACARÍDIOS PROTEÍNAS LIPÍDIOS GLICOSE AMINOÁCIDOS ÁCIDOS GRAXOS. Leu Ile Lys Phe. Gly Ala Ser Cys. Fosfoenolpiruvato (3) Piruvato (3)
 Ciclo de Krebs MAPA II POLISSACARÍDIOS PROTEÍNAS LIPÍDIOS GLICOSE AMINOÁCIDOS ÁCIDOS GRAXOS Fosfoenolpiruvato (3) Asp Gly Ala Ser Cys Leu Ile Lys Phe Glu Piruvato (3) CO 2 Acetil-CoA (2) CO 2 Oxaloacetato
Ciclo de Krebs MAPA II POLISSACARÍDIOS PROTEÍNAS LIPÍDIOS GLICOSE AMINOÁCIDOS ÁCIDOS GRAXOS Fosfoenolpiruvato (3) Asp Gly Ala Ser Cys Leu Ile Lys Phe Glu Piruvato (3) CO 2 Acetil-CoA (2) CO 2 Oxaloacetato
UNIVERSIDADE ESTADUAL PAULISTA
 GLICÓLISE Dra. Flávia Cristina Goulart CIÊNCIAS FISIOLÓGICAS UNIVERSIDADE ESTADUAL PAULISTA Campus de Marília flaviagoulart@marilia.unesp.br Glicose e glicólise Via Ebden-Meyerhof ou Glicólise A glicólise,
GLICÓLISE Dra. Flávia Cristina Goulart CIÊNCIAS FISIOLÓGICAS UNIVERSIDADE ESTADUAL PAULISTA Campus de Marília flaviagoulart@marilia.unesp.br Glicose e glicólise Via Ebden-Meyerhof ou Glicólise A glicólise,
Funções do Metabolismo
 Universidade Federal de Mato Grosso Disciplina de Bioquímica Conceito de Metabolismo METABOLISMO DOS CARBOIDRATOS Prof. Msc. Reginaldo Vicente Ribeiro Atividade celular altamente dirigida e coordenada,
Universidade Federal de Mato Grosso Disciplina de Bioquímica Conceito de Metabolismo METABOLISMO DOS CARBOIDRATOS Prof. Msc. Reginaldo Vicente Ribeiro Atividade celular altamente dirigida e coordenada,
METABOLISMO DE CARBOIDRATOS METABOLISMO DOS LIPÍDIOS METABOLISMO DE PROTEÍNAS
 METABOLISMO DE CARBOIDRATOS METABOLISMO DOS LIPÍDIOS METABOLISMO DE PROTEÍNAS METABOLISMO DE CARBOIDRATOS GLICÓLISE Transporte da Glicose para dentro das Células: Glicose não difunde diretamente para
METABOLISMO DE CARBOIDRATOS METABOLISMO DOS LIPÍDIOS METABOLISMO DE PROTEÍNAS METABOLISMO DE CARBOIDRATOS GLICÓLISE Transporte da Glicose para dentro das Células: Glicose não difunde diretamente para
1. Produção de Acetil-CoA. 2. Oxidação de Acetil-CoA. 3. Transferência de elétrons e fosforilação oxidativa
 CICLO DE KREBS OU DO ÁCIDO CÍTRICO 1. Produção de Acetil-CoA 2. Oxidação de Acetil-CoA 3. Transferência de elétrons e fosforilação oxidativa CICLO DE KREBS OU DO ÁCIDO CÍTRICO 1. Produção de Acetil-CoA
CICLO DE KREBS OU DO ÁCIDO CÍTRICO 1. Produção de Acetil-CoA 2. Oxidação de Acetil-CoA 3. Transferência de elétrons e fosforilação oxidativa CICLO DE KREBS OU DO ÁCIDO CÍTRICO 1. Produção de Acetil-CoA
Revisão do Metabolismo da Glicose
 Gliconeogênese Revisão do Metabolismo da Glicose Esquema Geral da Glicólise lise 1 açúcar de 6 C 2 açúcares de 3 C A partir deste ponto as reações são duplicadas 2 moléculas de Piruvato (3C) Saldo 2 moléculas
Gliconeogênese Revisão do Metabolismo da Glicose Esquema Geral da Glicólise lise 1 açúcar de 6 C 2 açúcares de 3 C A partir deste ponto as reações são duplicadas 2 moléculas de Piruvato (3C) Saldo 2 moléculas
21/11/2016. Destinos do Piruvato na Célula. Respiração Celular X Combustão. Respiração Celular
 Universidade de São Paulo Escola de Engenharia de Lorena Departamento de Biotecnologia Destinos do Piruvato na Célula Curso Engenharia Química Disciplina Bioquimica Metabolismo de Carboidratos Ciclo do
Universidade de São Paulo Escola de Engenharia de Lorena Departamento de Biotecnologia Destinos do Piruvato na Célula Curso Engenharia Química Disciplina Bioquimica Metabolismo de Carboidratos Ciclo do
Obtenção de Energia. Obtenção de Energia. Obtenção de Energia. Oxidação de Carboidratos. Obtenção de energia por oxidação 19/08/2014
 , Cadeia de Transporte de Elétrons e Fosforilação Oxidativa Prof. Dr. Bruno Lazzari de Lima Para que um organismo possa realizar suas funções básicas: Obtenção de nutrientes. Crescimento. Multiplicação.
, Cadeia de Transporte de Elétrons e Fosforilação Oxidativa Prof. Dr. Bruno Lazzari de Lima Para que um organismo possa realizar suas funções básicas: Obtenção de nutrientes. Crescimento. Multiplicação.
Ciclo do Ácido Cítrico ou Ciclo de Krebs ou Ciclo dos Ácidos Tricarboxílicos
 Ciclo do Ácido Cítrico ou Ciclo de Krebs ou Ciclo dos Ácidos Tricarboxílicos Vias da Respiração Celular NADH Glicólise NADH 2 Ciclo de Krebs Mitocôndria Cadeia transp. elétrons Glicose Piruvato Citosol
Ciclo do Ácido Cítrico ou Ciclo de Krebs ou Ciclo dos Ácidos Tricarboxílicos Vias da Respiração Celular NADH Glicólise NADH 2 Ciclo de Krebs Mitocôndria Cadeia transp. elétrons Glicose Piruvato Citosol
Hoje iremos conhecer o ciclo de Krebs e qual a sua importância no metabolismo aeróbio. Acompanhe!
 Aula: 13 Temática: Metabolismo aeróbio parte I Hoje iremos conhecer o ciclo de Krebs e qual a sua importância no metabolismo aeróbio. Acompanhe! O Ciclo de Krebs ou Ciclo do Ácido Cítrico A molécula de
Aula: 13 Temática: Metabolismo aeróbio parte I Hoje iremos conhecer o ciclo de Krebs e qual a sua importância no metabolismo aeróbio. Acompanhe! O Ciclo de Krebs ou Ciclo do Ácido Cítrico A molécula de
Profa. Angélica Pinho Zootecnista. Dpto de Zootecnia Fones:
 Profa. Angélica Pinho Zootecnista Dpto de Zootecnia Fones: 3243-7070 Email: angelicapinho@unipampa.edu.br UNIDADE 1 INTRODUÇÃO AO METABOLISMO 1.1 Visão geral do metabolismo. 1.2 Catabolismo e anabolismo.
Profa. Angélica Pinho Zootecnista Dpto de Zootecnia Fones: 3243-7070 Email: angelicapinho@unipampa.edu.br UNIDADE 1 INTRODUÇÃO AO METABOLISMO 1.1 Visão geral do metabolismo. 1.2 Catabolismo e anabolismo.
Metabolismo energético das células
 Metabolismo energético das células Medicina Veterinária Bioquímica I 2º período Professora: Ms. Fernanda Cristina Ferrari Como a célula produz energia? Fotossíntese Quimiossíntese Respiração Adenosina
Metabolismo energético das células Medicina Veterinária Bioquímica I 2º período Professora: Ms. Fernanda Cristina Ferrari Como a célula produz energia? Fotossíntese Quimiossíntese Respiração Adenosina
QBQ 0204 Bioquímica. Carlos Hotta. Glicólise 13/05/17
 QBQ 0204 Bioquímica Carlos Hotta Glicólise 13/05/17 Uma visão geral do metabolismo Ribose 5P (5) NUCLEOTÍDEOS Algumas reações são irreversíveis Vias de síntese e degradação precisam ser separadas Uma visão
QBQ 0204 Bioquímica Carlos Hotta Glicólise 13/05/17 Uma visão geral do metabolismo Ribose 5P (5) NUCLEOTÍDEOS Algumas reações são irreversíveis Vias de síntese e degradação precisam ser separadas Uma visão
Anderson Guarise Cristina Haas Fernando Oliveira Leonardo M de Castro Sergio Vargas Júnior
 Anderson Guarise Cristina Haas Fernando Oliveira Leonardo M de Castro Sergio Vargas Júnior Respiração Celular Glicólise Ciclo do Ácido Cítrico (CAC) Fosforilação oxidativa (Fox) Respiração Celular Glicólise
Anderson Guarise Cristina Haas Fernando Oliveira Leonardo M de Castro Sergio Vargas Júnior Respiração Celular Glicólise Ciclo do Ácido Cítrico (CAC) Fosforilação oxidativa (Fox) Respiração Celular Glicólise
TICA. Prof. Bruno Ramello
 BIOENERGÉ TICA Metabolismo Anabolismo catabolismo produção Quebra Metabolismo Metabolismos: é o conjunto de reações químicas que acontecem em um ser vivo. Anabolismo: metabolismo que serve para a construção
BIOENERGÉ TICA Metabolismo Anabolismo catabolismo produção Quebra Metabolismo Metabolismos: é o conjunto de reações químicas que acontecem em um ser vivo. Anabolismo: metabolismo que serve para a construção
Universidade Salgado de Oliveira Disciplina de Bioquímica Básica Carboidratos e metabolismo
 Universidade Salgado de Oliveira Disciplina de Bioquímica Básica Carboidratos e metabolismo Profª Larissa dos Santos Carboidratos Os carboidratos (também conhecidos como oses, osídeos, glicídios ou simplesmente
Universidade Salgado de Oliveira Disciplina de Bioquímica Básica Carboidratos e metabolismo Profª Larissa dos Santos Carboidratos Os carboidratos (também conhecidos como oses, osídeos, glicídios ou simplesmente
Oxidação parcial o que acontece com o piruvato?
 A glicólise ocorre no citosol das células transforma a glicose em duas moléculas de piruvato e é constituída por uma sequência de 10 reações (10 enzimas) divididas em duas fases. Fase preparatória (cinco
A glicólise ocorre no citosol das células transforma a glicose em duas moléculas de piruvato e é constituída por uma sequência de 10 reações (10 enzimas) divididas em duas fases. Fase preparatória (cinco
Gliconeogênese. Gliconeogênese. Órgãos e gliconeogênese. Fontes de Glicose. Gliconeogênese. Gliconeogênese Metabolismo dos aminoácidos Ciclo da Uréia
 Gliconeogênese Metabolismo dos aminoácidos Ciclo da Uréia Gliconeogênese Alexandre Havt Gliconeogênese Fontes de Energia para as Células Definição Via anabólica que ocorre no fígado e, excepcionalmente
Gliconeogênese Metabolismo dos aminoácidos Ciclo da Uréia Gliconeogênese Alexandre Havt Gliconeogênese Fontes de Energia para as Células Definição Via anabólica que ocorre no fígado e, excepcionalmente
Metabolismo de Carboidratos. Profa.Dra. Leticia Labriola Abril 2011
 Metabolismo de Carboidratos. Profa.Dra. Leticia Labriola Abril 2011 Funções da Via Glicolítica Gerar ATP (rápido); Gerar intermediários para síntese; Regenerar NADH; 2 ATP em anaerobiose Rendimento
Metabolismo de Carboidratos. Profa.Dra. Leticia Labriola Abril 2011 Funções da Via Glicolítica Gerar ATP (rápido); Gerar intermediários para síntese; Regenerar NADH; 2 ATP em anaerobiose Rendimento
BIOSSÍNTESE DE ÁCIDOS GRAXOS
 BIOSSÍNTESE DE ÁCIDOS GRAXOS Na aula anterior... Acetil-CoA carboxilase Visão geral da síntese do palmitato A cadeia de ácido graxo cresce de 2 em 2 carbonos, doados pelo malonato ativado, com a perda
BIOSSÍNTESE DE ÁCIDOS GRAXOS Na aula anterior... Acetil-CoA carboxilase Visão geral da síntese do palmitato A cadeia de ácido graxo cresce de 2 em 2 carbonos, doados pelo malonato ativado, com a perda
Metabolismo de Lipídeos
 Universidade de São Paulo Escola de Engenharia de Lorena Departamento de Biotecnologia Curso Engenharia Química Disciplina Bioquimica Metabolismo Energético de Lipídeos Oxidação Completa: Combustível +
Universidade de São Paulo Escola de Engenharia de Lorena Departamento de Biotecnologia Curso Engenharia Química Disciplina Bioquimica Metabolismo Energético de Lipídeos Oxidação Completa: Combustível +
Universidade Federal do Pampa Campus Itaqui Bioquímica GLICONEOGÊNESE. Profa. Dra. Marina Prigol
 Universidade Federal do Pampa Campus Itaqui Bioquímica GLICONEOGÊNESE Profa. Dra. Marina Prigol GLICONEOGÊNESE PROCESSO DE SÍNTESE DE GLICOSE A PARTIR DE COMPOSTOS NÃO GLICÍDICOS OCORRÊNCIA: Citosol do
Universidade Federal do Pampa Campus Itaqui Bioquímica GLICONEOGÊNESE Profa. Dra. Marina Prigol GLICONEOGÊNESE PROCESSO DE SÍNTESE DE GLICOSE A PARTIR DE COMPOSTOS NÃO GLICÍDICOS OCORRÊNCIA: Citosol do
Estratégias de regulação do metabolismo. Epinefrina, glucagon e insulina
 Estratégias de regulação do metabolismo Epinefrina, glucagon e insulina Estratégias de regulação do metabolismo Com a participação de enzimas Aula sobre enzimas... Com a participação de hormônios como
Estratégias de regulação do metabolismo Epinefrina, glucagon e insulina Estratégias de regulação do metabolismo Com a participação de enzimas Aula sobre enzimas... Com a participação de hormônios como
Metabolismo de Lipídeos
 Outros Exemplos de Mecanismos de Regulação Glicose X Gliconeogênese Regulação da Frutose 6P pela Frutose 2,6 bifosfato FBPase: bifosfatofosfatase (Gliconeogênese) PFK : fosfofrutoquinase (Glicólise) Universidade
Outros Exemplos de Mecanismos de Regulação Glicose X Gliconeogênese Regulação da Frutose 6P pela Frutose 2,6 bifosfato FBPase: bifosfatofosfatase (Gliconeogênese) PFK : fosfofrutoquinase (Glicólise) Universidade
A partir de agora, o processo de respiração celular ocorre dentro da organela citoplasmática chamada mitocôndria.
 A partir de agora, o processo de respiração celular ocorre dentro da organela citoplasmática chamada mitocôndria. Espaço intermembranar Membrana externa CITOSOL Finalizado o processo de GLICÓLISE 2 moléculas
A partir de agora, o processo de respiração celular ocorre dentro da organela citoplasmática chamada mitocôndria. Espaço intermembranar Membrana externa CITOSOL Finalizado o processo de GLICÓLISE 2 moléculas
CICLO DE KREBS. Bianca Zingales IQ-USP
 CICLO DE KREBS https://www.youtube.com/watch?v=ubzwpqpqm Bianca Zingales IQ-USP G L IC O S E A M IN O Á C ID O S Á C ID O S G R A X O S A sp G ly L eu G lu A la Ile F o sfo e n o lp iru v a to ( ) S er
CICLO DE KREBS https://www.youtube.com/watch?v=ubzwpqpqm Bianca Zingales IQ-USP G L IC O S E A M IN O Á C ID O S Á C ID O S G R A X O S A sp G ly L eu G lu A la Ile F o sfo e n o lp iru v a to ( ) S er
MANUAL DA DISCIPLINA DE BIOQUÍMICA CURSO DE FISIOTERAPIA
 MANUAL DA DISCIPLINA DE BIOQUÍMICA CURSO DE FISIOTERAPIA 2017 MÓDULO 2 METABOLISMO 1 Introdução ao Metabolismo METABOLISMO Tópicos para estudo (em casa): 1- Dê as principais características do ser vivo.
MANUAL DA DISCIPLINA DE BIOQUÍMICA CURSO DE FISIOTERAPIA 2017 MÓDULO 2 METABOLISMO 1 Introdução ao Metabolismo METABOLISMO Tópicos para estudo (em casa): 1- Dê as principais características do ser vivo.
BIOQUÍMICA II 2010/ º ano Mestrado Integrado em Medicina AULAS TEÓRICAS. 8ª aula teórica. Défice da piruvato desidrogenase (PDH)
 BIOQUÍMICA II 2010/2011 AULAS TEÓRICAS 1º ano Mestrado Integrado em Medicina 8ª aula teórica Défice da piruvato desidrogenase (PDH) 21-03-2011 BIBLIOGRAFIA Cap. 17 Biochemistry (Stryer), 5ª edição Cap.
BIOQUÍMICA II 2010/2011 AULAS TEÓRICAS 1º ano Mestrado Integrado em Medicina 8ª aula teórica Défice da piruvato desidrogenase (PDH) 21-03-2011 BIBLIOGRAFIA Cap. 17 Biochemistry (Stryer), 5ª edição Cap.
FISIOLOGIA VEGETAL 24/10/2012. Respiração. Respiração. Respiração. Substratos para a respiração. Mas o que é respiração?
 Respiração Mas o que é respiração? FISIOLOGIA VEGETAL Respiração É o processo pelo qual compostos orgânicos reduzidos são mobilizados e subsequentemente oxidados de maneira controlada É um processo de
Respiração Mas o que é respiração? FISIOLOGIA VEGETAL Respiração É o processo pelo qual compostos orgânicos reduzidos são mobilizados e subsequentemente oxidados de maneira controlada É um processo de
A mitocôndria oxida combustíveis para gerar energia, em analogia ao processo pelo qual as usinas de força utilizam os combustíveis para gerar energia
 A mitocôndria oxida combustíveis para gerar energia, em analogia ao processo pelo qual as usinas de força utilizam os combustíveis para gerar energia elétrica Micrografia eletrônica de uma mitocôndria
A mitocôndria oxida combustíveis para gerar energia, em analogia ao processo pelo qual as usinas de força utilizam os combustíveis para gerar energia elétrica Micrografia eletrônica de uma mitocôndria
Conversão de energia Mitocôndria - Respiração
 Universidade de São Paulo (USP) Escola de Engenharia de Lorena (EEL) Engenharia Ambiental Organelas: Cloroplasto e Mitocôndria Obtenção de energia para a célula a partir diferentes fontes: Conversão de
Universidade de São Paulo (USP) Escola de Engenharia de Lorena (EEL) Engenharia Ambiental Organelas: Cloroplasto e Mitocôndria Obtenção de energia para a célula a partir diferentes fontes: Conversão de
A energética celular:
 A energética celular: o papel das mitocôndrias e cloroplastos Capitulo 13 (p 427 a 444) e Capitulo 14 Fundamentos da Biologia Celular- Alberts- 2ª edição A energética celular Como já vimos anteriormente
A energética celular: o papel das mitocôndrias e cloroplastos Capitulo 13 (p 427 a 444) e Capitulo 14 Fundamentos da Biologia Celular- Alberts- 2ª edição A energética celular Como já vimos anteriormente
Oxidação parcial o que acontece com o piruvato?
 A glicólise ocorre no citosol das células transforma a glicose em duas moléculas de piruvato e é constituída por uma sequência de 10 reações (10 enzimas) divididas em duas fases. Fase preparatória (cinco
A glicólise ocorre no citosol das células transforma a glicose em duas moléculas de piruvato e é constituída por uma sequência de 10 reações (10 enzimas) divididas em duas fases. Fase preparatória (cinco
28/10/2016.
 alexandre.personal@hotmail.com www.professoralexandrerocha.com.br 1 O exercício é um grade desafio para as vias energéticas! Exercício intenso: 15 a 25X o gasto energético em repouso Os músculos aumentam
alexandre.personal@hotmail.com www.professoralexandrerocha.com.br 1 O exercício é um grade desafio para as vias energéticas! Exercício intenso: 15 a 25X o gasto energético em repouso Os músculos aumentam
O cérebro necessita de cerca de 120 g de glicose/dia, isso é mais que a metade de toda a glicose estocada no fígado e músculo.
 O cérebro necessita de cerca de 120 g de glicose/dia, isso é mais que a metade de toda a glicose estocada no fígado e músculo. Entre as refeições, jejuns ou depois de exercícios físicos vigorosos, o glicogênio
O cérebro necessita de cerca de 120 g de glicose/dia, isso é mais que a metade de toda a glicose estocada no fígado e músculo. Entre as refeições, jejuns ou depois de exercícios físicos vigorosos, o glicogênio
Glicose / carboidratos Ácidos graxos Aminoácidos. Acetil-CoA. Ciclo de Krebs (NADH e FADH 2 )
 A fosforilação oxidativa (FO) é o estágio final do metabolismo produtor de energia nos organismos aeróbicos Nessa etapa toda a energia produzida (na forma de carreadores de elétrons) durante a oxidação
A fosforilação oxidativa (FO) é o estágio final do metabolismo produtor de energia nos organismos aeróbicos Nessa etapa toda a energia produzida (na forma de carreadores de elétrons) durante a oxidação
Matéria: Biologia Assunto: Respiração celular Prof. Enrico blota
 Matéria: Biologia Assunto: Respiração celular Prof. Enrico blota Biologia 1. Moléculas, células e tecidos - Fotossíntese e respiração - Respiração celular Fermentação Organismos que só vivem na presença
Matéria: Biologia Assunto: Respiração celular Prof. Enrico blota Biologia 1. Moléculas, células e tecidos - Fotossíntese e respiração - Respiração celular Fermentação Organismos que só vivem na presença
Introdução e apresentação geral do metabolismo da glicose
 Introdução e apresentação geral do metabolismo da glicose Índice 1- O transporte transmembranar e a fosforilação da glicose...1 2- A glicólise e a oxidação da glicose a CO 2...1 3- A oxidação da glicose-6-fosfato
Introdução e apresentação geral do metabolismo da glicose Índice 1- O transporte transmembranar e a fosforilação da glicose...1 2- A glicólise e a oxidação da glicose a CO 2...1 3- A oxidação da glicose-6-fosfato
Fontes de Ácidos Graxos. Dieta Estoque de gorduras Síntese de outras fontes
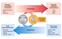 Acetil CoA ATP Fontes de Ácidos Graxos Dieta Estoque de gorduras Síntese de outras fontes Lipídios ingeridos da dieta L i Emulsificação Sais biliares Lipases intestinais degradam TCG Mucosa intestinal
Acetil CoA ATP Fontes de Ácidos Graxos Dieta Estoque de gorduras Síntese de outras fontes Lipídios ingeridos da dieta L i Emulsificação Sais biliares Lipases intestinais degradam TCG Mucosa intestinal
Metabolismo de Carboidratos. Profa.Dra. Leticia Labriola Abril 2012
 Metabolismo de Carboidratos. Profa.Dra. Leticia Labriola Abril 2012 Oxidação Completa da Glicose C 6 H 12 O 6 + 6O 2 + 36-38ADP + 36-38 P i 6CO 2 + 6H 2 O + 36-38ATP Via glicolítica gastou: 1 glicose,
Metabolismo de Carboidratos. Profa.Dra. Leticia Labriola Abril 2012 Oxidação Completa da Glicose C 6 H 12 O 6 + 6O 2 + 36-38ADP + 36-38 P i 6CO 2 + 6H 2 O + 36-38ATP Via glicolítica gastou: 1 glicose,
Aula Neoglicogênese Gliconeogênese
 Aula 22.10.09 Neoglicogênese Gliconeogênese Metabolismo de açúcares Visão Geral Galactose Frutose Ácido láctico Fermentação Glicólise Glicose Piruvato Glicogenólise Gliconeogênese Glicogênese Glicogênio
Aula 22.10.09 Neoglicogênese Gliconeogênese Metabolismo de açúcares Visão Geral Galactose Frutose Ácido láctico Fermentação Glicólise Glicose Piruvato Glicogenólise Gliconeogênese Glicogênese Glicogênio
Corpos cetônicos. Quais são? A partir de qual composto se formam? Como se formam? Quando se formam? Efeitos de corpos cetônicos elevados?
 Corpos cetônicos Quais são? A partir de qual composto se formam? Como se formam? Quando se formam? Efeitos de corpos cetônicos elevados? Importante saber!!!!!!!!!!!! A partir de qual composto se formam?
Corpos cetônicos Quais são? A partir de qual composto se formam? Como se formam? Quando se formam? Efeitos de corpos cetônicos elevados? Importante saber!!!!!!!!!!!! A partir de qual composto se formam?
UNIVERSIDADE BRASIL CAMPUS DE DESCALVADO
 UNVERSDADE BRASL CAMPUS DE DESCALVADO Wanderley José de Melo Gabriel Maurício Peruca de Melo Liandra Maria Abaker Bertipaglia Valéria Peruca de Melo DESCALVADO 01/12/2017 CONCETO Conjunto de reações cíclicas,
UNVERSDADE BRASL CAMPUS DE DESCALVADO Wanderley José de Melo Gabriel Maurício Peruca de Melo Liandra Maria Abaker Bertipaglia Valéria Peruca de Melo DESCALVADO 01/12/2017 CONCETO Conjunto de reações cíclicas,
Quantas moléculas de acetil-coa uma molécula de glicose e uma molécula de ácido graxo com 16 carbonos podem produzir após sua oxidação?
 Quantas moléculas de acetil-coa uma molécula de glicose e uma molécula de ácido graxo com 16 carbonos podem produzir após sua oxidação? E de transportadores de elétrons são reduzidos durante a oxidação
Quantas moléculas de acetil-coa uma molécula de glicose e uma molécula de ácido graxo com 16 carbonos podem produzir após sua oxidação? E de transportadores de elétrons são reduzidos durante a oxidação
Doenças Metabólicas. Revisão Bioquímica. Bruna Mion
 Doenças Metabólicas Revisão Bioquímica Bruna Mion GLICÓLISE Glicólise GLICOSE Armazenamento Polissacarídeo Sacarose Glicólise Piruvato ATP Intermediários Via das Pentoses Fosfato Ribose 5 fosfato NADPH
Doenças Metabólicas Revisão Bioquímica Bruna Mion GLICÓLISE Glicólise GLICOSE Armazenamento Polissacarídeo Sacarose Glicólise Piruvato ATP Intermediários Via das Pentoses Fosfato Ribose 5 fosfato NADPH
QBQ 0230 Bioquímica. Carlos Hotta. Metabolismo integrado do corpo 17/11/17
 QBQ 0230 Bioquímica Carlos Hotta Metabolismo integrado do corpo 17/11/17 Órgãos especializados: fígado - Garante a síntese de substrato energético para os demais tecidos - Sintetiza e armazena glicogênio
QBQ 0230 Bioquímica Carlos Hotta Metabolismo integrado do corpo 17/11/17 Órgãos especializados: fígado - Garante a síntese de substrato energético para os demais tecidos - Sintetiza e armazena glicogênio
Características Metabólicas dos Diferentes Tecidos Metabolismo de Estados Patológicos
 Características Metabólicas dos Diferentes Tecidos Metabolismo de Estados Patológicos 1 Pâncreas - Função exócrina: Secreção de enzimas líticas - Função endócrina (ilhotas): secreção de insulina e glucagon
Características Metabólicas dos Diferentes Tecidos Metabolismo de Estados Patológicos 1 Pâncreas - Função exócrina: Secreção de enzimas líticas - Função endócrina (ilhotas): secreção de insulina e glucagon
GLICONEOGÊNESE ou NEOGLICOGÊNESE
 GLICONEOGÊNESE ou NEOGLICOGÊNESE GLICONEOGÊNESE OU NEOGLICOGÊNESE Definição: é a via de biossíntese de Glicose a partir de Piruvato Esta via faz parte do ANABOLISMO A Gliconeogênese ocorre no CITOSSOL
GLICONEOGÊNESE ou NEOGLICOGÊNESE GLICONEOGÊNESE OU NEOGLICOGÊNESE Definição: é a via de biossíntese de Glicose a partir de Piruvato Esta via faz parte do ANABOLISMO A Gliconeogênese ocorre no CITOSSOL
Metabolismo de Glicídeos
 Universidade Federal de Pelotas Instituto de Química e Geociências Departamento de Bioquímica Metabolismo de Glicídeos Professora Ana Chaves Introdução Boca Enzima Ligação Substrato Produto α-amilase (glândulas
Universidade Federal de Pelotas Instituto de Química e Geociências Departamento de Bioquímica Metabolismo de Glicídeos Professora Ana Chaves Introdução Boca Enzima Ligação Substrato Produto α-amilase (glândulas
A energética celular:
 A energética celular: o papel das mitocôndrias e cloroplastos Capitulo 13 (p 427 a 444) e Capitulo 14 Fundamentos da Biologia Celular- Alberts- 2ª edição A energética celular Como já vimos anteriormente
A energética celular: o papel das mitocôndrias e cloroplastos Capitulo 13 (p 427 a 444) e Capitulo 14 Fundamentos da Biologia Celular- Alberts- 2ª edição A energética celular Como já vimos anteriormente
O Observatório de Educação em Direitos Humanos / Unesp (SP) está iniciando uma campanha educativa em defesa da "democracia".
 O Observatório de Educação em Direitos Humanos / Unesp (SP) está iniciando uma campanha educativa em defesa da "democracia". De que democracia estamos falando? Certamente não de uma democracia apenas formal.
O Observatório de Educação em Direitos Humanos / Unesp (SP) está iniciando uma campanha educativa em defesa da "democracia". De que democracia estamos falando? Certamente não de uma democracia apenas formal.
Organelas e suas funções. A energética celular:
 Organelas e suas funções Capitulo 15- Fundamentos da Biologia Celular- Alberts- 2ª edição A energética celular: Capitulo 13 (p 427 a 444) e Capitulo 14 Fundamentos da Biologia Celular- Alberts- 2ª edição
Organelas e suas funções Capitulo 15- Fundamentos da Biologia Celular- Alberts- 2ª edição A energética celular: Capitulo 13 (p 427 a 444) e Capitulo 14 Fundamentos da Biologia Celular- Alberts- 2ª edição
Organelas Transdutoras de Energia: Mitocôndria - Respiração
 Universidade de São Paulo Escola de Engenharia de Lorena Departamento de Biotecnologia Organelas: Cloroplasto e Mitocôndria Obtenção de energia para a célula a partir diferentes fontes: Curso: Engenharia
Universidade de São Paulo Escola de Engenharia de Lorena Departamento de Biotecnologia Organelas: Cloroplasto e Mitocôndria Obtenção de energia para a célula a partir diferentes fontes: Curso: Engenharia
Introdução ao Metabolismo Microbiano
 Introdução ao Metabolismo Microbiano METABOLISMO DEFINIÇÃO: Grego: metabole = mudança, transformação; Toda atividade química realizada pelos organismos; São de dois tipos: Envolvem a liberação de energia:
Introdução ao Metabolismo Microbiano METABOLISMO DEFINIÇÃO: Grego: metabole = mudança, transformação; Toda atividade química realizada pelos organismos; São de dois tipos: Envolvem a liberação de energia:
Metabolismo de Carboidratos
 Metabolismo de Carboidratos Curso de Bioqímica para Saúde Coletiva- UFRJ Profa. Dra. Mônica Santos de Freitas 1 Gliconeogênese - Ocorre principalmente no fígado; - Algumas das enzimas utilizadas na síntese
Metabolismo de Carboidratos Curso de Bioqímica para Saúde Coletiva- UFRJ Profa. Dra. Mônica Santos de Freitas 1 Gliconeogênese - Ocorre principalmente no fígado; - Algumas das enzimas utilizadas na síntese
BE066 - Fisiologia do Exercício BE066 Fisiologia do Exercício. Bioenergética. Sergio Gregorio da Silva, PhD
 BE066 Fisiologia do Exercício Bioenergética Sergio Gregorio da Silva, PhD Objetivos Definir Energia Descrever os 3 Sistemas Energéticos Descrever as diferenças em Produção de Energia Bioenergética Estuda
BE066 Fisiologia do Exercício Bioenergética Sergio Gregorio da Silva, PhD Objetivos Definir Energia Descrever os 3 Sistemas Energéticos Descrever as diferenças em Produção de Energia Bioenergética Estuda
Semana 12 Respiração Celular
 Semana 12 Respiração Celular Prof. Saul Carvalho Respiração Celular Extração de energia química de substâncias orgânicas (carboidratos e lipídios) Principalmente quebra da Glicose Gera energia celular
Semana 12 Respiração Celular Prof. Saul Carvalho Respiração Celular Extração de energia química de substâncias orgânicas (carboidratos e lipídios) Principalmente quebra da Glicose Gera energia celular
Pontifícia Universidade Católica de Goiás Departamento de Biologia Bioquímica Metabólica ENZIMAS
 Pontifícia Universidade Católica de Goiás Departamento de Biologia Bioquímica Metabólica ENZIMAS Origem das proteínas e de suas estruturas Níveis de Estrutura Protéica Estrutura das proteínas Conformação
Pontifícia Universidade Católica de Goiás Departamento de Biologia Bioquímica Metabólica ENZIMAS Origem das proteínas e de suas estruturas Níveis de Estrutura Protéica Estrutura das proteínas Conformação
MÓDULO 2 - METABOLISMO. Bianca Zingales IQ-USP
 MÓDULO 2 - METABOLISMO Bianca Zingales IQ-USP INTRODUÇÃO AO METABOLISMO CARACTERÍSTICAS DO SER VIVO 1- AUTO-REPLICAÇÃO Capacidade de perpetuação da espécie 2- TRANSFORMAÇÃO DE ENERGIA O ser vivo extrai
MÓDULO 2 - METABOLISMO Bianca Zingales IQ-USP INTRODUÇÃO AO METABOLISMO CARACTERÍSTICAS DO SER VIVO 1- AUTO-REPLICAÇÃO Capacidade de perpetuação da espécie 2- TRANSFORMAÇÃO DE ENERGIA O ser vivo extrai
Aula de Bioquímica II SQM Gliconeogênese Glicogênio: Glicogenólise, Síntese e Regulação
 Aula de Bioquímica II SQM04242015201 Bacharelado em Ciências Físicas e Biomoleculares Temas: Gliconeogênese Glicogênio: Glicogenólise, Síntese e Regulação Prof. Dr. Júlio César Borges Depto. de Química
Aula de Bioquímica II SQM04242015201 Bacharelado em Ciências Físicas e Biomoleculares Temas: Gliconeogênese Glicogênio: Glicogenólise, Síntese e Regulação Prof. Dr. Júlio César Borges Depto. de Química
21/10/2014. Referências Bibliográficas. Produção de ATP. Substratos Energéticos. Lipídeos Características. Lipídeos Papel no Corpo
 Referências Bibliográficas Livro: McArdle & Katch & Katch. Fisiologia do Exercício: Metabolismo de Lipídeos Durante o Exercício Físico Aeróbico Prof. Dr. Paulo Rizzo Ramires Escola de Educação Física e
Referências Bibliográficas Livro: McArdle & Katch & Katch. Fisiologia do Exercício: Metabolismo de Lipídeos Durante o Exercício Físico Aeróbico Prof. Dr. Paulo Rizzo Ramires Escola de Educação Física e
OXIDAÇÃO DOS AMINOÁCIDOS E PRODUÇÃO DE URÉIA
 Universidade Federal de Pelotas Programa de Pós-Graduação em Veterinária Disciplina de Doenças metabólicas OXIDAÇÃO DOS AMINOÁCIDOS E PRODUÇÃO DE URÉIA Doutoranda Lourdes Caruccio Hirschmann Orientador:
Universidade Federal de Pelotas Programa de Pós-Graduação em Veterinária Disciplina de Doenças metabólicas OXIDAÇÃO DOS AMINOÁCIDOS E PRODUÇÃO DE URÉIA Doutoranda Lourdes Caruccio Hirschmann Orientador:
CADEIA DE TRANSPORTE DE ELÉTRONS E FOSFORILAÇÃO OXIDATIVA COMO AS CÉLULAS SINTETIZAM ATP
 CADEIA DE TRANSPORTE DE ELÉTRONS E FOSFORILAÇÃO OXIDATIVA OU COMO AS CÉLULAS SINTETIZAM ATP SINTETIZAM ATP ÀS CUSTAS DA OXIDAÇÃO DAS COENZIMAS NADH E FADH 2 PELO OXIGÊNIO AS COENZIMAS REDUZIDAS SÃO PRODUZIDAS
CADEIA DE TRANSPORTE DE ELÉTRONS E FOSFORILAÇÃO OXIDATIVA OU COMO AS CÉLULAS SINTETIZAM ATP SINTETIZAM ATP ÀS CUSTAS DA OXIDAÇÃO DAS COENZIMAS NADH E FADH 2 PELO OXIGÊNIO AS COENZIMAS REDUZIDAS SÃO PRODUZIDAS
Biologia. Respiração Celular. Professor Enrico Blota.
 Biologia Respiração Celular Professor Enrico Blota www.acasadoconcurseiro.com.br Biologia RESPIRAÇÃO CELULAR A bioenergética é o estudo dos processos do metabolismo celular de produção e quebra de energia
Biologia Respiração Celular Professor Enrico Blota www.acasadoconcurseiro.com.br Biologia RESPIRAÇÃO CELULAR A bioenergética é o estudo dos processos do metabolismo celular de produção e quebra de energia
Variam em: localização, abundancia, forma... Axonema flagelar
 Mitocôndrias Variam em: localização, abundancia, forma... Axonema flagelar Matriz Membrana interna (Impermeável a íons) Membrana externa Espaço Intermembranas ou intermembanoso A origem das mitocôndrias:
Mitocôndrias Variam em: localização, abundancia, forma... Axonema flagelar Matriz Membrana interna (Impermeável a íons) Membrana externa Espaço Intermembranas ou intermembanoso A origem das mitocôndrias:
Lipídeos e ácidos graxos
 Lipídeos e ácidos graxos Tópicos de Estudo Lipídeos Lipoproteínas Passos da -oxidação Regulação em estados absortivos, fome e exercício Lipídeos que contem ácidos graxos Ácidos graxos e triacilgliceróis
Lipídeos e ácidos graxos Tópicos de Estudo Lipídeos Lipoproteínas Passos da -oxidação Regulação em estados absortivos, fome e exercício Lipídeos que contem ácidos graxos Ácidos graxos e triacilgliceróis
Glicólise. Professora Liza Felicori
 Glicólise Professora Liza Felicori Glicose Glicose (combustível metabólico) Fígado: Serve como tampão para manter o nível de glicose no sangue (liberação controlada de glicose) Glicose GLICOGÊNIO Estoque
Glicólise Professora Liza Felicori Glicose Glicose (combustível metabólico) Fígado: Serve como tampão para manter o nível de glicose no sangue (liberação controlada de glicose) Glicose GLICOGÊNIO Estoque
Profª Eleonora Slide de aula. Metabolismo de Carboidratos
 Metabolismo de Carboidratos Metabolismo de Carboidratos Profª Eleonora Slide de aula Condições de anaerobiose Fermentação alcoólica Glicose 2 Piruvato Ciclo do ácido cítrico Condições de anaerobiose Condições
Metabolismo de Carboidratos Metabolismo de Carboidratos Profª Eleonora Slide de aula Condições de anaerobiose Fermentação alcoólica Glicose 2 Piruvato Ciclo do ácido cítrico Condições de anaerobiose Condições
OXIDAÇÕES BIOLÓGICAS: Cadeia respiratória e fosforilação oxidativa
 OXIDAÇÕES BIOLÓGICAS: Cadeia respiratória e fosforilação oxidativa Metabolismo: integração entre catabolismo e anabolismo Assimilação ou processamento da mat. Orgânica Síntese de Substâncias Estágio 1
OXIDAÇÕES BIOLÓGICAS: Cadeia respiratória e fosforilação oxidativa Metabolismo: integração entre catabolismo e anabolismo Assimilação ou processamento da mat. Orgânica Síntese de Substâncias Estágio 1
Biossíntese de Lipídeos. Profa. Alana Cecília
 Biossíntese de Lipídeos Profa. Alana Cecília Biossíntese de Lipídeos Introdução Variedade de estruturas químicas: reserva de energia; componentes de membranas; vitaminas; detergentes (bile); transportadores
Biossíntese de Lipídeos Profa. Alana Cecília Biossíntese de Lipídeos Introdução Variedade de estruturas químicas: reserva de energia; componentes de membranas; vitaminas; detergentes (bile); transportadores
26/05/2017. Destinos do Piruvato na Célula. Respiração Celular X Combustão. Respiração Celular
 Universidade de São Paulo Escola de Engenharia de Lorena Departamento de Biotecnologia Destinos do Piruvato na Célula Curso Engenharia Química Disciplina Bioquimica Metabolismo de Carboidratos Ciclo do
Universidade de São Paulo Escola de Engenharia de Lorena Departamento de Biotecnologia Destinos do Piruvato na Célula Curso Engenharia Química Disciplina Bioquimica Metabolismo de Carboidratos Ciclo do
CADEIA DE TRANSPORTE DE ELÉTRONS E FOSFORILAÇÃO OXIDATIVA COMO AS CÉLULAS SINTETIZAM ATP
 CADEIA DE TRANSPORTE DE ELÉTRONS E FOSFORILAÇÃO OXIDATIVA OU COMO AS CÉLULAS SINTETIZAM ATP SINTETIZAM ATP ÀS CUSTAS DA OXIDAÇÃO DAS COENZIMAS NADH E FADH 2 PELO OXIGÊNIO AS COENZIMAS REDUZIDAS SÃO PRODUZIDAS
CADEIA DE TRANSPORTE DE ELÉTRONS E FOSFORILAÇÃO OXIDATIVA OU COMO AS CÉLULAS SINTETIZAM ATP SINTETIZAM ATP ÀS CUSTAS DA OXIDAÇÃO DAS COENZIMAS NADH E FADH 2 PELO OXIGÊNIO AS COENZIMAS REDUZIDAS SÃO PRODUZIDAS
26/4/2011. Beta-Oxidação de Ácidos Graxos. Principal fonte de Ácidos Graxos são os TRIGLICÉRIDES
 Beta-Oxidação de Ácidos Graxos Principal fonte de Ácidos Graxos são os TRIGLICÉRIDES 1 TG constituem mais de 90 % dos lipídios da dieta... TG são sintetizados no FÍGADO e estocados no TECIDO ADIPOSO 2
Beta-Oxidação de Ácidos Graxos Principal fonte de Ácidos Graxos são os TRIGLICÉRIDES 1 TG constituem mais de 90 % dos lipídios da dieta... TG são sintetizados no FÍGADO e estocados no TECIDO ADIPOSO 2
BIOSSÍNTESE DE ÁCIDOS GRAXOS E TRIACILGLICERÓIS. Bianca Zingales IQ-USP
 BIOSSÍNTESE DE ÁCIDOS GRAXOS E TRIACILGLICERÓIS Bianca Zingales IQ-USP Importância dos Lipídios 1. A maior fonte de armazenamento de Energia dos mamíferos 2. Componente de todas as membranas biológicas
BIOSSÍNTESE DE ÁCIDOS GRAXOS E TRIACILGLICERÓIS Bianca Zingales IQ-USP Importância dos Lipídios 1. A maior fonte de armazenamento de Energia dos mamíferos 2. Componente de todas as membranas biológicas
Metabolismo de Lipídeos
 Universidade de São Paulo Escola de Engenharia de Lorena Departamento de Biotecnologia Curso Engenharia Química Disciplina Bioquimica Metabolismo Energético de Lipídeos Oxidação Completa: Combustível +
Universidade de São Paulo Escola de Engenharia de Lorena Departamento de Biotecnologia Curso Engenharia Química Disciplina Bioquimica Metabolismo Energético de Lipídeos Oxidação Completa: Combustível +
Aulas Multimídias Santa Cecília Profª Renata Coelho Disciplina: Biologia Série: 9º ano EF
 Aulas Multimídias Santa Cecília Profª Renata Coelho Disciplina: Biologia Série: 9º ano EF QUAIS SÃO OS PROCESSOS METABÓLICOS QUE LIBERAM ENERGIA DO ALIMENTO DENTRO DAS CÉLULAS HUMANAS? ONDE, NAS CÉLULAS
Aulas Multimídias Santa Cecília Profª Renata Coelho Disciplina: Biologia Série: 9º ano EF QUAIS SÃO OS PROCESSOS METABÓLICOS QUE LIBERAM ENERGIA DO ALIMENTO DENTRO DAS CÉLULAS HUMANAS? ONDE, NAS CÉLULAS
1. o ANO ENSINO MÉDIO PROF.ª SABRINA ARAÚJO PROF.ª SARAH SANTOS
 1. o ANO ENSINO MÉDIO PROF.ª SABRINA ARAÚJO PROF.ª SARAH SANTOS Unidade III Metabolismo Energético. 2 Aula 9.2 Conteúdo Respiração Celular. 3 Habilidade Compreender como ocorre o processo da respiração
1. o ANO ENSINO MÉDIO PROF.ª SABRINA ARAÚJO PROF.ª SARAH SANTOS Unidade III Metabolismo Energético. 2 Aula 9.2 Conteúdo Respiração Celular. 3 Habilidade Compreender como ocorre o processo da respiração
QBQ-0230 Bioquímica do Metabolismo Biologia Noturno
 QBQ-0230 Bioquímica do Metabolismo Biologia Noturno O que é, e para que serve a vias das pentoses fosfato. A via das pentoses fosfato é uma via alternativa de oxidação da glicose. A via das pentoses fosfato
QBQ-0230 Bioquímica do Metabolismo Biologia Noturno O que é, e para que serve a vias das pentoses fosfato. A via das pentoses fosfato é uma via alternativa de oxidação da glicose. A via das pentoses fosfato
Profa. Alessandra Barone.
 Profa. Alessandra Barone www.profbio.com.br Quando é acionada a lipólise no organismo? ATP? Glicose? Glicólise? Glicogênese? Gliconeogênese? Via das pentoses? Lipídeo: reserva energética em forma de triacilglicerol
Profa. Alessandra Barone www.profbio.com.br Quando é acionada a lipólise no organismo? ATP? Glicose? Glicólise? Glicogênese? Gliconeogênese? Via das pentoses? Lipídeo: reserva energética em forma de triacilglicerol
Catabolismo de Aminoácidos em Mamíferos
 Catabolismo de Aminoácidos em Mamíferos O grupo amino e o esqueleto de carbono seguem vias separadas. A amônia é tóxica para os animais As bases moleculares não são totalmente esclarecidas Em humanos,
Catabolismo de Aminoácidos em Mamíferos O grupo amino e o esqueleto de carbono seguem vias separadas. A amônia é tóxica para os animais As bases moleculares não são totalmente esclarecidas Em humanos,
Introdução ao Metabolismo. Profª Eleonora Slide de aula
 Introdução ao Metabolismo Profª Eleonora Slide de aula Metabolismo Profª Eleonora Slide de aula Relacionamento energético entre as vias catabólicas e as vias anabólicas Nutrientes que liberam energia Carboidratos
Introdução ao Metabolismo Profª Eleonora Slide de aula Metabolismo Profª Eleonora Slide de aula Relacionamento energético entre as vias catabólicas e as vias anabólicas Nutrientes que liberam energia Carboidratos
Glicogênese, Glicogenólise e Gliconeogênese. Profa. Alessandra Barone
 Glicogênese, Glicogenólise e Gliconeogênese Profa. Alessandra Barone www.profbio.com.br Polissacarídeo de reserva animal Constituído por moléculas de α-d-glicose ligadas entre si por ligações glicosídicas
Glicogênese, Glicogenólise e Gliconeogênese Profa. Alessandra Barone www.profbio.com.br Polissacarídeo de reserva animal Constituído por moléculas de α-d-glicose ligadas entre si por ligações glicosídicas
