citoplasma Elemento água do mar sanguíneo Fe (Fe 3+ ) (Fe 3+ ) 10-2 (Fe 2+ )
|
|
|
- Amanda Farinha Castanho
- 5 Há anos
- Visualizações:
Transcrição
1 Transporte e armazenagem seletiva de Ferro Shriver & Atikins, cap. 26 Elemento água do mar plasma sanguíneo Na > < 10-2 K < 10-1 citoplasma Mg > Ca > Fe (Fe 3+ ) (Fe 3+ ) 10-2 (Fe 2+ ) Zn Cu (Cu 2+ ) < (Cu 2+ ) Mn
2 Distribuição de elétrons no Fe; Fe 2+ e Fe 3+ Fe (26 elétrons): 1s 2 2s 2 2p 6 3s 2 3p 6 3d 6 4s 2 Fe 2+ (24 elétrons): 1s 2 2s 2 2p 6 3s 2 3p 6 3d 6 4s 0 Fe 3+ (23 elétrons): 1s 2 2s 2 2p 6 3s 2 3p 6 3d 5 4s 0 Em solução aquosa, os dois íons geram estruturas octaédricas I - < Br - < S -2 < SCN - < Cl - < NO 2 - < N 3 - < F - < OH - < C 2 O 4-2 <H 2 O < NCS - < CH 3 CN < py < NH 3 < en < bipy < phen < NO -2 < PPh 3 < CN - < CO [Fe(H 2 O) 6 ] 2+ (t 2g ) 4 (e g ) 2 [Fe(H 2 O) 6 ] 3+ (t 2g ) 3 (e g ) 2
3 Em solução aquosa, os dois íons geram estruturas octaédricas H 2 O >> baixa amplitude para o valor de 0 [Fe(H 2 O) 6 ] ou 3+ I - < Br - < S -2 < SCN - < Cl - < NO 2 - < N 3 - < F - < OH - < C 2 O 4-2 <H 2 O < NCS - < CH 3 CN < py < NH 3 < en < bipy < phen < NO -2 < PPh 3 < CN - < CO [Fe(H 2 O) 6 ] 3+
4 Pense: O que é mais estável (Fe 3+ ou Fe 2+ ) em um ambiente com O 2 abundante - Potencias padrão de redução [Fe(H 2 O) 6 ] 3+ + e - [Fe(H 2 O) 6 ] 2+ E 0 = + 0,77 V LEMBRE>> E o se refere ao potencial padrão de redução (em relação ao H 2 ) H 2 2H + + 2e - E 0 = 0,00 V PENSE>> O íon Fe 2+ é estável em um ambiente que possui O 2 (dissolvido ou no ar)? O 2 + 4H + + 2e - 2 H 2 O E 0 = + 1,23 V >> A oxidação do Fe 2+ é espontânea: 2 [Fe(H 2 O) 6 ] 2+ 2 [Fe(H + 2e - 2 O) 6 ] 3+ E 0 = - 0,77 V O 2 + 4H + + 2e - 2 H 2 O E 0 = + 1,23 V E = + 0,46 V
5 Durante a oxidação de Fe 2+ em meio aquoso, ocorre a formação de vários intermediários que são muito importantes em sistemas biológicos Fe 2+ + O 2 + H + Fe 3+ + H-O-O. H-O-O. + Fe 2+ + H + H-O-O-H + Fe 3+ H-O-O-H + Fe 2+ + H + HO. + H 2 O + Fe 3+ Na prática, a oxidação em meio ácido é lenta, mas se o ph é elevado, há um momento em que o Fe 2 O 3 hidratado precipita (note que se trata de Fe 3+ ) e a redução ocorre mais rapidamente Fe 2 O 3.xH 2 >> mais simplificadamente podemos pensar que se forma Fe(OH) 3
6 Diagrama de Pourbaix ( Diferentes espécies de Fe em função do ph da solução aquosa e do potencial padrão de redução) Shriver & Atikins, pag. 181
7 Há muito tempo não havia O 2 abundante na atmosfera A maioria do Ferro estava disponível como Fe 2+ que é relativamente solúvel em ph 7,0 Cianobactérias fizeram fotossíntese, levando ao acúmulo de O 2 na atmosfera e o Fe 2+ disponível foi sendo progressivamente oxidado Evolução da disponibilidade de O 2 no planeta Terra
8 Hoje, um grande problema dos seres vivos é obter íons Ferro para suas vias metabólicas, devido a baixa solubilidade do Fe 3+ em ph 7,0 Fe(OH) 3 Fe 3+ + OH - Fe(OH) 2 Fe 2+ + OH -
9 Elemento água do mar plasma sanguíneo citoplasma Na > < 10-2 K < 10-1 Mg > Ca > Fe (Fe 3+ ) (Fe 3+ ) 10-2 (Fe 2+ ) Zn Cu (Cu 2+ ) < (Cu 2+ ) Mn
10 Algumas questões importantes sobre os íons Ferro em sistemas biológicos 1. Como os íons abundantes Fe 3+ que ocorrem na forma insolúvel são transportados para o interior das células >> Quelantes eficientes: por exemplo >> SIDERÓFOROS 2. Controle dos estados de oxidação (Fe 3+ /Fe 2+ ) >> muitos sistemas celulares apresentam ação redox 3. Acidificação pode solucionar parte do problema de solubilidade de Fe 3+, pois Fe 3+ é significativamente mais solúvel em ph baixo >> ácidos orgânicos como cítrico e oxálico Lembre>> Fe 2+ pode ser muito tóxico para as células Fe 2+ + O 2 + H + Fe 3+ + H-O-O. H-O-O. + Fe 2+ + H + H-O-O-H + Fe 3+ H-O-O-H + Fe 2+ + H + HO. + H 2 O + Fe 3+
11 Sideróforos >> Quelantes eficientes de íons Fe 3+ Sideróforo do tipo catecolato: Enterobactina Os prótons fenólicos estão ionizados e formam uma estrutura Octaédrica Fe 3+ + EntBac [Fe(EntBac)] 3- K = 10 52
12 No interior da célula, o Fe 3+ pode ser reduzido (ação de redutases) e a afinidade de Fe 2+ pela enterobactina é muito menor, além de Fe 2+ se mais solúvel em sistemas aquosos
13 Sideróforos do tipo hidroxamato Íon Fe 3+ complexado na forma octaédrica
14 Proteínas transportadoras de Fe 3+ Várias proteínas que são estruturalmente similares: Transferrinas Sorotransferrina (soro sanguíneo) Ovotransferrina (clara do ovo) Lactotransferrina (leite)
15 K = aprox Sítio de complexação da transferrina Note que a proteína depende da inclusão de um Carbonato externo, mas há um sítio de ligação específico para isso
16 Pense: Como a célula pode usar a transferrina como transportador de Fe 3+? >> Note que o sítio de complexação possui vários ligantes com O - Receptor de transferrina preso à membrana plasmática Qual seria o efeito da acidificação neste sítio de complexação?
17 Considere pkas aproximados para a espécie contendo Fe 3+ como: Tyr 192 e Tyr 92 = 7.4 Asp 60 = 6.3 Hist 253 = 6.7 CO 3 2- = 8.0 e 6.0 Qual seria a situação em ph 7,4 (extracelular) e 5,0 (interior do endossomo?)
18 Ferritina: uma proteína que armazena Ferro na célula Íons Fe3+ na forma de óxido hidratado são envoltos pela molécula proteica: - Até 4500 átomos de Ferro/molécula proteica, cuja massa molar da apoproteína (sem o Ferro) é de kda Se supõe que o transporte para o exterior envolva a redução à forma mais solúvel do Ferro (Fe 2+ )
19 Próxima aula: Transporte de Oxigênio e Sistemas envolvidos na transferência de elétrons Shriver & Atikins, cap. 26
citoplasma Elemento água do mar plasma sanguíneo Fe (Fe 3+ ) (Fe 3+ ) 10-2 (Fe 2+ )
 Transporte e armazenagem seletiva de Ferro Shriver & Atikins, cap. 26 Elemento água do mar plasma sanguíneo Na > 10-1 10-1 < 10-2 K 10-2 10-3 < 10-1 citoplasma Mg > 10-2 10-3 10-3 Ca > 10-3 10-3 10-7 Fe
Transporte e armazenagem seletiva de Ferro Shriver & Atikins, cap. 26 Elemento água do mar plasma sanguíneo Na > 10-1 10-1 < 10-2 K 10-2 10-3 < 10-1 citoplasma Mg > 10-2 10-3 10-3 Ca > 10-3 10-3 10-7 Fe
Elemento água do mar plasma sanguíneo. citoplasma
 Íons metálicos em sistemas biológicos Shriver & Atikins, pag 733-790 (Capítulo 26) Concentração aproximada de alguns elementos (na forma de íons metálicos) no exterior e interior das células Elemento água
Íons metálicos em sistemas biológicos Shriver & Atikins, pag 733-790 (Capítulo 26) Concentração aproximada de alguns elementos (na forma de íons metálicos) no exterior e interior das células Elemento água
Química Bio-inorgânica - 1 o semestre 2018 Prof. André Ferraz
 Química Bio-inorgânica - 1 o semestre 2018 Prof. André Ferraz Cronograma 2018 >> ver edisciplinas.usp.br Aspectos formais Avaliação: 4 Provas escritas: (2 para compor P1 e 2 para compor P2) Nota final
Química Bio-inorgânica - 1 o semestre 2018 Prof. André Ferraz Cronograma 2018 >> ver edisciplinas.usp.br Aspectos formais Avaliação: 4 Provas escritas: (2 para compor P1 e 2 para compor P2) Nota final
Concentração aproximada de alguns elementos (na forma de íons metálicos) no exterior e interior das células -
 Concentração aproximada de alguns elementos (na forma de íons metálicos) no exterior e interior das células - sistemas de transporte de íons metálicos Elemento água do mar plasma sanguíneo citoplasma Na
Concentração aproximada de alguns elementos (na forma de íons metálicos) no exterior e interior das células - sistemas de transporte de íons metálicos Elemento água do mar plasma sanguíneo citoplasma Na
), a concentração interna na célula é relativamente elevada (da ordem de 10-3 mol/l).
 Íons metálicos em sistemas biológicos Shriver & Atikins, cap. 26 No interior de uma célula as concentrações de íons metálicos são significativamente diferentes daquelas observadas no meio externo aonde
Íons metálicos em sistemas biológicos Shriver & Atikins, cap. 26 No interior de uma célula as concentrações de íons metálicos são significativamente diferentes daquelas observadas no meio externo aonde
Elementos (metais) relevantes em sistemas biológicos (complexos dos metais do bloco "d", Shiver & Atkins, p. 481)
 Elementos (metais) relevantes em sistemas biológicos (complexos dos metais do bloco "d", Shiver & Atkins, p. 481) Estudaremos estes elementos com certo detalhe: Mn, Fe, Cu, Zn Na, K e Ca serão estudados
Elementos (metais) relevantes em sistemas biológicos (complexos dos metais do bloco "d", Shiver & Atkins, p. 481) Estudaremos estes elementos com certo detalhe: Mn, Fe, Cu, Zn Na, K e Ca serão estudados
Pense: Como a teoria do campo cristalino explicaria cátions metálicos que apresentam estrutura tetraédrica??? Há complexos que contém cátions do
 Pense: Como a teoria do campo cristalino explicaria cátions metálicos que apresentam estrutura tetraédrica??? Há complexos que contém cátions do grupo "d" que possuem somente 4 ligantes distribuídos nas
Pense: Como a teoria do campo cristalino explicaria cátions metálicos que apresentam estrutura tetraédrica??? Há complexos que contém cátions do grupo "d" que possuem somente 4 ligantes distribuídos nas
PROVA DE CONHECIMENTO EM QUÍMICA INORGÂNICA INSTRUÇÕES
 Código do Aluno: PROVA DE CONHECIMENTO EM QUÍMICA INORGÂNICA 2 o SEMESTRE DE 2017 Leia atentamente a prova. INSTRUÇÕES DESLIGUE os seus aparelhos eletrônicos durante a prova (celular, tablet etc.). CANDIDATOS
Código do Aluno: PROVA DE CONHECIMENTO EM QUÍMICA INORGÂNICA 2 o SEMESTRE DE 2017 Leia atentamente a prova. INSTRUÇÕES DESLIGUE os seus aparelhos eletrônicos durante a prova (celular, tablet etc.). CANDIDATOS
Processos catalíticos mediados por enzimas que contém metais
 Processos catalíticos mediados por enzimas que contém metais Shriver e Atkins, cap 26 Catálise ácido-base Pense: muitas reações catalisadas por ácidos ou bases requerem concentrações de H + ou de OH -
Processos catalíticos mediados por enzimas que contém metais Shriver e Atkins, cap 26 Catálise ácido-base Pense: muitas reações catalisadas por ácidos ou bases requerem concentrações de H + ou de OH -
PROVA DE CONHECIMENTO EM QUÍMICA INORGÂNICA INSTRUÇÕES
 Código do Aluno: PROVA DE CONHECIMENTO EM QUÍMICA INORGÂNICA 1 o SEMESTRE DE 2018 Leia atentamente a prova. INSTRUÇÕES DESLIGUE os seus aparelhos eletrônicos durante a prova (celular, tablet etc.). CANDIDATOS
Código do Aluno: PROVA DE CONHECIMENTO EM QUÍMICA INORGÂNICA 1 o SEMESTRE DE 2018 Leia atentamente a prova. INSTRUÇÕES DESLIGUE os seus aparelhos eletrônicos durante a prova (celular, tablet etc.). CANDIDATOS
Elementos do bloco "d" Atkins, Princípios de química, Cap 16, p ; ou Shriver & Atkins, p ) Mn, Fe, Cu, Zn e Co
 Elementos do bloco "d" Atkins, Princípios de química, Cap 16, p.691-704; ou Shriver & Atkins, p. 481-512) Íons metálicos mais relevantes em sistemas biológicos: Mn, Fe, Cu, Zn e Co Na, K e Ca serão estudados
Elementos do bloco "d" Atkins, Princípios de química, Cap 16, p.691-704; ou Shriver & Atkins, p. 481-512) Íons metálicos mais relevantes em sistemas biológicos: Mn, Fe, Cu, Zn e Co Na, K e Ca serão estudados
HF (g) + H 2 O (l) H 3 O + (aq) + F - (aq) NH 3 (g) + H 2 O (l) NH 4+ (aq) + OH - (aq) Ácidos e bases (Shriver & Atkins, p.
 Ácidos e bases (Shriver & Atkins, p.133-162) Ácidos e bases, segundo a teoria de Bronsted Ácidos de Bronsted >> doadores de prótons Bases de Bronsted >> receptores de prótons Exemplos HF (g) + H 2 O (l)
Ácidos e bases (Shriver & Atkins, p.133-162) Ácidos e bases, segundo a teoria de Bronsted Ácidos de Bronsted >> doadores de prótons Bases de Bronsted >> receptores de prótons Exemplos HF (g) + H 2 O (l)
Processos catalíticos mediados por enzimas que contém metais
 Processos catalíticos mediados por enzimas que contém metais Shriver e Atkins, cap 26 Catálise ácido-base Pense: muitas reações catalisadas por ácidos ou bases requerem concentrações de H + ou de OH -
Processos catalíticos mediados por enzimas que contém metais Shriver e Atkins, cap 26 Catálise ácido-base Pense: muitas reações catalisadas por ácidos ou bases requerem concentrações de H + ou de OH -
Reações Redox Número de Oxidação Semi-Reações
 Química Geral e Inorgânica QGI0001 Eng a. de Produção e Sistemas Prof a. Dr a. Carla Dalmolin Reações Redox Número de Oxidação Semi-Reações Reações Redox Reações onde ocorre a transferência de elétrons
Química Geral e Inorgânica QGI0001 Eng a. de Produção e Sistemas Prof a. Dr a. Carla Dalmolin Reações Redox Número de Oxidação Semi-Reações Reações Redox Reações onde ocorre a transferência de elétrons
Reações em Soluções Aquosas
 Reações em Soluções Aquosas Classificação Reações sem transferência de elétrons: Reações de precipitação; Reações de neutralização. Reações com transferência de elétrons: Reações de oxirredução. Reações
Reações em Soluções Aquosas Classificação Reações sem transferência de elétrons: Reações de precipitação; Reações de neutralização. Reações com transferência de elétrons: Reações de oxirredução. Reações
+ e - + H + H-O-O. H-O-O. + e - + H + H-O-O-H H-O-O-H + e - + H + HO. + H 2. O + Fe 3+
 Catálise baseada em enzimas que contém íons de Ferro Enzimas que atuam sobre H 2 O 2 Peróxido de hidrogênio é comumente formado em reações que envolvem a redução de O 2 em sistemas biológicos. O H 2 O
Catálise baseada em enzimas que contém íons de Ferro Enzimas que atuam sobre H 2 O 2 Peróxido de hidrogênio é comumente formado em reações que envolvem a redução de O 2 em sistemas biológicos. O H 2 O
O grupo responsável pelo transporte de O 2 é uma porfirina lidada à cadeia proteica com um átomo de Fe 2+ quelado
 Transporte de Oxigênio Shriver & Atikins, cap. 26 Mioglobina é uma proteína de baixa massa molar (17 kda) presente nos tecidos musculares de mamíferos que apresenta a função de transportar O 2 O grupo
Transporte de Oxigênio Shriver & Atikins, cap. 26 Mioglobina é uma proteína de baixa massa molar (17 kda) presente nos tecidos musculares de mamíferos que apresenta a função de transportar O 2 O grupo
. (Um agente oxidante comumente formado nas células aeróbias)
 Pense: Qual seria a distribuição de elétrons no íon superóxi-ânion? O 2. (Um agente oxidante comumente formado nas células aeróbias) Onde estudar?? Atkins e Jones, Princípios de Química, Cap. 3>> p. 93-131
Pense: Qual seria a distribuição de elétrons no íon superóxi-ânion? O 2. (Um agente oxidante comumente formado nas células aeróbias) Onde estudar?? Atkins e Jones, Princípios de Química, Cap. 3>> p. 93-131
Profa Alessandra Barone.
 Profa Alessandra Barone www.profbio.com.br Bioenergética Parte da bioquímica que trata do estudo dos fenômenos energéticos nos seres vivos, bem como sua forma de obtenção, armazenamento, mobilização e
Profa Alessandra Barone www.profbio.com.br Bioenergética Parte da bioquímica que trata do estudo dos fenômenos energéticos nos seres vivos, bem como sua forma de obtenção, armazenamento, mobilização e
UNIVERSIDADE FEDERAL DE PELOTAS CENTRO DE CIÊNCIAS QUÍMICAS, FARMACÊUTICAS E DE ALIMENTOS PROGRAMA DE PÓS-GRADUAÇÃO EM QUÍMICA
 PROVA DE FÍSICO-QUÍMICA - 2017/02 Questão 1: Um mol de CO 2 ocupa um volume de 1,32 L e temperatura de 48ºC. Calcule a pressão do sistema supondo em a) um sistema ideal, b) um sistema real e em c) diga
PROVA DE FÍSICO-QUÍMICA - 2017/02 Questão 1: Um mol de CO 2 ocupa um volume de 1,32 L e temperatura de 48ºC. Calcule a pressão do sistema supondo em a) um sistema ideal, b) um sistema real e em c) diga
Espectro eletromagnético revisando. região do UV-Visível. aprox 360 nm aprox 900 nm aprox 100 nm
 Espectro eletromagnético revisando região do UV-Visível aprox 360 nm aprox 900 nm aprox 100 nm Ondas eletromagnéticas podem ser descritas por uma das 3 propriedades físicas: frequência (f); comprimento
Espectro eletromagnético revisando região do UV-Visível aprox 360 nm aprox 900 nm aprox 100 nm Ondas eletromagnéticas podem ser descritas por uma das 3 propriedades físicas: frequência (f); comprimento
MÓDULO 2 - METABOLISMO. Bianca Zingales IQ-USP
 MÓDULO 2 - METABOLISMO Bianca Zingales IQ-USP INTRODUÇÃO AO METABOLISMO CARACTERÍSTICAS DO SER VIVO 1- AUTO-REPLICAÇÃO Capacidade de perpetuação da espécie 2- TRANSFORMAÇÃO DE ENERGIA O ser vivo extrai
MÓDULO 2 - METABOLISMO Bianca Zingales IQ-USP INTRODUÇÃO AO METABOLISMO CARACTERÍSTICAS DO SER VIVO 1- AUTO-REPLICAÇÃO Capacidade de perpetuação da espécie 2- TRANSFORMAÇÃO DE ENERGIA O ser vivo extrai
FERRO. Mestrando: Ricardo Murilo Zanetti
 FERRO Mestrando: Ricardo Murilo Zanetti Universidade Federal do Paraná Departamento de Solos e Engenharia Agrícola Disciplina: Nutrição de Plantas Prof.: Volnei Pauletti Curitiba Novembro/2010 2 Ferro
FERRO Mestrando: Ricardo Murilo Zanetti Universidade Federal do Paraná Departamento de Solos e Engenharia Agrícola Disciplina: Nutrição de Plantas Prof.: Volnei Pauletti Curitiba Novembro/2010 2 Ferro
QUI 153 Química Analítica IV. Volumetria de Complexação Parte I
 Universidade Federal de Juiz de Fora (UFJF) Instituto de Ciências Exatas Depto. de Química QUI 15 Química Analítica IV Volumetria de Complexação Parte I Lilian Silva Juiz de Fora, 016 Titulações Complexométricas
Universidade Federal de Juiz de Fora (UFJF) Instituto de Ciências Exatas Depto. de Química QUI 15 Química Analítica IV Volumetria de Complexação Parte I Lilian Silva Juiz de Fora, 016 Titulações Complexométricas
PMT AULAS 1 E 2 Augusto Camara Neiva. PMT Augusto Neiva
 PMT3130 2017 - AULAS 1 E 2 Augusto Camara Neiva 1 2 3 4 AS AULAS NÃO SEGUIRÃO LINEARMENTE A APOSTILA HOJE: ELETROQUÍMICA 5 MOLÉCULA DE ÁGUA A molécula de água é polar e, portanto, a água pode alojar íons
PMT3130 2017 - AULAS 1 E 2 Augusto Camara Neiva 1 2 3 4 AS AULAS NÃO SEGUIRÃO LINEARMENTE A APOSTILA HOJE: ELETROQUÍMICA 5 MOLÉCULA DE ÁGUA A molécula de água é polar e, portanto, a água pode alojar íons
Reações envolvendo substâncias em solução aquosa: (reações por via úmida) e reações por via seca (substâncias não dissolvidas em solventes)
 Reações envolvendo substâncias em solução aquosa: (reações por via úmida) e reações por via seca (substâncias não dissolvidas em solventes) OBJETIVO: é possível fazer generalizações a respeito da ocorrência
Reações envolvendo substâncias em solução aquosa: (reações por via úmida) e reações por via seca (substâncias não dissolvidas em solventes) OBJETIVO: é possível fazer generalizações a respeito da ocorrência
OXIDAÇÕES BIOLÓGICAS: Cadeia respiratória e fosforilação oxidativa
 OXIDAÇÕES BIOLÓGICAS: Cadeia respiratória e fosforilação oxidativa Metabolismo: integração entre catabolismo e anabolismo Assimilação ou processamento da mat. Orgânica Síntese de Substâncias Estágio 1
OXIDAÇÕES BIOLÓGICAS: Cadeia respiratória e fosforilação oxidativa Metabolismo: integração entre catabolismo e anabolismo Assimilação ou processamento da mat. Orgânica Síntese de Substâncias Estágio 1
Aula 10 B Compostos de Coordenação Teorias de ligação Propriedades espectrais e magnéticas
 Aula 10 B Compostos de Coordenação Teorias de ligação Propriedades espectrais e magnéticas QFL 2129 Química Inorgânica 2017 Ana Maria da Costa Ferreira Alfred Werner Estrutura eletrônica dos compostos
Aula 10 B Compostos de Coordenação Teorias de ligação Propriedades espectrais e magnéticas QFL 2129 Química Inorgânica 2017 Ana Maria da Costa Ferreira Alfred Werner Estrutura eletrônica dos compostos
POTENCIAIS DE REDUÇÃO PADRÃO A 25 0 C
 Série Eletroquímica Série eletroquímica: os elementos são dispostos em ordem crescente de potenciais de eletrodo padrão (potenciais padrão de redução). Potenciais de redução podem ser usados na explicação
Série Eletroquímica Série eletroquímica: os elementos são dispostos em ordem crescente de potenciais de eletrodo padrão (potenciais padrão de redução). Potenciais de redução podem ser usados na explicação
2005 by Pearson Education. Capítulo 04
 QUÍMICA A Ciência Central 9ª Edição Capítulo 4 Reações em soluções aquosas e estequiometria de soluções David P. White Propriedades gerais das soluções aquosas Propriedades eletrolíticas As soluções aquosas
QUÍMICA A Ciência Central 9ª Edição Capítulo 4 Reações em soluções aquosas e estequiometria de soluções David P. White Propriedades gerais das soluções aquosas Propriedades eletrolíticas As soluções aquosas
HIDROMETALURGIA E ELETROMETALURGIA. Prof. Carlos Falcão Jr.
 HIDROMETALURGIA E ELETROMETALURGIA Prof. Carlos Falcão Jr. de um sólido em fase aquosa natureza do sólido (iônico, covalente ou metálico) processo: físico químico eletroquímico de redução eletrolítico
HIDROMETALURGIA E ELETROMETALURGIA Prof. Carlos Falcão Jr. de um sólido em fase aquosa natureza do sólido (iônico, covalente ou metálico) processo: físico químico eletroquímico de redução eletrolítico
E-books PCNA. Vol. 1 QUÍMICA ELEMENTAR CAPÍTULO 3 REAÇÕES INORGÂNICAS
 E-books PCNA Vol. 1 QUÍMICA ELEMENTAR CAPÍTULO 3 REAÇÕES INORGÂNICAS 1 QUÍMICA ELEMENTAR CAPÍTULO 3 SUMÁRIO Apresentação -------------------------------------------- 3 Capítulo 3 ------------------------------------------------
E-books PCNA Vol. 1 QUÍMICA ELEMENTAR CAPÍTULO 3 REAÇÕES INORGÂNICAS 1 QUÍMICA ELEMENTAR CAPÍTULO 3 SUMÁRIO Apresentação -------------------------------------------- 3 Capítulo 3 ------------------------------------------------
QUI109 QUÍMICA GERAL (Ciências Biológicas) 3ª aula /
 QUI109 QUÍMICA GERAL (Ciências Biológicas) 3ª aula / 2016-2 Prof. Mauricio X. Coutrim (disponível em: http://professor.ufop.br/mcoutrim) Massa / Mol Massa é uma medida invariável da quantidade de matéria
QUI109 QUÍMICA GERAL (Ciências Biológicas) 3ª aula / 2016-2 Prof. Mauricio X. Coutrim (disponível em: http://professor.ufop.br/mcoutrim) Massa / Mol Massa é uma medida invariável da quantidade de matéria
HF (g) + H 2 O (l) H 3 O + (aq) + F - (aq) NH 3 (g) + H 2 O (l) NH 4+ (aq) + OH - (aq) Ácidos e bases (Atkins, Princípios de Química, cap.
 Ácidos e bases (Atkins, Princípios de Química, cap. 11) Ácidos e bases, segundo a teoria de Bronsted Ácidos de Bronsted >> doadores de prótons Bases de Bronsted >> receptores de prótons Exemplos HF (g)
Ácidos e bases (Atkins, Princípios de Química, cap. 11) Ácidos e bases, segundo a teoria de Bronsted Ácidos de Bronsted >> doadores de prótons Bases de Bronsted >> receptores de prótons Exemplos HF (g)
Bioinorgânica do Manganês. Prof. Fernando R. Xavier
 Bioinorgânica do Manganês Prof. Fernando R. Xavier UDESC 2018 Características químicas gerais O manganês pode acessar 03 (três) estados de oxidação relevantes do ponto de vista biológico: Mn(2+), Mn(3+)
Bioinorgânica do Manganês Prof. Fernando R. Xavier UDESC 2018 Características químicas gerais O manganês pode acessar 03 (três) estados de oxidação relevantes do ponto de vista biológico: Mn(2+), Mn(3+)
Disciplina: Química Geral Docente Responsável: Prof a. Dr a. Luciana Maria Saran. Assunto: Ácidos e Bases de Lewis/ Óxidos/ Sais: classificação
 Disciplina: Química Geral Docente Responsável: Prof a. Dr a. Luciana Maria Saran 1 Assunto: Ácidos e Bases de Lewis/ Óxidos/ Sais: classificação 1. Ácidos e Bases: conceito de Lewis O modelo de Lewis baseia-se
Disciplina: Química Geral Docente Responsável: Prof a. Dr a. Luciana Maria Saran 1 Assunto: Ácidos e Bases de Lewis/ Óxidos/ Sais: classificação 1. Ácidos e Bases: conceito de Lewis O modelo de Lewis baseia-se
QUI109 QUÍMICA GERAL (Ciências Biológicas) 4ª aula /
 QUI109 QUÍMICA GERAL (Ciências Biológicas) 4ª aula / 2016-2 Prof. Mauricio X. Coutrim (disponível em: http://professor.ufop.br/mcoutrim) REAÇÃO EM SOLUÇÃO AQUOSA São reações envolvendo compostos iônicos
QUI109 QUÍMICA GERAL (Ciências Biológicas) 4ª aula / 2016-2 Prof. Mauricio X. Coutrim (disponível em: http://professor.ufop.br/mcoutrim) REAÇÃO EM SOLUÇÃO AQUOSA São reações envolvendo compostos iônicos
1º Questão: Escreva a distribuição eletrônica dos elementos abaixo e determine o número de valência de cada elemento: a) Fe (26):.
 FOLHA DE EXERCÍCIOS CURSO: Otimizado ASS.: Exercícios de Conteúdo DISCIPLINA: Fundamentos de Química e Bioquímica NOME: TURMA: 1SAU 1º Questão: Escreva a distribuição eletrônica dos elementos abaixo e
FOLHA DE EXERCÍCIOS CURSO: Otimizado ASS.: Exercícios de Conteúdo DISCIPLINA: Fundamentos de Química e Bioquímica NOME: TURMA: 1SAU 1º Questão: Escreva a distribuição eletrônica dos elementos abaixo e
PROCESSOS QUÍMICOS INDUSTRIAIS II. (Parte II)
 PROCESSOS QUÍMICOS INDUSTRIAIS II REAÇÕES QUÍMICAS E BALANÇO MATERIAL (Parte II) PROCESSOS UNITÁRIOS REAÇÕES QUÍMICAS Transformações Químicas Aspectos Qualitativos - Tipos de reação - Espécies em solução
PROCESSOS QUÍMICOS INDUSTRIAIS II REAÇÕES QUÍMICAS E BALANÇO MATERIAL (Parte II) PROCESSOS UNITÁRIOS REAÇÕES QUÍMICAS Transformações Químicas Aspectos Qualitativos - Tipos de reação - Espécies em solução
COMPOSIÇÃO QUÍMICA DA CÉLULA. Prof.(a):Monyke Lucena
 COMPOSIÇÃO QUÍMICA DA CÉLULA Prof.(a):Monyke Lucena Composição Química da Célula Substâncias Inorgânicas Substâncias Orgânicas Água Sais Minerais Carboidratos Lipídios Proteínas Ácidos Nucléicos Composição
COMPOSIÇÃO QUÍMICA DA CÉLULA Prof.(a):Monyke Lucena Composição Química da Célula Substâncias Inorgânicas Substâncias Orgânicas Água Sais Minerais Carboidratos Lipídios Proteínas Ácidos Nucléicos Composição
Química Geral I Aula 9 07/04/2016
 Química Geral I Aula 9 07/04/2016 Curso de Química Licenciatura 2016-1 Prof. Udo Eckard Sinks Reações com Formação de Produtos Gasosos, Classificação de Reações em Solução Aquosa, Reações de Oxirredução,
Química Geral I Aula 9 07/04/2016 Curso de Química Licenciatura 2016-1 Prof. Udo Eckard Sinks Reações com Formação de Produtos Gasosos, Classificação de Reações em Solução Aquosa, Reações de Oxirredução,
Reações de oxirredução
 LCE-108 Química Inorgânica e Analítica Reações de oxirredução Wanessa Melchert Mattos 2 Ag + + Cu (s) 2 Ag (s) + Cu 2+ Baseada na transferência de elétrons de uma substância para outra Perde oxigênio e
LCE-108 Química Inorgânica e Analítica Reações de oxirredução Wanessa Melchert Mattos 2 Ag + + Cu (s) 2 Ag (s) + Cu 2+ Baseada na transferência de elétrons de uma substância para outra Perde oxigênio e
UNIVERSIDADE ESTADUAL PAULISTA
 GLICÓLISE Dra. Flávia Cristina Goulart CIÊNCIAS FISIOLÓGICAS UNIVERSIDADE ESTADUAL PAULISTA Campus de Marília flaviagoulart@marilia.unesp.br Glicose e glicólise Via Ebden-Meyerhof ou Glicólise A glicólise,
GLICÓLISE Dra. Flávia Cristina Goulart CIÊNCIAS FISIOLÓGICAS UNIVERSIDADE ESTADUAL PAULISTA Campus de Marília flaviagoulart@marilia.unesp.br Glicose e glicólise Via Ebden-Meyerhof ou Glicólise A glicólise,
PROFESSOR: FELIPE ROSAL DISCIPLINA: QUÍMICA CONTEÚDO: PRATICANDO AULA 1
 PROFESSOR: FELIPE ROSAL DISCIPLINA: QUÍMICA CONTEÚDO: PRATICANDO AULA 1 2 NÚMERO DE OXIDAÇÃO ( Nox ) É o número que mede a CARGA REAL ou APARENTE de uma espécie química 3 OXIDAÇÃO É a perda de elétrons
PROFESSOR: FELIPE ROSAL DISCIPLINA: QUÍMICA CONTEÚDO: PRATICANDO AULA 1 2 NÚMERO DE OXIDAÇÃO ( Nox ) É o número que mede a CARGA REAL ou APARENTE de uma espécie química 3 OXIDAÇÃO É a perda de elétrons
Organelas Transdutoras de Energia: Mitocôndria - Respiração
 Universidade de São Paulo Escola de Engenharia de Lorena Departamento de Biotecnologia Organelas: Cloroplasto e Mitocôndria Obtenção de energia para a célula a partir diferentes fontes: Curso: Engenharia
Universidade de São Paulo Escola de Engenharia de Lorena Departamento de Biotecnologia Organelas: Cloroplasto e Mitocôndria Obtenção de energia para a célula a partir diferentes fontes: Curso: Engenharia
RESPOSTAS ESPERADAS QUÍMICA
 Questão 1 C 4 N 3 OH 7 - massa molar = 113 g mol -1 A concentração de creatinina no exame foi de 1,20 x 10-4 mol L -1, ou 1,20 x 10-5 mol dl -1. Assim, a concentração = 113.000 x 1,20 x 10-5 = 1,36 mg
Questão 1 C 4 N 3 OH 7 - massa molar = 113 g mol -1 A concentração de creatinina no exame foi de 1,20 x 10-4 mol L -1, ou 1,20 x 10-5 mol dl -1. Assim, a concentração = 113.000 x 1,20 x 10-5 = 1,36 mg
REAÇÕES QUÍMICAS. É o fenômeno pelo qual uma ou mais substâncias são transformadas em outra(s).
 REAÇÕES QUÍMICAS É o fenômeno pelo qual uma ou mais substâncias são transformadas em outra(s). Nessas reações chamamos de produtos as substâncias que são produzidas a partir de uma ou mais substâncias
REAÇÕES QUÍMICAS É o fenômeno pelo qual uma ou mais substâncias são transformadas em outra(s). Nessas reações chamamos de produtos as substâncias que são produzidas a partir de uma ou mais substâncias
Conversão de energia Mitocôndria - Respiração
 Universidade de São Paulo (USP) Escola de Engenharia de Lorena (EEL) Engenharia Ambiental Organelas: Cloroplasto e Mitocôndria Obtenção de energia para a célula a partir diferentes fontes: Conversão de
Universidade de São Paulo (USP) Escola de Engenharia de Lorena (EEL) Engenharia Ambiental Organelas: Cloroplasto e Mitocôndria Obtenção de energia para a célula a partir diferentes fontes: Conversão de
Química. A) Considerando-se que o pk a1 é aproximadamente 2, quais os valores de pk a2 e pk a3?
 Química 01. O gráfico a seguir representa a variação do ph de 50 ml de uma solução aquosa de um ácido H 3 X em função do volume de NaOH 0,30 moll -1 adicionado. A) Considerando-se que o pk a1 é aproximadamente
Química 01. O gráfico a seguir representa a variação do ph de 50 ml de uma solução aquosa de um ácido H 3 X em função do volume de NaOH 0,30 moll -1 adicionado. A) Considerando-se que o pk a1 é aproximadamente
25/08/2014 CÉLULAS. Células Procariontes. Raduan. Célula Eucarionte Vegetal. Raduan
 CÉLULAS Células Procariontes Célula Eucarionte Vegetal 1 Célula Eucarionte Animal Núcleo Citoplasma Célula Animal Estrutura geral Membrana citoplasmática Mitocôndrias Retículo endoplasmático Complexo de
CÉLULAS Células Procariontes Célula Eucarionte Vegetal 1 Célula Eucarionte Animal Núcleo Citoplasma Célula Animal Estrutura geral Membrana citoplasmática Mitocôndrias Retículo endoplasmático Complexo de
Determinação de uma Constante de Equilíbrio de Complexação. Prof. Érico Teixeira Neto
 Determinação de uma Constante de Equilíbrio de Complexação Prof. Érico Teixeira Neto 12/08/2011 Sumário: - Complexos Metálicos: Química de Coordenação - A Cor dos Complexos: Teoria do Campo Cristalino
Determinação de uma Constante de Equilíbrio de Complexação Prof. Érico Teixeira Neto 12/08/2011 Sumário: - Complexos Metálicos: Química de Coordenação - A Cor dos Complexos: Teoria do Campo Cristalino
VIII EXAME Questões Objetivas. RESPONDA AS QUESTÕES DE 1 a 30, MARCANDO UMA DAS ALTERNATIVAS DE ACORDO COM O QUE SE PEDE.
 Questões Objetivas RESPONDA AS QUESTÕES DE 1 a 30, MARCANDO UMA DAS ALTERNATIVAS DE ACORDO COM O QUE SE PEDE. Questão 01 (Peso 1) Use seus conhecimentos de estequiometria para dizer qual alternativa está
Questões Objetivas RESPONDA AS QUESTÕES DE 1 a 30, MARCANDO UMA DAS ALTERNATIVAS DE ACORDO COM O QUE SE PEDE. Questão 01 (Peso 1) Use seus conhecimentos de estequiometria para dizer qual alternativa está
Redução e oxidação. Housecroft cap. 8. Oxidação e redução
 Redução e oxidação Housecroft cap. 8 Oxidação e redução A oxidação refere-se ao ganho de oxigênio, perda de hidrogênio ou a perda de um ou mais elétrons A redução refere-se à perda de oxigênio, ganho de
Redução e oxidação Housecroft cap. 8 Oxidação e redução A oxidação refere-se ao ganho de oxigênio, perda de hidrogênio ou a perda de um ou mais elétrons A redução refere-se à perda de oxigênio, ganho de
UFSC. Química (Amarela) Reposta: 70
 Reposta: 70 01. Incorreta. Ferroso é o íon Fe +2 e sulfato é o íon SO 4 2. Logo a fórmula é Fe +2 SO 4 2 = FeSO 4 02. Correta. 04. Correta. 08. Incorreta. O átomo central é o enxofre que forma duas ligações
Reposta: 70 01. Incorreta. Ferroso é o íon Fe +2 e sulfato é o íon SO 4 2. Logo a fórmula é Fe +2 SO 4 2 = FeSO 4 02. Correta. 04. Correta. 08. Incorreta. O átomo central é o enxofre que forma duas ligações
O QUE É O METABOLISMO????
 O QUE É O METABOLISMO???? Metabolismo é a somatória de todas as transformações químicas de uma célula ou organismo Uma atividade celular altamente coordenada na qual diversos sistemas multienzimáticos
O QUE É O METABOLISMO???? Metabolismo é a somatória de todas as transformações químicas de uma célula ou organismo Uma atividade celular altamente coordenada na qual diversos sistemas multienzimáticos
Reações Químicas. Principais Tipos de Reações. Reações de combinação e decomposição. Combustão ao ar. Combinação. Decomposição
 Reações Químicas Principais Tipos de Reações Reações de síntese ou combinação Combinação Decomposição Reações de análise ou decomposição Reações de deslocamento e de troca Reações de neutralização (ácido-base)
Reações Químicas Principais Tipos de Reações Reações de síntese ou combinação Combinação Decomposição Reações de análise ou decomposição Reações de deslocamento e de troca Reações de neutralização (ácido-base)
O QUE É O METABOLISMO????
 O QUE É O METABOLISMO???? Metabolismo é a somatória de todas as transformações químicas de uma célula ou organismo Uma atividade celular altamente coordenada na qual diversos sistemas multienzimáticos
O QUE É O METABOLISMO???? Metabolismo é a somatória de todas as transformações químicas de uma célula ou organismo Uma atividade celular altamente coordenada na qual diversos sistemas multienzimáticos
Reacções de oxidação-redução (reacções redox)
 Reacções de oxidação-redução (reacções redox) Reacções de oxidação-redução (reacções redox) Reacções redox: reacções que envolvem transferência de electrões oxidação: perda de e - redução: ganho de e -
Reacções de oxidação-redução (reacções redox) Reacções de oxidação-redução (reacções redox) Reacções redox: reacções que envolvem transferência de electrões oxidação: perda de e - redução: ganho de e -
1.1 Conceitos em nutrição de plantas. Outros elementos químicos de interesse na nutrição vegetal.
 1. CONCEITOS 1.1 Conceitos em nutrição de plantas. 1.2 Conceito de nutrientes e critérios de essencialidade. 1.3 Composição relativa das plantas. Outros elementos químicos de interesse na nutrição vegetal.
1. CONCEITOS 1.1 Conceitos em nutrição de plantas. 1.2 Conceito de nutrientes e critérios de essencialidade. 1.3 Composição relativa das plantas. Outros elementos químicos de interesse na nutrição vegetal.
Redox: objectivos principais
 Redox: objectivos principais Definir reacções redox e acertar equações de reacções redox usando o método das semireacções. Escrever o diagrama de uma, dada a equação da reacção redox e viceversa. Calcular
Redox: objectivos principais Definir reacções redox e acertar equações de reacções redox usando o método das semireacções. Escrever o diagrama de uma, dada a equação da reacção redox e viceversa. Calcular
PROCESSO SELETIVO DE TRANSFERÊNCIA EXTERNA CADERNO DE PROVAS
 PROCESSO SELETIVO DE TRANSFERÊNCIA EXTERNA 20/10/2013 INSTRUÇÕES CADERNO DE PROVAS 1. Confira, abaixo, seu nome e número de inscrição. Confira, também, o curso e a série correspondentes à sua inscrição.
PROCESSO SELETIVO DE TRANSFERÊNCIA EXTERNA 20/10/2013 INSTRUÇÕES CADERNO DE PROVAS 1. Confira, abaixo, seu nome e número de inscrição. Confira, também, o curso e a série correspondentes à sua inscrição.
PROCESSO DE SELEÇÃO: primeiro semestre de 2009
 UNIVERSIDADE FEDERAL DO PARANÁ DEPARTAMENTO DE QUÍMICA PROGRAMA DE PÓS-GRADUAÇÃO EM QUÍMICA PROVA DE INGRESSO NO CURSO DE MESTRADO ACADÊMICO EM QUÍMICA PROCESSO DE SELEÇÃO: primeiro semestre de 2009 Fevereiro
UNIVERSIDADE FEDERAL DO PARANÁ DEPARTAMENTO DE QUÍMICA PROGRAMA DE PÓS-GRADUAÇÃO EM QUÍMICA PROVA DE INGRESSO NO CURSO DE MESTRADO ACADÊMICO EM QUÍMICA PROCESSO DE SELEÇÃO: primeiro semestre de 2009 Fevereiro
Reações Químicas GERAL
 Reações Químicas GERAL É o processo no qual 1 ou mais substâncias (reagentes) se transformam em 1 ou mais substâncias novas (produtos). Formação de ferrugem Combustão de um palito de fósforo Efervescência
Reações Químicas GERAL É o processo no qual 1 ou mais substâncias (reagentes) se transformam em 1 ou mais substâncias novas (produtos). Formação de ferrugem Combustão de um palito de fósforo Efervescência
Ácidos e Bases, intermediários de reações orgânicas. Profa. Alceni Augusta Werle Profa. Tania Marcia do Sacramento Melo
 Ácidos e Bases, intermediários de reações orgânicas Parte I Profa. Alceni Augusta Werle Profa. Tania Marcia do Sacramento Melo 1-Introdução Revisão da teoria de ácidos de Arrhenius, Brönsted-Lowry e de
Ácidos e Bases, intermediários de reações orgânicas Parte I Profa. Alceni Augusta Werle Profa. Tania Marcia do Sacramento Melo 1-Introdução Revisão da teoria de ácidos de Arrhenius, Brönsted-Lowry e de
Vamos iniciar o estudo da unidade fundamental que constitui todos os organismos vivos: a célula.
 Aula 01 Composição química de uma célula O que é uma célula? Vamos iniciar o estudo da unidade fundamental que constitui todos os organismos vivos: a célula. Toda célula possui a capacidade de crescer,
Aula 01 Composição química de uma célula O que é uma célula? Vamos iniciar o estudo da unidade fundamental que constitui todos os organismos vivos: a célula. Toda célula possui a capacidade de crescer,
Reações com transferência de elétrons: oxirredução
 Reações com transferência de elétrons: oxirredução Introdução à Química II Prof. Edson Nossol Uberlândia, 06/10/2017 Número de oxidação: número de cargas que um átomo teria em uma molécula (em um composto
Reações com transferência de elétrons: oxirredução Introdução à Química II Prof. Edson Nossol Uberlândia, 06/10/2017 Número de oxidação: número de cargas que um átomo teria em uma molécula (em um composto
SERVIÇO PÚBLICO FEDERAL MINISTÉRIO DA EDUCAÇÃO UNIVERSIDADE FEDERAL DE UBERLÂNDIA
 QUESTÕES 1 a 4 - OBRIGATÓRIAS 1ª Questão (7,5 pontos) obrigatória a) (2,5 pontos) b) Geometria molecular angular. (2,5 pontos) c) Na molécula de oxigênio (O 2 ) a ligação entre os oxigênios é dupla (ordem
QUESTÕES 1 a 4 - OBRIGATÓRIAS 1ª Questão (7,5 pontos) obrigatória a) (2,5 pontos) b) Geometria molecular angular. (2,5 pontos) c) Na molécula de oxigênio (O 2 ) a ligação entre os oxigênios é dupla (ordem
Reações de identificação de metais de
 A maioria dos metais de transição forma compostos coloridos, e esta propriedade é empregada em suas identificações. Os íons Al 3, Cr 3 e Fe 3 são precipitados como hidróxidos, enquanto que os demais são
A maioria dos metais de transição forma compostos coloridos, e esta propriedade é empregada em suas identificações. Os íons Al 3, Cr 3 e Fe 3 são precipitados como hidróxidos, enquanto que os demais são
A teoria dos orbitais moleculares
 A teoria dos orbitais moleculares Qualitativamente, indica regiões do espaço (entre os átomos que formam uma molécula) nas quais a probabilidade de encontrar os elétrons é máxima. Na mecânica quântica,
A teoria dos orbitais moleculares Qualitativamente, indica regiões do espaço (entre os átomos que formam uma molécula) nas quais a probabilidade de encontrar os elétrons é máxima. Na mecânica quântica,
MÓDULO 2 - METABOLISMO. Bianca Zingales IQ-USP
 MÓDULO 2 - METABOLISMO Bianca Zingales IQ-USP INTRODUÇÃO AO METABOLISMO CARACTERÍSTICAS DO SER VIVO 1- AUTO-REPLICAÇÃO Capacidade de perpetuação da espécie 2- TRANSFORMAÇÃO DE ENERGIA O ser vivo extrai
MÓDULO 2 - METABOLISMO Bianca Zingales IQ-USP INTRODUÇÃO AO METABOLISMO CARACTERÍSTICAS DO SER VIVO 1- AUTO-REPLICAÇÃO Capacidade de perpetuação da espécie 2- TRANSFORMAÇÃO DE ENERGIA O ser vivo extrai
Estudo das reações químicas para geração de energia.
 Estudo das reações químicas para geração de energia. Células Galvânicas (Pilhas e Baterias): Conversão de Energia Química em Energia Elétrica (Reações Espontâneas) Células Eletrolíticas: Conversão de Energia
Estudo das reações químicas para geração de energia. Células Galvânicas (Pilhas e Baterias): Conversão de Energia Química em Energia Elétrica (Reações Espontâneas) Células Eletrolíticas: Conversão de Energia
Reações com transferência de elétrons: oxirredução
 Reações com transferência de elétrons: oxirredução Química Geral Prof. Edson Nossol Uberlândia, 19/05/2016 Número de oxidação: número de cargas que um átomo teria em uma molécula (em um composto iônico)
Reações com transferência de elétrons: oxirredução Química Geral Prof. Edson Nossol Uberlândia, 19/05/2016 Número de oxidação: número de cargas que um átomo teria em uma molécula (em um composto iônico)
PROTEÍNAS GLOBULARES E
 Universidade Federal do Rio de Janeiro Centro de Ciências da Saúde Instituto de Bioquímica Médica Curso: Enfermagem e Obstetrícia PROTEÍNAS GLOBULARES E TRANSPORTE DE O 2 TRANSPORTE DE O 2 O 2 é pouco
Universidade Federal do Rio de Janeiro Centro de Ciências da Saúde Instituto de Bioquímica Médica Curso: Enfermagem e Obstetrícia PROTEÍNAS GLOBULARES E TRANSPORTE DE O 2 TRANSPORTE DE O 2 O 2 é pouco
Ácidos e Bases. Funções Inorgânicas
 Ácidos e Bases Funções Inorgânicas Funções Inorgânicas As substâncias podem ser classificadas em duas classes: Substâncias orgânicas: aquelas que contém carbono. Substâncias inorgânicas: aquelas formadas
Ácidos e Bases Funções Inorgânicas Funções Inorgânicas As substâncias podem ser classificadas em duas classes: Substâncias orgânicas: aquelas que contém carbono. Substâncias inorgânicas: aquelas formadas
Reações com transferência de elétrons: oxirredução
 Reações com transferência de elétrons: oxirredução Química Geral Prof. Edson Nossol Uberlândia, 09/09/2016 Número de oxidação: número de cargas que um átomo teria em uma molécula (em um composto iônico)
Reações com transferência de elétrons: oxirredução Química Geral Prof. Edson Nossol Uberlândia, 09/09/2016 Número de oxidação: número de cargas que um átomo teria em uma molécula (em um composto iônico)
TRABALHO DE BIOLOGIA A Química da Vida
 TRABALHO DE BIOLOGIA A Química da Vida Nomes: Leonardo e Samuel Turma: 103 Para iniciar o estudo das células (citologia) devemos primeiramente ter uma noção das estruturas básicas da célula ou as estruturas
TRABALHO DE BIOLOGIA A Química da Vida Nomes: Leonardo e Samuel Turma: 103 Para iniciar o estudo das células (citologia) devemos primeiramente ter uma noção das estruturas básicas da célula ou as estruturas
Reações Químicas GERAL
 Reações Químicas GERAL É o processo no qual 1 ou mais substâncias (reagentes) se transformam em 1 ou mais substâncias novas (produtos). Formação de ferrugem Equações químicas: representação gráfica, informa
Reações Químicas GERAL É o processo no qual 1 ou mais substâncias (reagentes) se transformam em 1 ou mais substâncias novas (produtos). Formação de ferrugem Equações químicas: representação gráfica, informa
Reações ácido-base. Ácidos. Ácido = substâncias que se ionizam para formar H + em solução (por exemplo, HCl, HNO 3, CH 3 CO 2 H - vinagre).
 Ácidos Ácido = substâncias que se ionizam para formar H + em solução (por exemplo, HCl, HNO 3, CH 3 CO 2 H - vinagre). H + é conhecido como próton Ácidos com um próton ácido são chamados monopróticos (por
Ácidos Ácido = substâncias que se ionizam para formar H + em solução (por exemplo, HCl, HNO 3, CH 3 CO 2 H - vinagre). H + é conhecido como próton Ácidos com um próton ácido são chamados monopróticos (por
Departamento de Química Inorgânica IQ / UFRJ IQG 128 / IQG ELETRÓLISE
 10. ELETRÓLISE I. INTRODUÇÃO Como já mencionado na aula prática de reações de oxirredução, a eletricidade também pode ser usada para realizarmos reações de transferência de elétrons não espontâneas. Por
10. ELETRÓLISE I. INTRODUÇÃO Como já mencionado na aula prática de reações de oxirredução, a eletricidade também pode ser usada para realizarmos reações de transferência de elétrons não espontâneas. Por
QUI219 QUÍMICA ANALÍTICA (Farmácia) Prof. Mauricio X. Coutrim
 QUI219 QUÍMICA ANALÍTICA (Farmácia) Prof. Mauricio X. Coutrim (mcoutrim@iceb.ufop.br) SOLUÇÕES AQUOSAS Equilíbrios químicos A água e os eletrólitos (solutos que forma íons quando dissolvidos em água):
QUI219 QUÍMICA ANALÍTICA (Farmácia) Prof. Mauricio X. Coutrim (mcoutrim@iceb.ufop.br) SOLUÇÕES AQUOSAS Equilíbrios químicos A água e os eletrólitos (solutos que forma íons quando dissolvidos em água):
Capítulo by Pearson Education
 QUÍMICA A Ciência Central 9ª Edição Aspectos adicionais dos equilíbrios aquosos David P. White O efeito do íon comum A solubilidade de um sal parcialmente solúvel diminui quando um íon comum é adicionado.
QUÍMICA A Ciência Central 9ª Edição Aspectos adicionais dos equilíbrios aquosos David P. White O efeito do íon comum A solubilidade de um sal parcialmente solúvel diminui quando um íon comum é adicionado.
FACULDADES OSWALDO CRUZ QUÍMICA GERAL E INORGÂNICA CURSO BÁSICO 1ºS ANOS
 FACULDADES OSWALDO CRUZ QUÍMICA GERAL E INORGÂNICA CURSO BÁSICO 1ºS ANOS Prezados Alunos Conforme orientação da Diretoria Geral, o reinício das aulas, teoria e laboratório, ocorrerá no dia 17 de agosto.
FACULDADES OSWALDO CRUZ QUÍMICA GERAL E INORGÂNICA CURSO BÁSICO 1ºS ANOS Prezados Alunos Conforme orientação da Diretoria Geral, o reinício das aulas, teoria e laboratório, ocorrerá no dia 17 de agosto.
Qui. Semana. Allan Rodrigues Gabriel Pereira (Renan Micha)
 Semana 4 Allan Rodrigues Gabriel Pereira (Renan Micha) Este conteúdo pertence ao Descomplica. Está vedada a cópia ou a reprodução não autorizada previamente e por escrito. Todos os direitos reservados.
Semana 4 Allan Rodrigues Gabriel Pereira (Renan Micha) Este conteúdo pertence ao Descomplica. Está vedada a cópia ou a reprodução não autorizada previamente e por escrito. Todos os direitos reservados.
LISTA DE EXERCÍCIOS 1
 UNIVERSIDADE DE SÃO PAULO ESCOLA SUPERIOR DE AGRICULTURA LUIZ DE QUEIROZ DEPARTAMENTO DE CIÊNCIAS EXATAS LCE 151 FUNDAMENTOS DE QUÍMICA INORGÂNICA E ANALÍTICA LISTA DE EXERCÍCIOS 1 1. Qual é e como é definida
UNIVERSIDADE DE SÃO PAULO ESCOLA SUPERIOR DE AGRICULTURA LUIZ DE QUEIROZ DEPARTAMENTO DE CIÊNCIAS EXATAS LCE 151 FUNDAMENTOS DE QUÍMICA INORGÂNICA E ANALÍTICA LISTA DE EXERCÍCIOS 1 1. Qual é e como é definida
REAÇÕES DE ÓXIDO-REDUÇÃO
 REAÇÕES DE ÓXIDO-REDUÇÃO A Química Analítica moderna tem por base a medida dos Sinais Analíticos, relacionados às transformações de propriedades dos materiais ao longo de uma Análise Química. Entre estes
REAÇÕES DE ÓXIDO-REDUÇÃO A Química Analítica moderna tem por base a medida dos Sinais Analíticos, relacionados às transformações de propriedades dos materiais ao longo de uma Análise Química. Entre estes
ABSORÇÃO RADICULAR, TRANSPORTE E REDISTRIBUIÇÃO DE NUTRIENTES
 ABSORÇÃO RADICULAR, TRANSPORTE E REDISTRIBUIÇÃO DE NUTRIENTES Prof. Volnei Pauletti Departamento de Solos e Engenharia Agrícola Mestrado em Ciência do Solo vpauletti@ufpr.br CONTATO NUTRIENTE - RAIZ Absorção
ABSORÇÃO RADICULAR, TRANSPORTE E REDISTRIBUIÇÃO DE NUTRIENTES Prof. Volnei Pauletti Departamento de Solos e Engenharia Agrícola Mestrado em Ciência do Solo vpauletti@ufpr.br CONTATO NUTRIENTE - RAIZ Absorção
ABSORÇÃO RADICULAR, TRANSPORTE E REDISTRIBUIÇÃO DE NUTRIENTES
 ABSORÇÃO RADICULAR, TRANSPORTE E REDISTRIBUIÇÃO DE NUTRIENTES Prof. Volnei Pauletti Departamento de Solos e Engenharia Agrícola Mestrado em Ciência do Solo vpauletti@ufpr.br CONTATO NUTRIENTE - RAIZ DEFINIÇÕES
ABSORÇÃO RADICULAR, TRANSPORTE E REDISTRIBUIÇÃO DE NUTRIENTES Prof. Volnei Pauletti Departamento de Solos e Engenharia Agrícola Mestrado em Ciência do Solo vpauletti@ufpr.br CONTATO NUTRIENTE - RAIZ DEFINIÇÕES
12/01/2014. Equilíbrio e volumetria de complexação VOLUMETRIA DE COMPLEXAÇÃO. Reações. M n+ + L y- ML n-y. Composto de Coordenação
 Reações Equilíbrio e volumetria de complexação Profa itória Soares TIPOS Classificação das reações químicas em titulometria volumétrica Reações de neutralização: entre ácidos e bases Ex:NaOHeHCl Reações
Reações Equilíbrio e volumetria de complexação Profa itória Soares TIPOS Classificação das reações químicas em titulometria volumétrica Reações de neutralização: entre ácidos e bases Ex:NaOHeHCl Reações
TEORIAS ÁCIDO BASE. Prof. Cristiano Torres Miranda Disciplina: Química Inorgânica I Turma Q33
 TEORIAS ÁCIDO BASE Prof. Cristiano Torres Miranda Disciplina: Química Inorgânica I Turma Q33 1 Antoine Lavoisier (1776) Humphry Davy (1810) SUMÁRIO Definição de Arrhenius Definição pelo Sistema Solvente
TEORIAS ÁCIDO BASE Prof. Cristiano Torres Miranda Disciplina: Química Inorgânica I Turma Q33 1 Antoine Lavoisier (1776) Humphry Davy (1810) SUMÁRIO Definição de Arrhenius Definição pelo Sistema Solvente
ATIVIDADES PARA SALA. Capítulo 19 QUÍMICA. Métodos de balanceamento de equações químicas. 1? a série Ensino Médio Livro 5? 31
 Resoluções Capítulo 19 Métodos de balanceamento de equações químicas ATIVIDADES PARA SALA 1 B X =? Y =? Z =? W =? I Balanceando o oxigênio (): A 2 HC AC 3 Não se repete no mesmo membro e apresenta maior
Resoluções Capítulo 19 Métodos de balanceamento de equações químicas ATIVIDADES PARA SALA 1 B X =? Y =? Z =? W =? I Balanceando o oxigênio (): A 2 HC AC 3 Não se repete no mesmo membro e apresenta maior
Prova para Classificação de Bolsas 2013. Identificação do Candidato
 PROGRAMA DE PÓS-GRADUAÇÃO EM QUÍMICA DOUTORADO ASSOCIAÇÃO AMPLA UEL/UEPG/UNICENTRO Prova para Classificação de Bolsas 2013 Identificação do Candidato Nome: Data: 07/03/2013. Candidato N o : Prezado (a)
PROGRAMA DE PÓS-GRADUAÇÃO EM QUÍMICA DOUTORADO ASSOCIAÇÃO AMPLA UEL/UEPG/UNICENTRO Prova para Classificação de Bolsas 2013 Identificação do Candidato Nome: Data: 07/03/2013. Candidato N o : Prezado (a)
QUÍMICA PRIMEIRA ETAPA
 QUÍMICA PRIMEIRA ETAPA - 1998 QUESTÃO 01 Uma mistura de hidrogênio, H 2 (g), e oxigênio, O 2 (g), reage, num recipiente hermeticamente fechado, em alta temperatura e em presença de um catalisador, produzindo
QUÍMICA PRIMEIRA ETAPA - 1998 QUESTÃO 01 Uma mistura de hidrogênio, H 2 (g), e oxigênio, O 2 (g), reage, num recipiente hermeticamente fechado, em alta temperatura e em presença de um catalisador, produzindo
Equações fundamentais
 Reacções de oxidação-redução em solução aquosa - Revisão de conceitos - Diagramas de Frost Livro Química Inorgânica Básica Capítulo 4, pag 116 até ao final Equações fundamentais G 0 = - n F E 0 n número
Reacções de oxidação-redução em solução aquosa - Revisão de conceitos - Diagramas de Frost Livro Química Inorgânica Básica Capítulo 4, pag 116 até ao final Equações fundamentais G 0 = - n F E 0 n número
REAÇÕES QUÍMICAS PRODUZINDO CORRENTE ELÉTRICA CORRENTE ELÉTRICA PRODUZINDO REAÇÃO QUÍMICA PROF. RODRIGO BANDEIRA
 REAÇÕES QUÍMICAS PRODUZINDO CORRENTE ELÉTRICA CORRENTE ELÉTRICA PRODUZINDO REAÇÃO QUÍMICA A relação entre as reações químicas e a corrente elétrica é estudada por um ramo da química chamado ELETROQUÍMICA
REAÇÕES QUÍMICAS PRODUZINDO CORRENTE ELÉTRICA CORRENTE ELÉTRICA PRODUZINDO REAÇÃO QUÍMICA A relação entre as reações químicas e a corrente elétrica é estudada por um ramo da química chamado ELETROQUÍMICA
BIOENERGÉTICA. Equipe de Biologia Leonardo da Vinci
 BIOENERGÉTICA Equipe de Biologia Leonardo da Vinci Conceito METABOLISMO ENERGÉTICO Conjunto de reações metabólicas (catabolismo + anabolismo) envolvidas nos processos de transformação de energia. Energia
BIOENERGÉTICA Equipe de Biologia Leonardo da Vinci Conceito METABOLISMO ENERGÉTICO Conjunto de reações metabólicas (catabolismo + anabolismo) envolvidas nos processos de transformação de energia. Energia
3º Trimestre Sala de estudos Química Data: 03/12/18 Ensino Médio 3º ano classe: A_B Profª Danusa Nome: nº
 3º Trimestre Sala de estudos Química Data: 03/12/18 Ensino Médio 3º ano classe: A_B Profª Danusa Nome: nº Conteúdo: FAMERP/UNIFESP (REVISÃO) Questão 01 - (FAMERP SP/2018) A tabela indica a abundância aproximada
3º Trimestre Sala de estudos Química Data: 03/12/18 Ensino Médio 3º ano classe: A_B Profª Danusa Nome: nº Conteúdo: FAMERP/UNIFESP (REVISÃO) Questão 01 - (FAMERP SP/2018) A tabela indica a abundância aproximada
Prática 3 Determinação do Teor de Bicarbonato de Sódio em Comprimidos Efervescentes
 Universidade Federal do ABC Disciplina: Laboratório de Transformações Químicas Prática 3 Determinação do Teor de Bicarbonato de Sódio em Comprimidos Efervescentes Hueder Paulo M. de Oliveira Santo André
Universidade Federal do ABC Disciplina: Laboratório de Transformações Químicas Prática 3 Determinação do Teor de Bicarbonato de Sódio em Comprimidos Efervescentes Hueder Paulo M. de Oliveira Santo André
25/08/2017 CÉLULAS. Células Procariontes. Raduan. Célula Eucarionte Vegetal. Raduan
 CÉLULAS Células Procariontes Célula Eucarionte Vegetal 1 Célula Eucarionte Animal Núcleo Citoplasma Célula Animal Estrutura geral Membrana citoplasmática Mitocôndrias Retículo endoplasmático Complexo de
CÉLULAS Células Procariontes Célula Eucarionte Vegetal 1 Célula Eucarionte Animal Núcleo Citoplasma Célula Animal Estrutura geral Membrana citoplasmática Mitocôndrias Retículo endoplasmático Complexo de
Assimilação de Nutrientes Minerais
 Assimilação de Nutrientes Minerais plantas são organismos fotoautoróficos: todos os compostos orgânicos necessários são formados em seu próprio corpo (macro e micro moléculas) a energia necessária para
Assimilação de Nutrientes Minerais plantas são organismos fotoautoróficos: todos os compostos orgânicos necessários são formados em seu próprio corpo (macro e micro moléculas) a energia necessária para
Metais no Organismo Humano
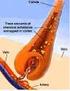 Metais no Organismo Humano Relativamente à necessidade biológica podem classificar-se Metais Essenciais: Metais Tóxicos: sódio, potássio, cálcio, magnésio, ferro, crómio, zinco, cobalto, manganês e níquel.
Metais no Organismo Humano Relativamente à necessidade biológica podem classificar-se Metais Essenciais: Metais Tóxicos: sódio, potássio, cálcio, magnésio, ferro, crómio, zinco, cobalto, manganês e níquel.
