ANEXO I RESUMO DAS CARACTERÍSTICAS DO MEDICAMENTO
|
|
|
- Marco Campelo Cipriano
- 8 Há anos
- Visualizações:
Transcrição
1 ANEXO I RESUMO DAS CARACTERÍSTICAS DO MEDICAMENTO 1
2 1. NOME DO MEDICAMENTO Pradaxa 75 mg cápsulas 2. COMPOSIÇÃO QUALITATIVA E QUANTITATIVA Cada cápsula contém 75 mg de dabigatrano etexilato (sob a forma de mesilato) Excipiente(s) com efeito conhecido: Cada cápsula contém 2 microgramas de amarelo-sol (E110) Lista completa de excipientes, ver secção FORMA FARMACÊUTICA Cápsula Cápsulas com cabeça azul clara opaca e corpo creme opaco, tamanho 2, cheias de péletes amarelados. A cabeça tem impresso o símbolo da Boehringer Ingelheim e o corpo R INFORMAÇÕES CLÍNICAS 4.1 Indicações terapêuticas Prevenção primária de fenómenos tromboembólicos venosos em doentes adultos que foram submetidos a artroplastia eletiva total da anca ou a artroplastia eletiva total do joelho. 4.2 Posologia e modo de administração Posologia Prevenção primária do Tromboembolismo Venoso em cirurgia ortopédica (prevenção primária do TVE em cirurgia ortopédica) Doentes após artroplastia eletiva do joelho A dose recomendada de Pradaxa é 220 mg, uma vez por dia, correspondendo a duas cápsulas de 110 mg. O tratamento deve ser iniciado com uma cápsula única de 110 mg, por via oral, 1 a 4 horas após a conclusão da cirurgia e continuado posteriormente com 2 cápsulas, uma vez por dia, até perfazer um total de 10 dias. Doentes após artroplastia eletiva da anca A dose recomendada de Pradaxa é 220 mg, uma vez por dia, correspondendo a duas cápsulas de 110 mg. O tratamento deve ser iniciado com uma cápsula única de 110 mg, por via oral, 1 a 4 horas após a conclusão da cirurgia e continuado posteriormente com 2 cápsulas, uma vez por dia, até perfazer um total de 28 a 35 dias. 2
3 Para os seguintes grupos, a dose diária recomendada de Pradaxa é de 150 mg tomados uma vez por dia como 2 cápsulas de 75 mg: O tratamento deve ser iniciado, por via oral, até 1-4 horas após a conclusão da cirurgia, com uma única cápsula de 75 mg e continuado com 2 cápsulas uma vez ao dia, até perfazer um total de 10 dias (artroplastia eletiva do joelho) ou dias (artroplastia eletiva da anca): Doentes com compromisso renal moderado (depuração da creatinina, CLCr ml/min) [ver Compromisso renal (prevenção primária do TVE em cirurgia ortopédica)] Doentes que tomam concomitantemente verapamilo, amiodarona, quinidina [ver Utilização concomitante de Pradaxa com inibidores fracos a moderados da glicoproteína-p (gp-p), tais como amiodarona, quinidina ou verapamilo (prevenção primária do TVE em cirurgia ortopédica)] Doentes com idade igual ou superior a 75 anos [ver Idosos (prevenção primária do TVE em cirurgia ortopédica)] Em ambas as cirurgias, se a hemostase não estiver assegurada, o início do tratamento deve ser adiado. No caso do tratamento não ser iniciado no dia da cirurgia, o mesmo deverá iniciar-se com 2 cápsulas, uma vez por dia. Avaliação da função renal (prevenção primária do TEV em cirurgia ortopédica): Em todos os doentes: A função renal deve ser avaliada através do cálculo da depuração da creatinina (CLCr), antes do início do tratamento com Pradaxa, de modo a excluir os doentes com compromisso renal grave (i.e. CLCr < 30 ml/min) (ver secções 4.3, 4.4 e 5.2). Pradaxa está contraindicado em doentes com compromisso grave da função renal. A função renal deve igualmente ser avaliada quando se suspeitar de um declínio da função renal durante o tratamento (ex. hipovolemia, desidratação e em caso de utilização concomitante de determinados medicamentos). O método usado para estimar a função renal (CLCr em ml/min) durante o desenvolvimento clínico do Pradaxa foi o método de Cockcroft-Gault. A fórmula é a seguinte: Para a creatinina em µmol/l: Para a creatinina em mg/dl: 1,23 x (140-idade [anos]) x peso [kg] (x 0,85 se mulher) creatinina sérica [µmol/l] (140- idade [anos]) x peso [kg] (x 0,85 se mulher) 72 x creatinina sérica [mg/dl] Este método está recomendado na avaliação da CLCr dos doentes, antes e durante o tratamento com Pradaxa. Populações especiais Compromisso renal (prevenção primária do TEV em cirurgia ortopédica) O tratamento com Pradaxa em doentes com compromisso renal grave (CLCr < 30 ml/min) é contraindicado (ver secção 4.3). A experiência clínica em doentes com compromisso renal moderado (CLCr ml/min) é limitada. Estes doentes devem ser tratados com precaução. A dose recomendada é 150 mg, uma vez por dia, correspondendo a 2 cápsulas de 75 mg (ver secções 4.4 e 5.1). 3
4 Utilização concomitante de Pradaxa com inibidores fracos a moderados da glicoproteína-p (gp-p), tais como amiodarona, quinidina ou verapamilo (prevenção primária do TEV em cirurgia ortopédica) A dose de Pradaxa deverá ser reduzida para 150 mg, uma vez por dia, correspondendo a 2 cápsulas de 75 mg, em doentes que estejam a receber concomitantemente dabigatrano etexilato e amiodarona, quinidina ou verapamilo (ver secções 4.4 e 4.5). Neste caso, Pradaxa deve ser tomado ao mesmo tempo que estes medicamentos. Nos doentes com compromisso renal moderado e concomitantemente tratados com dabigatrano etexilato e verapamilo, deve ser considerada uma redução da dose de Pradaxa para 75 mg por dia (ver secções 4.4 e 4.5). Idosos (prevenção primária do TEV em cirurgia ortopédica) A experiência clínica em doentes idosos (> 75 anos) é limitada. Estes doentes devem ser tratados com precaução. A dose recomendada é 150 mg, uma vez por dia, correspondendo a 2 cápsulas de 75 mg (ver secções 4.4 e 5.1). Uma vez que o compromisso renal pode ser frequente nos idosos (> 75 anos), a função renal deve ser avaliada através do cálculo da CLCr antes do início do tratamento com Pradaxa, de modo a excluir os doentes com compromisso renal grave (i.e. CLCr < 30 ml/min). Durante o tratamento, a função renal deve ser avaliada nas situações clínicas em que exista suspeita de que a função renal possa diminuir ou deteriorar-se (tais como, hipovolemia, desidratação, e determinadas medicações concomitantes, etc.) (ver secções 4.3, 4.4 e 5.2). Afeção hepática(prevenção primária do TEV em cirurgia ortopédica) Os doentes com um aumento das enzimas hepáticas > 2 do limite superior normal (LSN) foram excluídos dos ensaios clínicos que estudaram a prevenção do tromboembolismo venoso após artroplastia eletiva da anca ou do joelho. Não existe experiência de tratamento nesta subpopulação de doentes e, consequentemente, não se recomenda o uso de Pradaxa nesta população (ver secções 4.4 e 5.2). É contraindicado na afeção hepática ou doença hepática que possa ter qualquer impacto na sobrevivência (ver secção 4.3). Peso (prevenção primária do TEV em cirurgia ortopédica) A experiência clínica com a posologia recomendada em doentes com peso corporal < 50 kg ou > 110 kg é muito limitada. Considerando os dados clínicos e farmacocinéticos disponíveis não é necessário proceder a ajustes posológicos (ver secção 5.2), sendo no entanto recomendada uma monitorização clínica rigorosa (ver secção 4.4). Sexo (prevenção primária do TEV em cirurgia ortopédica) Tendo em conta os dados clínicos e farmacocinéticos disponíveis, não são necessários ajustes posológicos (ver secção 5.2). Substituição (prevenção primária do TEV em cirurgia ortopédica) De Pradaxa por anticoagulantes administrados por via parentérica Recomenda-se um tempo de espera de 24 horas após a última dose antes de substituir Pradaxa por um anticoagulante administrado por via parentérica (ver secção 4.5). 4
5 De anticoagulantes administrados por via parentérica por Pradaxa Descontinue a terapêutica anticoagulante administrada por via parentérica e inicie o dabigatrano etexilato 0-2 horas antes da hora em que seria administrada a próxima dose da terapêutica que está a ser substituída, ou na altura em que esta terapêutica é suspensa, nos casos de tratamento continuo (p. ex.: Heparina Não Fracionada (HNF) administrada por via intravenosa) (ver secção 4.5). População pediátrica (prevenção primária do TEV em cirurgia ortopédica) Não existe utilização relevante de Pradaxa na população pediátrica na indicação: prevenção primária dos fenómenos tromboembólicos venosos em doentes que foram submetidos a artroplastia eletiva total da anca ou a artroplastia eletiva total do joelho. Omissão de dose (prevenção primária do TEV em cirurgia ortopédica) Recomenda-se que se continue com as restantes doses diárias de dabigatrano etexilato à mesma hora do dia seguinte. Não deve ser tomada uma dose dupla para compensar uma dose individual que tenha sido omitida. Modo de administração (prevenção primária do TEV em cirurgia ortopédica) A cápsula de Pradaxa pode ser tomada com ou sem alimentos. Deverá ser engolida inteira com um copo de água, de modo a facilitar a deglutição, Os doentes devem ser advertidos para não abrir a cápsula, devido ao risco aumentado de hemorragia (ver secções 5.2 e 6.6). 4.3 Contraindicações Hipersensibilidade à substância ativa ou a qualquer um dos excipientes mencionados na secção 6.1 Doentes com compromisso renal grave (ClCr < 30 ml/min) (ver secção 4.2) Hemorragia ativa clinicamente significativa Lesões ou condições que sejam consideradas um fator de risco significativo para hemorragia major. Estas podem incluir úlceras gastrointestinais atuais ou recentes, presença de neoplasias malignas com elevado risco de hemorragia, lesão recente no cérebro ou na espinal medula, cirurgia cerebral, espinal ou oftálmica recente, hemorragia intracraniana recente, suspeita ou confirmação de varizes esofágicas, malformações arteriovenosas, aneurismas vasculares ou anomalias vasculares major intraespinais ou intracerebrais Tratamento concomitante com quaisquer outros anticoagulantes, ex. heparina não fracionada (HNF), heparina de baixo peso molecular (enoxaparina, dalteparina etc.), derivados da heparina (fondaparinux, etc.), anticoagulantes orais (varfarina, rivaroxabano, apixabano, etc.), exceto nas circunstâncias específicas de mudança de terapêutica anticoagulante (ver secção 4.2) ou quando são administradas doses de HNF necessárias para manter a permeabilidade de um acesso venoso central ou um cateter arterial (ver secção 4.5) Afeção hepática ou doença hepática com previsível impacto na sobrevivência Tratamento concomitante com cetoconazol sistémico, ciclosporina, itraconazole dronedarona (ver secção 4.5). Próteses valvulares cardíacas que requeiram tratamento anticoagulante (ver secção 5.1) 4.4 Advertências e precauções especiais de utilização Afeção hepática Os doentes com aumento das enzimas hepáticas > 2 LSN foram excluídos dos ensaios clínicos controlados que estudaram a prevenção do tromboembolismo venoso após artroplastia eletiva da anca ou do joelho. Não existe experiência de tratamento nesta subpopulação de doentes e, consequentemente, não se recomenda o uso de Pradaxa nesta população. 5
6 Risco hemorrágico O dabigatrano etexilato deve ser usado com precaução em situações em que o risco de hemorragia possa estar aumentado e em situações de uso concomitante de medicamentos que afetam a hemostase por inibição da agregação plaquetária. A hemorragia pode ocorrer em qualquer local durante a terapêutica com o dabigatrano etexilato. Uma redução inexplicada dos níveis de hemoglobina e/ou hematócrito ou da pressão sanguínea deve levar à investigação de um local de hemorragia. Fatores como função renal diminuída (CLCr ml/min), idade 75 anos, baixo peso corporal < 50 Kg, ou administração concomitante de inibidores fracos a moderados da gp-p (ex. amiodarona, quinidina ou verapamilo) estão associados a níveis plasmáticos de dabigatrano aumentados (ver secções 4.2, 4.5 e 5.2). A utilização concomitante de ticagrelor aumenta a exposição ao dabigatrano e pode mostrar interação farmacodinâmica, podendo resultar num aumento do risco de hemorragia (ver secção 4.5). A utilização de ácido acetilsalicílico (AAS), clopidogrel ou anti-inflamatórios não esteroides (AINE), bem como a presença de esofagite, gastrite ou refluxo gastroesofágico, aumentam o risco de hemorragia gastrointestinal. Pode ser considerada a administração de um IBP para prevenir a hemorragia gastrointestinal. O risco de hemorragia pode estar aumentado em doentes tratados concomitantemente com inibidores seletivos da recaptação da serotonina (ISRSs) ou inibidores seletivos da recaptação de serotonina e norepinefrina (ISRSNs) (ver secção 4.5). Durante o período de tratamento, é recomendada uma monitorização clínica rigorosa (procura de sinais de hemorragia ou anemia), especialmente se houver combinação de fatores de risco (ver secção 5.1). A Tabela 1 resume os fatores que podem aumentar o risco de hemorragia. Consulte igualmente as contraindicações na secção
7 Tabela1: Fatores que podem aumentar o risco de hemorragia Fatores farmacodinâmicos e cinéticos Fatores que aumentam os níveis plasmáticos de dabigatrano Idade 75 anos Principais: Compromisso renal moderado (CLCr ml/min) Administração concomitante de inibidores da gp-p (alguns inibidores da gp-p são contraindicados, ver secções 4.3 e 4.5) Menores: Baixo peso corporal (< 50 kg) Interações farmacodinâmicas AAS AINE Clopidogrel ISRSs ou ISRSNs Outros medicamentos que possam alterar a hemostase Doenças / intervenções com particular risco hemorrágico Alterações da coagulação congénitas ou adquiridas Trombocitopenia ou alterações funcionais das plaquetas Biopsia recente, trauma grave Endocardite bacteriana Esofagite, gastrite ou refluxo gastroesofágico A presença de lesões, condições, procedimentos e/ou tratamento farmacológico (tais como AINEs, antiplaquetários, ISRS ou ISRSNs, ver secção 4.5), que aumentem significativamente o risco de hemorragia major, requer uma avaliação cuidadosa do risco-benefício. Pradaxa só deve ser administrado se os benefícios forem superiores aos riscos de hemorragia. No geral, o Pradaxa não requer monitorização da anticoagulação de rotina. No entanto, a medição da anticoagulação relacionada com o dabigatrano pode ser útil para evitar uma exposição excessiva ao dabigratano em presença de fatores de risco adicionais. O teste do INR não é fiável em doentes a tomar Pradaxa e têm sido notificados INRs elevados falsos positivos Assim, os testes de INR não devem ser realizados. O Tempo de Trombina Diluído (dtt), o Tempo de Coagulação de Ecarina (ECT) e o Tempo de Tromboplastina Parcial ativada (aptt) podem fornecer informação útil, mas os testes não são padronizados e os resultados devem ser interpretados com precaução (ver secção 5.1). A tabela 2 mostra os limites dos testes de coagulação em vale que podem estar associados a um aumento do risco de hemorragia (ver secção 5.1). Tabela 2: Limites dos testes de coagulação em vale que podem estar associados a um aumento do risco de hemorragia Teste (valor em vale) dtt [ng/ml] >67 ECT [x-vezes ao limite superior Não há dados normal] aptt [x-vezes ao limite superior >1.3 normal] INR Não deve ser realizado Doentes que desenvolvam insuficiência renal aguda devem descontinuar o Pradaxa (ver secção 4.3). 7
8 Os dados disponíveis em doentes com peso corporal <50 kg são limitados (ver secção 5.2). Se ocorrerem hemorragias graves o tratamento deve ser descontinuado e a origem da hemorragia investigada (ver secção 4.9). Medicamentos que possam aumentar o risco de hemorragia não devem ser administrados concomitantemente ou devem ser administrados com precaução quando associados a Pradaxa (ver secção 4.5). Utilização de medicamentos fibrinolíticos para o tratamento do AVC isquémico agudo A utilização de medicamentos fibrinolíticos para o tratamento do AVC isquémico agudo pode ser considerada, se o doente apresentar valores de dtt, ECT or aptt não excedendo a LSN, de acordo com o intervalo de referência local. Interação com indutores da gp-p A administração concomitante com indutores da gp-p (tais como rifampicina, hipericão, carbamazepina ou fenitoína), pode resultar na diminuição das concentrações plasmáticas de dabigatrano, devendo ser evitada (ver secções 4.5 e 5.2). Cirurgia e intervenções Doentes em terapêutica com dabigatrano etexilato que sejam submetidos a cirurgia ou procedimentos invasivos têm risco aumentado de hemorragia. Consequentemente, intervenções cirúrgicas podem requerer a interrupção temporária do dabigatrano etexilato. Deve ser tida precaução quando o tratamento é temporariamente interrompido para intervenções e deve ser garantida a monitorização da anticoagulação. A depuração do dabigatrano em doentes com insuficiência renal pode ser mais demorada (ver secção 5.2). Isto deve ser antecipadamente considerado para quaisquer intervenções. Nestes casos, um teste de coagulação (ver secções 4.4. e 5.1) pode ajudar a determinar se a hemostase continua alterada. Fase pré-operatória A Tabela 3 resume as regras de interrupção antes de intervenções invasivas ou cirúrgicas. Tabela 3: Regras de interrupção antes de intervenções invasivas ou cirúrgicas. Função renal (CLCr em ml/min) Semivida estimada (horas) Interrupção do dabigatrano antes de cirurgia eletiva Elevado risco de hemorragia Risco normal ou cirurgia major 80 ~ 13 2 dias antes 24 horas antes 50-< 80 ~ dias antes 1-2 dias antes 30-< 50 ~ 18 4 dias antes 2-3 dias antes (> 48 horas) Em caso de ser necessária uma intervenção aguda, o dabigatrano etexilato deve ser temporariamente interrompido. Se possível, a cirurgia / intervenção deve ser adiada até, pelo menos, 12 horas após a última dose. Se a cirurgia não puder ser adiada o risco de hemorragia pode estar aumentado. Este risco de hemorragia deve ser ponderado em relação à urgência da intervenção. Anestesia espinal/anestesia epidural/punção lombar Intervenções como a anestesia espinal podem requerer função hemostática completa. 8
9 O risco de hematoma espinal ou epidural pode estar aumentado em casos de punção traumática ou repetida e pelo uso prolongado de cateteres epidurais. Após remoção de um cateter, deve existir um intervalo de pelo menos 2 horas antes da administração da primeira dose de dabigatrano etexilato. Estes doentes devem ser frequentemente observados quanto a sinais e sintomas neurológicos de hematoma espinal ou epidural. Fase pós-operatória Após um procedimento invasivo ou intervenção cirúrgica, o dabigatrano etexilato deve ser reintroduzido o mais rapidamente possível, assim que a situação clínica o permita e a hemostase adequada seja alcançada. Doentes em risco de hemorragia ou doentes em risco de sobrexposição, particularmente doentes com compromisso renal moderado (CLCr ml/min), devem ser tratados com precaução (ver secções 4.4 e 5.1). Doentes com elevado risco de mortalidade cirúrgica e com fatores de risco intrínsecos para acontecimentos tromboembólicos Nestes doentes, os dados disponíveis de eficácia e segurança do dabigatrano são limitados. Consequentemente, estes doentes devem ser tratados com precaução. Cirurgia por fratura da anca Não há dados relativos ao uso de Pradaxa em doentes submetidos a cirurgia por fratura da anca. Consequentemente o tratamento não é recomendado. Corantes As cápsulas de Pradaxa contêm o corante amarelo-sol (E110), que poderá causar reações alérgicas. 4.5 Interações medicamentosas e outras formas de interação Medicamentos anticoagulantes e antiagregantes plaquetários Não existe experiência, ou a experiência existente é limitada, relativamente aos seguintes tratamentos que podem aumentar o risco de hemorragia quando usados concomitantemente com Pradaxa: anticoagulantes tais como heparina não fracionada (HNF), heparinas de baixo peso molecular (HBPM) e derivados da heparina (fondaparinux, desirudina), medicamentos trombolíticos, e antagonistas da vitamina K, rivaroxabano ou outros anticoagulantes orais (ver secção 4.3), e medicamentos agregantes plaquetários tais como antagonistas dos recetores GPIIb/IIIa, ticlopidina, prasugrel, ticagrelor, dextrano e sulfimpirazona (ver secção 4.4). A HNF pode ser administrada em doses necessárias para manter um cateter central ou venoso funcionante (ver secção 4.3). Clopidogrel: Num estudo de fase I em voluntários jovens do sexo masculino, a administração concomitante de dabigatrano etexilato e clopidogrel, quando comparada com o clopidogrel em monoterapia, não resultou num prolongamento adicional dos tempos de hemorragia capilar. Adicionalmente os valores de AUCτ,ss e C max de dabigatrano e os tempos de coagulação para medição do efeito do dabigatrano, ou a inibição da agregação plaquetária como medida do efeito do clopidogrel, permaneceram essencialmente inalterados, comparando o tratamento combinado com as respetivas monoterapias. Com uma dose de carga de 300 mg ou 600 mg de clopidogrel, os valores de AUCτ,ss e C max de dabigatrano foram aumentados cerca de 30-40% (ver secção 4.4). AAS: O efeito da administração concomitante de dabigatrano etexilato e AAS no risco de hemorragia foi estudado em doentes com fibrilhação auricular num estudo de fase II no qual a coadministração de 9
10 AAS foi aleatorizada. Com base na análise de regressão logística, a coadministração de AAS e 150 mg de dabigatrano etexilato, duas vezes ao dia, pode aumentar o risco de qualquer hemorragia de 12% a 18% e 24%, com 81 mg e 325 mg de AAS, respetivamente (ver secção 4.4). AINE: os AINE utilizados em analgesia perioperatória de curta duração mostraram não estar associados a risco aumentado de hemorragia, quando administrados em conjunto com dabigatrano etexilato. Com a utilização crónica, os AINE aumentaram o risco de hemorragia em aproximadamente 50%, tanto com o dabigatrano como com a varfarina. Consequentemente, devido ao risco de hemorragia, particularmente para os AINE com semividas de eliminação > 12 horas, recomenda-se uma observação apertada em relação aos sinais de hemorragia (ver secção 4.4). HBPM: A utilização concomitante de HBPM, tais como a enoxaparina, e dabigatrano etexilato não foi especificamente investigada. Após substituição terapêutica, de um tratamento de 3 dias com 40 mg de enoxaparina administrada uma vez ao dia por via subcutânea, a exposição ao dabigatrano, 24 horas após a última dose de enoxaparina, foi ligeiramente menor do que a encontrada após a administração exclusiva de dabigatrano etexilato (dose única de 220 mg). Foi observada uma atividade anti-fxa/fiia mais elevada após a administração de dabigatrano etexilato, antecedido de tratamento com enoxaparina, comparativamente à encontrada após tratamento exclusivo com o dabigatrano etexilato. Considera-se que este facto se deve ao efeito de sobreposição do tratamento com a enoxaparina, sendo considerado clinicamente não relevante. Outros testes de anticoagulação relacionados com o dabigatrano não foram significativamente alterados pelo tratamento prévio com enoxaparina. Interações relacionadas com dabigatrano etexilato e com o perfil metabólico de dabigatrano O dabigatrano etexilato e o dabigatrano não são metabolizados pelo citocromo P450 e não exerceram efeitos in vitro nas enzimas do citocromo P450 humano. Assim, não são esperadas interações medicamentosas com o dabigatrano. Interações a nível do transporte Inibidores da gp-p O dabigatrano etexilato é um substracto do transportador de efluxo gp-p. É previsível que a administração concomitante com inibidores da gp-p (tais como amiodarona, verapamilo, quinidina, cetoconazol, dronedarona, claritromicina e ticagrelor) resulte num aumento das concentrações plasmáticas de dabigatrano. Quando o dabigatrano é coadministrado com fortes inibidores da gp-p, deve ser feita uma monitorização clínica rigorosa (com pesquisa de sinais de hemorragia ou anemia), exceto se especificamente descrito em contrário. Um teste de coagulação ajuda a identificar os doentes com risco aumentado de hemorragia por exposição aumentada ao dabigatrano (ver secções 4.2, 4.4 e 5.1). Os seguintes inibidores fortes da gp-p são contraindicados: cetoconazol sistémico, ciclosporina, itraconazol e dronedarona (ver secção 4.3). O tratamento concomitante com tacrolimus não é recomendado. Deve ser tida precaução com inibidores fracos a moderados da gp-p (ex.: amiodarona, posaconazol, quinidina, verapamilo e ticagrelor) (ver secções 4.2 e 4.4). Cetoconazol: o cetoconazol aumentou os valores totais de AUC 0- e C max de dabigatrano em 138% e 135%, respetivamente, após uma dose oral única de 400 mg, e em 153% e 149%, respetivamente, após doses orais múltiplas de 400 mg de cetoconazol uma vez ao dia. O tempo para atingir a concentração de pico, a semivida terminal e o tempo médio de residência não foram afetados pelo cetoconazol (ver secção 4.4). O tratamento concomitante com cetoconazol sistémico é contraindicado (ver secção 4.3). Dronedarona: quando o dabigatrano etexilato e a dronedarona são administrados na mesma altura os valores da AUC 0- e da C max do dabigatrano total aumentaram em cerca de 2,4 vezes e 2,3 vezes (+136% e 125%), respetivamente, após doses múltiplas de 400 mg de dronedarona, 2 vezes por dia, e em cerca de 2,1 vezes e 1,9 vezes (+114% e 87%), respectivamente, após uma dose única de 400 mg. 10
11 A semivida terminal e a depuração renal do dabigatrano não foram afetados pela dronedarona. Quando foram administradas doses únicas e doses múltiplas de dronedarona 2 horas após o dabigatrano etexilato, os aumentos na AUC 0- do dabigatrano foram de 1,3 vezes e 1,6 vezes, respetivamente. O tratamento concomitante com dronedarona está contraindicado. Amiodarona: Quando Pradaxa foi coadministrado com uma dose única oral de 600 mg de amiodarona, a extensão e taxa de absorção da amiodarona e do seu metabolito ativo DEA permaneceram essencialmente inalteradas. A AUC e a Cmax de dabigatrano aumentaram em cerca de 60% e 50%, respetivamente. O mecanismo da interação não está completamente clarificado. Tendo em conta a longa semivida da amiodarona, poderá existir potencial de interação medicamentosa durante semanas após a descontinuação da amiodarona (ver secções 4.2 e 4.4). Nos doentes tratados para a prevenção do TEV após artroplastia da anca ou do joelho, que recebam concomitantemente dabigatrano etexilato e amiodarona, a dose deve ser reduzida para 150 mg, uma vez por dia, correspondendo a 2 cápsulas de 75 mg de Pradaxa (ver secção 4.2). Quando o dabigatrano etexilato é combinado com a amiodarona, e particularmente na ocorrência de hemorragia, deve ser feita uma monitorização clínica rigorosa, em especial nos doentes com compromisso renal ligeiro a moderado. Quinidina: a quinidina foi administrada em doses de 200 mg a cada 2 horas até uma dose total de 1000 mg. O dabigatrano etexilato foi administrado 2 vezes ao dia durante 3 dias consecutivos, tendo no 3º dia sido administrado com e sem quinidina. Os valores de AUCт,ss e C max,ss de dabigatrano foram aumentados em média 53% e 56%, respetivamente, com a administração concomitante de quinidina (ver secções 4.2 e 4.4). Nos doentes tratados para a prevenção do TEV após artroplastia da anca ou do joelho, que recebam concomitantemente dabigatrano etexilato e quinidina, a dose deve ser reduzida para 150 mg, uma vez por dia, correspondendo a 2 cápsulas de 75 mg (ver secção 4.2). Quando o dabigatrano etexilato é combinado com a quinidina, e particularmente na ocorrência de hemorragia, deve ser feita uma monitorização clínica rigorosa, em especial nos doentes com compromisso renal ligeiro a moderado. Verapamilo: Quando o dabigatrano etexilato (150 mg) foi coadministrado com verapamilo oral, a Cmax e a AUC do dabigatrano foram aumentados, mas a magnitude desta alteração difere dependendo da altura da administração e da formulação do verapamilo (ver secções 4.2 e 4.4). O maior aumento da exposição ao dabigatrano foi observado com a primeira dose de uma formulação de libertação imediata de verapamilo, administrada uma hora antes da toma de dabigatrano etexilato (aumento da Cmax em cerca de 180% e da AUC em cerca de 150%). O efeito foi progressivamente reduzido com a administração de uma formulação de libertação prolongada (aumento da Cmax em cerca de 90% e da AUC em cerca de 70%) ou administração de múltiplas doses de verapamilo (aumento da Cmax em cerca de 60% e da AUC em cerca de 50%). Deste modo, é necessária uma monitorização clínica rigorosa (com pesquisa de sinais de hemorragia e anemia) quando o dabigatrano é coadministrado com verapamilo. Nos doentes com função renal normal após artroplastia da anca ou do joelho, a receber concomitantemente dabigatrano etexilato e verapamilo, a dose de Pradaxa deve ser reduzida para 150 mg, uma vez por dia, correspondendo a 2 cápsulas de 75 mg. Nos doentes com insuficiência renal moderada e tratados concomitantemente com dabigatrano etexilato e verapamilo, deve ser considerada a redução da dose de Pradaxa para 75 mg por dia (ver secções 4.2 e 4.4). Quando o dabigatrano etexilato é combinado com o verapamilo, e particularmente na ocorrência de hemorragia, deve ser feita uma monitorização clínica rigorosa, em especial nos doentes com compromisso renal ligeiro a moderado. Não foi observada interação significativa quando o verapamilo foi administrado 2 horas após o dabigatrano etexilato (aumento da Cmax em cerca de 10% e da AUC em cerca de 20%). Isto é explicado pela completa absorção do dabigatrano após 2 horas (ver secção 4.4). 11
12 Claritromicina: Quando a claritromicina (500 mg duas vezes por dia) foi administrada concomitantemente com dabigatrano etexilato em voluntários saudáveis, foi observado um aumento da AUC em cerca de 19% e da Cmax em cerca de 15%, sem qualquer motivo de preocupação de segurança clínica. Contudo, em doentes a receber dabigatrano, não pode ser excluída uma interação clinicamente relevante aquando da combinação com claritromicina. Assim, deve ser feita uma monitorização apertada quando o dabigatrano etexilato é coadministrado com claritromicina, nomeadamente na ocorrência de hemorragia, principalmente em doentes com compromisso renal ligeiro a moderado. Ticagrelor: Quando uma dose única de 75mg de dabigatrano etexilato foi coadministrada simultaneamente com uma dose de carga de 180mg de ticagrelor, a AUC e a C max do dabigatrano foram aumentadas em 1,73 e 1,95 vezes (+73% e 95%), respetivamente. Após doses múltiplas de 90mg de ticagrelor, duas vezes ao dia, o aumento da exposição ao dabigatrano é de 1,56 e 1,46 vezes (+56% e 46%) para a C max e para a AUC, respetivamente. A administração concomitante de uma dose de carga de 180 mg de ticagrelor e 110 mg de dabigatrano etexilato (no estado estacionário) aumentou a AUCτ,ss e a Cmax,ss do dabigatrano em 1,49 vezes e 1,65 vezes (+49% e 65%), respetivamente, em comparação à administração isolada de dabigatrano etexilato. Quando uma dose de carga de 180 mg de ticagrelor foi dada 2 horas após a administração de 110 mg de dabigatrano etexilato (no estado estacionário) o aumento da AUCτ,ss e da Cmax,ss do dabigatrano foi reduzido para 1,27 vezes e 1,23 vezes (+27% e 23%), respectivamente, em comparação à administração isolada de dabigatrano etexilato. Este intervalo de toma é a administração recomendada para iniciar o ticagrelor com uma dose de carga. A administração concomitante de 90 mg de ticagrelor duas vezes ao dia (dose de manutenção) com 110 mg de dabigatrano etexilato aumentou a AUCτ,ss e a Cmax,ss ajustadas do dabigatrano em 1,26 vezes e 1,29 vezes, respetivamente, em comparação à administração isolada de dabigatrano etexilato. Os seguintes potentes inibidores da gp-p não foram clinicamente estudados, mas com base nos resultados in vitro, espera-se um efeito semelhante ao encontrado com o cetoconazol: Itraconazol e ciclosporina, os quais são contraindicados (ver secção 4.3). In vitro, o tacrolimus demonstrou atividade semelhante no efeito inibidor da P-gp relativamente ao itraconazol e ciclosporina. O dabigatrano etexilato não foi ainda clinicamente estudado juntamente com o tacrolimus. Contudo, dados clínicos de outro substrato da P-gp (everolimus), sugerem que a inibição da P-gp com o tacrolimus é mais fraca do que a observada com inibidores fortes da P-gp. Com base nestes dados, o tratamento concomitante com tacrolimus não é recomendado. O posaconazol e o tacrolimus afetam a P-gp, todavia não foram ainda clinicamente estudados. A utilização concomitante de Pradaxa e Tacrolimus não está recomendada, e deve ser tida precaução na coadministração de Pradaxa com posaconazol. Indutores da gp-p É previsível que a administração concomitante de um indutor da gp-p (tal como rifampicina, hipericão, carbamazepina ou fenitoína) resulte na diminuição das concentrações de dabigatrano, devendo ser evitada (ver secções 4.4 e 5.2). Rifampicina: A pré-dosagem com o indutor rifampicina a uma dose de 600 mg uma vez por dia durante 7 dias, diminuiu o pico total e a exposição total de dabigatrano em 65,5% e 67%, respetivamente. Ao 7º dia após o fim do tratamento com a rifampicina, o efeito indutor foi diminuído, resultando numa exposição de dabigatrano próxima à da referência. Não foi observado nenhum aumento da biodisponibilidade após mais 7 dias. 12
13 Outros medicamentos que afetam a gp-p Os inibidores da protease, incluindo o ritonavir, e as suas combinações com outros inibidores da protease, afetam a gp-p (quer como inibidores ou como indutores). Estes não foram estudados e consequentemente não são recomendados para tratamento concomitante com Pradaxa. Substracto da gp-p Digoxina: Num estudo realizado com 24 indivíduos saudáveis, quando o Pradaxa foi coadministrado com digoxina não foram observadas alterações na exposição de digoxina nem alterações clinicamente significativas na exposição do dabigatrano. A administração concomitante de inibidores seletivos da recaptação da serotonina (ISRSs) ou inibidores seletivos da recaptação de serotonina e norepinefrina (ISRSNs) Os ISRSs e os ISRSNs aumentaram o risco de hemorragia no RE-LY, em todos os grupos de tratamento. ph gástrico Pantoprazol: Quando o Pradaxa foi coadministrado com pantoprazol, observou-se uma diminuição de aproximadamente 30% na área sob a curva da concentração plasmática/tempo. O pantoprazol e outros inibidores da bomba de protões (IBP) foram coadministrados com Pradaxa em ensaios clínicos e o tratamento concomitante com IBP não demonstrou reduzir a eficácia do Pradaxa. Ranitidina: A administração de ranitidina juntamente com Pradaxa não teve efeito clínico relevante na extensão da absorção do dabigatrano. 4.6 Fertilidade, gravidez e aleitamento Mulheres com potencial para engravidar / Contraceção em homens e mulheres Mulheres com potencial para engravidar devem evitar engravidar durante o tratamento com o dabigatrano etexilato. Gravidez A quantidade de dados sobre a utilização do dabigatrano etexilato em mulheres grávidas é limitada. Estudos em animais demonstraram toxicidade reprodutiva (ver secção 5.3). O potencial risco para os seres humanos é desconhecido. Pradaxa não deve ser utilizado durante a gravidez exceto se for claramente necessário. Amamentação Não existem dados clinicos relativos ao efeito do dabigatrano em recém-nascidos durante a amamentação. A amamentação deve ser interrompida durante o tratamento com Pradaxa. Fertilidade Não existem dados disponíveis em humanos. Em estudos em animais foi observado um efeito na fertilidade feminina, na forma de diminuição nas implantações e aumento na perda pré-implantação, com 70 mg/kg (representando um nível de exposição plasmática 5 vezes superior ao dos doentes). Não foram observados outros efeitos na fertilidade feminina. Não houve qualquer influência na fertilidade masculina. Foi observada, em ratos 13
14 e em coelhos, uma diminuição no peso corporal fetal e na viabilidade embriofetal, juntamente com um aumento nas alterações fetais, com doses que foram tóxicas para as mães (representando um nível de exposição plasmática 5-10 vezes superior ao dos doentes). Nos estudos pré e pós-natal foi observado um aumento na mortalidade fetal em doses que foram tóxicas para as fêmeas gestantes (correspondendo a um nível de exposição plasmática 4 vezes superior ao observado nos doentes). 4.7 Efeitos sobre a capacidade de conduzir e utilizar máquinas A influencia do Pradaxa na capacidade de conduzir e utilizar máquinas é nula ou negligenciável. 4.8 Efeitos indesejáveis Resumo do perfil de segurança Foram tratados doentes, em 4 a 6 ensaios ativamente controlados na prevenção do TEV, com pelo menos uma dose do medicamento. Destes, foram tratados com 150 mg ou 220 mg diários de Pradaxa. As reações adversas mais frequentemente notificadas foram hemorragias ocorridas, no total, em aproximadamente 14% dos doentes; a frequência das hemorragias graves (incluindo hemorragias no local da ferida) é inferior a 2%. Embora com uma frequência rara nos ensaios clínicos, podem ocorrer hemorragias major ou graves e, dependendo da localização, podem resultar em incapacidade, risco de vida ou morte. Lista de reações adversas em formato tabelar A Tabela 4 mostra as reações adversas, classificadas por Classe de Sistemas de Órgãos (SOC) e frequência, utilizando a seguinte classificação: muito frequentes ( 1/10); frequentes ( 1/100 a < 1/10); pouco frequentes ( 1/1.000 a < 1/100); raros ( 1/ a < 1/1.000); muito raros (< 1/10.000); desconhecido (não pode ser calculado a partir dos dados disponíveis). Tabela 4: Reações adversas SOC / Termo preferencial Doenças do sangue e do sistema linfático Diminuição da hemoglobina Anemia Diminuição do hematócrito Trombocitopenia Doenças do sistema imunitário Hipersensibilidade ao fármaco Reação anafilática Angioedema Urticária Erupção cutânea Prurido Broncospasmo Doenças do sistema nervoso Hemorragia intracraneana Vasculopatias Hematoma Ferida hemorrágica Hemorragia Doenças respiratórias, torácicas e do mediastino Epistaxe Frequente Pouco Frequente Pouco frequente Raro Pouco frequente Raro Raro Raro Raro Raro Desconhecido Raro Pouco frequente Pouco frequente Raro Pouco frequente 14
15 SOC / Termo preferencial Hemoptise Raro Doenças gastrointestinais Hemorragia gastrointestinal Pouco frequente Hemorragia retal Pouco frequente Hemorragia hemorroidal Pouco frequente Diarreia Pouco frequente Náusea Pouco frequente Vómitos Pouco frequente Úlcera gastrointestinal incluindo úlcera Raro esofágica Gastroesofagite Raro Doença do refluxo gastroesofágico Raro Dor abdominal Raro Dispepsia Raro Disfagia Raro Afeções hepatobiliares Alteração da função hepática / Alteração dos Frequente testes da função hepática Aumento da alanina aminotransferase Pouco frequente Aumento da aspartato aminotransferase Pouco frequente Aumento das enzimas hepáticas Pouco frequente Hiperbilirrubinémia Pouco frequente Afeções dos tecidos cutâneos e subcutâneos Hemorragia cutânea Pouco frequente Afeções musculosqueléticas e dos tecidos conjuntivos Hemartroses Pouco frequente Doenças renais e urinárias Hemorragia genito-urinária, incluindo Pouco frequente hematúria Perturbações gerais e alterações no local de administração Hemorragia no local de injeção Raro Hemorragia no local de inserção do cateter Raro Perda hemorrágica Raro Complicações de intervenções relacionadas com lesões e intoxicações Hemorragia traumática Pouco frequente Hematoma pós-intervenção Pouco frequente Hemorragia pós-intervenção Pouco frequente Perda hemorrágica pós-intervenção Pouco frequente Secreções pela ferida Pouco frequente Hemorragia no local de incisão Raro Anemia pós-operatória Raro Procedimentos cirúrgicos e médicos Drenagem da ferida Raro Drenagem pós-procedimento Raro Hemorragia A Tabela 5 mostra o número (%) de doentes que sofreram a reação adversa hemorragia durante o período de tratamento para prevenção do tromboembolismo venoso, em 2 ensaios clínicos principais, de acordo com a dose. 15
16 Tabela 5: Número (%) de doentes que sofreram a reação adversa hemorragia Dabigatrano etexilato 150 mg N (%) Dabigatrano etexilato 220 mg N (%) Enoxaparina N (%) Tratados (100,0) (100,0) (100,0) Hemorragia major 24 (1,3) 33 (1,8) 27 (1,5) Qualquer hemorragia 258 (13,8) 251 (13,8) 247 (13,4) A definição da reação adversa hemorragia major nos estudos RE-NOVATE e RE-MODEL foi a seguinte: hemorragia fatal hemorragia clinicamente evidente, para além do esperado, e associada a diminuição da hemoglobina 20 g/l (correspondente a 1,24 mmol/l), para além do esperado hemorragia clinicamente evidente, para além do esperado, e que leve a transfusão de 2 unidades de células ou sangue total, para além do esperado hemorragia sintomática retroperitonial, intracraniana, intraocular ou intraespinal hemorragia que requer paragem do tratamento hemorragia que leve a nova operação Foi necessário um teste objetivo para a hemorragia retroperitonial (ecografia ou Tomografia Computadorizada (TC)) e para a hemorragia intracraniana ou intraespinal (TC ou Imagem por Ressonância Magnética). Notificação de suspeitas de reações adversas A notificação de suspeitas de reações adversas após a autorização do medicamento é importante, uma vez que permite uma monitorização contínua da relação benefício-risco do medicamento. Pede-se aos profissionais de saúde que notifiquem quaisquer suspeitas de reações adversas através do sistema nacional de notificação mencionado no Apêndice V* 4.9 Sobredosagem Doses de dabigatrano etexilato superiores às recomendadas expõem o doente a um risco aumentado de hemorragia. Em caso de suspeita de sobredosagem, um teste de coagulação pode ajudar a determinar o risco de hemorragia (ver secções 4.4 e 5.1). Um teste calibrado quantitativo do TTd ou medições repetidas do TTd permitem prever quando serão atingidos determinados níveis de dabigatrano (ver secção 5.1), mesmo que tenham sido iniciadas medidas adicionais, como por exemplo diálise. Em caso de anticoagulação excessiva pode ser necessário interromper o tratamento com Pradaxa. Não existe antídoto específico para o dabigatrano. Em caso de complicações hemorrágicas, o tratamento deve ser descontinuado e investigada a origem da hemorragia. Uma vez que a via de excreção do dabigatrano é predominantemente renal, deve ser mantida uma diurese adequada. De acordo com o critério do médico, deve ser realizado tratamento de suporte adequado, tal como hemostase cirúrgica e reposição da volemia. Poderão ser considerados concentrados de complexo de protrombina ativado (ex. FEIBA) ou fator VIIa recombinante ou concentrados de fatores de coagulação II, IX e X. Existe alguma evidência experimental que suporta o papel destes medicamentos na reversão do efeito anticoagulante do dabigatrano, mas os dados sobre a sua utilidade em ambiente clínico, bem como, sobre o possível risco de tromboembolismo rebound são muito limitadas. Os testes de coagulação podem não ser fiáveis após a administração dos medicamentos de reversão sugeridos. Recomenda-se precaução aquando da interpretação destes testes. Deverá também ser considerada a administração de concentrados de plaquetas na presença de trombocitopenia ou em casos em que tenham sido usados 16
17 medicamentos antiplaquetários de longa duração de ação. Todo o tratamento sintomático deve ser dado de acordo com a avaliação médica. Dependendo da disponibilidade local, deverá ser considerada a consulta de um perito em coagulação no caso de hemorragias graves. Como a ligação às proteínas é baixa, o dabigatrano pode ser dialisado; é limitada a experiência clínica que demonstra a utilidade desta abordagem em ensaios clínicos (ver secção 5.2). 5. PROPRIEDADES FARMACOLÓGICAS 5.1 Propriedades farmacodinâmicas Grupo farmacoterapêutico: antitrombótico, inibidor direto da trombina, código ATC: B01AE07. Mecanismo de ação O dabigatrano etexilato é uma pequena molécula de profármaco que não possui atividade farmacológica. Após administração oral, o dabigatrano etexilato é rapidamente absorvido e convertido em dabigatrano por hidrólise catalisada pelas esterases, no plasma e no fígado. O dabigatrano é um potente inibidor direto da trombina, competitivo e reversível, e é o principal metabolito ativo no plasma. Uma vez que a trombina (protease de serina) permite a conversão do fibrinogénio em fibrina durante a cascata de coagulação, a sua inibição previne a formação de trombos. O dabigatrano também inibe a trombina livre, a trombina ligada à fibrina e a agregação plaquetária induzida pela trombina. Efeitos farmacodinâmicos Os estudos em animais in vivo e ex vivo demonstraram a eficácia antitrombótica e a atividade anticoagulante do dabigatrano após administração intravenosa e do dabigatrano etexilato após administração oral em vários modelos animais de trombose. Com base em estudos de fase II, existe uma clara correlação entre a concentração plasmática do dabigatrano e o grau do efeito anticoagulante. O dabigatrano prolonga o Tempo de Trombina (TT), o ECT e o aptt. O teste de TT diluído (dtt) calibrado fornece uma estimativa da concentração plasmática do dabigatrano, que pode ser comparada às concentrações plasmáticas esperadas de dabigatrano. O ECT pode fornecer uma medida direta da atividade dos inibidores diretos da trombina. O teste de aptt é um teste que se encontra largamente disponível e fornece uma indicação aproximada da intensidade da anticoagulação obtida com dabigatrano. No entanto, o teste de aptt tem uma sensibilidade limitada e não é adequado para uma quantificação precisa do efeito anticoagulante, especialmente em presença de concentrações plasmáticas de dabigatrano elevadas. Valores elevados de aptt devem ser interpretados com precaução. No geral, pode assumir-se que estas medições da atividade anticoagulante podem refletir os níveis de dabigatrano e podem fornecer uma orientação para a avaliação do risco de hemorragia, i.e. excedendo o 90º percentil dos níveis de dabigatrano em vale ou um teste da coagulação como o aptt medido em vale, é considerado como estando associado a um risco de hemorragia aumentado. A média geométrica do pico da concentração plasmática do dabigatrano no estado estacionário (após o 3º dia), medido aproximadamente 2 horas após a administração de 220 mg de dabigatrano etexilato, foi 70,8 ng/ml, com um intervalo de 35,2-162 ng/ml (25%-75% em intervalo percentual). 17
18 A média geométrica da concentração de vale do dabigatrano, medida no fim do intervalo de dosagem (ou seja, 24 horas após uma dose de 220 mg de dabigatrano), foi em média 22,0 ng/ml, com um intervalo de 13,0-35,7 ng/ml (25%-75% em intervalo percentual). Em doentes tratados com 220 mg de dabigatrano etexilato, uma vez por dia, para prevenção de TEVs após artroplastia eletiva da anca ou joelho, - o percentil 90 de concentrações plasmáticas de dabigatrano foi de 67 ng/ml, medidos em vale (20-28 horas após a dose prévia) (ver secções 4.4 e 4.9), - o percentil 90 de aptt em vale (20-28 horas após a dose prévia) foi de 51 segundos, o que seria 1,3 vezes o limite superior normal. O ECT não foi medido em doentes tratados com 220 mg dabigatrano etexilato, uma vez por dia, para a prevenção de TEVs após artroplastia eletiva da anca ou do joelho. Eficácia e segurança clínicas Origem étnica Não foram observadas diferenças étnicas clinicamente relevantes entre doentes Caucasianos, Afro- Americanos, Hispânicos, Japoneses ou Chineses. Ensaios clínicos na profilaxia do Tromboembolismo Venoso (TEV) após cirurgia major artroplastia total Em 2 grandes ensaios aleatorizados, de grupos paralelos, com dupla ocultação, para confirmação de dose, os doentes que foram sujeitos a cirurgia ortopédica major eletiva (um para artroplastia totaldo joelho e outro para artroplastia total da anca) tomaram Pradaxa 75 mg ou 110 mg, 1-4 horas após cirurgia seguidos de 150 mg ou 220 mg diariamente, estando a hemostase assegurada, ou enoxaparina 40 mg no dia anterior à cirurgia e diariamente a partir daí. A duração do tratamento no ensaio RE-MODEL (artroplastia total do joelho) foi de 6-10 dias e, no ensaio RE-NOVATE (artroplastia total da anca), foi de dias. Um total de doentes (joelho) e de (anca) foram, respetivamente, tratados. O parâmetro primário para ambos os ensaios foi o composto de TEV total (incluindo embolia pulmonar, trombose venosa profunda proximal e distal, tanto sintomática como assintomática, detetada através de venografia de rotina) e a mortalidade por qualquer causa. O parâmetro secundário, considerado de maior relevância clínica, foi o composto de TEV grave (incluindo embolia pulmonar e trombose venosa profunda proximal, tanto sintomática como assintomática, detetada através de venografia de rotina) e a mortalidade relacionada com TEV. Os resultados de ambos os ensaios demonstraram que o efeito antitrombótico de 150 mg e 220 mg de Pradaxa não foi estatisticamente inferior ao da enoxaparina no TEV total e mortalidade por qualquer causa. O valor estimado da incidência de TEV grave e mortalidade relacionada com TVE para a dose de 150 mg foi ligeiramente pior do que para a enoxaparina (tabela 6). Foram observados melhores resultados com a dose de 220 mg, em que o valor estimado de TEV grave foi ligeiramente melhor do que com a enoxaparina (tabela 6). Os estudos clínicos foram realizados numa população de doentes com uma idade média > 65 anos. Não se verificaram quaisquer diferenças nos dados de eficácia e segurança entre homens e mulheres nos ensaios de fase 3. Na população de doentes estudada do RE-MODEL e RE-NOVATE (5.539 doentes tratados), 51% sofria concomitantemente de hipertensão, 9% de diabetes, 9% de doença arterial coronária e 20% tinha história de insuficiência venosa. Nenhuma destas patologias demonstrou ter impacto nos efeitos do dabigatrano na prevenção de TEV ou nas taxas de hemorragia. 18
19 Os dados relativos aos resultados de TEV grave e de mortalidade relacionada com o TEV foram semelhantes no que respeita ao parâmetro primário de eficácia e são apresentados na tabela 6. Os dados relativos ao TEV total e à mortalidade por qualquer causa são apresentados na tabela 7. Os dados relativos a hemorragia grave são apresentados na tabela 8. Tabela 6: Análise do TEV grave e mortalidade associada com TEV durante o período de tratamento dos estudos na cirurgia ortopédica RE-MODEL e RE-NOVATE Ensaio Dabigatrano etexilato 220 mg Dabigatrano etexilato 150 mg Enoxaparina 40 mg RE-NOVATE (anca) N Incidências (%) 28 (3,1) 38 (4,3) 36 (3,9) Proporção de risco vs. 0,78 1,09 enoxaparina IC 95% 0,48; 1,27 0,70; 1,70 RE-MODEL (joelho) N Incidências (%) 13 (2,6) 20 (3,8) 18 (3,5) Proporção de risco vs. enoxaparina 0,73 1,08 IC 95% 0,36; 1,47 0,58; 2,01 Tabela 7: Análise do TEV total e mortalidade por qualquer causa durante o período de tratamento dos estudos na cirurgia ortopédica RE-MODEL e RE-NOVATE Ensaio Dabigatrano etexilato 220 mg Dabigatrano etexilato 150 mg Enoxaparina 40 mg RE-NOVATE (anca) N Incidências (%) 53 (6,0) 75 (8,6) 60 (6,7) Proporção de risco vs. 0,9 1,28 enoxaparina IC 95% (0,63; 1,29) 0,93; 1,78 RE-MODEL (joelho) N Incidências (%) 183 (36,4) 213 (40,5) 193 (37,7) Proporção de risco vs. enoxaparina 0,97 1,07 IC 95% (0,82; 1,13) (0,92; 1,25) 19
20 Tabela 8: Acontecimentos hemorrágicos major por tratamento nos estudos individuais RE-MODEL e RE-NOVATE Ensaio Dabigatrano etexilato 220 mg Dabigatrano etexilato 150 mg Enoxaparina 40 mg RE-NOVATE (anca) Doentes tratados N Número de Acontecimentos hemorrágicos major N(%) 23 (2,0) 15 (1,3) 18 (1,6) RE-MODEL (joelho) Doentes tratados N Número de Acontecimentos hemorrágicos major N(%) População pediátrica 10 (1,5) 9 (1,3) 9 (1,3) A Agência Europeia de Medicamentos determinou a não obrigatoriedade de apresentar os resultados dos estudos com Pradaxa em todos os subgrupos da população pediátrica na prevenção dos acontecimentos tromboembólicos na indicação aprovada (ver secção 4.2 para informação sobre utilização pediátrica). Ensaios clínicos na prevenção do tromboembolismo em doentes com próteses valvulares cardíacas Um estudo de fase II avaliou o dabigatrano etexilato e a varfarina num total de 252 doentes recentemente submetidos a cirurgia de substituição de válvula cardíaca mecânica (ou seja, durante o período de internamento) e doentes submetidos a cirurgia de substituição de válvula cardíaca mecânica há mais de 3 meses. Foram observados mais eventos tromboembólicos (maioritariamente AVCs e trombose de prótese valvular sintomática/assintomática) e mais eventos hemorrágicos com o dabigatrano em comparação com a varfarina. Nos doentes recentemente submetidos a cirurgia, a hemorragia major manifestou-se predominantemente como derrame pericárdico hemorrágico, especificamente nos doentes que iniciaram o dabigatrano etexilato logo após a cirurgia (i.e., no Dia 3) de substituição de válvula cardíaca mecânica (ver secção 4.3). 5.2 Propriedades farmacocinéticas Após administração oral, o dabigatrano etexilato é rápida e completamente convertido em dabigatrano, que é a forma plasmática ativa. A clivagem do profármaco, dabigatrano etexilato, por hidrólise catalisada pela esterase no princípio ativo dabigatrano, é a reação metabólica predominante. A biodisponibilidade absoluta do dabigatrano após administração oral de Pradaxa foi aproximadamente 6,5%. Após administração oral do Pradaxa em voluntários saudáveis, o perfil farmacocinético do dabigatrano no plasma é caracterizado por um rápido aumento nas concentrações plasmáticas sendo a Cmax alcançada 0,5 a 2,0 horas após administração. Absorção Um estudo que avaliou a absorção pós-operatória do dabigatrano etexilato, 1-3 horas após a cirurgia, demonstrou uma absorção relativamente lenta quando comparada com voluntários saudáveis, mostrando um perfil de concentração plasmática-tempo mais plano, sem concentrações plasmáticas máximas elevadas. As concentrações plasmáticas máximas são atingidas 6 horas após administração em período pós-operatório devido a fatores contribuintes como a anestesia, a paresia gastrointestinal e os efeitos cirúrgicos, independentes da formulação oral do medicamento. Num estudo posterior ficou demonstrado que a absorção lenta e atrasada está geralmente presente apenas no dia da cirurgia. Nos 20
Este Guia de Prescrição não substitui o Resumo das Características do Medicamento (RCM) do Pradaxa.
 PRADAXA GUIA DE PRESCRIÇÃO PARA O TRATAMENTO DA TROMBOSE VENOSA PROFUNDA (TVP) E DA EMBOLIA PULMONAR (EP), E PREVENÇÃO DA TVP E DA EP RECORRENTE EM ADULTOS (TVP/EP) PRADAXA GUIA DE PRESCRIÇÃO PARA O TRATAMENTO
PRADAXA GUIA DE PRESCRIÇÃO PARA O TRATAMENTO DA TROMBOSE VENOSA PROFUNDA (TVP) E DA EMBOLIA PULMONAR (EP), E PREVENÇÃO DA TVP E DA EP RECORRENTE EM ADULTOS (TVP/EP) PRADAXA GUIA DE PRESCRIÇÃO PARA O TRATAMENTO
ANEXO I RESUMO DAS CARACTERÍSTICAS DO MEDICAMENTO
 ANEXO I RESUMO DAS CARACTERÍSTICAS DO MEDICAMENTO 1 1. NOME DO MEDICAMENTO Pradaxa 75 mg cápsulas 2. COMPOSIÇÃO QUALITATIVA E QUANTITATIVA Cada cápsula contém 75 mg de dabigatrano etexilato (sob a forma
ANEXO I RESUMO DAS CARACTERÍSTICAS DO MEDICAMENTO 1 1. NOME DO MEDICAMENTO Pradaxa 75 mg cápsulas 2. COMPOSIÇÃO QUALITATIVA E QUANTITATIVA Cada cápsula contém 75 mg de dabigatrano etexilato (sob a forma
Guia do prescritor rivaroxabano
 Guia do prescritor rivaroxabano Informação importante de segurança Bayer Portugal, S.A. Rua Quinta do Pinheiro, nº 5 2794-003 Carnaxide NIF: 500 043256 Versão 4, agosto 2014 Este medicamento está sujeito
Guia do prescritor rivaroxabano Informação importante de segurança Bayer Portugal, S.A. Rua Quinta do Pinheiro, nº 5 2794-003 Carnaxide NIF: 500 043256 Versão 4, agosto 2014 Este medicamento está sujeito
NOVOS ANTICOAGULANTES NO
 NOVOS ANTICOAGULANTES NO TEV Guilherme Parreiras Médico Pneumologista do HJK Coordenador do Ambulatório de Anticoagulação do HJK 05/2014 OBJETIVOS DA AULA Introdução Características dos novos Anticoagulantes
NOVOS ANTICOAGULANTES NO TEV Guilherme Parreiras Médico Pneumologista do HJK Coordenador do Ambulatório de Anticoagulação do HJK 05/2014 OBJETIVOS DA AULA Introdução Características dos novos Anticoagulantes
Trombofilias. Dr Alexandre Apa
 Trombofilias Dr Alexandre Apa TENDÊNCIA À TROMBOSE TRÍADE DE VIRCHOW Mudanças na parede do vaso Mudanças no fluxo sanguíneo Mudanças na coagulação do sangue ESTADOS DE HIPERCOAGULABILIDADE
Trombofilias Dr Alexandre Apa TENDÊNCIA À TROMBOSE TRÍADE DE VIRCHOW Mudanças na parede do vaso Mudanças no fluxo sanguíneo Mudanças na coagulação do sangue ESTADOS DE HIPERCOAGULABILIDADE
Boehringer Ingelheim do Brasil Química e Farmacêutica Ltda. Cápsulas 75 mg, 110 mg e 150 mg
 PRADAXA (etexilato de dabigatrana) Boehringer Ingelheim do Brasil Química e Farmacêutica Ltda. Cápsulas 75 mg, 110 mg e 150 mg APRESENTAÇÕES PRADAXA 75 mg: embalagens com 10 e 30 cápsulas PRADAXA 110 mg
PRADAXA (etexilato de dabigatrana) Boehringer Ingelheim do Brasil Química e Farmacêutica Ltda. Cápsulas 75 mg, 110 mg e 150 mg APRESENTAÇÕES PRADAXA 75 mg: embalagens com 10 e 30 cápsulas PRADAXA 110 mg
Manuseio Peri-operatório dos. dos doentes medicados com Anticoagulantes Orais Diretos (AOD)
 Manuseio Peri-operatório dos doentes medicados com Anticoagulantes Orais Diretos Guia de Consenso 2014 I. MANUSEIO PERI-OPERATÓRIO EM DOENTES MEDICADOS COM ANTICOAGULANTES ORAIS DIRETOS 1. Fatores a considerar
Manuseio Peri-operatório dos doentes medicados com Anticoagulantes Orais Diretos Guia de Consenso 2014 I. MANUSEIO PERI-OPERATÓRIO EM DOENTES MEDICADOS COM ANTICOAGULANTES ORAIS DIRETOS 1. Fatores a considerar
ANEXO III ALTERAÇÕES ÀS SECÇÕES RELEVANTES DO RESUMO DAS CARACTERÍSTICAS DO MEDICAMENTO E DO FOLHETO INFORMATIVO
 ANEXO III ALTERAÇÕES ÀS SECÇÕES RELEVANTES DO RESUMO DAS CARACTERÍSTICAS DO MEDICAMENTO E DO FOLHETO INFORMATIVO Nota: O resumo das características do medicamento e o folheto informativo podem necessitar
ANEXO III ALTERAÇÕES ÀS SECÇÕES RELEVANTES DO RESUMO DAS CARACTERÍSTICAS DO MEDICAMENTO E DO FOLHETO INFORMATIVO Nota: O resumo das características do medicamento e o folheto informativo podem necessitar
ALTERAÇÕES A INCLUIR NAS SECÇÕES RELEVANTES DO RESUMO DAS CARACTERÍSTICAS DOS MEDICAMENTOS QUE CONTENHAM NIMESULIDA (FORMULAÇÕES SISTÉMICAS)
 ANEXO III 58 ALTERAÇÕES A INCLUIR NAS SECÇÕES RELEVANTES DO RESUMO DAS CARACTERÍSTICAS DOS MEDICAMENTOS QUE CONTENHAM NIMESULIDA (FORMULAÇÕES SISTÉMICAS) Adições aparecem em itálico e sublinhado; rasuras
ANEXO III 58 ALTERAÇÕES A INCLUIR NAS SECÇÕES RELEVANTES DO RESUMO DAS CARACTERÍSTICAS DOS MEDICAMENTOS QUE CONTENHAM NIMESULIDA (FORMULAÇÕES SISTÉMICAS) Adições aparecem em itálico e sublinhado; rasuras
ENOXALOW enoxaparina sódica. Forma farmacêutica e apresentações Solução injetável. Via de administração: IV/SC
 ENOXALOW enoxaparina sódica Forma farmacêutica e apresentações Solução injetável. Via de administração: IV/SC 20 mg/0,2 ml cartucho com 1 ou 10 seringas. 40 mg/0,4 ml cartucho com 1 ou 10 seringas. 60
ENOXALOW enoxaparina sódica Forma farmacêutica e apresentações Solução injetável. Via de administração: IV/SC 20 mg/0,2 ml cartucho com 1 ou 10 seringas. 40 mg/0,4 ml cartucho com 1 ou 10 seringas. 60
INFORMAÇÃO DE SEGURANÇA IMPORTANTE
 INFORMAÇÃO DE SEGURANÇA IMPORTANTE para os médicos prescritores de PROTELOS /OSSEOR (Ranelato de estrôncio) 2 g granulado para suspensão oral Estes medicamentos estão sujeitos a monitorização adicional
INFORMAÇÃO DE SEGURANÇA IMPORTANTE para os médicos prescritores de PROTELOS /OSSEOR (Ranelato de estrôncio) 2 g granulado para suspensão oral Estes medicamentos estão sujeitos a monitorização adicional
Anexo I. Conclusões científicas e fundamentos para a alteração dos termos das Autorizações de Introdução no Mercado
 Anexo I Conclusões científicas e fundamentos para a alteração dos termos das Autorizações de Introdução no Mercado Conclusões científicas Tendo em conta o relatório de avaliação do PRAC sobre os RPS para
Anexo I Conclusões científicas e fundamentos para a alteração dos termos das Autorizações de Introdução no Mercado Conclusões científicas Tendo em conta o relatório de avaliação do PRAC sobre os RPS para
Abcd PRADAXA. Boehringer Ingelheim cápsulas 75 mg 110 mg 150 mg
 Abcd PRADAXA Boehringer Ingelheim cápsulas 75 mg 110 mg 150 mg APRESENTAÇÕES PRADAXA 75 mg: embalagens com 10 e 30 cápsulas PRADAXA 110 mg e 150 mg: embalagens com 10, 30 e 60 cápsulas USO ORAL USO ADULTO
Abcd PRADAXA Boehringer Ingelheim cápsulas 75 mg 110 mg 150 mg APRESENTAÇÕES PRADAXA 75 mg: embalagens com 10 e 30 cápsulas PRADAXA 110 mg e 150 mg: embalagens com 10, 30 e 60 cápsulas USO ORAL USO ADULTO
ANEXO I RESUMO DAS CARACTERÍSTICAS DO MEDICAMENTO
 ANEXO I RESUMO DAS CARACTERÍSTICAS DO MEDICAMENTO 1 Este medicamento está sujeito a monitorização adicional. Isto irá permitir a rápida identificação de nova informação de segurança. Pede-se aos profissionais
ANEXO I RESUMO DAS CARACTERÍSTICAS DO MEDICAMENTO 1 Este medicamento está sujeito a monitorização adicional. Isto irá permitir a rápida identificação de nova informação de segurança. Pede-se aos profissionais
ANEXO I. Conclusões científicas e fundamentos para a alteração dos termos das autorizações de introdução no mercado
 ANEXO I Conclusões científicas e fundamentos para a alteração dos termos das autorizações de introdução no mercado Conclusões científicas - Síndrome de abstinência: Ocorreram 54 casos de arrepios com Effentora/Actiq,
ANEXO I Conclusões científicas e fundamentos para a alteração dos termos das autorizações de introdução no mercado Conclusões científicas - Síndrome de abstinência: Ocorreram 54 casos de arrepios com Effentora/Actiq,
ANEXO I RESUMO DE CARACTERÍSTICAS DO MEDICAMENTO
 ANEXO I RESUMO DE CARACTERÍSTICAS DO MEDICAMENTO 1 1. NOME DO MEDICAMENTO Arixtra 1,5 mg/0,3 ml solução injetável, seringa pré-cheia. 2. COMPOSIÇÃO QUALITATIVA E QUANTITATIVA Cada seringa pré-cheia (0,3
ANEXO I RESUMO DE CARACTERÍSTICAS DO MEDICAMENTO 1 1. NOME DO MEDICAMENTO Arixtra 1,5 mg/0,3 ml solução injetável, seringa pré-cheia. 2. COMPOSIÇÃO QUALITATIVA E QUANTITATIVA Cada seringa pré-cheia (0,3
CETIRIZINA HISTACET 10 mg COMPRIMIDOS REVESTIDOS
 FOLHETO INFORMATIVO Leia atentamente este folheto antes de tomar o medicamento -Conserve este folheto: Pode ter necessidade de o reler. -Caso tenha dúvidas, consulte o seu médico ou farmacêutico. -Este
FOLHETO INFORMATIVO Leia atentamente este folheto antes de tomar o medicamento -Conserve este folheto: Pode ter necessidade de o reler. -Caso tenha dúvidas, consulte o seu médico ou farmacêutico. -Este
CENTRO DE APOIO OPERACIONAL DE DEFESA DA SAÚDE CESAU. Av. Joana Angélica, 1312, Prédio Principal, sala 404 Nazaré. Tel.: 71 3103-6436 / 6812.
 ORIENTAÇÃO TÉCNICA N.º 08 /2014 - CESAU Salvador, 23 de janeiro de 2014. OBJETO: Parecer. - Centro de Apoio Operacional de Defesa da Saúde- CESAU REFERÊNCIA:xxxPromotoria da Justiça de xxx/dispensação
ORIENTAÇÃO TÉCNICA N.º 08 /2014 - CESAU Salvador, 23 de janeiro de 2014. OBJETO: Parecer. - Centro de Apoio Operacional de Defesa da Saúde- CESAU REFERÊNCIA:xxxPromotoria da Justiça de xxx/dispensação
CENTRO DE APOIO OPERACIONAL DE DEFESA DA SAÚDE CESAU ORIENTAÇÃO TÉCNICA N.º10 /2014 - CESAU
 ORIENTAÇÃO TÉCNICA N.º10 /2014 - CESAU Salvador, 27 de janeiro de 2014. OBJETO: Parecer. - Centro de Apoio Operacional de Defesa da Saúde- CESAU REFERÊNCIA: xxx Promotoria da Justiça de Brumado/Dispensação
ORIENTAÇÃO TÉCNICA N.º10 /2014 - CESAU Salvador, 27 de janeiro de 2014. OBJETO: Parecer. - Centro de Apoio Operacional de Defesa da Saúde- CESAU REFERÊNCIA: xxx Promotoria da Justiça de Brumado/Dispensação
Aesculus hippocastanum
 Novarrutina Aesculus hippocastanum FITOTERÁPICO Parte utilizada: semente Nomenclatura botânica Nome científico: Aesculus hippocastanum Nome popular: Castanha da Índia Família: Hippocastanaceae. Formas
Novarrutina Aesculus hippocastanum FITOTERÁPICO Parte utilizada: semente Nomenclatura botânica Nome científico: Aesculus hippocastanum Nome popular: Castanha da Índia Família: Hippocastanaceae. Formas
Terapêutica anticoagulante oral
 Terapêutica anticoagulante oral Quando iniciar? Quando e como suspender? Quando parar definitivamente? Eugénia Cruz e Sara Morais Serviço de Hematologia Clínica, Hospital de Santo António 1º Encontro Proximidade
Terapêutica anticoagulante oral Quando iniciar? Quando e como suspender? Quando parar definitivamente? Eugénia Cruz e Sara Morais Serviço de Hematologia Clínica, Hospital de Santo António 1º Encontro Proximidade
O que muda com os novos an.coagulantes? Daniela Calderaro Luciana S. Fornari
 O que muda com os novos an.coagulantes? Daniela Calderaro Luciana S. Fornari Pacientes e clínicos devem receber diretrizes prá5cas sobre o uso dos novos an5coagulantes orais, e a facilidade de uso destes
O que muda com os novos an.coagulantes? Daniela Calderaro Luciana S. Fornari Pacientes e clínicos devem receber diretrizes prá5cas sobre o uso dos novos an5coagulantes orais, e a facilidade de uso destes
PROF.: FERNANDA BRITO Disciplina Farmacologia. fernandabrito@vm.uff.br
 PROF.: FERNANDA BRITO Disciplina Farmacologia fernandabrito@vm.uff.br EXEMPLOS DE ESQUEMAS COMPARTIMENTAIS DO CORPO TGI COMPARTIMENTO CENTRAL CÉREBRO FÍGADO ELIMINAÇÃO METABÓLICA EXCREÇÃO RENAL OUTROS
PROF.: FERNANDA BRITO Disciplina Farmacologia fernandabrito@vm.uff.br EXEMPLOS DE ESQUEMAS COMPARTIMENTAIS DO CORPO TGI COMPARTIMENTO CENTRAL CÉREBRO FÍGADO ELIMINAÇÃO METABÓLICA EXCREÇÃO RENAL OUTROS
Anexo III. Resumo das características do medicamento
 Anexo III Resumo das características do medicamento 10 RESUMO DAS CARACTERÍSTICAS DO MEDICAMENTO E FOLHETO INFORMATIVO 11 RESUMO DAS CARACTERÍSTICAS DO MEDICAMENTO 12 1. NOME DO MEDICAMENTO
Anexo III Resumo das características do medicamento 10 RESUMO DAS CARACTERÍSTICAS DO MEDICAMENTO E FOLHETO INFORMATIVO 11 RESUMO DAS CARACTERÍSTICAS DO MEDICAMENTO 12 1. NOME DO MEDICAMENTO
DOBEVEN. dobesilato de cálcio. APRESENTAÇÕES Cápsula gelatinosa dura contendo 500 mg de dobesilato de cálcio: Caixas com 5 e 30 cápsulas.
 DOBEVEN dobesilato de cálcio APSEN FORMA FARMACÊUTICA Cápsula gelatinosa dura APRESENTAÇÕES Cápsula gelatinosa dura contendo 500 mg de dobesilato de cálcio: Caixas com 5 e 30 cápsulas. USO ORAL USO ADULTO
DOBEVEN dobesilato de cálcio APSEN FORMA FARMACÊUTICA Cápsula gelatinosa dura APRESENTAÇÕES Cápsula gelatinosa dura contendo 500 mg de dobesilato de cálcio: Caixas com 5 e 30 cápsulas. USO ORAL USO ADULTO
Daiichi Sankyo Brasil Farmacêutica Ltda.
 IDENTIFICAÇÃO DO MEDICAMENTO BENICAR olmesartana medoxomila APRESENTAÇÕES Benicar é apresentado em embalagens com 10 ou 30 comprimidos revestidos de olmesartana medoxomila nas concentrações de 20 mg ou
IDENTIFICAÇÃO DO MEDICAMENTO BENICAR olmesartana medoxomila APRESENTAÇÕES Benicar é apresentado em embalagens com 10 ou 30 comprimidos revestidos de olmesartana medoxomila nas concentrações de 20 mg ou
ANEXO I RESUMO DAS CARACTERÍSTICAS DO MEDICAMENTO
 ANEXO I RESUMO DAS CARACTERÍSTICAS DO MEDICAMENTO 1 Este medicamento está sujeito a monitorização adicional. Isto irá permitir a rápida identificação de nova informação de segurança. Pede-se aos profissionais
ANEXO I RESUMO DAS CARACTERÍSTICAS DO MEDICAMENTO 1 Este medicamento está sujeito a monitorização adicional. Isto irá permitir a rápida identificação de nova informação de segurança. Pede-se aos profissionais
Bristol-Myers Squibb Farmacêutica S.A.
 APRESENTAÇÕES ELIQUIS (apixabana) é apresentado na forma farmacêutica de comprimidos revestidos de 2,5 mg em embalagens contendo 10, 20 ou 60 comprimidos. ELIQUIS (apixabana) é também apresentado na forma
APRESENTAÇÕES ELIQUIS (apixabana) é apresentado na forma farmacêutica de comprimidos revestidos de 2,5 mg em embalagens contendo 10, 20 ou 60 comprimidos. ELIQUIS (apixabana) é também apresentado na forma
Anexo I. Titular da autorização de introdução no mercado. Estado Membro. Via de administra ção. Forma farmacêutica. Dosagem
 Anexo I Estado Membro (no EEE) Titular da autorização de introdução no mercado Contacto local DCI Nome de fantasia Dosagem Forma farmacêutica Via de administra ção Fresenius Medical Care Nephrologica Deutschland
Anexo I Estado Membro (no EEE) Titular da autorização de introdução no mercado Contacto local DCI Nome de fantasia Dosagem Forma farmacêutica Via de administra ção Fresenius Medical Care Nephrologica Deutschland
Princípios Ativos Ácido Cítrico,Ácido Acetilsalicílico, Bicarbonato de Sódio e Carbonato de Sodio.
 Sonrisal Classe terapêutica dos Antiacidos. Princípios Ativos Ácido Cítrico,Ácido Acetilsalicílico, Bicarbonato de Sódio e Carbonato de Sodio. Indicação Para quê serve Sonrisal? Sonrisal é indicado como
Sonrisal Classe terapêutica dos Antiacidos. Princípios Ativos Ácido Cítrico,Ácido Acetilsalicílico, Bicarbonato de Sódio e Carbonato de Sodio. Indicação Para quê serve Sonrisal? Sonrisal é indicado como
magnésio, lactose monoidratada, dióxido de titânio, triacetina, óxido de ferro vermelho e óxido de ferro amarelo.
 IDENTIFICAÇÃO DO MEDICAMENTO EFFIENT cloridrato de prasugrel D.C.B. 09669 APRESENTAÇÕES EFFIENT (cloridrato de prasugrel) é apresentado na forma de comprimidos revestidos para administração oral, nas seguintes
IDENTIFICAÇÃO DO MEDICAMENTO EFFIENT cloridrato de prasugrel D.C.B. 09669 APRESENTAÇÕES EFFIENT (cloridrato de prasugrel) é apresentado na forma de comprimidos revestidos para administração oral, nas seguintes
ANEXO CONDIÇÕES OU RESTRIÇÕES RESPEITANTES À UTILIZAÇÃO SEGURA E EFICAZ DO MEDICAMENTO A SEREM IMPLEMENTADAS PELOS ESTADOS-MEMBROS
 ANEXO CONDIÇÕES OU RESTRIÇÕES RESPEITANTES À UTILIZAÇÃO SEGURA E EFICAZ DO MEDICAMENTO A SEREM IMPLEMENTADAS PELOS ESTADOS-MEMBROS 1 Os Estados-Membros devem garantir que todas as condições ou restrições
ANEXO CONDIÇÕES OU RESTRIÇÕES RESPEITANTES À UTILIZAÇÃO SEGURA E EFICAZ DO MEDICAMENTO A SEREM IMPLEMENTADAS PELOS ESTADOS-MEMBROS 1 Os Estados-Membros devem garantir que todas as condições ou restrições
Encerrado o XXXIII Congresso Português de Cardiologia, cumpre-se o lema: «Reunir em equipa para proteger e tratar o coração»
 24 Abril de 2012 Jornal do Com a garantia www.jasfarma.com 22-24 Abril 2012 Tivoli Marina Vilamoura A SPC tem um papel extremamente importante no seio da própria ESC Prof. Doutor Michel Komadja Página
24 Abril de 2012 Jornal do Com a garantia www.jasfarma.com 22-24 Abril 2012 Tivoli Marina Vilamoura A SPC tem um papel extremamente importante no seio da própria ESC Prof. Doutor Michel Komadja Página
CDS22FEV08 EFFIENT cloridrato de prasugrel D.C.B. 09669 APRESENTAÇÕES EFFIENT (cloridrato de prasugrel) é apresentado na forma de comprimidos
 CDS22FEV08 EFFIENT cloridrato de prasugrel D.C.B. 09669 APRESENTAÇÕES EFFIENT (cloridrato de prasugrel) é apresentado na forma de comprimidos revestidos para administração oral, nas seguintes concentrações:
CDS22FEV08 EFFIENT cloridrato de prasugrel D.C.B. 09669 APRESENTAÇÕES EFFIENT (cloridrato de prasugrel) é apresentado na forma de comprimidos revestidos para administração oral, nas seguintes concentrações:
Anexo III. Alterações a incluir nas secções relevantes do Resumo das Características do Medicamento e do Folheto Informativo
 Anexo III Alterações a incluir nas secções relevantes do Resumo das Características do Medicamento e do Folheto Informativo Nota: Este Resumo das Características do Medicamento, rotulagem e folheto informativo
Anexo III Alterações a incluir nas secções relevantes do Resumo das Características do Medicamento e do Folheto Informativo Nota: Este Resumo das Características do Medicamento, rotulagem e folheto informativo
Boehringer Ingelheim do Brasil Química e Farmacêutica Ltda. Cápsulas moles 100 mg e 150 mg
 OFEV (esilato de nintedanibe) Boehringer Ingelheim do Brasil Química e Farmacêutica Ltda. Cápsulas moles 100 mg e 150 mg Ofev esilato de nintedanibe APRESENTAÇÕES Cápsulas moles de 100 mg e 150 mg: embalagem
OFEV (esilato de nintedanibe) Boehringer Ingelheim do Brasil Química e Farmacêutica Ltda. Cápsulas moles 100 mg e 150 mg Ofev esilato de nintedanibe APRESENTAÇÕES Cápsulas moles de 100 mg e 150 mg: embalagem
DOBEVEN. Apsen Farmacêutica S.A. Cápsula gelatinosa dura 500 mg
 DOBEVEN Apsen Farmacêutica S.A. Cápsula gelatinosa dura 500 mg DOBEVEN dobesilato de cálcio APSEN FORMA FARMACÊUTICA Cápsula gelatinosa dura APRESENTAÇÕES Cápsula gelatinosa dura contendo 500 mg de dobesilato
DOBEVEN Apsen Farmacêutica S.A. Cápsula gelatinosa dura 500 mg DOBEVEN dobesilato de cálcio APSEN FORMA FARMACÊUTICA Cápsula gelatinosa dura APRESENTAÇÕES Cápsula gelatinosa dura contendo 500 mg de dobesilato
Arixtra. fondaparinux sódico USO ADULTO
 Arixtra I) IDENTIFICAÇÃO DO MEDICAMENTO FORMA FARMACÊUTICA, VIAS DE ADMINISTRAÇÃO E APRESENTAÇÕES COMERCIALIZADAS Solução injetável para uso subcutâneo ou intravenoso. Apresentado em embalagens contendo
Arixtra I) IDENTIFICAÇÃO DO MEDICAMENTO FORMA FARMACÊUTICA, VIAS DE ADMINISTRAÇÃO E APRESENTAÇÕES COMERCIALIZADAS Solução injetável para uso subcutâneo ou intravenoso. Apresentado em embalagens contendo
ANEXO I RESUMO DAS CARACTERÍSTICAS DO MEDICAMENTO
 ANEXO I RESUMO DAS CARACTERÍSTICAS DO MEDICAMENTO 1 1. NOME DO MEDICAMENTO Pradaxa 75 mg cápsulas 2. COMPOSIÇÃO QUALITATIVA E QUANTITATIVA Cada cápsula contém 75 mg de dabigatrano etexilato (sob a forma
ANEXO I RESUMO DAS CARACTERÍSTICAS DO MEDICAMENTO 1 1. NOME DO MEDICAMENTO Pradaxa 75 mg cápsulas 2. COMPOSIÇÃO QUALITATIVA E QUANTITATIVA Cada cápsula contém 75 mg de dabigatrano etexilato (sob a forma
1. O QUE É PARACETAMOL BLUEPHARMA E PARA QUE É UTILIZADO. Grupo Farmacoterapêutico: 2.10 - Sistema Nervoso Central - Analgésicos e antipiréticos
 Folheto Informativo Informação para o utilizador Paracetamol Bluepharma Paracetamol Este folheto contém informações importantes para si. Leia-o atentamente Este medicamento pode ser adquirido sem receita
Folheto Informativo Informação para o utilizador Paracetamol Bluepharma Paracetamol Este folheto contém informações importantes para si. Leia-o atentamente Este medicamento pode ser adquirido sem receita
Estado- Titular da autorização de Nome do medicamento introdução no mercado. Postfach 210805 Ludwigshafen DE 67008 Germany.
 Anexo I 3 Substância: Propil-hexedrina Estado- Titular da autorização de Nome do medicamento Membro introdução no mercado Alemanha Knoll AG Postfach 210805 Ludwigshafen DE 67008 Germany Eventin 4 Substância:
Anexo I 3 Substância: Propil-hexedrina Estado- Titular da autorização de Nome do medicamento Membro introdução no mercado Alemanha Knoll AG Postfach 210805 Ludwigshafen DE 67008 Germany Eventin 4 Substância:
Informação de Segurança para os Profissionais de Saúde
 Agomelatina Informação de Segurança para os Profissionais de Saúde Monitorização da função hepática 03 Valdoxan está indicado para o tratamento de episódios de depressão major em adultos. Para assegurar
Agomelatina Informação de Segurança para os Profissionais de Saúde Monitorização da função hepática 03 Valdoxan está indicado para o tratamento de episódios de depressão major em adultos. Para assegurar
TROMBOSE VENOSA PROFUNDA (TVP) E TROMBOEMBOLISMO PULMONAR (TEP)
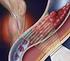 TROMBOSE VENOSA PROFUNDA (TVP) E TROMBOEMBOLISMO PULMONAR (TEP) - Fatores de risco: Idade superior a 40 anos Acidente vascular cerebral (isquêmico ou hemorrágico) Paralisia de membros inferiores Infarto
TROMBOSE VENOSA PROFUNDA (TVP) E TROMBOEMBOLISMO PULMONAR (TEP) - Fatores de risco: Idade superior a 40 anos Acidente vascular cerebral (isquêmico ou hemorrágico) Paralisia de membros inferiores Infarto
IDENTIFICAÇÃO DO MEDICAMENTO DAFLON. 500mg: diosmina 450mg + hesperidina 50mg micronizada. 1000mg: diosmina 900mg + hesperidina 100mg micronizada
 1 IDENTIFICAÇÃO DO MEDICAMENTO DAFLON 500mg: diosmina 450mg + hesperidina 50mg micronizada 1000mg: diosmina 900mg + hesperidina 100mg micronizada APRESENTAÇÕES: DAFLON 500mg: embalagem contendo 15, 30
1 IDENTIFICAÇÃO DO MEDICAMENTO DAFLON 500mg: diosmina 450mg + hesperidina 50mg micronizada 1000mg: diosmina 900mg + hesperidina 100mg micronizada APRESENTAÇÕES: DAFLON 500mg: embalagem contendo 15, 30
BROCHURA para o DOENTE com ARTRITE IDIOPÁTICA JUVENIL POLIARTICULAR (AIJp) em TRATAMENTO com RoACTEMRA
 BROCHURA para o DOENTE com ARTRITE IDIOPÁTICA JUVENIL POLIARTICULAR (AIJp) em TRATAMENTO com RoACTEMRA Esta brochura fornece informação de segurança importante para o doente com AIJp e para os seus pais/responsáveis
BROCHURA para o DOENTE com ARTRITE IDIOPÁTICA JUVENIL POLIARTICULAR (AIJp) em TRATAMENTO com RoACTEMRA Esta brochura fornece informação de segurança importante para o doente com AIJp e para os seus pais/responsáveis
DOBEVEN. dobesilato de cálcio. APRESENTAÇÕES Cápsula gelatinosa dura contendo 500 mg de dobesilato de cálcio: Caixas com 5 e 30 cápsulas.
 DOBEVEN dobesilato de cálcio APRESENTAÇÕES Cápsula gelatinosa dura contendo 500 mg de dobesilato de cálcio: Caixas com 5 e 30 cápsulas. USO ORAL USO ADULTO COMPOSIÇÃO Cada cápsula gelatinosa dura contém:
DOBEVEN dobesilato de cálcio APRESENTAÇÕES Cápsula gelatinosa dura contendo 500 mg de dobesilato de cálcio: Caixas com 5 e 30 cápsulas. USO ORAL USO ADULTO COMPOSIÇÃO Cada cápsula gelatinosa dura contém:
APROVADO EM 04-08-2011 INFARMED. Folheto Informativo: Informação para o utilizador. Paracetamol Azevedos, 500 mg, comprimidos Paracetamol
 Folheto Informativo: Informação para o utilizador Paracetamol Azevedos, 500 mg, comprimidos Paracetamol Leia com atenção todo este folheto antes de começar a tomar este medicamento pois contém informação
Folheto Informativo: Informação para o utilizador Paracetamol Azevedos, 500 mg, comprimidos Paracetamol Leia com atenção todo este folheto antes de começar a tomar este medicamento pois contém informação
Dimensão Segurança do Doente. Check-list Procedimentos de Segurança
 1. 1.1 1.2 Cultura de Segurança Existe um elemento(s) definido(s) com responsabilidade atribuída para a segurança do doente Promove o trabalho em equipa multidisciplinar na implementação de processos relativos
1. 1.1 1.2 Cultura de Segurança Existe um elemento(s) definido(s) com responsabilidade atribuída para a segurança do doente Promove o trabalho em equipa multidisciplinar na implementação de processos relativos
LABIRIN. dicloridrato de betaistina APSEN. FORMA FARMACÊUTICA Comprimidos. APRESENTAÇÕES Comprimidos de 24 mg. Caixa com 30 comprimidos.
 LABIRIN dicloridrato de betaistina APSEN FORMA FARMACÊUTICA Comprimidos APRESENTAÇÕES Comprimidos de 24 mg. Caixa com 30 comprimidos. USO ORAL USO ADULTO COMPOSIÇÃO Cada comprimido contém: 24 mg dicloridrato
LABIRIN dicloridrato de betaistina APSEN FORMA FARMACÊUTICA Comprimidos APRESENTAÇÕES Comprimidos de 24 mg. Caixa com 30 comprimidos. USO ORAL USO ADULTO COMPOSIÇÃO Cada comprimido contém: 24 mg dicloridrato
Excipientes: cloreto de sódio, água para injeção (ácido clorídrico ou hidróxido de sódio para ajuste do ph, conforme necessário).
 LEIA ESTA BULA ATENTAMENTE ANTES DE INICIAR O TRATAMENTO. I - IDENTIFICAÇÃO DO MEDICAMENTO Arixtra fondaparinux sódico APRESENTAÇÃO Solução injetável para uso subcutâneo (apresentação de 2,5 mg e 7,5 mg)
LEIA ESTA BULA ATENTAMENTE ANTES DE INICIAR O TRATAMENTO. I - IDENTIFICAÇÃO DO MEDICAMENTO Arixtra fondaparinux sódico APRESENTAÇÃO Solução injetável para uso subcutâneo (apresentação de 2,5 mg e 7,5 mg)
RESUMO DAS CARACTERÍSTICAS DO MEDICAMENTO
 RESUMO DAS CARACTERÍSTICAS DO MEDICAMENTO Página 1 de 15 1. NOME DO MEDICAMENTO VETERINÁRIO Fertagyl, 0,1 mg/ml solução injetável para bovinos e coelhos. 2. COMPOSIÇÃO QUALITATIVA E QUANTITATIVA Cada ml
RESUMO DAS CARACTERÍSTICAS DO MEDICAMENTO Página 1 de 15 1. NOME DO MEDICAMENTO VETERINÁRIO Fertagyl, 0,1 mg/ml solução injetável para bovinos e coelhos. 2. COMPOSIÇÃO QUALITATIVA E QUANTITATIVA Cada ml
Não tome Doxivenil Se tem alergia ao dobesilato de cálcio ou a qualquer outro componente deste medicamento (indicados na secção 6)
 Folheto informativo: Informação para o utilizador Doxivenil 500 mg cápsula Dobesilato de cálcio Leia com atenção todo este folheto antes de começar a tomar este medicamento pois contém informação importante
Folheto informativo: Informação para o utilizador Doxivenil 500 mg cápsula Dobesilato de cálcio Leia com atenção todo este folheto antes de começar a tomar este medicamento pois contém informação importante
Rivastigmina (Port.344/98 -C1)
 Rivastigmina (Port.344/98 -C1) Alzheimer DCB: 09456 CAS: 129101-54-8 Fórmula molecular: C 14 H 22 N 2 O 2.C 4 H 6 O 6 Nome químico: (S)-N-Ethyl-3-[(1-dimethylamino)ethyl]-N-methylphenylcarbamate hydrogen
Rivastigmina (Port.344/98 -C1) Alzheimer DCB: 09456 CAS: 129101-54-8 Fórmula molecular: C 14 H 22 N 2 O 2.C 4 H 6 O 6 Nome químico: (S)-N-Ethyl-3-[(1-dimethylamino)ethyl]-N-methylphenylcarbamate hydrogen
Tiaprida Generis é um neuroléptico indicado no tratamento de perturbações do comportamento.
 Folheto informativo: Informação para o utilizador Tiaprida Generis 100 mg comprimidos Leia com atenção todo este folheto antes de começar a tomar este medicamento pois contém informação importante para
Folheto informativo: Informação para o utilizador Tiaprida Generis 100 mg comprimidos Leia com atenção todo este folheto antes de começar a tomar este medicamento pois contém informação importante para
Réus: Município de Belo Horizonte e Estado de Minas Gerais
 NOTA TÉCNICA 66/2014 Solicitante: Dra. Patricia Santos Firmo Juíza de Direito Data: 09/04/2014 Medicamento X Material Procedimento Cobertura Réus: Município de Belo Horizonte e Estado de Minas Gerais Processo
NOTA TÉCNICA 66/2014 Solicitante: Dra. Patricia Santos Firmo Juíza de Direito Data: 09/04/2014 Medicamento X Material Procedimento Cobertura Réus: Município de Belo Horizonte e Estado de Minas Gerais Processo
RESUMO DAS CARACTERÍSTICAS DO MEDICAMENTO
 RESUMO DAS CARACTERÍSTICAS DO MEDICAMENTO 1. NOME DO MEDICAMENTO CROMABAK 20 mg/ml, colírio, solução 2. COMPOSIÇÃO QUALITATIVA E QUANTITATIVA Para 100 ml de solução: Cromoglicato de sódio...2,00 g Lista
RESUMO DAS CARACTERÍSTICAS DO MEDICAMENTO 1. NOME DO MEDICAMENTO CROMABAK 20 mg/ml, colírio, solução 2. COMPOSIÇÃO QUALITATIVA E QUANTITATIVA Para 100 ml de solução: Cromoglicato de sódio...2,00 g Lista
ANEXO I RESUMO DAS CARACTERÍSTICAS DO MEDICAMENTO
 ANEXO I RESUMO DAS CARACTERÍSTICAS DO MEDICAMENTO 1 1. NOME DO MEDICAMENTO VETERINÁRIO Velactis 1,12 mg/ml solução injetável para bovinos 2. COMPOSIÇÃO QUALITATIVA E QUANTITATIVA Cada ml contém: Substância
ANEXO I RESUMO DAS CARACTERÍSTICAS DO MEDICAMENTO 1 1. NOME DO MEDICAMENTO VETERINÁRIO Velactis 1,12 mg/ml solução injetável para bovinos 2. COMPOSIÇÃO QUALITATIVA E QUANTITATIVA Cada ml contém: Substância
Novos an(coagulantes para tratamento da TVP e TEP
 Novos an(coagulantes para tratamento da TVP e TEP Angiologia e Cirurgia Vascular Hospital Mater Dei Daniel Mendes Pinto Simpósio sobre Atualização em An
Novos an(coagulantes para tratamento da TVP e TEP Angiologia e Cirurgia Vascular Hospital Mater Dei Daniel Mendes Pinto Simpósio sobre Atualização em An
Capilarema. Laboratórios Baldacci Ltda. Comprimidos. 75 mg
 Capilarema Laboratórios Baldacci Ltda. Comprimidos 75 mg CAPILAREMA aminaftona APRESENTAÇÕES Comprimidos simples de 75 mg cartucho contendo 30 ou 60 comprimidos. VIA ORAL - USO ADULTO COMPOSIÇÃO Cada comprimido
Capilarema Laboratórios Baldacci Ltda. Comprimidos 75 mg CAPILAREMA aminaftona APRESENTAÇÕES Comprimidos simples de 75 mg cartucho contendo 30 ou 60 comprimidos. VIA ORAL - USO ADULTO COMPOSIÇÃO Cada comprimido
As ampolas de Nolotil também não deverão ser utilizadas em:
 Folheto informativo: Informação para o utilizador Nolotil 2000 mg/5 ml solução injetável Metamizol magnésico Leia com atenção todo este folheto antes de começar a utilizar este medicamento pois contém
Folheto informativo: Informação para o utilizador Nolotil 2000 mg/5 ml solução injetável Metamizol magnésico Leia com atenção todo este folheto antes de começar a utilizar este medicamento pois contém
Como administrar Nebido com segurança (ampolas)
 Como administrar Nebido com segurança (ampolas) Informação para profissionais de saúde Este folheto fornece informações sobre certos aspetos da administração de Nebido, a fim de ampliar o seu conhecimento
Como administrar Nebido com segurança (ampolas) Informação para profissionais de saúde Este folheto fornece informações sobre certos aspetos da administração de Nebido, a fim de ampliar o seu conhecimento
Informação para o paciente
 Informação para o paciente Viramune - nevirapina 18355 BI Viramune brochure POR_V2.indd 1 14-12-11 14:19 Introdução Viramune é um medicamento para o tratamento do HIV. Este prospecto contém informação
Informação para o paciente Viramune - nevirapina 18355 BI Viramune brochure POR_V2.indd 1 14-12-11 14:19 Introdução Viramune é um medicamento para o tratamento do HIV. Este prospecto contém informação
FOLHETO INFORMATIVO: INFORMAÇÃO PARA O UTILIZADOR
 FOLHETO INFORMATIVO: INFORMAÇÃO PARA O UTILIZADOR Cincofarm 100 mg Cápsulas APROVADO EM Este folheto contém informações importantes para si. Leia-o atentamente. Este medicamento pode ser adquirido sem
FOLHETO INFORMATIVO: INFORMAÇÃO PARA O UTILIZADOR Cincofarm 100 mg Cápsulas APROVADO EM Este folheto contém informações importantes para si. Leia-o atentamente. Este medicamento pode ser adquirido sem
Conclusões científicas
 Anexo II Conclusões científicas e fundamentos para a alteração do Resumo das Características do Medicamento, da Rotulagem e do Folheto Informativo apresentados pela Agência Europeia de Medicamentos 7 Conclusões
Anexo II Conclusões científicas e fundamentos para a alteração do Resumo das Características do Medicamento, da Rotulagem e do Folheto Informativo apresentados pela Agência Europeia de Medicamentos 7 Conclusões
MODELO DE BULA. USO ADULTO E PEDIÁTRICO (crianças acima de dois anos de idade)
 MODELO DE BULA Logo Novartis Lacrigel TM A palmitato de retinol 10 mg/g Lágrima artificial estéril Forma farmacêutica e apresentação Gel oftálmico: cada tubo contém 10 g de gel. USO ADULTO E PEDIÁTRICO
MODELO DE BULA Logo Novartis Lacrigel TM A palmitato de retinol 10 mg/g Lágrima artificial estéril Forma farmacêutica e apresentação Gel oftálmico: cada tubo contém 10 g de gel. USO ADULTO E PEDIÁTRICO
GUIA POSOLÓGICO E INFORMAÇÃO DE SEGURANÇA
 Peso do doente (kg) Indicações Infeções complicadas da pele e dos tecidos moles por bactérias Gram-positivas não associadas a bacteriemia* * ICTPM associadas a bacteriemia ver dosagem de 6 mg/kg Manuseamento
Peso do doente (kg) Indicações Infeções complicadas da pele e dos tecidos moles por bactérias Gram-positivas não associadas a bacteriemia* * ICTPM associadas a bacteriemia ver dosagem de 6 mg/kg Manuseamento
Propil* propiltiouracila
 Propil* propiltiouracila PARTE I IDENTIFICAÇÃO DO PRODUTO Nome: Propil* Nome genérico: propiltiouracila Forma farmacêutica e apresentação: Propil* 100 mg em embalagem contendo 30 comprimidos. USO ADULTO
Propil* propiltiouracila PARTE I IDENTIFICAÇÃO DO PRODUTO Nome: Propil* Nome genérico: propiltiouracila Forma farmacêutica e apresentação: Propil* 100 mg em embalagem contendo 30 comprimidos. USO ADULTO
RESUMO DAS CARACTERÍSTICAS DO MEDICAMENTO
 RESUMO DAS CARACTERÍSTICAS DO MEDICAMENTO 1. NOME DO MEDICAMENTO Bromexina Bluepharma 0,8 mg/ml, xarope 2. COMPOSIÇÃO QUALITATIVA E QUANTITATIVA Cada ml de xarope contém 0,8 mg de cloridrto de bromexina.
RESUMO DAS CARACTERÍSTICAS DO MEDICAMENTO 1. NOME DO MEDICAMENTO Bromexina Bluepharma 0,8 mg/ml, xarope 2. COMPOSIÇÃO QUALITATIVA E QUANTITATIVA Cada ml de xarope contém 0,8 mg de cloridrto de bromexina.
CENTRO DE APOIO OPERACIONAL DE DEFESA DA SAÚDE CESAU ORIENTAÇÃO TÉCNICA N.º 064 /2015 - CESAU
 ORIENTAÇÃO TÉCNICA N.º 064 /2015 - CESAU Salvador, 13 de abril de 2015 OBJETO: Parecer. - Centro de Apoio Operacional de Defesa da Saúde- CESAU REFERÊNCIA: 3 a promotoria de Justiça de Dias D'Àvila / Dispensação
ORIENTAÇÃO TÉCNICA N.º 064 /2015 - CESAU Salvador, 13 de abril de 2015 OBJETO: Parecer. - Centro de Apoio Operacional de Defesa da Saúde- CESAU REFERÊNCIA: 3 a promotoria de Justiça de Dias D'Àvila / Dispensação
ANADOR PRT paracetamol 750 mg. Forma farmacêutica e apresentação Comprimidos 750 mg: embalagem com 20 e 256 comprimidos.
 ANADOR PRT paracetamol 750 mg Antitérmico e analgésico Forma farmacêutica e apresentação Comprimidos 750 mg: embalagem com 20 e 256 comprimidos. Outra forma farmacêutica e apresentação Solução oral: frasco
ANADOR PRT paracetamol 750 mg Antitérmico e analgésico Forma farmacêutica e apresentação Comprimidos 750 mg: embalagem com 20 e 256 comprimidos. Outra forma farmacêutica e apresentação Solução oral: frasco
PROCTO-GLYVENOL tribenosídeo + lidocaína
 MODELO DE TEXTO DE BULA PROCTO-GLYVENOL tribenosídeo + lidocaína TRATAMENTO LOCAL DAS HEMORRÓIDAS Formas farmacêuticas, via de administração e apresentações: Supositórios. Embalagens com 5 ou 10 supositórios.
MODELO DE TEXTO DE BULA PROCTO-GLYVENOL tribenosídeo + lidocaína TRATAMENTO LOCAL DAS HEMORRÓIDAS Formas farmacêuticas, via de administração e apresentações: Supositórios. Embalagens com 5 ou 10 supositórios.
FOLHETO EDUCACIONAL COM INFORMAÇÃO DE SEGURANÇA IMPORTANTE SOBRE O TASIGNA DESTINADA AOS PROFISSIONAIS DE SAÚDE
 FOLHETO EDUCACIONAL COM INFORMAÇÃO DE SEGURANÇA IMPORTANTE SOBRE O TASIGNA DESTINADA AOS PROFISSIONAIS DE SAÚDE 1 INTRODUÇÃO O objetivo desta brochura é assegurar a seguinte informação aos profissionais
FOLHETO EDUCACIONAL COM INFORMAÇÃO DE SEGURANÇA IMPORTANTE SOBRE O TASIGNA DESTINADA AOS PROFISSIONAIS DE SAÚDE 1 INTRODUÇÃO O objetivo desta brochura é assegurar a seguinte informação aos profissionais
APROVADO EM 01-10-2004 INFARMED
 FOLHETO INFORMATIVO Antibiophilus, 250 mg, Cápsulas Lactobacillus casei variedade rhamnosus Este folheto contém informações importantes para si. Leia-o atentamente. Este medicamento pode ser adquirido
FOLHETO INFORMATIVO Antibiophilus, 250 mg, Cápsulas Lactobacillus casei variedade rhamnosus Este folheto contém informações importantes para si. Leia-o atentamente. Este medicamento pode ser adquirido
TROMBOCITOPENIA NA GRAVIDEZ
 TROMBOCITOPENIA NA GRAVIDEZ Ricardo Oliveira Santiago Francisco Herlânio Costa Carvalho INTRODUÇÃO: - Trombocitopenia pode resultar de uma variedade de condições fisiológicas e patológicas na gravidez.
TROMBOCITOPENIA NA GRAVIDEZ Ricardo Oliveira Santiago Francisco Herlânio Costa Carvalho INTRODUÇÃO: - Trombocitopenia pode resultar de uma variedade de condições fisiológicas e patológicas na gravidez.
Check-list Procedimentos de Segurança
 Check-list Procedimentos de Segurança 1. Cultura de Segurança 1.1 1.2 Existe um elemento definido como responsável pelas questões da segurança do doente Promove o trabalho em equipa multidisciplinar na
Check-list Procedimentos de Segurança 1. Cultura de Segurança 1.1 1.2 Existe um elemento definido como responsável pelas questões da segurança do doente Promove o trabalho em equipa multidisciplinar na
ANEXO I RESUMO DAS CARACTERÍSTICAS DO MEDICAMENTO
 ANEXO I RESUMO DAS CARACTERÍSTICAS DO MEDICAMENTO 1 1. NOME DO MEDICAMENTO Xarelto 10 mg comprimidos revestidos por película 2. COMPOSIÇÃO QUALITATIVA E QUANTITATIVA Cada comprimido revestido por película
ANEXO I RESUMO DAS CARACTERÍSTICAS DO MEDICAMENTO 1 1. NOME DO MEDICAMENTO Xarelto 10 mg comprimidos revestidos por película 2. COMPOSIÇÃO QUALITATIVA E QUANTITATIVA Cada comprimido revestido por película
CLASSIFICAÇÃO DAS CEFALEIAS (IHS 2004)
 CLASSIFICAÇÃO DAS CEFALEIAS (IHS 2004) ENXAQUECAS Enxaqueca sem aura De acordo com a IHS, a enxaqueca sem aura é uma síndroma clínica caracterizada por cefaleia com características específicas e sintomas
CLASSIFICAÇÃO DAS CEFALEIAS (IHS 2004) ENXAQUECAS Enxaqueca sem aura De acordo com a IHS, a enxaqueca sem aura é uma síndroma clínica caracterizada por cefaleia com características específicas e sintomas
AO ANEXO I - INFORMAÇÕES. COMPOSIÇÃO: Cada comprimido revestido contém 15 mg ou 20 mg de rivaroxabana.
 Xarelto rivaroxabana APRESENTAÇÕES: Xarelto (rivaroxabana) é apresentado na forma de comprimidos revestidos em cartucho com blíster contendo 14 ou 28 comprimidos revestidos de 15 mg ou 20 mg. USO ORAL
Xarelto rivaroxabana APRESENTAÇÕES: Xarelto (rivaroxabana) é apresentado na forma de comprimidos revestidos em cartucho com blíster contendo 14 ou 28 comprimidos revestidos de 15 mg ou 20 mg. USO ORAL
30/07/2013. Uso de anticoagulantes suspensão da atividade trombótica e auxílio à trombólise endógena. Trombólise exógena trombolíticos
 Contraindicações da anticoagulação Ricardo de Amorim Corrêa Faculdade de Medicina/UFMG Tratamento da tromboembolia pulmonar aguda Uso de anticoagulantes suspensão da atividade trombótica e auxílio à trombólise
Contraindicações da anticoagulação Ricardo de Amorim Corrêa Faculdade de Medicina/UFMG Tratamento da tromboembolia pulmonar aguda Uso de anticoagulantes suspensão da atividade trombótica e auxílio à trombólise
Foram ainda notificados casos de síndrome nefrótica com diferentes nefropatias subjacentes.
 25 de agosto de 2014 Interferões Beta: risco de microangiopatia trombótica e síndrome nefrótica Caro Profissional de Saúde, O INFARMED, I.P. em acordo com a Agência Europeia do Medicamento e os Titulares
25 de agosto de 2014 Interferões Beta: risco de microangiopatia trombótica e síndrome nefrótica Caro Profissional de Saúde, O INFARMED, I.P. em acordo com a Agência Europeia do Medicamento e os Titulares
Adultos e crianças com mais de 12 anos: 10 ml (2 colheres de chá), 2 vezes por dia.
 RESUMO DAS CARACTERÍSTICAS DO MEDICAMENTO 1. NOME DO MEDICAMENTO Ambroxol Azevedos 6 mg/ml, Xarope 2. COMPOSIÇÃO QUALITATIVA E QUANTITATIVA Cada 5 ml de xarope contêm 30 mg de cloridrato de trans-4-[(2-amino-3,5-dibromobenzil)amino]ciclohexanol
RESUMO DAS CARACTERÍSTICAS DO MEDICAMENTO 1. NOME DO MEDICAMENTO Ambroxol Azevedos 6 mg/ml, Xarope 2. COMPOSIÇÃO QUALITATIVA E QUANTITATIVA Cada 5 ml de xarope contêm 30 mg de cloridrato de trans-4-[(2-amino-3,5-dibromobenzil)amino]ciclohexanol
IDENTIFICAÇÃO DO MEDICAMENTO Alburex 20 albumina humana
 IDENTIFICAÇÃO DO MEDICAMENTO Alburex 20 albumina humana APRESENTAÇÃO Alburex 20: embalagem contendo 1 frasco-ampola com 50 ml de solução hiperoncótica de albumina humana para infusão (20%). VIA INTRAVENOSA
IDENTIFICAÇÃO DO MEDICAMENTO Alburex 20 albumina humana APRESENTAÇÃO Alburex 20: embalagem contendo 1 frasco-ampola com 50 ml de solução hiperoncótica de albumina humana para infusão (20%). VIA INTRAVENOSA
Bicalutamida inibe o estímulo androgênico, resultando assim na regressão dos tumores prostáticos.
 BICALUTAMIDA Medicamento genérico Lei n 9.787, de 1999 Oral Comprimido revestido USO ADULTO Forma Farmacêutica e Apresentação da Bicalutamida Embalagem com 30 comprimidos contendo 50 mg de bicalutamida.
BICALUTAMIDA Medicamento genérico Lei n 9.787, de 1999 Oral Comprimido revestido USO ADULTO Forma Farmacêutica e Apresentação da Bicalutamida Embalagem com 30 comprimidos contendo 50 mg de bicalutamida.
Versa. Bula para paciente. Solução injetável. 100 mg/ml
 Versa Bula para paciente Solução injetável 100 mg/ml VERSA enoxaparina sódica Solução injetável FORMA FARMACÊUTICA E APRESENTAÇÕES: Versa (enoxaparina sódica) solução injetável: 20 mg/0,2 ml, 40 mg/0,4
Versa Bula para paciente Solução injetável 100 mg/ml VERSA enoxaparina sódica Solução injetável FORMA FARMACÊUTICA E APRESENTAÇÕES: Versa (enoxaparina sódica) solução injetável: 20 mg/0,2 ml, 40 mg/0,4
Tabela 1 Descrição dos números e nomes dos fatores de coagulação sangüínea e a via de atuação.
 HEMOSTASIA 1 2 IX Tabela 1 Descrição dos números e nomes dos fatores de coagulação sangüínea e a via de atuação. INATIVO ATIVADO NOME COMUM VIA DE ATIVAÇÃO I Ia Fibrinogênio Comum II IIa Protrombina Comum
HEMOSTASIA 1 2 IX Tabela 1 Descrição dos números e nomes dos fatores de coagulação sangüínea e a via de atuação. INATIVO ATIVADO NOME COMUM VIA DE ATIVAÇÃO I Ia Fibrinogênio Comum II IIa Protrombina Comum
Naxogin nimorazol. Naxogin 500 mg em embalagem contendo 8 comprimidos. Cada comprimido de Naxogin contém 500 mg de nimorazol.
 Naxogin nimorazol PARTE I IDENTIFICAÇÃO DO PRODUTO Nome: Naxogin Nome genérico: nimorazol Forma farmacêutica e apresentações: Naxogin 500 mg em embalagem contendo 8 comprimidos. USO ADULTO USO ORAL Composição:
Naxogin nimorazol PARTE I IDENTIFICAÇÃO DO PRODUTO Nome: Naxogin Nome genérico: nimorazol Forma farmacêutica e apresentações: Naxogin 500 mg em embalagem contendo 8 comprimidos. USO ADULTO USO ORAL Composição:
Em que situações se deve realizar um eco- doppler arterial dos membros inferiores.
 O que é um eco- doppler? O eco- doppler, ultrassonografia vascular ou triplex- scan é um método de imagem que se baseia na emissão e reflecção de de ondas de som (ultra- sons). Através deste exame é possível
O que é um eco- doppler? O eco- doppler, ultrassonografia vascular ou triplex- scan é um método de imagem que se baseia na emissão e reflecção de de ondas de som (ultra- sons). Através deste exame é possível
CISTICID. praziquantel. Merck S/A. Comprimidos 500 mg
 CISTICID praziquantel Merck S/A Comprimidos 500 mg Cisticid praziquantel APRESENTAÇÕES Embalagens contendo 50 comprimidos. USO ORAL USO ADULTO E PEDIÁTRICO ACIMA DOS 4 ANOS DE IDADE COMPOSIÇÃO Cada comprimido
CISTICID praziquantel Merck S/A Comprimidos 500 mg Cisticid praziquantel APRESENTAÇÕES Embalagens contendo 50 comprimidos. USO ORAL USO ADULTO E PEDIÁTRICO ACIMA DOS 4 ANOS DE IDADE COMPOSIÇÃO Cada comprimido
Drenol hidroclorotiazida. Drenol 50 mg em embalagem contendo 30 comprimidos. Cada comprimido de Drenol contém 50 mg de hidroclorotiazida.
 Drenol hidroclorotiazida PARTE I IDENTIFICAÇÃO DO PRODUTO Nome: Drenol Nome genérico: hidroclorotiazida Forma farmacêutica e apresentações: Drenol 50 mg em embalagem contendo 30 comprimidos. USO ADULTO
Drenol hidroclorotiazida PARTE I IDENTIFICAÇÃO DO PRODUTO Nome: Drenol Nome genérico: hidroclorotiazida Forma farmacêutica e apresentações: Drenol 50 mg em embalagem contendo 30 comprimidos. USO ADULTO
TROMBOSE VENOSA PROFUNDA (TVP)
 TROMBOSE VENOSA PROFUNDA (TVP) José de Arimatea Barreto Os fenômenos tromboembólicos incidem em 0,2% a 1% durante o ciclo gravídico-puerperal. Metade das tromboses venosas é identificada antes do parto
TROMBOSE VENOSA PROFUNDA (TVP) José de Arimatea Barreto Os fenômenos tromboembólicos incidem em 0,2% a 1% durante o ciclo gravídico-puerperal. Metade das tromboses venosas é identificada antes do parto
Esta bula é continuamente atualizada. Favor proceder a sua leitura antes de utilizar o medicamento. CLEXANE enoxaparina sódica
 MODELO DE TEXTO DE BULA SANOFI-AVENTIS Esta bula é continuamente atualizada. Favor proceder a sua leitura antes de utilizar o medicamento. CLEXANE enoxaparina sódica FORMA FARMACÊUTICA E APRESENTAÇÕES
MODELO DE TEXTO DE BULA SANOFI-AVENTIS Esta bula é continuamente atualizada. Favor proceder a sua leitura antes de utilizar o medicamento. CLEXANE enoxaparina sódica FORMA FARMACÊUTICA E APRESENTAÇÕES
Comprimidos revestidos por película. Comprimidos circulares biconvexos, brancos a ligeiramente amarelados, revestidos por uma película homogénea.
 RESUMO DAS CARACTERÍSTICAS DO MEDICAMENTO 1. NOME DO MEDICAMENTO Algimate 125 mg comprimidos revestidos por película 2. COMPOSIÇÃO QUALITATIVA E QUANTITATIVA Clonixinato de lisina 125 mg Lista completa
RESUMO DAS CARACTERÍSTICAS DO MEDICAMENTO 1. NOME DO MEDICAMENTO Algimate 125 mg comprimidos revestidos por película 2. COMPOSIÇÃO QUALITATIVA E QUANTITATIVA Clonixinato de lisina 125 mg Lista completa
ANEXO I RESUMO DAS CARACTERÍSTICAS DO MEDICAMENTO
 ANEXO I RESUMO DAS CARACTERÍSTICAS DO MEDICAMENTO 1 1. NOME DO MEDICAMENTO ELIQUIS 2,5 mg comprimidos revestidos por película 2. COMPOSIÇÃO QUALITATIVA E QUANTITATIVA Cada comprimido revestido por película
ANEXO I RESUMO DAS CARACTERÍSTICAS DO MEDICAMENTO 1 1. NOME DO MEDICAMENTO ELIQUIS 2,5 mg comprimidos revestidos por película 2. COMPOSIÇÃO QUALITATIVA E QUANTITATIVA Cada comprimido revestido por película
cloxazolam Eurofarma Laboratórios S.A. Comprimido 1 mg e 2 mg
 cloxazolam Eurofarma Laboratórios S.A. Comprimido 1 mg e 2 mg cloxazolam Medicamento genérico Lei nº 9.787, de 1999 Comprimido FORMAS FARMACÊUTICAS E APRESENTAÇÕES: Embalagens com 20 e 30 comprimidos contendo
cloxazolam Eurofarma Laboratórios S.A. Comprimido 1 mg e 2 mg cloxazolam Medicamento genérico Lei nº 9.787, de 1999 Comprimido FORMAS FARMACÊUTICAS E APRESENTAÇÕES: Embalagens com 20 e 30 comprimidos contendo
