PROPRIEDADES COLIGATIVAS
|
|
|
- Alícia Ferrão Cesário
- 8 Há anos
- Visualizações:
Transcrição
1 PROPRIEDADES COLIGATIVAS 1) Qual das seguintes soluções aquosas apresenta maior ponto de ebulição? A) uréia 2,0 molar. B) glicose 1,5 molar. C) NaCl 1,5 molar. D) CH 3 COOH 1,0 molar. E) sacarose 2,5 molar. 2) Qual das substâncias abaixo, quando em solução aquosa de idênticos graus de dissociação e concentração, apresenta maior pressão osmótica? A) K 3 PO 4. B) NaCl. C) NH 4 Cl. D) C 6 H 12 O 6. E) CaCl 2. 3) No quadro abaixo estão fornecidas as temperaturas de ebulição de soluções aquosas de mesma concentração molar de nitrato de amônio, sulfeto de sódio e glicose, Solução NH 4 NO 3 Na 2 S C 6 H 12 O 6 Temperatura. T1 T2 T3 A relação entre estas temperaturas é A) T1 > T2 > T3 B) T2 > T3 > T1 C) T3 > T1 > T2 D) T1 > T3 > T2 E) T2 > T1 > T3 4) Duas soluções, uma de glicose e outra de cloreto de sódio, serão isotônicas quando tiverem a mesma A) temperatura. B) concentração em mols por litro. C) concentração e a mesma temperatura. D) concentração e mesmo fator de Vant Hoff. E) temperatura e mesmo número de partículas dissolvido. 5) O gráfico abaixo dá as temperaturas de ebulição de soluções aquosas de NaCl a várias concentrações: A partir dessa curva pode-se estimar as temperaturas de ebulição de soluções de outros sais. Uma solução aquosa 2,0 mol/l de MgCl 2 apresentará temperatura de ebulição aproximadamente igual a A) 105,0 B) 103,7 C) 102,3 D) 101,2 E) 100,0 1
2 6) (UNIFOR) Dentre os pares de soluções aquosas abaixo, o único que indica soluções aquosas com mesmas propriedades coligativas é A) NaCl 0,1 mol/l e KCl 0,2 mol/l B) glicose (C 6 H 12 O 6 ) 0,2 mol/l e NaCl 0,1 mol/l C) glicose (C 6 H 12 O 6 ) 0,2 mol/l e KCl 0,2 mol/l D) glicose (C 6 H 12 O 6 ) 0,1 mol/l e KCl 0,1 mol/l E) glicose (C 6 H 12 O 6 ) 0,2 mol/l e sacarose 0,1 mol/l 7) (UNIFOR) A concentração normal do sal no sangue é, aproximadamente, igual àquela de uma solução aquosa 0,9%, em massa, de cloreto de sódio. Uma solução aquosa de glicose contendo 5,5%, em massa, do soluto I. poderá ser utilizada quando se quer uma solução isotônica à solução de cloreto de sódio. II. congela à mesma temperatura que a solução de cloreto de sódio. III. tem a mesma concentração, em mols, do soluto por 100 g de solução que a do cloreto de sódio. Está correto o que se afirma SOMENTE em A) I B) II C) III D) I e II E) II e III 8) (ITA) Em uma amostra de água do mar dissolve-se um pouco de sacarose. Em relação à conseqüência deste acréscimo de sacarose, são feitas as seguintes afirmações: I- A pressão de vapor da água diminui. II- A pressão osmótica da solução aumenta. III- A condutividade elétrica da solução permanece praticamente a mesma. IV- A temperatura precisará descer mais para que possa começar a solidificação. V- O grau de dissociação dos sais presentes na água do mar permanecerá praticamente o mesmo. Das afirmações acima estão corretas: A) Apenas I, II e III. B) Apenas II, III e IV. C) Apenas III, IV, e V. D) Apenas II, III, IV e V. E)Todas. 9) (ITA) Considere as seguintes soluções diluídas: I - x mol de sacarose / quilograma de água. II - y mol de cloreto de sódio / quilograma de água. III - w mol de sulfato de magnésio / quilograma de água. IV - m mol de cloreto de magnésio/ quilograma de água. Para que nestas quatro soluções, durante o resfriamento, possa começar a aparecer gelo na mesma temperatura, digamos a 1,3 C, é necessário que, em primeira aproximação, tenhamos: A) x = y = z = w. B) 1x = 2y = 4z = 4w. C) 1x = 2y = 2z = 3w. D) x / 1 = y / 2 = z / 2 = w / 3. E) x / 1 = y / 2 = z / 4 = w / 4. 10) (PUCRS) A água do mar é rica em sais dissolvidos, nela predominando o cloreto de sódio. A concentração de sais varia em função da região, sendo que no Mar Morto se encontra a maior concentração salina conhecida, na ordem de 35g/100mL de solução. Sobre a água do mar, é correto afirmar que A) entra em ebulição a uma temperatura abaixo de 100 C. B) é mais fácil de ser tratada, com vistas à sua potabilidade, do que a água dos rios (água doce). C) tem ph próximo de 0,0. D) evapora com mais facilidade do que a água pura. E) congela a uma temperatura abaixo de 0 o C. 11) (PUCRS) Pela análise da figura, é correto afirmar que, após algum tempo, 2
3 A) a solução A ficará mais concentrada. B) as duas soluções continuarão com a mesma concentração. C) ocorrerá a diluição da solução B. D) a solução B ficará mais concentrada. E) as duas soluções terão a sua concentração aumentada. 12) (UEL) Na mesma condição de pressão foram preparadas as seguintes soluções. Em um béquer (béquer 1) foram adicionados 1 kg de água e 1 mol de sacarose (C 12 H 22 O 11 ). A mistura foi agitada dando origem a uma solução 1. Em outro béquer (béquer 2) foram adicionados 1 kg de água e 1 mol de cloreto de sódio (NaCl). A mistura foi agitada dando origem a uma solução 2. Em outro béquer (béquer 3) foram adicionados 1 kg de água e 1 mol de glicose (C 6 H 12 O 6 ). A mistura foi agitada dando origem a uma solução 3. Com relação às soluções contidas nos béqueres 1, 2 e 3 é correto afirmar: A) A diminuição do ponto de congelamento do solvente na solução 1 é maior que na solução 3. B) O aumento do ponto de ebulição do solvente na solução 2 é menor que na solução 1. C) A diminuição da pressão de vapor do solvente da solução 2 é duas vezes maior que da solução 1. D) A diminuição da pressão de vapor do solvente da solução 2 é igual ao da solução 3. E) O aumento do ponto de ebulição do solvente da solução 1 é duas vezes maior que da solução 3. 13) (UFRGS) Considerando as três soluções do desenho, pode-se prever que a relação entre as pressões de vapor das mesmas é: A) P1 > P2 > P3. B) P2 > P3 > P1. C) P1 > P3 > P2. D) P3 > P1 > P2. E) P2 > P1 > P3. 14) (UNESP) Considere cinco soluções aquosas diferentes, todas de concentração 0,1mol/L, de glicose (C 6 H 12 O 6 ) e de quatro eletrólitos fortes, NaCl, KCl, K 2 SO 4 e ZnSO 4, respectivamente. A solução que apresenta o maior abaixamento do ponto de congelação é a de: A) C 6 H 12 O 6. B) NaCl. C) KCl. D) K 2 SO 4. E) ZnSO 4. 15) (UNESP) A uma dada temperatura, possui a MENOR pressão de vapor a solução aquosa: A) 0,1 mol/l de sacarose. 3
4 B) 0,2 mol/l de sacarose. C) 0,1 mol/l de ácido clorídrico. D) 0,2 mol/l de ácido clorídrico. E) 0,1 mol/l de hidróxido de sódio. (UFPE) Foi observado que o cozimento de meio quilo de batatas em 1 litro de água é mais rápido se adicionarmos 200 gramas de sal à água de cozimento. Considere as seguintes possíveis explicações para o fato: 1- a adição de sal provoca um aumento da temperatura de ebulição da água; 2- a adição de sal provoca um aumento da pressão de vapor da água; 3- o sal adicionado não altera a temperatura de ebulição da água, mas reage com o amido das batatas. Está(ão) correta(s) a(s) explicação(ões): A) 1 apenas B) 2 apenas C) 3 apenas D) 1 e 2 apenas E) 1, 2 e 3 17) (UEL) m cinco frascos contendo a mesma quantidade de água, são adicionados, separadamente, 0,1 mol de: sacarose, frutose, iodeto de sódio, iodeto de potássio e iodeto de magnésio. Qual das soluções obtidas tem maior temperatura de ebulição? A) Sacarose. B) Frutose. C) Iodeto de sódio. D) Iodeto de potássio. E) Iodeto de magnésio. 18) (UNESP) Comparando-se os pontos de congelação de três soluções aquosas diluídas de KNO 3, MgSO 4 e Cr(NO 3 ) 3, de mesma concentração em mol/l, verifica-se que: A) as três soluções têm o mesmo ponto de congelação. B) os pontos de congelação, decrescem da seguinte ordem: KNO 3 < MgSO 4 < Cr(NO 3 ) 3. C) a solução de Cr(NO 3 ) 3 tem ponto de congelação mais baixo que as soluções dos outros dois sais. D) o ponto de congelação de cada solução depende de seu volume. E) as três soluções têm pontos de congelação maiores que o da água. 19) (FVG) Em países onde os invernos são rigorosos, coloca-se sobre o leito de ruas consideradas prioritárias ao trânsito, uma mistura de sal (NaCl), cloreto de cálcio (CaCl 2 ) e areia, para diminuir os riscos de derrapagens dos veículos, durante os períodos de nevadas. Cada um desses produtos tem uma função definida, que associadas são muito eficientes. Indique a afirmação correta. A) O sal abaixa o ponto de congelamento da água, o cloreto de cálcio quando se dissolve, absorve calor, e a areia aumenta a aderência dos pneus ao solo. B) O sal eleva o ponto de congelamento da água, o cloreto de cálcio quando se dissolve, absorve calor, e a areia aumenta a aderência dos pneus ao solo. C) O sal abaixa o ponto de congelamento da água, o cloreto de cálcio quando se dissolve, libera calor, e a areia aumenta a aderência dos pneus ao solo. D) O sal abaixa o ponto de congelamento da água, o cloreto de cálcio dissolve-se através de uma reação endotérmica, e a areia aumenta a aderência dos pneus ao solo. E) O sal eleva o ponto de congelamento da água, o cloreto de cálcio dissolve-se através de uma reação endotérmica, e a areia aumenta a aderência dos pneus ao solo. 20) A solução aquosa bem diluída que possui a menor temperatura de solidificação é a de: A) NaCl 0,01 M. B) MgCl 2 0,01 M. C) NaNO 3 0,02 M. D) NaCl 0,02 M. E) C 12 H 22 O 11 0,03 M. 4
5 21) (FAAP) "Mesmo em dias sem sol, o banho de mar provoca sede." Seguem-se as afirmações: I. A concentração salina da água do mar é mais alta do que as soluções corporais. Em conseqüência, a imersão prolongada no mar provoca saída de água do corpo para a solução mais concentrada - a água do mar. A sede é um recurso natural do organismo para repor a água perdida por esse meio. II. A concentração salina da água do mar é mais baixa do que as soluções corporais. Em conseqüência, a imersão prolongada no mar provoca a absorção de energia dos raios solares que ficaram retidos durante os dias de sol, provocando assim, a sede. III. Em dias sem sol, a imersão prolongada no mar provoca o fenômeno conhecido como crioscopia, muito usado na indústria de sorvetes, onde se emprega a salmoura, uma solução saturada de sal marinho. Destas afirmações: A) somente I e II são corretas B) somente I e III são corretas C) somente I é correta D) somente III é correta E) somente II e III são corretas 22) (FUVEST) Para distinguir entre duas soluções aquosas de concentração 0,10 mol/l, uma de ácido forte e a outra de ácido fraco, ambos monopróticos, pode-se A) mergulhar em cada uma delas um pedaço de papel de tornassol azul. B) mergulhar em cada uma delas uma pedaço de papel de tornassol rosa. C) mergulhar em cada uma delas uma lâmina de prata polida. D) medir a temperatura de congelamento de cada solução. E) adicionar uma pequena quantidade de cloreto de sódio em cada solução. 23) (UFMG) Estudaram-se as variações das pressões de vapor da água pura e de uma solução aquosa diluída de sacarose (açúcar de cana), em função da temperatura. O gráfico que descreve, qualitativamente, essas variações é: 24) (PUCCAMP) Sejam dadas as seguintes soluções aquosas: I. 0,2 mol/l de cloreto de cálcio. II. 0,2 mol/l de hidróxido de potássio. III. 0,2 mol/l de glicose (C 6 H 12 O 6 ). IV. 0,5 mol/l de ácido acético. V. 0,5 mol/l de sulfato de potássio. Das soluções acima, a que apresenta a temperatura de congelação mais alta é: A) I B) II C) III D) IV E) V 25) (UNESP) A solução aquosa que apresenta menor ponto de congelação é a de: A) CaBr 2 de concentração 0,10 mol/l. B) KBr de concentração 0,20 mol/l. C) Na 2 SO 4 de concentração 0,10 mol/l. D) glicose (C 6 H 12 O 6 ) de concentração 0,50 mol/l. E) HNO 3 de concentração 0,30 mol/l. 26) (PUCCAMP) Considere o texto adiante. "Se as células vermelhas do sangue forem removidas para um béquer contendo água destilada há passagem da água para...(i)... das células. Se as células forem colocadas numa solução salina concentrada há migração da água para...(ii)... das células com o...(iii)... das mesmas. As soluções projetadas para injeções endovenenosas devem ter...(iv)... próximas às das soluções contidas nas células." Para completá-lo corretamente, I, II, III e IV devem ser substituídos, respectivamente, por A) dentro - fora - enrugamento - pressões osmóticas 5
6 B) fora - dentro - inchaço - condutividades térmicas C) dentro - fora - enrugamento - colorações D) fora - fora - enrugamento - temperaturas de ebulição E) dentro - dentro - inchaço densidades 27) (PUCCAMP) Nos invernos rigorosos é costume europeu aspergir cloreto de sódio ou cloreto de cálcio em ruas e estradas cobertas de gelo, bem como, adicionar etilenoglicol à água do radiador dos automóveis. Com esses procedimentos, qual alteração se deseja provocar na água? A) Diminuição da temperatura de ebulição. B) Aumento da condutibilidade elétrica. C) Diminuição da densidade. D) Aumento da pressão de vapor. E) Diminuição da temperatura de congelamento. 28) (PUCCAMP) A concentração de sais dissolvidos no lago conhecido como "Mar Morto" é muito superior às encontradas nos oceanos. Devido à alta concentração de sais, nesse lago, I - a flutuabilidade dos corpos é maior do que nos oceanos. II - o fenômeno da osmose provocaria a morte, por desidratação, de seres vivos que nele tentassem sobreviver. III a água congela-se facilmente nos dias de inverno. Dessas afirmações, SOMENTE A) I é correta. B) II é correta. C) III é correta. D) I e II são corretas. E) I e III são corretas. 29) (PUCMG) Sejam dadas as seguintes soluções aquosas: I. 0,1 M de glicose (C 6 H 12 O 6 ) II. 0,2 M de sacarose (C 22 H 11 O 11 ) III. 0,1 M de hidróxido de sódio (NaOH) IV. 0,2 M de cloreto de cálcio (CaCl 2 ) V. 0,2 M de nitrato de potássio (KNO 3 ) A que apresenta maior temperatura de ebulição é: A) I B) II C) III D) IV E) V 30) (PUCCAMP) Comparando-se as seguintes soluções aquosas, à mesma temperatura e todas de IGUAL concentração em mol/l: I. glicose II. sacarose III. cloreto de sódio IV. cloreto de cálcio pode-se dizer que são isotônicas (exercem igual pressão osmótica) SOMENTE A) I e II B) I e III C) I e IV D) II e III E) III e IV 31) (UFPE) Por que a adição de certos aditivos na água dos radiadores de carros evita que ocorra o superaquecimento da mesma, e também o seu congelamento, quando comparada com a da água pura? A) Porque a água mais o aditivo formam uma solução que apresenta pontos de ebulição e de fusão maiores que os da água pura. B) Porque a solução formada (água + aditivo) apresenta pressão de vapor maior que a água pura, o que causa um aumento no ponto de ebulição e de fusão. C) Porque o aditivo reage com a superfície metálica do radiador, que passa então a absorver energia mais eficientemente, diminuindo, portanto, os pontos de ebulição e de fusão quando comparados com a água pura. D) Porque o aditivo diminui a pressão de vapor da solução formada com relação à água pura, causando um aumento do ponto de ebulição e uma diminuição do ponto de fusão. E) Porque o aditivo diminui a capacidade calorífica da água, causando uma diminuição do ponto de fusão e de ebulição. 6
7 32) (UFES) O sistema abaixo é constituído de dois compartimentos separados por uma membrana permeável somente ao solvente (MPS). Após o sistema atingir o equilíbrio, pode-se afirmar que A) a solução no compartimento II torna-se mais diluída. B) a solução no compartimento I torna-se mais diluída. C) a solução no compartimento I torna-se mais concentrada. D) ocorre diluição nos dois compartimentos. E) em nenhum dos dois compartimentos ocorre diluição. 33) (UFC) Durante o processo de produção da "carne de sol" ou "carne seca", após imersão em salmoura (solução aquosa saturada de cloreto de sódio), a carne permanece em repouso em um lugar coberto e arejado por cerca de três dias. Observa-se que, mesmo sem refrigeração ou adição de qualquer conservante, a decomposição da carne é retardada. Assinale a alternativa que relaciona corretamente o processo responsável pela conservação da "carne de sol". A) Formação de ligação hidrogênio entre as moléculas de água e os íons Na + e Cl B) Elevação na pressão de vapor da água contida no sangue da carne. C) Redução na temperatura de evaporação da água. D) Elevação do ponto de fusão da água. E) Desidratação da carne por osmose. 34) (UNIRIO) Para dessalinizar a água, um método ultimamente empregado é o da osmose reversa. A osmose ocorre quando se separa a água pura e a água salgada por uma membrana semipermeável (que deixa passar moléculas de água, mas não de sal). A água pura escoa através da membrana, diluindo a salgada. Para dessalinizar a água salobra é preciso inverter o processo, através da aplicação de uma pressão no lado com maior concentração de sal. Para tal, essa pressão exercida deverá ser superior à: A) densidade da água B) pressão atmosférica C) pressão osmótica D) pressão de vapor E) concentração do sal na água 35) (CESGRANRIO) É muito comum o uso de aditivos químicos para a preservação e conservação de produtos alimentícios por um tempo maior e, também, para melhorar o aspecto visual, o odor e o sabor de alimentos. Dois bons exemplos são o processo de salgamento da carne e a utilização de fermentos químicos e biológicos nas massas para bolos. Os microorganismos presentes na carne são a causa da decomposição natural. Com o processo de salgamento, o meio se torna hipertônico e, por isso, ela se conserva por um tempo maior. Já a utilização de fermentos químicos à base de bicarbonato de sódio (hidrogeno carbonato de sódio) faz com que a massa cresça em virtude do gás carbônico oriundo do fermento, o que torna o bolo mais saboroso e atraente. A conservação da carne pelo processo citado impede o desenvolvimento de agentes decompositores que morrem em decorrência da(o): A) osmose, pois as suas células desidratam. B) osmose, pois as suas células ganham água provocando o rompimento da membrana plasmática. C) difusão, pois a perda de sais de suas células torna o meio intracelular mais hipotônico. D) difusão facilitada, pois a perda de sais de suas células torna o meio mais hipotônico. E) transporte ativo, pois as suas células ganham sais tornando o meio intracelular hipertônico. 7
8 36) (PUCSP) Osmose é a difusão do solvente através de uma membrana semipermeável do meio menos concentrado para o meio mais concentrado. A pressão osmótica (π) de uma determinada solução é a pressão externa a qual essa solução deve ser submetida para garantir o equilíbrio osmótico com o solvente puro. A osmose é uma propriedade coligativa, ou seja, depende somente do número de partículas dispersas em solução e não da natureza do soluto. Preparou-se as seguintes soluções aquosas: Solução 1 - HCl(aq) 0,01 mol/l; Solução 2 H 3 CCOOH(aq) 0,01 mol/l; Solução 3 C 12 H 22 O 11 (aq) 0,01 mol/l; Solução 4 - MgCl 2 (aq) 0,01 mol/l. Considerando-se a natureza dessas soluções, pode-se concluir a respeito de suas pressões osmóticas que A) π 3 < π 1 = π 2 < π 4 B) π 4 < π 3 < π 2 < π 1 C) π 2 = π 3 < π 4 = π 1 D) π 1 = π 2 = π 3 < π 4 E) π 3 < π 2 < π 1 < π 4 1-C 2-A 3-E 4-E 5-B 6-B 7-D 8-E 9-C 10-E 11-D 12-C 13-D 14-D 15-D 16-A 17-E 18-C 19-C 20-C 21-C 22-D 23-C 24-E 25-E 26-A 27-E 28-D 29-D 30-A 31-D 32-B 33-E 34-C 35-A 36-E 8
Exercícios de Propriedades Coligativas e Coloides
 Exercícios de Propriedades Coligativas e Coloides 1. Considere o gráfico da pressão máxima de vapor em função da temperatura para um solvente puro e para uma solução desse solvente contendo um soluto molecular
Exercícios de Propriedades Coligativas e Coloides 1. Considere o gráfico da pressão máxima de vapor em função da temperatura para um solvente puro e para uma solução desse solvente contendo um soluto molecular
Exercícios sobre Propriedades coligativas - Osmose
 Exercícios sobre Propriedades coligativas - Osmose 01. (Pucsp) Osmose é a difusão do solvente através de uma membrana semipermeável do meio menos concentrado para o meio mais concentrado. A pressão osmótica
Exercícios sobre Propriedades coligativas - Osmose 01. (Pucsp) Osmose é a difusão do solvente através de uma membrana semipermeável do meio menos concentrado para o meio mais concentrado. A pressão osmótica
1- PROPRIEDADES DAS SOLUÇÕES OU PROPRIEDADES COLIGATIVAS
 1- PROPRIEDADES DAS SOLUÇÕES OU PROPRIEDADES COLIGATIVAS Em países quentes, é costume adicionar à água do radiador dos automóveis o etilenoglicol, que eleva a temperatura de ebulição da água. Evita-se
1- PROPRIEDADES DAS SOLUÇÕES OU PROPRIEDADES COLIGATIVAS Em países quentes, é costume adicionar à água do radiador dos automóveis o etilenoglicol, que eleva a temperatura de ebulição da água. Evita-se
Propriedades coligativas
 Química Aula de Revisão 9 3 os anos Décio ago/09 Nome: Nº: Turma: Propriedades coligativas Objetivo O objetivo dessa ficha é dar continuidade à revisão do 3º ano Química, dos assuntos mais significativos.
Química Aula de Revisão 9 3 os anos Décio ago/09 Nome: Nº: Turma: Propriedades coligativas Objetivo O objetivo dessa ficha é dar continuidade à revisão do 3º ano Química, dos assuntos mais significativos.
Características e os efeitos das propriedades coligativas
 Características e os efeitos das propriedades coligativas O estudo das propriedades coligativas é um dos conteúdos mais importantes a serem estudados, pois facilita a compreensão de fenômenos químicos
Características e os efeitos das propriedades coligativas O estudo das propriedades coligativas é um dos conteúdos mais importantes a serem estudados, pois facilita a compreensão de fenômenos químicos
 PROPRIEDADES COLIGATIVAS Prof. Robinho Propriedades Coligativas São mudanças que ocorrem no comportamento de um líquido. Quando comparamos, em análise química, um líquido puro e uma solução desse líquido
PROPRIEDADES COLIGATIVAS Prof. Robinho Propriedades Coligativas São mudanças que ocorrem no comportamento de um líquido. Quando comparamos, em análise química, um líquido puro e uma solução desse líquido
Propriedades coligativas I
 Propriedades coligativas I 01. (Ufrn) Um béquer de vidro, com meio litro de capacidade, em condições normais de temperatura e pressão, contém 300 ml de água líquida e 100 g de gelo em cubos. Adicionando-se,
Propriedades coligativas I 01. (Ufrn) Um béquer de vidro, com meio litro de capacidade, em condições normais de temperatura e pressão, contém 300 ml de água líquida e 100 g de gelo em cubos. Adicionando-se,
a) Incorreta. O aumento da temperatura desloca o equilíbrio para o lado direito, no sentido da formação do vapor (transformação endotérmica).
 01 a) Incorreta. O aumento da temperatura desloca o equilíbrio para o lado direito, no sentido da formação do vapor (transformação endotérmica). b) Incorreta. Quanto mais volátil o líquido, menor será
01 a) Incorreta. O aumento da temperatura desloca o equilíbrio para o lado direito, no sentido da formação do vapor (transformação endotérmica). b) Incorreta. Quanto mais volátil o líquido, menor será
Química Fascículo 07 Elisabeth Pontes Araújo Elizabeth Loureiro Zink José Ricardo Lemes de Almeida
 Química Fascículo 07 Elisabeth Pontes Araújo Elizabeth Loureiro Zink José Ricardo Lemes de Almeida Índice Propriedades Coligativas...1 Exercícios...3 Gabarito...5 Propriedades coligativas Propriedades
Química Fascículo 07 Elisabeth Pontes Araújo Elizabeth Loureiro Zink José Ricardo Lemes de Almeida Índice Propriedades Coligativas...1 Exercícios...3 Gabarito...5 Propriedades coligativas Propriedades
Química Prof. Marcelo
 Química Prof. Marcelo PROPRIEDADES COLIGATIVAS 1 Pressão de vapor 2 Pressão de vapor e mudança de estado 3- Tonoscopia 4- Crioscopia 5- Ebulioscopia 6 - Osmose e pressão osmótica PROPRIEDADES COLIGATIVAS
Química Prof. Marcelo PROPRIEDADES COLIGATIVAS 1 Pressão de vapor 2 Pressão de vapor e mudança de estado 3- Tonoscopia 4- Crioscopia 5- Ebulioscopia 6 - Osmose e pressão osmótica PROPRIEDADES COLIGATIVAS
PROPRIEDADES COLIGATIVAS
 PROPRIEDADES COLIGATIVAS 1- Pressão Máxima de Vapor: É a pressão exercida por seus vapores quando estes estão em equilíbrio dinâmico com o líquido. É bom lembrar também que quanto maior for a pressão máxima
PROPRIEDADES COLIGATIVAS 1- Pressão Máxima de Vapor: É a pressão exercida por seus vapores quando estes estão em equilíbrio dinâmico com o líquido. É bom lembrar também que quanto maior for a pressão máxima
COLÉGIO NOSSA SENHORA DE LOURDES 2ª SÉRIE Ensino Médio -2015. Roteiro de estudos para recuperação trimestral
 COLÉGIO NOSSA SENHORA DE LOURDES 2ª SÉRIE Ensino Médio -2015 Disciplina: Professor (a): QUÍMICA LUÍS FERNANDO Roteiro de estudos para recuperação trimestral Conteúdo: Referência para estudo: Sites recomendados:
COLÉGIO NOSSA SENHORA DE LOURDES 2ª SÉRIE Ensino Médio -2015 Disciplina: Professor (a): QUÍMICA LUÍS FERNANDO Roteiro de estudos para recuperação trimestral Conteúdo: Referência para estudo: Sites recomendados:
PROPRIEDADES COLIGATIVAS. Prof.: Rodrigo Rocha Monteiro
 PROPRIEDADES COLIGATIVAS Prof.: Rodrigo Rocha Monteiro Propriedades Coligativas São mudanças que ocorrem no comportamento de um líquido. Quando comparamos, em análise química, um líquido puro e uma solução
PROPRIEDADES COLIGATIVAS Prof.: Rodrigo Rocha Monteiro Propriedades Coligativas São mudanças que ocorrem no comportamento de um líquido. Quando comparamos, em análise química, um líquido puro e uma solução
Propriedades Coligativas. Profa. Kátia Aquino
 Propriedades Coligativas Profa. Kátia Aquino O que são? São as propriedades de uma solução que são influenciadas pela quantidade de soluto. Tal influência não depende da natureza do soluto. Vamos recapitular...
Propriedades Coligativas Profa. Kátia Aquino O que são? São as propriedades de uma solução que são influenciadas pela quantidade de soluto. Tal influência não depende da natureza do soluto. Vamos recapitular...
PROPRIEDADES COLIGATIVAS I
 PROPRIEDADES COLIGATIVAS I CONCEITO São propriedades que dependem unicamente do número de partículas dispersas na solução. Não dependem da natureza das partículas dispersas. Observe, a seguir, alguns dados
PROPRIEDADES COLIGATIVAS I CONCEITO São propriedades que dependem unicamente do número de partículas dispersas na solução. Não dependem da natureza das partículas dispersas. Observe, a seguir, alguns dados
SOLUÇÕES. 3) (UNIFOR) O gráfico seguinte dá a solubilidade em água do açúcar de cana em função da temperatura.
 SOLUÇÕES 1) (FEI) Tem-se 500g de uma solução aquosa de sacarose (C 12 H 22 O 11 ), saturada a 50 C. Qual a massa de cristais que se separam da solução, quando ela é resfriada até 30 C? Dados: Coeficiente
SOLUÇÕES 1) (FEI) Tem-se 500g de uma solução aquosa de sacarose (C 12 H 22 O 11 ), saturada a 50 C. Qual a massa de cristais que se separam da solução, quando ela é resfriada até 30 C? Dados: Coeficiente
2º ANO QUÍMICA 1 PROFª ELAINE CRISTINA. Educação para toda a vida. Colégio Santo Inácio. Jesuítas
 2º ANO QUÍMICA 1 1 mol 6,02.10 23 partículas Massa (g)? Massa molar Cálculo do número de mols (n) Quando juntamos duas espécies químicas diferentes e, não houver reação química entre elas, isto é, não
2º ANO QUÍMICA 1 1 mol 6,02.10 23 partículas Massa (g)? Massa molar Cálculo do número de mols (n) Quando juntamos duas espécies químicas diferentes e, não houver reação química entre elas, isto é, não
Quando juntamos duas espécies químicas diferentes e, não houver reação química entre elas, isto é, não houver formação de nova(s) espécie(s), teremos
 SOLUÇÕES Quando juntamos duas espécies químicas diferentes e, não houver reação química entre elas, isto é, não houver formação de nova(s) espécie(s), teremos uma MISTURA Quando na mistura tiver apenas
SOLUÇÕES Quando juntamos duas espécies químicas diferentes e, não houver reação química entre elas, isto é, não houver formação de nova(s) espécie(s), teremos uma MISTURA Quando na mistura tiver apenas
PROPRIEDADES COLIGATIVAS
 PROPRIEDADES COLIGATIVAS 01) (UNESP-SP) Considere cinco soluções aquosas diferentes, todas de concentração 0,1mol/L, de glicose (C 6 H 12 O 6 ) e de quatro eletrólitos fortes, NaCl, KCl, K 2 SO 4 e ZnSO
PROPRIEDADES COLIGATIVAS 01) (UNESP-SP) Considere cinco soluções aquosas diferentes, todas de concentração 0,1mol/L, de glicose (C 6 H 12 O 6 ) e de quatro eletrólitos fortes, NaCl, KCl, K 2 SO 4 e ZnSO
Propriedades Coligativas
 Propriedades Coligativas São as propriedades das soluções que dependem do número de partículas dispersas e independem da natureza das partículas do soluto. Pressão Máxima de Vapor (PMV) PMV é a pressão
Propriedades Coligativas São as propriedades das soluções que dependem do número de partículas dispersas e independem da natureza das partículas do soluto. Pressão Máxima de Vapor (PMV) PMV é a pressão
3 Propriedades Coligativas
 3 Propriedades Coligativas 1 Introdução É bastante comum as pessoas adicionarem sal à água que será utilizada no cozimento de alimentos. Com a adição de sal de cozinha, a água demora mais tempo para entrar
3 Propriedades Coligativas 1 Introdução É bastante comum as pessoas adicionarem sal à água que será utilizada no cozimento de alimentos. Com a adição de sal de cozinha, a água demora mais tempo para entrar
Profa. Maria Fernanda - Química nandacampos.mendonc@gmail.com
 Profa. Maria Fernanda - Química nandacampos.mendonc@gmail.com Estudo de caso Reúnam-se em grupos de máximo 5 alunos e proponha uma solução para o seguinte caso: A morte dos peixes ornamentais. Para isso
Profa. Maria Fernanda - Química nandacampos.mendonc@gmail.com Estudo de caso Reúnam-se em grupos de máximo 5 alunos e proponha uma solução para o seguinte caso: A morte dos peixes ornamentais. Para isso
Lista de Exercícios 4 Indústrias Químicas Resolução pelo Monitor: Rodrigo Papai de Souza
 Lista de Exercícios 4 Indústrias Químicas Resolução pelo Monitor: Rodrigo Papai de Souza 1) a-) Calcular a solubilidade do BaSO 4 em uma solução 0,01 M de Na 2 SO 4 Dissolução do Na 2 SO 4 : Dado: BaSO
Lista de Exercícios 4 Indústrias Químicas Resolução pelo Monitor: Rodrigo Papai de Souza 1) a-) Calcular a solubilidade do BaSO 4 em uma solução 0,01 M de Na 2 SO 4 Dissolução do Na 2 SO 4 : Dado: BaSO
QUÍMICA - 3 o ANO MÓDULO 27 PROPRIEDADES COLIGATIVAS
 QUÍMICA - 3 o ANO MÓDULO 27 PROPRIEDADES COLIGATIVAS 800 pressão de vapor de água (mmhg) 760 700 600 500 400 300 200 100 líquido benzeno puro benzeno + soluto p vapor p.e. do benzeno puro t p.e. do
QUÍMICA - 3 o ANO MÓDULO 27 PROPRIEDADES COLIGATIVAS 800 pressão de vapor de água (mmhg) 760 700 600 500 400 300 200 100 líquido benzeno puro benzeno + soluto p vapor p.e. do benzeno puro t p.e. do
Propriedades Coligativas
 1. Introdução Propriedades Coligativas Algumas propriedades do solvente mudam quando um soluto é dissolvido nele para formar uma solução. O ponto de congelamento da água salgada, por exemplo, é menor que
1. Introdução Propriedades Coligativas Algumas propriedades do solvente mudam quando um soluto é dissolvido nele para formar uma solução. O ponto de congelamento da água salgada, por exemplo, é menor que
SOLUÇÕES PROPRIEDADES COLIGATIVAS TERMODINAMICA II PROF. JAQUELINE SCAPINELLO
 SOLUÇÕES PROPRIEDADES COLIGATIVAS TERMODINAMICA II PROF. JAQUELINE SCAPINELLO A SOLUÇÃO IDEAL Solução: mistura homogenia de espécies químicas (única fase) Solvente: constituinte em maior quantidade Soluto:
SOLUÇÕES PROPRIEDADES COLIGATIVAS TERMODINAMICA II PROF. JAQUELINE SCAPINELLO A SOLUÇÃO IDEAL Solução: mistura homogenia de espécies químicas (única fase) Solvente: constituinte em maior quantidade Soluto:
Prof. Agamenon Roberto PROPRIEDADES COLIGATIVAS www.agamenonquimica.com 1
 Prof. Agamenon Roberto PROPRIEDADES COLIGATIVAS www.agamenonquimica.com 1 PROPRIEDADES COLIGATIVAS 01) (PUC-MG) Tendo em vista o momento em que um líquido se encontra em equilíbrio com seu vapor, leia
Prof. Agamenon Roberto PROPRIEDADES COLIGATIVAS www.agamenonquimica.com 1 PROPRIEDADES COLIGATIVAS 01) (PUC-MG) Tendo em vista o momento em que um líquido se encontra em equilíbrio com seu vapor, leia
Aulas 13 e 14. Soluções
 Aulas 13 e 14 Soluções Definição Solução é a denominação ao sistema em que uma substância está distribuída, ou disseminada, numa segunda substância sob forma de pequenas partículas. Exemplos Dissolvendo-se
Aulas 13 e 14 Soluções Definição Solução é a denominação ao sistema em que uma substância está distribuída, ou disseminada, numa segunda substância sob forma de pequenas partículas. Exemplos Dissolvendo-se
Propriedades Coligativas Aula 3
 Propriedades Coligativas Aula 3 Um efeito coligativo é uma modificação em certas propriedades de um solvente quando nele adicionados um soluto não-volátil, o qual só depende do número de partículas (moléculas
Propriedades Coligativas Aula 3 Um efeito coligativo é uma modificação em certas propriedades de um solvente quando nele adicionados um soluto não-volátil, o qual só depende do número de partículas (moléculas
Segundo a Portaria do Ministério da Saúde MS n.o 1.469, de 29 de dezembro de 2000, o valor máximo permitido (VMP) da concentração do íon sulfato (SO 2
 11 Segundo a Portaria do Ministério da Saúde MS n.o 1.469, de 29 de dezembro de 2000, o valor máximo permitido (VMP) da concentração do íon sulfato (SO 2 4 ), para que a água esteja em conformidade com
11 Segundo a Portaria do Ministério da Saúde MS n.o 1.469, de 29 de dezembro de 2000, o valor máximo permitido (VMP) da concentração do íon sulfato (SO 2 4 ), para que a água esteja em conformidade com
Aluno (a): Professor:
 3º BIM P1 LISTA DE EXERCÍCIOS CIÊNCIAS 6º ANO Aluno (a): Professor: Turma: Turno: Data: / / Unidade: ( ) Asa Norte ( ) Águas Lindas ( )Ceilândia ( ) Gama ( )Guará ( ) Pistão Norte ( ) Recanto das Emas
3º BIM P1 LISTA DE EXERCÍCIOS CIÊNCIAS 6º ANO Aluno (a): Professor: Turma: Turno: Data: / / Unidade: ( ) Asa Norte ( ) Águas Lindas ( )Ceilândia ( ) Gama ( )Guará ( ) Pistão Norte ( ) Recanto das Emas
Introdução. Muitas reações ocorrem completamente e de forma irreversível como por exemplo a reação da queima de um papel ou palito de fósforo.
 Introdução Muitas reações ocorrem completamente e de forma irreversível como por exemplo a reação da queima de um papel ou palito de fósforo. Existem também sistemas, em que as reações direta e inversa
Introdução Muitas reações ocorrem completamente e de forma irreversível como por exemplo a reação da queima de um papel ou palito de fósforo. Existem também sistemas, em que as reações direta e inversa
Osmose Reversa Conheça este processo de purificação de água
 Osmose Reversa Conheça este processo de purificação de água Antes de falarmos sobre Osmose Reversa, precisamos entender o que é Osmose. Osmose é o nome dado ao movimento da água entre meios com concentrações
Osmose Reversa Conheça este processo de purificação de água Antes de falarmos sobre Osmose Reversa, precisamos entender o que é Osmose. Osmose é o nome dado ao movimento da água entre meios com concentrações
QUÍMICA AULA 01 SÉRIE AULA
 QUÍMICA Prof. Lessa AULA 01 SÉRIE AULA 1. Sabendo que a pressão de vapor do solvente puro (água) é 0,18 mmhg e que a pressão de vapor do solvente na solução é 0,16 mmhg, pede-se: Glicose a) O abaixamento
QUÍMICA Prof. Lessa AULA 01 SÉRIE AULA 1. Sabendo que a pressão de vapor do solvente puro (água) é 0,18 mmhg e que a pressão de vapor do solvente na solução é 0,16 mmhg, pede-se: Glicose a) O abaixamento
Química C Extensivo V. 2
 Química C Extensivo V. 2 Exercícios 01) E 02) E Situação 1. Sistema heterogêneo solução saturada com corpo de fundo; 20 C = 46,5/100 g H 2 Na situação 1 há 80 g de soluto em 100 g de água a 20 C. excesso
Química C Extensivo V. 2 Exercícios 01) E 02) E Situação 1. Sistema heterogêneo solução saturada com corpo de fundo; 20 C = 46,5/100 g H 2 Na situação 1 há 80 g de soluto em 100 g de água a 20 C. excesso
SOLUÇÕES SOLUÇÕES MISTURAS
 MISTURAS SOLUÇÕES Quando juntamos duas espécies químicas diferentes e, não houver reação química entre elas, isto é, não houver formação de nova(s) espécie(s), teremos uma mistura. Exemplos: Mistura de
MISTURAS SOLUÇÕES Quando juntamos duas espécies químicas diferentes e, não houver reação química entre elas, isto é, não houver formação de nova(s) espécie(s), teremos uma mistura. Exemplos: Mistura de
PROF. KELTON WADSON OLIMPÍADA 8º SÉRIE ASSUNTO: TRANSFORMAÇÕES DE ESTADOS DA MATÉRIA.
 PROF. KELTON WADSON OLIMPÍADA 8º SÉRIE ASSUNTO: TRANSFORMAÇÕES DE ESTADOS DA MATÉRIA. 1)Considere os seguintes dados obtidos sobre propriedades de amostras de alguns materiais. Com respeito a estes materiais,
PROF. KELTON WADSON OLIMPÍADA 8º SÉRIE ASSUNTO: TRANSFORMAÇÕES DE ESTADOS DA MATÉRIA. 1)Considere os seguintes dados obtidos sobre propriedades de amostras de alguns materiais. Com respeito a estes materiais,
Professora Sonia - Química para o Vestibular Questões Resolvidas Hidrólise Salina (com respostas e resoluções no final)
 Questões Resolvidas Hidrólise Salina (com respostas e resoluções no final) 01. (Uftm) Em soluções aquosas de acetato de sódio, o íon acetato sofre hidrólise: 3 l 3 CH COO (aq) + H O( ) CH COOH (aq) + OH
Questões Resolvidas Hidrólise Salina (com respostas e resoluções no final) 01. (Uftm) Em soluções aquosas de acetato de sódio, o íon acetato sofre hidrólise: 3 l 3 CH COO (aq) + H O( ) CH COOH (aq) + OH
Exercícios - PROPRIEDADES COLIGATIVAS - 2012
 Exercícios - PROPRIEDADES COLIGATIVAS - 2012 1- Ao se preparar uma salada de folhas de alface, utilizando sal e vinagre, devemos temperá-la e comê-la imediatamente, pois, ao ser deixada em repouso por
Exercícios - PROPRIEDADES COLIGATIVAS - 2012 1- Ao se preparar uma salada de folhas de alface, utilizando sal e vinagre, devemos temperá-la e comê-la imediatamente, pois, ao ser deixada em repouso por
TURMA DE MEDICINA - QUÍMICA
 Prof. Borges / Lessa TURMA DE MEDICINA - QUÍMICA AULA 06 DILUIÇÃO DE SOLUÇÕES Diluir significa adicionar solvente a uma solução que já existe. Este método faz com que o volume de solução aumente e a concentração
Prof. Borges / Lessa TURMA DE MEDICINA - QUÍMICA AULA 06 DILUIÇÃO DE SOLUÇÕES Diluir significa adicionar solvente a uma solução que já existe. Este método faz com que o volume de solução aumente e a concentração
Equipe de Química QUÍMICA
 Aluno (a): Série: 3ª Turma: TUTORIAL 11R Ensino Médio Equipe de Química Data: QUÍMICA SOLUÇÕES As misturas podem ser homogêneas ou heterogêneas. As misturas homogêneas possuem uma fase distinta. As misturas
Aluno (a): Série: 3ª Turma: TUTORIAL 11R Ensino Médio Equipe de Química Data: QUÍMICA SOLUÇÕES As misturas podem ser homogêneas ou heterogêneas. As misturas homogêneas possuem uma fase distinta. As misturas
PROVA DE QUÍMICA - 1998 Segunda Etapa
 PROVA DE QUÍMICA - 1998 Segunda Etapa QUESTÃO 01 Num laboratório químico, havia três frascos que continham, respectivamente, um alcano, um álcool e um alqueno. Foram realizados experimentos que envolviam
PROVA DE QUÍMICA - 1998 Segunda Etapa QUESTÃO 01 Num laboratório químico, havia três frascos que continham, respectivamente, um alcano, um álcool e um alqueno. Foram realizados experimentos que envolviam
PROPRIEDADES COLIGATIVAS
 PROPRIEDADES COLIGATIVAS EXERCÍCIOS DE APLICAÇÃO 01 (FUVEST-SP) À mesma temperatura, comparando-se as propriedades da água pura e as soluções aquosas de cloreto de sódio, estas devem apresentar menor:
PROPRIEDADES COLIGATIVAS EXERCÍCIOS DE APLICAÇÃO 01 (FUVEST-SP) À mesma temperatura, comparando-se as propriedades da água pura e as soluções aquosas de cloreto de sódio, estas devem apresentar menor:
Disciplina de Físico Química I - Tipos de Soluções Propriedades Coligativas. Prof. Vanderlei Inácio de Paula contato: vanderleip@anchieta.
 Disciplina de Físico Química I - Tipos de Soluções Propriedades Coligativas. Prof. Vanderlei Inácio de Paula contato: vanderleip@anchieta.br Misturas - soluções A grande maioria dos sistemas encontrados
Disciplina de Físico Química I - Tipos de Soluções Propriedades Coligativas. Prof. Vanderlei Inácio de Paula contato: vanderleip@anchieta.br Misturas - soluções A grande maioria dos sistemas encontrados
Química Geral Materiais Homogêneos e Heterogêneos
 Química Geral Materiais Homogêneos e Heterogêneos 1. (Uepg 2013) Quanto às características das substâncias puras e das misturas, assinale o que for correto. 01) Misturas sólidas homogêneas não podem ser
Química Geral Materiais Homogêneos e Heterogêneos 1. (Uepg 2013) Quanto às características das substâncias puras e das misturas, assinale o que for correto. 01) Misturas sólidas homogêneas não podem ser
Resoluções das Atividades
 Resoluções das Atividades Sumário Módulo 1 Estudo das dispersões Definição, classificação, estudo dos coloides, coeficiente de solubilidade... 1 Módulo 2 Concentração de soluções... 3 Módulo 3 Propriedades
Resoluções das Atividades Sumário Módulo 1 Estudo das dispersões Definição, classificação, estudo dos coloides, coeficiente de solubilidade... 1 Módulo 2 Concentração de soluções... 3 Módulo 3 Propriedades
Propriedades Físicas das Soluções
 Propriedades Físicas das Soluções Solução (def): é uma mistura homogénea de duas ou mais substâncias. Solvente: componente da solução do mesmo estado físico, por exemplo água numa solução aquosa Soluto:
Propriedades Físicas das Soluções Solução (def): é uma mistura homogénea de duas ou mais substâncias. Solvente: componente da solução do mesmo estado físico, por exemplo água numa solução aquosa Soluto:
QUÍMICA QUESTÃO 41 QUESTÃO 42
 Processo Seletivo/UNIFAL- janeiro 2008-1ª Prova Comum TIPO 1 QUÍMICA QUESTÃO 41 Diferentes modelos foram propostos ao longo da história para explicar o mundo invisível da matéria. A respeito desses modelos
Processo Seletivo/UNIFAL- janeiro 2008-1ª Prova Comum TIPO 1 QUÍMICA QUESTÃO 41 Diferentes modelos foram propostos ao longo da história para explicar o mundo invisível da matéria. A respeito desses modelos
As Propriedades das Misturas (Aulas 18 a 21)
 As Propriedades das Misturas (Aulas 18 a 21) I Introdução Em Química, solução é o nome dado a dispersões cujo tamanho das moléculas dispersas é menor que 1 nanometro (10 Angstrons). A solução ainda pode
As Propriedades das Misturas (Aulas 18 a 21) I Introdução Em Química, solução é o nome dado a dispersões cujo tamanho das moléculas dispersas é menor que 1 nanometro (10 Angstrons). A solução ainda pode
Água, Soluções e Suspensões.
 Água, Soluções e Suspensões. A água é a molécula mais abundante nos seres vivos. Cerca de 75% de um adulto. No planeta não existem seres vivos sem água. Fases da água: Sólida Líquida Gasosa Na dependência
Água, Soluções e Suspensões. A água é a molécula mais abundante nos seres vivos. Cerca de 75% de um adulto. No planeta não existem seres vivos sem água. Fases da água: Sólida Líquida Gasosa Na dependência
Solidificação: é o processo em que uma substância passa do estado líquido para o estado sólido.
 EXERCÍCIOS PREPARATÓRIOS 1. (G1) Explique o significado das palavras a seguir. Observe o modelo. Solidificação: é o processo em que uma substância passa do estado líquido para o estado sólido. Vaporização:
EXERCÍCIOS PREPARATÓRIOS 1. (G1) Explique o significado das palavras a seguir. Observe o modelo. Solidificação: é o processo em que uma substância passa do estado líquido para o estado sólido. Vaporização:
Existem diversos tipos de transporte que podem ocorrer através da membrana plasmática. Vejamos abaixo:
 MEMBRANA PLASMÁTICA E TRANSPORTES MEMBRANA PLASMÁTICA A membrana plasmática é constituída de uma camada dupla de lipídeos. Nesta camada, existem moléculas de proteínas encaixadas. Essas moléculas de proteínas
MEMBRANA PLASMÁTICA E TRANSPORTES MEMBRANA PLASMÁTICA A membrana plasmática é constituída de uma camada dupla de lipídeos. Nesta camada, existem moléculas de proteínas encaixadas. Essas moléculas de proteínas
Propriedade Coligativas das Soluções
 Capítulo 9 Propriedade Coligativas das Soluções 1. (IME) Um instrumento desenvolvido para medida de concentração de soluções aquosas não eletrolíticas, consta de: a) um recipiente contendo água destilada;
Capítulo 9 Propriedade Coligativas das Soluções 1. (IME) Um instrumento desenvolvido para medida de concentração de soluções aquosas não eletrolíticas, consta de: a) um recipiente contendo água destilada;
pressão (atm) temperatura( C)
 pressão (atm) T temperatura( C) 01) No diagrama de fases da água: 760 Pressão (mmhg) ta tb ta ( C) As temperaturas ta e tb são, respectivamente: a) pontos normais de fusão e ebulição. b) pontos normais
pressão (atm) T temperatura( C) 01) No diagrama de fases da água: 760 Pressão (mmhg) ta tb ta ( C) As temperaturas ta e tb são, respectivamente: a) pontos normais de fusão e ebulição. b) pontos normais
SOLUÇÕES. As misturas homogêneas possuem uma fase distinta. As misturas heterogêneas possuem duas ou mais fases distintas.
 QUÍMICA PROF - 3C13 SOLUÇÕES As misturas podem ser homogêneas ou heterogêneas. As misturas homogêneas possuem uma fase distinta. As misturas heterogêneas possuem duas ou mais fases distintas. Solução é
QUÍMICA PROF - 3C13 SOLUÇÕES As misturas podem ser homogêneas ou heterogêneas. As misturas homogêneas possuem uma fase distinta. As misturas heterogêneas possuem duas ou mais fases distintas. Solução é
Claudi Cândia /Sara Regina. Aluno(a): PROVA COMENTADA
 QUÍMICA AVALIAÇÃO Claudi Cândia /Sara Regina Aluno(a): PROVA COMENTADA III UNIDADE Nota: Série: 2 a Ensino Médio Turma: A / B / C / D Data: 14/08/2015 1. A prova é composta de 07 questões abertas e 03
QUÍMICA AVALIAÇÃO Claudi Cândia /Sara Regina Aluno(a): PROVA COMENTADA III UNIDADE Nota: Série: 2 a Ensino Médio Turma: A / B / C / D Data: 14/08/2015 1. A prova é composta de 07 questões abertas e 03
EXERCÍCIOS PROPOSTOS RESUMO. ΔH: variação de entalpia da reação H R: entalpia dos reagentes H P: entalpia dos produtos
 Química Frente IV Físico-química Prof. Vitor Terra Lista 04 Termoquímica Entalpia (H) e Fatores que Alteram o ΔH RESUMO Entalpia (H) é a quantidade total de energia de um sistema que pode ser trocada na
Química Frente IV Físico-química Prof. Vitor Terra Lista 04 Termoquímica Entalpia (H) e Fatores que Alteram o ΔH RESUMO Entalpia (H) é a quantidade total de energia de um sistema que pode ser trocada na
Água e Solução Tampão
 União de Ensino Superior de Campina Grande Faculdade de Campina Grande FAC-CG Curso de Fisioterapia Água e Solução Tampão Prof. Dra. Narlize Silva Lira Cavalcante Fevereiro /2015 Água A água é a substância
União de Ensino Superior de Campina Grande Faculdade de Campina Grande FAC-CG Curso de Fisioterapia Água e Solução Tampão Prof. Dra. Narlize Silva Lira Cavalcante Fevereiro /2015 Água A água é a substância
A) Escreva a equação que representa a semi-reação de redução e seu respectivo potencial padrão.
 QUÍMICA QUESTÃ 01 Aparelhos eletrônicos sem fio, tais como máquinas fotográficas digitais e telefones celulares, utilizam, como fonte de energia, baterias recarregáveis. Um tipo comum de bateria recarregável
QUÍMICA QUESTÃ 01 Aparelhos eletrônicos sem fio, tais como máquinas fotográficas digitais e telefones celulares, utilizam, como fonte de energia, baterias recarregáveis. Um tipo comum de bateria recarregável
LISTA COMPLEMENTAR DE EXERCÍCIOS. Ensino Médio 3º ano. Cinética Química Equilíbrio Químico Equilíbrio Iônico
 LISTA COMPLEMENTAR DE EXERCÍCIOS Ensino Médio 3º ano Cinética Química Equilíbrio Químico Equilíbrio Iônico Prof. Ricardo Finkler 2011 1) A velocidade de uma reação química depende: I. Do número de colisões
LISTA COMPLEMENTAR DE EXERCÍCIOS Ensino Médio 3º ano Cinética Química Equilíbrio Químico Equilíbrio Iônico Prof. Ricardo Finkler 2011 1) A velocidade de uma reação química depende: I. Do número de colisões
Resolução: 0,86ºC. x = 0,5 mol etanol/kg acetona. 0,5 mol 1000 g de acetona. 200 g de acetona. y = 0,1 mol de etanol. 1 mol de etanol (C 2 H 6 O) 46 g
 (ACAFE) Foi dissolvida uma determinada massa de etanol puro em 200 g de acetona acarretando em um aumento de 0,86 C na temperatura de ebulição da acetona. Dados: H: 1 g/mol, C: 12 g/mol, O: 16 g/mol. Constante
(ACAFE) Foi dissolvida uma determinada massa de etanol puro em 200 g de acetona acarretando em um aumento de 0,86 C na temperatura de ebulição da acetona. Dados: H: 1 g/mol, C: 12 g/mol, O: 16 g/mol. Constante
DEPARTAMENTO DE ZOOLOGIA FACULDADE DE CIÊNCIAS E TECNOLOGIA UNIVERSIDADE DE COIMBRA PERMEABILIDADE DAS MEMBRANAS CELULARES
 DEPARTAMENTO DE ZOOLOGIA FACULDADE DE CIÊNCIAS E TECNOLOGIA UNIVERSIDADE DE COIMBRA FISIOLOGIA ANIMAL II AULA 4 PERMEABILIDADE DAS MEMBRANAS CELULARES CAETANA CARVALHO, PAULO SANTOS 2006 1 INTRODUÇÃO As
DEPARTAMENTO DE ZOOLOGIA FACULDADE DE CIÊNCIAS E TECNOLOGIA UNIVERSIDADE DE COIMBRA FISIOLOGIA ANIMAL II AULA 4 PERMEABILIDADE DAS MEMBRANAS CELULARES CAETANA CARVALHO, PAULO SANTOS 2006 1 INTRODUÇÃO As
MASSA ATÔMICA. 1u corresponde a 1,66.10-24 g, que equivale aproximadamente à massa de um próton ou de um nêutron.
 Cálculos Químicos MASSA ATÔMICA Na convenção da IUPAC (União Internacional de Química Pura e Aplicada) realizada em 1961, adotou-se como unidade padrão para massa atômica o equivalente a 1/12 da massa
Cálculos Químicos MASSA ATÔMICA Na convenção da IUPAC (União Internacional de Química Pura e Aplicada) realizada em 1961, adotou-se como unidade padrão para massa atômica o equivalente a 1/12 da massa
SÉRIE: 2º ano EM Exercícios de recuperação final DATA / / DISCIPLINA: QUÍMICA PROFESSOR: FLÁVIO QUESTÕES DE MÚLTIPLA ESCOLHA
 SÉRIE: 2º ano EM Exercícios de recuperação final DATA / / DISCIPLINA: QUÍMICA PROFESSOR: FLÁVIO QUESTÕES DE MÚLTIPLA ESCOLHA QUESTÃO 01 Em uma determinada transformação foi constatado que poderia ser representada
SÉRIE: 2º ano EM Exercícios de recuperação final DATA / / DISCIPLINA: QUÍMICA PROFESSOR: FLÁVIO QUESTÕES DE MÚLTIPLA ESCOLHA QUESTÃO 01 Em uma determinada transformação foi constatado que poderia ser representada
química FUVEST ETAPA Resposta QUESTÃO 1 QUESTÃO 2 c) Determine o volume adicionado da solução
 Química QUESTÃO 1 Um recipiente contém 100 ml de uma solução aquosa de H SO 4 de concentração 0,1 mol/l. Duas placas de platina são inseridas na solução e conectadas a um LED (diodo emissor de luz) e a
Química QUESTÃO 1 Um recipiente contém 100 ml de uma solução aquosa de H SO 4 de concentração 0,1 mol/l. Duas placas de platina são inseridas na solução e conectadas a um LED (diodo emissor de luz) e a
QUÍMICA TESTES EXERCÍCIOS DE SOLUBILIDADE SÉRIE CASA
 QUÍMICA Prof. Borges TESTES EXERCÍCIOS DE SOLUBILIDADE SÉRIE CASA 1. (Fuvest-SP) Descargas industriais de água pura aquecida podem provocar a morte de peixes em rios e lagos porque causam: a) o aumento
QUÍMICA Prof. Borges TESTES EXERCÍCIOS DE SOLUBILIDADE SÉRIE CASA 1. (Fuvest-SP) Descargas industriais de água pura aquecida podem provocar a morte de peixes em rios e lagos porque causam: a) o aumento
a) Qual a configuração eletrônica do cátion do alumínio isoeletrônico ao gás nobre neônio?
 Questão 1: O Brasil é o campeão mundial da reciclagem de alumínio, colaborando com a preservação do meio ambiente. Por outro lado, a obtenção industrial do alumínio sempre foi um processo caro, consumindo
Questão 1: O Brasil é o campeão mundial da reciclagem de alumínio, colaborando com a preservação do meio ambiente. Por outro lado, a obtenção industrial do alumínio sempre foi um processo caro, consumindo
Solubilidade & Unidades de Concentração
 Solubilidade & Unidades de Concentração Introdução Como se formam as soluções? Qual é o mecanismo de dissolução? Para responder essas questões devemos estudar as alterações estruturais que ocorrem durante
Solubilidade & Unidades de Concentração Introdução Como se formam as soluções? Qual é o mecanismo de dissolução? Para responder essas questões devemos estudar as alterações estruturais que ocorrem durante
Matéria: Química Assunto: Materiais Prof. Gilberto Ramos
 Matéria: Química Assunto: Materiais Prof. Gilberto Ramos Química Materiais, suas propriedades e usos Estados Físicos Estado vem do latim status (posição,situação, condição,modo de estar). O estado físico
Matéria: Química Assunto: Materiais Prof. Gilberto Ramos Química Materiais, suas propriedades e usos Estados Físicos Estado vem do latim status (posição,situação, condição,modo de estar). O estado físico
MATÉRIA Química II. Helder
 Valores eternos. TD Recuperação ALUNO(A) MATÉRIA Química II PROFESSOR(A) Helder ANO SEMESTRE DATA 1º 1º Jul/2013 TOTAL DE ESCORES ---- ESCORES OBTIDOS ---- 1. Numa solução saturada temos: a) uma soluçâo
Valores eternos. TD Recuperação ALUNO(A) MATÉRIA Química II PROFESSOR(A) Helder ANO SEMESTRE DATA 1º 1º Jul/2013 TOTAL DE ESCORES ---- ESCORES OBTIDOS ---- 1. Numa solução saturada temos: a) uma soluçâo
Volumetria ácido-base (continuação) Prof a Alessandra Smaniotto QMC 5325 - Química Analítica - Farmácia Turmas 02102A e 02102B
 Volumetria ácido-base (continuação) Prof a Alessandra Smaniotto QMC 5325 - Química Analítica - Farmácia Turmas 02102A e 02102B Curvas de titulação ² A curva de titulação é a representação gráfica de como
Volumetria ácido-base (continuação) Prof a Alessandra Smaniotto QMC 5325 - Química Analítica - Farmácia Turmas 02102A e 02102B Curvas de titulação ² A curva de titulação é a representação gráfica de como
OSMOSE (Pressão Osmótica - )
 OSMOSE (Pressão Osmótica - ) Portal de Estudos em Química (PEQ) www.profpc.com.br Página 1 EXERCÍCIOS DE APLICAÇÃO 01 (FEI-SP) Uma salada de alface foi temperada com solução de vinagre e sal. Após um certo
OSMOSE (Pressão Osmótica - ) Portal de Estudos em Química (PEQ) www.profpc.com.br Página 1 EXERCÍCIOS DE APLICAÇÃO 01 (FEI-SP) Uma salada de alface foi temperada com solução de vinagre e sal. Após um certo
2) Uma solução de 5,00 g de ácido acético, CH 3 COOH, em 100 g de benzeno congela a 3,37
 Química Geral e Experimental II Soluções e propriedades coligativas Resolução comentada de exercícios selecionados versão colig_v3_2005 Prof. Fabricio R. Sensato 1) Qual o ponto de ebulição de uma solução
Química Geral e Experimental II Soluções e propriedades coligativas Resolução comentada de exercícios selecionados versão colig_v3_2005 Prof. Fabricio R. Sensato 1) Qual o ponto de ebulição de uma solução
QUÍMICA CELULAR NUTRIÇÃO TIPOS DE NUTRIENTES NUTRIENTES ENERGÉTICOS 4/3/2011 FUNDAMENTOS QUÍMICOS DA VIDA
 NUTRIÇÃO QUÍMICA CELULAR PROFESSOR CLERSON CLERSONC@HOTMAIL.COM CIESC MADRE CLÉLIA CONCEITO CONJUNTO DE PROCESSOS INGESTÃO, DIGESTÃO E ABSORÇÃO SUBSTÂNCIAS ÚTEIS AO ORGANISMO ESPÉCIE HUMANA: DIGESTÃO ONÍVORA
NUTRIÇÃO QUÍMICA CELULAR PROFESSOR CLERSON CLERSONC@HOTMAIL.COM CIESC MADRE CLÉLIA CONCEITO CONJUNTO DE PROCESSOS INGESTÃO, DIGESTÃO E ABSORÇÃO SUBSTÂNCIAS ÚTEIS AO ORGANISMO ESPÉCIE HUMANA: DIGESTÃO ONÍVORA
Exercícios Sobre LigaÇões iônicas
 Exercícios Sobre LigaÇões iônicas Dados: 01. (Ufrj - adaptado) A caiação é um processo tradicionalmente utilizado na pintura de casas. Uma das maneiras de se preparar o pigmento consiste em misturar cal
Exercícios Sobre LigaÇões iônicas Dados: 01. (Ufrj - adaptado) A caiação é um processo tradicionalmente utilizado na pintura de casas. Uma das maneiras de se preparar o pigmento consiste em misturar cal
www.professormazzei.com PROPREDADES COLIGATIVAS Folha 03 João Roberto Mazzei
 01. (UNESP 1989) Considerar duas soluções de ácido clorídrico e outra de ácido acético (ácido etanóico), ambas 10 2 M. Pergunta-se: a) Qual das duas soluções apresenta menor temperatura de congelação?
01. (UNESP 1989) Considerar duas soluções de ácido clorídrico e outra de ácido acético (ácido etanóico), ambas 10 2 M. Pergunta-se: a) Qual das duas soluções apresenta menor temperatura de congelação?
O interesse da Química é analisar as...
 O interesse da Química é analisar as... PROPRIEDADES CONSTITUINTES SUBSTÂNCIAS E MATERIAIS TRANSFORMAÇÕES ESTADOS FÍSICOS DOS MATERIAIS Os materiais podem se apresentar na natureza em 3 estados físicos
O interesse da Química é analisar as... PROPRIEDADES CONSTITUINTES SUBSTÂNCIAS E MATERIAIS TRANSFORMAÇÕES ESTADOS FÍSICOS DOS MATERIAIS Os materiais podem se apresentar na natureza em 3 estados físicos
A Termoquímica tem como objetivo o estudo das variações de energia que acompanham as reações químicas.
 A Termoquímica tem como objetivo o estudo das variações de energia que acompanham as reações químicas. Não há reação química que ocorra sem variação de energia! A energia é conservativa. Não pode ser criada
A Termoquímica tem como objetivo o estudo das variações de energia que acompanham as reações químicas. Não há reação química que ocorra sem variação de energia! A energia é conservativa. Não pode ser criada
PROPRIEDADES DOS MATERIAIS QUÍMICA GERAL
 PROPRIEDADES DOS MATERIAIS QUÍMICA GERAL PROPRIEDADES DA MATÉRIA CONCEITOS BÁSICOS MATÉRIA: tudo o que tem massa e ocupa lugar no espaço. CORPO/OBJETO: porção limitada da matéria. MASSA: quantidade matéria,
PROPRIEDADES DOS MATERIAIS QUÍMICA GERAL PROPRIEDADES DA MATÉRIA CONCEITOS BÁSICOS MATÉRIA: tudo o que tem massa e ocupa lugar no espaço. CORPO/OBJETO: porção limitada da matéria. MASSA: quantidade matéria,
Mudanças de fase. Temperatura e pressão críticas Os gases são liquefeitos sob o aumento da pressão a uma temperatura.
 Mudanças de fase Sublimação: sólido gás. Vaporização: líquido gás. Derretimento ou fusão: sólido líquido. Deposição: gás sólido. Condensação: gás líquido. Congelamento: líquido sólido. Mudanças de fase
Mudanças de fase Sublimação: sólido gás. Vaporização: líquido gás. Derretimento ou fusão: sólido líquido. Deposição: gás sólido. Condensação: gás líquido. Congelamento: líquido sólido. Mudanças de fase
FISIOLOGIA RENAL EXERCÍCIOS DE APRENDIZAGEM
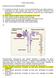 EXERCÍCIOS DE APRENDIZAGEM FISIOLOGIA RENAL 01. A sudorese (produção de suor) é um processo fisiológico que ajuda a baixar a temperatura do corpo quando está muito calor ou quando realizamos uma atividade
EXERCÍCIOS DE APRENDIZAGEM FISIOLOGIA RENAL 01. A sudorese (produção de suor) é um processo fisiológico que ajuda a baixar a temperatura do corpo quando está muito calor ou quando realizamos uma atividade
Departamento de Química Inorgânica 2. SOLUÇÕES
 2. SOLUÇÕES I. INTRODUÇÃO Soluções são misturas homogêneas de dois ou mais componentes, sendo que estes estão misturados uniformemente em nível molecular. Em nosso cotidiano temos diversos exemplos de
2. SOLUÇÕES I. INTRODUÇÃO Soluções são misturas homogêneas de dois ou mais componentes, sendo que estes estão misturados uniformemente em nível molecular. Em nosso cotidiano temos diversos exemplos de
Água como solvente. Objectivos de Aprendizagem. No final desta lição, você será capaz de:
 Lição N o 3 Água como solvente Objectivos de Aprendizagem No final desta lição, você será capaz de: Mencionar as propriedades físicas da água. Descrever a composição química da água. Material de apoio
Lição N o 3 Água como solvente Objectivos de Aprendizagem No final desta lição, você será capaz de: Mencionar as propriedades físicas da água. Descrever a composição química da água. Material de apoio
Reacções de precipitação
 Precipitados Reacções de precipitação Introdução teórica O interesse das reacções de precipitação manifesta-se em diversos domínios, nomeadamente a nível geológico, biológico e industrial. Já ouviste falar
Precipitados Reacções de precipitação Introdução teórica O interesse das reacções de precipitação manifesta-se em diversos domínios, nomeadamente a nível geológico, biológico e industrial. Já ouviste falar
P2 - PROVA DE QUÍMICA GERAL - 11/10/08
 P2 - PROVA DE QUÍMICA GERAL - 11/10/08 Nome: Gabarito Nº de Matrícula: Turma: Assinatura: Questão Valor Grau Revisão 1 a 2,5 2 a 2,5 3 a 2,5 4 a 2,5 Total 10,0 Constantes: R 8,314 J mol -1 K -1 0,0821
P2 - PROVA DE QUÍMICA GERAL - 11/10/08 Nome: Gabarito Nº de Matrícula: Turma: Assinatura: Questão Valor Grau Revisão 1 a 2,5 2 a 2,5 3 a 2,5 4 a 2,5 Total 10,0 Constantes: R 8,314 J mol -1 K -1 0,0821
QUÍMICA COMENTÁRIO DA PROVA DE QUÍMICA
 COMENTÁRIO DA PROVA DE QUÍMICA Prova boa, com questões claras e nível superior ao do ano passado. Nota-se, no entanto, a falta de uma revisão criteriosa, feita por algum professor da área, que não tenha
COMENTÁRIO DA PROVA DE QUÍMICA Prova boa, com questões claras e nível superior ao do ano passado. Nota-se, no entanto, a falta de uma revisão criteriosa, feita por algum professor da área, que não tenha
PROCESSO SELETIVO 2006 QUESTÕES OBJETIVAS
 3 PROCESSO SELETIVO 2006 QUESTÕES OBJETIVAS QUÍMICA 01 - O dispositivo de segurança que conhecemos como air-bag utiliza como principal reagente para fornecer o gás N 2 (massa molar igual a 28 g mol -1
3 PROCESSO SELETIVO 2006 QUESTÕES OBJETIVAS QUÍMICA 01 - O dispositivo de segurança que conhecemos como air-bag utiliza como principal reagente para fornecer o gás N 2 (massa molar igual a 28 g mol -1
Revisão: Química inorgânica Soluções aquosas
 QUÍMICA è Revisão: Química inorgânica Hidróxidos fortes família 1A e 2A (exceto Ca e Mg) Ácidos fortes nº de oxigênios nº de hidrogênios > 2, principalmente nítrico (HNO 3 ), clorídrico (HCl) e sulfúrico
QUÍMICA è Revisão: Química inorgânica Hidróxidos fortes família 1A e 2A (exceto Ca e Mg) Ácidos fortes nº de oxigênios nº de hidrogênios > 2, principalmente nítrico (HNO 3 ), clorídrico (HCl) e sulfúrico
QUÍMICA - 3 o ANO MÓDULO 13 SAIS
 QUÍMICA - 3 o ANO MÓDULO 13 SAIS Ácido ídrico eto oso ito ico ato Sal nome do ácido de origem eto ito ato nome do cátion da base de origem +y B x +x A y Como pode cair no enem O etanol é considerado um
QUÍMICA - 3 o ANO MÓDULO 13 SAIS Ácido ídrico eto oso ito ico ato Sal nome do ácido de origem eto ito ato nome do cátion da base de origem +y B x +x A y Como pode cair no enem O etanol é considerado um
PROPRIEDADES COLIGATIVAS
 RORIEDADES COLIGAIVAS O artigo abaixo trata de um tema extremamente cobrado nas provas do IME e do IA dos últimos anos. Em nosso site já existem dois outros artigos com exercícios sobre esse assunto e
RORIEDADES COLIGAIVAS O artigo abaixo trata de um tema extremamente cobrado nas provas do IME e do IA dos últimos anos. Em nosso site já existem dois outros artigos com exercícios sobre esse assunto e
IDENTIFICAÇÃO E CONFIRMAÇÃO DE GRUPOS FUNCIONAIS: Parte 1: ALDEÍDOS E CETONAS
 PRÁTICA N o. 02 IDENTIFICAÇÃO E CONFIRMAÇÃO DE GRUPOS FUNCIONAIS: Parte 1: ALDEÍDOS E CETONAS OBJETIVOS: Esta prática tem como objetivo a identificação e confirmação de grupos funcionais de aldeídos e
PRÁTICA N o. 02 IDENTIFICAÇÃO E CONFIRMAÇÃO DE GRUPOS FUNCIONAIS: Parte 1: ALDEÍDOS E CETONAS OBJETIVOS: Esta prática tem como objetivo a identificação e confirmação de grupos funcionais de aldeídos e
Funções inorgânicas - Sais
 Funções inorgânicas - Sais 01. Faça as equações de neutralização (ou salificação) total entre os seguintes compostos: 02. (UNESP) Os sais hidrogenocarbonato de potássio, ortofosfato de cálcio, cianeto
Funções inorgânicas - Sais 01. Faça as equações de neutralização (ou salificação) total entre os seguintes compostos: 02. (UNESP) Os sais hidrogenocarbonato de potássio, ortofosfato de cálcio, cianeto
FICHA DE TRABALHO DE FÍSICA E QUÍMICA A MAIO 2011
 FICHA DE TRABALHO DE FÍSICA E QUÍMICA A MAIO 2011 APSA Nº21 11º Ano de Escolaridade 1- Classifique, justificando, as soluções aquosas dos sais que se seguem como ácidas, básicas ou neutras. a) CaCO 3 b)
FICHA DE TRABALHO DE FÍSICA E QUÍMICA A MAIO 2011 APSA Nº21 11º Ano de Escolaridade 1- Classifique, justificando, as soluções aquosas dos sais que se seguem como ácidas, básicas ou neutras. a) CaCO 3 b)
TERMOQUÍMICA. O que é o CALOR? Energia térmica em transito
 TERMOQUÍMICA Termoquímica PROF. Prof. DAVID David TERMOQUÍMICA O que é o CALOR? Energia térmica em transito TERMOQUÍMICA Estuda as quantidades de calor liberadas ou absorvidas durante as reações químicas
TERMOQUÍMICA Termoquímica PROF. Prof. DAVID David TERMOQUÍMICA O que é o CALOR? Energia térmica em transito TERMOQUÍMICA Estuda as quantidades de calor liberadas ou absorvidas durante as reações químicas
UNIVERSIDADE ABERTA DO BRASIL UNIVERSIDADE FEDERAL DA PARAIBA - UFPB VIRTUAL LICENCIATURA EM CIÊNCIAS BIOLÓGICAS A DISTÂNCIA
 UNIVERSIDADE ABERTA DO BRASIL UNIVERSIDADE FEDERAL DA PARAIBA - UFPB VIRTUAL LICENCIATURA EM CIÊNCIAS BIOLÓGICAS A DISTÂNCIA DISCIPLINA BIOQUÍMICA ESTRUTURAL Ministrante: Prof. Dr. Carlos Alberto de Almeida
UNIVERSIDADE ABERTA DO BRASIL UNIVERSIDADE FEDERAL DA PARAIBA - UFPB VIRTUAL LICENCIATURA EM CIÊNCIAS BIOLÓGICAS A DISTÂNCIA DISCIPLINA BIOQUÍMICA ESTRUTURAL Ministrante: Prof. Dr. Carlos Alberto de Almeida
Se um sistema troca energia com a vizinhança por trabalho e por calor, então a variação da sua energia interna é dada por:
 Primeira Lei da Termodinâmica A energia interna U de um sistema é a soma das energias cinéticas e das energias potenciais de todas as partículas que formam esse sistema e, como tal, é uma propriedade do
Primeira Lei da Termodinâmica A energia interna U de um sistema é a soma das energias cinéticas e das energias potenciais de todas as partículas que formam esse sistema e, como tal, é uma propriedade do
Métodos de determinação da Massa Molecular
 Métodos de determinação da Massa Molecular Métodos absolutos a) Massa molecular média em número - Análise de grupos terminais - Elevação ebulioscópica - Depressão crioscópica - Abaixamento da pressão de
Métodos de determinação da Massa Molecular Métodos absolutos a) Massa molecular média em número - Análise de grupos terminais - Elevação ebulioscópica - Depressão crioscópica - Abaixamento da pressão de
Atividade 1: Grandezas Químicas
 COLÉGIO SHALOM Ensino Fundamental 9 Ano Prof.º: Hélen Cristina Disciplina Química Aluno (a):. No. Trabalho de Recuperação Data: / / Valor: Nota: Orientações: -Responder manuscrito; -Cópias de colegas,
COLÉGIO SHALOM Ensino Fundamental 9 Ano Prof.º: Hélen Cristina Disciplina Química Aluno (a):. No. Trabalho de Recuperação Data: / / Valor: Nota: Orientações: -Responder manuscrito; -Cópias de colegas,
Química. Resolução das atividades complementares. Q9 Diluição e concentração
 Resolução das atividades complementares 1 Química Q9 Diluição e concentração p. 45 1 (UFSM-RS) A soda cáustica (NaOH) é uma das bases mais usadas pela indústria química na preparação de compostos orgânicos,
Resolução das atividades complementares 1 Química Q9 Diluição e concentração p. 45 1 (UFSM-RS) A soda cáustica (NaOH) é uma das bases mais usadas pela indústria química na preparação de compostos orgânicos,
Fisiologia vegetal. Aulas práticas. Departamento de Botânica Faculdade de Ciências e Tecnologia de Coimbra Universidade de Coimbra
 Fisiologia vegetal Aulas práticas Departamento de Botânica Faculdade de Ciências e Tecnologia de Coimbra Universidade de Coimbra 2 Aula 1 Osmose Gradiente osmótico (1 aluno de cada grupo) Osmómetro de
Fisiologia vegetal Aulas práticas Departamento de Botânica Faculdade de Ciências e Tecnologia de Coimbra Universidade de Coimbra 2 Aula 1 Osmose Gradiente osmótico (1 aluno de cada grupo) Osmómetro de
