RESOLUÇÃO- RDC Nº 3, de 4 de fevereiro de 2011 CAPÍTULO I Seção I Seção II Seção III
|
|
|
- Giovanna Peixoto Pinheiro
- 6 Há anos
- Visualizações:
Transcrição
1 página 1/6 RESOLUÇÃO- RDC Nº 3, de 4 de fevereiro de 2011 DOU 07/02/ Esta Resolução entrará em vigor 360 (trezentos e sessenta) dias após a sua publicação. Estabelece os requisitos mínimos de identidade e qualidade para seringas hipodérmicas estéreis de uso único. A Diretoria Colegiada da Agência Nacional de Vigilância Sanitária, no uso da atribuição que lhe confere o inciso IV do art. 11 do Regulamento aprovado pelo Decreto No , de 16 de abril de 1999, e tendo em vista o disposto no inciso II e nos 1º e 3º do art. 54 do Regimento Interno aprovado nos termos do Anexo I da Portaria No- 354 da ANVISA, de 11 de agosto de 2006, republicada no DOU de 21 de agosto de 2006, em reunião realizada 11 de janeiro de 2011, adota a seguinte Resolução da Diretoria Colegiada e eu, Diretor- Presidente Substituto, determino a sua publicação: Art. 1 Fica aprovado o Regulamento Técnico que estabelece os requisitos mínimos de identidade e qualidade para seringas hipodérmicas estéreis de uso único. CAPÍTULO I DAS DISPOSIÇÕES INICIAIS Seção I Objetivo e Abrangência Art. 2 Este Regulamento Técnico estabelece os requisitos mínimos de identidade e qualidade para seringas hipodérmicas estéreis de uso único feitas de material plástico e destinadas à aspiração de fluidos ou à injeção de fluidos, realizadas por meio manual ou em bomba de seringa. Seção II Definições Art. 3 Para efeito deste Regulamento Técnico são adotadas as seguintes definições: I - CAPACIDADE NOMINAL - capacidade da seringa declarada pelo fabricante. II - CAPACIDADE MÁXIMA DE USO - capacidade da seringa quando o pistão é levado à posição mais distal da seringa. III - CAPA DE AGULHA - capa protetora da extremidade destinada a manter a esterilidade da cânula da agulha e proteger fisicamente a cânula e a base da agulha, quando presente. IV - PROTETOR DE AGULHA - capa destinada a proporcionar proteção física à cânula da agulha. V - CAPAS PROTETORAS DAS EXTREMIDADES: capas destinadas a envolver a proporção projetada da haste e a base do êmbolo em uma extremidade e o bico e ou agulha na outra extremidade. Seção III Classificações Art. 4 As seringas hipodérmicas estéreis de uso único são classificadas em: I - Para uso manual; II - Para uso em bomba de seringa; e III - Para insulina, seguida pelos tipos: a) Tipo 1: Seringa com montagem cônica com conicidade de 6% (Luer), sem agulha e embalada unitariamente. b) Tipo 2: Seringa com montagem cônica com conicidade de 6% (Luer), sem agulha e com protetor e capa. c) Tipo 3: Seringa com montagem cônica com conicidade de 6% (Luer), com uma agulha desconectável e embalada unitariamente.
2 página 2/6 d) Tipo 4: Seringa com montagem cônica com conicidade de 6% (Luer), com uma agulha desconectável e montada com protetor e capa. e) Tipo 5: Seringa com conector diferente da montagem cônica com conicidade de 6% (Luer), com uma agulha que não pode ser desconectada e embalada unitariamente. f) Tipo 6: Seringa com conector diferente da montagem cônica com conicidade de 6% (Luer), com uma agulha que não pode ser desconectada e embalada com capa protetora. g) Tipo 7: Seringa com agulha fixa e embalada unitariamente. h) Tipo 8: Seringa com agulha fixa e embalada com capa protetora. Seção IV Designações Art. 5 O fabricante e o importador deverão utilizar as seguintes designações: I - Seringa hipodérmica estéril de uso único para uso manual com agulha; II - Seringa hipodérmica estéril de uso único para uso manual sem agulha; III - Seringa hipodérmica estéril de uso único para uso em bomba de seringa; IV - Seringa estéril de uso único para insulina com agulha; V - Seringa estéril de uso único para insulina sem agulha; VI - Seringa estéril de uso único para insulina com agulha fixa. Seção V Certificação de Conformidade Art. 6 Além dos requisitos previstos nesta Resolução, as seringas hipodérmicas estéreis de uso único devem atender também aos requisitos de certificação de conformidade no âmbito do Sistema Brasileiro de Avaliação da Conformidade (SBAC). 1º Os fabricantes nacionais e os importadores podem optar pela certificação mediante avaliação do sistema e ensaios no produto ou pela certificação mediante avaliação lote a lote. 2º As empresas devem apresentar, no momento da solicitação do registro e da revalidação, cópia válida do atestado de conformidade ou de liberação do lote, para cada modelo e tamanho de seringa, conforme o modelo adotado. CAPÍTULO II DO REGULAMENTO TÉCNICO Seção I Princípios Gerais Art. 7 Os fabricantes de seringas hipodérmicas estéreis de uso único devem ter implantadas as Boas Práticas de Fabricação (BPF). Art. 8 Os materiais usados na fabricação de seringas hipodérmicas estéreis de uso único devem ser compatíveis com os fluidos injetáveis e não devem alterar suas propriedades físicas e químicas. Art. 9º As seringas estéreis de uso único devem estar isentas de contaminantes que possam causar risco à saúde humana. Art. 10 Os fabricantes de seringas estéreis de uso único devem demonstrar que existe compatibilidade com as agulhas hipodérmicas quando do registro e alterações de projeto do produto. Art. 11 Os fabricantes de seringas estéreis de uso único para uso em bomba de seringa devem demonstrar que existe compatibilidade com a bomba.
3 página 3/6 Art. 12 As seringas hipodérmicas estéreis de uso único devem ser lubrificadas e graduadas. Art. 13 Quando o produto for composto do conjunto seringa e agulha, está última também deve cumprir os requisitos de qualidade e de certificação estabelecidos em regulamento específico. Art. 14 As seringas hipodérmicas estéreis de uso único devem atender aos requisitos mínimos, conforme ensaios, procedimentos e metodologias descritos nas referências normativas nacionais e internacionais aplicáveis às seringas hipodérmicas estéreis de uso único, conforme anexo. Seção II Requisitos Mínimos Art. 15. São requisitos mínimos de identidade e qualidade para seringas hipodérmicas estéreis de uso único: I - As seringas não devem conter partículas e matérias estranhas por meio de verificação visual normal; II - O valor de ph de um extrato preparado deve estar dentro de uma unidade de ph, quando comparado com fluido controle; III - O extrato não deve conter mais do que 5 mg/l (miligramas por litro) do somatório dos conteúdos de chumbo, estanho, zinco e ferro; e ter menos do que 1mg/L (miligramas por litro) de cádmio; IV - As seringas não devem conter gotas de lubrificante na superfície interna e externa da seringa por meio de inspeção visual normal; V - A quantidade de lubrificante utilizado não deve exceder 0,25 mg/cm2 (não aplicável para seringas para insulina); VI - O lubrificante usado deve atender aos requisitos da farmacopéia; VII - A capacidade nominal, a capacidade graduada, o volume residual, as dimensões da escala e a força para o ensaio de vazamento devem atender aos requisitos mínimos, conforme ensaios, procedimentos e metodologias descritos nas referências normativas nacionais e internacionais aplicáveis às seringas hipodérmicas estéreis de uso único, conforme anexo. VIII - Quando apresentar mais de uma escala, a seringa deve expressar graduações idênticas e uniformes, devendo a unidade de volume estar marcada no cilindro; IX - O cilindro deve ter dimensão pelo menos 10% (dez por cento) maior que a capacidade nominal declarada; X - O cilindro deve apresentar flange com tamanho e resistência compatíveis com a finalidade de uso. O flange deve restringir a rotação do cilindro em até uma volta de 180º (cento e oitenta graus); XI - O desenho da haste e da base da haste da seringa deve assegurar que o pistão não se desconecte; XII - O comprimento da haste, a partir do flange do cilindro, deve atender aos requisitos especificados em regulamento de avaliação da conformidade, de acordo com a capacidade nominal; XIII - O êmbolo não deve se mover quando a seringa é preenchida com água e sustentada verticalmente, com o bico para cima e para baixo; XIV - Deve haver uma linha de referência visível e definida, de acordo com as condições especificadas em regulamento de avaliação da conformidade. XV - Não deve haver vazamento de ar e líquido através do pistão; XVI - O espaço morto da seringa para insulina deve atender aos limites máximos especificados pelo tipo de seringa; Art. 16. Além dos requisitos mínimos previstos no artigo anterior, as seringas para uso em bomba de seringa também devem observar: I - Os requisitos especificados em regulamento de avaliação da conformidade para vazão estável, relação de vazão real/determinada e variação máxima de vazão;
4 página 4/6 II - A conformidade da seringa de acordo com o volume máximo de deslocamento de fluido; III - O mínimo da variação da força necessária para mover o pistão; IV - O projeto de montagem do pistão/haste deve dificultar a retirada completa da haste do cilindro; V - As dimensões mínimas das seringas para montagem em bombas, conforme a capacidade nominal especificada em regulamento de avaliação da conformidade; VI - O encaixe cônico do bico das seringas tipos 1, 2, 3, 4 deve atender às especificações previstas em regulamento de avaliação da conformidade; VII - O bico da seringa deve estar no centro, em posição coaxial em relação ao cilindro. Seção III Embalagem e Rotulagem Art. 17 As seringas hipodérmicas estéreis de uso único para uso manual ou em bomba de seringa devem ser acondicionadas em embalagens unitárias. Parágrafo único. É admissível a apresentação de seringas hipodérmicas em forma de conjunto de dispositivos médicos quando este for destinado a um único procedimento. Art. 18 As embalagens unitárias devem garantir a integridade das seringas hipodérmicas estéreis de uso único para uso manual ou em bomba de seringa, em especial quanto à manutenção da esterilidade do conteúdo. Art. 19 As embalagens unitárias das seringas hipodérmicas estéreis de uso único para uso manual ou em bomba de seringa devem apresentar evidências claras de que foram abertas, não permitindo o selamento posterior à abertura. Art. 20 Os dizeres de rotulagem das seringas hipodérmicas estéreis de uso único para uso manual ou em bomba de seringa devem atender às exigências das referências normativas nacionais e internacionais correspondentes conforme anexo e à legislação sanitária aplicável para os dispositivos médicos. Seção IV Amostragem Art. 21 Os Planos de Amostragem, os Níveis de Inspeção e os Níveis de Qualidade Aceitáveis aplicáveis às seringas hipodérmicas estéreis de uso único devem ser aqueles especificados em regulamento de avaliação da conformidade.parágrafo único. No caso de o(s) lote(s) estar(em) sob suspeita ou haver denúncias de irregularidades, a ANVISA poderá exigir níveis mais rigorosos de inspeção. Seção V Acondicionamento e Armazenamento Art. 22 As seringas hipodérmicas estéreis de uso único para uso manual ou em bomba de seringa devem ser acondicionadas em embalagens que permitam proteger o produto e manter sua integridade desde a fabricação até o seu uso. Art. 23 As seringas hipodérmicas estéreis de uso único para uso manual ou em bomba de seringa devem ser armazenadas e transportadas em condições que preservem sua integridade e as protejam da exposição ao calor, à umidade e à luz.
5 página 5/6 CAPÍTULO III DAS DISPOSIÇÕES FINAIS E TRANSITÓRIAS Art. 24. Os produtos fabricados antes da vigência deste regulamento podem ser comercializados e utilizados até a sua data de validade. Art. 24. O descumprimento das disposições contidas nesta Resolução constitui infração sanitária, nos termos da Lei º 6.437, de 20 de agosto de 1977, sem prejuízo das responsabilidades civil, administrativa e penal cabíveis. Art. 26. Esta Resolução entrará em vigor 360 (trezentos e sessenta) dias após a sua publicação. DIRCEU BRÁS APARECIDO BARBANO ANEXO 1. REFERÊNCIAS 1.1 BRASIL. Lei No , de 11 de setembro de Código de Defesa do Consumidor. Diário Oficial da União, Brasília, DF, 12 set Suplemento. 1.2 BRASIL, Portaria Interministerial MS/MIDC No 692 de 8 de abril de Define a operacionalização das ações de cooperação técnica para a Garantia da Qualidade e Segurança de Dispositivos Médicos submetidos ao regime de controle sanitário, conforme o estabelecido no Termo de Cooperação Técnica entre o Ministério da Saúde (MS) e o Ministério do Desenvolvimento, Indústria e Comércio Exterior (MDIC). 1.3 BRASIL, Resolução ANVISA RDC No-. 56 de 06 de abril de Regulamento Técnico que estabelece os requisitos essenciais de segurança e eficácia aplicáveis aos produtos para saúde, referidos no anexo desta Resolução. Diário Oficial da União, Brasília, DF, Poder Executivo, de 10 de abril de BRASIL, Resolução ANVISA RDC No de 22 de outubro de Regulamento Técnico que trata do Registro, Alteração, Revalidação e Cancelamento do Registro de Produtos Médicos na Agência Nacional de Vigilância Sanitária - ANVISA. Diário Oficial da União, Brasília, DF, Poder Executivo, de 06 de novembro de BRASIL, Resolução ANVISA RDC n 156, de 11 de agosto de Dispõe sobre o registro, rotulagem e re-processamento de produtos médicos, e dá outras providências. 1.6 BRASIL, Resolução ANVISA RDC No de 17 de novembro de Altera a Resolução ANVISA RDC 185, que trata do Registro, Alteração, Revalidação e Cancelamento do Registro de Produtos Médicos na Agência Nacional de Vigilância Sanitária - ANVISA. Diário Oficial da União, Brasília, DF, Poder Executivo, de 06 de novembro de BRASIL, Resolução ANVISA RDC n. 59 de 27 de junho de Regulamento Técnico que determina a todos fornecedores de produtos médicos, o cumprimento dos requisitos estabelecidos pelas "Boas Práticas de Fabricação de Produtos Médicos". Diário Oficial da União, Brasília, DF Poder Executivo, de 29 de junho de BRASIL, Associação Brasileira de Normas Técnicas - ABNT, NBR n. 5426:1985, que aprova Planos de Amostragem e Procedimentos na Inspeção por Atributos, BRASIL, Associação Brasileira de Normas Técnicas - ABNT, NBR ISO n :2003, que aprova a Norma Brasileira para Seringa hipodérmica estéril para uso único - Parte 1: Seringa para uso manual BRASIL, Associação Brasileira de Normas Técnicas - ABNT, NBR ISO n :2003, que aprova a Norma Brasileira para Seringa hipodérmica estéril para uso único - Parte 2: Seringa para uso em bomba de seringa BRASIL, Associação Brasileira de Normas Técnicas - ABNT, NBR ISO n. ISO 594-1:2003- Montagem cônica com conicidade de 6% (Luer) para seringas, agulhas e outros equipamentos médicos - Parte 1 - Requisitos gerais.
6 página 6/ BRASIL, Associação Brasileira de Normas Técnicas - ABNT, NBR ISO n. ISO 594-2: Montagem cônica com conicidade de 6% (Luer) para seringas, agulhas e outros equipamentos médicos - Parte 2 - Montagem fixa BRASIL, Associação Brasileira de Normas Técnicas - ABNT, NBR ISO No- 8537: Seringas estéreis de uso único, com ou sem agulhas, para insulina INTERNATIONAL ORGANIZATION FOR STARDARDIZATION - ISO, ISO 8537:2007- Sterile single-use syringes, with or without needle, for insulin.
Esta Resolução entrará em vigor 360 (trezentos e sessenta) dias após a sua publicação.
 página 1/11 Esta Resolução entrará em vigor 360 (trezentos e sessenta) dias após a sua publicação. RESOLUÇÃO - RDC Nº 3, DE 4 DE FEVEREIRO DE 2011 Estabelece os requisitos mínimos de identidade e qualidade
página 1/11 Esta Resolução entrará em vigor 360 (trezentos e sessenta) dias após a sua publicação. RESOLUÇÃO - RDC Nº 3, DE 4 DE FEVEREIRO DE 2011 Estabelece os requisitos mínimos de identidade e qualidade
Esta Resolução entrará em vigor 360 (trezentos e sessenta) dias após a sua publicação.
 página 1/6 Esta Resolução entrará em vigor 360 (trezentos e sessenta) dias após a sua publicação. RESOLUÇÃO - RDC N 5, DE 4 DE FEVEREIRO DE 2011 Estabelece os requisitos mínimos de identidade e qualidade
página 1/6 Esta Resolução entrará em vigor 360 (trezentos e sessenta) dias após a sua publicação. RESOLUÇÃO - RDC N 5, DE 4 DE FEVEREIRO DE 2011 Estabelece os requisitos mínimos de identidade e qualidade
RESOLUÇÃO - RDC N 25, DE 5 DE MAIO DE 2014
 RESOLUÇÃO - RDC N 25, DE 5 DE MAIO DE 2014 Dispõe sobre os requisitos mínimos de identidade e qualidade para as agulhas hipodérmicas e agulhas gengivais. A Diretoria Colegiada da Agência Nacional de Vigilância
RESOLUÇÃO - RDC N 25, DE 5 DE MAIO DE 2014 Dispõe sobre os requisitos mínimos de identidade e qualidade para as agulhas hipodérmicas e agulhas gengivais. A Diretoria Colegiada da Agência Nacional de Vigilância
RESOLUÇÃO- RDC Nº 4, de 4 de fevereiro de 2011 DOU 07/02/ Esta Resolução entra em vigor 360 (trezentos e sessenta) dias após a sua publicação.
 página 1/5 RESOLUÇÃO- RDC Nº 4, de 4 de fevereiro de 2011 DOU 07/02/2011 - Esta Resolução entra em vigor 360 (trezentos e sessenta) dias após a sua publicação. Estabelece os requisitos mínimos de identidade
página 1/5 RESOLUÇÃO- RDC Nº 4, de 4 de fevereiro de 2011 DOU 07/02/2011 - Esta Resolução entra em vigor 360 (trezentos e sessenta) dias após a sua publicação. Estabelece os requisitos mínimos de identidade
adota a seguinte Consulta Pública e eu, Diretor-Presidente, determino a sua publicação:
 Agência Nacional de Vigilância Sanitária www.anvisa.gov.br Consulta Pública nº 6, de 18 de janeiro de 2012 D.O.U de 19/01/2012 A Diretoria Colegiada da Agência Nacional de Vigilância Sanitária, no uso
Agência Nacional de Vigilância Sanitária www.anvisa.gov.br Consulta Pública nº 6, de 18 de janeiro de 2012 D.O.U de 19/01/2012 A Diretoria Colegiada da Agência Nacional de Vigilância Sanitária, no uso
adota a seguinte Consulta Pública e eu, Diretor-Presidente, determino a sua publicação:
 Agência Nacional de Vigilância Sanitária www.anvisa.gov.br Consulta Pública nº 73, de 10 de agosto de 2007. D.O.U de 13/08/2007. A Diretoria Colegiada da Agência Nacional de Vigilância Sanitária, no uso
Agência Nacional de Vigilância Sanitária www.anvisa.gov.br Consulta Pública nº 73, de 10 de agosto de 2007. D.O.U de 13/08/2007. A Diretoria Colegiada da Agência Nacional de Vigilância Sanitária, no uso
Ministério da Saúde Agência Nacional de Vigilância Sanitária RESOLUÇÃO DA DIRETORIA COLEGIADA RDC N 55, DE 4 DE NOVEMBRO DE 2011
 ADVERTÊNCIA Este texto não substitui o publicado no Diário Oficial da União Ministério da Saúde Agência Nacional de Vigilância Sanitária RESOLUÇÃO DA DIRETORIA COLEGIADA RDC N 55, DE 4 DE NOVEMBRO DE 2011
ADVERTÊNCIA Este texto não substitui o publicado no Diário Oficial da União Ministério da Saúde Agência Nacional de Vigilância Sanitária RESOLUÇÃO DA DIRETORIA COLEGIADA RDC N 55, DE 4 DE NOVEMBRO DE 2011
Esta Resolução entra em vigor 180 (cento e oitenta) dias após a data de sua publicação.
 página 1/5 Esta Resolução entra em vigor 180 (cento e oitenta) dias após a data de sua publicação. RESOLUÇÃO - RDC Nº 14, DE 5 DE ABRIL DE 2011 Institui o Regulamento Técnico com os requisitos para agrupamento
página 1/5 Esta Resolução entra em vigor 180 (cento e oitenta) dias após a data de sua publicação. RESOLUÇÃO - RDC Nº 14, DE 5 DE ABRIL DE 2011 Institui o Regulamento Técnico com os requisitos para agrupamento
Diário Oficial Imprensa Nacional
 RESOLUÇÃO-RDC No- 69, DE 21DEZEMBRO DE 2009 Institui instruções sobre registro, fabricação, controle de qualidade, comercialização e uso de Dispositivo Intra-Uterino (DIU) contendo cobre. A Diretoria Colegiada
RESOLUÇÃO-RDC No- 69, DE 21DEZEMBRO DE 2009 Institui instruções sobre registro, fabricação, controle de qualidade, comercialização e uso de Dispositivo Intra-Uterino (DIU) contendo cobre. A Diretoria Colegiada
Dispõe sobre a documentação para regularização de equipamentos médicos das Classes de Risco I e II.
 INSTRUÇÃO NORMATIVA - IN Nº 13, DE 22 DE OUTUBRO DE 2009 Dispõe sobre a documentação para regularização de equipamentos médicos das Classes de Risco I e II. A Diretoria Colegiada da Agência Nacional de
INSTRUÇÃO NORMATIVA - IN Nº 13, DE 22 DE OUTUBRO DE 2009 Dispõe sobre a documentação para regularização de equipamentos médicos das Classes de Risco I e II. A Diretoria Colegiada da Agência Nacional de
Portaria n.º 503, de 29 de dezembro de 2011.
 Serviço Público Federal MINISTÉRIO DO DESENVOLVIMENTO, INDÚSTRIA E COMÉRCIO EXTERIOR INSTITUTO NACIONAL DE METROLOGIA, QUALIDADE E TECNOLOGIA INMETRO Portaria n.º 503, de 29 de dezembro de 2011. O PRESIDENTE
Serviço Público Federal MINISTÉRIO DO DESENVOLVIMENTO, INDÚSTRIA E COMÉRCIO EXTERIOR INSTITUTO NACIONAL DE METROLOGIA, QUALIDADE E TECNOLOGIA INMETRO Portaria n.º 503, de 29 de dezembro de 2011. O PRESIDENTE
RDC Nº 32, DE 29 DE MAIO DE 2007
 página 1/6 RDC Nº 32, DE 29 DE MAIO DE 2007 D.O.U. - Diário Oficial da União; Poder Executivo, de 01 de junho de 2007 Versão Republicada 01.06.2007 RESOLUÇÃO DA DIRETORIA COLEGIADA - RDC Nº 32, DE 29 DE
página 1/6 RDC Nº 32, DE 29 DE MAIO DE 2007 D.O.U. - Diário Oficial da União; Poder Executivo, de 01 de junho de 2007 Versão Republicada 01.06.2007 RESOLUÇÃO DA DIRETORIA COLEGIADA - RDC Nº 32, DE 29 DE
I - alimentos à base de cereais para alimentação infantil; II - alimentos de transição para lactentes e crianças de primeira infância;
 RESOLUÇÃO ANVISA-RDC Nº 193, de 12/12/2017 Estabelece os Limites Máximos Tolerados (LMT) dos contaminantes arsênio inorgânico, cádmio total, chumbo total e estanho inorgânico em alimentos infantis, e dá
RESOLUÇÃO ANVISA-RDC Nº 193, de 12/12/2017 Estabelece os Limites Máximos Tolerados (LMT) dos contaminantes arsênio inorgânico, cádmio total, chumbo total e estanho inorgânico em alimentos infantis, e dá
DIRETORIA COLEGIADA RESOLUÇÃO-RDC No- 54, DE 10 DE DEZEMBRO DE 2013 DOU de 11/12/2013 Seção I págs. 76 e 77
 DIRETORIA COLEGIADA RESOLUÇÃO-RDC No- 54, DE 10 DE DEZEMBRO DE 2013 DOU de 11/12/2013 Seção I págs. 76 e 77 Dispõe sobre a implantação do sistema nacional de controle de medicamentos e os mecanismos e
DIRETORIA COLEGIADA RESOLUÇÃO-RDC No- 54, DE 10 DE DEZEMBRO DE 2013 DOU de 11/12/2013 Seção I págs. 76 e 77 Dispõe sobre a implantação do sistema nacional de controle de medicamentos e os mecanismos e
Dispõe sobre as diretrizes para elaboração, validação e implantação de protocolos de reprocessamento de produtos médicos e dá outras providências.
 Resolução - REnº 2.606, de 11 de agosto de 2006 D.O.U. de 14/8/2006 Dispõe sobre as diretrizes para elaboração, validação e implantação de protocolos de reprocessamento de produtos médicos e dá outras
Resolução - REnº 2.606, de 11 de agosto de 2006 D.O.U. de 14/8/2006 Dispõe sobre as diretrizes para elaboração, validação e implantação de protocolos de reprocessamento de produtos médicos e dá outras
AGÊNCIA NACIONAL DE VIGILÂNCIA SANITÁRIA DIRETORIA COLEGIADA. RESOLUÇÃO-RDC No- 2, DE 2 DE FEVEREIRO DE 2011
 AGÊNCIA NACIONAL DE VIGILÂNCIA SANITÁRIA DIRETORIA COLEGIADA RESOLUÇÃO-RDC No- 2, DE 2 DE FEVEREIRO DE 2011 Dispõe sobre os procedimentos no âmbito da ANVISA para acompanhamento, instrução e análise dos
AGÊNCIA NACIONAL DE VIGILÂNCIA SANITÁRIA DIRETORIA COLEGIADA RESOLUÇÃO-RDC No- 2, DE 2 DE FEVEREIRO DE 2011 Dispõe sobre os procedimentos no âmbito da ANVISA para acompanhamento, instrução e análise dos
órgão emissor: ANVISA - Agência Nacional de Vigilância Sanitária alcance do ato: federal - Brasil relacionamento(s):
 título: Resolução RDC nº 81, de 14 de abril de 2003 ementa: Dispõe sobre a obrigatoriedade de identificação do fabricante do produto palmito em conserva, litografada na parte lateral da tampa metálica
título: Resolução RDC nº 81, de 14 de abril de 2003 ementa: Dispõe sobre a obrigatoriedade de identificação do fabricante do produto palmito em conserva, litografada na parte lateral da tampa metálica
revoga: Portaria nº 379, de 26 de abril de 1999 RESOLUÇÃO DE DIRETORIA COLEGIADA - RDC Nº. 266, DE 22 DE SETEMBRO DE 2005.
 título: Resolução RDC nº 266, de 22 de setembro de 2005 ementa não oficial: Aprova o "REGULAMENTO TÉCNICO PARA GELADOS COMESTÍVEIS E PREPARADOS PARA GELADOS COMESTÍVEIS". publicação: D.O.U. - Diário Oficial
título: Resolução RDC nº 266, de 22 de setembro de 2005 ementa não oficial: Aprova o "REGULAMENTO TÉCNICO PARA GELADOS COMESTÍVEIS E PREPARADOS PARA GELADOS COMESTÍVEIS". publicação: D.O.U. - Diário Oficial
RESOLUÇÃO - RDC N 22, DE 23 DE ABRIL DE
 página 1/9 RESOLUÇÃO - RDC N 22, DE 23 DE ABRIL DE 2013. Aprova os Procedimentos Comuns para as Inspeções nos Fabricantes de Produtos Médicos e Produtos para Diagnóstico de Uso in vitro nos Estados Partes,
página 1/9 RESOLUÇÃO - RDC N 22, DE 23 DE ABRIL DE 2013. Aprova os Procedimentos Comuns para as Inspeções nos Fabricantes de Produtos Médicos e Produtos para Diagnóstico de Uso in vitro nos Estados Partes,
Nº DOU de 25/06/18 - Seção 1 - p.34 MINISTÉRIO DA SAÚDE AGÊNCIA NACIONAL DE VIGILÂNCIA SANITÁRIA DIRETORIA COLEGIADA
 Diário Oficial Imprensa Nacional Nº 120 - DOU de 25/06/18 - Seção 1 - p.34 REPÚBLICA FEDERATIVA DO BRASIL BRASÍLIA - DF MINISTÉRIO DA SAÚDE AGÊNCIA NACIONAL DE VIGILÂNCIA SANITÁRIA DIRETORIA COLEGIADA
Diário Oficial Imprensa Nacional Nº 120 - DOU de 25/06/18 - Seção 1 - p.34 REPÚBLICA FEDERATIVA DO BRASIL BRASÍLIA - DF MINISTÉRIO DA SAÚDE AGÊNCIA NACIONAL DE VIGILÂNCIA SANITÁRIA DIRETORIA COLEGIADA
Diário Oficial Imprensa Nacional.Nº 62 DOU 29/03/12 seção 1 - p.104
 Diário Oficial Imprensa Nacional.Nº 62 DOU 29/03/12 seção 1 - p.104 REPÚBLICA FEDERATIVA DO BRASIL BRASÍLIA - DF MINISTÉRIO DA SAÚDE AGÊNCIA NACIONAL DE VIGILÂNCIA SANITÁRIA RESOLUÇÃO - RDC Nº 21, DE 28
Diário Oficial Imprensa Nacional.Nº 62 DOU 29/03/12 seção 1 - p.104 REPÚBLICA FEDERATIVA DO BRASIL BRASÍLIA - DF MINISTÉRIO DA SAÚDE AGÊNCIA NACIONAL DE VIGILÂNCIA SANITÁRIA RESOLUÇÃO - RDC Nº 21, DE 28
Portaria n.º 287, de 08 de julho de CONSULTA PÚBLICA
 Serviço Público Federal MINISTÉRIO DO DESENVOLVIMENTO, INDÚSTRIA E COMÉRCIO EXTERIOR INSTITUTO NACIONAL DE METROLOGIA, NORMALIZAÇÃO E QUALIDADE INDUSTRIAL-INMETRO Portaria n.º 287, de 08 de julho de 2011.
Serviço Público Federal MINISTÉRIO DO DESENVOLVIMENTO, INDÚSTRIA E COMÉRCIO EXTERIOR INSTITUTO NACIONAL DE METROLOGIA, NORMALIZAÇÃO E QUALIDADE INDUSTRIAL-INMETRO Portaria n.º 287, de 08 de julho de 2011.
MINISTÉRIO DA SAÚDE AGÊNCIA NACIONAL DE VIGILÂNCIA SANITÁRIA DIRETORIA COLEGIADA
 MINISTÉRIO DA SAÚDE AGÊNCIA NACIONAL DE VIGILÂNCIA SANITÁRIA DIRETORIA COLEGIADA RESOLUÇÃO DA DIRETORIA COLEGIADA - RDC Nº 270, DE 28 DE FEVEREIRO DE 2019 DOU de 01/03/2019 [Página 68] Dispõe sobre a migração
MINISTÉRIO DA SAÚDE AGÊNCIA NACIONAL DE VIGILÂNCIA SANITÁRIA DIRETORIA COLEGIADA RESOLUÇÃO DA DIRETORIA COLEGIADA - RDC Nº 270, DE 28 DE FEVEREIRO DE 2019 DOU de 01/03/2019 [Página 68] Dispõe sobre a migração
RESOLUÇÃO-RDC Nº 42, DE 25 DE OUTUBRO DE 2010
 RESOLUÇÃO-RDC Nº 42, DE 25 DE OUTUBRO DE 2010 Dispõe sobre a obrigatoriedade de disponibilização de preparação alcoólica para fricção antisséptica das mãos, pelos serviços de saúde do País, e dá outras
RESOLUÇÃO-RDC Nº 42, DE 25 DE OUTUBRO DE 2010 Dispõe sobre a obrigatoriedade de disponibilização de preparação alcoólica para fricção antisséptica das mãos, pelos serviços de saúde do País, e dá outras
Diário Oficial da União Seção 01 DOU 18 de janeiro de 2012 [Página 39-41]
![Diário Oficial da União Seção 01 DOU 18 de janeiro de 2012 [Página 39-41] Diário Oficial da União Seção 01 DOU 18 de janeiro de 2012 [Página 39-41]](/thumbs/98/137777214.jpg) *Este texto não substitui o publicado do Diário Oficial da União* Diário Oficial da União Seção 01 DOU 18 de janeiro de 2012 [Página 39-41] Resolução-RDC nº 2 de 17 de janeiro de 2012 Institui o protocolo
*Este texto não substitui o publicado do Diário Oficial da União* Diário Oficial da União Seção 01 DOU 18 de janeiro de 2012 [Página 39-41] Resolução-RDC nº 2 de 17 de janeiro de 2012 Institui o protocolo
Diário Oficial da União Seção 01 DOU 05 de janeiro de 2009 Página 21
 Diário Oficial da União Seção 01 DOU 05 de janeiro de 2009 Página 21 RESOLUÇÃO - RDC Nº 99, DE 30 DE DEZEMBRO DE 2008 Dispõe sobre controle de importações e exportações de substâncias e medicamentos sob
Diário Oficial da União Seção 01 DOU 05 de janeiro de 2009 Página 21 RESOLUÇÃO - RDC Nº 99, DE 30 DE DEZEMBRO DE 2008 Dispõe sobre controle de importações e exportações de substâncias e medicamentos sob
Ministério da Saúde AGÊNCIA NACIONAL DE VIGILÂNCIA SANITÁRIA
 Ministério da Saúde AGÊNCIA NACIONAL DE VIGILÂNCIA SANITÁRIA RESOLUÇÃO DA DIRETORIA COLEGIADA - RDC Nº 99 DE 30 DE DEZEMBRO DE 2008(*) Dispõe sobre controle de importações e exportações de substâncias
Ministério da Saúde AGÊNCIA NACIONAL DE VIGILÂNCIA SANITÁRIA RESOLUÇÃO DA DIRETORIA COLEGIADA - RDC Nº 99 DE 30 DE DEZEMBRO DE 2008(*) Dispõe sobre controle de importações e exportações de substâncias
RESOLUÇÃO Nº 7, DE 18 DE FEVEREIRO DE 2011(*) Dispõe sobre limites máximos tolerados (LMT) para micotoxinas em alimentos.
 RESOLUÇÃO Nº 7, DE 18 DE FEVEREIRO DE 2011(*) Dispõe sobre limites máximos tolerados (LMT) para micotoxinas em alimentos. A Diretoria Colegiada da Agência Nacional de Vigilância Sanitária, no uso da atribuição
RESOLUÇÃO Nº 7, DE 18 DE FEVEREIRO DE 2011(*) Dispõe sobre limites máximos tolerados (LMT) para micotoxinas em alimentos. A Diretoria Colegiada da Agência Nacional de Vigilância Sanitária, no uso da atribuição
Art. 2º Este Regulamento incorpora ao ordenamento jurídico nacional a Resolução GMC MERCOSUL n. 15/10.
 DOU Nº 229, quarta-feira, 1 de dezembro de 2010 (página 63) Republicada DOU Nº 244, quarta-feira, 22 de dezembro de 2010 (página 79) RESOLUÇÃO-RDC No- 52, DE 26 DE NOVEMBRO DE 2010 Dispõe sobre corantes
DOU Nº 229, quarta-feira, 1 de dezembro de 2010 (página 63) Republicada DOU Nº 244, quarta-feira, 22 de dezembro de 2010 (página 79) RESOLUÇÃO-RDC No- 52, DE 26 DE NOVEMBRO DE 2010 Dispõe sobre corantes
Ministério da Saúde - MS Agência Nacional de Vigilância Sanitária - ANVISA. (Publicada em DOU nº 37, de 22 de fevereiro de 2011)
 RESOLUÇÃO DE DIRETORIA COLEGIADA RDC Nº 07, DE 18 DE FEVEREIRO DE 11 (*) (Publicada em DOU nº 37, de 22 de fevereiro de 11) (Republicada em DOU nº 46, de 09 de março de 11) Dispõe sobre limites máximos
RESOLUÇÃO DE DIRETORIA COLEGIADA RDC Nº 07, DE 18 DE FEVEREIRO DE 11 (*) (Publicada em DOU nº 37, de 22 de fevereiro de 11) (Republicada em DOU nº 46, de 09 de março de 11) Dispõe sobre limites máximos
RESOLUÇÃO Nº 7, DE 18 DE FEVEREIRO DE 2011(*) Dispõe sobre limites máximos tolerados (LMT) para micotoxinas em alimentos.
 RESOLUÇÃO Nº 7, DE 18 DE FEVEREIRO DE 11(*) Dispõe sobre limites máximos tolerados (LMT) para micotoxinas em alimentos. A Diretoria Colegiada da Agência Nacional de Vigilância Sanitária, no uso da atribuição
RESOLUÇÃO Nº 7, DE 18 DE FEVEREIRO DE 11(*) Dispõe sobre limites máximos tolerados (LMT) para micotoxinas em alimentos. A Diretoria Colegiada da Agência Nacional de Vigilância Sanitária, no uso da atribuição
Área de Atividade/Produto Classe de Ensaio/Descrição do Ensaio Norma e/ou Procedimento
 Folha: 1 de 15 PRODUTOS RELACIONADOS À SAÚDE E SEGURANÇA HUMANA chama ar- acetileno: Sn, Fe, Pb, Zn, Cd. Pb = 0,04 µg/ml Determinação de PH pelo método eletrométrico (determinação dos limites de acidez
Folha: 1 de 15 PRODUTOS RELACIONADOS À SAÚDE E SEGURANÇA HUMANA chama ar- acetileno: Sn, Fe, Pb, Zn, Cd. Pb = 0,04 µg/ml Determinação de PH pelo método eletrométrico (determinação dos limites de acidez
Ministério da Saúde Agência Nacional de Vigilância Sanitária RESOLUÇÃO DA DIRETORIA COLEGIADA - RDC Nº 56, DE 8 DE OUTUBRO DE 2014.
 ADVERTÊNCIA Este texto não substitui o publicado no Diário Oficial da União Ministério da Saúde Agência Nacional de Vigilância Sanitária RESOLUÇÃO DA DIRETORIA COLEGIADA - RDC Nº 56, DE 8 DE OUTUBRO DE
ADVERTÊNCIA Este texto não substitui o publicado no Diário Oficial da União Ministério da Saúde Agência Nacional de Vigilância Sanitária RESOLUÇÃO DA DIRETORIA COLEGIADA - RDC Nº 56, DE 8 DE OUTUBRO DE
ANEXO PROPOSTA DE RESOLUÇÃO EM CONSULTA PÚBLICA
 Agência Nacional de Vigilância Sanitária www.anvisa.gov.br Consulta Pública nº 21, de 13 de março de 2012 D.O.U de 19/03/2012 A Diretoria Colegiada da Agência Nacional de Vigilância Sanitária, no uso da
Agência Nacional de Vigilância Sanitária www.anvisa.gov.br Consulta Pública nº 21, de 13 de março de 2012 D.O.U de 19/03/2012 A Diretoria Colegiada da Agência Nacional de Vigilância Sanitária, no uso da
Ministério da Saúde - MS Agência Nacional de Vigilância Sanitária - ANVISA. (Publicada no DOU nº 37, de 22 de fevereiro de 2011)
 RESOLUÇÃO DA DIRETORIA COLEGIADA RDC Nº 7, DE 18 DE FEVEREIRO DE 2011 (*) (Publicada no DOU nº 37, de 22 de fevereiro de 2011) (Republicada no DOU nº 46, de 9 de março de 2011) Dispõe sobre limites máximos
RESOLUÇÃO DA DIRETORIA COLEGIADA RDC Nº 7, DE 18 DE FEVEREIRO DE 2011 (*) (Publicada no DOU nº 37, de 22 de fevereiro de 2011) (Republicada no DOU nº 46, de 9 de março de 2011) Dispõe sobre limites máximos
MINISTÉRIO DA SAÚDE AGÊNCIA NACIONAL DE VIGILÂNCIA SANITÁRIA DIRETORIA COLEGIADA
 [Este texto não substitui o publicado no DOU] MINISTÉRIO DA SAÚDE AGÊNCIA NACIONAL DE VIGILÂNCIA SANITÁRIA DIRETORIA COLEGIADA CONSULTA PÚBLICA Nº 528, DE 17 DE MAIO DE 2018 DOU de 22/05/2018 [Página 119]
[Este texto não substitui o publicado no DOU] MINISTÉRIO DA SAÚDE AGÊNCIA NACIONAL DE VIGILÂNCIA SANITÁRIA DIRETORIA COLEGIADA CONSULTA PÚBLICA Nº 528, DE 17 DE MAIO DE 2018 DOU de 22/05/2018 [Página 119]
RESOLUÇÃO-RDC No- 59, DE 24 DE NOVEMBRO DE 2009
 RESOLUÇÃO-RDC No- 59, DE 24 DE NOVEMBRO DE 2009 Dispõe sobre a implantação do Sistema Nacional de Controle de Medicamentos e definição dos mecanismos para rastreamento de medicamentos, por meio de tecnologia
RESOLUÇÃO-RDC No- 59, DE 24 DE NOVEMBRO DE 2009 Dispõe sobre a implantação do Sistema Nacional de Controle de Medicamentos e definição dos mecanismos para rastreamento de medicamentos, por meio de tecnologia
RESOLUÇÃO - RDC Nº 359, DE 23 DE DEZEMBRO DE 2003
 RESOLUÇÃO - RDC Nº 359, DE 23 DE DEZEMBRO DE 2003 A Diretoria Colegiada da Agência Nacional de Vigilância Sanitária, no uso da atribuição que lhe confere o art. 11 inciso IV do Regulamento da ANVISA aprovado
RESOLUÇÃO - RDC Nº 359, DE 23 DE DEZEMBRO DE 2003 A Diretoria Colegiada da Agência Nacional de Vigilância Sanitária, no uso da atribuição que lhe confere o art. 11 inciso IV do Regulamento da ANVISA aprovado
Ministério do Desenvolvimento, Indústria e Comércio Exterior - MDIC Instituto Nacional de Metrologia, Normalização e Qualidade Industrial Inmetro
 Ministério do Desenvolvimento, Indústria e Comércio Exterior - MDIC Instituto Nacional de Metrologia, Normalização e Qualidade Industrial Inmetro Portaria nº 50, de 28 de março de 2002 O PRESIDENTE DO
Ministério do Desenvolvimento, Indústria e Comércio Exterior - MDIC Instituto Nacional de Metrologia, Normalização e Qualidade Industrial Inmetro Portaria nº 50, de 28 de março de 2002 O PRESIDENTE DO
Ministério da Saúde Agência Nacional de Vigilância Sanitária RESOLUÇÃO DA DIRETORIA COLEGIADA - RDC Nº 58, DE 20 DE DEZEMBRO DE 2013.
 ADVERTÊNCIA Este texto não substitui o publicado no Diário Oficial da União Ministério da Saúde Agência Nacional de Vigilância Sanitária RESOLUÇÃO DA DIRETORIA COLEGIADA - RDC Nº 58, DE 20 DE DEZEMBRO
ADVERTÊNCIA Este texto não substitui o publicado no Diário Oficial da União Ministério da Saúde Agência Nacional de Vigilância Sanitária RESOLUÇÃO DA DIRETORIA COLEGIADA - RDC Nº 58, DE 20 DE DEZEMBRO
MINISTÉRIO DO DESENVOLVIMENTO, INDÚSTRIA E COMÉRCIO EXTERIOR INSTITUTO NACIONAL DE METROLOGIA, QUALIDADE E TECNOLOGIA INMETRO
 Serviço Público Federal MINISTÉRIO DO DESENVOLVIMENTO, INDÚSTRIA E COMÉRCIO EXTERIOR INSTITUTO NACIONAL DE METROLOGIA, QUALIDADE E TECNOLOGIA INMETRO Portaria n.º 502, de 29 de dezembro de 2011. O PRESIDENTE
Serviço Público Federal MINISTÉRIO DO DESENVOLVIMENTO, INDÚSTRIA E COMÉRCIO EXTERIOR INSTITUTO NACIONAL DE METROLOGIA, QUALIDADE E TECNOLOGIA INMETRO Portaria n.º 502, de 29 de dezembro de 2011. O PRESIDENTE
PROJETO DE DECRETO LEGISLATIVO N.º 715, DE 2012 (Do Sr. Eleuses Paiva)
 CÂMARA DOS DEPUTADOS PROJETO DE DECRETO LEGISLATIVO N.º 715, DE 2012 (Do Sr. Eleuses Paiva) Susta a aplicação da RDC nº 41/2012 da ANVISA. DESPACHO: ÀS COMISSÕES DE: SEGURIDADE SOCIAL E FAMÍLIA E CONSTITUIÇÃO
CÂMARA DOS DEPUTADOS PROJETO DE DECRETO LEGISLATIVO N.º 715, DE 2012 (Do Sr. Eleuses Paiva) Susta a aplicação da RDC nº 41/2012 da ANVISA. DESPACHO: ÀS COMISSÕES DE: SEGURIDADE SOCIAL E FAMÍLIA E CONSTITUIÇÃO
RESOLUÇÃO ANVISA Nº 07, DE
 RESOLUÇÃO ANVISA Nº 07, DE 10-02-2015 DOU 11-02-2015 Dispõe sobre os requisitos técnicos para a regularização de produtos de higiene pessoal, cosméticos e perfumes e dá outras providências. A Diretoria
RESOLUÇÃO ANVISA Nº 07, DE 10-02-2015 DOU 11-02-2015 Dispõe sobre os requisitos técnicos para a regularização de produtos de higiene pessoal, cosméticos e perfumes e dá outras providências. A Diretoria
WORKSHOP PARA USUÁRIOS Convênio FNS/USP 2209/2008
 WORKSHOP PARA USUÁRIOS Convênio FNS/USP 2209/2008 Normas Técnicas, Gerenciamento de Risco, Metrologia e Utilização de Produtos para a Saúde: Porque participar e se envolver? Profº Dr. José Carlos Teixeira
WORKSHOP PARA USUÁRIOS Convênio FNS/USP 2209/2008 Normas Técnicas, Gerenciamento de Risco, Metrologia e Utilização de Produtos para a Saúde: Porque participar e se envolver? Profº Dr. José Carlos Teixeira
Dispõe sobre os critérios de indicação, inclusão e exclusão de medicamentos na Lista de Medicamentos de Referência.
 RESOLUÇÃO - RDC Nº 35, DE 15/06/2012 DOU 19/06/2012 Dispõe sobre os critérios de indicação, inclusão e exclusão de medicamentos na Lista de Medicamentos de Referência. A Diretoria Colegiada da Agência
RESOLUÇÃO - RDC Nº 35, DE 15/06/2012 DOU 19/06/2012 Dispõe sobre os critérios de indicação, inclusão e exclusão de medicamentos na Lista de Medicamentos de Referência. A Diretoria Colegiada da Agência
DIRCEU BRÁS APARECIDO BARBANO
 Agência Nacional de Vigilância Sanitária www.anvisa.gov.br Consulta Pública n 22, de 25 de junho de 2013 D.O.U de 26/06/2013 A Diretoria Colegiada da Agência Nacional de Vigilância Sanitária, no uso das
Agência Nacional de Vigilância Sanitária www.anvisa.gov.br Consulta Pública n 22, de 25 de junho de 2013 D.O.U de 26/06/2013 A Diretoria Colegiada da Agência Nacional de Vigilância Sanitária, no uso das
RESOLUÇÃO RDC ANVISA Nº 308, DE 14 DE NOVEMBRO DE 2002 (*) (D.O.U. de 05/12/02)
 RESOLUÇÃO RDC ANVISA Nº 308, DE 14 DE NOVEMBRO DE 2002 (*) (D.O.U. de 05/12/02) Dispõe sobre as prescrições a serem atendidas pelos fornecedores de câmaras de bronzeamento e estabelecimentos que executam
RESOLUÇÃO RDC ANVISA Nº 308, DE 14 DE NOVEMBRO DE 2002 (*) (D.O.U. de 05/12/02) Dispõe sobre as prescrições a serem atendidas pelos fornecedores de câmaras de bronzeamento e estabelecimentos que executam
Resolução nº 55 de 17/03/2005 / ANVISA - Agência Nacional de Vigilância Sanitária (D.O.U. 21/03/2005)
 Resolução nº 55 de 17/03/2005 / ANVISA - Agência Nacional de Vigilância Sanitária (D.O.U. 21/03/2005) Fica estabelecidos, por meio do presente regulamento, os requisitos mínimos relativos à obrigatoriedade,
Resolução nº 55 de 17/03/2005 / ANVISA - Agência Nacional de Vigilância Sanitária (D.O.U. 21/03/2005) Fica estabelecidos, por meio do presente regulamento, os requisitos mínimos relativos à obrigatoriedade,
Ministério da Saúde - MS Agência Nacional de Vigilância Sanitária - ANVISA. (Publicada em DOU nº 181, de 18 de setembro de 2003)
 RESOLUÇÃO DE DIRETORIA COLEGIADA RDC Nº 252, DE 16 DE SETEMBRO DE 2003 (Publicada em DOU nº 181, de 18 de setembro de 2003) A Diretoria Colegiada da Agência Nacional de Vigilância Sanitária, no uso da
RESOLUÇÃO DE DIRETORIA COLEGIADA RDC Nº 252, DE 16 DE SETEMBRO DE 2003 (Publicada em DOU nº 181, de 18 de setembro de 2003) A Diretoria Colegiada da Agência Nacional de Vigilância Sanitária, no uso da
[Este texto não substitui o publicado no DOU] MINISTÉRIO DA SAÚDE AGÊNCIA NACIONAL DE VIGILÂNCIA SANITÁRIA DIRETORIA COLEGIADA
![[Este texto não substitui o publicado no DOU] MINISTÉRIO DA SAÚDE AGÊNCIA NACIONAL DE VIGILÂNCIA SANITÁRIA DIRETORIA COLEGIADA [Este texto não substitui o publicado no DOU] MINISTÉRIO DA SAÚDE AGÊNCIA NACIONAL DE VIGILÂNCIA SANITÁRIA DIRETORIA COLEGIADA](/thumbs/82/85863199.jpg) [Este texto não substitui o publicado no DOU] MINISTÉRIO DA SAÚDE AGÊNCIA NACIONAL DE VIGILÂNCIA SANITÁRIA DIRETORIA COLEGIADA RESOLUÇÃO - RDC Nº 205, DE 28 DE DEZEMBRO DE 2017 DOU de 29/12/2017 [Página
[Este texto não substitui o publicado no DOU] MINISTÉRIO DA SAÚDE AGÊNCIA NACIONAL DE VIGILÂNCIA SANITÁRIA DIRETORIA COLEGIADA RESOLUÇÃO - RDC Nº 205, DE 28 DE DEZEMBRO DE 2017 DOU de 29/12/2017 [Página
Agulhas Hipodérmicas Estéreis para Uso Único e Agulhas Gengivais Estéreis para Uso Único
 Complemento de Regra de Certificação Doc: 703-CRC-002 Página: 1/11 Elaborado por: Eliana T. Shimoda Verificado por: Afonso Martins Cristian Kendi Higuchi Aprovado por: Lester Amaral Data Aprovação: 28/09/2016
Complemento de Regra de Certificação Doc: 703-CRC-002 Página: 1/11 Elaborado por: Eliana T. Shimoda Verificado por: Afonso Martins Cristian Kendi Higuchi Aprovado por: Lester Amaral Data Aprovação: 28/09/2016
ZANDEI INDÚSTRIA DE PLÁSTICOS LTDA MINISTÉRIO DA SAÚDE AGÊNCIA NACIONAL DE VIGILÂNCIA SANITÁRIA
 ZANDEI INDÚSTRIA DE PLÁSTICOS LTDA MINISTÉRIO DA SAÚDE AGÊNCIA NACIONAL DE VIGILÂNCIA SANITÁRIA RESOLUÇÃO RDC Nº 52, DE 26 DE NOVEMBRO DE 2010 Legislação RDC Quarta- 01 de Dezembro de 2010 RESOLUÇÃO-RDC
ZANDEI INDÚSTRIA DE PLÁSTICOS LTDA MINISTÉRIO DA SAÚDE AGÊNCIA NACIONAL DE VIGILÂNCIA SANITÁRIA RESOLUÇÃO RDC Nº 52, DE 26 DE NOVEMBRO DE 2010 Legislação RDC Quarta- 01 de Dezembro de 2010 RESOLUÇÃO-RDC
RESOLUÇÃO-RE Nº 91, DE 16 DE MARÇO DE 2004.
 RESOLUÇÃO-RE Nº 91, DE 16 DE MARÇO DE 2004. O Adjunto da Diretoria Colegiada da Agência Nacional de Vigilância Sanitária, no uso da atribuição, que lhe confere a Portaria n.º 13, de 16 de janeiro de 2004,
RESOLUÇÃO-RE Nº 91, DE 16 DE MARÇO DE 2004. O Adjunto da Diretoria Colegiada da Agência Nacional de Vigilância Sanitária, no uso da atribuição, que lhe confere a Portaria n.º 13, de 16 de janeiro de 2004,
Equipos de Uso Único de Transfusão, de Infusão Gravitacional e de Infusão para Uso com Bomba de Infusão
 Equipos de Uso Único de Transfusão, de Gravitacional e de para Uso com Bomba de Página: 1/13 Elaborado por: Lester Amaral Jr Verificado por: Suzete Schipa Suzuki Priscila Martins Pedroso João Gustavo Lopes
Equipos de Uso Único de Transfusão, de Gravitacional e de para Uso com Bomba de Página: 1/13 Elaborado por: Lester Amaral Jr Verificado por: Suzete Schipa Suzuki Priscila Martins Pedroso João Gustavo Lopes
Republicada no D.O.U de 10 de julho de 2003.
 título: Resolução RDC nº 175, de 08 de julho de 2003 ementa não oficial: Aprova "Regulamento Técnico de Avaliação de Matérias Macroscópicas e Microscópicas Prejudiciais à Saúde Humana em Alimentos Embalados".
título: Resolução RDC nº 175, de 08 de julho de 2003 ementa não oficial: Aprova "Regulamento Técnico de Avaliação de Matérias Macroscópicas e Microscópicas Prejudiciais à Saúde Humana em Alimentos Embalados".
Portaria n.º 269, de 05 de agosto de 2008.
 Serviço Público Federal MINISTÉRIO DO DESENVOLVIMENTO, INDÚSTRIA E COMÉRCIO EXTERIOR INSTITUTO NACIONAL DE METROLOGIA, NORMALIZAÇÃO E QUALIDADE INDUSTRIAL-INMETRO Portaria n.º 269, de 05 de agosto de 2008.
Serviço Público Federal MINISTÉRIO DO DESENVOLVIMENTO, INDÚSTRIA E COMÉRCIO EXTERIOR INSTITUTO NACIONAL DE METROLOGIA, NORMALIZAÇÃO E QUALIDADE INDUSTRIAL-INMETRO Portaria n.º 269, de 05 de agosto de 2008.
RESOLUÇÃO N 26, DE 02 DE JULHO DE 2015
 RESOLUÇÃO N 26, DE 02 DE JULHO DE 2015 Dispõe sobre os requisitos para rotulagem obrigatória dos principais alimentos que causam alergias alimentares. A Diretoria Colegiada da Agência Nacional de Vigilância
RESOLUÇÃO N 26, DE 02 DE JULHO DE 2015 Dispõe sobre os requisitos para rotulagem obrigatória dos principais alimentos que causam alergias alimentares. A Diretoria Colegiada da Agência Nacional de Vigilância
Consulta Pública nº 584 e o processamento de DMI s não-estéreis. Leandro Rodrigues Pereira II Fórum ABRAIDI Brasília, 20 de fevereiro de 2019
 Consulta Pública nº 584 e o processamento de DMI s não-estéreis. Leandro Rodrigues Pereira II Fórum ABRAIDI Brasília, 20 de fevereiro de 2019 Evolução Histórica da Regulação Brasileira Regulamentos vigentes
Consulta Pública nº 584 e o processamento de DMI s não-estéreis. Leandro Rodrigues Pereira II Fórum ABRAIDI Brasília, 20 de fevereiro de 2019 Evolução Histórica da Regulação Brasileira Regulamentos vigentes
Art. 2º Esta lista poderá ser atualizada por meio da publicação de uma nova Instrução Normativa e será disponibilizada no sitio:
 página 1/5 INSTRUÇÃO NORMATIVA N 8, DE 8 DE JULHO DE 2009 DOU 09/07/2009 Dispõe sobre a lista de normas técnicas exigidas para a certificação de equipamentos elétricos sob regime de vigilância sanitária.
página 1/5 INSTRUÇÃO NORMATIVA N 8, DE 8 DE JULHO DE 2009 DOU 09/07/2009 Dispõe sobre a lista de normas técnicas exigidas para a certificação de equipamentos elétricos sob regime de vigilância sanitária.
ANEXO PROPOSTA EM CONSULTA PÚBLICA
 Agência Nacional de Vigilância Sanitária www.anvisa.gov.br Consulta Pública n 52, de 03 de dezembro de 2013 D.O.U de 04/12/2013 A Diretoria Colegiada da Agência Nacional de Vigilância Sanitária, no uso
Agência Nacional de Vigilância Sanitária www.anvisa.gov.br Consulta Pública n 52, de 03 de dezembro de 2013 D.O.U de 04/12/2013 A Diretoria Colegiada da Agência Nacional de Vigilância Sanitária, no uso
Portaria n.º 341, de 22 de julho de 2014.
 Serviço Público Federal MINISTÉRIO DO DESENVOLVIMENTO, INDÚSTRIA E COMÉRCIO EXTERIOR INSTITUTO NACIONAL DE METROLOGIA, QUALIDADE E TECNOLOGIA-INMETRO Portaria n.º 341, de 22 de julho de 2014. O PRESIDENTE
Serviço Público Federal MINISTÉRIO DO DESENVOLVIMENTO, INDÚSTRIA E COMÉRCIO EXTERIOR INSTITUTO NACIONAL DE METROLOGIA, QUALIDADE E TECNOLOGIA-INMETRO Portaria n.º 341, de 22 de julho de 2014. O PRESIDENTE
RESOLUÇÃO - RDC No- 55, DE 10 DE NOVEMBRO DE 2009
 RESOLUÇÃO - RDC No- 55, DE 10 DE NOVEMBRO DE 2009 Dispõe sobre Regulamento Técnico para Produtos Saneantes Categorizados como Água Sanitária e Alvejantes à Base de Hipoclorito de Sódio ou Hipoclorito de
RESOLUÇÃO - RDC No- 55, DE 10 DE NOVEMBRO DE 2009 Dispõe sobre Regulamento Técnico para Produtos Saneantes Categorizados como Água Sanitária e Alvejantes à Base de Hipoclorito de Sódio ou Hipoclorito de
Ministério da Saúde - MS Agência Nacional de Vigilância Sanitária - ANVISA. (Publicada em DOU nº 195, de 2 de outubro de 2008)
 RESOLUÇÃO DE DIRETORIA COLEGIADA RDC Nº 70, DE 1 DE OUTUBRO DE 2008 (Publicada em DOU nº 195, de 2 de outubro de 2008) Dispõe sobre a notificação de Gases Medicinais A Diretoria Colegiada da Agência Nacional
RESOLUÇÃO DE DIRETORIA COLEGIADA RDC Nº 70, DE 1 DE OUTUBRO DE 2008 (Publicada em DOU nº 195, de 2 de outubro de 2008) Dispõe sobre a notificação de Gases Medicinais A Diretoria Colegiada da Agência Nacional
RESOLUÇÃO DA DIRETORIA COLEGIADA - RDC N 24, DE 08 JUNHO DE 2015
 DIÁRIO OFICIAL DA UNIÃO MINISTÉRIO DA SAÚDE AGÊNCIA NACIONAL DE VIGILÂNCIA SANITÁRIA DIRETORIA COLEGIADA RESOLUÇÃO DA DIRETORIA COLEGIADA - RDC N 24, DE 08 JUNHO DE 2015 Publicada no D.O.U. do dia 09 de
DIÁRIO OFICIAL DA UNIÃO MINISTÉRIO DA SAÚDE AGÊNCIA NACIONAL DE VIGILÂNCIA SANITÁRIA DIRETORIA COLEGIADA RESOLUÇÃO DA DIRETORIA COLEGIADA - RDC N 24, DE 08 JUNHO DE 2015 Publicada no D.O.U. do dia 09 de
RESOLUÇÃO ANVISA Nº 34, DE 1976 D.O.U. DE
 RESOLUÇÃO ANVISA Nº 34, DE 1976 D.O.U. DE 19-01-77 Revogada parcialmente pela Resolução - RDC nº 274, de 15 de outubro de 2002 A Comissão Nacional de Normas e Padrões para Alimentos resolve fixar para
RESOLUÇÃO ANVISA Nº 34, DE 1976 D.O.U. DE 19-01-77 Revogada parcialmente pela Resolução - RDC nº 274, de 15 de outubro de 2002 A Comissão Nacional de Normas e Padrões para Alimentos resolve fixar para
RESOLUÇÃO DA DIRETORIA COLEGIADA RDC N 157, DE 11 DE MAIO DE 2017
 RESOLUÇÃO DA DIRETORIA COLEGIADA RDC N 157, DE 11 DE MAIO DE 2017 Dispõe sobre a implantação do Sistema Nacional de Controle de Medicamentos e os mecanismos e procedimentos para rastreamento de medicamentos
RESOLUÇÃO DA DIRETORIA COLEGIADA RDC N 157, DE 11 DE MAIO DE 2017 Dispõe sobre a implantação do Sistema Nacional de Controle de Medicamentos e os mecanismos e procedimentos para rastreamento de medicamentos
Seção III - Do Sigilo e Manutenção dos Dados CAPÍTULO III - DAS DISPOSIÇÕES FINAIS E TRANSITÓRIAS RESOLUÇÃO NORMATIVA - RN Nº 360, DE
 CONTEÚDO CAPÍTULO I - DAS DISPOSIÇÕES PRELIMINARES CAPÍTULO II - DAS DISPOSIÇÕES GERAIS Seção I - Do Cartão Nacional de Saúde Seçã o II - Da Identificação Padrão da Saúde Suplementar Seção III - Do Sigilo
CONTEÚDO CAPÍTULO I - DAS DISPOSIÇÕES PRELIMINARES CAPÍTULO II - DAS DISPOSIÇÕES GERAIS Seção I - Do Cartão Nacional de Saúde Seçã o II - Da Identificação Padrão da Saúde Suplementar Seção III - Do Sigilo
RESOLUÇÃO-RDC No- 46 DE 19 DE SETEMBRO DE 2011
 RESOLUÇÃO-RDC No- 46 DE 19 DE SETEMBRO DE 2011 Dispõe sobre aditivos alimentares e coadjuvantes de tecnologia para fórmulas infantis destinadas a lactentes e crianças de primeira infância. A Diretoria
RESOLUÇÃO-RDC No- 46 DE 19 DE SETEMBRO DE 2011 Dispõe sobre aditivos alimentares e coadjuvantes de tecnologia para fórmulas infantis destinadas a lactentes e crianças de primeira infância. A Diretoria
RESOLUÇÃO Nº... DE... DE O Conselho Federal de Farmácia (CFF), no uso de suas atribuições legais e regimentais e,
 RESOLUÇÃO Nº... DE... DE 2013 Ementa: Inclui o Capítulo XV no Anexo I da Resolução nº 387, de 13 de dezembro de 2002, que regulamenta as atividades do farmacêutico na indústria farmacêutica. O Conselho
RESOLUÇÃO Nº... DE... DE 2013 Ementa: Inclui o Capítulo XV no Anexo I da Resolução nº 387, de 13 de dezembro de 2002, que regulamenta as atividades do farmacêutico na indústria farmacêutica. O Conselho
Resolução ANVISA/DC Nº 213 DE 23/01/2018
 Resolução ANVISA/DC Nº 213 DE 23/01/2018 Publicado no DOU em 24 jan 2018 Dispõe sobre a exposição à venda e a comercialização de produtos fumígenos derivados do tabaco. A Diretoria Colegiada da Agência
Resolução ANVISA/DC Nº 213 DE 23/01/2018 Publicado no DOU em 24 jan 2018 Dispõe sobre a exposição à venda e a comercialização de produtos fumígenos derivados do tabaco. A Diretoria Colegiada da Agência
RESOLUÇÃO - RDC Nº 40, DE 26 DE AGOSTO DE Define os requisitos do cadastro de produtos médicos.
 página 1/8 RESOLUÇÃO - RDC Nº 40, DE 26 DE AGOSTO DE 2015 DOU 27 de Agosto de 2015. Define os requisitos do cadastro de produtos médicos. A Diretoria Colegiada da Agência Nacional de Vigilância Sanitária,
página 1/8 RESOLUÇÃO - RDC Nº 40, DE 26 DE AGOSTO DE 2015 DOU 27 de Agosto de 2015. Define os requisitos do cadastro de produtos médicos. A Diretoria Colegiada da Agência Nacional de Vigilância Sanitária,
ALBERT EINSTEIN INSTITUTO ISRAELITA DE ENSINO E PESQUISA CENTRO DE EDUCAÇÃO EM SAÚDE ABRAM SZAJMAN
 ALBERT EINSTEIN INSTITUTO ISRAELITA DE ENSINO E PESQUISA CENTRO DE EDUCAÇÃO EM SAÚDE ABRAM SZAJMAN CURSO DE ESPECIALIZAÇÃO EM ENGENHARIA CLÍNICA DISCIPLINA: GESTÃO DE TECNOLOGIAS MÉDICAS TEMA:REGULAÇÃO
ALBERT EINSTEIN INSTITUTO ISRAELITA DE ENSINO E PESQUISA CENTRO DE EDUCAÇÃO EM SAÚDE ABRAM SZAJMAN CURSO DE ESPECIALIZAÇÃO EM ENGENHARIA CLÍNICA DISCIPLINA: GESTÃO DE TECNOLOGIAS MÉDICAS TEMA:REGULAÇÃO
RESOLUÇÃO - RDC Nº 31, DE 29 DE MAIO DE 2014
 RESOLUÇÃO - RDC Nº 31, DE 29 DE MAIO DE 2014 Dispõe sobre o procedimento simplificado de solicitações de registro, pós-registro e renovação de registro de medicamentos genéricos, similares, específicos,
RESOLUÇÃO - RDC Nº 31, DE 29 DE MAIO DE 2014 Dispõe sobre o procedimento simplificado de solicitações de registro, pós-registro e renovação de registro de medicamentos genéricos, similares, específicos,
RESOLUÇÃO Nº 626 DE 18 DE AGOSTO DE 2016
 RESOLUÇÃO Nº 626 DE 18 DE AGOSTO DE 2016 Ementa: Dispõe sobre as atribuições do farmacêutico na logística, no transporte e acondicionamento de material biológico em suas diferentes modalidades e formas.
RESOLUÇÃO Nº 626 DE 18 DE AGOSTO DE 2016 Ementa: Dispõe sobre as atribuições do farmacêutico na logística, no transporte e acondicionamento de material biológico em suas diferentes modalidades e formas.
RESOLUÇÃO DE DIRETORIA COLEGIADA - RDC Nº. 270, DE 22 DE SETEMBRO DE 2005.
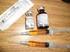 RESOLUÇÃO DE DIRETORIA COLEGIADA - RDC Nº. 270, DE 22 DE SETEMBRO DE 2005. A Diretoria Colegiada da Agência Nacional de Vigilância Sanitária, no uso da atribuição que lhe confere o art. 11 inciso IV do
RESOLUÇÃO DE DIRETORIA COLEGIADA - RDC Nº. 270, DE 22 DE SETEMBRO DE 2005. A Diretoria Colegiada da Agência Nacional de Vigilância Sanitária, no uso da atribuição que lhe confere o art. 11 inciso IV do
Ministério da Saúde - MS Agência Nacional de Vigilância Sanitária ANVISA
 RESOLUÇÃO DA DIRETORIA COLEGIADA - RDC Nº 241, DE 26 DE JULHO DE 2018 (Publicada no DOU nº 144, de 27 de julho de 2018) Dispõe sobre os requisitos para comprovação da segurança e dos benefícios à saúde
RESOLUÇÃO DA DIRETORIA COLEGIADA - RDC Nº 241, DE 26 DE JULHO DE 2018 (Publicada no DOU nº 144, de 27 de julho de 2018) Dispõe sobre os requisitos para comprovação da segurança e dos benefícios à saúde
DIRETORIA COLEGIADA RESOLUÇÃO - RDC Nº 53, DE 7 DE OUTUBRO DE 2014
 DIRETORIA COLEGIADA RESOLUÇÃO - RDC Nº 53, DE 7 DE OUTUBRO DE 2014 Dispõe sobre a lista de enzimas, aditivos alimentares e veículos autorizados em preparações enzimáticas para uso na produção de alimentos
DIRETORIA COLEGIADA RESOLUÇÃO - RDC Nº 53, DE 7 DE OUTUBRO DE 2014 Dispõe sobre a lista de enzimas, aditivos alimentares e veículos autorizados em preparações enzimáticas para uso na produção de alimentos
para Produtos para Saúde
 Programas de Avaliação da Conformidade para Produtos para Saúde São Paulo, 07 de junho de 2011 Andréia Quintana Divisão de Programas de Avaliação da Conformidade Diretoria da Qualidade Inmetro Quem Somos
Programas de Avaliação da Conformidade para Produtos para Saúde São Paulo, 07 de junho de 2011 Andréia Quintana Divisão de Programas de Avaliação da Conformidade Diretoria da Qualidade Inmetro Quem Somos
CAPÍTULO I DAS DISPOSIÇÕES INICIAIS. Seção I Abrangência
 RESOLUÇÃO - RDC Nº 32, DE 27 DE JUNHO DE 2013 Dispõe sobre os procedimentos e requisitos técnicos para o registro de produtos saneantes corrosivos à pele ou que causem lesão ocular grave e dá outras providências.
RESOLUÇÃO - RDC Nº 32, DE 27 DE JUNHO DE 2013 Dispõe sobre os procedimentos e requisitos técnicos para o registro de produtos saneantes corrosivos à pele ou que causem lesão ocular grave e dá outras providências.
RESOLUÇÃO - RDC Nº 29, DE 30 DE JUNHO DE 2011
 ! RESOLUÇÃO - RDC Nº 29, DE 30 DE JUNHO DE 2011! Legislações!+!ANVISA! Sex,!01!de!Julho!de!2011!00:00! RESOLUÇÃO - RDC Nº 29, DE 30 DE JUNHO DE 2011 Dispõe sobre os requisitos de segurança sanitária para
! RESOLUÇÃO - RDC Nº 29, DE 30 DE JUNHO DE 2011! Legislações!+!ANVISA! Sex,!01!de!Julho!de!2011!00:00! RESOLUÇÃO - RDC Nº 29, DE 30 DE JUNHO DE 2011 Dispõe sobre os requisitos de segurança sanitária para
Conselho Federal de Farmácia
 RESOLUÇÃO Nº 584 DE 29 DE AGOSTO DE 2013 Ementa: Inclui o Capítulo XV no Anexo I da Resolução nº 387, de 13 de dezembro de 2002, que regulamenta as atividades do farmacêutico na indústria farmacêutica.
RESOLUÇÃO Nº 584 DE 29 DE AGOSTO DE 2013 Ementa: Inclui o Capítulo XV no Anexo I da Resolução nº 387, de 13 de dezembro de 2002, que regulamenta as atividades do farmacêutico na indústria farmacêutica.
Portaria n.º 300, de 14 de junho de 2012.
 Serviço Público Federal MINISTÉRIO DO DESENVOLVIMENTO, INDÚSTRIA E COMÉRCIO EXTERIOR INSTITUTO NACIONAL DE METROLOGIA, QUALIDADE E TECNOLOGIA - INMETRO Portaria n.º 300, de 14 de junho de 2012. O PRESIDENTE
Serviço Público Federal MINISTÉRIO DO DESENVOLVIMENTO, INDÚSTRIA E COMÉRCIO EXTERIOR INSTITUTO NACIONAL DE METROLOGIA, QUALIDADE E TECNOLOGIA - INMETRO Portaria n.º 300, de 14 de junho de 2012. O PRESIDENTE
PORTARIA CONJUNTA SEAG - IDAF - CEASA Nº 01, DE
 PORTARIA CONJUNTA SEAG - IDAF - CEASA Nº 01, DE 24-11- 2017 Disciplina o acondicionamento de produtos hortifrutigranjeiros expostos à venda e comercializados nas dependências da Centrais de Abastecimento
PORTARIA CONJUNTA SEAG - IDAF - CEASA Nº 01, DE 24-11- 2017 Disciplina o acondicionamento de produtos hortifrutigranjeiros expostos à venda e comercializados nas dependências da Centrais de Abastecimento
Equipo de Irrigação Razek Pump
 Equipo de Irrigação Razek Pump Manual do Usuário Visando a praticidade e a facilidade no acesso às informações contidas no Manual do Usuário dos nossos produtos, a Razek em acordo com a IN nº 4 / 2012
Equipo de Irrigação Razek Pump Manual do Usuário Visando a praticidade e a facilidade no acesso às informações contidas no Manual do Usuário dos nossos produtos, a Razek em acordo com a IN nº 4 / 2012
RESOLUÇÃO-RDC Nº 47, DE 8 DE SETEMBRO DE 2009
 RESOLUÇÃO-RDC Nº 47, DE 8 DE SETEMBRO DE 2009 Estabelece regras para elaboração, harmonização, atualização, publicação e disponibilização de bulas de medicamentos para pacientes e para profissionais de
RESOLUÇÃO-RDC Nº 47, DE 8 DE SETEMBRO DE 2009 Estabelece regras para elaboração, harmonização, atualização, publicação e disponibilização de bulas de medicamentos para pacientes e para profissionais de
COMUNICADO Nº 01. REF.: Errata ao item 3 do Anexo I do Edital de Embasamento referente ao P.L. nº105/2014 Feaes.
 Curitiba, 02 de Setembro de 2014. COMUNICADO Nº 01 REF.: Errata ao item 3 do Anexo I do Edital de Embasamento referente ao P.L. nº105/2014 Feaes. Srs. Licitantes, por meio deste, informo que se faz necessária
Curitiba, 02 de Setembro de 2014. COMUNICADO Nº 01 REF.: Errata ao item 3 do Anexo I do Edital de Embasamento referente ao P.L. nº105/2014 Feaes. Srs. Licitantes, por meio deste, informo que se faz necessária
Sumário RESOLUÇÃO DA DIRETORIA COLEGIADA RDC Nº 23 DE 4 DE ABRIL DE CAPÍTULO I... 1 DAS DISPOSIÇÕES INICIAIS... 1 CAPÍTULO III...
 RDC Nº 23 /2012 Dispõe sobre a obrigatoriedade de execução e notificação de ações de campo por detentores de registro de produtos para a saúde no Brasil. Sumário RESOLUÇÃO DA DIRETORIA COLEGIADA RDC Nº
RDC Nº 23 /2012 Dispõe sobre a obrigatoriedade de execução e notificação de ações de campo por detentores de registro de produtos para a saúde no Brasil. Sumário RESOLUÇÃO DA DIRETORIA COLEGIADA RDC Nº
RESOLUÇÃO ANP Nº 70, DE DOU
 1 de 4 27/12/2016 16:09 AGÊNCIA NACIONAL DO PETRÓLEO, GÁS NATURAL E BIOCOMBUSTÍVEIS RESOLUÇÃO ANP Nº 70, DE 20.12.2011 - DOU 22.12.2011 O DIRETOR-GERAL SUBSTITUTO da AGÊNCIA NACIONAL DO PETRÓLEO, GÁS NATURAL
1 de 4 27/12/2016 16:09 AGÊNCIA NACIONAL DO PETRÓLEO, GÁS NATURAL E BIOCOMBUSTÍVEIS RESOLUÇÃO ANP Nº 70, DE 20.12.2011 - DOU 22.12.2011 O DIRETOR-GERAL SUBSTITUTO da AGÊNCIA NACIONAL DO PETRÓLEO, GÁS NATURAL
Ministério da Saúde - MS Agência Nacional de Vigilância Sanitária - ANVISA
 RESOLUÇÃO DA DIRETORIA COLEGIADA RDC N 98, DE 1 DE AGOSTO DE 2016 Dispõe sobre os critérios e procedimentos para o enquadramento de medicamentos como isentos de prescrição e o reenquadramento como medicamentos
RESOLUÇÃO DA DIRETORIA COLEGIADA RDC N 98, DE 1 DE AGOSTO DE 2016 Dispõe sobre os critérios e procedimentos para o enquadramento de medicamentos como isentos de prescrição e o reenquadramento como medicamentos
RESOLUÇÃO - RDC N 98, DE 1 DE AGOSTO DE 2016
 RESOLUÇÃO - RDC N 98, DE 1 DE AGOSTO DE 2016 Dispõe sobre os critérios e procedimentos para o enquadramento de medicamentos como isentos de prescrição e o reenquadramento como medicamentos sob prescrição,
RESOLUÇÃO - RDC N 98, DE 1 DE AGOSTO DE 2016 Dispõe sobre os critérios e procedimentos para o enquadramento de medicamentos como isentos de prescrição e o reenquadramento como medicamentos sob prescrição,
