Nesta aula prática serão utilizados alguns reagentes, com as seguintes finalidades:
|
|
|
- Maria do Loreto Palhares Porto
- 6 Há anos
- Visualizações:
Transcrição
1 Universidade Estadual de Londrina Centro de ciências biológicas Departamento de ciências fisiológicas Disciplina de Biofísica - Aula prática Difusão de moléculas através da membrana de diálise. Introdução Difusão é a movimentação de uma população de partículas de um local para outro por deslocamento aleatório individual. Em solução, todas as partículas presentes estão em constante movimento aleatório, sendo que seu deslocamento é dependente da temperatura e do seu peso molecular. A rota percorrida por cada partícula é alterada quando há choque entre elas. Apesar de o movimento individual de partículas ser de direção aleatória, podemos avaliar se existe movimentação preferencial de uma população de partículas de uma região para outra dentro de uma solução. Para tanto, analisamos o fluxo de partículas, que indica o número de partículas que atravessa uma determinada área em um período de tempo definido. Segundo a primeira lei de Fick, o fluxo (J) de uma determinada molécula é diretamente proporcional à área observada (A), à diferença de concentração da substância entre as áreas observadas (dc), e ao coeficiente de difusão, que leva em consideração o peso molecular, a temperatura da solução, a estrutura química da molécula (solubilidade, p.ex.) e a natureza da solução, enquanto que a distância a ser percorrida pelas partículas (dx) tem relação inversa com o fluxo. A diferença de concentração determinará a direção do fluxo, que será sempre da região de maior concentração para a região de menor concentração. Notas Nesta aula prática serão utilizados alguns reagentes, com as seguintes finalidades: O amido consiste de duas grandes moléculas que reagem diferentemente a presença de iodo. A α-amilose consiste de longas cadeias insolúveis em água, que formam micelas hidratadas que, na presença de iodo, resultam na coloração azul. Amilopectina é uma molécula ramificada e forma soluções tanto coloidais quanto micelares, e na presença de iodo gera a coloração vermelho-violeta. A α-amilose pode ser hidrolisada pela α-amilase, enzima presente na saliva, gerando maltose e maltotriose, que são moléculas pequenas. α-amilase não consegue atacar os pontos de ramificação da amilopectina, gerando como produto da hidrólise a isomaltose e um produto grande e altamente ramificado, a dectrina-limite. A solução de AgNO 3 revela os íons cloreto, formando um precipitado branco (o cloreto de prata). A solução de Fehling ou Benedict revela a maltose, gerando uma coloração vermelho tijolo. A membrana de celofane possui poros de diferentes tamanhos e restringe a passagem de algumas substâncias, sendo por isso utilizada como modelo de membrana semipermeável.
2 . Técnica:.. Mergulhe a folha de celofane em água destilada por 5 minutos. Faça um saquinho com o celofane e coloque no seu interior 0 ml de solução de NaCl %, 0 ml de amido e ml de saliva. Amarre-o com linha. Coloque-o em um Becker e adicione uma quantidade mínima de água destilada, o suficiente para cobrir todo o saco de celofane. Marque o tempo inicial... Tome tubos de ensaio: no primeiro, coloque ml de solução de amido % e gota de solução de lugol. Ao segundo, coloque ml de solução de NaCl % e 3 gotas de solução de AgNO 3. Observe e anote os resultados..3. Após 5 minutos, tome 3 tubos. Adicione a cada tubo ml do líquido de diálise. Ao º adicione gota de lugol, ao º, 3 gotas de AgNO 3 e ao terceiro ml do reativo de Benedict ou Fehling. O último tubo deve ser aquecido até ebulição..4. Repetir a mesma operação aos 30 minutos. Com o dialisado e com o conteúdo do saquinho. 3. Responda: a. O que você pode concluir sobre o tamanho dos poros da membrana de celofane? b. Qual o mecanismo de passagem do cloreto para o meio exterior ao saquinho de diálise? c. Quais são os requisitos para que uma substância atravesse a membrana através da porção lipídica ou por canais iônicos?
3 Universidade Estadual de Londrina Centro de ciências biológicas Departamento de ciências fisiológicas Disciplina de Biofísica - Aula prática Difusão através da membrana celular. Introdução: A membrana plasmática de praticamente todas as células é bastante permeável à água. Nesta aula, analisaremos alguns fatores que determinam o fluxo de água através da membrana de eritrócitos. O movimento de água chamado de osmose ou fluxo osmótico compreende o movimento natural das moléculas de água de uma solução com maior concentração de água livre para outra com menor concentração de água livre. Nas soluções do organismo, a presença de certos sais e outras moléculas em um fluído reduz a concentração de água livre. O movimento da água para o compartimento que contém maior concentração de sais cria uma pressão hidrostática devido ao aumento de volume nesse compartimento. A pressão hidrostática necessária para impedir o fluxo osmótico de água em determinada solução é chamada de pressão osmótica. A magnitude da pressão osmótica está relacionada à concentração de partículas dissolvidas. A pressão osmótica de uma solução ideal de não-eletrólitos é diretamente proporcional à soma das concentrações molares de todos os seus solutos. Soluções ideais de mesma osmolaridade são isosmóticas. Tendo soluções ideais de concentrações molares diferentes, a que possui maior concentração molar é considerada hiperosmótica em relação à outra, a hiposmótica. A tonicidade é uma fração da pressão osmótica total de uma solução, quando ela se encontra em contato com uma membrana semipermeável, assim como também é semipermeável a membrana celular. A membrana celular, por exemplo, permite a passagem de água e de alguns solutos, mas não de todos. Assim, a pressão osmótica a que a membrana celular está exposta se refere aos solutos impermeantes à membrana. Logo, a tonicidade de uma solução não depende exclusivamente da concentração molar dessa solução, mas também da permeabilidade da membrana que separa essa solução de outra. Os fluídos do organismo humano possuem, em sua maioria, por volta de 0,30 osmóis por litro. Se um soluto não pode atravessar a membrana (impermeante), qualquer alteração na sua concentração produzirá um gradiente de concentração através da membrana, conduzindo a um fluxo resultante de água para dentro ou para fora da célula, o que acarretará em modificação do volume celular. Somente os solutos não permeantes é que podem alterar o volume celular no longo prazo, acarretando uma mudança de concentração de água livre através da membrana. Solutos que se movimentam passivamente apenas pela membrana tendem a alcançar o equilíbrio e, portanto não tem efeito sobre a osmose. No caso das hemácias, quando existe aumento do seu volume a aproximadamente o dobro, esta hemolisa (hemólise osmótica).
4 . Protocolo experimental Hemólise osmótica a) Coloque numa estante 7 tubos de ensaio. b) Coloque em cada tubo ml de solução de NaCl de seguintes molaridades : 0,6; 0,; 0,0; 0,08; 0,06; 0,04; 0,0. c) Adicione gota de sangue, agite suavemente por poucos minutos e deixe a suspensão em repouso por 0 minutos. d) No fim deste período, agite os tubos novamente e analise os resultados. Determine o limite da fragilidade de membrana celular, isto é, a menor concentração salina na qual ocorre hemólise. Analise o grau de hemólise pelo grau de transparência da suspensão. Hemólise osmótica e não-osmótica: a) Coloque numa estante 5 tubos de ensaio; b) Adicione 5 ml das seguintes soluções, respectivamente: 0,6 M de NaCl; 0,3% de saponina; 0,3% de saponina em 0,6M de NaCl; 0,3M de uréia em 0,6 M de NaCl; 0,3 M de uréia. c) Adicione gota de sangue a cada um dos tubos, agite suavemente e deixe em repouso por 0 minutos. d) No fim deste período, observe o grau de opacidade da suspensão de células. Avalie em qual suspensão ocorreu hemólise. e) Assumindo que qualquer troca de materiais entre eritrócitos e a solução externa não altere expressivamente a composição do meio externo, analise a direção do movimento de água para cada um dos tubos. 3. Questões para discussão 3.. O que significa hemólise parcial e porque ela ocorreu? 3.. Qual a diferença entre hemólise osmótica e não osmótica? Em quais tubos ocorreram? 3.3. Por que não houve hemólise na solução hiperosmótica de uréia e NaCl? 3.4. Por que houve hemólise na solução hiperosmótica de uréia?
5 . Introdução: Universidade Estadual de Londrina Centro de ciências biológicas Departamento de ciências fisiológicas Disciplina de Biofísica - Aula prática Equilíbrio de Donnan Consideramos o sistema constituído por dois compartimentos separados por uma membrana impermeável a proteínas, porém permeável a pequenos íons. Como as proteínas em solução apresentam cargas elétricas, conforme o ph da solução, sua presença em apenas um dos compartimentos do sistema alterará a distribuição final dos íons difusíveis, e a pressão osmótica das soluções, o que é denominado efeito Donnan. Para compreender a origem desse fenômeno, suponhamos a seguinte situação inicial e final: Membrana semi-permeável Compartimento Compartimento 5 P - 0 A - 5B + 0B + t Compartimento 5 P - 4 A - 9B + Compartimento 6 A - 6B + onde: *[P - ] = concentração do ânion não-difusível *[A - ] = concentração do ânion difusível *[B + ] = concentração do cátion difusível * Os compartimentos têm paredes rígidas e o sistema é fechado. Se não existisse o íon não-difusível P -, os cátions e ânions difusíveis atravessariam a membrana segundo o seu gradiente de concentração até atingir o equilíbrio de difusão. Devido a impermeabilidade ao ânion P -, não se produz a equipartição dos íons difusíveis, pois é necessário que se estabeleça a eletroneutralidade das soluções. Assim, o sistema após ter alcançado o equilíbrio apresentará as seguintes características... Eletroneutralidade O número total de cargas negativas deve ser igual ao número de cargas positivas em cada um dos dois compartimentos. Portanto: P - + A - = B +, no compartimento A- = B +, no compartimento No compartimento, o cátion B + deve achar-se em maior concentração que no compartimento, porque deve neutralizar os ânions P - e A -... Equilíbrio eletroquímico de todos os íons difusíveis Na situação do Equilíbrio de Donnan, existe um gradiente de concentração para cada espécie de íons difusível. Esse gradiente é de direção oposta por cátions e ânions. Assim, a condição de equilíbrio não pode ser especificada apenas em termos de concentrações químicas, visto que os gradientes de concentrações individuais resultariam em distribuição igual de íons difusíveis através da membrana. Os
6 gradientes de concentração para íons difusíveis existentes no equilíbrio devem ser, portanto, neutralizados por força impulsora de mesma intensidade e oposta. Essa força é um potencial de equilíbrio gerado pela distribuição desigual de íons difusíveis através da membrana. Quando o sistema entrar em equilíbrio, o potencial de equilíbrio deverá ser igual para cada íon difusível. Isto significa que podemos aplicar a equação de Nernst para cada íons difusível do sistema (veja anexo para demonstração), de forma que no equilíbrio teremos que o produto das concentrações dos íons difusíveis em cada lado da membrana serão iguais: A. B = A B. Assim, é estabelecida uma diferença de potencial através da membrana tal que o compartimento que contém o ânion não difusível é eletronegativo em relação ao outro. Por outro lado, em sistemas biológicos, existe a presença de transporte ativo nas membranas celulares, o que determina as distribuições iônicas entre o interior e o exterior da célula.. Protocolo experimental O protocolo experimental a seguir será utilizado para estudo do efeito de um íon não-difusível exerce sobre a distribuição de íons difusíveis em uma membrana semipermeável. 3. Técnica 3.. Coloque 50 ml de água destilada no Becker e ml de indicador de bromofenol. Junte HCl 0,N gota a gota até atingir a coloração amarela, sendo que a solução ficará primeiramente esverdeada. Em seguida, adicione NaOH 0,N gota a gota até a coloração esverdeada novamente. 3.. Retire 0 ml de alíquota do Becker e deixe para posterior comparação. Verificar o volume restante Coloque 50 ml de solução de gelatina % no Becker e ml de indicador azul de bromofenol. Adicione HCl 0,N até a coloração semelhante da solução contida no Becker. As duas soluções terão aproximadamente o mesmo ph Retire do Becker um volume de forma que se igualem os volumes dos Becker e. Esse volume retirado do Becker deverá ser guardado para posterior comparação Coloque a solução de gelatina do Becker em um saco de celofane (igual a prática de diálise) e coloque no Becker. Agite periodicamente Observe a modificação da cor das soluções comparando com os dois tubos controle. Analise os resultados. Nota: indicador de bromofenol ph = 3,0 amarelo ph = 4, verde ph = 4,6 azul ponto isoelétrico da gelatina = 4,8 4. Questões para discussão a. O que é ponto isoelétrico de um aminoácido ou proteína? b. Por que houve no Becker com gelatina uma necessidade de maior adição de HCl para tornar verde a solução? c. Por que houve mudança do ph das soluções? Explique d. Defina: equilíbrio de Donnan. e. Em uma célula viva normal, o equilíbrio de Donnan é atingido? Explique.
7 Anexo Para cátions difusíveis RT B E B =.ln = ZF B RT B.ln F B + ; quando Z=+ Para ânions difusíveis RT A E A =.ln = ZF A RT A.ln F A ; quando Z=- No equilíbrio teremos E E B + = A RT B.ln F B = RT F.ln A A B A = B A A. B = A. B 3
8 Universidade Estadual de Londrina Centro de ciências biológicas Departamento de ciências fisiológicas Disciplina de Biofísica - Aula prática Determinação colorimétrica do ph. Efeito tampão: Uma ideia aproximada do ph de uma solução pode ser obtida usando indicadores. Estes são compostos orgânicos de origem sintética ou natural cujas cores são dependentes do ph. Indicadores são geralmente ácidos fracos que dissociam em solução: H. ln H+ + In- O ph de uma solução do indicador é dado pela equação: ( In ) ph = pkin + log ; sendo que o indicador exibe sua cor intermediária ( H. In) quando a razão (In)/(H.In) = e o ph = pk In. O intervalo mais eficiente para um determinado indicador é aproximadamente de duas unidades de ph, isto é: pk in ±. Para determinar o ph de uma solução, adicionam-se algumas gotas de solução de indicador e compara-se a cor obtida com a cor de uma série de tampões de ph conhecido e contendo a mesma quantidade de indicador. Indicadores universais são misturas de vários indicadores, a fim de abranger um intervalo mais amplo de ph. Por exemplo, segue o protocolo para preparo de uma solução de um indicador universal que abrange a faixa de ph 3 até : laranja de metila : 0,05g vermelho de metila : 0,5g azul de bromotinol : 0,30g fenolftaleína : 0,35g álcool etílico a 66% : litro azul 0... violeta ou mais... púrpura ph Cor 3 ou menos... vermelho 4... alaranjado 5... laranja 6... amarelo 7... verde amarelado 8... verde azulado
9 Aplicação prática Reagentes: Tampões de ph = 3, 4, 5, 6, 7, 8, 9 e 0. Indicador universal NaOH 0,N HCl 0,N Técnica:. Preparar uma bateria de 8 tubos de ensaio. Adicionar ao primeiro tubo ml de solução tampão ph = 3, no segundo tubo ml de solução ph = 4 e assim sucessivamente até o tampão de ph = 0. Adicionar a cada tubo 9 ml de H O destilada e ml do indicador universal. Esta bateria irá construir a escala padrão de ph.. Preparar outra bateria de 4 tubos de ensaio e numerá-los de a 4. Adicionar ml do indicador universal a cada tubo. 3. Aos tubos e 3 adicionar 0 ml de H O destilada. 4. Aos tubos e 4 adicionar ml de solução tampão ph = 7 e 9 ml de H O destilada. 5. Adicionar gota de NaOH 0,N aos tubos e. Observar e determinar o ph. 6. Adicionar aos tubos 3 e 4 uma gota de HCl 0,N. Observar mudança de coloração e determinar o ph. 7. Continuar a adição de HCl ao tubo 4, gota a gota. Quantas foram adicionadas até que se obtenha a mesma coloração do tubo 3 da escala? Explicar.
10 3 Universidade Estadual de Londrina Centro de ciências biológicas Departamento de ciências fisiológicas Disciplina de Biofísica - Aula prática Medida de tensão de CO. Introdução: A difusão de um gás ocorre pela tendência que suas moléculas apresentam em passar de um ponto de maior pressão para outro ponto de pressão menor, distribuindo-se por todo espaço disponível. Cada gás de uma mistura exerce pressão de acordo com sua própria concentração, independentemente da pressão de outros gases. Este estudo permite avaliar como se dá a passagem dos gases respiratórios dos alvéolos para o sangue capilar, dos capilares para os alvéolos, do sangue para os tecidos ou do tecido para o sangue. Quando um gás é colocado em contato com uma superfície líquida, as moléculas gasosas bombardeiam a superfície do líquido e passam para o seu interior, que depende da solubilidade desse gás no meio líquido. Contudo, as moléculas gasosas dissolvidas também tendem a escapar do líquido. No equilíbrio, a velocidade com que as moléculas escapam do líquido é a mesma com que elas penetram no interior do mesmo, estabelecendo, portanto, uma concentração constante de gás na fase líquida. A pressão parcial ou tensão de um gás dissolvido em um líquido é a pressão exercida pelo gás dentro da fase líquida, ou seja, é a mesma pressão que o gás tem na fase gasosa quando em equilíbrio com a fase líquida. A velocidade de difusão de um gás em um líquido depende de vários fatores, como diferença de pressão, solubilidade do gás no líquido, temperatura, área de secção transversal do líquido, distância através da qual o gás deve se difundir e peso molecular do gás.. Protocolo experimental: Para se avaliar a tensão aproximada de CO no ar expirado, utilizaremos nesta prática um sistema fechado contendo bicarbonato em concentrações variadas, de modo que o ar expirado, quando em contato com a solução de bicarbonato, formará ácido carbônico e bicarbonato, com consequente alteração do ph da solução. A mudança de ph dependerá da pressão parcial de CO no ar expirado, visto que esta pressão determinará a quantidade de CO dissolvido na solução de bicarbonato. O protocolo utilizado será o seguinte: a) Tubo : 0 ml de NaHCO 3 0,04M; b) Tubo : 5 ml de NaHCO 3 0,04M e 5ml de H O destilada (solução de NaHCO 3 0,03M); c) Tubo 3: 0 ml de NaHCO 3 0,04M e 0ml de H O destilada (solução de NaHCO 3 0,0M); d) A cada um dos 3 tubos foi adicionado ml de indicador universal. e) Os tubos serão fechados. Montado o sistema, o aluno deve assoprar pelo tubo de borracha (de entrada) até observar mudança de coloração nos 3 tubos. Comparar cada um deles com a bateria de tampões e identificar o ph. 3
11 4. Dados: a. A equação de Henderson-Hasselbalch descreve o comportamento do ph de uma solução que contém um ácido ou base fraca e seus respectivos sais, ou seja, uma solução tampão: [ HCO3 ] ph = pk + log -> pk = 6, [ CO ] b. Lei de Henry: a quantidade dissolvida de um gás em solução é diretamente proporcional a pressão parcial do gás: [ CO] = β PCO c. Coeficiente de solubilidade ou coeficiente de absorção: define a solubilidade de um gás em solução. α = coeficiente de absorção volumétrico: (em l/atm) α H O = 0,57 l/atm α plasma = 0,5 l/atm β = coeficiente de absorção molar (em mmoles/mmhg β H O = 0,033 mmoles/mmhg β plasma = 0,03 mmoles/mmhg 3. Calcule: a. A tensão de CO nos tubos, e 3. b. A [CO ] no sangue venoso, sabendo que a PCO = 46 mmhg c. A [CO ] no sangue arterial, sabendo que a PCO = 40 mmhg. 4
12
ROTEIRO PRÁTICO DE QUÍMICA GERAL
 ROTEIRO PRÁTICO DE QUÍMICA GERAL 1- Objetivo 1. Estimar o ph de água destilada e de soluções aquosas usando indicadores ácidobase. 2. Diferenciar o comportamento de uma solução tampão. 2 Introdução Eletrólitos
ROTEIRO PRÁTICO DE QUÍMICA GERAL 1- Objetivo 1. Estimar o ph de água destilada e de soluções aquosas usando indicadores ácidobase. 2. Diferenciar o comportamento de uma solução tampão. 2 Introdução Eletrólitos
Transporte através da Membrana Plasmática. CSA Colégio Santo Agostinho BIOLOGIA 1º ano Ensino Médio Professor: Wilian Cosme Pereira
 Transporte através da Membrana Plasmática CSA Colégio Santo Agostinho BIOLOGIA 1º ano Ensino Médio Professor: Wilian Cosme Pereira A membrana plasmática é formada por 2 camadas ( Bicamada ) de lipídios
Transporte através da Membrana Plasmática CSA Colégio Santo Agostinho BIOLOGIA 1º ano Ensino Médio Professor: Wilian Cosme Pereira A membrana plasmática é formada por 2 camadas ( Bicamada ) de lipídios
FISIOLOGIA DAS MEMBRANAS. Composição da membrana plasmática. Transporte através da membrana.
 FISIOLOGIA DAS MEMBRANAS Composição da membrana plasmática. Transporte através da membrana. FUNÇÕES DA MEMBRANA PLASMÁTICA Isolamento físico Regulação de trocas Comunicação celular Suporte estrutural Modelo
FISIOLOGIA DAS MEMBRANAS Composição da membrana plasmática. Transporte através da membrana. FUNÇÕES DA MEMBRANA PLASMÁTICA Isolamento físico Regulação de trocas Comunicação celular Suporte estrutural Modelo
Universidade Federal Rural de Pernambuco
 Universidade Federal Rural de Pernambuco Departamento de Morfologia e Fisiologia Animal Área de Biofísica Medindo o potencial Hidrogeniônico Prof. Romildo Nogueira 1. Entendendo as bases A manutenção da
Universidade Federal Rural de Pernambuco Departamento de Morfologia e Fisiologia Animal Área de Biofísica Medindo o potencial Hidrogeniônico Prof. Romildo Nogueira 1. Entendendo as bases A manutenção da
CÉLULAS QUAL CÉLULA É ANIMAL E QUAL É A VEGETAL?
 CÉLULAS QUAL CÉLULA É ANIMAL E QUAL É A VEGETAL? CÉLULAS EUCARIÓTICAS E PROCARIÓTICAS Organismos constituídos por células procarióticas: Bactérias e cianobácterias. Organismos constituídos por células
CÉLULAS QUAL CÉLULA É ANIMAL E QUAL É A VEGETAL? CÉLULAS EUCARIÓTICAS E PROCARIÓTICAS Organismos constituídos por células procarióticas: Bactérias e cianobácterias. Organismos constituídos por células
Experimento 1: Efeito do íon comum equilíbrio de ionização da amônia
 Experimento Deslocamento de equilíbrios químicos (Princípio de Le Chatelier) Objetivo: Estudar e compreender alguns fatores que deslocam equilíbrios químicos. Experimento 1: Efeito do íon comum equilíbrio
Experimento Deslocamento de equilíbrios químicos (Princípio de Le Chatelier) Objetivo: Estudar e compreender alguns fatores que deslocam equilíbrios químicos. Experimento 1: Efeito do íon comum equilíbrio
TITULAÇÃO ÁCIDO-BASE
 Introdução a Analise Química II sem/2015 Profa Ma Auxiliadora Universidade Federal de Juiz de Fora Instituto de Ciências Exatas Departamento de Química Disciplina QUIO94 - Introdução à Análise Química
Introdução a Analise Química II sem/2015 Profa Ma Auxiliadora Universidade Federal de Juiz de Fora Instituto de Ciências Exatas Departamento de Química Disciplina QUIO94 - Introdução à Análise Química
Exercícios de Tipos celulares e membranas
 Exercícios de Tipos celulares e membranas 1. (UFF, 2011) As células animais, vegetais e bacterianas apresentam diferenças estruturais relacionadas às suas características fisiológicas. A tabela abaixo
Exercícios de Tipos celulares e membranas 1. (UFF, 2011) As células animais, vegetais e bacterianas apresentam diferenças estruturais relacionadas às suas características fisiológicas. A tabela abaixo
PROPRIEDADES COLIGATIVAS DAS SOLUÇõES
 PROPRIEDADES COLIGATIVAS DAS SOLUÇõES Propriedades coligativas são propriedades de uma solução que dependem exclusivamente do número de partículas do soluto dissolvido e não da sua natureza. Cada uma dessas
PROPRIEDADES COLIGATIVAS DAS SOLUÇõES Propriedades coligativas são propriedades de uma solução que dependem exclusivamente do número de partículas do soluto dissolvido e não da sua natureza. Cada uma dessas
2005 by Pearson Education. Capítulo 04
 QUÍMICA A Ciência Central 9ª Edição Capítulo 4 Reações em soluções aquosas e estequiometria de soluções David P. White Propriedades gerais das soluções aquosas Propriedades eletrolíticas As soluções aquosas
QUÍMICA A Ciência Central 9ª Edição Capítulo 4 Reações em soluções aquosas e estequiometria de soluções David P. White Propriedades gerais das soluções aquosas Propriedades eletrolíticas As soluções aquosas
LISTA DE EXERCÍCIOS # 05 QUÍMICA ANALÍTICA PROF. Wendell
 LISTA DE EXERCÍCIOS # 05 QUÍMICA ANALÍTICA PROF. Wendell 1. Considere uma solução aquosa de NH 3, preparada na concentração de 0,100 mol L -1. Calcule o ph desta solução. Use K b = 1,8 10-5. 2. Uma alíquota
LISTA DE EXERCÍCIOS # 05 QUÍMICA ANALÍTICA PROF. Wendell 1. Considere uma solução aquosa de NH 3, preparada na concentração de 0,100 mol L -1. Calcule o ph desta solução. Use K b = 1,8 10-5. 2. Uma alíquota
FISIOLOGIA DO EXERCÍCIO
 FISIOLOGIA DO EXERCÍCIO 1 Ventilação e metabolismo energético Equivalente ventilatório de oxigênio: Relação entre volume de ar ventilado (VaV) e a quantidade de oxigênio consumida pelos tecidos (VO2) indica
FISIOLOGIA DO EXERCÍCIO 1 Ventilação e metabolismo energético Equivalente ventilatório de oxigênio: Relação entre volume de ar ventilado (VaV) e a quantidade de oxigênio consumida pelos tecidos (VO2) indica
Biofísica renal. Estrutura e função dos rins
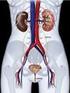 Biofísica renal Estrutura e função dos rins Múltiplas funções do sistema renal Regulação do balanço hídrico e eletrolítico (volume e osmolaridade) Regulação do equilíbrio ácidobásico (ph) Excreção de produtos
Biofísica renal Estrutura e função dos rins Múltiplas funções do sistema renal Regulação do balanço hídrico e eletrolítico (volume e osmolaridade) Regulação do equilíbrio ácidobásico (ph) Excreção de produtos
Equipe de Química QUÍMICA
 Aluno (a): Série: 3ª Turma: TUTORIAL 12R Ensino Médio Equipe de Química Data: QUÍMICA Mistura de soluções que não reagem entre si: Misturas de soluções de mesmo soluto quando misturamos soluções de mesmo
Aluno (a): Série: 3ª Turma: TUTORIAL 12R Ensino Médio Equipe de Química Data: QUÍMICA Mistura de soluções que não reagem entre si: Misturas de soluções de mesmo soluto quando misturamos soluções de mesmo
TITULAÇÃO BASE FRACA COM ÁCIDO FORTE
 TITULAÇÃO BASE FRACA COM ÁCIDO FORTE TITULAÇÃO BASE FRACA COM ÁCIDO FORTE 1 ETAPA Antes de iniciar a titulação A solução contém apenas base fraca e água - solução aquosa de uma base fraca. O ph da solução
TITULAÇÃO BASE FRACA COM ÁCIDO FORTE TITULAÇÃO BASE FRACA COM ÁCIDO FORTE 1 ETAPA Antes de iniciar a titulação A solução contém apenas base fraca e água - solução aquosa de uma base fraca. O ph da solução
Aula: 03 Temática: Componentes Inorgânicos das Células Parte I
 Aula: 03 Temática: Componentes Inorgânicos das Células Parte I As substâncias inorgânicas existem na natureza, independentemente dos seres vivos, mas algumas delas podem ser encontradas nas células. Acompanhe!
Aula: 03 Temática: Componentes Inorgânicos das Células Parte I As substâncias inorgânicas existem na natureza, independentemente dos seres vivos, mas algumas delas podem ser encontradas nas células. Acompanhe!
ARTIGO SOBRE OS PERSONAGENS MARCANTES DA HISTÓRIA DA FISIOLOGIA
 ARTIGO SOBRE OS PERSONAGENS MARCANTES DA HISTÓRIA DA FISIOLOGIA Adaptação Ponto de vista evolutivo Exemplos: gado Zebu X gado europeu Aclimatação Alteração fisiológica, bioquímica ou anatômica a partir
ARTIGO SOBRE OS PERSONAGENS MARCANTES DA HISTÓRIA DA FISIOLOGIA Adaptação Ponto de vista evolutivo Exemplos: gado Zebu X gado europeu Aclimatação Alteração fisiológica, bioquímica ou anatômica a partir
3ª Série / Vestibular _ TD 08 _ 19 de abril
 3ª Série / Vestibular _ TD 08 _ 19 de abril 21. As células caracterizam-se por possuir uma membrana plasmática, separando o meio intracelular do meio extracelular. A manutenção da integridade dessa membrana
3ª Série / Vestibular _ TD 08 _ 19 de abril 21. As células caracterizam-se por possuir uma membrana plasmática, separando o meio intracelular do meio extracelular. A manutenção da integridade dessa membrana
Concentração de soluções e diluição
 Concentração de soluções e diluição 1. Introdução Uma solução é uma dispersão homogênea de duas ou mais espécies de substâncias moleculares ou iônicas. É um tipo especial de mistura, em que as partículas
Concentração de soluções e diluição 1. Introdução Uma solução é uma dispersão homogênea de duas ou mais espécies de substâncias moleculares ou iônicas. É um tipo especial de mistura, em que as partículas
P1 - PROVA DE QUÍMICA GERAL 09/04/11
 P1 - PROVA DE QUÍMICA GERAL 09/04/11 Nome: Nº de Matrícula: GABARITO Turma: Assinatura: Questão Valor Grau Revisão 1 a 2,5 2 a 2,5 3 a 2,5 4 a 2,5 Total 10,0 Dados R = 0,0821 atm L mol -1 K -1 T (K) =
P1 - PROVA DE QUÍMICA GERAL 09/04/11 Nome: Nº de Matrícula: GABARITO Turma: Assinatura: Questão Valor Grau Revisão 1 a 2,5 2 a 2,5 3 a 2,5 4 a 2,5 Total 10,0 Dados R = 0,0821 atm L mol -1 K -1 T (K) =
Pontifícia Universidade Católica de Goiás Departamento de Biologia. Membrana Plasmática. Prof. Msc. Macks Wendhell Gonçalves.
 Pontifícia Universidade Católica de Goiás Departamento de Biologia Membrana Plasmática Prof. Msc. Macks Wendhell Gonçalves mackswendhell@gmail.com Membrana Plasmática (MP) A MP mantem constante o meio
Pontifícia Universidade Católica de Goiás Departamento de Biologia Membrana Plasmática Prof. Msc. Macks Wendhell Gonçalves mackswendhell@gmail.com Membrana Plasmática (MP) A MP mantem constante o meio
Variações do Volume Celular: Osmoticidade e Tonicidade
 Teoria da Aula-Prática Variações do Volume Celular: Osmoticidade e Tonicidade Os primeiros sistemas vivos, provavelmente, surgiram nos mares pouco profundos e, mesmo atualmente, os líquidos extracelulares,
Teoria da Aula-Prática Variações do Volume Celular: Osmoticidade e Tonicidade Os primeiros sistemas vivos, provavelmente, surgiram nos mares pouco profundos e, mesmo atualmente, os líquidos extracelulares,
Objetivo: Estudar os mecanismos fisiológicos responsáveis pelas trocas gasosas e pelo controle do transporte de gases Roteiro:
 TROCAS GASOSAS E CONTROLE DO TRANSPORTE DE GASES Objetivo: Estudar os mecanismos fisiológicos responsáveis pelas trocas gasosas e pelo controle do transporte de gases Roteiro: 1. Trocas gasosas 1.1. Locais
TROCAS GASOSAS E CONTROLE DO TRANSPORTE DE GASES Objetivo: Estudar os mecanismos fisiológicos responsáveis pelas trocas gasosas e pelo controle do transporte de gases Roteiro: 1. Trocas gasosas 1.1. Locais
ABSORÇÃO RADICULAR, TRANSPORTE E REDISTRIBUIÇÃO DE NUTRIENTES
 ABSORÇÃO RADICULAR, TRANSPORTE E REDISTRIBUIÇÃO DE NUTRIENTES Prof. Volnei Pauletti Departamento de Solos e Engenharia Agrícola Mestrado em Ciência do Solo vpauletti@ufpr.br CONTATO NUTRIENTE - RAIZ Absorção
ABSORÇÃO RADICULAR, TRANSPORTE E REDISTRIBUIÇÃO DE NUTRIENTES Prof. Volnei Pauletti Departamento de Solos e Engenharia Agrícola Mestrado em Ciência do Solo vpauletti@ufpr.br CONTATO NUTRIENTE - RAIZ Absorção
ABSORÇÃO RADICULAR, TRANSPORTE E REDISTRIBUIÇÃO DE NUTRIENTES
 ABSORÇÃO RADICULAR, TRANSPORTE E REDISTRIBUIÇÃO DE NUTRIENTES Prof. Volnei Pauletti Departamento de Solos e Engenharia Agrícola Mestrado em Ciência do Solo vpauletti@ufpr.br CONTATO NUTRIENTE - RAIZ DEFINIÇÕES
ABSORÇÃO RADICULAR, TRANSPORTE E REDISTRIBUIÇÃO DE NUTRIENTES Prof. Volnei Pauletti Departamento de Solos e Engenharia Agrícola Mestrado em Ciência do Solo vpauletti@ufpr.br CONTATO NUTRIENTE - RAIZ DEFINIÇÕES
1º Questão: Escreva a distribuição eletrônica dos elementos abaixo e determine o número de valência de cada elemento: a) Fe (26):.
 FOLHA DE EXERCÍCIOS CURSO: Otimizado ASS.: Exercícios de Conteúdo DISCIPLINA: Fundamentos de Química e Bioquímica NOME: TURMA: 1SAU 1º Questão: Escreva a distribuição eletrônica dos elementos abaixo e
FOLHA DE EXERCÍCIOS CURSO: Otimizado ASS.: Exercícios de Conteúdo DISCIPLINA: Fundamentos de Química e Bioquímica NOME: TURMA: 1SAU 1º Questão: Escreva a distribuição eletrônica dos elementos abaixo e
Ocorrência de reações
 Ocorrência de reações Dados: Força de ácidos e bases Classificação dos hidrácidos mais conhecidos: Regra prática para a classificação dos oxiácidos Determine a diferença (D) entre a quantidade de átomos
Ocorrência de reações Dados: Força de ácidos e bases Classificação dos hidrácidos mais conhecidos: Regra prática para a classificação dos oxiácidos Determine a diferença (D) entre a quantidade de átomos
Newton gostava de ler! 4ª Série Módulo II Pós sob investigação
 Newton gostava de ler! 4ª Série Módulo II Pós sob investigação Fábrica Centro Ciência Viva de Aveiro 14 janeiro 2014 Objetivos - Dinamização de uma sessão de leitura de excertos de um livro. - A partir
Newton gostava de ler! 4ª Série Módulo II Pós sob investigação Fábrica Centro Ciência Viva de Aveiro 14 janeiro 2014 Objetivos - Dinamização de uma sessão de leitura de excertos de um livro. - A partir
Faculdade Anhanguera de Campinas FAC 4
 Faculdade Anhanguera de Campinas FAC 4 Curso de Graduação em Educação Física Profa. Dra. Amabile Vessoni Arias E-mail: Amabile.arias@anhanguera.com 2016-2 Membrana plasmática = plasmalema É uma película
Faculdade Anhanguera de Campinas FAC 4 Curso de Graduação em Educação Física Profa. Dra. Amabile Vessoni Arias E-mail: Amabile.arias@anhanguera.com 2016-2 Membrana plasmática = plasmalema É uma película
COLÉGIO XIX DE MARÇO excelência em educação
 COLÉGIO XIX DE MARÇO excelência em educação 1ª PROVA PARCIAL DE BIOLOGIA Aluno(a): Nº Ano: 1º Turma: Data: 18/03/2011 Nota: Professora: Regina Volpato Valor da Prova: 40 pontos Assinatura do responsável:
COLÉGIO XIX DE MARÇO excelência em educação 1ª PROVA PARCIAL DE BIOLOGIA Aluno(a): Nº Ano: 1º Turma: Data: 18/03/2011 Nota: Professora: Regina Volpato Valor da Prova: 40 pontos Assinatura do responsável:
Propriedades Coligativas
 Propriedades Coligativas Propriedades Coligativas São propriedades que se somam pela presença de um ou mais solutos e dependem única e exclusivamente do número de partículas (moléculas ou íons) que estão
Propriedades Coligativas Propriedades Coligativas São propriedades que se somam pela presença de um ou mais solutos e dependem única e exclusivamente do número de partículas (moléculas ou íons) que estão
Equilíbrio Ácido-base
 Universidade Federal de Juiz de Fora Instituto de Ciências Exatas Departamento de Química Disciplina Química das Soluções QUI084 II semestre 2016 AULA 03 Equilíbrio Ácido-base Hidrólise de Sais Profa.
Universidade Federal de Juiz de Fora Instituto de Ciências Exatas Departamento de Química Disciplina Química das Soluções QUI084 II semestre 2016 AULA 03 Equilíbrio Ácido-base Hidrólise de Sais Profa.
BIOMEMBRANAS. M Filomena Botelho
 BIOMEMBRANAS M Filomena Botelho Transporte de massa Transporte de moléculas neutras Transporte de iões Noções de bioelectricidade Biomembranas Transporte de massa Transporte de massa ou transferência de
BIOMEMBRANAS M Filomena Botelho Transporte de massa Transporte de moléculas neutras Transporte de iões Noções de bioelectricidade Biomembranas Transporte de massa Transporte de massa ou transferência de
Resolução UNIFESP 2015
 Resolução UNIFESP 2015 1-Utilizando o aparato indicado na figura, certo volume de solução aquosa de sulfato de cobre(ii) hidratado foi colocado dentro do béquer. Quando o plugue foi conectado à tomada
Resolução UNIFESP 2015 1-Utilizando o aparato indicado na figura, certo volume de solução aquosa de sulfato de cobre(ii) hidratado foi colocado dentro do béquer. Quando o plugue foi conectado à tomada
Profº André Montillo
 Profº André Montillo www.montillo.com.br Definição: É uma Mistura Homogênia de 2 ou mais substâncias. Na Solução não ocorre uma reação química, porque não há formação de novas substâncias e não há alterações
Profº André Montillo www.montillo.com.br Definição: É uma Mistura Homogênia de 2 ou mais substâncias. Na Solução não ocorre uma reação química, porque não há formação de novas substâncias e não há alterações
Ao misturar acetona com bromo, na presença de ácido, ocorre a transformação representada pela equação química
 Questão 1 Ao misturar acetona com bromo, na presença de ácido, ocorre a transformação representada pela equação química Dentre as substâncias presentes nessa mistura, apenas o bromo possui cor e, quando
Questão 1 Ao misturar acetona com bromo, na presença de ácido, ocorre a transformação representada pela equação química Dentre as substâncias presentes nessa mistura, apenas o bromo possui cor e, quando
Identificação funções inorgânicas, ionização e dissociação, número de oxidação
 Identificação funções inorgânicas, ionização e dissociação, número de oxidação Várias teorias tentaram explicar o fato de algumas soluções conduzirem energia elétrica e outra não 1903 Arrhenius experiências
Identificação funções inorgânicas, ionização e dissociação, número de oxidação Várias teorias tentaram explicar o fato de algumas soluções conduzirem energia elétrica e outra não 1903 Arrhenius experiências
RELAÇÕES DE MASSA E MOL
 RELAÇÃO DE MASSA E MOL A relação entre massa e quantidade Em uma gota de água de 0,05 ml há 1,67 sextilhão (1,67 x 10 21 ) de moléculas de água. A relação entre massa e quantidade A unidade de massa atômica
RELAÇÃO DE MASSA E MOL A relação entre massa e quantidade Em uma gota de água de 0,05 ml há 1,67 sextilhão (1,67 x 10 21 ) de moléculas de água. A relação entre massa e quantidade A unidade de massa atômica
DATA: Nº de ordem GRAU: PROVA: TURMA MATRÍCULA: Estudo Independente
 FOLHA DE QUESTÕES CURSO: ASS.: Engenharia de Produção DISCIPLINA: NOME: Química Geral DATA: Nº de ordem GRAU: PROVA: TURMA MATRÍCULA: Estudo Independente 5PRD31A 01) O grupo de átomos que é encontrado
FOLHA DE QUESTÕES CURSO: ASS.: Engenharia de Produção DISCIPLINA: NOME: Química Geral DATA: Nº de ordem GRAU: PROVA: TURMA MATRÍCULA: Estudo Independente 5PRD31A 01) O grupo de átomos que é encontrado
Química C Semiextensivo V. 4
 Química C Semiextensivo V. Exercícios 01) E 02) B 0) D 0) C 05) B Quanto maior a constante ácida, maior a força do ácido (acidez). Assim, HF
Química C Semiextensivo V. Exercícios 01) E 02) B 0) D 0) C 05) B Quanto maior a constante ácida, maior a força do ácido (acidez). Assim, HF
INSTITUTO POLITÉCNICO DE TOMAR ESCOLA SUPERIOR DE TECNOLOGIA. Departamento de Engenharia Química e do Ambiente. QUÍMICA I (1º Ano/1º Semestre)
 INSTITUTO POLITÉCNICO DE TOMAR ESCOLA SUPERIOR DE TECNOLOGIA Departamento de Engenharia Química e do Ambiente QUÍMICA I (1º Ano/1º Semestre) 4ª Série de Exercícios EQUILÍBRIO QUÍMICO Tomar (2003) 1 Equilíbrio
INSTITUTO POLITÉCNICO DE TOMAR ESCOLA SUPERIOR DE TECNOLOGIA Departamento de Engenharia Química e do Ambiente QUÍMICA I (1º Ano/1º Semestre) 4ª Série de Exercícios EQUILÍBRIO QUÍMICO Tomar (2003) 1 Equilíbrio
ph SISTEMAS TAMPÕES Faculdade de Medicina PUC-Campinas Profa. Dra. Celene Fernandes Bernardes
 ph SISTEMAS TAMPÕES Faculdade de Medicina PUC-Campinas Profa. Dra. Celene Fernandes Bernardes ph = potencial hidrogeniônico ph = -log [H + ] Sorenson 1909 A escala de ph é logarítma; portanto, quando duas
ph SISTEMAS TAMPÕES Faculdade de Medicina PUC-Campinas Profa. Dra. Celene Fernandes Bernardes ph = potencial hidrogeniônico ph = -log [H + ] Sorenson 1909 A escala de ph é logarítma; portanto, quando duas
Laboratório de Análise Instrumental
 Laboratório de Análise Instrumental Prof. Renato Camargo Matos Tutora: Aparecida Maria http://www.ufjf.br/nupis PRÁTICA 8: Verificação da influência do ph na extração de Fe(III) com éter etílico Objetivo:
Laboratório de Análise Instrumental Prof. Renato Camargo Matos Tutora: Aparecida Maria http://www.ufjf.br/nupis PRÁTICA 8: Verificação da influência do ph na extração de Fe(III) com éter etílico Objetivo:
Atividade de Autoavaliação Recuperação 2 os anos Rodrigo ago/09
 Química Atividade de Autoavaliação Recuperação 2 os anos Rodrigo ago/09 Re Resolução 1. O carbeto de cálcio CaC 2 (s) (massa molar = 64 g mol 1 ), também conhecido como carbureto, pode ser obtido aquecendo-se
Química Atividade de Autoavaliação Recuperação 2 os anos Rodrigo ago/09 Re Resolução 1. O carbeto de cálcio CaC 2 (s) (massa molar = 64 g mol 1 ), também conhecido como carbureto, pode ser obtido aquecendo-se
CAPÍTULO 1 Quantidades e Unidades 1. CAPÍTULO 2 Massa Atômica e Molecular; Massa Molar 16. CAPÍTULO 3 O Cálculo de Fórmulas e de Composições 26
 Sumário CAPÍTULO 1 Quantidades e Unidades 1 Introdução 1 Os sistemas de medida 1 O Sistema Internacional de Unidades (SI) 1 A temperatura 2 Outras escalas de temperatura 3 O uso e o mau uso das unidades
Sumário CAPÍTULO 1 Quantidades e Unidades 1 Introdução 1 Os sistemas de medida 1 O Sistema Internacional de Unidades (SI) 1 A temperatura 2 Outras escalas de temperatura 3 O uso e o mau uso das unidades
Introdução aos métodos volumétricos de análise química
 LCE-190 Química Analítica Aplicada Introdução aos métodos volumétricos de análise química Wanessa Melchert Mattos Titulometria: inclui um grupo de métodos analíticos baseados na determinação da quantidade
LCE-190 Química Analítica Aplicada Introdução aos métodos volumétricos de análise química Wanessa Melchert Mattos Titulometria: inclui um grupo de métodos analíticos baseados na determinação da quantidade
Atividade prática Estudo das misturas: fases e componentes Parte 1
 Atividade prática Estudo das misturas: fases e componentes Parte 1 9º ano do Ensino Fundamental/1º ano do Ensino Médio Objetivo Vivenciar conceitos importantes sobre a classificação dos diversos tipos
Atividade prática Estudo das misturas: fases e componentes Parte 1 9º ano do Ensino Fundamental/1º ano do Ensino Médio Objetivo Vivenciar conceitos importantes sobre a classificação dos diversos tipos
PROVA DE QUÍMICA TABELA PERIÓDICA DOS ELEMENTOS
 PROVA DE QUÍMICA TABELA PERIÓDICA DOS ELEMENTOS FONTE: Tabela Periódica da IUPAC/versão 2005(adaptada). Acesso: http://www.iupac.org/reports/periodic_table/ 25 QUESTÃO 3 Analise este quadro, em que se
PROVA DE QUÍMICA TABELA PERIÓDICA DOS ELEMENTOS FONTE: Tabela Periódica da IUPAC/versão 2005(adaptada). Acesso: http://www.iupac.org/reports/periodic_table/ 25 QUESTÃO 3 Analise este quadro, em que se
Aula de Bioquímica I. Tema: Água. Prof. Dr. Júlio César Borges
 Aula de Bioquímica I Tema: Água Prof. Dr. Júlio César Borges Depto. de Química e Física Molecular DQFM Instituto de Química de São Carlos IQSC Universidade de São Paulo USP E-mail: borgesjc@iqsc.usp.br
Aula de Bioquímica I Tema: Água Prof. Dr. Júlio César Borges Depto. de Química e Física Molecular DQFM Instituto de Química de São Carlos IQSC Universidade de São Paulo USP E-mail: borgesjc@iqsc.usp.br
Ciclo Respiratório Normal. Como Respiramos? Prova de Função Pulmonar. Que diz a espirometria? Espirômetro. Sensível ao volume.
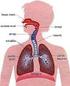 Ciclo Respiratório Normal Como Respiramos? Prova de Função Pulmonar Que diz a espirometria? Espirômetro Sensível ao volume Sensível ao fluxo 1 FEV1 / FVC % Visão Geral da Hematose O índice espirométrico
Ciclo Respiratório Normal Como Respiramos? Prova de Função Pulmonar Que diz a espirometria? Espirômetro Sensível ao volume Sensível ao fluxo 1 FEV1 / FVC % Visão Geral da Hematose O índice espirométrico
QUÍMICA - 2 o ANO MÓDULO 19 EQUILÍBRIO IÔNICO - PARTE 1
 QUÍMICA - 2 o ANO MÓDULO 19 EQUILÍBRIO IÔNICO - PARTE 1 H O 2 + H + 2 - H - 2 O + 2 - H + - H O 2 2 + H + - Como pode cair no enem (PUC) A tabela abaixo se refere a dados de forças relativas de ácidos
QUÍMICA - 2 o ANO MÓDULO 19 EQUILÍBRIO IÔNICO - PARTE 1 H O 2 + H + 2 - H - 2 O + 2 - H + - H O 2 2 + H + - Como pode cair no enem (PUC) A tabela abaixo se refere a dados de forças relativas de ácidos
BIOELETROGÊNESE. Capacidade de gerar e alterar a diferença de potencial elétrico através da membrana. - Neurônios. esqueléticas lisas cardíacas
 BIOELETROGÊNESE Capacidade de gerar e alterar a diferença de potencial elétrico através da membrana - Neurônios - células musculares esqueléticas lisas cardíacas Membrana citoplasmática Os neurônios geram
BIOELETROGÊNESE Capacidade de gerar e alterar a diferença de potencial elétrico através da membrana - Neurônios - células musculares esqueléticas lisas cardíacas Membrana citoplasmática Os neurônios geram
Citologia (membrana e citoplasma):
 Aula 01 Citologia (membrana e citoplasma): Passagem de soluto (geralmente um gás) do meio mais concentrado para o menos concentrado. Processo comum nos alvéolos pulmonares (hematose). A Membrana Plasmática
Aula 01 Citologia (membrana e citoplasma): Passagem de soluto (geralmente um gás) do meio mais concentrado para o menos concentrado. Processo comum nos alvéolos pulmonares (hematose). A Membrana Plasmática
QUI219 QUÍMICA ANALÍTICA (Farmácia) Prof. Mauricio X. Coutrim
 QUI219 QUÍMICA ANALÍTICA (Farmácia) Prof. Mauricio X. Coutrim (mcoutrim@iceb.ufop.br) SOLUÇÃO TAMPÃO Tampão Ácido Qual o ph de uma solução de ácido fórmico 1,00.10-1 mol.l -1 e formiato de sódio 1,00 mol.l
QUI219 QUÍMICA ANALÍTICA (Farmácia) Prof. Mauricio X. Coutrim (mcoutrim@iceb.ufop.br) SOLUÇÃO TAMPÃO Tampão Ácido Qual o ph de uma solução de ácido fórmico 1,00.10-1 mol.l -1 e formiato de sódio 1,00 mol.l
DISCIPLINA DE QUÍMICA
 DISCIPLINA DE QUÍMICA OBJETIVOS: 1ª série Traduzir linguagens químicas em linguagens discursivas e linguagem discursiva em outras linguagens usadas em Química tais como gráficos, tabelas e relações matemáticas,
DISCIPLINA DE QUÍMICA OBJETIVOS: 1ª série Traduzir linguagens químicas em linguagens discursivas e linguagem discursiva em outras linguagens usadas em Química tais como gráficos, tabelas e relações matemáticas,
Lista de Exercício. Professor: Cassio Pacheco Disciplina: Química 2 Ano Data de entrega: 04/03/2016. Concentração Comum
 Professor: Cassio Pacheco Disciplina: Química 2 Ano Data de entrega: 04/03/2016 Lista de Exercício Concentração Comum 1- Num balão volumétrico de 250 ml adicionam-se 2,0g de sulfato de amônio sólido; o
Professor: Cassio Pacheco Disciplina: Química 2 Ano Data de entrega: 04/03/2016 Lista de Exercício Concentração Comum 1- Num balão volumétrico de 250 ml adicionam-se 2,0g de sulfato de amônio sólido; o
Introdução. Uma mistura éconstituída por duas ou mais substâncias puras, sejam simples ou compostas MISTURA
 SOLUÇÕES Introdução MISTURA MISTURA HETEROGÊNEA Uma mistura éconstituída por duas ou mais substâncias puras, sejam simples ou compostas A mistura seráheterogênea quando apresentar duas ou mais fases perceptíveis.
SOLUÇÕES Introdução MISTURA MISTURA HETEROGÊNEA Uma mistura éconstituída por duas ou mais substâncias puras, sejam simples ou compostas A mistura seráheterogênea quando apresentar duas ou mais fases perceptíveis.
PRÁTICA 07: PADRONIZAÇÃO DE SOLUÇÕES
 PRÁTICA 07: PADRONIZAÇÃO DE SOLUÇÕES 1- INTRODUÇÃO Análise volumétrica refere-se a todo procedimento no qual o volume de um reagente necessário para reagir com um constituinte em análise é medido. - Em
PRÁTICA 07: PADRONIZAÇÃO DE SOLUÇÕES 1- INTRODUÇÃO Análise volumétrica refere-se a todo procedimento no qual o volume de um reagente necessário para reagir com um constituinte em análise é medido. - Em
Conceito de ph ph = - Log [H + ] Aumento [H + ] => diminuição do ph => acidose Diminuição [H + ] => aumento do ph => alcalose Alterações são dependent
![Conceito de ph ph = - Log [H + ] Aumento [H + ] => diminuição do ph => acidose Diminuição [H + ] => aumento do ph => alcalose Alterações são dependent Conceito de ph ph = - Log [H + ] Aumento [H + ] => diminuição do ph => acidose Diminuição [H + ] => aumento do ph => alcalose Alterações são dependent](/thumbs/50/27125458.jpg) Equilíbrio ácido-básico A concentração de H no FEC é mantida dentro de um limite extremamente estreito: 40 nmol/l = 1.000.000 menor que a Concentração dos outros íons!! [H] tem profundo efeito nos eventos
Equilíbrio ácido-básico A concentração de H no FEC é mantida dentro de um limite extremamente estreito: 40 nmol/l = 1.000.000 menor que a Concentração dos outros íons!! [H] tem profundo efeito nos eventos
Aprender a preparar soluções aquosas, realizar diluições e determinar suas concentrações.
 EXPERIMENTO 2 Preparação e Padronização de Soluções OBJETIVOS Rever os conceitos de concentração de soluções. Aprender a preparar soluções aquosas, realizar diluições e determinar suas concentrações. Exercitar
EXPERIMENTO 2 Preparação e Padronização de Soluções OBJETIVOS Rever os conceitos de concentração de soluções. Aprender a preparar soluções aquosas, realizar diluições e determinar suas concentrações. Exercitar
Química Fascículo 06 Elisabeth Pontes Araújo Elizabeth Loureiro Zink José Ricardo Lemes de Almeida
 Química Fascículo 06 Elisabeth Pontes Araújo Elizabeth Loureiro Zink José Ricardo Lemes de Almeida Índice Soluções...1 Exercícios... 5 Gabarito...7 Soluções Unidades de Concentração Concentração é determinada
Química Fascículo 06 Elisabeth Pontes Araújo Elizabeth Loureiro Zink José Ricardo Lemes de Almeida Índice Soluções...1 Exercícios... 5 Gabarito...7 Soluções Unidades de Concentração Concentração é determinada
DURAÇÃO DA PROVA: 03 HORAS
 DURAÇÃO DA PROVA: 03 HORAS PROCESSO SELETIVO 2016/2 - CPS PROVA DISCURSIVA DE QUÍMICA CURSO DE GRADUAÇÃO EM MEDICINA INSTRUÇÕES: 1. Só abra a prova quando autorizado. 2. Veja se este caderno contém 5 (cinco)
DURAÇÃO DA PROVA: 03 HORAS PROCESSO SELETIVO 2016/2 - CPS PROVA DISCURSIVA DE QUÍMICA CURSO DE GRADUAÇÃO EM MEDICINA INSTRUÇÕES: 1. Só abra a prova quando autorizado. 2. Veja se este caderno contém 5 (cinco)
Nome do(a) candidato(a):
 Universidade Federal do Rio Grande do Norte Instituto de Química Programa de Pós Graduação em Química Concurso para Entrada no Curso de Mestrado/Doutorado do PPGQ UFRN 2016.2 Instruções 1. Não identifique
Universidade Federal do Rio Grande do Norte Instituto de Química Programa de Pós Graduação em Química Concurso para Entrada no Curso de Mestrado/Doutorado do PPGQ UFRN 2016.2 Instruções 1. Não identifique
O movimento da água e dos solutos nas plantas
 O movimento da água e dos solutos nas plantas A água Princípios do movimento da Água O movimento da água em qualquer sistema é governado por 3 processos: Difusão Osmose Fluxo de massa; Osmose glicose Membrana
O movimento da água e dos solutos nas plantas A água Princípios do movimento da Água O movimento da água em qualquer sistema é governado por 3 processos: Difusão Osmose Fluxo de massa; Osmose glicose Membrana
20 Não se fazem mais nobres como antigamente pelo menos na Química. (Folha de S. Paulo, ). As descobertas de compostos como o XePtF 6
 20 Não se fazem mais nobres como antigamente pelo menos na Química. (Folha de S. Paulo, 17.08.2000). As descobertas de compostos como o XePtF 6, em 1962, e o HArF, recentemente obtido, contrariam a crença
20 Não se fazem mais nobres como antigamente pelo menos na Química. (Folha de S. Paulo, 17.08.2000). As descobertas de compostos como o XePtF 6, em 1962, e o HArF, recentemente obtido, contrariam a crença
LABORATÓRIO DE QUÍMICA QUI126 1ª LISTA DE EXERCÍCIOS
 1. Soluções básicas servem para a dissolução de gorduras sólidas que obstruem tubulações das cozinhas. O hidróxido de sódio é um exemplo, pois reage com gorduras e gera produtos solúveis. Qual a massa
1. Soluções básicas servem para a dissolução de gorduras sólidas que obstruem tubulações das cozinhas. O hidróxido de sódio é um exemplo, pois reage com gorduras e gera produtos solúveis. Qual a massa
Aulão de Química. Química Geral Professor: Eduardo Ulisses
 Aulão de Química Química Geral Professor: Eduardo Ulisses Substâncias e Misturas Substância é qualquer parte da matéria que possui propriedades constantes. As substâncias podem ser classificadas como sendo
Aulão de Química Química Geral Professor: Eduardo Ulisses Substâncias e Misturas Substância é qualquer parte da matéria que possui propriedades constantes. As substâncias podem ser classificadas como sendo
SOLUÇÕES E CONCENTRAÇÃO
 1. (Uerj 2016) Para diferenciar os hidrocarbonetos etano e eteno em uma mistura gasosa, utiliza-se uma reação com bromo molecular: o etano não reage com esse composto, enquanto o eteno reage de acordo
1. (Uerj 2016) Para diferenciar os hidrocarbonetos etano e eteno em uma mistura gasosa, utiliza-se uma reação com bromo molecular: o etano não reage com esse composto, enquanto o eteno reage de acordo
CPV seu pé direito também na Medicina
 seu pé direito também na Medicina UNIFESP 17/dezembro/2010 QUÍMICA 06. Ligas metálicas são comuns no cotidiano e muito utilizadas nas indústrias automobilística, aeronáutica, eletrônica e na construção
seu pé direito também na Medicina UNIFESP 17/dezembro/2010 QUÍMICA 06. Ligas metálicas são comuns no cotidiano e muito utilizadas nas indústrias automobilística, aeronáutica, eletrônica e na construção
Química FUVEST ETAPA. Resposta QUESTÃO 1 QUESTÃO 2
 Química FUVEST QUESTÃO 1 Em uma aula de laboratório de Química, a professora propôs a realização da eletrólise da água. Após a montagem de uma aparelhagem como a da figura a seguir, e antes de iniciar
Química FUVEST QUESTÃO 1 Em uma aula de laboratório de Química, a professora propôs a realização da eletrólise da água. Após a montagem de uma aparelhagem como a da figura a seguir, e antes de iniciar
Vamos iniciar o estudo da unidade fundamental que constitui todos os organismos vivos: a célula.
 Aula 01 Composição química de uma célula O que é uma célula? Vamos iniciar o estudo da unidade fundamental que constitui todos os organismos vivos: a célula. Toda célula possui a capacidade de crescer,
Aula 01 Composição química de uma célula O que é uma célula? Vamos iniciar o estudo da unidade fundamental que constitui todos os organismos vivos: a célula. Toda célula possui a capacidade de crescer,
REAGENTES H 2 C N CH 2 CH 2 N CH 2
 PRÁTICA 2 DETERMINAÇÃ DE CÁLCI EM LEITE Metodologia de análise: Volumetria de Complexação MATERIAIS Bureta de 25 ml Béquer 100 e 250 ml Erlenmeyer de 250 ml Proveta de 50 ml Balão volumétrico 100 ml Pipetas
PRÁTICA 2 DETERMINAÇÃ DE CÁLCI EM LEITE Metodologia de análise: Volumetria de Complexação MATERIAIS Bureta de 25 ml Béquer 100 e 250 ml Erlenmeyer de 250 ml Proveta de 50 ml Balão volumétrico 100 ml Pipetas
Resolução de Química UFRGS / 2012
 26. Resposta C Resolução de Química UFRGS / 2012 Água super-resfriada é água líquida em temperatura abaixo do seu ponto de congelamento. Geralmente ocorre num resfriamento lento e sem agitação onde qualquer
26. Resposta C Resolução de Química UFRGS / 2012 Água super-resfriada é água líquida em temperatura abaixo do seu ponto de congelamento. Geralmente ocorre num resfriamento lento e sem agitação onde qualquer
2 ª Fase Exame Discursivo
 02/12/2007 2 ª Fase Exame Discursivo química Caderno de prova Este caderno, com doze páginas numeradas seqüencialmente, contém dez questões de Química. A tabela periódica está na página 12. Não abra o
02/12/2007 2 ª Fase Exame Discursivo química Caderno de prova Este caderno, com doze páginas numeradas seqüencialmente, contém dez questões de Química. A tabela periódica está na página 12. Não abra o
SOLUÇÕES - SOLUÇÃO IDEAL E AS PROPRIEDADES COLIGATIVAS
 ESCOLA DE ENGENHARIA DE LORENA EEL/USP TERMODINÂMICA QUÍMICA PROF. ANTONIO CARLOS DA SILVA SOLUÇÕES - SOLUÇÃO IDEAL E AS PROPRIEDADES COLIGATIVAS 1. TIPOS DE SOLUÇÕES Solução é uma mistura homogênea de
ESCOLA DE ENGENHARIA DE LORENA EEL/USP TERMODINÂMICA QUÍMICA PROF. ANTONIO CARLOS DA SILVA SOLUÇÕES - SOLUÇÃO IDEAL E AS PROPRIEDADES COLIGATIVAS 1. TIPOS DE SOLUÇÕES Solução é uma mistura homogênea de
P4 - PROVA DE QUÍMICA GERAL 30/11/13
 P4 - PROVA DE QUÍMICA GERAL 30//3 Nome: Nº de Matrícula: GABARITO Turma: Assinatura: Questão Valor Grau Revisão a 2,5 2 a 2,5 3 a 2,5 4 a 2,5 Total 0,0 Constantes e equações: F = 96500 C mol - 273,5 K
P4 - PROVA DE QUÍMICA GERAL 30//3 Nome: Nº de Matrícula: GABARITO Turma: Assinatura: Questão Valor Grau Revisão a 2,5 2 a 2,5 3 a 2,5 4 a 2,5 Total 0,0 Constantes e equações: F = 96500 C mol - 273,5 K
Introdução à Análise Química QUI semestre 2011 Profa. Maria Auxiliadora Costa Matos TITULOMETRIA DE PRECIPITAÇÃO
 Introdução à Análise Química QUI 094 2 semestre 2011 Profa. Maria Auxiliadora Costa Matos TITULOMETRIA DE PRECIPITAÇÃO 1 TITULOMETRIA DE PRECIPITAÇÃO Volumetria de precipitação envolve a titulação com
Introdução à Análise Química QUI 094 2 semestre 2011 Profa. Maria Auxiliadora Costa Matos TITULOMETRIA DE PRECIPITAÇÃO 1 TITULOMETRIA DE PRECIPITAÇÃO Volumetria de precipitação envolve a titulação com
Experiência 2. DETERMINAÇÃO DO PONTO DE FUSÃO DE SUBSTÂNCIAS
 Experiência 2. DETERMINAÇÃO DO PONTO DE FUSÃO DE SUBSTÂNCIAS 1. Objetivos Ao final desta atividade experimental espera-se que o aluno seja capaz de: - Identificar compostos e determinar suas purezas usando
Experiência 2. DETERMINAÇÃO DO PONTO DE FUSÃO DE SUBSTÂNCIAS 1. Objetivos Ao final desta atividade experimental espera-se que o aluno seja capaz de: - Identificar compostos e determinar suas purezas usando
BIOQUÍMICA II SISTEMAS TAMPÃO NOS ORGANISMOS ANIMAIS 3/1/2012
 BIOQUÍMICA II Professora: Ms. Renata Fontes Medicina Veterinária 3º Período O conteúdo de Bioquímica II utiliza os conhecimentos adquiridos referentes ao estudo do metabolismo celular e fenômenos físicos
BIOQUÍMICA II Professora: Ms. Renata Fontes Medicina Veterinária 3º Período O conteúdo de Bioquímica II utiliza os conhecimentos adquiridos referentes ao estudo do metabolismo celular e fenômenos físicos
4- Lista de exercícios
 4- Lista de exercícios 1) Qual o princípio químico por trás da expressão semelhante dissolve semelhante? Um bom solvente consegue interagir com o soluto e vencer as interações entre soluto-soluto. Podemos
4- Lista de exercícios 1) Qual o princípio químico por trás da expressão semelhante dissolve semelhante? Um bom solvente consegue interagir com o soluto e vencer as interações entre soluto-soluto. Podemos
FISIOLOGIA E TRANSPORTE ATRAVÉS DA MEMBRANA CELULAR
 FISIOLOGIA E TRANSPORTE ATRAVÉS DA MEMBRANA CELULAR AULA 2 DISCIPLINA: FISIOLOGIA I PROFESSOR RESPONSÁVEL: FLÁVIA SANTOS Membrana Celular ou Membrana Plasmática Função 2 Membrana Celular ou Membrana Plasmática
FISIOLOGIA E TRANSPORTE ATRAVÉS DA MEMBRANA CELULAR AULA 2 DISCIPLINA: FISIOLOGIA I PROFESSOR RESPONSÁVEL: FLÁVIA SANTOS Membrana Celular ou Membrana Plasmática Função 2 Membrana Celular ou Membrana Plasmática
Figura 1: Potencial químico de um solvente na presença de um soluto.
 Propriedades Coligativas 1. Introdução Algumas propriedades do solvente mudam quando um soluto é dissolvido nele para formar uma solução. O ponto de congelamento da água salgada, por exemplo, é menor que
Propriedades Coligativas 1. Introdução Algumas propriedades do solvente mudam quando um soluto é dissolvido nele para formar uma solução. O ponto de congelamento da água salgada, por exemplo, é menor que
P4 - PROVA DE QUÍMICA GERAL - 03/12/05
 P4 - PROVA DE QUÍMICA GERAL - 03//05 Nome: GABARITO Nº de Matrícula: Turma: Assinatura: Questão Valor Grau Revisão a,5 a,5 3 a,5 4 a,5 Total 0,0 Constantes e equações: R = 0,08 atm L mol - K - = 8,34 J
P4 - PROVA DE QUÍMICA GERAL - 03//05 Nome: GABARITO Nº de Matrícula: Turma: Assinatura: Questão Valor Grau Revisão a,5 a,5 3 a,5 4 a,5 Total 0,0 Constantes e equações: R = 0,08 atm L mol - K - = 8,34 J
Questão 10: Sobre as moléculas de CO 2 e SO 2, cujas estruturas estão representadas a seguir, é CORRETO afirmar que: S O O C O
 QUESTÕES OBJETIVAS Questão 9: Nitrogênio e fósforo são elementos essenciais para a nutrição das plantas e por isso alguns de seus compostos são utilizados na maioria dos fertilizantes. Sobre esses elementos
QUESTÕES OBJETIVAS Questão 9: Nitrogênio e fósforo são elementos essenciais para a nutrição das plantas e por isso alguns de seus compostos são utilizados na maioria dos fertilizantes. Sobre esses elementos
Experiência 02 - SOLUBILIDADE SOLUBILIDADE
 1. Objetivos SOLUBILIDADE No final dessa experiência, o aluno deverá ser capaz de: - Identificar algumas variáveis que afetam a solubilidade. - Utilizar técnicas simples de separação de misturas. 2. Introdução
1. Objetivos SOLUBILIDADE No final dessa experiência, o aluno deverá ser capaz de: - Identificar algumas variáveis que afetam a solubilidade. - Utilizar técnicas simples de separação de misturas. 2. Introdução
Transporte Iônico e o Potencial de Membrana
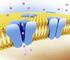 Transporte Iônico e o Potencial de Membrana Até o momento, consideramos apenas o transporte de solutos neutros (sem carga elétrica) através da membrana celular. A partir de agora, vamos passar a estudar
Transporte Iônico e o Potencial de Membrana Até o momento, consideramos apenas o transporte de solutos neutros (sem carga elétrica) através da membrana celular. A partir de agora, vamos passar a estudar
DILUIÇÃO DE SOLUÇÕES. É o processo que consiste em adicionar solvente puro a uma solução, com o objetivo de diminuir sua concentração SOLVENTE PURO
 DILUIÇÃO DE SOLUÇÕES É o processo que consiste em adicionar solvente puro a uma solução, com o objetivo de diminuir sua concentração SOLVENTE PURO SOLUÇÃO INICIAL SOLUÇÃO FINAL SOLVENTE PURO VA V V C C
DILUIÇÃO DE SOLUÇÕES É o processo que consiste em adicionar solvente puro a uma solução, com o objetivo de diminuir sua concentração SOLVENTE PURO SOLUÇÃO INICIAL SOLUÇÃO FINAL SOLVENTE PURO VA V V C C
RESOLUÇÃO DE EXERCÍCIOS PROPOSTOS AULA 10 TURMA ANUAL
 RESOLUÇÃO DE EXERCÍCIOS PROPOSTOS AULA 10 TURMA ANUAL 01. Item B I Correto. A energia para quebrar a ligação H F (568 kj/mol) é a maior da tabela. Isto torna mais difícil a sua quebra, portanto ionizando
RESOLUÇÃO DE EXERCÍCIOS PROPOSTOS AULA 10 TURMA ANUAL 01. Item B I Correto. A energia para quebrar a ligação H F (568 kj/mol) é a maior da tabela. Isto torna mais difícil a sua quebra, portanto ionizando
Cromatografia Iônica. Alexandre Martins Fernandes Orientador: Prof. Jefferson Mortatti. Novembro 2006.
 Cromatografia Iônica Alexandre Martins Fernandes Orientador: Prof. Jefferson Mortatti Novembro 2006. Roteiro 1. O que é troca iônica. 2. Cromatografia iônica. 3. Dionex ICS-90. 4. Vantagens. 5. Desvantagens.
Cromatografia Iônica Alexandre Martins Fernandes Orientador: Prof. Jefferson Mortatti Novembro 2006. Roteiro 1. O que é troca iônica. 2. Cromatografia iônica. 3. Dionex ICS-90. 4. Vantagens. 5. Desvantagens.
5ª LISTA - EXERCÍCIOS DE PROVAS Lei de Raoult
 Pg. 1/6 1 a Questão Metanol, CH 4 O, e etanol, C 2 H 6 O, são dois álcoois voláteis a 25 C. Ambos podem ser usados como solvente ou combustível e muitas vezes a mistura dos dois é empregada em processos
Pg. 1/6 1 a Questão Metanol, CH 4 O, e etanol, C 2 H 6 O, são dois álcoois voláteis a 25 C. Ambos podem ser usados como solvente ou combustível e muitas vezes a mistura dos dois é empregada em processos
Eletrólise é a parte da eletroquímica que estuda a transformação de energia elétrica em energia química. ENERGIA
 AULA 19 ELETRÓLISE Eletrólise é a parte da eletroquímica que estuda a transformação de energia elétrica em energia química. ENERGIA não espontâneo ELÉTRICA ENERGIA QUÍMICA A eletrólise é um processo não
AULA 19 ELETRÓLISE Eletrólise é a parte da eletroquímica que estuda a transformação de energia elétrica em energia química. ENERGIA não espontâneo ELÉTRICA ENERGIA QUÍMICA A eletrólise é um processo não
INTERAÇÕES INTERMOLECULARES
 INTERAÇÕES INTERMOLECULARES Serão abordados: as forças íon-dipolo, dipolo-dipolo, dispersão de London e ligação de hidrogênio e a relação entre propriedade física e interação intermolecular. As partículas
INTERAÇÕES INTERMOLECULARES Serão abordados: as forças íon-dipolo, dipolo-dipolo, dispersão de London e ligação de hidrogênio e a relação entre propriedade física e interação intermolecular. As partículas
EXAME DE SELEÇÃO PARA O PROGRAMA DE PÓS-GRADUAÇÃO EM QUÍMICA DA UNIVERSIDADE FEDERAL DO CEARÁ (PPGQ-UFC) /2012.1
 Universidade Federal do Ceará Centro de Ciências Programa de Pós-Graduação em Química Caixa Postal 12.200 -- Tel. (085) 3366. 9981 FAX 3366.9978 CEP - 60.450-970 - Fortaleza - Ceará - Brasil EXAME DE SELEÇÃO
Universidade Federal do Ceará Centro de Ciências Programa de Pós-Graduação em Química Caixa Postal 12.200 -- Tel. (085) 3366. 9981 FAX 3366.9978 CEP - 60.450-970 - Fortaleza - Ceará - Brasil EXAME DE SELEÇÃO
3ª Série / Vestibular. As equações (I) e (II), acima, representam reações que podem ocorrer na formação do H 2SO 4. É correto afirmar que, na reação:
 3ª Série / Vestibular 01. I _ 2SO 2(g) + O 2(g) 2SO 3(g) II _ SO 3(g) + H 2O(l) H 2SO 4(ag) As equações (I) e (II), acima, representam reações que podem ocorrer na formação do H 2SO 4. É correto afirmar
3ª Série / Vestibular 01. I _ 2SO 2(g) + O 2(g) 2SO 3(g) II _ SO 3(g) + H 2O(l) H 2SO 4(ag) As equações (I) e (II), acima, representam reações que podem ocorrer na formação do H 2SO 4. É correto afirmar
Resposta: D Resolução comentada: Ci x Vi = Cf x Vf Ci = 0,5 mol/l Cf = 0,15 mol/l Vf = 250 ml Vi = 0,5 x Vi = 0,15 x 250 Vi = 75 ml.
 Unesp 1-Em 2013 comemora-se o centenário do modelo atômico proposto pelo físico dinamarquês Niels Bohr para o átomo de hidrogênio, o qual incorporou o conceito de quantização da energia, possibilitando
Unesp 1-Em 2013 comemora-se o centenário do modelo atômico proposto pelo físico dinamarquês Niels Bohr para o átomo de hidrogênio, o qual incorporou o conceito de quantização da energia, possibilitando
PLANEJAMENTO ANUAL / TRIMESTRAL 2014 Conteúdos/ atividades Habilidades Avaliação/ Atividade 1º Trimestre: (12 semanas)
 Disciplina: Química Trimestre: 1º Professor(a): Rodrigo Valério e Georgia Monique. Série: 1º Turmas: 101,102,103,104. Conteúdos/ atividades Habilidades Avaliação/ Atividade 1º Trimestre: (12 semanas) 1-
Disciplina: Química Trimestre: 1º Professor(a): Rodrigo Valério e Georgia Monique. Série: 1º Turmas: 101,102,103,104. Conteúdos/ atividades Habilidades Avaliação/ Atividade 1º Trimestre: (12 semanas) 1-
1ª QUESTÃO Valor 1,0 = 1. Dados: índice de refração do ar: n 2. massa específica da cortiça: 200 kg/m 3. 1 of :36
 1ª QUESTÃO Valor 1,0 Uma lâmpada é colocada no fundo de um recipiente com líquido, diretamente abaixo do centro de um cubo de cortiça de 10 cm de lado que flutua no líquido. Sabendo que o índice de refração
1ª QUESTÃO Valor 1,0 Uma lâmpada é colocada no fundo de um recipiente com líquido, diretamente abaixo do centro de um cubo de cortiça de 10 cm de lado que flutua no líquido. Sabendo que o índice de refração
P4 PROVA DE QUÍMICA GERAL 02/12/08
 P4 PROVA DE QUÍMICA GERAL 0/1/08 Nome: Nº de Matrícula: GABARITO Turma: Assinatura: Questão Valor Grau Revisão 1 a,5 a,5 3 a,5 4 a,5 Total 10,0 Constantes e equações: R = 0,08 atm L mol -1 K -1 = 8,314
P4 PROVA DE QUÍMICA GERAL 0/1/08 Nome: Nº de Matrícula: GABARITO Turma: Assinatura: Questão Valor Grau Revisão 1 a,5 a,5 3 a,5 4 a,5 Total 10,0 Constantes e equações: R = 0,08 atm L mol -1 K -1 = 8,314
Experiência nº 8: Titulações Ácido-Base
 Experiência nº 8: Titulações Ácido-Base 1. Questões de estudo - Como determinar com precisão a concentração de uma solução (ácida ou básica)? Explique detalhadamente. - Como determinar experimentalmente
Experiência nº 8: Titulações Ácido-Base 1. Questões de estudo - Como determinar com precisão a concentração de uma solução (ácida ou básica)? Explique detalhadamente. - Como determinar experimentalmente
Funções das glicoproteínas e proteínas da membrana :
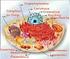 Funções das glicoproteínas e proteínas da membrana : 1- UNE ALGUMAS CÉLULAS ÀS OUTRAS (junção celular) muito importante em tecidos como a pele e os vasos sanguíneos 2- FUNCIONAM COMO RECEPTORES > para
Funções das glicoproteínas e proteínas da membrana : 1- UNE ALGUMAS CÉLULAS ÀS OUTRAS (junção celular) muito importante em tecidos como a pele e os vasos sanguíneos 2- FUNCIONAM COMO RECEPTORES > para
