MEMBRANA DE DONNAN. M Filomena Botelho
|
|
|
- Heitor Sintra Álvares
- 6 Há anos
- Visualizações:
Transcrição
1 EBRANA DE DONNAN Filomena Botelho
2 embrana de Donnan Do mesmo modo que para os outros tipos de membranas, também neste caso da membrana de Donnan temos que impor condições Condições impostas ao sistema Trabalhamos no equilíbrio embrana semi-permeável A membrana separa 2 soluções com características diferentes: De um lado a solução tem exclusivamente componentes iónicos difusíveis através da membrana Do outro lado a solução contém Componente iónico difusível Componente iónico não difusível através da membrana Não existe movimento de solvente Consegue-se exercendo uma pressão, no compartimento que tem o componente não difusível de modo a igualar a pressão osmótica uso de um êmbolo
3 Consideremos 2 recipientes, separados por uma membrana semi-permeável I I [NaCl] = n [NaCl] = n Inicialmente Igual concentração de cloreto de sódio (NaCl) dos dois recipientes equilíbrio Quando o NaCl se dissocia, fica igual a concentração de cada ião nos dois recipientes A concentração seria então de n
4 I Quando o equilíbrio é atingido, a diferença de potencial entre os dois lados da membrana, para cada ião, é dada pela equação de Nernst Para o caso do sódio: Para o caso do cloro: φ Don (Na+) = RT ln F [Na + ] 2 [Na + ] 1 φ Don (Cl-) = RT ln F [Cl - ] 1 [Cl - ] 2 Inversão, porque para o caso do Cl -, o Z=-1
5 I Para o caso do sódio: φ Don (Na+) = RT ln F [Na + ] 2 [Na + ] 1 Para o caso do cloro: φ Don (Cl-) = RT ln Como: F pressão e temperatura constantes diferença de potencial para cada ião igual no equilíbrio RT/F constante [Cl - ] 1 [Cl - ] 2 Os cocientes entre as concentrações têm que ser iguais [Na + ] 2 [Cl - ] 1 φ Don (Na+) = φ Don (Cl-) = [Na + ] 1 [Cl - ] 2 Equação de Gibbs Donnan
6 Posteriormente Adiciona-se ao compartimento I um sal sódico de uma proteína de modo a que fique com uma concentração de P mol/cm 3 Após se ter adicionado o proteinato ao recipiente I, é necessário exercer-se sobre este compartimento uma pressão de modo a que a corrente de água, devida à diferença de pressão osmótica entre os dois recipientes, se verifique. I [NaP] = P Quando se adiciona ao recipiente I o componente não difusível (a proteína) as concentrações dos dois recipientes, logo no início, antes de ser atingido o equilíbrio, são diferentes
7 Por causa do êmbolo I [NaP] = P não pode haver movimentos de solvente Uma vez adicionado o proteinato, este dissocia-se em dois componentes: - um difusível (Na + ) - outro não difusível (proteína) existência de um componente não difusível (proteina) I vão ocorrer movimentos de pequenos iões (componentes difusíveis) através da membrana Atingir novo equilíbrio [P Zp ] = P [Na + ] = PxZp - x - x + x + x
8 Após o equilíbrio, as concentrações nos dois recipientes serão: I Zp valência da proteína [P Zp ] = P [Na + ] = PxZp - x - x + x + x Como novo equilíbrio foi atingido, podemos aplicar a equação de Gibbs-Donnan [Na + ] 2 [Cl - ] 1 = [Na + ] 1 [Cl - ] 2 [Na + ] 1 [Cl - ] 1 = [Na + ] 2 [Cl - ] 2 No equilíbrio os produtos das concentrações do ião difusíveis, para cada recipiente, é igual
9 I [P Zp ] = P [Na + ] = PxZp - x - x + x + x Após a adição da proteína e devido à electroneutralidade que tem que ser mantida nos dois recipientes, as concentrações ficam do seguinte modo: No compartimento No compartimento I [Na + ] 2 [Cl - ] 2 Têm que ser iguais [Na + ] 1 = [Cl - ] 1 + P Zp
10 I No compartimento [P Zp ] = P [Na + ] = PxZp [Na + ] 2 [Cl - ] 2 Têm que ser iguais - x - x + x + x No compartimento I [Na + ] 1 = [Cl - ] 1 + P Zp Sendo assim, vem que: [Na + ] 1 > [Cl - ] 1 [Na + ] 2 [Cl - ] 1 = [Na + ] 1 [Cl - ] 2 [Na + ] 2 = [Cl - ] 2 [Cl - ] 2 > [Cl - ] 1 [Na + ] 1 [Cl - ] 1 = [Cl - ] 2 2 [Na + ] 1 > [Cl - ] 1
11 I Voltando à equação de Gibbs-Donnan: [P Zp ] = P [Na + ] = PxZp - x - x + x + x [Na + ] 2 [Cl - ] 1 = [Na + ] 1 [Cl - ] 2 [Na + ] 1 [Cl - ] 1 = [Na + ] 2 [Cl - ] 2 Resolvendo em ordem a [Na + ] 1, e como [Na + ] 2 = [Cl - ] 2, vem: [Na + ] 1 [Cl - ] 1 = [Na + ] 2 2 Como: [Na + ] 1 = [Cl - ] 1 + P.Zp [Cl - ] 1 = [Na + ] 1 - P.Zp vem: [Na + ] 1 {[Na + ] 1 - P.Zp} = [Na + ] 2 2
12 [Na + ] 1 {[Na + ] 1 - P.Zp} = [Na + ] 2 2 Continuando a resolver em ordem a [Na + ] 1, vem: [Na + ] 2 1 -P.Zp[Na + ] 1 -[Na + ] 2 2 = 0 x 2 b x c (P.Zp) [Na + ] 2 2 [Na + ] 1 = P.Zp ± 2 - Como a 2ª parcela do numerador é menor do que a primeira, uma das raízes é negativa; - Só nos interessa a solução positiva, já que a concentração de [Na + ] 1 tem que ser um valor positivo
13 Podemos então, na equação do potencial de Donnan, substituir o valor de [Na + ] 1, aparecendo: φ Don (Na+) = RT [Na + ] ln 2 = - F [Na + ] 1 RT F ln [Na + ] 1 [Na + ] 2 RT P 2.Zp [Na + ] 2 2 φ Don (Na+) = - ln P.Zp ± F 2. [Na + ] 2 Equação do potencial de Donnan, quando se mistura um componente não difusível num compartimento (neste caso no I)
14 RT P 2.Zp [Na + ] 2 2 φ Don (Na+) = - ln P.Zp ± F 2. [Na + ] 2 A partir desta equação podemos ver que: a) Se [P. Zp] = 0 φ Donnan = 0 O potencial de Donnan é nulo i.é. Para que este tipo de potencial possa existir, é necessário haver iões para os quais a membrana seja impermeável b) Se [P. Zp] 0 φ Donnan 0 Neste caso estabelece-se uma diferença de potencial através da membrana
15 Se quisermos saber qual a quantidade de iões que atravessam a membrana, podemos resolver de outra maneira Vamos supor o mesmo esquema anterior, onde dois recipientes contendo igual concentração de [NaCl] se encontram separados por uma membrana semi-permeável I Podemos então considerar que a concentração inicial de cada ião, é n I [NaP] = P Num dos lados da membrana (por exemplo no recipiente I) adicionamos um componente ionizável mas não difusível
16 Deste modo temos: Lado I: [P] = P Zp [Na + ] = PxZp - x - x Lado : + x + x [Na + ] 1 = n x + P. Zp Número de moléculas de proteína em solução Número de cargas negativas com que cada molécula de proteína ionizada fica em solução Número de moléculas proteicas negativas em solução, devidas à dissociação das proteínas
17 I [P Zp ] = P [Na + ] = PxZp Do mesmo modo pela equação de Gibbs-Donnan: [Na + ] 1 [Cl - ] 1 = [Na + ] 2 [Cl - ] 2 - x - x + x + x Substituindo: (n x + P. Zp) (n x) = (n + x) 2 Desta equação, podemos tirar duas conclusões: 1ª n + x = (n x + P. Zp) (n x) n + x média geométrica das concentrações dos microiões existentes no recipiente
18 (n x + P.Zp) (n x) = (n + x) 2 2ª Resolvendo esta equação, vem: n 2 nx nx + x 2 + n P.Zp x P.Zp = n nx + x 2-4 nx + n P.Zp x P.Zp = 0 x (4 n P.Zp) = n P.Zp n P.Zp x = (4 n + P.Zp) Número de iões que passam a membrana, para se obter o equilíbrio, depois de se adicionar a proteína
19 I [P Zp ] = P [Na + ] = PxZp - x + x Tudo se passa como se os: acroiões P repelissem os iões do mesmo sinal para o outro lado da membrana e atraíssem os iões de sinal oposto - x + x Cálculo das concentrações totais dos pequenos iões Lado I: Lado : C I = [Cl - ] 1 + [Na + ] 1 C I = n x + n x + P.Zp C I = 2n 2x + P.Zp C = [Cl - ] 2 + [Na + ] 2 C = n + x + n + x C = 2n + 2x
20 I Lado I: [P Zp ] = P [Na + ] = PxZp - x - x + x + x C I = 2n 2x + P.Zp Lado : C I = 2n + 2x A diferença entre as 2 concentrações é: d = C I -C = 2n 2x + P.Zp -2n -2x d = 4x + P.Zp
21 Diferença entre as 2 concentrações d = 4x + P.Zp n P.Zp d = 4 + P.Zp (4 n + P.Zp) como: n P.Zp x = (4 n + P.Zp) P d = 2.Zp 2 = C I -C 4 n + P.Zp Diferença de concentrações em termos de microiões Esta diferença tem um valor positivo, isto é: A concentração iónica dos pequenos d > 0 C I > C iões do lado I é maior do que a concentração iónica do lado, onde não há macroiões
22 Esta diferença tem um valor positivo, isto é: A concentração iónica dos pequenos d > 0 C I > C iões do lado I é maior do que a concentração iónica do lado, onde não há macroiões Significado: Há um certo número de pequenos iões que não atravessam a membrana, correspondendo d = C I -C a partículas não difusíveis Desta maneira, há pequenos iões que se comportam como macroiões
23 as as partículas não difusíveis não são só estas. Há ainda, no recipiente I, a proteína. A concentração total de partículas não difusíveis são: P p + d = P + 2.Zp 2 4 n + P.Zp
24 Pressões osmóticas As pressões osmóticas dos dois comportamentos, estão relacionadas com as concentrações totais π = RT C Recipiente I: π I = RT C I C I = n x + P.Zp + n x + P C I = 2n 2x + P.Zp + P Recipiente : π = RT C C = n + x + n + x C = 2n + 2x π I = RT (2n 2x + P.Zp + P) π I = RT (2n + 2x)
25 π = RT C π = RT (p + d) P 2.Zp π = RT ( 2 ) 4 n + P.Zp ou π = RT (2n 2x + P.Zp + P - 2n - 2x) π = RT ( 4x + P.Zp + P)
MEMBRANA DE DONNAN. Objectivos
 MEMBRANA DE DONNAN M ilomena Botelho Objectivos Compreender o modelo de membrana de Donnan Compreender a equação de GibbsDonnan Explicar as diferenças de pressão osmótica existentes 1 Membrana de Donnan
MEMBRANA DE DONNAN M ilomena Botelho Objectivos Compreender o modelo de membrana de Donnan Compreender a equação de GibbsDonnan Explicar as diferenças de pressão osmótica existentes 1 Membrana de Donnan
EQUILÍBRIO IÓNICO E POTENCIAIS DE REPOUSO DAS MEMBRANAS. M Filomena Botelho
 EQUILÍBRIO IÓNICO E POTENCIAIS DE REPOUSO DAS MEMBRANAS M ilomena Botelho Potenciais de repouso das membranas O equilíbrio de Donnan não explica o potencial de repouso das células nervosas e musculares,
EQUILÍBRIO IÓNICO E POTENCIAIS DE REPOUSO DAS MEMBRANAS M ilomena Botelho Potenciais de repouso das membranas O equilíbrio de Donnan não explica o potencial de repouso das células nervosas e musculares,
ULTRAFILTRAÇÃO. M Filomena Botelho
 ULTRAFILTRAÇÃO M Filomena Botelho Ultrafiltração renal A ultrafiltração renal, é uma situação muito importante, dependente dos movimentos do solvente Processo de filtração glomerular no rim, com formação
ULTRAFILTRAÇÃO M Filomena Botelho Ultrafiltração renal A ultrafiltração renal, é uma situação muito importante, dependente dos movimentos do solvente Processo de filtração glomerular no rim, com formação
16/03/2017. A difusão é um movimento de moléculas que depende de sua própria energia e que tende a deslocá-las de
 A difusão é um movimento de moléculas que depende de sua própria energia e que tende a deslocá-las de um local de MAIOR concentração para um de menor concentração (i.e. a favor do gradiente de concentração).
A difusão é um movimento de moléculas que depende de sua própria energia e que tende a deslocá-las de um local de MAIOR concentração para um de menor concentração (i.e. a favor do gradiente de concentração).
POTENCIAL DE REPOUSO
 POTENCIAL DE REPOUSO Mário Gomes Marques Instituto de Fisiologia 1 POTENCIAL DE REPOUSO Os potenciais eléctricos através das membranas existem em virtualmente todas as células do nosso organismo Algumas
POTENCIAL DE REPOUSO Mário Gomes Marques Instituto de Fisiologia 1 POTENCIAL DE REPOUSO Os potenciais eléctricos através das membranas existem em virtualmente todas as células do nosso organismo Algumas
Bioeletrogênese-Origens do potencial de membrana. Prof. Ricardo M. Leão. FMRP-USP
 Bioeletrogênese-Origens do potencial de membrana Prof. Ricardo M. Leão. FMRP-USP Origens do potencial de repouso Todas as células apresentam uma diferença de potencial elétrico (voltagem) através da membrana.
Bioeletrogênese-Origens do potencial de membrana Prof. Ricardo M. Leão. FMRP-USP Origens do potencial de repouso Todas as células apresentam uma diferença de potencial elétrico (voltagem) através da membrana.
BIOMEMBRANAS. M Filomena Botelho
 BIOMEMBRANAS M Filomena Botelho Transporte de massa Transporte de moléculas neutras Transporte de iões Noções de bioelectricidade Biomembranas Transporte de massa Transporte de massa ou transferência de
BIOMEMBRANAS M Filomena Botelho Transporte de massa Transporte de moléculas neutras Transporte de iões Noções de bioelectricidade Biomembranas Transporte de massa Transporte de massa ou transferência de
AULA 3. Tratamento Sistemático do Equilíbrio Químico
 AULA Tratamento Sistemático do Equilíbrio Químico Objetivos Escrever as equações químicas que descrevem as reações químicas. Escrever as expressões de constante de equilíbrio para as reações químicas.
AULA Tratamento Sistemático do Equilíbrio Químico Objetivos Escrever as equações químicas que descrevem as reações químicas. Escrever as expressões de constante de equilíbrio para as reações químicas.
Para compreender o conceito de reacção de precipitação é necessário considerar as noções básicas de dissolução e de solubilidade de sais em água.
 PRECIPITAÇÃO SELECTIVA INTRODUÇÃO Para compreender o conceito de reacção de precipitação é necessário considerar as noções básicas de dissolução e de solubilidade de sais em água. O fenómeno de dissolução
PRECIPITAÇÃO SELECTIVA INTRODUÇÃO Para compreender o conceito de reacção de precipitação é necessário considerar as noções básicas de dissolução e de solubilidade de sais em água. O fenómeno de dissolução
Profª Eleonora Slide de aula. Revisão: Termodinâmica e Bioenergética
 Revisão: Termodinâmica e Bioenergética Revisão:Termodinâmica As leis da termodinâmica governam o comportamento de s bioquímicos As leis da termodinâmica são princípios gerais aplicados a todos os processos
Revisão: Termodinâmica e Bioenergética Revisão:Termodinâmica As leis da termodinâmica governam o comportamento de s bioquímicos As leis da termodinâmica são princípios gerais aplicados a todos os processos
Para compreender o conceito de reacção de precipitação é necessário considerar as noções básicas de dissolução e de solubilidade de sais em água.
 ESTUDO DA SOLUBILIDADE DO ACETATO DE PRATA INTRODUÇÃO Para compreender o conceito de reacção de precipitação é necessário considerar as noções básicas de dissolução e de solubilidade de sais em água. O
ESTUDO DA SOLUBILIDADE DO ACETATO DE PRATA INTRODUÇÃO Para compreender o conceito de reacção de precipitação é necessário considerar as noções básicas de dissolução e de solubilidade de sais em água. O
Físico-Química I. Profa. Dra. Carla Dalmolin. Misturas Simples. Físico-Química, cap. 5: Transformações Físicas de Substâncias Puras
 Físico-Química I Profa. Dra. Carla Dalmolin Misturas Simples Físico-Química, cap. 5: Transformações Físicas de Substâncias Puras Misturas Simples Misturas de substâncias que não reagem Modelo simples para
Físico-Química I Profa. Dra. Carla Dalmolin Misturas Simples Físico-Química, cap. 5: Transformações Físicas de Substâncias Puras Misturas Simples Misturas de substâncias que não reagem Modelo simples para
P3 - PROVA DE QUÍMICA GERAL - 18/06/05
 P3 - PROVA DE QUÍMICA GERAL - 18/06/05 Nome: Nº de Matrícula: (Gabarito) Turma: Assinatura: Questão Valor Grau Revisão 1 a,0 a,0 3 a,0 4 a,0 5 a,0 Total 10,0 Constantes K w [H + ] [OH - ] 1,0 x 10-14 a
P3 - PROVA DE QUÍMICA GERAL - 18/06/05 Nome: Nº de Matrícula: (Gabarito) Turma: Assinatura: Questão Valor Grau Revisão 1 a,0 a,0 3 a,0 4 a,0 5 a,0 Total 10,0 Constantes K w [H + ] [OH - ] 1,0 x 10-14 a
PROPRIEDADES COLIGATIVAS DAS SOLUÇõES
 PROPRIEDADES COLIGATIVAS DAS SOLUÇõES Propriedades coligativas são propriedades de uma solução que dependem exclusivamente do número de partículas do soluto dissolvido e não da sua natureza. Cada uma dessas
PROPRIEDADES COLIGATIVAS DAS SOLUÇõES Propriedades coligativas são propriedades de uma solução que dependem exclusivamente do número de partículas do soluto dissolvido e não da sua natureza. Cada uma dessas
Volume de um gás em um pistão
 Universidade de Brasília Departamento de Matemática Cálculo Volume de um gás em um pistão Suponha que um gás é mantido a uma temperatura constante em um pistão. À medida que o pistão é comprimido, o volume
Universidade de Brasília Departamento de Matemática Cálculo Volume de um gás em um pistão Suponha que um gás é mantido a uma temperatura constante em um pistão. À medida que o pistão é comprimido, o volume
Papiro 01 QUÍMICA. 1ª QUESTÃO Valor 1,0. 2ª QUESTÃO Valor 1,0
 Papiro 01 QUÍMICA 1ª QUESTÃO Valor 1,0 2ª QUESTÃO Valor 1,0 Cloreto de sulfurila, SO 2 Cl 2, se decompõe em fase gasosa, produzindo SO 2(g) e Cl 2(g). A concentração do SO 2 Cl 2, foi acompanhada em uma
Papiro 01 QUÍMICA 1ª QUESTÃO Valor 1,0 2ª QUESTÃO Valor 1,0 Cloreto de sulfurila, SO 2 Cl 2, se decompõe em fase gasosa, produzindo SO 2(g) e Cl 2(g). A concentração do SO 2 Cl 2, foi acompanhada em uma
Equilíbrio Químico Folha 2.1 Prof.: João Roberto Mazzei
 01. A cisteína é um aminoácido que contém enxofre e é encontrada na feijoada, devido às proteínas da carne e derivados. A reação de conversão da cisteína em cistina ocorre de acordo com a seguinte equação
01. A cisteína é um aminoácido que contém enxofre e é encontrada na feijoada, devido às proteínas da carne e derivados. A reação de conversão da cisteína em cistina ocorre de acordo com a seguinte equação
3. Solubilidade de sais pouco solúveis.
 3. Solubilidade de sais pouco solúveis. Suponhamos que temos um recipiente com uma dada quantidade de água que mantemos a uma temperatura constante de, por exemplo, 25 C. Suponhamos também que vamos adicionando
3. Solubilidade de sais pouco solúveis. Suponhamos que temos um recipiente com uma dada quantidade de água que mantemos a uma temperatura constante de, por exemplo, 25 C. Suponhamos também que vamos adicionando
Métodos de Determinação da Massa Molar. Fábio Herbst Florenzano
 Métodos de Determinação da Massa Molar Fábio Herbst Florenzano Importância da Massa Molar Média A maioria das propriedades mecânicas, termomecânicas, reológicas e outras dependem da massa molar média.
Métodos de Determinação da Massa Molar Fábio Herbst Florenzano Importância da Massa Molar Média A maioria das propriedades mecânicas, termomecânicas, reológicas e outras dependem da massa molar média.
CONSELHO REGIONAL DE QUÍMICA - IV REGIÃO (SP)
 CONSELHO REGIONAL DE QUÍMICA - IV REGIÃO (SP) Medição de ph e íons por potenciometria Ministrante: Nilton Pereira Alves Quimlab Química Contatos: nilton@quimlab.com.br Apoio São José dos Campos, 29 de
CONSELHO REGIONAL DE QUÍMICA - IV REGIÃO (SP) Medição de ph e íons por potenciometria Ministrante: Nilton Pereira Alves Quimlab Química Contatos: nilton@quimlab.com.br Apoio São José dos Campos, 29 de
7ª LISTA - EXERCÍCIOS DE PROVAS Equilíbrio ácido-base. 2,10 x 10-4
 Pg. 1/8 1 a Questão A tabela abaixo apresenta os valores das constantes de basicidade, K b, a 25 C, para diferentes espécies em solução aquosa. Espécies K b CH 3 C - 5,60 x 10-10 CN - 2,50 x 10-5 C 3 2-2,10
Pg. 1/8 1 a Questão A tabela abaixo apresenta os valores das constantes de basicidade, K b, a 25 C, para diferentes espécies em solução aquosa. Espécies K b CH 3 C - 5,60 x 10-10 CN - 2,50 x 10-5 C 3 2-2,10
Fisiologia I. Como é que se gera um potencial de repouso?
 Fisiologia I Data: 9 de Novembro de 2007 (8ª aula) Docente: Prof. Mário Marques Desgravado por: Micaela Caixeiro; Carla Pereira; Margarida Cunha Tema: Potencial de Membrana; Potencial de Repouso Como é
Fisiologia I Data: 9 de Novembro de 2007 (8ª aula) Docente: Prof. Mário Marques Desgravado por: Micaela Caixeiro; Carla Pereira; Margarida Cunha Tema: Potencial de Membrana; Potencial de Repouso Como é
CÉLULAS GALVÂNICAS OU CÉLULAS ELECTROQUÍMICAS
 CÉLULAS GALVÂNICAS OU CÉLULAS ELECTROQUÍMICAS Uma CÉLULA ELECTROQUÍMICA é um dispositivo que permite a conversão de energia química em energia eléctrica através de reacções de oxidação-redução que ocorrem
CÉLULAS GALVÂNICAS OU CÉLULAS ELECTROQUÍMICAS Uma CÉLULA ELECTROQUÍMICA é um dispositivo que permite a conversão de energia química em energia eléctrica através de reacções de oxidação-redução que ocorrem
CONSTANTE DE EQUILÍBRIO
 EQUILÍBRIO QUÍMICO CONSTANTE DE EQUILÍBRIO A maneira de descrever a posição de equilíbrio de uma reação química é dar as concentrações de equilíbrio dos reagentes e produtos. A expressão da constante de
EQUILÍBRIO QUÍMICO CONSTANTE DE EQUILÍBRIO A maneira de descrever a posição de equilíbrio de uma reação química é dar as concentrações de equilíbrio dos reagentes e produtos. A expressão da constante de
Equilíbrio de solubilidade
 Equilíbrio de solubilidade Solubilidade É a quantidade máxima de soluto que se pode dissolver numa certa quantidade de solvente, a uma dada temperatura e pressão. Solubilidade se sais em água: Regra geral
Equilíbrio de solubilidade Solubilidade É a quantidade máxima de soluto que se pode dissolver numa certa quantidade de solvente, a uma dada temperatura e pressão. Solubilidade se sais em água: Regra geral
Gás Ideal (1) PMT2305 Físico-Química para Metalurgia e Materiais I César Yuji Narita e Neusa Alonso-Falleiros 2012
 Gás Ideal (1) Para um gás, uma equação de estado é uma relação entre pressão (P), volume (V), temperatura (T) e composição ou número de mols (n). O primeiro passo para a determinação de uma equação de
Gás Ideal (1) Para um gás, uma equação de estado é uma relação entre pressão (P), volume (V), temperatura (T) e composição ou número de mols (n). O primeiro passo para a determinação de uma equação de
Curso Satélite de. Matemática. Sessão n.º 1. Universidade Portucalense
 Curso Satélite de Matemática Sessão n.º 1 Universidade Portucalense Conceitos Algébricos Propriedades das operações de números reais Considerem-se três números reais quaisquer, a, b e c. 1. A adição de
Curso Satélite de Matemática Sessão n.º 1 Universidade Portucalense Conceitos Algébricos Propriedades das operações de números reais Considerem-se três números reais quaisquer, a, b e c. 1. A adição de
E S T U D O D E U M E L É C T R O D O S E L E T I V O D E I Ã O N I T R A T O
 E S T U D O D E U M E L É C T R O D O S E L E T I V O D E I Ã O N I T R A T O OBJETIVO Pretende-se com este trabalho experimental que os alunos avaliem as características de um eléctrodo sensível a ião
E S T U D O D E U M E L É C T R O D O S E L E T I V O D E I Ã O N I T R A T O OBJETIVO Pretende-se com este trabalho experimental que os alunos avaliem as características de um eléctrodo sensível a ião
3ª Série / Vestibular. As equações (I) e (II), acima, representam reações que podem ocorrer na formação do H 2SO 4. É correto afirmar que, na reação:
 3ª Série / Vestibular 01. I _ 2SO 2(g) + O 2(g) 2SO 3(g) II _ SO 3(g) + H 2O(l) H 2SO 4(ag) As equações (I) e (II), acima, representam reações que podem ocorrer na formação do H 2SO 4. É correto afirmar
3ª Série / Vestibular 01. I _ 2SO 2(g) + O 2(g) 2SO 3(g) II _ SO 3(g) + H 2O(l) H 2SO 4(ag) As equações (I) e (II), acima, representam reações que podem ocorrer na formação do H 2SO 4. É correto afirmar
Equilíbrio de Precipitação
 Capítulo 4 Equilíbrio de Precipitação Prof a Alessandra Smaniotto QMC 5325 - Química Analítica Curso de Graduação em Farmácia Turmas 02102A e 02102B Introdução Os equilíbrios ácido -base são exemplos de
Capítulo 4 Equilíbrio de Precipitação Prof a Alessandra Smaniotto QMC 5325 - Química Analítica Curso de Graduação em Farmácia Turmas 02102A e 02102B Introdução Os equilíbrios ácido -base são exemplos de
Propriedades coligativas
 Propriedas coligativas Resposta da questão 1: Adição 1,0 mol Na 2 SO 4 a 1 L água (experimento A): + 2 1 Na2SO4 2Na + 1SO 4 3 mols partículas A partir da tabela percebe-se que: Volume Soluto água (L) 1
Propriedas coligativas Resposta da questão 1: Adição 1,0 mol Na 2 SO 4 a 1 L água (experimento A): + 2 1 Na2SO4 2Na + 1SO 4 3 mols partículas A partir da tabela percebe-se que: Volume Soluto água (L) 1
Difusão: Osmose Tônus Aplicação: Diálise T É C N I C A S B Á S I C A S D E L A B O R A T Ó R I O B I O M E D I C I N A U F R J M A I O
 Difusão: Osmose Tônus Aplicação: Diálise T É C N I C A S B Á S I C A S D E L A B O R A T Ó R I O B I O M E D I C I N A U F R J M A I O 2 0 1 0 Difusão Movimento de componentes de uma mistura qualquer,
Difusão: Osmose Tônus Aplicação: Diálise T É C N I C A S B Á S I C A S D E L A B O R A T Ó R I O B I O M E D I C I N A U F R J M A I O 2 0 1 0 Difusão Movimento de componentes de uma mistura qualquer,
Nome do(a) candidato(a):
 Universidade Federal do Rio Grande do Norte Instituto de Química Programa de Pós Graduação em Química Concurso para Entrada no Curso de Mestrado/Doutorado do PPGQ UFRN 2016.2 Instruções 1. Não identifique
Universidade Federal do Rio Grande do Norte Instituto de Química Programa de Pós Graduação em Química Concurso para Entrada no Curso de Mestrado/Doutorado do PPGQ UFRN 2016.2 Instruções 1. Não identifique
ESCOLA SECUNDÁRIA DE MONSERRATE
 ESCOLA SECUNDÁRIA DE MONSERRATE F.Q. A 2º ANO EQUILÍBRIO QUÍMICO 1. Para ocorrer uma situação de equilíbrio num sistema são necessárias, pelo menos, duas das condições seguintes: A Todos os reagentes se
ESCOLA SECUNDÁRIA DE MONSERRATE F.Q. A 2º ANO EQUILÍBRIO QUÍMICO 1. Para ocorrer uma situação de equilíbrio num sistema são necessárias, pelo menos, duas das condições seguintes: A Todos os reagentes se
A Ligação Iônica ou Eletrovalente
 A Ligação Iônica ou Eletrovalente Formação de pares iônicos As substâncias sólidas podem ser formadas por átomos, moléculas, macromoléculas, ou seja, por partículas eletricamente neutras ou por íons dispostos
A Ligação Iônica ou Eletrovalente Formação de pares iônicos As substâncias sólidas podem ser formadas por átomos, moléculas, macromoléculas, ou seja, por partículas eletricamente neutras ou por íons dispostos
Química Geral e Experimental II Equilíbrio químico Resolução comentada de exercícios selecionados versão equilíbrio_v1_2005 Prof. Fabricio R.
 Química Geral e Experimental II Equilíbrio químico comentada de exercícios selecionados versão equilíbrio_v1_2005 Prof. Fabricio R. Sensato 1) A constante de equilíbrio K c da reação: H 2 (g) + Cl 2 (g)
Química Geral e Experimental II Equilíbrio químico comentada de exercícios selecionados versão equilíbrio_v1_2005 Prof. Fabricio R. Sensato 1) A constante de equilíbrio K c da reação: H 2 (g) + Cl 2 (g)
Capítulo III. Coeficientes de Actividade
 Capítulo Coeficientes de Actividade Fundamentals of Analytical Chemistry D. A. Skoog, D. M. West and F. J. Holler, Saunders College Publishing 7 th Edition onic Equilibrium A Mathematical Approach Butler,
Capítulo Coeficientes de Actividade Fundamentals of Analytical Chemistry D. A. Skoog, D. M. West and F. J. Holler, Saunders College Publishing 7 th Edition onic Equilibrium A Mathematical Approach Butler,
3ª Série / Vestibular _ TD 08 _ 19 de abril
 3ª Série / Vestibular _ TD 08 _ 19 de abril 21. As células caracterizam-se por possuir uma membrana plasmática, separando o meio intracelular do meio extracelular. A manutenção da integridade dessa membrana
3ª Série / Vestibular _ TD 08 _ 19 de abril 21. As células caracterizam-se por possuir uma membrana plasmática, separando o meio intracelular do meio extracelular. A manutenção da integridade dessa membrana
Físico-Química II Termodinâmica de Soluções
 Físico-Química II Termodinâmica de Soluções Este material está disponível no endereço: https://sites.google.com/site/otavioquimica/ Programa da Disciplina: Conteúdo CONTEÚDO Transformações Físicas (Substâncias
Físico-Química II Termodinâmica de Soluções Este material está disponível no endereço: https://sites.google.com/site/otavioquimica/ Programa da Disciplina: Conteúdo CONTEÚDO Transformações Físicas (Substâncias
INSTITUTO POLITÉCNICO DE TOMAR ESCOLA SUPERIOR DE TECNOLOGIA. Departamento de Engenharia Química e do Ambiente. QUÍMICA I (1º Ano/1º Semestre)
 INSTITUTO POLITÉCNICO DE TOMAR ESCOLA SUPERIOR DE TECNOLOGIA Departamento de Engenharia Química e do Ambiente QUÍMICA I (1º Ano/1º Semestre) 4ª Série de Exercícios EQUILÍBRIO QUÍMICO Tomar (2003) 1 Equilíbrio
INSTITUTO POLITÉCNICO DE TOMAR ESCOLA SUPERIOR DE TECNOLOGIA Departamento de Engenharia Química e do Ambiente QUÍMICA I (1º Ano/1º Semestre) 4ª Série de Exercícios EQUILÍBRIO QUÍMICO Tomar (2003) 1 Equilíbrio
Composição de Funções
 Composição de Funções Existem muitas situações em que uma função depende de uma variável que, por sua vez, depende de outra, e assim por diante. Podemos dizer, por exemplo, que a concentração de monóxido
Composição de Funções Existem muitas situações em que uma função depende de uma variável que, por sua vez, depende de outra, e assim por diante. Podemos dizer, por exemplo, que a concentração de monóxido
Termodinâmica Aplicada. (PF: comunicar eventuais erros para Exercícios 6
 Termodinâmica Aplicada (PF: comunicar eventuais erros para pmmiranda@fc.ul.pt) Exercícios 6 1. Um mole de um gás de van der Waals sofre uma expansão isotérmica (à temperatura ) entre um volume inicial
Termodinâmica Aplicada (PF: comunicar eventuais erros para pmmiranda@fc.ul.pt) Exercícios 6 1. Um mole de um gás de van der Waals sofre uma expansão isotérmica (à temperatura ) entre um volume inicial
TERMODINÂMICA QUÍMICA
 TERMODINÂMICA QUÍMICA Processos Espontâneos 1ª Lei da termodinâmica: Energia de um sistema é conservada ΔE = variação da energia interna q = calor absorvido pelo sistema w = trabalho realizado pela vizinhança
TERMODINÂMICA QUÍMICA Processos Espontâneos 1ª Lei da termodinâmica: Energia de um sistema é conservada ΔE = variação da energia interna q = calor absorvido pelo sistema w = trabalho realizado pela vizinhança
Disciplina de BIOQUÍMICA do Ciclo Básico de MEDICINA Universidade dos Açores 1º Ano ENSINO PRÁTICO 4ª AULA PRÁTICA
 Disciplina de BIOQUÍMICA do Ciclo Básico de MEDICINA Universidade dos Açores 1º Ano ENSINO PRÁTICO 4ª AULA PRÁTICA CONCEITO DE SOLUÇÕES TAMPÃO, ph E pk 1. Conceito de soluções tampão (ph e pk) 2. Principais
Disciplina de BIOQUÍMICA do Ciclo Básico de MEDICINA Universidade dos Açores 1º Ano ENSINO PRÁTICO 4ª AULA PRÁTICA CONCEITO DE SOLUÇÕES TAMPÃO, ph E pk 1. Conceito de soluções tampão (ph e pk) 2. Principais
O processo de dissolução
 SOLUBILIDADE Sabemos que um soluto altera as propriedades do solvente. Solução sólida: silício dopado com fósforo eletrônica. indústria Sal sobre o gelo abaixa o ponto e congelamento se a temperatura é
SOLUBILIDADE Sabemos que um soluto altera as propriedades do solvente. Solução sólida: silício dopado com fósforo eletrônica. indústria Sal sobre o gelo abaixa o ponto e congelamento se a temperatura é
EQUAÇÕES BIQUADRADAS
 EQUAÇÕES BIQUADRADAS Acredito que só pelo nome dar pra você ter uma idéia de como seja uma equação biquadrada, Se um time é campeão duas vezes, dizemos ele é bicampeão, se uma equação é do grau quando
EQUAÇÕES BIQUADRADAS Acredito que só pelo nome dar pra você ter uma idéia de como seja uma equação biquadrada, Se um time é campeão duas vezes, dizemos ele é bicampeão, se uma equação é do grau quando
Introdução à Bioquímica
 Introdução à Bioquímica Água Dra. Fernanda Canduri Laboratório de Sistemas BioMoleculares. Departamento de Física. UNESP São José do Rio Preto. SP. A água é fundamental para os seres vivos, atua como solvente
Introdução à Bioquímica Água Dra. Fernanda Canduri Laboratório de Sistemas BioMoleculares. Departamento de Física. UNESP São José do Rio Preto. SP. A água é fundamental para os seres vivos, atua como solvente
SISTEMAS DE COMPOSIÇÃO VARIÁVEL EQUILÍBRIO QUÍMICO
 ESCOLA DE ENGENHARIA DE LORENA EEL/USP TERMODINÂMICA QUÍMICA PROF. ANTONIO CARLOS DA SILVA SISTEMAS DE COMPOSIÇÃO VARIÁVEL EQUILÍBRIO QUÍMICO 1. EQUAÇÃO FUNDAMENTAL DA ENERGIA DE GIBBS Para uma substância
ESCOLA DE ENGENHARIA DE LORENA EEL/USP TERMODINÂMICA QUÍMICA PROF. ANTONIO CARLOS DA SILVA SISTEMAS DE COMPOSIÇÃO VARIÁVEL EQUILÍBRIO QUÍMICO 1. EQUAÇÃO FUNDAMENTAL DA ENERGIA DE GIBBS Para uma substância
Função das Membranas Celulares. 5_Transporte Activo Transmembranar
 Licenciatura em Engenharia Biomédica Luís Martinho do Rosário [Depto. de Bioquímica / FCTUC] Função das Membranas Celulares 5_Transporte Activo Transmembranar EQUILÍBRIO DE DONNAN i K + K + o volume constante
Licenciatura em Engenharia Biomédica Luís Martinho do Rosário [Depto. de Bioquímica / FCTUC] Função das Membranas Celulares 5_Transporte Activo Transmembranar EQUILÍBRIO DE DONNAN i K + K + o volume constante
8ª LISTA - EXERCÍCIOS DE PROVAS Equilíbrio de Solubilidade
 Pg. 1/6 1 a Questão De acordo com as equações abaixo, a 25 ºC, faça o que se pede. BaF 2 (s) Ba 2+ (aq) + 2F - (aq) K ps (BaF 2 ) = 1,7 x 10-6 BaSO 4 (s) Ba 2+ (aq) + SO 2-4 (aq) K ps (BaSO 4 ) = 1,0 x
Pg. 1/6 1 a Questão De acordo com as equações abaixo, a 25 ºC, faça o que se pede. BaF 2 (s) Ba 2+ (aq) + 2F - (aq) K ps (BaF 2 ) = 1,7 x 10-6 BaSO 4 (s) Ba 2+ (aq) + SO 2-4 (aq) K ps (BaSO 4 ) = 1,0 x
Transporte Iônico e o Potencial de Membrana
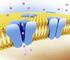 Transporte Iônico e o Potencial de Membrana Até o momento, consideramos apenas o transporte de solutos neutros (sem carga elétrica) através da membrana celular. A partir de agora, vamos passar a estudar
Transporte Iônico e o Potencial de Membrana Até o momento, consideramos apenas o transporte de solutos neutros (sem carga elétrica) através da membrana celular. A partir de agora, vamos passar a estudar
O gráfico abaixo representa a pressão de vapor, em atm, em função da temperatura, em ºC, de três amostras, I, II e III.
 Educador: Cristina Disciplina:Química Data: _/ /2011 Estudante: 3ª Série Questão 1 O gráfico abaixo representa a pressão de vapor, em atm, em função da temperatura, em ºC, de três amostras, I, II e III.
Educador: Cristina Disciplina:Química Data: _/ /2011 Estudante: 3ª Série Questão 1 O gráfico abaixo representa a pressão de vapor, em atm, em função da temperatura, em ºC, de três amostras, I, II e III.
algébrica das variações de entalpia de outras reacções químicas cujas equações, depois de somadas, dão a equação inicial.
 Ciclos de Born Haber Um CicIo de Born-Haber é um ciclo que estabelece relações entre várias grandezas termodinâmicas e que se baseia na lei de Hess a variação de entalpia de uma dada reacção é independente
Ciclos de Born Haber Um CicIo de Born-Haber é um ciclo que estabelece relações entre várias grandezas termodinâmicas e que se baseia na lei de Hess a variação de entalpia de uma dada reacção é independente
CÉLULAS QUAL CÉLULA É ANIMAL E QUAL É A VEGETAL?
 CÉLULAS QUAL CÉLULA É ANIMAL E QUAL É A VEGETAL? CÉLULAS EUCARIÓTICAS E PROCARIÓTICAS Organismos constituídos por células procarióticas: Bactérias e cianobácterias. Organismos constituídos por células
CÉLULAS QUAL CÉLULA É ANIMAL E QUAL É A VEGETAL? CÉLULAS EUCARIÓTICAS E PROCARIÓTICAS Organismos constituídos por células procarióticas: Bactérias e cianobácterias. Organismos constituídos por células
EXAME NACIONAL DO ENSINO SECUNDÁRIO VERSÃO 2
 EXAME NACIONAL DO ENSINO SECUNDÁRIO 12.º Ano de Escolaridade (Decreto-Lei n.º 286/89, de 29 de Agosto) Cursos Gerais Agrupamentos 1 e 2 PROVA 142/12 Págs. Duração da prova: 120 minutos 2005 2.ª FASE PROVA
EXAME NACIONAL DO ENSINO SECUNDÁRIO 12.º Ano de Escolaridade (Decreto-Lei n.º 286/89, de 29 de Agosto) Cursos Gerais Agrupamentos 1 e 2 PROVA 142/12 Págs. Duração da prova: 120 minutos 2005 2.ª FASE PROVA
(g) (92 g/mol). O sistema é aquecido até 27 C, ocorrendo a reação a seguir: 1 N 2. (g) F 2 NO 2. (g) é igual a 20%, calcule a pressão parcial de N 2
 Resolução das atividades complementares 3 Química Q34 Grau de equilíbrio a p. 10 1 (Faap-SP) Em um recipiente indeformável de 10 L são colocados 46 g de N (9 g/mol). O sistema é aquecido até 7, ocorrendo
Resolução das atividades complementares 3 Química Q34 Grau de equilíbrio a p. 10 1 (Faap-SP) Em um recipiente indeformável de 10 L são colocados 46 g de N (9 g/mol). O sistema é aquecido até 7, ocorrendo
Componente de Química
 Componente de Química 1.5 Controlo da produção industrial Alteração do estado de equilíbrio de um sistema O carácter dinâmico do equilíbrio (num sistema em equilíbrio, a uma dada temperatura, as velocidades
Componente de Química 1.5 Controlo da produção industrial Alteração do estado de equilíbrio de um sistema O carácter dinâmico do equilíbrio (num sistema em equilíbrio, a uma dada temperatura, as velocidades
QUÍMICA 3 - APOSTILA 4. Prof. Msc João Neto
 QUÍMICA - APOSTILA Prof. Msc João Neto A (g) B (g) C (g) D (g) Em um sistema fechado, o equilíbrio é atingido quando: as propriedades macroscópicas ficam inalteradas; no estado final, coexistem reagentes
QUÍMICA - APOSTILA Prof. Msc João Neto A (g) B (g) C (g) D (g) Em um sistema fechado, o equilíbrio é atingido quando: as propriedades macroscópicas ficam inalteradas; no estado final, coexistem reagentes
Reacções incompletas e equilíbrio químico
 Reacções incompletas e equilíbrio químico Reversibilidade das reacções químicas Reversibilidade das reacções químicas Uma reacção química diz-se reversível quando pode ocorrer nos dois sentidos, isto é,
Reacções incompletas e equilíbrio químico Reversibilidade das reacções químicas Reversibilidade das reacções químicas Uma reacção química diz-se reversível quando pode ocorrer nos dois sentidos, isto é,
Nome.. nº Sala... Responder às perguntas 1, 2, 3, 4 na folha do enunciado
 Química II 1º Exame A 30 de Maio de 2014 Mestrado Integrado Eng. Química Mestrado Integrado Eng. Biológica Nome.. nº Sala... 1: 2: 3: 4: 5: 6: Total: Responder às perguntas 1, 2, 3, 4 na folha do enunciado
Química II 1º Exame A 30 de Maio de 2014 Mestrado Integrado Eng. Química Mestrado Integrado Eng. Biológica Nome.. nº Sala... 1: 2: 3: 4: 5: 6: Total: Responder às perguntas 1, 2, 3, 4 na folha do enunciado
ALQ1.3 - Efeito da variação de temperatura e da variação de concentração na progressão global de uma reação
 ALQ1.3 - Efeito da variação de temperatura e da variação de concentração na progressão global de uma reação A situação de equilíbrio de um sistema químico pode alterar-se quando lhe provocamos uma perturbação:
ALQ1.3 - Efeito da variação de temperatura e da variação de concentração na progressão global de uma reação A situação de equilíbrio de um sistema químico pode alterar-se quando lhe provocamos uma perturbação:
AULA 5 Equilíbrio Ácido Base Equilíbrio Ácido-Base envolvendo soluções de ácidos e bases fortes
 AULA 5 Equilíbrio Ácido Base Equilíbrio Ácido-Base envolvendo soluções de ácidos e bases fortes Objetivo Definir e reconhecer um ácido forte e uma base forte. Calcular o ph de soluções aquosas de ácidos
AULA 5 Equilíbrio Ácido Base Equilíbrio Ácido-Base envolvendo soluções de ácidos e bases fortes Objetivo Definir e reconhecer um ácido forte e uma base forte. Calcular o ph de soluções aquosas de ácidos
SOLUÇÕES - SOLUÇÃO IDEAL E AS PROPRIEDADES COLIGATIVAS
 ESCOLA DE ENGENHARIA DE LORENA EEL/USP TERMODINÂMICA QUÍMICA PROF. ANTONIO CARLOS DA SILVA SOLUÇÕES - SOLUÇÃO IDEAL E AS PROPRIEDADES COLIGATIVAS 1. TIPOS DE SOLUÇÕES Solução é uma mistura homogênea de
ESCOLA DE ENGENHARIA DE LORENA EEL/USP TERMODINÂMICA QUÍMICA PROF. ANTONIO CARLOS DA SILVA SOLUÇÕES - SOLUÇÃO IDEAL E AS PROPRIEDADES COLIGATIVAS 1. TIPOS DE SOLUÇÕES Solução é uma mistura homogênea de
P4 - PROVA DE QUÍMICA GERAL - 03/12/05
 P4 - PROVA DE QUÍMICA GERAL - 03//05 Nome: GABARITO Nº de Matrícula: Turma: Assinatura: Questão Valor Grau Revisão a,5 a,5 3 a,5 4 a,5 Total 0,0 Constantes e equações: R = 0,08 atm L mol - K - = 8,34 J
P4 - PROVA DE QUÍMICA GERAL - 03//05 Nome: GABARITO Nº de Matrícula: Turma: Assinatura: Questão Valor Grau Revisão a,5 a,5 3 a,5 4 a,5 Total 0,0 Constantes e equações: R = 0,08 atm L mol - K - = 8,34 J
P1 - PROVA DE QUÍMICA GERAL 31/03/07
 1 - ROVA DE QUÍMICA GERAL 31/03/07 Nome: GABARITO Nº de Matrícula: Turma: Assinatura: Questão Valor Grau Revisão 1 a,5 a,5 3 a,5 4 a,5 Total 10,0 Dados R 0,081 atm L mol -1 K -1 T (K) T ( C) + 73,15 1
1 - ROVA DE QUÍMICA GERAL 31/03/07 Nome: GABARITO Nº de Matrícula: Turma: Assinatura: Questão Valor Grau Revisão 1 a,5 a,5 3 a,5 4 a,5 Total 10,0 Dados R 0,081 atm L mol -1 K -1 T (K) T ( C) + 73,15 1
GABARITO - QUÍMICA - Grupo A
 GABARITO - QUÍMICA - Grupo A 1 a QUESTÃO: (2,0 pontos) Avaliador Revisor O teor do íon Cl - existente nos fluidos corporais pode ser determinado através de uma analise volumétrica do íon Cl - com o íon
GABARITO - QUÍMICA - Grupo A 1 a QUESTÃO: (2,0 pontos) Avaliador Revisor O teor do íon Cl - existente nos fluidos corporais pode ser determinado através de uma analise volumétrica do íon Cl - com o íon
Equilíbrio Químico. Controlo da Produção Industrial de Amoníaco
 Equilíbrio Químico Controlo da Produção Industrial de Amoníaco Reações completas Combustão do carvão C (s) + O 2 (g) CO 2 (g) Reações completas Reação do Ácido clorídrico com o Magnésio 2 HCl (aq) + Mg
Equilíbrio Químico Controlo da Produção Industrial de Amoníaco Reações completas Combustão do carvão C (s) + O 2 (g) CO 2 (g) Reações completas Reação do Ácido clorídrico com o Magnésio 2 HCl (aq) + Mg
Lista de Equilíbrio Químico
 Lista de Equilíbrio Químico 1 Escrever as constantes K C e K P e estabelecer a relação entre elas para os seguintes equilíbrios: a) N 2 (g) + 3H 2(g) 2NH 3(g) b) H 2(g) + I 2(s) 2HI (g) c) H 2(g) + Cl
Lista de Equilíbrio Químico 1 Escrever as constantes K C e K P e estabelecer a relação entre elas para os seguintes equilíbrios: a) N 2 (g) + 3H 2(g) 2NH 3(g) b) H 2(g) + I 2(s) 2HI (g) c) H 2(g) + Cl
Figura 1: Potencial químico de um solvente na presença de um soluto.
 Propriedades Coligativas 1. Introdução Algumas propriedades do solvente mudam quando um soluto é dissolvido nele para formar uma solução. O ponto de congelamento da água salgada, por exemplo, é menor que
Propriedades Coligativas 1. Introdução Algumas propriedades do solvente mudam quando um soluto é dissolvido nele para formar uma solução. O ponto de congelamento da água salgada, por exemplo, é menor que
QUÍMICA ANALÍTICA SOLUÇÃO TAMPÃO E PRODUTO DE SOLUBILIDADE. Prof.a. Dra. Renata P. Herrera Brandelero. Dois Vizinhos - PR 2012
 QUÍMICA ANALÍTICA SOLUÇÃO TAMPÃO E PRODUTO DE SOLUBILIDADE Prof.a. Dra. Renata P. Herrera Brandelero Dois Vizinhos - PR 2012 Soluções Tampões Soluções tampões são formadas por uma mistura de um ácido e
QUÍMICA ANALÍTICA SOLUÇÃO TAMPÃO E PRODUTO DE SOLUBILIDADE Prof.a. Dra. Renata P. Herrera Brandelero Dois Vizinhos - PR 2012 Soluções Tampões Soluções tampões são formadas por uma mistura de um ácido e
Nome Completo : Prova de Acesso de Química para Maiores de 23 Anos. Candidatura de Junho de 2013, 10: h
 Nome Completo : B. I. n.º Prova de Acesso de Química para Maiores de 23 Anos Candidatura 2013-2014 18 de Junho de 2013, 10:00 12.30 h Respostas às perguntas de escolha múltipla: assinale a resposta certa
Nome Completo : B. I. n.º Prova de Acesso de Química para Maiores de 23 Anos Candidatura 2013-2014 18 de Junho de 2013, 10:00 12.30 h Respostas às perguntas de escolha múltipla: assinale a resposta certa
Colégio Avanço de Ensino Programado
 α Colégio Avanço de Ensino Programado Trabalho Bimestral 1º Semestre - 1º Bim. /2016 Nota: Professor (a): Cintia Disciplina: Química Turma: 3ª Série Médio Nome: Nº: Atividade deverá ser entregue em pasta
α Colégio Avanço de Ensino Programado Trabalho Bimestral 1º Semestre - 1º Bim. /2016 Nota: Professor (a): Cintia Disciplina: Química Turma: 3ª Série Médio Nome: Nº: Atividade deverá ser entregue em pasta
P4 - PROVA DE QUÍMICA GERAL 03/07/10
 P4 - PROVA DE QUÍMICA GERAL 0/07/10 Nome: Nº de Matrícula: GABARITO Turma: Assinatura: Questão Valor Grau Revisão 1 a,5 a,5 a,5 4 a,5 Total 10,0 Constantes e equações: R = 0,08 atm L mol -1 K -1 = 8,14
P4 - PROVA DE QUÍMICA GERAL 0/07/10 Nome: Nº de Matrícula: GABARITO Turma: Assinatura: Questão Valor Grau Revisão 1 a,5 a,5 a,5 4 a,5 Total 10,0 Constantes e equações: R = 0,08 atm L mol -1 K -1 = 8,14
EXAME NACIONAL DO ENSINO SECUNDÁRIO
 EXAME NACIONAL DO ENSINO SECUNDÁRIO 12.º Ano de Escolaridade (Decreto-Lei n.º 286/89, de 29 de Agosto) Cursos Gerais Agrupamentos 1 e 2 PROVA 142/C/8 Págs. Duração da prova: 120 minutos 1.ª FASE 2003 2.ª
EXAME NACIONAL DO ENSINO SECUNDÁRIO 12.º Ano de Escolaridade (Decreto-Lei n.º 286/89, de 29 de Agosto) Cursos Gerais Agrupamentos 1 e 2 PROVA 142/C/8 Págs. Duração da prova: 120 minutos 1.ª FASE 2003 2.ª
Aula de Bioquímica I. Tema: Água. Prof. Dr. Júlio César Borges
 Aula de Bioquímica I Tema: Água Prof. Dr. Júlio César Borges Depto. de Química e Física Molecular DQFM Instituto de Química de São Carlos IQSC Universidade de São Paulo USP E-mail: borgesjc@iqsc.usp.br
Aula de Bioquímica I Tema: Água Prof. Dr. Júlio César Borges Depto. de Química e Física Molecular DQFM Instituto de Química de São Carlos IQSC Universidade de São Paulo USP E-mail: borgesjc@iqsc.usp.br
POTENCIAIS DE MEMBRANA: POTENCIAL DE REPOUSO E POTENCIAL DE AÇÃO. MARIANA SILVEIRA
 POTENCIAIS DE MEMBRANA: POTENCIAL DE REPOUSO E POTENCIAL DE AÇÃO. MARIANA SILVEIRA COLETA, DISTRIBUIÇÃO E INTEGRAÇÃO DE INFORMAÇÃO Para o cérebro Medula espinhal Corpo celular do neurônio motor Corpo celular
POTENCIAIS DE MEMBRANA: POTENCIAL DE REPOUSO E POTENCIAL DE AÇÃO. MARIANA SILVEIRA COLETA, DISTRIBUIÇÃO E INTEGRAÇÃO DE INFORMAÇÃO Para o cérebro Medula espinhal Corpo celular do neurônio motor Corpo celular
PROVA DE QUÍMICA SEGUNDA ETAPA DO VESTIBULAR 99 DA UFMG
 PROVA DE QUÍMICA SEGUNDA ETAPA DO VESTIBULAR 99 DA UFMG QUESTÃO 01 A queima do enxofre produz um dos seus óxidos, SO 2 (g) ou SO 3 (g). A identificação de qual dos dois é, realmente, produzido pode ser
PROVA DE QUÍMICA SEGUNDA ETAPA DO VESTIBULAR 99 DA UFMG QUESTÃO 01 A queima do enxofre produz um dos seus óxidos, SO 2 (g) ou SO 3 (g). A identificação de qual dos dois é, realmente, produzido pode ser
Segundo o gráfico, o líquido mais volátil será a substância a) A b) B c) C d) D
 Professor: Alfênio Coligativas / Tonoscopia 01 (UEG GO) As propriedades físicas dos líquidos podem ser comparadas a partir de um gráfico de pressão de vapor em função da temperatura, como mostrado no gráfico
Professor: Alfênio Coligativas / Tonoscopia 01 (UEG GO) As propriedades físicas dos líquidos podem ser comparadas a partir de um gráfico de pressão de vapor em função da temperatura, como mostrado no gráfico
Q.02 Considere uma solução aquosa diluída de dicromato de potássio, a 25 ºC. Dentre os equilíbrios que estão presentes nessa solução, destacam-se:
 Q.01 Íons indesejáveis podem ser removidos da água, tratando-a com resinas de troca iônica, que são constituídas por uma matriz polimérica, à qual estão ligados grupos que podem reter cátions ou ânions.
Q.01 Íons indesejáveis podem ser removidos da água, tratando-a com resinas de troca iônica, que são constituídas por uma matriz polimérica, à qual estão ligados grupos que podem reter cátions ou ânions.
Ligações e Equilíbrio Químico
 Ligações e Equilíbrio Químico Ligações e Equilíbrio Químico 1. (FUVEST) A hemoglobina (Hb) é a proteína responsável pelo transporte de oxigênio. Nesse processo, a hemoglobina se transforma em oxi-hemoglobina
Ligações e Equilíbrio Químico Ligações e Equilíbrio Químico 1. (FUVEST) A hemoglobina (Hb) é a proteína responsável pelo transporte de oxigênio. Nesse processo, a hemoglobina se transforma em oxi-hemoglobina
Exercícios de Propriedades Coligativas e Coloides
 Exercícios de Propriedades Coligativas e Coloides Material de apoio do Extensivo 1. Considere o gráfico da pressão máxima de vapor em função da temperatura para um solvente puro e para uma solução desse
Exercícios de Propriedades Coligativas e Coloides Material de apoio do Extensivo 1. Considere o gráfico da pressão máxima de vapor em função da temperatura para um solvente puro e para uma solução desse
QUÍMICA 12º ANO ACTIVIDADE DE PROJECTO CONSTRUÇÃO DE UMA PILHA PROPOSTA DA METODOLOGIA 2010/ º Período
 QUÍMICA 12º ANO ACTIVIDADE DE PROJECTO CONSTRUÇÃO DE UMA PILHA PROPOSTA DA METODOLOGIA Henrique Fernandes, número 9 Ricardo Cunha, número 20 Jéssica Lopes, número 26 Professor Ângelo Fernandes Turma B
QUÍMICA 12º ANO ACTIVIDADE DE PROJECTO CONSTRUÇÃO DE UMA PILHA PROPOSTA DA METODOLOGIA Henrique Fernandes, número 9 Ricardo Cunha, número 20 Jéssica Lopes, número 26 Professor Ângelo Fernandes Turma B
ATENÇÃO: assinale ou apresente cuidadosamente as respostas e apresente TODOS os cálculos efectuados.
 Prova de Acesso de Química Maiores de 23 Anos Candidatura 2015-2016 / Candidatos oriundos de outros sistemas de ensino 2015/2016 15 de Junho de 2016 10h00 12h30 ATENÇÃO: assinale ou apresente cuidadosamente
Prova de Acesso de Química Maiores de 23 Anos Candidatura 2015-2016 / Candidatos oriundos de outros sistemas de ensino 2015/2016 15 de Junho de 2016 10h00 12h30 ATENÇÃO: assinale ou apresente cuidadosamente
Experiência 7. PREPARO DE SOLUÇÃO A PARTIR DE SUBSTÂNCIAS SÓLIDAS, LIQUIDAS E DE SOLUÇÃO CONCENTRADA
 Experiência 7. PREPARO DE SOLUÇÃO A PARTIR DE SUBSTÂNCIAS SÓLIDAS, LIQUIDAS E DE SOLUÇÃO CONCENTRADA 1. Objetivos Após a realização desta aula experimental, espera-se que o graduando do curso de Química
Experiência 7. PREPARO DE SOLUÇÃO A PARTIR DE SUBSTÂNCIAS SÓLIDAS, LIQUIDAS E DE SOLUÇÃO CONCENTRADA 1. Objetivos Após a realização desta aula experimental, espera-se que o graduando do curso de Química
Exercícios sobre Solubilidade - conceitos e curvas
 Exercícios sobre Solubilidade - conceitos e curvas 01. (Ufrrj) Ao analisar o gráfico acima, percebe-se que a) a solubilidade do KCl é maior que a do KBr. b) à medida que a temperatura aumenta a solubilidade
Exercícios sobre Solubilidade - conceitos e curvas 01. (Ufrrj) Ao analisar o gráfico acima, percebe-se que a) a solubilidade do KCl é maior que a do KBr. b) à medida que a temperatura aumenta a solubilidade
DESTILAÇÃO Lei de Raoult
 DESTILAÇÃO Operação que consiste na separação de líquidos de suas eventuais misturas, por passagem de vapor e posterior condensação com retorno ao estado líquido, com auxílio de calor e/ou por redução
DESTILAÇÃO Operação que consiste na separação de líquidos de suas eventuais misturas, por passagem de vapor e posterior condensação com retorno ao estado líquido, com auxílio de calor e/ou por redução
Prova de Acesso de Química para Maiores de 23 Anos 2009/2010
 Nome Completo : B. I. n.º Prova de Acesso de Química para Maiores de 23 Anos 2009/2010 21 Julho 2009, 10:00 13:00 h Respostas às perguntas de escolha múltipla: assinale a resposta certa quando lhe for
Nome Completo : B. I. n.º Prova de Acesso de Química para Maiores de 23 Anos 2009/2010 21 Julho 2009, 10:00 13:00 h Respostas às perguntas de escolha múltipla: assinale a resposta certa quando lhe for
Velocidade inicial (mol L -1 s -1 ) 1 0,0250 0,0250 6,80 x ,0250 0,0500 1,37 x ,0500 0,0500 2,72 x 10-4.
 P3 - PROVA DE QUÍMICA GERAL - 31/05/14 Nome: Nº de Matrícula: GABARITO Turma: Assinatura: Dados gerais: G = - n F E G = G o + RT Q ΔE RT ΔE nf Questão Valor Grau Revisão 1 a,5 a,5 3 a,5 4 a,5 Total 10,0
P3 - PROVA DE QUÍMICA GERAL - 31/05/14 Nome: Nº de Matrícula: GABARITO Turma: Assinatura: Dados gerais: G = - n F E G = G o + RT Q ΔE RT ΔE nf Questão Valor Grau Revisão 1 a,5 a,5 3 a,5 4 a,5 Total 10,0
31/05/17. Ondas e Linhas
 31/05/17 1 Guias de Onda (pags 102 a 112 do Pozar) Geometria e Condições de Contorno Solução geral para Modos TE Solução geral para Modos TM 31/05/17 2 Cabo Coaxial Vamos considerar os campos de um cabo
31/05/17 1 Guias de Onda (pags 102 a 112 do Pozar) Geometria e Condições de Contorno Solução geral para Modos TE Solução geral para Modos TM 31/05/17 2 Cabo Coaxial Vamos considerar os campos de um cabo
Capítulo by Pearson Education
 QUÍMICA A Ciência Central 9ª Edição Equilíbrio químico David P. White Conceito de equilíbrio Considere o N 2 O 4 congelado e incolor. À temperatura ambiente, ele se decompõe em NO 2 marrom: N 2 O 4 (g)
QUÍMICA A Ciência Central 9ª Edição Equilíbrio químico David P. White Conceito de equilíbrio Considere o N 2 O 4 congelado e incolor. À temperatura ambiente, ele se decompõe em NO 2 marrom: N 2 O 4 (g)
Biofísica renal. Estrutura e função dos rins
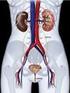 Biofísica renal Estrutura e função dos rins Múltiplas funções do sistema renal Regulação do balanço hídrico e eletrolítico (volume e osmolaridade) Regulação do equilíbrio ácidobásico (ph) Excreção de produtos
Biofísica renal Estrutura e função dos rins Múltiplas funções do sistema renal Regulação do balanço hídrico e eletrolítico (volume e osmolaridade) Regulação do equilíbrio ácidobásico (ph) Excreção de produtos
P2 - PROVA DE QUÍMICA GERAL - 27/10/12
 P2 - PROVA DE QUÍMICA GERAL - 27/10/12 Nome: Nº de Matrícula: GABARITO Turma: Assinatura: Questão Valor Grau Revisão 1 a 2,5 2 a 2,5 3 a 2,5 4 a 2,5 Total 10,0 Dados: T (K) = T ( C) + 273,15 R = 8,314
P2 - PROVA DE QUÍMICA GERAL - 27/10/12 Nome: Nº de Matrícula: GABARITO Turma: Assinatura: Questão Valor Grau Revisão 1 a 2,5 2 a 2,5 3 a 2,5 4 a 2,5 Total 10,0 Dados: T (K) = T ( C) + 273,15 R = 8,314
a) 20 d) 100 b) 40 e) 160 c) 80
 01) (Unifesp-SP) Uma solução contendo 14 g de cloreto de sódio dissolvidos em 200 ml de água foi deixada em um frasco aberto, a 30 C. Após algum tempo, começou a cristalizar o soluto. Qual volume mínimo
01) (Unifesp-SP) Uma solução contendo 14 g de cloreto de sódio dissolvidos em 200 ml de água foi deixada em um frasco aberto, a 30 C. Após algum tempo, começou a cristalizar o soluto. Qual volume mínimo
Mistura de Soluções, Solubilidade e Propriedades Coligativas. Química 2/set
 Mistura de Soluções, Solubilidade e Propriedades Coligativas Química 2/set Mistura de Soluções 1 L 20 g/l 1 L 50 g/l 2L 70 g ou 35 g/l m a.v a + m b.v b = m f.v f m f = m a + m b Curvas de Solubilidade
Mistura de Soluções, Solubilidade e Propriedades Coligativas Química 2/set Mistura de Soluções 1 L 20 g/l 1 L 50 g/l 2L 70 g ou 35 g/l m a.v a + m b.v b = m f.v f m f = m a + m b Curvas de Solubilidade
Propriedades e classificação dos sólidos Semicondutores Dopados Dispositivos semicondutores Exercícios
 SÓLIDOS Fundamentos de Física Moderna (1108090) - Capítulo 04 I. Paulino* *UAF/CCT/UFCG - Brasil 2015.2 1 / 42 Sumário Propriedades e classificação dos sólidos Propriedades elétricas dos sólidos Isolantes
SÓLIDOS Fundamentos de Física Moderna (1108090) - Capítulo 04 I. Paulino* *UAF/CCT/UFCG - Brasil 2015.2 1 / 42 Sumário Propriedades e classificação dos sólidos Propriedades elétricas dos sólidos Isolantes
Produto de solubilidade de sais
 Produto de solubilidade de sais Nos sais pouco solúveis (solubilidade menor que 0,01mol/L) o produto da concentração molar de íons é uma constante a uma determinada temperatura, esse produto (Kps) é chamado
Produto de solubilidade de sais Nos sais pouco solúveis (solubilidade menor que 0,01mol/L) o produto da concentração molar de íons é uma constante a uma determinada temperatura, esse produto (Kps) é chamado
A) Se a massa molar do composto C é 76 g.mol 1, determine as fórmulas químicas para os compostos A, B, C, D e E.
 VTB 2008 2ª ETAPA Solução Comentada da Prova de Química 01. Na análise de 5 (cinco) diferentes compostos (A, B, C, D e E) formados apenas por nitrogênio e oxigênio, observou-se que as relações de massas
VTB 2008 2ª ETAPA Solução Comentada da Prova de Química 01. Na análise de 5 (cinco) diferentes compostos (A, B, C, D e E) formados apenas por nitrogênio e oxigênio, observou-se que as relações de massas
P3 - PROVA DE QUÍMICA GERAL - 19/11/11
 P3 - PROVA DE QUÍMICA GERAL - 19/11/11 Nome: Nº de Matrícula: GABARITO Turma: Assinatura: Questão Valor Grau Revisão 1 a,5 a,5 3 a,5 4 a,5 Total 10,0 Dados gerais: G = - n F E G = G o + RT ln Q F = 96500
P3 - PROVA DE QUÍMICA GERAL - 19/11/11 Nome: Nº de Matrícula: GABARITO Turma: Assinatura: Questão Valor Grau Revisão 1 a,5 a,5 3 a,5 4 a,5 Total 10,0 Dados gerais: G = - n F E G = G o + RT ln Q F = 96500
44. Com relação aos compostos representados abaixo, é INCORRETO afirmar que: N(CH 2 CH 3 ) 3 CH 3 CO 2 H ClCH 2 CO 2 H I II III
 22 GABARITO 1 1º DIA 2º Processo Seletivo/2004 44. Com relação aos compostos representados abaixo, é INCORRETO afirmar que: N(CH 2 CH 3 ) 3 CH 3 CO 2 H ClCH 2 CO 2 H I II III a) o composto III é um ácido
22 GABARITO 1 1º DIA 2º Processo Seletivo/2004 44. Com relação aos compostos representados abaixo, é INCORRETO afirmar que: N(CH 2 CH 3 ) 3 CH 3 CO 2 H ClCH 2 CO 2 H I II III a) o composto III é um ácido
Prática 08 Determinação da Massa Molar da Ureia via Ebuliometria
 UNIVERSIDADE DO ESTADO DE SANTA CATARINA CENTRO DE CIÊNCIAS TECNOLÓGICAS CCT DEPARTAMENTO DE QUÍMICA DQMC Disciplina: Química Geral Experimental QEX0002 Prática 08 Determinação da Massa Molar da Ureia
UNIVERSIDADE DO ESTADO DE SANTA CATARINA CENTRO DE CIÊNCIAS TECNOLÓGICAS CCT DEPARTAMENTO DE QUÍMICA DQMC Disciplina: Química Geral Experimental QEX0002 Prática 08 Determinação da Massa Molar da Ureia
