CAPÍTULO IV ESTRUTURAS ATÔMICAS
|
|
|
- Vasco Philippi Alencar
- 6 Há anos
- Visualizações:
Transcrição
1 CAPÍTULO IV ESTRUTURAS ATÔMICAS
2 ESTRUTURAS ATÔMICAS 4.1. Introdução Através de ligações atômicas, os átomos podem formar compostos com propriedades bem distintas das propriedades de seus constituintes individuais. Estes compostos também variam bastante em tamanho, podendo consistir de um mero par de átomos a sólidos com uma enorme quantidade de átomos. O tamanho e a forma destes compostos são fatores diretamente determinados pela natureza das ligações entre os átomos do composto. Por exemplo, os metais tendem a formar compostos de muitos átomos organizados espacialmente em um arranjo atômico que se repete (cristais). Devido à natureza da ligação metálica, os núcleos atômicos podem se mover comparativamente mais fácil que no caso de materiais com outro tipo de ligação atômica. Adicionalmente, os elétrons livres conferem aos materiais metálicos altas condutividades térmica e elétrica. Átomos ligados ionicamente também tendem a formar arranjos organizados de átomos (cristais), porém estes arranjos são fortemente influenciados pelas relações entre as cargas elétricas dos íons e pelos seus tamanhos relativos. Os materiais ligados covalentemente, ao contrário, raramente formam cristais devido à natureza altamente impositiva da direcionalidade das ligações. A probabilidade maior é que os compostos covalentes formem cadeias, como nos polímeros ou pequenas moléculas discretas, como nos líquidos ou gases. O diamante e a sílica são dois exemplos de materiais covalentes cristalinos, pois coincidentemente, as direções das ligações entre os átomos são tais que permitem a formações de um arranjo do tipo cristalino. Como a ligação covalente possui alta energia, os cristais covalentes cristalinos possuem em geral alto ponto de fusão e alta dureza. As forças de Van der Waals só se fazem notar quando as demais ligações não existem ou em processos secundários. Por exemplo, é do tipo Van der Waals a ligação entre diferentes moléculas poliméricas e entre gases e líquidos cujas moléculas são ligadas covalentemente. Fenômenos de adsorção de líquido e gases são também desta natureza, bem como as ligações existentes entre as camadas de materiais de estrutura folheada. A seguir vamos estudar o caso em que átomos se ligam de modo a formarem um arranjo espacialmente organizado e repetido, formando as chamadas estruturas cristalinas. Primeiramente veremos algumas características das estruturas cristalinas e apresentaremos as estruturas cristalinas de modo geral. Em seguida, entraremos no caso especial das estruturas cristalinas dos materiais cerâmicos. Finalizaremos vendo o caso de materiais vítreos, caso em que inexiste a ordem cristalina. É o caso do vidro, considerado uma cerâmica Estrutura Cristalina Uma estrutura cristalina é um arranjo coordenado de átomos que se repete espacialmente. Sendo assim, é possível selecionar um conjunto mínimo de átomos que, se repetidos um ao lado do outro, reproduz toda a estrutura do material. O arranjo mínimo de átomos forma um volume mínimo que reproduz a rede cristalina completa caso colocado um ao lado do outro. Este volume mínimo é chamado célula unitária da rede cristalina. Em muitas ocasiões, é preferível não trabalhar com nem com o arranjo mínimo nem com o volume mínimo, para que se ganhe em simetria espacial. Assim, a visualização da rede a partir de uns poucos átomos fica mais fácil. Uma vez selecionada a célula unitária, é recomendável escolher um sistema de eixos coordenados que possibilitará a determinação de posições dos átomos e de direções na rede 40
3 cristalina. Cada célula unitária terá assim tamanhos de arestas e ângulos entre arestas específicos. A figura 4.1 exibe as geometrias das células unitárias dos sete sistemas cristalinos com suas dimensões e angulações. A figura 4.2 exibe os 14 retículos cristalinos que são desdobramentos daqueles gerais mostrados na figura 4.1. cúbico a=b=c α=β=γ=90 hexagonal a=b c α=β=90, γ=120 tetragonal a=b c α=β=γ=90 romboédrico a=b=c α=β=γ 90 ortorrômbico a b c α=β=γ=90 monoclínico a b c α=γ=90 β triclínico a b c α β γ 90 Figura 4.1: células unitárias dos sistemas cristalinos e suas relações de parâmetros.. 41
4 cúbica simples Cúbica de corpo centrado Cúbica de face centrada Tetragonal simples Tetragonal de corpo centrado Ortorrômbica simples Ortorrômbica de corpo centrado Ortorrômbica de extremidades centradas Ortorrômbica de faces centradas Monoclínica simples Monoclínica de extremidades centradas Romboédrica Triclínica Hexagonal Figura 4.2: Redes cristalinas resultantes dos desdobramentos dos 7 sistemas cristalinos fundamentais. 42
5 Os eixos coordenados são escolhidos de modo a seguir a simetria espacial da célula unitária. Eles são utilizados para localizar posições, direções e planos cristalinos na rede cristalina. A figura 4.3(a) exibe uma rede cúbica simples com um sistema de coordenadas. O átomo em vermelho ocupa a posição (1,1,0) Direções cristalinas As direções cristalinas consistem de um linha de átomos como aquela mostrada em vermelho na figura 4.3(b), porém com direção. Ou seja, a linha de átomos exibida, para ser uma direção tem que ter um sentido, o qual poderia ser da esquerda para a direita ou o inverso. As direções na rede cristalina são determinadas através de um vetor. O vetor é representado por suas coordenadas em relação ao sistema de eixos coordenados escolhidos. Estas coordenadas são medidas em relação às dimensões da célula cristalina. Peguemos um exemplo. Estamos querendo determinar a direção cristalina do átomo identificado por um ponto escuro, na célula cristalina cúbica exibida na figura 4.3(c). As dimensões cristalinas são iguais. O sistema de eixos coordenados está também mostrado. A direção é dada com relação ao ponto escolhido e à origem do sistema. Figura 4.3: a) átomo em posição (1,1,0); b) linha de átomos sinalizando duas direções cristalinas; c? vetor indicando direção cristalina [111]. A determinação da direção cristalina é simples e pode ser determinada em etapas. Primeiramente pegamos a coordenada do átomo em questão. No caso, devido à simetria da célula cúbica, as coordenadas são (a, a, a). Pegamos apenas os múltiplos de cada coordenada. No caso, temos (1, 1, 1). A seguir, dividimos ou multiplicamos estes múltiplos por um fator comum, de modo que estes se transformem no menor conjunto de inteiros possível. No caso particular, o conjunto (1,1,1) já é o menor grupo possível de inteiros. Por fim, colocamos este grupo entre colchetes. O resultado é [111]. Outro exemplo é o do ponto de coordenadas (a/2,b,0) em uma rede ortorrômbica. Primeiramente pegamos os inteiros que são (1/2,1,0). Depois multiplicamos por 2 e ficamos com (1,2,0). O resultado é [120]. A coordenada que for negativa recebe um traço horizontal sobre o respectivo índice, como em [ 102]. Quando invertemos os sinais do terno de índices a direção cristalina é também invertida. Ex.: [ 123] [ 123]. Existem certas direções cristalinas que são completamente equivalentes, ou seja, se caminharmos ao longo destas direções, encontraremos a mesma quantidade de átomos, nas mesmas distâncias. Por exemplo, no sistema cúbico, as seguintes direções são equivalentes: [100], [010], [001], [ 100],[010],[001]. Direções equivalentes podem ser representadas como 100. No sistema cúbico, para um determinado terno de índices, todas as direções originadas da troca de posição e de sinal destes índices são equivalentes. Entretanto, cada sistema cristalino possui seu conjunto 43
6 específico de direções equivalentes. As direções [100] e [010] são equivalentes no sistema tetragonal, mas as direções [100] e [001] não são. Para o sistema hexagonal, devido à simetria particular, quatro eixos coordenados, ao invés de três, são comumente utilizados. Embora 3 eixos sejam suficientes para descrever tudo no espaço tridimensional, o uso de um quarto eixo facilita a visualização de eixos e direções. Por exemplo, com o uso de 3 índices, direções equivalentes não terão mais os mesmos índices. Três eixos estão no mesmo plano, o plano basal, separados entre si de 120. O quarto eixo é perpendicular. Uma determinada direção [uvw] no sistema hexagonal representada por 3 eixos pode ser convertida para a representação de 4 eixos [u v tw ] através de n n u' = (2u v), v' = (2v u), t = ( u' + v' ), w ' = nw 3 3 onde n é um inteiro que pode ser necessário para fazer de u, v, t e w os menores inteiros possíveis. A figura 4.4 mostra uma célula unitária hexagonal que mostra como estão dispostos os quatro eixos. Figura 4.4: Sistema de 4 eixos alternativos usado para a rede hexagonal. Fonte: W. Callister Número de coordenação Em uma rede cristalina, os átomos que rodeiam um determinado átomo estão dispostos a distâncias determinadas e fixas, de acordo com as direções cristalinas. O número de átomos mais próximos de um certo átomo é denominado número de coordenação. Para uma rede cúbica simples, o número de coordenação é 6. Para a rede cúbica de corpo centrado (ccc) este número é 8. Para as redes hexagonal e cúbica de face centrada, o número de coordenação é 12. Isto pode ser visto na figura 4.5. Estas redes são formadas pelo empilhamento de planos compactos de átomos. Cada átomo de um plano é rodeado por outros seis de seu próprio plano, por três de um plano superior e mais três de um plano inferior, totalizando 12 átomos mais próximos. 44
7 Figura 4.5: empilhamento compacto de esferas no arranjo cfc. O número de coordenação é Fator de empacotamento O fator de empacotamento mede a fração de espaço da rede que é efetivamente ocupado pelos átomos. Isto porque a forma como os átomos estão arranjados (o tipo de estrutura cristalina) pode ocupar mais eficientemente ou não o espaço. Este fator é definido como a razão entre o espaço ocupado pelos átomos em uma célula unitária e o volume da célula cristalina. Neste caso, os átomos são representados por esferas sólidas que se tocam para construir a rede. Veja como exemplo a célula de uma rede cúbica de corpo centrado (ccc). A figura 4.6 mostra uma célula unitária preenchida com as esferas rígidas, representando os átomos. Existem 2 átomos ocupando a célula. 3 A relação entre a constante de rede e o raio da esfera é dada por R = a. O volume da célula é 4 V=a e o volume das três esferas é V esf = 2 π R = πr. Deste modo, o fator de empacotamento é 3 3 fe=0,68. Para a cfc o fator de empacotamento é 0,74, que é o mesmo valor deste para a rede hexagonal compacta (hcp). Figura 4.6: Célula unitária da rede cúbica de corpo centrado no modelo de esferas rígidas. 45
8 Densidade de materiais cristalinos A partir do número de átomos que ocupam a célula unitária e do volume desta célula é na possível calcular a densidade do material pela relação ρ = onde n é o número de átomos na V C N A célula, A é o peso atômico do material, V C é o volume da célula unitária e N A é o número de Avogrado. Obviamente, esta relação á válida somente para materiais cristalinos de um só elemento Planos cristalinos e índices de Miller O ordenamento de átomos da rede cristalina produz também planos atômicos, que são planos ocupados pelos átomos da rede, como aquele constituído pelos átomos vermelhos indicados na figura 4.7. Figura 4.7: Plano de átomos (100) em rede cúbica simples. Cada rede possui seu conjunto específico de planos, os quais são identificados por índices, a exemplo das direções cristalinas. Os índices que identificam planos são denominados índices de Miller. Um plano atômico, assim como um plano qualquer, é perfeitamente determinado por três pontos. Tomamos, por simplicidade, os pontos onde o plano corta os três eixos coordenados. Pegamos as coordenadas destes pontos, tendo como referência os parâmetros de rede. Em seguida, fazemos o inverso de cada coordenada e multiplicamos todas por um mesmo inteiro, de modo a termos o menor terno de inteiros possível. Por exemplo, suponha que um determinado plano corte o eixo x nas coordenadas (2a,0,0), corte o eixo y em (0,b,0) e o eixo z em (0,0,3c). Pegamos apenas o terno (2,1,3) e fazemos os inversos (1/2,1,1/3). A seguir multiplicamos por 6 e ficamos com (3,6,2). O plano em questão será representado como (362). Quando o plano é paralelo a um eixo, tomamos o índice do plano com referência aquele plano como sendo zero. Um índice negativo é apresentado com um traço sobre o índice, como no caso das direções cristalinas. Revertendo o sinal de todos os índices de um terno, nós obtemos um plano paralelo, como uma imagem deste plano refletida em um espelho localizado na origem. Quando um plano passar pela origem, a determinação dos índices de Miller é feita deslocando-se a origem do sistema de eixos ou criando um plano equivalente, paralelo que não passa pela origem. A figura 4.8 mostra exemplo de alguns planos cristalinos na rede cúbica. 46
9 Figura 4.8: Conjuntos de planos cristalinos equivalentes. Fonte: W. Callister. O arranjo atômico de cada plano cristalino é determinado pelas características da rede, de modo que, planos cristalinos de mesmos índices, mas pertencentes a diferentes estruturas possuem geralmente arranjos atômicos diferentes. A figura 4.9 exibe planos de mesmo índice nas estruturas cfc e ccc, respectivamente. O arranjo dos átomos é claramente diferente em cada plano. Por outro lado, existem planos cristalinos de índices diferentes que possuem o mesmo arranjo atômico. Estes planos são chamados equivalentes e formam uma família. Uma família de planos é representada pelos índices de Miller de um dos planos da família entre chaves. Por exemplo, para a rede cúbica, todos os planos cujos índices tenham o mesmo módulo, não importando a ordem nem o sinal, são equivalentes e compõem uma família. Assim (123), (231), (132) são equivalentes e fazem parte da família {123}. Existem planos que são mais ocupados que outros. Estes têm maior densidade atômica. Logicamente, os planos que são paralelos a estes são equivalentes. Os planos paralelos mais densamente ocupados são mais distantes uns dos outros que os planos paralelos menos densos. Isto ocorre para manter a densidade do cristal constante. No sistema hexagonal, o sistema de quatro eixos (e quatro índices) também pode ser usado para representar planos atômicos. O motivo novamente é a facilidade de se visualizar os planos nessa representação. Se no sistema de três índices, um certo plano é representado como (hkl) sua representação no sistema de quatro índices é (hkil), onde hkl são exatamente os mesmos e i=-(h+k). A figura 4.10 exibe planos na rede hexagonal e seus respectivos índices. Figura 4.9: Planos cristalinos de mesmos índices para as redes cfc (a) e ccc (b). A disposição dos átomos varia. Fonte: W. Callister. 47
10 Figura 4.10: Planos cristalinos e seus índices na rede hexagonal. Fonte: W. Callister Empacotamento cristalino denso A forma com que os átomos se agrupam determina a eficiência do empacotamento da estrutura. No modelo de esferas rígidas, é possível determinar o fator de empacotamento. Ele é máximo para as estruturas cúbica de face centrada e hexagonal compacta. Estas estruturas são bastante parecidas. Para construí-las basta que façamos uma camada plana de esferas de mesmo tamanho que se tocam, chamada camada A. Vemos que há espaços vazios entre as esferas. Cada esfera toca seis vizinhas e existem seis espaços entre elas. Cada grupo de três esferas forma um espaço entre elas. Podemos dividir estes espaços vazios em dois grupos, denominando-os B e C, como mostra a figura 4.11(a). Em seguida, colocamos uma outra camada de esferas similar à camada A, mas nas posições dos espaços B. Vemos que as esferas se tocam e são igualmente rodeadas por seis esferas cada. Existem também espaços vazios entre as esferas da camada B. Veja a figura 4.11(b). Podemos colocar uma terceira camada de esferas iguais sobre a camada B de duas maneiras diferentes. (a) (c) 48
11 (b) (d) (e) Figura 4.11: Empacotamento de esferas para formação das redes compactas cfc e hcp. Fonte: W. Callister. Na primeira, colocamos as esferas da terceira camada exatamente sobre os espaços ocupados pelas esferas da camada A. Formamos assim uma estrutura de três camadas de seqüência ABA. Podemos continuar a colocar camadas sobre camadas, formando a estrutura ABABABAB, como mostrado na figura 4.11(c). Ao fazermos isto, criamos a estrutura hexagonal compacta, onde a camada A forma a base e a camada B o plano atômico intermediário. A segunda maneira de colocar a terceira camada é colocar as esferas sobre os espaços denominados C. Deste modo fazemos uma estrutura do tipo do tipo ABC. Ao continuarmos o empilhamento, formamos a seqüência ABCABCABC. Esta estrutura é a cúbica de face centrada, vista do plano (111). Veja as figuras 4.11(d,e). 49
12 Estas estruturas possuem o melhor empacotamento porque a ocupação dos interstícios produz a maior proximidade possível entre as esferas. Em muitas ocasiões, a seqüência de empilhamento das esferas não é perfeita, podendo conter falhas do tipo ABABCABAB ou ABCABABC. Estas são as chamadas falhas de empilhamento ou stacking faults Materiais policristalinos e anisotropia. A presença de defeitos da rede cristalina é energeticamente favorável, isto é, decresce a energia livre do material através do aumento de sua entropia. Por esta razão, não existem cristais perfeitos, por mais cuidadosamente que se tente obtê-los. Um dos defeitos mais freqüentes é a existência de muitos cristais em materiais. Isto significa que os materiais em seu formato macroscópico são formados pela coleção de um grande número de monocristais. Um monocristal é uma parte do material que possui uma única ordem cristalina e é denominada de grão. Nos policristais, a ordem cristalina muda. As regiões de contorno entre os monocristais são chamadas de contornos de grão. A formação de materiais policristalinos a partir da solidificação é um processo natural, pois a fase sólida começa a se formar (nuclear) em diferentes lugares do material líquido. Este pequenos núcleos formam os monocristais e vão crescendo, até que todo o líquido seja solidificado e os monocristais toquem uns aos outros. A figura 4.12 ilustra o processo. Em um monocristal, os diferentes planos e direções cristalinas possuem normalmente diferentes arranjos atômicos, isto é, densidade atômica. A densidade atômica de direções e planos muitas vezes determinam as propriedades do material. Portanto, se as densidades mudam de acordo com as direções, então mudam também as propriedades. Na maioria das estruturas cristalinas sempre existem assimetrias que causam bastante mudança das densidades atômicas. Ao fato da mudança das propriedades com a direção cristalina, damos o nome de anisotropia. Nos materiais policristalinos, os grãos estão orientados em todas as direções, de modo que a anisotropia dos grãos individuais é anulada pelos demais grãos da estrutura macroscópica. Assim, os materiais policristalinos são, em geral, isotrópicos. 50
13 Figura 4.12: processo de solidificação com formação de material policristalino. Fonte: W. Callister Cerâmicas Cristalinas O nome cerâmica é derivado do grego keramikos que significa material queimado. Isto porque as propriedades que se queria obter de certos materiais eram obtidas através da queima deles. Por muito tempo, o termo foi aplicado a materiais usados em louça, porcelana, tijolos, telhas, etc. Posteriormente, o vidro e outros materiais usados em altas temperaturas passaram a ser tratados por este nome também. Atualmente, os materiais mais rústicos como porcelana e tijolos são tratados como cerâmica tradicional ou estrutural e uma categoria nova de materiais cerâmicos foi desenvolvida com alta tecnologia, envolvendo extremo controle das etapas de síntese da matéria prima e seu processamento. Enquanto as matérias primas dos produtos cerâmicos estruturais são encontradas e coletadas na natureza sem preocupação com a pureza, os materiais cerâmicos de alta tecnologia são em geral sintetizados industrialmente com rigoroso controle de composição. Enquanto as cerâmicas tradicionais são processadas por métodos rústicos, as cerâmicas avançadas exigem equipamentos sofisticados e condições bem controladas. Em compensação, as aplicações das cerâmicas avançadas são muito mais sofisticadas. Elas exibem uma larga variedade de propriedades e são usadas em condições muito mais rigorosas que as cerâmicas tradicionais. Em termos químicos, os materiais cerâmicos são formados por elementos não metálicos, ligados ionicamente ou covalentemente. Assim, hidróxidos, óxidos, nitretos, boretos, hidretos e carbetos são considerados cerâmicos. As ligações covalentes envolvem geralmente elementos com tendência de ceder elétrons e com eletronegatividades próximas. As ligações iônicas envolvem elementos eletropositivos e eletronegativos, ou seja, de eletronegatividades bem diferentes. Deste modo, um dos elementos tende a ceder e o outro a receber elétrons. Entretanto, não se pode falar que uma ligação é completamente iônica ou completamente covalente, pois os átomos mais eletronegativos sempre tendem a puxar mais para si os elétrons, o que caracterizaria uma ionização parcial dos átomos. Um exemplo disso é o SiO 2. Este material é ora tratado como covalente ora tratado como iônico. Raramente um material covalente é cristalino, o SiO 2 é. Os tetraedros conseguem se unir, formando uma cadeia tridimensional. Porém, o oxigênio é ligeiramente mais eletronegativo que o silício, por isso tende a atrair mais os elétrons para si. Daí o caráter iônico da ligação. Além disso, como veremos adiante, a forma tetraédrica em que os átomos de Si e O estão dispostos é também uma característica das ligações iônicas. Os carbetos são geralmente iônicos ou covalentes, havendo um caráter de ambos os tipos. Porém alguns carbetos de metais de transição conduzem carga elétrica. Diz-se então que eles têm também um caráter metálico em suas ligações. Portanto, os materiais raramente exibem um caráter puro de suas ligações. 51
14 Figura 4.38: Estrutura do grafite. Fonte: W. Callister. Figura 4.39: Estrutura do fulereno C 60. Fonte: W. Callister Defeitos em Cristais As estruturas cristalinas sempre possuem imperfeições. Cristais com um mínimo de defeitos só são possíveis com enorme controle no processo de crescimento. A presença de imperfeições é energeticamente favorável, pois minimiza a energia livre através do aumento da entropia do cristal. Diversos são os tipos de imperfeição. As imperfeições na rede cristalina de uma cerâmica trazem mais implicações que em um metal, devido ao balanceamento de carga na rede. Os defeitos nas estruturas cristalinas podem ser classificados como defeitos de ponto, de linha e de superfície. 71
15 Os defeitos de superfície são considerados as fronteiras de grão e as falhas de empilhamento. Estes últimos são interrupções da seqüência normal de empilhamento dos átomos nas estruturas compactas. Vimos que uma estrutura cfc pode ser entendida como uma seqüência de dois tipos de camadas, como por exemplo ABCABC. Uma falha seria a modificação da seqüência para ABABC. Um segundo tipo de defeito do tipo é a chamada inversão da seqüência, como no caso ABCABCBACBA. Este tipo de defeito altera ligeiramente a energia da estrutura, porque os planos atômicos são normais, apenas a seqüência é modificada. Os defeitos de linha são as discordâncias. Existem as discordâncias em linha, ou cunha, e as discordâncias em hélice. O primeiro tipo é nada mais que um semiplano de átomos que é colocado entre dois planos da estrutura. O segundo tipo é um deslocamento entre planos atômicos adjacentes. Sua ocorrência nos materiais cerâmicos é muito mais difícil que nos materiais metálicos, devido às implicações de equilíbrio de carga elétrica e de empilhamento iônico. Como as discordâncias são responsáveis pela plasticidade dos metais, tem-se o porquê das cerâmicas apresentarem propriedades plásticas tão pobres, comparativamente. Os defeitos mais importantes e freqüentes são os do tipo pontual. É sempre válido informar que os defeitos em estruturas cristalinas sempre produzem deformações na rede, aumentando assim sua energia, porém, no caso das cerâmicas iônicas, existe uma preocupação a mais, que é o balanceamento elétrico da estrutura. Os defeitos pontuais aqui expostos irão expressar esta condição. Defeito de Frenkel Tanto vacâncias quanto posições intersticiais ocupadas podem ocorrer nas cerâmicas, a exemplo dos metais, tanto para os ânions quanto para os cátions. Entretanto, uma vez que os ânions são muitas vezes bem maiores que os cátions, um ânion intersticial produziria muita deformação da rede. Por isso, este tipo de defeito não é comum. O defeito de Frenkel é aquele em que existe um interstício catiônico e, para compensar eletricamente, existe uma vacância catiônica. A figura 4.40 mostra o defeito de Frenkel. Figura 4.40: Defeitos dos tipos Frenkel e Schottky. Fonte: W. Callister. Defeito de Schottky Neste caso, há uma vacância de ânion. Para compensar eletricamente, há também uma vacância de cátion. Deste modo, assim como no defeito de Frenkel, o número relativo de ânions e cátions não se altera. A figura 4.40 também mostra um defeito de Schottky. 72
16 Defeitos tais como interstícios e vacâncias estão também associados a estruturas não estequiométricas. A estequiometria de uma estrutura pode ser quebrada com a existência de íons de mais de uma valência. Como exemplo, tome-se a wustita (FeO). O Fe pode apresentar duas valências: +2 e +3. A concentração de íons dessas valências depende da temperatura e da pressão parcial de oxigênio no ambiente. O oxigênio é sempre 2. Isto significa que para cada cátion Fe +3 na estrutura, ela fica carregada com uma carga positiva em excesso. Para compensar isso, uma vacância de cátion Fe +2 é criada para cada dois cátions Fe +3 presentes na estrutura. A figura 4.41 mostra isso. Note que agora, o número relativo de ânions e cátions é modificado. A composição agora é outra, não estequiométrica. Muitas vezes, a composição da wustita é escrita como Fe 1-x O. Há também a possibilidade de átomos de outros elementos que não aqueles da rede hospedeira estejam presentes na estrutura, ocupando posições substitucionais ou intersticiais. Estes átomos são considerados impurezas. As condições que determinam se um determinado átomo pode ou não ser impureza em certa rede são de tamanho e de carga. Caso seja substitucional, a impureza não pode ser muito maior ou menor que o íon que substitui. Caso seja intersticial, seu tamanho deve ser bem menor que o tamanho do ânion, para que caiba no espaço disponível. Caso a carga do íon impureza seja diferente daquela do íon que ele substitui, ouro evento deverá ocorrer para que o equilíbrio elétrico seja conservado. Uma possibilidade é a criação de defeitos tais como vacâncias e interstícios. A figura 4.42 esquematiza os defeitos do tipo impureza intersticial e substitucional. Figura 4.41: A ocorrência de íons de diferentes valências introduz defeitos na rede e leva a uma composição não estequiométrica. Fonte: W. Callister. Figura 4.42: Impurezas substitucionais e intersticiais. Fonte: W. Callister. 73
17 As discordâncias Quando uma rede cristalina é submetida a tensões externas, ela se deforma. Esta deformação pode ser permanente, denominada plástica. Este tipo de deformação decorre do deslocamento relativo não reversível dos átomos. A primeira explicação para este fenômeno foi formulada por J. Frenkel, em Ele defendia que a deformação consistia do deslizamento de um plano cristalino em relação a outro. Assim, todos os átomos pertencentes a um dado plano, se deslocariam em conjunto da mesma quantidade, na mesma direção e sentido. A figura 4.43 ilustra o processo. Ele calculou a tensão necessária para que isto ocorresse e o resultado é um valor bem superior aos valores determinados experimentalmente. Em 1934, Orowan, Polanyi e Taylor propuseram independentemente a existência de um mecanismo de deformação que explicava melhor os valores de tensões de deformação experimentalmente medidos. Este mecanismo de baseia em um tipo de defeito cristalino, denominado defeito de linha, a discordância. A existência deste defeito foi somente comprovada em 1949, com o uso de microscopia eletrônica de transmissão. Até esta data, toda a teoria de discordância e deformação baseada no movimento destas discordâncias havia sido construída. Figura 4.43: O modelo de Frenkel para explicar a plasticidade: o deslizamento simultâneo de todos os átomos de planos adjacentes. Fonte: A.F. Padilha. Existem dois tipos de discordâncias: a discordância em cunha e a discordância em hélice. A discordância em cunha consiste de um plano atômico que se interpõe entre dois planos atômicos regulares. Veja figura A discordância em hélice consiste de um deslocamento de poucos átomos de um plano com respeito aos átomos do plano adjacente. Veja figura
18 Figura 4.44: a discordância em cunha formada pelo plano extra de átomos. O vetor de Burgers que mede a deformação causada na rede (direita) e a linha de discordância (esquerda), que marca o local onde está o plano extra. Fonte: A.F. Padilha. Discordâncias puras de cunha ou de hélice são raras. O mais comum é encontrar discordâncias mistas, que são compostas por uma combinação de discordância em cunha e em hélice. A figura 4.46 ilustra uma discordância mista. Figura 4.45: Discordância em hélice. Vetor de Burgers (esquerda) e linha de discordância (direita). Fonte: D. Richerson e A.F. Padilha. 75
19 Figura 4.46: Discordância mista. Vetor de Burgers e linha de discordância. Fonte: W. Callister. Na descrição de uma discordância, dois parâmetros são importantes: a linha de discordância e o vetor de Burgers. A linha de discordância marca o término do plano atômico extra na discordância em cunha. Na discordância em hélice, ela acompanha a região onde há o deslocamento dos átomos. O vetor de Burgers mede a deformação da rede, dimensionando o deslocamento atômico sofrido devido á discordância. Na discordância em cunha, o vetor de Burgers é perpendicular à linha de discordância. Na discordância em hélice, o vetor de Burgers é paralelo à linha de discordância. Contornos de macla Este tipo de defeito pode ser causado por deformações ou por recozimento (tratamentos de recristalização). Pode ainda surgir durante o crescimento do grão, na solidificação. Trata-se de uma deformação especular da rede. Determinada região fica deformada em relação à outra. As estruturas são idênticas, mas parecem deslocadas em relação à outra, como se olhadas em um espelho. A figura 4.47 ilustra um caso. As maclas de deformação possuem contornos curvilíneos e as de recozimento ou crescimento possuem os contornos retilíneos. Estes contornos podem ser coerentes ou incoerentes, dependendo do grau de coincidência entre os átomos. A maclação é mais freqüente em sistemas cristalinos que não possuem muitos planos de deslizamento. A maclação envolve o movimento de muitos átomos, embora seja um pequeno deslocamento. A energia para este deslocamento é, em geral, maior que a energia para o movimento de discordâncias. A maclação ocorre, portanto, quando o sistema não pode se deformar pelo movimento de discordâncias. Interfaces Os materiais polifásicos são aqueles cujas estruturas apresentam mais de uma fase. Neste caso, conforme a coerência existente entre as estruturas de grãos adjacentes de fases diferentes, podemos classificar estas interfaces em coerentes, semicoerente e incoerentes. No primeiro caso, as fases devem ter estruturas cristalinas semelhante e parâmetros de rede aproximados. Uma das fases deve estar presente como precipitações menores que 0,1μm. No segundo caso, é possível encontrar algum grau de coerência entre as fases, mesmo tendo elas diferentes estruturas, quando discordâncias no contorno aumentam o nível de coincidência entre as posições das redes. O último caso é mais comum. Neste caso, há um completo desacordo entre as posições atômicas das fases adjacentes. A figura 4.48 ilustra os três casos. 76
20 Figura 4.47: Maclação: deslocamento atômico, contornos de macla devido à deformação e à recozimento, contornos coerentes e incoerentes. Fonte: A.F. Padilha. Figura 4.48: Interfaces coerente, semicoerente e incoerente, respectivamente, entre fases distintas. Fonte: A.F.Padilha. 77
ARRANJOS ATÔMICOS. Química Aplicada. Profº Vitor de Almeida Silva
 ARRANJOS ATÔMICOS Química Aplicada Profº Vitor de Almeida Silva 1. Arranjo Periódico de Átomos SÓLIDO: Constituído por átomos (ou grupo de átomos) que se distribuem de acordo com um ordenamento bem definido;
ARRANJOS ATÔMICOS Química Aplicada Profº Vitor de Almeida Silva 1. Arranjo Periódico de Átomos SÓLIDO: Constituído por átomos (ou grupo de átomos) que se distribuem de acordo com um ordenamento bem definido;
Ligações químicas e estrutura dos materiais
 Disciplina : - MFI Professores: Guilherme Ourique Verran - Dr. Eng. Metalúrgica Aula 02 Revisão de alguns conceitos fundamentais da Ciência dos Materiais Ligações químicas e estrutura dos materiais Conceitos
Disciplina : - MFI Professores: Guilherme Ourique Verran - Dr. Eng. Metalúrgica Aula 02 Revisão de alguns conceitos fundamentais da Ciência dos Materiais Ligações químicas e estrutura dos materiais Conceitos
Introdução a Engenharia e Ciência dos Materiais
 Introdução a Engenharia e Ciência dos Materiais Estrutura Cristalina Prof. Vera L Arantes 2014 25/3/2014 ESTRUTURA CRISTALINA 2 ARRANJO ATÔMICO Por que estudar? As propriedades de alguns materiais estão
Introdução a Engenharia e Ciência dos Materiais Estrutura Cristalina Prof. Vera L Arantes 2014 25/3/2014 ESTRUTURA CRISTALINA 2 ARRANJO ATÔMICO Por que estudar? As propriedades de alguns materiais estão
estrutura atômica cristalino
 Aula 0b estrutura atômica cristalina ZEA 1038 Ciência e Tecnologia dos Materiais Prof. João Adriano Rossignolo Profa. Eliria M.J.A. Pallone estrutura atômica cristalino 1 CRISTAL ESTRUTURA CRISTALINA Muitos
Aula 0b estrutura atômica cristalina ZEA 1038 Ciência e Tecnologia dos Materiais Prof. João Adriano Rossignolo Profa. Eliria M.J.A. Pallone estrutura atômica cristalino 1 CRISTAL ESTRUTURA CRISTALINA Muitos
Introdução aos Materiais Imperfeições em Sólidos Metais DEMEC TM229 Prof Adriano Scheid
 Introdução aos Materiais Imperfeições em Sólidos Metais DEMEC TM229 Prof Adriano Scheid Introdução Os sólidos contém inúmeras imperfeições nas estruturas cristalinas e muitas propriedades são alteradas
Introdução aos Materiais Imperfeições em Sólidos Metais DEMEC TM229 Prof Adriano Scheid Introdução Os sólidos contém inúmeras imperfeições nas estruturas cristalinas e muitas propriedades são alteradas
Ciências dos materiais- 232
 1 Ciências dos materiais- 232 2 a aula - Ligações químicas - Estruturas Cristalinas Quinta Quinzenal Semana par 10/03/2015 1 Professor: Luis Gustavo Sigward Ericsson Curso: Engenharia Mecânica Série: 5º/
1 Ciências dos materiais- 232 2 a aula - Ligações químicas - Estruturas Cristalinas Quinta Quinzenal Semana par 10/03/2015 1 Professor: Luis Gustavo Sigward Ericsson Curso: Engenharia Mecânica Série: 5º/
Estrutura de Sólidos Cristalinos. Profa. Dra Daniela Becker
 Estrutura de Sólidos Cristalinos Profa. Dra Daniela Becker Bibliografia Callister Jr., W. D. Ciência e engenharia de materiais: Uma introdução. LTC, 5ed., cap 3, 2002. Shackelford, J.F. Ciências dos Materiais,
Estrutura de Sólidos Cristalinos Profa. Dra Daniela Becker Bibliografia Callister Jr., W. D. Ciência e engenharia de materiais: Uma introdução. LTC, 5ed., cap 3, 2002. Shackelford, J.F. Ciências dos Materiais,
DEFEITOS CRISTALINOS
 ESCOLA POLITÉCNICA DA UNIVERSIDADE DE SÃO PAULO Departamento de Engenharia Metalúrgica e de Materiais DEFEITOS CRISTALINOS PMT 2100 - Introdução à Ciência dos Materiais para Engenharia 2º Semestre de 2005
ESCOLA POLITÉCNICA DA UNIVERSIDADE DE SÃO PAULO Departamento de Engenharia Metalúrgica e de Materiais DEFEITOS CRISTALINOS PMT 2100 - Introdução à Ciência dos Materiais para Engenharia 2º Semestre de 2005
Fotografia de vários cristais de fluorita CaF 2 3-0
 Arranjos Atômicos Fotografia de vários cristais de fluorita CaF 2 3-0 Conceito de Cristalinidade Cristalinidade corresponde a forma de organização da estrutura em um modelo ordenado e repetitivo de longo
Arranjos Atômicos Fotografia de vários cristais de fluorita CaF 2 3-0 Conceito de Cristalinidade Cristalinidade corresponde a forma de organização da estrutura em um modelo ordenado e repetitivo de longo
PMT Fundamentos de Ciência e Engenharia dos Materiais 2º semestre de 2014
 ESCOLA POLITÉCNICA DA UNIVERSIDADE DE SÃO PAULO Departamento de Engenharia Metalúrgica e de Materiais PMT 3100 - Fundamentos de Ciência e Engenharia dos Materiais 2º semestre de 2014 ESTRUTURA DOS SÓLIDOS
ESCOLA POLITÉCNICA DA UNIVERSIDADE DE SÃO PAULO Departamento de Engenharia Metalúrgica e de Materiais PMT 3100 - Fundamentos de Ciência e Engenharia dos Materiais 2º semestre de 2014 ESTRUTURA DOS SÓLIDOS
TP064 - CIÊNCIA DOS MATERIAIS PARA EP. FABIANO OSCAR DROZDA
 TP064 - CIÊNCIA DOS MATERIAIS PARA EP FABIANO OSCAR DROZDA fabiano.drozda@ufpr.br 1 AULA 03 ESTRUTURA DOS SÓLIDOS CRISTALINOS 2 BREVE REVISÃO AULA PASSADA LIGAÇÕES QUÍMICAS Ligações primárias ou fortes
TP064 - CIÊNCIA DOS MATERIAIS PARA EP FABIANO OSCAR DROZDA fabiano.drozda@ufpr.br 1 AULA 03 ESTRUTURA DOS SÓLIDOS CRISTALINOS 2 BREVE REVISÃO AULA PASSADA LIGAÇÕES QUÍMICAS Ligações primárias ou fortes
ESTRUTURA DOS SÓLIDOS CRISTALINOS. Mestranda: Marindia Decol
 ESTRUTURA DOS SÓLIDOS CRISTALINOS Mestranda: Marindia Decol Bibliografia Callister Jr., W. D. Ciência e engenharia de materiais: Uma introdução. LTC, 5ed., cap 3, 2002. Shackelford, J.F. Ciências dos Materiais,
ESTRUTURA DOS SÓLIDOS CRISTALINOS Mestranda: Marindia Decol Bibliografia Callister Jr., W. D. Ciência e engenharia de materiais: Uma introdução. LTC, 5ed., cap 3, 2002. Shackelford, J.F. Ciências dos Materiais,
ESTRUTURA CRISTALINA E IMPERFEIÇÕES NOS SÓLIDOS ESTRUTURA CRISTALINA E IMPERFEIÇÕES NOS SÓLIDOS
 ESTRUTURA CRISTALINA E IMPERFEIÇÕES NOS SÓLIDOS Prof. Dr.: Anael Krelling 1 CONCEITOS FUNDAMENTAIS Materiais sólidos podem ser classificados de acordo com a regularidade com que os seus átomos ou íons
ESTRUTURA CRISTALINA E IMPERFEIÇÕES NOS SÓLIDOS Prof. Dr.: Anael Krelling 1 CONCEITOS FUNDAMENTAIS Materiais sólidos podem ser classificados de acordo com a regularidade com que os seus átomos ou íons
Estruturas cristalinas - Reticulado cristalino
 Página 1 de 9 MENU PRINCIPAL CONTEUDO TÉCNICO DOWNLOAD CONTATO ENTRETENIMENTO LOGIN search.... Home PAINEL Ciência dos Materiais Estruturas cristalinas - Reticulado cristalino Estruturas cristalinas -
Página 1 de 9 MENU PRINCIPAL CONTEUDO TÉCNICO DOWNLOAD CONTATO ENTRETENIMENTO LOGIN search.... Home PAINEL Ciência dos Materiais Estruturas cristalinas - Reticulado cristalino Estruturas cristalinas -
ESTRUTURA DOS SÓLIDOS
 ESCOLA POLITÉCNICA DA UNIVERSIDADE DE SÃO PAULO Departamento de Engenharia Metalúrgica e de Materiais ESTRUTURA DOS SÓLIDOS PMT 2100 - Introdução à Ciência dos Materiais para Engenharia 2º semestre de
ESCOLA POLITÉCNICA DA UNIVERSIDADE DE SÃO PAULO Departamento de Engenharia Metalúrgica e de Materiais ESTRUTURA DOS SÓLIDOS PMT 2100 - Introdução à Ciência dos Materiais para Engenharia 2º semestre de
ESTRUTURA DOS SÓLIDOS CRISTALINOS CAP. 03 Parte II
 UNIVERSIDADE DO ESTADO DE SANTA CATARINA CENTRO DE CIÊNCIAS TECNOLÓGICAS DEPARTAMENTO DE ENGENHARIA MECÂNICA PROGRAMA DE PÓS-GRADUAÇÃO EM CIÊNCIA E ENGENHARIA DE MATERIAIS - PGCEM ESTRUTURA DOS SÓLIDOS
UNIVERSIDADE DO ESTADO DE SANTA CATARINA CENTRO DE CIÊNCIAS TECNOLÓGICAS DEPARTAMENTO DE ENGENHARIA MECÂNICA PROGRAMA DE PÓS-GRADUAÇÃO EM CIÊNCIA E ENGENHARIA DE MATERIAIS - PGCEM ESTRUTURA DOS SÓLIDOS
4- IMPERFEIÇÕES CRISTALINAS
 ASSUNTO 4- IMPERFEIÇÕES CRISTALINAS - Defeitos pontuais - Defeitos de linha (discordâncias) - Defeitos de interface (grão e maclas) - Defeitos volumétricos (inclusões, precipitados) Eleani Maria da Costa
ASSUNTO 4- IMPERFEIÇÕES CRISTALINAS - Defeitos pontuais - Defeitos de linha (discordâncias) - Defeitos de interface (grão e maclas) - Defeitos volumétricos (inclusões, precipitados) Eleani Maria da Costa
ESCOLA POLITÉCNICA DA UNIVERSIDADE DE SÃO PAULO Departamento de Engenharia Metalúrgica e de Materiais. Unidade 4 ESTRUTURA DOS SÓLIDOS CRISTALINOS
 ESCOLA POLITÉCNICA DA UNIVERSIDADE DE SÃO PAULO Departamento de Engenharia Metalúrgica e de Materiais Unidade 4 ESTRUTURA DOS SÓLIDOS CRISTALINOS PMT 3100 - Fundamentos de Ciência e Engenharia dos Materiais
ESCOLA POLITÉCNICA DA UNIVERSIDADE DE SÃO PAULO Departamento de Engenharia Metalúrgica e de Materiais Unidade 4 ESTRUTURA DOS SÓLIDOS CRISTALINOS PMT 3100 - Fundamentos de Ciência e Engenharia dos Materiais
ESTRUTURA CRISTALINA E IMPERFEIÇÕES NOS SÓLIDOS ESTRUTURA CRISTALINA E IMPERFEIÇÕES NOS SÓLIDOS
 ESTRUTURA CRISTALINA E IMPERFEIÇÕES NOS SÓLIDOS Prof. M.Sc.: Anael Krelling 1 CONCEITOS FUNDAMENTAIS Materiais sólidos podem ser classificados de acordo com a regularidade com que os seus átomos ou íons
ESTRUTURA CRISTALINA E IMPERFEIÇÕES NOS SÓLIDOS Prof. M.Sc.: Anael Krelling 1 CONCEITOS FUNDAMENTAIS Materiais sólidos podem ser classificados de acordo com a regularidade com que os seus átomos ou íons
UNIVERSIDADE FEDERAL DO ABC BC-1105: MATERIAIS E SUAS PROPRIEDADES
 UNIVERSIDADE FEDERAL DO ABC Centro de Engenharia, Modelagem e Ciências Sociais Aplicadas (CECS) BC-1105: MATERIAIS E SUAS PROPRIEDADES Estrutura Cristalina - direções e planos cristalográficos - alotropia
UNIVERSIDADE FEDERAL DO ABC Centro de Engenharia, Modelagem e Ciências Sociais Aplicadas (CECS) BC-1105: MATERIAIS E SUAS PROPRIEDADES Estrutura Cristalina - direções e planos cristalográficos - alotropia
IMPERFEIÇÕES EM SÓLIDOS. Bento Gonçalves, 2014.
 IMPERFEIÇÕES EM SÓLIDOS Bento Gonçalves, 2014. O QUE É UM DEFEITO? É uma imperfeição ou um "erro" no arranjo cristalino dos átomos em um cristal. Podem envolver uma irregularidade: Na posição dos átomos
IMPERFEIÇÕES EM SÓLIDOS Bento Gonçalves, 2014. O QUE É UM DEFEITO? É uma imperfeição ou um "erro" no arranjo cristalino dos átomos em um cristal. Podem envolver uma irregularidade: Na posição dos átomos
Estruturas dos Materiais
 Sumário Conceitos 1 Constituição de um átomo.......................... 1 Propriedade dos átomos........................... 1 Ligações químicas 2 Ligações Primárias............................... 2 Ligação
Sumário Conceitos 1 Constituição de um átomo.......................... 1 Propriedade dos átomos........................... 1 Ligações químicas 2 Ligações Primárias............................... 2 Ligação
ORDEM. Periocidade. SÓLIDO CRISTALINO OU CRISTAL agregado ordenado e periódico de átomos, moléculas ou iões, formando uma estrutura cristalina regular
 Capítulo I ESTRUTURA CRISTALINA DE SÓLIDOS ORDEM curto alcance médio alcance longo alcance Periocidade unidimensional bidimensional tridimensional SÓLIDO CRISTALINO OU CRISTAL agregado ordenado e periódico
Capítulo I ESTRUTURA CRISTALINA DE SÓLIDOS ORDEM curto alcance médio alcance longo alcance Periocidade unidimensional bidimensional tridimensional SÓLIDO CRISTALINO OU CRISTAL agregado ordenado e periódico
Estrutura Cristalina dos Sólidos (Arranjos Atômicos)
 Estrutura Cristalina dos Sólidos (Arranjos Atômicos) INTRODUÇÃO As propriedades dos materiais dependem dos arranjos dos seus átomos. Esses arranjos podem ser classificados em: Estruturas moleculares: agrupamento
Estrutura Cristalina dos Sólidos (Arranjos Atômicos) INTRODUÇÃO As propriedades dos materiais dependem dos arranjos dos seus átomos. Esses arranjos podem ser classificados em: Estruturas moleculares: agrupamento
ESTRUTURA DOS SÓLIDOS CRISTALINOS CAP. 03
 UNIVERSIDADE DO ESTADO DE SANTA CATARINA CENTRO DE CIÊNCIAS TECNOLÓGICAS DEPARTAMENTO DE ENGENHARIA MECÂNICA ESTRUTURA DOS SÓLIDOS CRISTALINOS CAP. 03 CMA CIÊNCIA DOS MATERIAIS 2º Semestre de 2014 Prof.
UNIVERSIDADE DO ESTADO DE SANTA CATARINA CENTRO DE CIÊNCIAS TECNOLÓGICAS DEPARTAMENTO DE ENGENHARIA MECÂNICA ESTRUTURA DOS SÓLIDOS CRISTALINOS CAP. 03 CMA CIÊNCIA DOS MATERIAIS 2º Semestre de 2014 Prof.
30 Exercícios Resolvidos CAPÍTULO 3 ESTRUTURA CRISTALINA
 IFRS - Mestrado em Tecnologia e Engenharia de Materiais DISCIPLINA: Ciência dos Materiais PROFESSOR: Juliano Toniollo ALUNO: PAULO CESAR FRITZEN 30 Exercícios Resolvidos CAPÍTULO 3 ESTRUTURA CRISTALINA
IFRS - Mestrado em Tecnologia e Engenharia de Materiais DISCIPLINA: Ciência dos Materiais PROFESSOR: Juliano Toniollo ALUNO: PAULO CESAR FRITZEN 30 Exercícios Resolvidos CAPÍTULO 3 ESTRUTURA CRISTALINA
Fundamentos de Ciência e Engenharia de Materiais. DEFEITOS CRISTALINOS Prof. Dr. André Paulo Tschiptschin
 Fundamentos de Ciência e Engenharia de Materiais DEFEITOS CRISTALINOS Prof. Dr. André Paulo Tschiptschin Defeitos cristalinos Defeito cristalino: imperfeição do reticulado cristalino Classificação dos
Fundamentos de Ciência e Engenharia de Materiais DEFEITOS CRISTALINOS Prof. Dr. André Paulo Tschiptschin Defeitos cristalinos Defeito cristalino: imperfeição do reticulado cristalino Classificação dos
AULA 04 IMPERFEIÇÕES CRISTALINAS Capítulo 04
 AULA 04 IMPERFEIÇÕES CRISTALINAS Capítulo 04 1 IMPERFEIÇÕES CRISTALINAS Estrutura perfeita no arranjo atômico, existe?? Material Cristalino 2 IMPERFEIÇÕES CRISTALINAS 3 Imagem representagva de um plano
AULA 04 IMPERFEIÇÕES CRISTALINAS Capítulo 04 1 IMPERFEIÇÕES CRISTALINAS Estrutura perfeita no arranjo atômico, existe?? Material Cristalino 2 IMPERFEIÇÕES CRISTALINAS 3 Imagem representagva de um plano
Centro Universitário da Fundação Educacional de Barretos. Princípio de Ciências dos Materiais Prof.: Luciano H. de Almeida
 Centro Universitário da Fundação Educacional de Barretos Princípio de Ciências dos Materiais Prof.: Luciano H. de Almeida Porque estudar estrutura atômica? Ligação atômica e as propriedades dos materiais
Centro Universitário da Fundação Educacional de Barretos Princípio de Ciências dos Materiais Prof.: Luciano H. de Almeida Porque estudar estrutura atômica? Ligação atômica e as propriedades dos materiais
Os materiais no estado sólido ocupam geralmente menos volume que no estado líquido (fundido).
 Instituto de Ciência e Tecnologia de Sorocaba Materiais e Reciclagem 3 Arranjo Atômico e Cristalografia Professor Sandro Donnini Mancini Sorocaba, Fevereiro de 2018. Os materiais no estado sólido ocupam
Instituto de Ciência e Tecnologia de Sorocaba Materiais e Reciclagem 3 Arranjo Atômico e Cristalografia Professor Sandro Donnini Mancini Sorocaba, Fevereiro de 2018. Os materiais no estado sólido ocupam
ESTADOS EXCITADOS: fonões, electrões livres
 Capítulo III.1 DEFEITOS (IMPERFEIÇÕES) NOS SÓLIDOS CRISTALINOS ESTADOS EXCITADOS: fonões, electrões livres DEFEITOS TRANSIENTES: fotões, electrões, neutrões tõ IMPERFEIÇÕES ESTRUTURAIS IMPORTÂNCIA DEFEITOS
Capítulo III.1 DEFEITOS (IMPERFEIÇÕES) NOS SÓLIDOS CRISTALINOS ESTADOS EXCITADOS: fonões, electrões livres DEFEITOS TRANSIENTES: fotões, electrões, neutrões tõ IMPERFEIÇÕES ESTRUTURAIS IMPORTÂNCIA DEFEITOS
UNIVERSIDADE DO ESTADO DE SANTA CATARINA CENTRO DE CIÊNCIAS TECNOLÓGICAS DEPARTAMENTO DE QUÍMICA - DQMC. Estrutura Interna. Prof Karine P.
 UNIVERSIDADE DO ESTADO DE SANTA CATARINA CENTRO DE CIÊNCIAS TECNOLÓGICAS DEPARTAMENTO DE QUÍMICA - DQMC Estrutura Interna Prof Karine P. Naidek Estrutura Cristalina Os materiais sólidos podem ser classificados
UNIVERSIDADE DO ESTADO DE SANTA CATARINA CENTRO DE CIÊNCIAS TECNOLÓGICAS DEPARTAMENTO DE QUÍMICA - DQMC Estrutura Interna Prof Karine P. Naidek Estrutura Cristalina Os materiais sólidos podem ser classificados
Introdução aos Materiais A Estrutura em Sólidos Cristalinos Metais DEMEC TM229 Prof. Adriano Scheid
 Introdução aos Materiais A Estrutura em Sólidos Cristalinos Metais DEMEC TM229 Prof. Adriano Scheid Introdução: Diversas propriedades dos sólidos estão relacionadas à Estrutura Cristalina. Não somente
Introdução aos Materiais A Estrutura em Sólidos Cristalinos Metais DEMEC TM229 Prof. Adriano Scheid Introdução: Diversas propriedades dos sólidos estão relacionadas à Estrutura Cristalina. Não somente
Defeitos cristalinos. (monocristais) Ponto. Superfície
 [7] Defeitos cristalinos 1> Ligações atômicas propriedades resistência teórica (monocristais) causa da discrepância > resistência experimental defeitos cristalinos Ponto Defeitos cristalinos Linha Superfície
[7] Defeitos cristalinos 1> Ligações atômicas propriedades resistência teórica (monocristais) causa da discrepância > resistência experimental defeitos cristalinos Ponto Defeitos cristalinos Linha Superfície
COMPORTAMENTO MECÂNICO DOS MATERIAIS: DEFEITOS CRISTALINOS E DEFORMAÇÃO PLÁSTICA
 UNIVERSIDADE FEDERAL DO ABC Centro de Engenharia, Modelagem e Ciências Sociais Aplicadas (CECS) BC-1105: MATERIAIS E SUAS PROPRIEDADES COMPORTAMENTO MECÂNICO DOS MATERIAIS: DEFEITOS CRISTALINOS E DEFORMAÇÃO
UNIVERSIDADE FEDERAL DO ABC Centro de Engenharia, Modelagem e Ciências Sociais Aplicadas (CECS) BC-1105: MATERIAIS E SUAS PROPRIEDADES COMPORTAMENTO MECÂNICO DOS MATERIAIS: DEFEITOS CRISTALINOS E DEFORMAÇÃO
MATERIAIS CERÂMICOS E POLIMÉRICOS
 MATERIAIS CERÂMICOS E POLIMÉRICOS Curso: Engenharia Mecânica - Terceiro Semestre Letivo Período: Primeiro Semestre 2010 Carga Horária: 60 horas Docente: Prof. Dr. Wagner M. Pachekoski MATERIAIS CERÂMICOS:
MATERIAIS CERÂMICOS E POLIMÉRICOS Curso: Engenharia Mecânica - Terceiro Semestre Letivo Período: Primeiro Semestre 2010 Carga Horária: 60 horas Docente: Prof. Dr. Wagner M. Pachekoski MATERIAIS CERÂMICOS:
Propriedades dos sólidos metálicos. C. E. Housecroft, cap. 6
 C. E. Housecroft, cap. 6 O caráter metálico refere-se às propriedades dos metais (brilhante ou lustroso, maleável e dúctil, os óxidos formam sólidos iônicos básicos e tendem a formar cátions em solução
C. E. Housecroft, cap. 6 O caráter metálico refere-se às propriedades dos metais (brilhante ou lustroso, maleável e dúctil, os óxidos formam sólidos iônicos básicos e tendem a formar cátions em solução
Física dos Materiais FMT0502 ( )
 Física dos Materiais FMT0502 (4300502) 1º Semestre de 2010 Instituto de Física Universidade de São Paulo Professor: Antonio Dominguesdos Santos E-mail: adsantos@if.usp.br Fone: 3091.6886 http://plato.if.usp.br/~fmt0502n/
Física dos Materiais FMT0502 (4300502) 1º Semestre de 2010 Instituto de Física Universidade de São Paulo Professor: Antonio Dominguesdos Santos E-mail: adsantos@if.usp.br Fone: 3091.6886 http://plato.if.usp.br/~fmt0502n/
Física dos Materiais FMT0502 ( )
 Física dos Materiais FMT0502 (4300502) 1º Semestre de 2010 Instituto de Física Universidade de São Paulo Professor: Antonio Dominguesdos Santos E-mail: adsantos@if.usp.br Fone: 3091.6886 http://plato.if.usp.br/~fmt0502n/
Física dos Materiais FMT0502 (4300502) 1º Semestre de 2010 Instituto de Física Universidade de São Paulo Professor: Antonio Dominguesdos Santos E-mail: adsantos@if.usp.br Fone: 3091.6886 http://plato.if.usp.br/~fmt0502n/
Aula 02 (Revisão): Ligação Química e Estruturas Cristalinas
 Aula 02 (Revisão): Ligação Química e Estruturas Cristalinas Prof. Dr. André Luiz Molisani Curso de Engenharia de Materiais e-mail: andre.molisani@fsa.br 2017 1 MATERIAL RECOMENDADO PARA ESTUDO: Capítulo
Aula 02 (Revisão): Ligação Química e Estruturas Cristalinas Prof. Dr. André Luiz Molisani Curso de Engenharia de Materiais e-mail: andre.molisani@fsa.br 2017 1 MATERIAL RECOMENDADO PARA ESTUDO: Capítulo
TM229 - Introdução aos Materiais
 TM229 - Introdução aos Materiais 2009.2 Ana Sofia C. M. D Oliveira Introdução aos materiais O que determina o comportamento/propriedades dos materiais? Composição química e microestrutura Cada uma destas
TM229 - Introdução aos Materiais 2009.2 Ana Sofia C. M. D Oliveira Introdução aos materiais O que determina o comportamento/propriedades dos materiais? Composição química e microestrutura Cada uma destas
Estrutura Cristalina
 Estrutura Cristalina Para todos os tipos de sólidos (metálicos, iónicos, covalentes ou moleculares), a energia de ligação é máxima para uma distância de equílibrio específica r 0. Um sistema de átomos
Estrutura Cristalina Para todos os tipos de sólidos (metálicos, iónicos, covalentes ou moleculares), a energia de ligação é máxima para uma distância de equílibrio específica r 0. Um sistema de átomos
CTM P OBS: Esta prova contém 7 páginas e 6 questões. Verifique antes de começar. VOCÊ DEVE ESCOLHER APENAS 5 QUESTÕES PARA RESOLVER.
 Nome: Assinatura: CTM P1 2014.2 Matrícula: Turma: OBS: Esta prova contém 7 páginas e 6 questões. Verifique antes de começar. VOCÊ DEVE ESCOLHER APENAS 5 QUESTÕES PARA RESOLVER. VOCÊ DEVE RISCAR NA TABELA
Nome: Assinatura: CTM P1 2014.2 Matrícula: Turma: OBS: Esta prova contém 7 páginas e 6 questões. Verifique antes de começar. VOCÊ DEVE ESCOLHER APENAS 5 QUESTÕES PARA RESOLVER. VOCÊ DEVE RISCAR NA TABELA
DEFEITOS CRISTALINOS E DEFORMAÇÃO PLÁSTICA
 ESCOLA POLITÉCNICA DA UNIVERSIDADE DE SÃO PAULO Departamento de Engenharia Metalúrgica e de Materiais DEFEITOS CRISTALINOS E DEFORMAÇÃO PLÁSTICA PMT 2100 - Introdução à Ciência dos Materiais para Engenharia
ESCOLA POLITÉCNICA DA UNIVERSIDADE DE SÃO PAULO Departamento de Engenharia Metalúrgica e de Materiais DEFEITOS CRISTALINOS E DEFORMAÇÃO PLÁSTICA PMT 2100 - Introdução à Ciência dos Materiais para Engenharia
SISTEMA HEXAGONAL SIMPLES
 SISTEMA HEXAGONAL SIMPLES Os metais não cristalizam no sistema hexagonal simples porque o fator de empacotamento é muito baixo Entretanto, cristais com mais de um tipo de átomo cristalizam neste sistema
SISTEMA HEXAGONAL SIMPLES Os metais não cristalizam no sistema hexagonal simples porque o fator de empacotamento é muito baixo Entretanto, cristais com mais de um tipo de átomo cristalizam neste sistema
APONTAMENTOS PRIMEIRA PROVA DE MATERIAIS DE CONSTRUÇÃO I
 APONTAMENTOS PRIMEIRA PROVA DE MATERIAIS DE CONSTRUÇÃO I Normalização na construção civil Normalizar: É padronizar atividades específicas e repetitivas. Normas técnicas: Documentos aprovados por instituições
APONTAMENTOS PRIMEIRA PROVA DE MATERIAIS DE CONSTRUÇÃO I Normalização na construção civil Normalizar: É padronizar atividades específicas e repetitivas. Normas técnicas: Documentos aprovados por instituições
Ligações Atômicas e Bandas de Energia. Livro Texto - Capítulo 2
 40 Ligações Atômicas e Bandas de Energia Livro Texto - Capítulo 2 Ligação Atômica 41 Porque estudar a estrutura atômica? As propriedades macroscópicas dos materiais dependem essencialmente do tipo de ligação
40 Ligações Atômicas e Bandas de Energia Livro Texto - Capítulo 2 Ligação Atômica 41 Porque estudar a estrutura atômica? As propriedades macroscópicas dos materiais dependem essencialmente do tipo de ligação
Defeitos em Cristais Iônicos. Prof Ubirajara Pereira Rodrigues Filho
 Defeitos em Cristais Iônicos Prof Ubirajara Pereira Rodrigues Filho Defeitos Os defeitos perturbam a ordem a longa distância da rede cristalina e afetam as propriedades dos compostos cristalinos que dependem
Defeitos em Cristais Iônicos Prof Ubirajara Pereira Rodrigues Filho Defeitos Os defeitos perturbam a ordem a longa distância da rede cristalina e afetam as propriedades dos compostos cristalinos que dependem
SMM-0194 ENGENHARIA E CIÊNCIA DOS MATERIAIS II I
 SMM-0194 ENGENHARIA E CIÊNCIA DOS MATERIAIS II I Ligação química Estrutura cristalina de cerâmicas cristalinas 2 Ligação química Ligação química 3 % de caráter iônico = {1-exp[-(0,25)(X A -X B ) 2 ]}.100
SMM-0194 ENGENHARIA E CIÊNCIA DOS MATERIAIS II I Ligação química Estrutura cristalina de cerâmicas cristalinas 2 Ligação química Ligação química 3 % de caráter iônico = {1-exp[-(0,25)(X A -X B ) 2 ]}.100
Volume e forma - não são tão fixos como na teoria. Os sólidos sofrem dilatação com o aumento da temperatura, embora outros se contraem.
 Roberto Márcio Assinado de forma digital por Roberto Márcio DN: CN = Roberto Márcio, C = BR, O = Área 1, OU = Faculdade de Ciência e Tecnologia Motivo: Sou o autor deste documento Dados: 2004.08.10 21:56:32-03'00'
Roberto Márcio Assinado de forma digital por Roberto Márcio DN: CN = Roberto Márcio, C = BR, O = Área 1, OU = Faculdade de Ciência e Tecnologia Motivo: Sou o autor deste documento Dados: 2004.08.10 21:56:32-03'00'
ESTADO SÓLIDO. paginapessoal.utfpr.edu.br/lorainejacobs. Profª. Loraine Jacobs
 ESTADO SÓLIDO lorainejacobs@utfpr.edu.br paginapessoal.utfpr.edu.br/lorainejacobs Profª. Loraine Jacobs Estado Sólido Tradicionalmente, um sólido é definido como uma substância que mantém um volume e uma
ESTADO SÓLIDO lorainejacobs@utfpr.edu.br paginapessoal.utfpr.edu.br/lorainejacobs Profª. Loraine Jacobs Estado Sólido Tradicionalmente, um sólido é definido como uma substância que mantém um volume e uma
Sólidos. Prof. Fernando R. Xavier
 Sólidos Prof. Fernando R. Xavier UDESC 2015 Sólidos Sob um aspecto simples e prático, é dito sólido o estado da matéria onde seu volume e forma são bem definidos. Dentro de um sólido, os átomos ou moléculas
Sólidos Prof. Fernando R. Xavier UDESC 2015 Sólidos Sob um aspecto simples e prático, é dito sólido o estado da matéria onde seu volume e forma são bem definidos. Dentro de um sólido, os átomos ou moléculas
Capítulo 1 - Cristais
 1. Cristais 1.1. Introdução O materiais no estado sólido podem apresentar estruturas cristalinas ou amorfas. Na estrutura cristalina os átomo (moléculas) apresentam um ordenamento periódico nas posições
1. Cristais 1.1. Introdução O materiais no estado sólido podem apresentar estruturas cristalinas ou amorfas. Na estrutura cristalina os átomo (moléculas) apresentam um ordenamento periódico nas posições
Sugestões de estudo para a P1
 Sugestões de estudo para a P1 1) Considere a curva de energia potencial da ligação entre dois átomos (E) apresentada ao lado, e as três afirmações a Seguir: I. Na distância interatômica r o as forças de
Sugestões de estudo para a P1 1) Considere a curva de energia potencial da ligação entre dois átomos (E) apresentada ao lado, e as três afirmações a Seguir: I. Na distância interatômica r o as forças de
ESTRUTURA CRISTALINA 1
 ESTRUTURA CRISTALINA ARRANJAMENTO ATÔMICO Por que estudar? As propriedades de alguns materiais estão diretamente associadas à sua estrutura cristalina (ex: magnésio e berílio que têm a mesma estrutura
ESTRUTURA CRISTALINA ARRANJAMENTO ATÔMICO Por que estudar? As propriedades de alguns materiais estão diretamente associadas à sua estrutura cristalina (ex: magnésio e berílio que têm a mesma estrutura
SMM-0194 ENGENHARIA E CIÊNCIA DOS MATERIAIS II I
 SMM-0194 ENGENHARIA E CIÊNCIA DOS MATERIAIS II I Ligação química Estrutura cristalina de cerâmicas cristalinas 2 Ligação química Ligação química 3 % de caráter iônico = {1-exp[-(0,25)(X A -X B ) 2 ]}.100
SMM-0194 ENGENHARIA E CIÊNCIA DOS MATERIAIS II I Ligação química Estrutura cristalina de cerâmicas cristalinas 2 Ligação química Ligação química 3 % de caráter iônico = {1-exp[-(0,25)(X A -X B ) 2 ]}.100
Aula 5: Propriedades e Ligação Química
 Aula 5: Propriedades e Ligação Química Relacionar o tipo de ligação química com as propriedades dos materiais Um entendimento de muitas propriedades físicas dos materiais é previsto através do conhecimento
Aula 5: Propriedades e Ligação Química Relacionar o tipo de ligação química com as propriedades dos materiais Um entendimento de muitas propriedades físicas dos materiais é previsto através do conhecimento
Física dos Materiais
 4300502 1º Semestre de 2014 Instituto de Física Universidade de São Paulo Professor: Luiz C C M Nagamine E-mail: nagamine@if.usp.br Fone: 3091.6877 homepage: http://disciplinas.stoa.usp.br/course/view.php?id=10070
4300502 1º Semestre de 2014 Instituto de Física Universidade de São Paulo Professor: Luiz C C M Nagamine E-mail: nagamine@if.usp.br Fone: 3091.6877 homepage: http://disciplinas.stoa.usp.br/course/view.php?id=10070
Sólidos iônicos. Química Geral. Prof. Edson Nossol
 Sólidos iônicos Química Geral Prof. Edson Nossol Uberlândia, 07/10/2016 Sólido cristalino: possui ordem a longa distância: átomos, moléculas ou íons ocupam posições específicas Sólido não-cristalino: não
Sólidos iônicos Química Geral Prof. Edson Nossol Uberlândia, 07/10/2016 Sólido cristalino: possui ordem a longa distância: átomos, moléculas ou íons ocupam posições específicas Sólido não-cristalino: não
Líquido Sólido Amorfo Sólido Cristalino
 INTRODUÇÃO AOS MATERIAIS METÁLICOS Os processos de fabricação que se encarregam de dar forma à matéria-prima, entre outras coisas, modificam a estrutura interna da mesma apresentada em cada etapa do processamento,
INTRODUÇÃO AOS MATERIAIS METÁLICOS Os processos de fabricação que se encarregam de dar forma à matéria-prima, entre outras coisas, modificam a estrutura interna da mesma apresentada em cada etapa do processamento,
Sólidos. Prof. Fernando R. Xavier
 Sólidos Prof. Fernando R. Xavier UDESC 2013 Sólidos Sob um aspecto simples e prático, é dito sólido o estado da matéria onde seu volume e forma são bem definidos. Dentro de um sólido, os átomos ou moléculas
Sólidos Prof. Fernando R. Xavier UDESC 2013 Sólidos Sob um aspecto simples e prático, é dito sólido o estado da matéria onde seu volume e forma são bem definidos. Dentro de um sólido, os átomos ou moléculas
A Dualidade Onda-Partícula
 A Dualidade Onda-Partícula O fato de que as ondas têm propriedades de partículas e viceversa se chama Dualidade Onda-Partícula. Todos os objetos (macroscópicos também!) são onda e partícula ao mesmo tempo.
A Dualidade Onda-Partícula O fato de que as ondas têm propriedades de partículas e viceversa se chama Dualidade Onda-Partícula. Todos os objetos (macroscópicos também!) são onda e partícula ao mesmo tempo.
Universidade Estadual de Ponta Grossa PRÓ-REITORIA DE GRADUAÇÃO DIVISÃO DE ENSINO
 Universidade Estadual de Ponta Grossa PRÓ-REITORIA DE GRADUAÇÃO DIVISÃO DE ENSINO PROGRAMA DE DISCIPLINA SETOR: Ciências Agrárias e de Tecnologia DEPARTAMENTO: Engenharia de Materiais DISCIPLINA: Ciência
Universidade Estadual de Ponta Grossa PRÓ-REITORIA DE GRADUAÇÃO DIVISÃO DE ENSINO PROGRAMA DE DISCIPLINA SETOR: Ciências Agrárias e de Tecnologia DEPARTAMENTO: Engenharia de Materiais DISCIPLINA: Ciência
A4 Estrutura cristalina perfeição
 A4 Estrutura cristalina perfeição TEM Muitos dos materiais aplicados em engenharia têm estrutura cristalina: os átomos do material estão dispostos de modo regular e repetitivo Estrutura cristalina A célula
A4 Estrutura cristalina perfeição TEM Muitos dos materiais aplicados em engenharia têm estrutura cristalina: os átomos do material estão dispostos de modo regular e repetitivo Estrutura cristalina A célula
Física dos Materiais FMT0502 ( )
 Física dos Materiais FMT0502 (4300502) 1º Semestre de 2010 Instituto de Física Universidade de São Paulo Professor: Antonio Dominguesdos Santos E-mail: adsantos@if.usp.br Fone: 3091.6886 http://plato.if.usp.br/~fmt0502n/
Física dos Materiais FMT0502 (4300502) 1º Semestre de 2010 Instituto de Física Universidade de São Paulo Professor: Antonio Dominguesdos Santos E-mail: adsantos@if.usp.br Fone: 3091.6886 http://plato.if.usp.br/~fmt0502n/
CONCEITOS. Prof. Roberto Monteiro de Barros Filho. Prof. Roberto Monteiro de Barros Filho
 CONCEITOS Materiais e Processos de Produção ESTRUTURA DA MATÉRIA ÁTOMOS PRÓTONS NÊUTRONS ELÉTRONS MOLÉCULAS ESTADOS DA MATÉRIA TIPO DE LIGAÇÃO ESTRUTURA (ARRANJO) IÔNICA COVALENTE METÁLICA CRISTALINO AMORFO
CONCEITOS Materiais e Processos de Produção ESTRUTURA DA MATÉRIA ÁTOMOS PRÓTONS NÊUTRONS ELÉTRONS MOLÉCULAS ESTADOS DA MATÉRIA TIPO DE LIGAÇÃO ESTRUTURA (ARRANJO) IÔNICA COVALENTE METÁLICA CRISTALINO AMORFO
Professora: Daniela Becker Mestranda: Jéssica de Aguiar
 Professora: Daniela Becker Mestranda: Jéssica de Aguiar JOINVILLE SC BRASIL 2016 Estruturas Cerâmicas São compostas por pelo menos dois elementos; Em geral são mais complexas do que a dos metais; Ex.:
Professora: Daniela Becker Mestranda: Jéssica de Aguiar JOINVILLE SC BRASIL 2016 Estruturas Cerâmicas São compostas por pelo menos dois elementos; Em geral são mais complexas do que a dos metais; Ex.:
SOLIDOS CRISTALINOS. Conceitos Gerais
 SOLIDOS CRISTALINOS Conceitos Gerais CAPA Liga de Magnésio CAPA ligas de magnésio O sistema da ASTM estabelece que as ligas de magnésio, divididas em fundidas e trabalhadas, são designadas por um conjunto
SOLIDOS CRISTALINOS Conceitos Gerais CAPA Liga de Magnésio CAPA ligas de magnésio O sistema da ASTM estabelece que as ligas de magnésio, divididas em fundidas e trabalhadas, são designadas por um conjunto
 Ligações Químicas Por que os átomos formam ligações químicas? Distância de equilíbrio Comprimento da ligação H-H r o = 74 pm distância internuclear Uma ligação química entre dois átomos é formada se
Ligações Químicas Por que os átomos formam ligações químicas? Distância de equilíbrio Comprimento da ligação H-H r o = 74 pm distância internuclear Uma ligação química entre dois átomos é formada se
Ligação iônica Ligação covalente Ligação metálica
 Principais Tipos de Ligações Químicas Ligação iônica Ligação covalente Ligação metálica Iônicas Covalentes Metálicas Ligações químicas A maioria dos compostos situa-se dentro do triângulo Representações
Principais Tipos de Ligações Químicas Ligação iônica Ligação covalente Ligação metálica Iônicas Covalentes Metálicas Ligações químicas A maioria dos compostos situa-se dentro do triângulo Representações
Ciência dos materiais Aula 3. Profª Mª Patrícia Cristina Costa Ladeira
 Ciência dos materiais Aula 3 Profª Mª Patrícia Cristina Costa Ladeira patricia.ladeira@educadores.net.br patricia.ladeira@yahoo.com.br Recapitulando 2 Na Unidade 1 nós vimos: Aspectos históricos da Ciência
Ciência dos materiais Aula 3 Profª Mª Patrícia Cristina Costa Ladeira patricia.ladeira@educadores.net.br patricia.ladeira@yahoo.com.br Recapitulando 2 Na Unidade 1 nós vimos: Aspectos históricos da Ciência
Descoberta dos Raios-X
 Descoberta dos Raios-X 1895 - Wilhelm Conrad Roentgen Experimentos com tubo de raios catódicos brilho em um cristal fluorescente perto do tubo mesmo mantendo o tubo coberto Raios invisíveis, natureza desconhecida:
Descoberta dos Raios-X 1895 - Wilhelm Conrad Roentgen Experimentos com tubo de raios catódicos brilho em um cristal fluorescente perto do tubo mesmo mantendo o tubo coberto Raios invisíveis, natureza desconhecida:
ESCOLA POLITÉCNICA DA UNIVERSIDADE DE SÃO PAULO Departamento de Engenharia Metalúrgica e de Materiais UNIDADE 6 DEFEITOS DO SÓLIDO CRISTALINO
 ESCOLA POLITÉCNICA DA UNIVERSIDADE DE SÃO PAULO Departamento de Engenharia Metalúrgica e de Materiais UNIDADE 6 DEFEITOS DO SÓLIDO CRISTALINO PMT 3110 - Introdução à Ciência dos Materiais para Engenharia
ESCOLA POLITÉCNICA DA UNIVERSIDADE DE SÃO PAULO Departamento de Engenharia Metalúrgica e de Materiais UNIDADE 6 DEFEITOS DO SÓLIDO CRISTALINO PMT 3110 - Introdução à Ciência dos Materiais para Engenharia
Estruturas baseadas na HC Wurtzita ZnS
 Estruturas baseadas na HC Wurtzita ZnS Baseada num arranjo HC dos ânions com metade dos interstícios tetraedrais ocupados por cátions O número de coordenação de cada íon é 4 Se somente a metade das posições
Estruturas baseadas na HC Wurtzita ZnS Baseada num arranjo HC dos ânions com metade dos interstícios tetraedrais ocupados por cátions O número de coordenação de cada íon é 4 Se somente a metade das posições
Materiais e sua propriedades Aula 5
 Materiais e sua propriedades Aula 5 Prof a. Dr a. Vânia Trombini Hernandes Imperfeições nos sólidos cristalinos 2 º Q - 2017 Defeitos Cristalinos Até agora, ao estudar os materiais cristalinos, tem-se
Materiais e sua propriedades Aula 5 Prof a. Dr a. Vânia Trombini Hernandes Imperfeições nos sólidos cristalinos 2 º Q - 2017 Defeitos Cristalinos Até agora, ao estudar os materiais cristalinos, tem-se
TRATAMENTO TÉRMICO PARTE 2
 TRATAMENTO TÉRMICO PARTE 2 Antes de falarmos sobre tratamento térmico, devemos conhecer estruturas cristalinas Estrutura Cristalina O que é uma Estrutura Cristalina? É a maneira segundo a qual os átomos,
TRATAMENTO TÉRMICO PARTE 2 Antes de falarmos sobre tratamento térmico, devemos conhecer estruturas cristalinas Estrutura Cristalina O que é uma Estrutura Cristalina? É a maneira segundo a qual os átomos,
DEFEITOS CRISTALINOS. Conceitos Gerais
 DEFEITOS CRISTALINOS Conceitos Gerais CAPA 1 CAPA 2 1 Defeitos atômicos usados para reduzir a emissão de poluentes 2 Conversor catalítico poluente é retido pelo material que tem esta capacidade em função
DEFEITOS CRISTALINOS Conceitos Gerais CAPA 1 CAPA 2 1 Defeitos atômicos usados para reduzir a emissão de poluentes 2 Conversor catalítico poluente é retido pelo material que tem esta capacidade em função
Aula 6: Estrutura Cristalina dos Metais
 Aula 6: Estrutura Cristalina dos Metais - Como a ligação metálica é não-direcional, não há restrições quanto ao número e posições dos vizinhos mais próximos. - A estrutura cristalina dos metais têm um
Aula 6: Estrutura Cristalina dos Metais - Como a ligação metálica é não-direcional, não há restrições quanto ao número e posições dos vizinhos mais próximos. - A estrutura cristalina dos metais têm um
Aula 5. Defeitos cristalinos
 Aula 5 Defeitos cristalinos 1 DEFEITOS - Defeitos pontuais - Defeitos de linha (discordâncias) - Defeitos de interface (grão e maclas) - Defeitos volumétricos (inclusões, precipitados) 2 O QUE É UM DEFEITO?
Aula 5 Defeitos cristalinos 1 DEFEITOS - Defeitos pontuais - Defeitos de linha (discordâncias) - Defeitos de interface (grão e maclas) - Defeitos volumétricos (inclusões, precipitados) 2 O QUE É UM DEFEITO?
SEMICONDUTORES. Condução Eletrônica
 Condução Eletrônica SEMICONDUTORES A corrente elétrica é resultante do movimento de partículas carregadas eletricamente como resposta a uma força de natureza elétrica, em função do campo elétrico aplicado.
Condução Eletrônica SEMICONDUTORES A corrente elétrica é resultante do movimento de partículas carregadas eletricamente como resposta a uma força de natureza elétrica, em função do campo elétrico aplicado.
Disciplina: Ciência dos Materiais. Prof. Alex Bernardi
 Disciplina: Ciência dos Materiais Prof. Alex Bernardi 1 Aula Atividade Tele Aula 1 Questão 1. A Ciência dos Materiais é definida como o estudo das relações entre as estruturas e propriedades dos materiais
Disciplina: Ciência dos Materiais Prof. Alex Bernardi 1 Aula Atividade Tele Aula 1 Questão 1. A Ciência dos Materiais é definida como o estudo das relações entre as estruturas e propriedades dos materiais
Aula 7: Cristais 0,0,1 1/2,1/2,1/2 0,0,0 0,1/2,0 0,1,0 1/2,1/2,0 1,0,0. Aula 7 - Profa. Adélia
 Aula 7: Cristais Para poder descrever a estrutura cristalina é necessário escolher uma notação para posições, direções e planos As posições são definidas dentro de um cubo com lado unitário. 0,0,1 1/2,1/2,1/2
Aula 7: Cristais Para poder descrever a estrutura cristalina é necessário escolher uma notação para posições, direções e planos As posições são definidas dentro de um cubo com lado unitário. 0,0,1 1/2,1/2,1/2
A6 Estrutura não cristalina imperfeição: defeitos lineares, planares e em volume
 A6 Estrutura não cristalina imperfeição: defeitos lineares, planares e em volume Deslocações no KCl. O KCl é transparente e as deslocações (linhas brancas) foram decoradas com impurezas para as tornar
A6 Estrutura não cristalina imperfeição: defeitos lineares, planares e em volume Deslocações no KCl. O KCl é transparente e as deslocações (linhas brancas) foram decoradas com impurezas para as tornar
Aula 17 - Transformações no estado sólido. Transformações Estruturais a nível de tamanho e formato dos grãos
 Aula 17 - Transformações no estado sólido Transformações Estruturais a nível de tamanho e formato dos grãos Encruamento Recristalização Crescimento de Grão Encruamento Aumento de dureza ou da resistência
Aula 17 - Transformações no estado sólido Transformações Estruturais a nível de tamanho e formato dos grãos Encruamento Recristalização Crescimento de Grão Encruamento Aumento de dureza ou da resistência
IMPERFEIÇÕES EM SÓLIDOS
 IMPERFEIÇÕES EM SÓLIDOS INTRODUÇÃO Ao estudar os materiais cristalinos, tem-se admitido que existe uma perfeita ordem em escala atômica Contudo esse tipo de sólido idealizado não existe, todos os materiais
IMPERFEIÇÕES EM SÓLIDOS INTRODUÇÃO Ao estudar os materiais cristalinos, tem-se admitido que existe uma perfeita ordem em escala atômica Contudo esse tipo de sólido idealizado não existe, todos os materiais
FUNDAMENTOS DE CIÊNCIA DOS MATERIAIS LISTA DE EXERCÍCIOS CRISTAIS
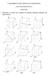 FUNDAMENTOS DE CIÊNCIA DOS MATERIAIS LISTA DE EXERCÍCIOS CRISTAIS 1 Determine os índices e/ou desenhe as direções cristalinas indicadas nas figuras abaixo. 2 Determineos índices dos planos cristalinos
FUNDAMENTOS DE CIÊNCIA DOS MATERIAIS LISTA DE EXERCÍCIOS CRISTAIS 1 Determine os índices e/ou desenhe as direções cristalinas indicadas nas figuras abaixo. 2 Determineos índices dos planos cristalinos
Ciência dos Materiais Estrutura Cristalina Difração de raios X. Professora: Maria Ismenia Sodero
 Ciência dos Materiais Estrutura Cristalina Difração de raios X Professora: Maria Ismenia Sodero maria.ismenia@usp.br Assuntos abordados Coordenação atômica Arranjo das estruturas sólidas: cristalinos ou
Ciência dos Materiais Estrutura Cristalina Difração de raios X Professora: Maria Ismenia Sodero maria.ismenia@usp.br Assuntos abordados Coordenação atômica Arranjo das estruturas sólidas: cristalinos ou
P1 de CTM VOCÊ DEVE ESCOLHER APENAS 5 QUESTÕES PARA RESOLVER. VOCÊ DEVE RISCAR NA TABELA ABAIXO A QUESTÃO QUE NÃO SERÁ CORRIGIDA
 P1 de CTM 2014.1 Nome: Assinatura: Matrícula: Turma: OBS: Esta prova contém 7 páginas e 6 questões. Verifique antes de começar. VOCÊ DEVE ESCOLHER APENAS 5 QUESTÕES PARA RESOLVER. VOCÊ DEVE RISCAR NA TABELA
P1 de CTM 2014.1 Nome: Assinatura: Matrícula: Turma: OBS: Esta prova contém 7 páginas e 6 questões. Verifique antes de começar. VOCÊ DEVE ESCOLHER APENAS 5 QUESTÕES PARA RESOLVER. VOCÊ DEVE RISCAR NA TABELA
UNIDADE 6 Defeitos do Sólido Cristalino
 UNIDADE 6 Defeitos do Sólido Cristalino 1. Em condições de equilíbrio, qual é o número de lacunas em 1 m de cobre a 1000 o C? Dados: N: número de átomos por unidade de volume N L : número de lacunas por
UNIDADE 6 Defeitos do Sólido Cristalino 1. Em condições de equilíbrio, qual é o número de lacunas em 1 m de cobre a 1000 o C? Dados: N: número de átomos por unidade de volume N L : número de lacunas por
Estrutura atômica e ligação interatômica. Profa. Daniela Becker
 Estrutura atômica e ligação interatômica Profa. Daniela Becker Referências Callister Jr., W. D. Ciência e engenharia de materiais: Uma introdução. LTC, 5ed., cap 2, 2002. Shackelford, J.F. Ciências dos
Estrutura atômica e ligação interatômica Profa. Daniela Becker Referências Callister Jr., W. D. Ciência e engenharia de materiais: Uma introdução. LTC, 5ed., cap 2, 2002. Shackelford, J.F. Ciências dos
A5 Estrutura nãocristalina. -imperfeição. Materiais são preparados com algum grau de impurezas químicas
 A5 Estrutura nãocristalina -imperfeição Materiais são preparados com algum grau de impurezas químicas Além das impurezas, existem numerosos tipos de defeitos estruturais que representam uma perda da perfeição
A5 Estrutura nãocristalina -imperfeição Materiais são preparados com algum grau de impurezas químicas Além das impurezas, existem numerosos tipos de defeitos estruturais que representam uma perda da perfeição
INTRODUÇÃO À FÍSICA DO ESTADO SÓLIDO
 FÍSICA PARA ENGENHARIA ELÉTRICA José Fernando Fragalli Departamento de Física Udesc/Joinville INTRODUÇÃO À FÍSICA DO ESTADO SÓLIDO É errado pensar que a tarefa da física é descobrir como a natureza é.
FÍSICA PARA ENGENHARIA ELÉTRICA José Fernando Fragalli Departamento de Física Udesc/Joinville INTRODUÇÃO À FÍSICA DO ESTADO SÓLIDO É errado pensar que a tarefa da física é descobrir como a natureza é.
LISTA DE EXERCÍCIOS 6 1 (UNIDADE III INTRODUÇÃO À CIÊNCIA DOS MATERIAIS)
 UNIVERSIDADE FEDERAL RURAL DO SEMI-ÁRIDO CENTRO DE ENGENHARIAS DEPARTAMENTO DE ENGENHARIA E TECNOLOGIA DISCIPLINA: QUÍMICA APLICADA À ENGENHARIA PROFESSOR: FREDERICO RIBEIRO DO CARMO Estrutura cristalina
UNIVERSIDADE FEDERAL RURAL DO SEMI-ÁRIDO CENTRO DE ENGENHARIAS DEPARTAMENTO DE ENGENHARIA E TECNOLOGIA DISCIPLINA: QUÍMICA APLICADA À ENGENHARIA PROFESSOR: FREDERICO RIBEIRO DO CARMO Estrutura cristalina
Sólidos: Estudo de Estruturas Cristalinas
 UnB - Universidade de Brasília IQD - Instituto de Química Curso de Graduação Disciplina: Química Inorgânica 1 Experimental (Código 114073) Sólidos: Estudo de Estruturas Cristalinas A estrutura dos materiais
UnB - Universidade de Brasília IQD - Instituto de Química Curso de Graduação Disciplina: Química Inorgânica 1 Experimental (Código 114073) Sólidos: Estudo de Estruturas Cristalinas A estrutura dos materiais
O espectro eletromagnético
 Difração de Raios X O espectro eletromagnético luz visível raios-x microondas raios gama UV infravermelho ondas de rádio Comprimento de onda (nm) Raios Absorção, um fóton de energia é absorvido promovendo
Difração de Raios X O espectro eletromagnético luz visível raios-x microondas raios gama UV infravermelho ondas de rádio Comprimento de onda (nm) Raios Absorção, um fóton de energia é absorvido promovendo
1. ESTRUTURAS CRISTALINAS
 1. ESTRUTURAS CRISTALINAS 1.1 CONCEITOS FUNDAMENTAIS Materiais sólidos podem ser classificados de acordo com a regularidade com a qual os átomos ou íons se arranjam entre si. Um material cristalino é aquele
1. ESTRUTURAS CRISTALINAS 1.1 CONCEITOS FUNDAMENTAIS Materiais sólidos podem ser classificados de acordo com a regularidade com a qual os átomos ou íons se arranjam entre si. Um material cristalino é aquele
Informações estruturais de compostos iônicos. Arranjos entre os íons dos compostos iônicos.
 Arranjos entre os íons dos compostos iônicos. a Tendências gerais para os raios iônicos na tabela periódica: 1- Os raios iônicos aumentam para baixo em um grupo (coluna) na T.P. 2- Os raios dos íons de
Arranjos entre os íons dos compostos iônicos. a Tendências gerais para os raios iônicos na tabela periódica: 1- Os raios iônicos aumentam para baixo em um grupo (coluna) na T.P. 2- Os raios dos íons de
AULA 07 DEFORMAÇÃO PLÁSTICA DOS METAIS
 AULA 07 DEFORMAÇÃO PLÁSTICA DOS METAIS Conceitos fundamentais σ Os materiais experimentam dois tipos de deformação: elástica e plástica. Elástica: retornável. Plástica: permanente. ε Em uma escala microscópica:
AULA 07 DEFORMAÇÃO PLÁSTICA DOS METAIS Conceitos fundamentais σ Os materiais experimentam dois tipos de deformação: elástica e plástica. Elástica: retornável. Plástica: permanente. ε Em uma escala microscópica:
2 Características e propriedades do InP
 2 Características e propriedades do InP Neste capítulo são apresentadas algumas características e propriedades mecânicas dos compostos III-V. Na primeira seção a estrutura cristalina dos semicondutores
2 Características e propriedades do InP Neste capítulo são apresentadas algumas características e propriedades mecânicas dos compostos III-V. Na primeira seção a estrutura cristalina dos semicondutores
