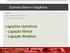
Temperatura / ºC Densidade / g.cm , , , , ,9922
|
|
|
- Sophia Costa Lemos
- 8 Há anos
- Visualizações:
Transcrição
1 Lista Química 1os. Anos I. QUESTÕES OBJETIVAS QUESTÃO 01 A densidade é uma propriedade específica que varia de acordo com a temperatura. Quanto maior a temperatura, menor é a densidade de um material. Analise o quadro que contém o valor da densidade da água em algumas temperaturas. Temperatura / ºC Densidade / g.cm , , , , ,9922 Um determinado caminhão pipa tem capacidade para transportar 20 m 3 de água e, quando vazio, possui massa de 5 t. Ao ser parado em um posto de fiscalização equipado com balança, esse caminhão, quando transportava água em sua capacidade máxima, teve sua massa determinada e o valor encontrado foi de 5,0199 t. Desse modo, a temperatura da água dentro do caminhão é de aproximadamente (A) 0 ºC 10 ºC (C) 20 ºC (D) 30 ºC (E) 40 ºC QUESTÃO 02 Leia a informação a seguir. NO MAR MORTO NADA AFUNDA Esse mar fica entre dois países do oriente, Israel e a Jordânia, e se chama Mar Morto. Na verdade, não é um mar: é um grande lago, onde deságua o rio Jordão. Ele está a 392 metros abaixo do nível do mar, e é o ponto mais baixo de toda a superfície do planeta. De tão grande, parece mesmo um mar: tem 85 quilômetros de comprimento e 17 quilômetros de largura. É tanto sal em suas águas que não tem peixe, alga ou camarão que consiga viver ali dentro. Por isso o nome de Mar Morto. Esse lago em que tudo bóia tem a água mais salgada do mundo: é seis vezes mais salgado que um mar normal! É preciso muito cuidado para não abrir os olhos embaixo d água, pois o sal queima as partes mais delicadas do corpo. Tomar sol depois de sair do Mar Morto pode causar queimaduras na pele. Disponível em: Acesso em: 12 out (adaptado) Em comparação aos oceanos, os objetos no Mar Morto têm mais facilidade em flutuar porque (A) (C) (D) (E) a baixa altitude facilita a flutuação de objetos. a densidade da água no mar morto é consideravelmente maior. a pressão atmosférica no mar morto é consideravelmente maior. a temperatura de ebulição da água no mar morto é maior. o volume de água nos oceanos é consideravelmente maior. 1
2 QUESTÃO 03 Leia as informações sobre o Monte Everest. O Monte Everest é a montanha mais alta do mundo com metros de altitude. Está situado no continente asiático, na cordilheira do Himalaia (fronteira do Nepal com o Tibet). Em função da altitude, o cume desta montanha permanece coberto por gelo durante o ano todo. O nome do monte é uma homenagem a George Everest (topógrafo da Índia), primeiro homem a estabelecer sua altitude e posição. Este fato ocorreu em 1841 e a montanha foi batizada, primeiramente, com o nome de Pico XV. O Everest é a montanha que mais desafia os alpinistas, pois representa uma grande dificuldade. Vários alpinistas já morreram ao tentar chegar ao cume da montanha. Mesmo com planejamento, preparo físico e treinamento, a subida apresenta diversas dificuldades: ar rarefeito (baixa quantidade de oxigênio), frio extremo e avalanches de neve. No dia 29 de maio de 1953, a expedição anglo-neozelandesa, comandada por John Hunt, atingiu o cume do Everest pela primeira vez na história. Disponível em: Acesso em: 12 out (adaptado) No alto do monte Everest a temperatura de ebulição da água é igual a 72 ºC, diferentemente de uma cidade litorânea, cujo valor para essa propriedade é 100 ºC. A partir das informações apresentadas no texto, indique a alternativa que apresenta uma causa para essa diferença nos valores. (A) (C) (D) O Monte Everest apresenta avalanche de neves. O Monte Everest apresenta um frio extremo. O Monte Everest é a montanha mais alta do mundo. O Monte Everest possui cume coberto de gelo. (E) O Monte Everest só pode ser explorado após o ano de QUESTÃO 04 Numa escola em Recife, dois grupos de alunos do Ensino Médio fizeram no laboratório, sob supervisão do professor, o aquecimento de água até a completa vaporização. Eles monitoraram a temperatura durante todo o experimento. O grupo 1 aqueceu 150 ml de água e o grupo 2 aqueceu 300 ml. Com relação ao experimento realizado podemos afirmar que a (A) água do grupo 1 demorou mais tempo para entrar em ebulição do que a do grupo 2. água vaporizou completamente com o mesmo tempo em ambos os grupos. (C) temperatura da água de ambos os grupos aumentou gradativamente durante todo o experimento. (D) temperatura na qual a água entrou em ebulição foi a mesma em ambos os grupos. (E) temperatura sofre pequenas variações quando a água entra em ebulição em ambos os béqueres. 2
3 QUESTÃO 05 A solubilidade é uma propriedade que varia de acordo com a temperatura. O quadro a seguir que contém o valor da solubilidade da sacarose em algumas temperaturas. Temperatura (ºC) Solubilidade (g/100 g de água) , , , , ,3 Num determinado experimento, um químico colocou 500,0 g de sacarose em 200 g de água, obtendo no fundo do recipiente um resíduo sólido. Após filtrar o sistema, ele mediu a massa desse resíduo e encontrou 90,0 g. De posse dessas informações, é possível afirmar que a temperatura da água que o químico realizou o experimento é próxima de (A) 20 ºC 30 ºC (C) 40 ºC (D) 50 ºC (E) 60 ºC QUESTÃO 06 Em uma atividade no laboratório, supervisionada pelo professor, um aluno aqueceu um tubo de ensaio com um balão preso à boca. Veja a figura a seguir com os resultados deste experimento. Sobre o experimento concluímos que (A) (C) (D) (E) a densidade do ar dentro do balão aumentou após o aquecimento. a distância média entre as partículas do ar permaneceu a mesma. a energia cinética média das partículas do ar aumentou com o aquecimento. a massa do conjunto balão - tubo de ensaio diminuiu com o aquecimento. o balão se encheu porque o ar se deslocou totalmente para ele. 3
4 QUESTÃO 07 O gráfico a seguir foi construído a partir do resfriamento de um determinado material líquido até a sua completa solidificação. A partir da análise do gráfico inferimos que (A) (C) (D) (E) a mudança de fase ocorreu em 16 minutos. a partir do tempo 6 minutos, passa a existir apenas da fase sólida. a temperatura de ebulição do material é menor que 25 ºC. a temperatura de fusão do material é igual a 25 ºC. o material é constituído por 2 substâncias distintas. QUESTÃO 08 Leia a notícia a seguir. Israel inaugura a maior usina de dessalinização do mundo Em 2010, Israel inaugurou a sua terceira usina de dessalinização no norte da cidade de Hadera. A usina foi considerada a maior usina de dessalinização por osmose reversa do mundo. Ela captura água do Mar Mediterrâneo e a torna potável, a expectativa é que a usina produza 127 milhões de metros cúbicos de água por ano o suficiente para abastecer um sexto da população israelense. Criada com um investimento de quase meio bilhão de dólares, a usina foi criada pela IDE Technologies, uma companhia israelense que já construiu duas usinas de dessalinização de água no país. O governo foi o responsável pelo plano de criar a usina, com o objetivo de atender as demandas de uma população crescente e com o seu estoque de água sempre ameaçado, dependentes quase que exclusivamente das chuvas de inverno. Através de um contrato de 25 anos, a água custará um pouco mais de 50 centavos por metro cúbico. Uma nova era? O sucesso do conceito de uma mega usina de dessalinização alcançou uma nova era de água abundante e acessível para o mundo, que vêm enfrentando problemas de falta de água disse Avshalom Felber, CEO da IDE Technologies, em um comunicado oficial. A IDE apresentou avanços tecnológicos nos campos da dessalinização térmica e de membrana. O sal é retirado da água marinha, utilizando um processo de osmose reversa, uma das duas maneiras de utilizar membranas para dessalinizar a água. Na osmose reversa a água de uma solução salina altamente pressurizada é canalizada através de uma membrana permeável que a separa dos componentes salgados. Disponível em: Acesso em: 12 out (adaptado) 4
5 Considerando as informações e o processo de dessalinização apresentados no texto, podemos inferir que (A) (C) (D) (E) a quantidade de indústrias iguais a essa para produzir água suficiente para abastecer toda a população de Israel durante 1 ano seria igual a duas. as preocupações com a economia de água e com maneiras de evitar a poluição de lagos, rios e nascentes devem ser reduzidas. as usinas de dessalinização mostram se eficientes para se substituir as estações de tratamento de água que existem hoje. o processo da osmose reversa para dessalinizar a água produz o mesmo efeito de evaporar uma grande quantidade de água e em seguida condensar. o processo de dessalinização vem para resolver o problema da falta de água em todo o mundo, já que há um aumento crescente da população mundial. QUESTÃO 09 A figura a seguir apresenta um esquema com materiais de laboratório que pode ser usado para separar componentes de algumas misturas. Com relação a esse esquema e ao processe de separação que ele representa, podemos afirmar que (A) a propriedade envolvida na separação dos componentes é a diferença na temperatura de ebulição das substâncias. a separação da mistura de água e ácido clorídrico, através deste método, deixará cloro no erlenmeyer ao final do experimento. (C) a separação dos componentes, através deste método, só pode ser feita se os sistemas homogêneos contiverem no máximo 2 substâncias. (D) a separação dos componentes de uma mistura contendo 50% de água e 50% de álcool é possível de ser feita com esse método. (E) o filtro de barro, muito comum nas residências, executa um processo de separação semelhante ao realizado por esse método. 5
6 QUESTÃO 10 Em nosso cotidiano acontece uma série de transformações que podem ser físicas ou químicas. Considerando as transformações citadas a seguir, indique aquela que representa uma transformação física. (A) (C) (D) (E) Envelhecimento da pele. Evaporação da água de um lago. Limpeza do piso de mármore com ácido muriático. Queima do gás de cozinha no fogão. Respiração dos seres vivos. QUESTÃO 11 Leia o trecho seguinte. Utilizando uma ampola de Crookes, isto é, tubos de vidro fechados com um eletrodo positivo e outro negativo, contendo gases a pressões extremamente baixas; o cientista inglês Joseph John Thomson ( ) fez uma descoberta imprescindível para a evolução do modelo atômico. Ele submeteu esses gases a voltagens elevadíssimas, desse modo, foi possível observar o aparecimento de emissões, que foram denominadas raios catódicos. Em seguida, foi colocado um campo elétrico externo e, por fim, verificou-se que o feixe de raios catódicos era desviado, sempre indo na direção e sentido da placa carregada positivamente. Portanto, estas emissões possuíam cargas negativas. Outro ponto importante é que não importava o gás utilizado, sempre ocorria o mesmo; assim, Thomson chegou à conclusão lógica de que estas cargas negativas estavam presentes em toda e qualquer matéria, eram parte integrante destas. Desse modo, provou-se que, ao contrário do que Dalton havia afirmado, o átomo não era indivisível, pois possuía uma partícula subatômica negativa, que ficou denominada elétron. Disponível em: Acesso em: 12 out (adaptado) Ao realizar este experimento, Thomson (A) determina o número atômico dos elementos químicos conhecidos da época. estabelece um padrão para massas atômicas baseadas no isótopo do carbono. (C) mostra que a diferença entre os átomos de um elemento está no número de massa. (D) comprova a existência de partículas com massa semelhante à dos prótons. (E) comprova a existência de partículas menores e mais leves que o menor dos átomos. 6
7 QUESTÃO 12 A experiência de Rutherford foi crucial na determinação da estrutura atômica. Os parágrafos que seguem foram extraídos de sua própria comunicação (1911): "É um feito bem conhecido que as partículas alfa e beta sofrem desvios de suas trajetórias retilíneas por causa das interações com os átomos da matéria. Parece indubitável que estas partículas com grande movimento passam em seu percurso através dos átomos, e os desvios observados são devidos ao campo elétrico dentro do sistema atômico. A teoria de Thomson está baseada na hipótese de que a dispersão devida a um simples choque atômico é pequena e que a estrutura suposta para o átomo não admite um desvio muito grande de uma partícula alfa que incida sobre ele, a menos que se suponha que o diâmetro da esfera de carga positiva é pequeno em comparação com o diâmetro de influência do átomo. Posto que as partículas alfa atravessam o átomo, um estudo rigoroso da natureza do desvio deve proporcionar certa luz sobre a constituição do átomo, capaz de produzir os efeitos observados. No efeito, a dispersão de partículas carregadas pelos átomos da matéria constitui um dos métodos mais promissores de ataque do problema. Disponível em: Acesso: Acesso em: 12 out (adaptado) Em relação ao modelo de Rutherford e às conclusões que podem ser inferidas a partir da experiência que culminou em tal modelo, podemos deduzir que (A) (C) as cargas positivas e negativas dos átomos de ouro da lâmina exercem a mesma influência na trajetória das partículas alfa. as cargas positivas e negativas estão distribuídas uniformemente ao longo de todo o átomo, como Thomson já havia proposto. os grandes desvios sofridos pelas partículas alfa foram decisivos para que Rutherford propusesse um novo modelo atômico. (D) os resultados esperados na experiência, segundo o modelo de Thomson, era que a maioria das partículas alfa voltasse ao incidir sobre a lâmina. (E) os níveis de energia dos átomos influenciam na trajetória das partículas alfa, uma vez que essas excitam os elétrons das camadas. QUESTÃO 13 Juntamente com Geiger e Marsden, Rutherford realizou uma das experiências mais famosas da história que ficou conhecida como experiência do espalhamento de partículas alfa. Nela, uma fina lâmina de ouro foi bombardeada com partículas alfa que saíam de uma fonte radioativa. Um anteparo de sulfeto de zinco indicava a trajetória das partículas alfa. Com base nos resultados deste experimento, Rutherford aprimora o modelo de Thomson propondo a existência (A) das partículas alfa. de partículas de carga negativa. 7
8 (C) (D) (E) do núcleo dos átomos. dos materiais radioativos. dos níveis de energia nos átomos. QUESTÃO 14 Apesar de terem uma estrutura bastante semelhante, os íons em termos de propriedades são bastante diferentes de seus átomos neutros. Por exemplo, no nosso organismo, o ferro desempenha papéis indispensáveis. A deficiência dele pode causar anemia, fadiga, tonteiras, cáries, entre outros males. Acontece que no organismo ele está presente na forma iônica (Fe 2+ ou Fe 3+ ), diferente da forma metálica de uma barra de ferro ou de um prego, que possui átomos de ferro (Fe). O átomo neutro e aos íons citados no texto, possuem (A) diferente quantidade de prótons. massas aproximadamente iguais. (C) mesma configuração eletrônica (D) mesma quantidade de cargas negativas. (E) prótons a mais que elétrons. QUESTÃO 15 Leia as informações sobre a radioterapia. A RADIOTERAPIA A radioterapia consiste em tratamento com fontes de radiação. Fontes radiativas de césio-137 e cobalto-60 são usadas para destruir células de tumores, uma vez que estas são mais sensíveis à radiação do que os tecidos normais (sãos). Um dos aparelhos de radioterapia mais conhecidos é a Bomba de Cobalto, usada no tratamento contra o câncer, e que nada tem de bomba (não explode). Trata-se de uma fonte radiativa de cobalto-60 (Co-60), encapsulada ou selada (hermeticamente fechada) e blindada, para impedir a passagem de radiação. No momento da utilização, a fonte é deslocada de sua posição segura, dentro do cabeçote de proteção (feito de chumbo e aço inoxidável), para a frente de um orifício, que permite a passagem de um feixe de radiação, concentrado sobre a região a ser tratada ou irradiada. Após o uso, a fonte é recolhida para a posição de origem ( segura ). Até bem pouco tempo, para este fim, eram utilizadas fontes de césio-137, que foram substituídas pelas de cobalto-60, que, entre outras razões técnicas, apresentam maior rendimento terapêutico. O isótopo de massa 60 do cobalto é produzido artificialmente pelo bombardeamento do isótopo Cobalto-59 por nêutrons em um reator atômico. Já o césio-137 é produzido pela fissão nuclear espontânea ou induzida de vários radionuclídeos pesados, tais como o urânio-233, o urânio-235 ou o plutônio-239. Constitui característica dos radioisótopos citados no texto e seu uso no tratamento de tumores. 8
9 (A) O cobalto de massa 60 pode ser produzido a partir de seu isótopo mais leve, através do ganho de prótons, nêutrons e elétrons. O isótopo do urânio de massa 233 pode se transformar em césio utilizável no tratamento de tumores. Para isso, ele deverá perder prótons, nêutrons e elétrons. (C) O radioisótopo mais pesado citado no texto possui 102 prótons a mais do que o radioisótopo que ele pode gerar por fissão nuclear. (D) Os isótopos do césio e do cobalto usados para destruir células de tumores possuem mesma quantidade de prótons. (E) Os isótopos dos elementos césio e cobalto podem ser utilizados na radioterapia para tratamento de tumores. QUESTÃO 16 O elemento tecnécio (Tc) foi descoberto na Itália, por meio de uma amostra de molibdênio bombardeada por núcleos de deutério em um acelerador de partículas. Foi o primeiro elemento produzido artificialmente. É encontrado em alguns tipos de estrelas e, na Terra, aparentemente não. Em 1962, o isótopo 99 Tc foi identificado em um mineral de urânio, em diminutas quantidades, como resultado da fissão espontânea de átomos de 238 U. Se realmente existe na Terra, a concentração deve ser muito pequena. O isótopo 99 Tc é subproduto da fissão do urânio em reatores nucleares e, portanto, quantidades razoáveis vem sendo acumuladas ao longo do anos. Os radiofármacos de tecnécio tornaram-se, nos últimos 30 anos, importantes ferramentas para o diagnóstico de várias doenças ou disfunções de órgãos e sistemas que compõem o corpo humano. Atualmente, existem aproximadamente 30 desses compostos sendo utilizados em medicina nuclear, gerando um volume de exames correspondente a 80% da rotina clínica de um serviço de medicina nuclear. Disponível em: Acesso em: 26 out (adaptado) O átomo neutro do tecnécio apresenta a seguinte configuração eletrônica por subníveis no estado fundamental: 99Tc: 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p d 5 Considerando as informações apresentadas a respeito do elemento tecnécio, é possível inferir que (A) é impossível obter grande quantidades desse elemento pelo fato de não ser encontrado na natureza. é impossível de se formar compostos com outros elementos químicos, devido a sua radioatividade. (C) (D) são perdidos 49 prótons, no processo de sua obtenção a partir do urânio-238. encontra-se na camada de valência seu elétron mais energético. (E) pode somente ser obtido através da fissão espontânea de átomos de urânio. QUESTÃO 17 (Descritor: Ler, selecionar, interpretar e fazer uso apropriado de informações e dados apresentados em diferentes linguagens ou formas de representação.) Nível de dificuldade: Fácil. Assunto: Fórmulas. De toda a água atualmente encontrada na terra, 97% formam os oceanos e apenas 3% são encontrados nos continentes ou na atmosfera. A água do mar é uma solução contendo 70 elementos químicos, constituída por solvente (água) e por soluto (sais). A tabela traz a porcentagem em massa dos principais íons presentes na água do mar. 9
10 Principais íons presentes na água do mar Porcentagem em massa Cloreto (Cl - ) 55,0 Sódio (Na + ) 30,6 2- Sulfato (SO 4 ) 7,7 Magnésio (Mg 2+ ) 3,7 Cálcio (Ca 2+ ) 1,2 Potássio (K + ) 1,1 Com relação aos principais íons presentes na água do mar e suas quantidades, assinale a afirmativa correta. (A) A porcentagem em massa de cátions bivalentes é maior que a de cátions monovalentes. (C) A porcentagem em massa de cátions e ânions presentes na água do mar é a mesma. O cátion e o ânion de maior porcentagem em massa possuem a mesma quantidade de elétrons. (D) O cátion que possui mais elétrons é o que possui maior porcentagem em massa. (E) O número de elétrons dos dois cátions de menor porcentagem em massa é o mesmo. QUESTÃO 18 A fórmula do corpo Seu corpo não passa de um amontoado de elementos que não custam nem R$ 150. O que não tem preço, claro, é o jeito que tudo isso se organiza para formar você. Olhando, ninguém diz, mas 95% da massa do nosso corpo é constituída de apenas 4 elementos: oxigênio, carbono, hidrogênio e nitrogênio, que inclui os aproximados 42 litros de água que circulam em um organismo adulto. São os átomos desses quatro elementos combinados que formam as moléculas de proteína, gordura e carboidrato, os tijolos que constroem todos os nossos tecidos. Por isso, os quatro são chamados de elementos de constituição. Mas tudo não passaria de um grande amontoado de moléculas sem os outros 5%, que mesmo estando em menor quantidade, são fundamentais nos processos biológicos. Disponível em: Acesso em: 26 out (adaptado) A tabela mostra a porcentagem em massa de alguns dos elementos que constituem o corpo humano e sua contribuição na massa de um corpo de um adulto de 80 kg. Elemento Porcentagem em massa no corpo humano Massa em um adulto de 80 kg Oxigênio Carbono 18 14,4 Hidrogênio 10 8 Nitrogênio 3 2,4 Cálcio 1,5 1,2 Fósforo 1 0,8 Enxofre 0,25 0,2 Potássio 0,2 0,2 Cloro 0,15 0,12 Sódio 0,15 0,12 Magnésio 0,05 0,04 10
11 Ferro 0,006 0,0048 Flúor 0,0037 0,00296 Com relação às informações apresentadas e a posição dos elementos no quadro periódico, afirmamos que (A) a massa de cloreto de sódio em um adulto de 70 kg é de 120 g. os elementos do 3º período da tabela constituem mais de 90% da massa. (C) os metais alcalinos constituem menos de 1% da massa do corpo. (D) os metais alcalinos terrosos estão em menor massa que os alcalinos. (E) os metais estão em maior massa no corpo humano. QUESTÃO 19 Analise a charge que faz referência a um tipo de classificação dos elementos no sistema periódico. Disponível em: Acesso: 26 out Caso o texto do primeiro quadrinho representasse uma questão de prova, em que o enunciado estivesse mais claro sobre as intenções do professor em relação a alguma classificação ou característica dos elementos metálicos no quadro periódico, uma das respostas corretas possíveis para essa questão da prova seria: (A) São de transição ou representativos. São encontrados em qualquer grupo. (C) São encontrados em qualquer período. (D) São encontrados na família dos halogênios. (E) São maioria dentre os elementos representativos. 11
12 QUESTÃO 20 O gráfico representa, de forma qualitativa, as seis primeiras energias de ionização em função da ordem de retirada para átomos de um determinado elemento que se encontra no 3º período da classificação periódica. O gráfico representa átomos de um elemento que possui (A) 1ª energia de ionização menor que seu antecessor no quadro periódico. dez elétrons quando forma cátions bivalentes. (C) elétrons distribuídos em seis camadas de valência. (D) total de dois níveis de energia preenchidos com elétrons. (E) total de seis níveis de energia preenchidos com elétrons. QUESTÃO A bauxita é o minério de onde se extrai o alumínio, um elemento metálico constituinte de inúmeros objetos e manufaturas utilizadas pelo homem. É um metal resistente e de baixa densidade, o que confere menor peso aos componentes em que esse metal faz parte. Na natureza, é encontrado combinado com átomos de oxigênio na forma de óxido de alumínio, Al 2O 3. O processo que converte alumínio na forma iônica presente na bauxita em alumínio metálico, utilizado nas manufaturas, é chamado de eletrólise e consome uma enorme quantidade de energia elétrica, o que justifica sua reciclagem. Indique a afirmativa que caracteriza as duas espécies de alumínio citados no texto. (A) Ambas as espécies possuem o mesmo raio atômico. As duas espécies possuem a mesma configuração eletrônica por subníveis. (C) As duas espécies possuem a mesma quantidade de elétrons. (D) No processo da eletrólise do alumínio, três elétrons são ganhos. (E) No processo de reciclagem, o alumínio ganha elétrons. 12
13 QUESTÃO 22 A teoria das ligações covalentes e iônicas é incapaz de explicar as propriedades de um número muito grande de compostos, os metálicos. O modelo do gás eletrônico explica de maneira adequada uma série de propriedade dos metais, como a alta condutividade elétrica, por exemplo. Assinale a alternativa que representa uma característica da ligação presente nos compostos metálicos. (A) Ocorrem devido a atração de cátions por uma nuvem de elétrons. Ocorrem frequentemente com elementos de elevada eletronegatividade. (C) Ocorrem frequentemente com elementos de elevado potencial de ionização. (D) Ocorrem para formar substâncias sólidas somente. (E) Ocorrem somente entre átomos de um mesmo elemento. QUESTÃO 23 O conhecimento das ligações químicas é importante porque explica as propriedades e características dos diversos materiais existentes na natureza. O comportamento sob aquecimento, a condutibilidade elétrica e a solubilidade são algumas das propriedades que podem ser explicadas ou previstas através dos modelos de ligação. No laboratório de uma escola, um grupo de alunos sob supervisão do professor, recebeu uma amostra de sólido branco cristalino para que fosse determinado o tipo dessa substância com relação à natureza das ligações químicas envolvidas. Os alunos I. determinaram a temperatura de fusão dessa substância e encontraram 773 ºC. II. III. IV. mediram a condutividade elétrica no estado sólido e observaram que a substância não conduziu a eletricidade. colocaram certa quantidade desta substância em água e notaram que ela se solubilizou completamente. mediram a condutividade da solução obtida em III e perceberam que a substância conduziu bem a eletricidade. De acordo com os resultados obtidos nos experimento, os alunos podem concluir que, com relação à natureza da ligação envolvida, o material analisado é um sólido (A) ametálico. covalente. (C) iônico. (D) metálico. (E) molecular. 13
14 QUESTÃO 24 Nas substâncias moleculares, dois ou mais átomos de elementos não metálicos se unem através do compartilhamento de elétrons, formando uma estrutura denominada molécula. As interações entre as moléculas se dão por interações de natureza diferente das ligações químicas interatômicas. Com base nas informações apresentadas, indique a alternativa que contém fórmulas que representam este tipo de substância. (A) NaCl, H 2O e Ag. H 2O, O 2 e C 2H 5OH. (C) H 2O, CaCl 2 e HCl. (D) O 2, Ag e H 2SO 4. (E) N 2, CO 2 e NaCl. II. QUESTÕES DISCURSIVAS QUESTÃO 25 Leia o trecho a seguir. Um problema preocupava Hierão, tirano de Siracusa, no século III a.c., havia encomendado uma coroa de ouro, para homenagear uma divindade, mas suspeitava que o ourives o enganara, não utilizando ouro maciço em sua confecção. Como descobrir, sem danificar o objeto, se seu interior continha uma parte feita de prata? Só um homem talvez conseguisse resolver a questão: seu amigo Arquimedes, famoso matemático e inventor de vários engenhos mecânicos. Hierão mandou chamá-lo e pediu-lhe uma resposta que pusesse fim à sua dúvida. Arquimedes aceitou a incumbência e pôs-se a procurar a solução para o problema. Esta lhe ocorreu durante o banho. Observou que a quantidade de água que se elevava na banheira, ao submergir, era equivalente ao volume de seu próprio corpo. Ali estava a chave para resolver a questão proposta pelo tirano. No entusiasmo da descoberta, Arquimedes saiu nu pelas ruas, gritando: Eureka! Eureka! Achei! Achei! Disponível em: Acesso em: 12 out (A) Supondo que a coroa do rei tivesse uma massa total de 1,5 kg, e que o volume de água transbordado de um recipiente completamente cheio com esse líquido ao ser colocada a coroa foi de 100 ml. Com essas informações responda se a coroa era feita de ouro puro ou não. Justifique sua resposta. Caso a coroa fosse feita com uma liga que contivesse uma proporção em massa de 50% de ouro e 50% de prata, determine o volume de água que deveria transbordar do recipiente. Dados: d(ouro) = 19,3 g.cm -3 (25 ºC) e d(prata) = 10,5 g.cm -3 (25 ºC) QUESTÃO 26 Leia as informações a seguir. Tendo a qualidade dos alimentos se tornado um problema mundial, é cada vez mais importante a detecção de produtos rotulados de forma fraudulenta, e de qualidade inferior no mercado, tanto por razões econômicas como por razões de saúde pública. Assim, se faz necessário utilizar todos os meios disponíveis para detectar a possível presença de substâncias indesejáveis nos alimentos. E com o leite não é diferente, pois ele apresenta vários componentes que podem ser alterados no caso de fraude. A adição de água ao leite é um método muito antigo utilizado em pequenas propriedades rurais, para aumentar o seu rendimento. Esse tipo de alteração além de lesar o consumidor, põe em risco a saúde sua saúde, pois a água que é adicionada muitas vezes não passa por nenhum tratamento e pode contaminar o produto com microrganismos. Quando ao leite é adicionada água, a caseína que se encontra na forma de partículas esféricas combinadas com o cálcio vai se desfazendo, o que, além da própria água adicionada, ainda contribui para diminuir o rendimento na produção dos derivados do leite. 14
15 Pela Instrução Normativa nº 51 para leite cru tipo C integral refrigerado, permite-se um variação de 1,028 a 1,034g/mL (BRASIL, 2002) na densidade e um teor de gordura máximo de 3% em massa. Disponível em: Acesso em: 12 out (adaptado) Um determinado laboratório de análise recebeu 50 ml de 7 amostras de leite suspeitas de estarem adulteradas pela adição de água. Após a análise, foi construída a tabela a seguir com alguns dos resultados obtidos. Massa de gordura Amostra Densidade a 25º C / g.ml -1 encontrada / g 1 1,031 1,95 2 1,031 1,85 3 1,030 1,90 4 1,029 1,80 5 1,028 1,80 6 1,028 1,70 7 1,026 1,60 (A) Sabendo-se que houve adição de água em 5 amostras de leite, identifique estas amostras. Justifique a sua resposta. Dentre as amostras apresentadas por você no item anterior desta questão, indique qual teve a maior adição de água. (C) Dentre as amostras analisadas, somente uma está fora dos padrões estabelecidos. Identifique-a e justifique a sua resposta. QUESTÃO 27 Uma importante etapa no processo da reciclagem consiste na separação dos materiais a serem reciclados. Considere que em uma cooperativa de reciclagem um grupo de trabalhadores fez a separação de diferentes tipos de plásticos, que em seguida foram triturados e ensacados em sacos de plástico de diferentes volumes que ficaram completamente cheios. Um dos trabalhadores resolveu medir a massa de cada um desses sacos e encontrou os seguintes valores. Amostra Massa / kg Volume do saco / L 1 4, , , ,6 50 Com base nas informações apresentadas e considerando desprezível o espaço vazio em cada um dos sacos, responda às questões a seguir. (A) Identifique qual plástico possui menor densidade. Justifique a sua resposta. Sabendo que duas destas amostras contêm o mesmo tipo de plástico, identifique-as. Justifique sua resposta. (C) Um dos trabalhadores desta cooperativa ensacou o mesmo plástico da amostra 1, porém em sacos de 25 L. Indique a massa, em kg, deste saco. (D) Considere uma mistura contendo plástico das 4 amostras. Um desses plásticos pode ser separado dos demais pela adição de água. Sabendo que todos os plásticos são insolúveis em água, identifique a amostra que contém esse plástico e explique sua resposta. 15
16 QUESTÃO 28 O gráfico a seguir mostra o aquecimento de 500 g de um determinado material no estado líquido, à temperatura ambiente, até a sua completa vaporização. Considerando-se que esta experiência fora realizada ao nível do mar, responda às questões a seguir. (A) O material é uma substância ou uma mistura? Justifique a sua resposta. Se, em vez de aquecer 500 g, fosse aquecido o dobro da massa da substância líquida até a completa vaporização. Neste caso, o patamar constante mostrado no gráfico seria abaixo, acima ou no mesmo lugar do apresentado no gráfico anterior. Justifique sua resposta. (C) Caso essa experiência tivesse sido realizada no alto de uma montanha, o patamar constante mostrado no gráfico seria abaixo, acima ou no mesmo lugar do apresentado no gráfico anterior. Justifique sua resposta. QUESTÃO 29 Para entender o principio de funcionamento dos termômetros, um professor propôs que seus alunos segurassem, durante algum tempo, o bulbo de um termômetro de laboratório. Os resultados encontrados são mostrados na figura a seguir. Com base nos resultados deste experimento e nos conceitos da teoria cinética molecular, resolva as questões a seguir. 16
17 (A) Identifique qual foi o aumento de temperatura. Explique por que o líquido no interior do termômetro aumentou de volume. (C) Explique se a densidade do líquido no termômetro ao fim da experiência é maior, igual ou menor que no início. QUESTÃO 30 (Descritor: Identificar as transformações ou variáveis relevantes em uma situação-problema e elaborar possíveis estratégias para equacioná-la ou resolvê-la.) Nível de dificuldade: Médio. Assunto: Separação de mistura. Uma tarefa importante do trabalho de um químico é a separação dos componentes de uma mistura. Para isso, é importante que se conheça as propriedades das substâncias que se deseja isolar. O quadro a seguir apresenta a solubilidade de alguns cloretos em água. Sal Água Fria Água Quente AgCl Insolúvel Insolúvel NaCl Solúvel Solúvel KCl Solúvel Solúvel PbCl 2 Insolúvel Solúvel Supondo que um químico disponha dos materiais mais comuns de laboratório, além de água fria e quente, descreva um procedimento que ele poderia realizar para separar uma mistura de (A) cloreto de prata e cloreto de sódio. cloreto de prata, cloreto de potássio e cloreto de chumbo. QUESTÃO 31 Em uma feira de ciências um grupo de alunos, sob coordenação do professor, resolveu apresentar um trabalho sobre separação de misturas. O esquema a seguir ilustra os processos que foram realizados. (A) Considerando os métodos de separação mais comuns realizados em laboratório, identifique a operação X. Justifique sua resposta. Identifique a operação Y e a descreva sucintamente. Em sua resposta indique a propriedade envolvida que tornou possível a separação. 17
18 QUESTÃO 32 Leia as informações a seguir: Para representar uma realidade que não podemos ver, como o átomo, lançamos mão do uso de modelos. Ao longo da história, o uso de modelos tem se mostrado uma importante ferramenta para se compreender inúmeros conceitos e fenômenos do mundo científico. Através do resultado de experimentos, é possível elaborar conclusões e a partir delas fazer propostas de como as coisas funcionam ou são constituídas. No início do século XX, Rutherford e colaboradores realizaram uma experiência que ficou conhecida como a experiência do espalhamento de partículas alfa. Essa experiência consistia basicamente em bombardear uma fina lâmina de ouro com partículas alfa, de natureza positiva e verificar, através de detectores, os ângulos de deflexão dessas partículas. De acordo com o modelo atômico da época, o de Thomson, esperava-se que a maioria das partículas alfa atravessasse a lâmina de ouro direto, sem sofrer grandes desvios. Através dos resultados deste experimento, Rutherford tirou conclusões e fez propostas sobre a constituição do átomo, propondo, para isso, um modelo. A seguir, são descritos alguns dos resultados obtidos com a experiência do espalhamento de partículas alfa. A partir desses resultados, indique qual foi a conclusão proposta por Rutherford. (A) A maioria das partículas alfa atravessou a lâmina de ouro direto sem sofrer desvios. Algumas poucas partículas sofreram grandes desvios. (C) Para o átomo de ouro, uma contagem permitiu concluir que a cada cerca de partículas que atravessavam a lamina de ouro direto, uma sofria grande desvio ou voltava. QUESTÃO 33 Leia a notícia a seguir: Copernício Elemento químico 112 é batizado de Copernício Redação do Site Inovação Tecnológica - 25/02/2010 O elemento químico mais pesado que se conhece, já reconhecido pela União Internacional de Química Pura e Aplicada (IUPAC, em inglês), acaba de ser batizado, mais de uma década depois do seu "nascimento." O elemento, com número atômico 112, recebeu o nome de copernicium na versão oficial - aportuguesado para copernício - e terá o símbolo químico "Cn". O nome é uma homenagem ao astrônomo Nicolau Copérnico ( ). Elemento mais pesado que existe A IUPAC aceitou o nome proposto pela equipe que descobriu o elemento, que trabalha no Centro para Pesquisa de Íons Pesados, em Darmstadt, na Alemanha. Os cientistas haviam sugerido o símbolo químico "Cp", mas a IUPAC afirmou que esta abreviatura tem outros sentidos científicos, o que poderia causar confusão, terminando por optar por Cn. O copernício é 277 vezes mais pesado do que o hidrogênio, tornando-se o elemento mais pesado oficialmente reconhecido pela IUPAC. Antes do batismo oficial, o copernício era conhecido como unúmbio (ununbium), a palavra latina para o número 112. Os cientistas produziram o copernício pela primeira vez em 9 de Fevereiro de Usando um acelerador de 100 metros de comprimento, a equipe do Dr. Sigurd Hofmann disparou íons de zinco sobre uma folha de um metal representativo. A fusão dos núcleos atômicos dos dois elementos produziu um átomo do novo elemento 112, que dura apenas uma fração de segundo. Os cientistas foram capazes de identificá-lo medindo as partículas alfa emitidas durante o decaimento radioativo do novo átomo. 18
19 Disponível em: Acesso: 30 out (Adaptações). Com relação ao método de produção do novo elemento químico produzido e as suas características, resolva as questões a seguir. (A) Localize o elemento copernício na tabela periódica e indique o período e o grupo onde ele se encontra. Identifique o metal representativo da folha que foi bombardeada por íons zinco para a produção do copernício. Justifique sua resposta. QUESTÃO 34 Leia a informação a seguir: Metais estão ameaçados de extinção, diz relatório da ONU Metais estão ameaçados de extinção, diz relatório da ONU Redação do Site Inovação Tecnológica - 22/06/2010 "Os cientistas devem antever a possibilidade de que eles poderão não dispor de toda a Tabela Periódica para trabalhar no futuro," afirmou Thomas Graedel, ao divulgar um novo relatório da ONU sobre a oferta mundial de metais. Na lista dos "metais ameaçados de extinção" estão lítio, neodímio e índio, todos elementos essenciais para a indústria eletrônica, principalmente o lítio, que é a base de todas as baterias dos equipamentos portáteis atuais. A "extinção" referida é, na verdade, um risco de exaustão, o termo utilizado para se referir ao fim das reservas de uma mina - neste caso, os pesquisadores apontam o risco de exaustão não apenas de uma mina, mas de todas as reservas conhecidas no mundo. Meia Tabela Periódica em cada celular Um dos maiores obstáculos para determinar a quantidade de metal com que a humanidade poderá contar no futuro é que apenas cerca de um terço deles conta com estatísticas ou estimativas sobre a quantidade já extraída e em uso. De todos eles, apenas cinco foram quantificados de forma segura. Os telefones celulares e os computadores podem usar até 40 elementos químicos, em quantidades que vão de miligramas a gramas. Não é à toa que virou um chavão afirmar que cada celular, além da mais moderna tecnologia, tem também metade da Tabela Periódica em seu interior. Nós usamos muito material em estruturas altamente complexas. Segundo Graedel o redesenho de produtos e equipamentos é uma opção imediata para lidar com o desafio. Um desafio para os cientistas e para os engenheiros de materiais, segundo ele. Disponível em: Acesso em: 30 out (Adaptações). Com relação aos elementos citados no texto, resolva as questões a seguir. (A) Identifique, dentre os metais mais ameaçados de extinção, aquele que é alcalino. Indique o número de elétrons de seu átomo neutro. Identifique o metal de transição citado no texto e indique o grupo da tabela periódica a qual ele pertence. (C) Um dos elementos citados no texto possui a seguinte configuração eletrônica por subníveis: 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 1 Identifique esse elemento e indique a quantidade de elétrons em cada nível de energia de seus átomos. 19
20 (D) No texto há uma recomendação para se solucionar ou pelo menos tornar mínimo o impacto do consumo de metais de forma excessiva. Cite outra forma de resolver ou pelo menos minimizar o problema da extinção de alguns metais. Questão 35 Leia as informações seguintes: Multidão lota as areias de Copacabana para o réveillon Expectativa é de que cerca de 2 milhões de pessoas assistam aos shows e à queima de fogos na orla Anderson Dezan, ig Rio de Janeiro 31/12/2010 Milhares de pessoas lotam no início da noite desta sexta-feira (31) as areias da praia de Copacabana, na zona sul do Rio de Janeiro, para comemorar a chegada de A expectativa é de que cerca de 2 milhões de pessoas assistam à queima de fogos. Para garantir o espetáculo, onze balsas com fogos de artifício três a mais que no último réveillon já estão estacionadas no mar a 400 metros da faixa de areia, por medidas de segurança. As embarcações estão espalhadas lado a lado ao longo da orla. Essa disposição, segundo os organizadores, irá proporcionar ao público uma melhor visualização do show pirotécnico. A previsão é de que o espetáculo de fogos no céu de Copacabana dure cerca de 20 minutos. Para isso, cada balsa conta com bombas cada, totalizando 20 toneladas de fogos de artifício. Disponível em: Acesso: 26 out (Adaptações) As cores dos fogos de artifício que vemos no céu são produzidas a partir de dois fenômenos, a incandescência e a luminescência. A incandescência é a luz produzida quando se aquece uma substância. É o que ocorre, por exemplo, nas lâmpadas chamadas incandescentes, onde a passagem de corrente elétrica sobre o filamento que é feito de tungstênio, aquece esse metal que, a altas temperaturas, emite luz. Quando nos fogos de artifício se utiliza magnésio e/ou alumínio acontece processo semelhante, ou seja, os átomos destes elementos produzem luz a altas temperaturas. O outro fenômeno, a luminescência, é o responsável por diversas cores produzidas pelos fogos de artifício. Essas cores por sua vez, dependem do tipo de sal utilizado na mistura, que é colocada junto com a pólvora. O quadro a seguir relaciona algumas destas substâncias e as cores que elas produzem. Sal NaCl CuCl 2 SrCl 2 BaCl 2 Cor produzida nos fogos de artifício Amarela Azul Vermelha Verde (A)Para cada substância apresentada no quadro, identifique qual é o elemento responsável pela produção da cor. Explique como o fenômeno da luminescência produz as cores nos fogos de artifício. 20
21 Questão 36 Uma propriedade periódica varia repetidamente ao longo da tabela periódica, ou seja, ao longo desta, os elementos possuem características que se repetem. Uma das grandes contribuições do modelo de Bohr foi a possibilidade de explicação de algumas dessas propriedades. Observe o quadro a seguir que contem os valores de raio atômico, primeira e segunda energias de ionização para átomos de alguns elementos químicos. Elemento Número atômico (Z) Raio atômico (pm) 1ª energia de ionização (kj/mol) 2ª energia de ionização (kj/mol) Nitrogênio (N) ,3 2846,0 Oxigênio (O) ,9 3388,3 Flúor (F) ,0 3374,2 Sódio (Na) ,8 4562,0 Com base nos dados apresentados no quadro anterior e na variação das propriedades periódicas dos elementos, responda as questões a seguir. (A) Seguindo a lógica dos valores de raio atômico para os elementos de número atômico igual a 7, 8 e 9, qual é o valor do raio atômico esperado para o átomo do elemento sódio? Por que o sódio tem raio atômico consideravelmente maior que os demais elementos mostrados no quadro, uma vez que o seu número atômico é próximo ao desses elementos? (C) Dentre os elementos apresentados no quadro, qual possui maior diferença, em temos percentuais, entre o valor da 1ª e da 2ª energia de ionização. Explique a causa dessa considerável diferença. QUESTÃO 37 Analise o quadro a seguir com algumas características de alguns materiais A, B, C e D. Substância Temperatura de Fusão (ºC) Condutividade elétrica no estado sólido Condutividade elétrica no estado líquido Solubilidade em água Solubilidade em Gasolina A 962 Bom condutor Bom condutor Insolúvel Insolúvel B 2500 Mal condutor Bom condutor Solúvel Insolúvel C 114 Mal condutor Mal condutor Insolúvel Solúvel D 2800 Mal condutor Mal condutor Insolúvel Insolúvel Com base nas propriedades dessas substâncias, e nos modelos de ligação química, resolva as questões a seguir. (A) Classifique a substância A em metálica, covalente, iônica ou molecular. Justifique sua resposta indicando a(s) propriedade(s) na(s) qual(is) sua escolha se afirma. Classifique a substância B em metálica, covalente, iônica ou molecular. Justifique sua resposta indicando a(s) propriedade(s) na(s) qual(is) sua escolha se afirma. (C) Classifique as substâncias C e D em metálica, covalente, iônica ou molecular. 21
22 QUESTÃO 38 A natureza da ligação química é revelada a partir da estrutura eletrônica dos átomos, mostrando como esta afeta as propriedades macroscópicas das substâncias. Os três tipos mais comuns de ligações químicas, consideradas fortes e que estão presentes na maioria das moléculas são a ligação iônica, a ligação covalente e a ligação metálica. A ligação química, sendo a interação de dois átomos (ou grupos de átomos), está intimamente ligada ao rearranjo da estrutura eletrônica, ou melhor, dos elétrons dos átomos dentro de uma nova molécula. Considere os seguintes grupos de elementos: Grupo I: Na, Ca e Al Grupo II: Cl, O e F. Disponível em: Acesso: 26 out (A) Ligações iônicas podem ocorrer entre átomos de qual(is) grupo(s)? Explique sua resposta. Escreva a fórmula de dois compostos iônicos formados pela combinação de átomos citados no item anterior desta questão. (C) Se átomos dos elementos do grupo I combinarem entre si, qual será a ligação química formada? Explique como se dá a atração interatômica neste caso. QUESTÃO 39 O valor da temperatura de fusão e ebulição de uma substância está diretamente ligado à intensidade da força de atração que existe em suas partículas. Através dos modelos de ligação podemos explicar os altos ou os baixos valores desta propriedade. Analise o quadro a seguir que apresenta a temperatura de fusão de duas diferentes substâncias. Substância Temperatura de fusão ( C) Cloreto de potássio KCl 773 Óxido de cálcio CaO (A) Identifique a ligação química que predomina entre os átomos destas duas substâncias. Explique porque a temperatura de fusão do óxido de cálcio é consideravelmente maior que a do cloreto de potássio. QUESTÃO 40 As substâncias moleculares possuem baixa temperatura de fusão e ebulição, quando comparadas às substâncias iônicas, covalentes e metálicas. Observe os processos I e II a seguir, que mostram o calor gasto para duas transformações que ocorrem com a água. Processo I Vaporização de água H 2O(l) H 2O (v) Consome 44 kj de energia para cada 18 g de água. Processo II Atomização da água 2H 2O (v) 2H(g) + O(g) Consome 900 kj de energia para cada 18 g de água. (A) Classifique os processos I e II em físicos ou químicos. Explique por que o processo II consome uma quantidade de energia consideravelmente maior que o processo I, considerando uma mesma quantidade de água. 22
23 23
(B) Identifique o metal representativo da folha que foi bombardeada por íons zinco para a produção do copernício. Justifique sua resposta.
 Lista de Exercícios de Recuperação do 2 Bimestre Instruções gerais: Resolver os exercícios à caneta e em folha de papel almaço ou monobloco (folha de fichário). Copiar os enunciados das questões. Entregar
Lista de Exercícios de Recuperação do 2 Bimestre Instruções gerais: Resolver os exercícios à caneta e em folha de papel almaço ou monobloco (folha de fichário). Copiar os enunciados das questões. Entregar
Lista de Exercícios de Recuperação do 1 Bimestre
 Lista de Exercícios de Recuperação do 1 Bimestre Instruções gerais: Resolver os exercícios à caneta e em folha de papel almaço ou monobloco (folha de fichário). Copiar os enunciados das questões. Entregar
Lista de Exercícios de Recuperação do 1 Bimestre Instruções gerais: Resolver os exercícios à caneta e em folha de papel almaço ou monobloco (folha de fichário). Copiar os enunciados das questões. Entregar
Escola Secundária Anselmo de Andrade Teste Sumativo de Ciências Físico - Químicas 9º Ano Ano Lectivo 08/09
 Escola Secundária Anselmo de Andrade Teste Sumativo de Ciências Físico - Químicas 9º Ano Ano Lectivo 08/09 2ºTeste Sumativo 1ºPeríodo Duração do Teste:60 minutos Data: 05 / 12 / 08 Prof. Dulce Godinho
Escola Secundária Anselmo de Andrade Teste Sumativo de Ciências Físico - Químicas 9º Ano Ano Lectivo 08/09 2ºTeste Sumativo 1ºPeríodo Duração do Teste:60 minutos Data: 05 / 12 / 08 Prof. Dulce Godinho
Teoria Atômica. Constituição da matéria. Raízes históricas da composição da matéria. Modelos atômicos. Composição de um átomo.
 Teoria Atômica Constituição da matéria Raízes históricas da composição da matéria Modelos atômicos Composição de um átomo Tabela periódica Raízes Históricas 6000 a.c.: descoberta do fogo 4000 a.c.: vidros,
Teoria Atômica Constituição da matéria Raízes históricas da composição da matéria Modelos atômicos Composição de um átomo Tabela periódica Raízes Históricas 6000 a.c.: descoberta do fogo 4000 a.c.: vidros,
Prova de Recuperação Bimestral de Ciências Nome Completo: Data: / /2010
 COLÉGIO MARIA IMACULADA QI 05 ch. 72 LAGO SUL BRASÍLIA DF E-MAIL: cmidf@cmidf.com.br FONE: 248 4768 SITE: www.cmidf.com.br VALOR:10 pontos. NOTA: 9ºano 2º PERÍODO Prova de Recuperação Bimestral de Ciências
COLÉGIO MARIA IMACULADA QI 05 ch. 72 LAGO SUL BRASÍLIA DF E-MAIL: cmidf@cmidf.com.br FONE: 248 4768 SITE: www.cmidf.com.br VALOR:10 pontos. NOTA: 9ºano 2º PERÍODO Prova de Recuperação Bimestral de Ciências
Química. Resolução das atividades complementares. Q42 Ligação metálica
 Resolução das atividades complementares 3 Química Q42 Ligação metálica p. 59 1 (Cefet-PR) Analise as afirmações a seguir: I. O metal X é leve, sofre pouca corrosão e é bastante utilizado na construção
Resolução das atividades complementares 3 Química Q42 Ligação metálica p. 59 1 (Cefet-PR) Analise as afirmações a seguir: I. O metal X é leve, sofre pouca corrosão e é bastante utilizado na construção
1º trimestre Ciências Sala de estudos Data: Abril/2015 Ensino Fundamental 9º ano classe: Profª Elisete Nome: nº
 1º trimestre Ciências Sala de estudos Data: Abril/2015 Ensino Fundamental 9º ano classe: Profª Elisete Nome: nº Valor: 10 Nota:.. Conteúdo: Atomística e MRU 1) Observe o trecho da história em quadrinhos
1º trimestre Ciências Sala de estudos Data: Abril/2015 Ensino Fundamental 9º ano classe: Profª Elisete Nome: nº Valor: 10 Nota:.. Conteúdo: Atomística e MRU 1) Observe o trecho da história em quadrinhos
Material Extra: Modelos atômicos e atomística Química professor Cicero # Modelos Atômicos e atomística - Palavras chaves
 Material Extra: Modelos atômicos e atomística Química professor Cicero # Modelos Atômicos e atomística - Palavras chaves Evolução da ideia do átomo 1) Partícula maciça, indivisível e indestrutível; 2)
Material Extra: Modelos atômicos e atomística Química professor Cicero # Modelos Atômicos e atomística - Palavras chaves Evolução da ideia do átomo 1) Partícula maciça, indivisível e indestrutível; 2)
Apostila de Química Geral
 Cursinho Vitoriano UNESP - Universidade Estadual Paulista "Júlio de Mesquita Filho" Câmpus de São José do Rio Preto Apostila de Química Geral Período noturno Ligações químicas interatômicas Vanessa R.
Cursinho Vitoriano UNESP - Universidade Estadual Paulista "Júlio de Mesquita Filho" Câmpus de São José do Rio Preto Apostila de Química Geral Período noturno Ligações químicas interatômicas Vanessa R.
QUÍMICA QUESTÃO 41 QUESTÃO 42
 Processo Seletivo/UNIFAL- janeiro 2008-1ª Prova Comum TIPO 1 QUÍMICA QUESTÃO 41 Diferentes modelos foram propostos ao longo da história para explicar o mundo invisível da matéria. A respeito desses modelos
Processo Seletivo/UNIFAL- janeiro 2008-1ª Prova Comum TIPO 1 QUÍMICA QUESTÃO 41 Diferentes modelos foram propostos ao longo da história para explicar o mundo invisível da matéria. A respeito desses modelos
A) a existência do oceano líquido é uma hipótese possível, pois um sal solúvel só forma uma mistura homogênea com a água, quando ela está líquida.
 TEXTO PARA A QUESTÃO 1. Sonda espacial detecta sal de cozinha em lua de Saturno A análise da composição química do anel mais externo de Saturno revelou a presença de 98% de água, 1% de cloreto de sódio,
TEXTO PARA A QUESTÃO 1. Sonda espacial detecta sal de cozinha em lua de Saturno A análise da composição química do anel mais externo de Saturno revelou a presença de 98% de água, 1% de cloreto de sódio,
COLÉGIO NOSSA SENHORA DA PIEDADE. Programa de Recuperação Paralela. 2ª Etapa 2014. 1ª série Turma: FG
 COLÉGIO NOSSA SENHORA DA PIEDADE Programa de Recuperação Paralela 2ª Etapa 2014 Disciplina: QUÍMICA Professora: Maria Luiza 1ª série Turma: FG Caro aluno, você está recebendo o conteúdo de recuperação.
COLÉGIO NOSSA SENHORA DA PIEDADE Programa de Recuperação Paralela 2ª Etapa 2014 Disciplina: QUÍMICA Professora: Maria Luiza 1ª série Turma: FG Caro aluno, você está recebendo o conteúdo de recuperação.
Separação de Misturas
 1. Introdução Separação de Misturas As misturas são comuns em nosso dia a dia. Como exemplo temos: as bebidas, os combustíveis, e a própria terra em que pisamos. Poucos materiais são encontrados puros.
1. Introdução Separação de Misturas As misturas são comuns em nosso dia a dia. Como exemplo temos: as bebidas, os combustíveis, e a própria terra em que pisamos. Poucos materiais são encontrados puros.
Química Atomística Profª: Bruna Villas Bôas. Exercícios
 NÚMERO ATÔMICO (Z) Os diferentes tipos de átomos (elementos químicos) são identificados pela quantidade de prótons (P) que possui. Esta quantidade de prótons recebe o nome de número atômico e é representado
NÚMERO ATÔMICO (Z) Os diferentes tipos de átomos (elementos químicos) são identificados pela quantidade de prótons (P) que possui. Esta quantidade de prótons recebe o nome de número atômico e é representado
RESOLUÇÃO COMENTADA DA PROVA DA UNESP DE 2014
 RESOLUÇÃO COMENTADA DA PROVA DA UNESP DE 2014 1-Alguns historiadores da Ciência atribuem ao filósofo pré-socrático Empédocles a Teoria dos Quatro Elementos. Segundo essa teoria, a constituição de tudo
RESOLUÇÃO COMENTADA DA PROVA DA UNESP DE 2014 1-Alguns historiadores da Ciência atribuem ao filósofo pré-socrático Empédocles a Teoria dos Quatro Elementos. Segundo essa teoria, a constituição de tudo
Juliana Cerqueira de Paiva. Modelos Atômicos Aula 2
 Juliana Cerqueira de Paiva Modelos Atômicos Aula 2 2 Modelo Atômico de Thomson Joseph John Thomson (1856 1940) Por volta de 1897, realizou experimentos estudando descargas elétricas em tubos semelhantes
Juliana Cerqueira de Paiva Modelos Atômicos Aula 2 2 Modelo Atômico de Thomson Joseph John Thomson (1856 1940) Por volta de 1897, realizou experimentos estudando descargas elétricas em tubos semelhantes
Resolução da Prova de Química Vestibular Verão UERGS/2003 Prof. Emiliano Chemello
 Fácil Resolução da Prova de Química Vestibular Verão UERGS/2003 Prof. Emiliano Chemello Médio www.quimica.net/emiliano emiliano@quimica.net Difícil Níveis de dificuldade das Questões 01. Em um frasco,
Fácil Resolução da Prova de Química Vestibular Verão UERGS/2003 Prof. Emiliano Chemello Médio www.quimica.net/emiliano emiliano@quimica.net Difícil Níveis de dificuldade das Questões 01. Em um frasco,
PROF. KELTON WADSON OLIMPÍADA 8º SÉRIE ASSUNTO: TRANSFORMAÇÕES DE ESTADOS DA MATÉRIA.
 PROF. KELTON WADSON OLIMPÍADA 8º SÉRIE ASSUNTO: TRANSFORMAÇÕES DE ESTADOS DA MATÉRIA. 1)Considere os seguintes dados obtidos sobre propriedades de amostras de alguns materiais. Com respeito a estes materiais,
PROF. KELTON WADSON OLIMPÍADA 8º SÉRIE ASSUNTO: TRANSFORMAÇÕES DE ESTADOS DA MATÉRIA. 1)Considere os seguintes dados obtidos sobre propriedades de amostras de alguns materiais. Com respeito a estes materiais,
Tabel e a l P rió dica
 Tabela Periódica Desenvolvimento histórico da Tabela Periódica Dmitri Mendeleev (1834-1907 ) Escreveu em fichas separadas as propriedades (estado físico, massa, etc) dos elementos químicos. Enquanto arruma
Tabela Periódica Desenvolvimento histórico da Tabela Periódica Dmitri Mendeleev (1834-1907 ) Escreveu em fichas separadas as propriedades (estado físico, massa, etc) dos elementos químicos. Enquanto arruma
Aluno (a): Professor:
 3º BIM P1 LISTA DE EXERCÍCIOS CIÊNCIAS 6º ANO Aluno (a): Professor: Turma: Turno: Data: / / Unidade: ( ) Asa Norte ( ) Águas Lindas ( )Ceilândia ( ) Gama ( )Guará ( ) Pistão Norte ( ) Recanto das Emas
3º BIM P1 LISTA DE EXERCÍCIOS CIÊNCIAS 6º ANO Aluno (a): Professor: Turma: Turno: Data: / / Unidade: ( ) Asa Norte ( ) Águas Lindas ( )Ceilândia ( ) Gama ( )Guará ( ) Pistão Norte ( ) Recanto das Emas
478 a.c. Leucipo e seu discípulo Demócrito
 MODELOS ATÔMICOS 478 a.c. Leucipo e seu discípulo Demócrito - A matéria após sofrer várias subdivisões, chegaria a uma partícula indivisível a que chamaram de átomo. - ÁTOMO a = sem tomos = divisão - Esta
MODELOS ATÔMICOS 478 a.c. Leucipo e seu discípulo Demócrito - A matéria após sofrer várias subdivisões, chegaria a uma partícula indivisível a que chamaram de átomo. - ÁTOMO a = sem tomos = divisão - Esta
CLASSIFICAÇÃO PERIÓDICA DOS ELEMENTOS
 CLASSIFICAÇÃO PERIÓDICA DOS ELEMENTOS EXERCÍCIOS Questão 01) O correto uso da tabela periódica permite determinar os elementos químicos a partir de algumas de suas características. Recorra a tabela periódica
CLASSIFICAÇÃO PERIÓDICA DOS ELEMENTOS EXERCÍCIOS Questão 01) O correto uso da tabela periódica permite determinar os elementos químicos a partir de algumas de suas características. Recorra a tabela periódica
Propriedades da matéria e mudanças de estado físico
 INSTITUTO FEDERAL DE EDUCAÇÃO, CIÊNCIA E TECNOLOGIA BAIANO Campus Valença Propriedades da matéria e mudanças de estado físico Professor: José Tiago Pereira Barbosa 1 Propriedades da Matéria A matéria é
INSTITUTO FEDERAL DE EDUCAÇÃO, CIÊNCIA E TECNOLOGIA BAIANO Campus Valença Propriedades da matéria e mudanças de estado físico Professor: José Tiago Pereira Barbosa 1 Propriedades da Matéria A matéria é
Segundo a Portaria do Ministério da Saúde MS n.o 1.469, de 29 de dezembro de 2000, o valor máximo permitido (VMP) da concentração do íon sulfato (SO 2
 11 Segundo a Portaria do Ministério da Saúde MS n.o 1.469, de 29 de dezembro de 2000, o valor máximo permitido (VMP) da concentração do íon sulfato (SO 2 4 ), para que a água esteja em conformidade com
11 Segundo a Portaria do Ministério da Saúde MS n.o 1.469, de 29 de dezembro de 2000, o valor máximo permitido (VMP) da concentração do íon sulfato (SO 2 4 ), para que a água esteja em conformidade com
Profa. Maria Fernanda - Química nandacampos.mendonc@gmail.com
 Profa. Maria Fernanda - Química nandacampos.mendonc@gmail.com Estudo de caso Reúnam-se em grupos de máximo 5 alunos e proponha uma solução para o seguinte caso: A morte dos peixes ornamentais. Para isso
Profa. Maria Fernanda - Química nandacampos.mendonc@gmail.com Estudo de caso Reúnam-se em grupos de máximo 5 alunos e proponha uma solução para o seguinte caso: A morte dos peixes ornamentais. Para isso
ATIVIDADES DE RECUPERAÇÃO PARALELA 3º TRIMESTRE 8º ANO DISCIPLINA: FÍSICA
 ATIVIDADES DE RECUPERAÇÃO PARALELA 3º TRIMESTRE 8º ANO DISCIPLINA: FÍSICA Observações: 1- Antes de responder às atividades, releia o material entregue sobre Sugestão de Como Estudar. 2 - Os exercícios
ATIVIDADES DE RECUPERAÇÃO PARALELA 3º TRIMESTRE 8º ANO DISCIPLINA: FÍSICA Observações: 1- Antes de responder às atividades, releia o material entregue sobre Sugestão de Como Estudar. 2 - Os exercícios
PROVA DE QUÍMICA - 1998 Segunda Etapa
 PROVA DE QUÍMICA - 1998 Segunda Etapa QUESTÃO 01 Num laboratório químico, havia três frascos que continham, respectivamente, um alcano, um álcool e um alqueno. Foram realizados experimentos que envolviam
PROVA DE QUÍMICA - 1998 Segunda Etapa QUESTÃO 01 Num laboratório químico, havia três frascos que continham, respectivamente, um alcano, um álcool e um alqueno. Foram realizados experimentos que envolviam
U N I V E R S I D A D E F E D E R A L D E M I N A S G E R A I S SÓ ABRA QUANDO AUTORIZADO.
 U N I V E R S I D A D E F E D E R A L D E M I N A S G E R A I S QUÍMICA Prova de 2 a Etapa SÓ ABRA QUANDO AUTORIZADO. Leia atentamente as instruções que se seguem. 1 - Este Caderno de Prova contém cinco
U N I V E R S I D A D E F E D E R A L D E M I N A S G E R A I S QUÍMICA Prova de 2 a Etapa SÓ ABRA QUANDO AUTORIZADO. Leia atentamente as instruções que se seguem. 1 - Este Caderno de Prova contém cinco
Ligações Químicas Ligação Iônica Ligação Metálica
 Química Geral e Inorgânica QGI0001 Eng a. de Produção e Sistemas Prof a. Dr a. Carla Dalmolin Ligações Químicas Ligação Iônica Ligação Metálica Periodicidade O átomo é visto como uma esfera, onde só as
Química Geral e Inorgânica QGI0001 Eng a. de Produção e Sistemas Prof a. Dr a. Carla Dalmolin Ligações Químicas Ligação Iônica Ligação Metálica Periodicidade O átomo é visto como uma esfera, onde só as
ROTEIRO DE ESTUDO I ETAPA LETIVA CIÊNCIAS 4.º ANO/EF 2015
 SOCIEDADE MINEIRA DE CULTURA MANTENEDORA DA PUC Minas E DO COLÉGIO SANTA MARIA ROTEIRO DE ESTUDO I ETAPA LETIVA CIÊNCIAS 4.º ANO/EF 2015 Caro (a) aluno(a), É tempo de conferir os conteúdos estudados na
SOCIEDADE MINEIRA DE CULTURA MANTENEDORA DA PUC Minas E DO COLÉGIO SANTA MARIA ROTEIRO DE ESTUDO I ETAPA LETIVA CIÊNCIAS 4.º ANO/EF 2015 Caro (a) aluno(a), É tempo de conferir os conteúdos estudados na
Prova de Química Resolvida Segunda Etapa Vestibular UFMG 2011 Professor Rondinelle Gomes Pereira
 QUESTÃO 01 Neste quadro, apresentam-se as concentrações aproximadas dos íons mais abundantes em uma amostra de água típica dos oceanos e em uma amostra de água do Mar Morto: 1. Assinalando com um X a quadrícula
QUESTÃO 01 Neste quadro, apresentam-se as concentrações aproximadas dos íons mais abundantes em uma amostra de água típica dos oceanos e em uma amostra de água do Mar Morto: 1. Assinalando com um X a quadrícula
MODELOS ATÔMICOS. Química Professora: Raquel Malta 3ª série Ensino Médio
 MODELOS ATÔMICOS Química Professora: Raquel Malta 3ª série Ensino Médio PRIMEIRA IDEIA DO ÁTOMO 546 a.c. Tales de Mileto: propriedade da atração e repulsão de objetos após atrito; 500 a.c. Empédocles:
MODELOS ATÔMICOS Química Professora: Raquel Malta 3ª série Ensino Médio PRIMEIRA IDEIA DO ÁTOMO 546 a.c. Tales de Mileto: propriedade da atração e repulsão de objetos após atrito; 500 a.c. Empédocles:
-2014- CONTEÚDO SEPARADO POR TRIMESTRE E POR AVALIAÇÃO CIÊNCIAS 9º ANO 1º TRIMESTRE
 -2014- CONTEÚDO SEPARADO POR TRIMESTRE E POR AVALIAÇÃO CIÊNCIAS 9º ANO 1º TRIMESTRE DISCURSIVA OBJETIVA QUÍMICA FÍSICA QUÍMICA FÍSICA Matéria e energia Propriedades da matéria Mudanças de estado físico
-2014- CONTEÚDO SEPARADO POR TRIMESTRE E POR AVALIAÇÃO CIÊNCIAS 9º ANO 1º TRIMESTRE DISCURSIVA OBJETIVA QUÍMICA FÍSICA QUÍMICA FÍSICA Matéria e energia Propriedades da matéria Mudanças de estado físico
Abril Educação Água Aluno(a): Número: Ano: Professor(a): Data: Nota:
 Abril Educação Água Aluno(a): Número: Ano: Professor(a): Data: Nota: Questão 1 A água e o ar são indispensáveis para a sobrevivência dos seres vivos, mas o homem vem poluindo esses meios de forma muitas
Abril Educação Água Aluno(a): Número: Ano: Professor(a): Data: Nota: Questão 1 A água e o ar são indispensáveis para a sobrevivência dos seres vivos, mas o homem vem poluindo esses meios de forma muitas
Aula 2: O estudo da matéria
 KROTON S.A. UNIC EDUCACIONAL LTDA. ENGENHARIA DE PRODUÇÃO 2015/1 Aula 2: O estudo da matéria A Matéria Conceitos; Tudo que tem massa e ocupa lugar no espaço. - O que é massa? - Como se afere a massa de
KROTON S.A. UNIC EDUCACIONAL LTDA. ENGENHARIA DE PRODUÇÃO 2015/1 Aula 2: O estudo da matéria A Matéria Conceitos; Tudo que tem massa e ocupa lugar no espaço. - O que é massa? - Como se afere a massa de
01) (ACAFE) O grupo de átomos que é encontrado na forma monoatômica pelo fato de serem estáveis é:
 01) (ACAFE) O grupo de átomos que é encontrado na forma monoatômica pelo fato de serem estáveis é: a) Halogênios b) Calcogênios c) Metais Alcalinos Terrosos d) Metais Alcalinos e) Gases Nobres 02) (UFF-RJ)
01) (ACAFE) O grupo de átomos que é encontrado na forma monoatômica pelo fato de serem estáveis é: a) Halogênios b) Calcogênios c) Metais Alcalinos Terrosos d) Metais Alcalinos e) Gases Nobres 02) (UFF-RJ)
P R O V A DE FÍSICA II
 1 P R O V A DE FÍSICA II QUESTÃO 16 A figura mostra uma barra rígida articulada no ponto O. A barra é homogênea e seu peso P está em seu ponto médio. Sobre cada uma de suas extremidades são aplicadas forças
1 P R O V A DE FÍSICA II QUESTÃO 16 A figura mostra uma barra rígida articulada no ponto O. A barra é homogênea e seu peso P está em seu ponto médio. Sobre cada uma de suas extremidades são aplicadas forças
LIGAÇÕES QUÍMICAS TEORIA CORPUSCULAR
 LIGAÇÕES QUÍMICAS 5 TEORIA CORPUSCULAR 1 INTRODUÇÃO O fato de os gases nobres existirem na natureza como átomos isolados, levou os cientistas KOSSEL e LEWIS a elaborar um modelo para as ligações químicas.
LIGAÇÕES QUÍMICAS 5 TEORIA CORPUSCULAR 1 INTRODUÇÃO O fato de os gases nobres existirem na natureza como átomos isolados, levou os cientistas KOSSEL e LEWIS a elaborar um modelo para as ligações químicas.
ESTADOS DA MATÉRIA. O átomo é composto por outras partículas ainda menores.
 ESTADOS DA MATÉRIA A matéria que temos a nossa volta é formada de moléculas que são constituídas por átomos. Uma combinação destes átomos forma as substâncias que conhecemos, porém, devemos salientar que
ESTADOS DA MATÉRIA A matéria que temos a nossa volta é formada de moléculas que são constituídas por átomos. Uma combinação destes átomos forma as substâncias que conhecemos, porém, devemos salientar que
CALORIMETRIA, MUDANÇA DE FASE E TROCA DE CALOR Lista de Exercícios com Gabarito e Soluções Comentadas
 COLÉGIO PEDRO II PRÓ-REITORIA DE PÓS-GRADUAÇÃO, PESQUISA, EXTENSÃO E CULTURA PROGRAMA DE RESIDÊNCIA DOCENTE RESIDENTE DOCENTE: Marcia Cristina de Souza Meneguite Lopes MATRÍCULA: P4112515 INSCRIÇÃO: PRD.FIS.0006/15
COLÉGIO PEDRO II PRÓ-REITORIA DE PÓS-GRADUAÇÃO, PESQUISA, EXTENSÃO E CULTURA PROGRAMA DE RESIDÊNCIA DOCENTE RESIDENTE DOCENTE: Marcia Cristina de Souza Meneguite Lopes MATRÍCULA: P4112515 INSCRIÇÃO: PRD.FIS.0006/15
O interesse da Química é analisar as...
 O interesse da Química é analisar as... PROPRIEDADES CONSTITUINTES SUBSTÂNCIAS E MATERIAIS TRANSFORMAÇÕES ESTADOS FÍSICOS DOS MATERIAIS Os materiais podem se apresentar na natureza em 3 estados físicos
O interesse da Química é analisar as... PROPRIEDADES CONSTITUINTES SUBSTÂNCIAS E MATERIAIS TRANSFORMAÇÕES ESTADOS FÍSICOS DOS MATERIAIS Os materiais podem se apresentar na natureza em 3 estados físicos
Roteiro de Estudos 2 trimestre 2015 Disciplina: Química 9º ANOS
 Roteiro de Estudos 2 trimestre 2015 Disciplina: Química 9º ANOS Professor: Ricardo Augusto Marques da Costa O que devo saber: UNIDADE 2 Os estados físicos da matéria. Estados físicos da matéria e suas
Roteiro de Estudos 2 trimestre 2015 Disciplina: Química 9º ANOS Professor: Ricardo Augusto Marques da Costa O que devo saber: UNIDADE 2 Os estados físicos da matéria. Estados físicos da matéria e suas
Projeto Embuá Unidade de Aprendizagem: ENERGIA
 Projeto Embuá Unidade de Aprendizagem: ENERGIA Energia para realizar reações químicas: eletrólise do iodeto de potássio aquoso Existem reações químicas não espontâneas, mas que são realizadas com rapidez
Projeto Embuá Unidade de Aprendizagem: ENERGIA Energia para realizar reações químicas: eletrólise do iodeto de potássio aquoso Existem reações químicas não espontâneas, mas que são realizadas com rapidez
CADERNO DE EXERCÍCIOS 1D
 CADERNO DE EXERCÍCIOS 1D Ensino Fundamental Ciências da Natureza II Questão Conteúdo Habilidade da Matriz da EJA/FB 01 Propriedades e aplicação dos materiais H55/H56 02 Propriedades específicas, físicas
CADERNO DE EXERCÍCIOS 1D Ensino Fundamental Ciências da Natureza II Questão Conteúdo Habilidade da Matriz da EJA/FB 01 Propriedades e aplicação dos materiais H55/H56 02 Propriedades específicas, físicas
Thomson denominou este segundo modelo atômico de Pudim de Passas.
 EVOLUÇÃO DOS MODELOS ATÔMICOS Durante algum tempo a curiosidade do que era constituída a matéria parecia ser impossível de ser desvendada. Até que em 450 a.c. o filósofo grego Leucipo de Mileto afirmava
EVOLUÇÃO DOS MODELOS ATÔMICOS Durante algum tempo a curiosidade do que era constituída a matéria parecia ser impossível de ser desvendada. Até que em 450 a.c. o filósofo grego Leucipo de Mileto afirmava
Resoluções das Atividades
 Resoluções das Atividades Sumário Módulo 1 Teoria atômica básica e leis ponderais Evolução dos modelos atômicos Modelo atômico atual 1 Módulo 2 Números quânticos; Distribuição eletrônica Paramagnetismo,
Resoluções das Atividades Sumário Módulo 1 Teoria atômica básica e leis ponderais Evolução dos modelos atômicos Modelo atômico atual 1 Módulo 2 Números quânticos; Distribuição eletrônica Paramagnetismo,
Introdução à Química Inorgânica
 Introdução à Química Inorgânica Orientadora: Drª Karla Vieira Professor Monitor: Gabriel Silveira Química A Química é uma ciência que está diretamente ligada à nossa vida cotidiana. A produção do pão,
Introdução à Química Inorgânica Orientadora: Drª Karla Vieira Professor Monitor: Gabriel Silveira Química A Química é uma ciência que está diretamente ligada à nossa vida cotidiana. A produção do pão,
Próton Nêutron Elétron
 Próton Nêutron Elétron ARNOLD SOMMERFELD MODELO ATÔMICO DE ARNOLD SOMMERFELD - 1916 Ao pesquisar o átomo, Sommerfeld concluiu que os elétrons de um mesmo nível, ocupam órbitas de trajetórias diferentes
Próton Nêutron Elétron ARNOLD SOMMERFELD MODELO ATÔMICO DE ARNOLD SOMMERFELD - 1916 Ao pesquisar o átomo, Sommerfeld concluiu que os elétrons de um mesmo nível, ocupam órbitas de trajetórias diferentes
PROPRIEDADES DA MATÉRIA
 Profª Msc.Anna Carolina A. Ribeiro PROPRIEDADES DA MATÉRIA RELEMBRANDO Matéria é tudo que tem massa e ocupa lugar no espaço. Não existe vida nem manutenção da vida sem matéria. Corpo- Trata-se de uma porção
Profª Msc.Anna Carolina A. Ribeiro PROPRIEDADES DA MATÉRIA RELEMBRANDO Matéria é tudo que tem massa e ocupa lugar no espaço. Não existe vida nem manutenção da vida sem matéria. Corpo- Trata-se de uma porção
Mudanças de estado da água: fusão, solidificação, evaporação, ebulição, condensação...
 PROFESSOR: EQUIPE DE CIÊNCIAS BANCO DE QUESTÕES - CIÊNCIAS - 6º ANO - ENSINO FUNDAMENTAL ============================================================================================= Mudanças de estado
PROFESSOR: EQUIPE DE CIÊNCIAS BANCO DE QUESTÕES - CIÊNCIAS - 6º ANO - ENSINO FUNDAMENTAL ============================================================================================= Mudanças de estado
a) Qual a configuração eletrônica do cátion do alumínio isoeletrônico ao gás nobre neônio?
 Questão 1: O Brasil é o campeão mundial da reciclagem de alumínio, colaborando com a preservação do meio ambiente. Por outro lado, a obtenção industrial do alumínio sempre foi um processo caro, consumindo
Questão 1: O Brasil é o campeão mundial da reciclagem de alumínio, colaborando com a preservação do meio ambiente. Por outro lado, a obtenção industrial do alumínio sempre foi um processo caro, consumindo
Química Orgânica I Profª Dra. Alceni Augusta Werle Profª Dra.Tânia M. Sacramento Melo
 Química Orgânica I Profª Dra. Alceni Augusta Werle Profª Dra.Tânia M. Sacramento Melo Ligação Química e Estudo do Átomo de Carbono Aula 1 1- INTRODUÇÃO Os átomos são formados por nêutrons, prótons e elétrons.
Química Orgânica I Profª Dra. Alceni Augusta Werle Profª Dra.Tânia M. Sacramento Melo Ligação Química e Estudo do Átomo de Carbono Aula 1 1- INTRODUÇÃO Os átomos são formados por nêutrons, prótons e elétrons.
CAPACIDADE TÉRMICA E CALOR ESPECÍFICO 612EE T E O R I A 1 O QUE É TEMPERATURA?
 1 T E O R I A 1 O QUE É TEMPERATURA? A temperatura é a grandeza física que mede o estado de agitação das partículas de um corpo. Ela caracteriza, portanto, o estado térmico de um corpo.. Podemos medi la
1 T E O R I A 1 O QUE É TEMPERATURA? A temperatura é a grandeza física que mede o estado de agitação das partículas de um corpo. Ela caracteriza, portanto, o estado térmico de um corpo.. Podemos medi la
Esse grupo já foi conhecido como gases raros e gases inertes.
 GASES NOBRES GRUPO 18 OU VIIIA Esse grupo já foi conhecido como gases raros e gases inertes. Gases raros não é apropriado porque o argônio (Ar) não é raro (é mais abundante que o CO 2 no ar). Gases Inertes
GASES NOBRES GRUPO 18 OU VIIIA Esse grupo já foi conhecido como gases raros e gases inertes. Gases raros não é apropriado porque o argônio (Ar) não é raro (é mais abundante que o CO 2 no ar). Gases Inertes
Professor Ventura Ensina Tecnologia
 Professor Ventura Ensina Tecnologia Experimento PV001 Maquete com Instalação Elétrica Ensino Fundamental Direitos Reservados = Newton C. Braga 1 Maquete com Instalação Elétrica Você gostaria de aprender
Professor Ventura Ensina Tecnologia Experimento PV001 Maquete com Instalação Elétrica Ensino Fundamental Direitos Reservados = Newton C. Braga 1 Maquete com Instalação Elétrica Você gostaria de aprender
LISTA 1 NÍVEL 1. Material Extra
 LISTA 1 NÍVEL 1 01. (UEMA) Das três fases de uma substância, a que possui menor energia cinética é a fase, cuja característica é apresentar. Os termos que preenchem corretamente as lacunas são: a) Sólida
LISTA 1 NÍVEL 1 01. (UEMA) Das três fases de uma substância, a que possui menor energia cinética é a fase, cuja característica é apresentar. Os termos que preenchem corretamente as lacunas são: a) Sólida
Eletricidade Aula 1. Profª Heloise Assis Fazzolari
 Eletricidade Aula 1 Profª Heloise Assis Fazzolari História da Eletricidade Vídeo 2 A eletricidade estática foi descoberta em 600 A.C. com Tales de Mileto através de alguns materiais que eram atraídos entre
Eletricidade Aula 1 Profª Heloise Assis Fazzolari História da Eletricidade Vídeo 2 A eletricidade estática foi descoberta em 600 A.C. com Tales de Mileto através de alguns materiais que eram atraídos entre
Hoje estou elétrico!
 A U A UL LA Hoje estou elétrico! Ernesto, observado por Roberto, tinha acabado de construir um vetor com um pedaço de papel, um fio de meia, um canudo e um pedacinho de folha de alumínio. Enquanto testava
A U A UL LA Hoje estou elétrico! Ernesto, observado por Roberto, tinha acabado de construir um vetor com um pedaço de papel, um fio de meia, um canudo e um pedacinho de folha de alumínio. Enquanto testava
A Matéria Química Geral
 Química Geral A Matéria Tudo o que ocupa lugar no espaço e tem massa. A matéria nem sempre é visível Noções Preliminares Prof. Patrícia Andrade Mestre em Agricultura Tropical Massa, Inércia e Peso Massa:
Química Geral A Matéria Tudo o que ocupa lugar no espaço e tem massa. A matéria nem sempre é visível Noções Preliminares Prof. Patrícia Andrade Mestre em Agricultura Tropical Massa, Inércia e Peso Massa:
DISTRIBUIÇÃO ELETRÔNICA E N OS QUâNTICOS TEORIA - PARTE II. Elétron de diferenciação e elétrons de valência. Distribuição eletrônica de íons
 DISTRIBUIÇÃO ELETRÔNICA E N OS QUâNTICOS TEORIA - PARTE II Elétron de diferenciação e elétrons de valência O elétron de diferenciação é definido como o último elétron do subnível mais energético de um
DISTRIBUIÇÃO ELETRÔNICA E N OS QUâNTICOS TEORIA - PARTE II Elétron de diferenciação e elétrons de valência O elétron de diferenciação é definido como o último elétron do subnível mais energético de um
FÍSICA: CONCEITOS E EXERCÍCIOS DE FÍSICA TÉRMICA
 FÍSICA: CONCEITOS E EXERCÍCIOS DE FÍSICA TÉRMICA 1 SOBRE Apanhado de exercícios sobre física térmica selecionados por segrev. O objetivo é que com esses exercícios você esteja preparado para a prova, mas
FÍSICA: CONCEITOS E EXERCÍCIOS DE FÍSICA TÉRMICA 1 SOBRE Apanhado de exercícios sobre física térmica selecionados por segrev. O objetivo é que com esses exercícios você esteja preparado para a prova, mas
COLÉGIO SANTA TERESINHA R. Madre Beatriz 135 centro Tel. (33) 3341-1244 www.colegiosantateresinha.com.br
 PLANEJAMENTO DE AÇÕES DA 2 ª ETAPA 2015 PERÍODO DA ETAPA: 01/09/2015 á 04/12/2015 TURMA: 9º Ano EF II DISCIPLINA: CIÊNCIAS / QUÍMICA 1- S QUE SERÃO TRABALHADOS DURANTE A ETAPA : Interações elétricas e
PLANEJAMENTO DE AÇÕES DA 2 ª ETAPA 2015 PERÍODO DA ETAPA: 01/09/2015 á 04/12/2015 TURMA: 9º Ano EF II DISCIPLINA: CIÊNCIAS / QUÍMICA 1- S QUE SERÃO TRABALHADOS DURANTE A ETAPA : Interações elétricas e
Prof. Rogério Eletrônica Geral 1
 Prof. Rogério Eletrônica Geral 1 Apostila 2 Diodos 2 COMPONENTES SEMICONDUTORES 1-Diodos Um diodo semicondutor é uma estrutura P-N que, dentro de seus limites de tensão e de corrente, permite a passagem
Prof. Rogério Eletrônica Geral 1 Apostila 2 Diodos 2 COMPONENTES SEMICONDUTORES 1-Diodos Um diodo semicondutor é uma estrutura P-N que, dentro de seus limites de tensão e de corrente, permite a passagem
O Aquecimento Global se caracteriza pela modificação, intensificação do efeito estufa.
 O que é o Aquecimento Global? O Aquecimento Global se caracteriza pela modificação, intensificação do efeito estufa. O efeito estufa é um fenômeno natural e consiste na retenção de calor irradiado pela
O que é o Aquecimento Global? O Aquecimento Global se caracteriza pela modificação, intensificação do efeito estufa. O efeito estufa é um fenômeno natural e consiste na retenção de calor irradiado pela
Química A Intensivo V. 1
 1 Química A Intensivo V. 1 Exercícios 01) 10 01. Incorreta. O modelo atômico de Dalton não prevê a existência de elétrons. 02. Correta. Segundo Dalton, os átomos eram indestrutíveis e, durante uma reação
1 Química A Intensivo V. 1 Exercícios 01) 10 01. Incorreta. O modelo atômico de Dalton não prevê a existência de elétrons. 02. Correta. Segundo Dalton, os átomos eram indestrutíveis e, durante uma reação
 Termos Técnicos Ácidos Classe de substâncias que têm ph igual ou maior que 1 e menor que 7. Exemplo: sumo do limão. Átomos Todos os materiais são formados por pequenas partículas. Estas partículas chamam-se
Termos Técnicos Ácidos Classe de substâncias que têm ph igual ou maior que 1 e menor que 7. Exemplo: sumo do limão. Átomos Todos os materiais são formados por pequenas partículas. Estas partículas chamam-se
AULA PRÁTICA DE QUÍMICA GERAL Estudando a água parte 32
 AULA PRÁTICA DE QUÍMICA GERAL Estudando a água parte 32 9º NO DO ENSINO FUNDAMENTAL - 1º ANO DO ENSINO MÉDIO OBJETIVO Diversos experimentos, usando principalmente água e materiais de fácil obtenção, são
AULA PRÁTICA DE QUÍMICA GERAL Estudando a água parte 32 9º NO DO ENSINO FUNDAMENTAL - 1º ANO DO ENSINO MÉDIO OBJETIVO Diversos experimentos, usando principalmente água e materiais de fácil obtenção, são
ROTEIRO DE RECUPERAÇÃO DE CIÊNCIAS
 ROTEIRO DE RECUPERAÇÃO DE CIÊNCIAS Nome: Nº 6º Ano Data: / / 2015 Professor(a): Nota: (Valor 1,0) 3º Bimestre A Introdução: Neste bimestre, tivemos como tema principal a água. Estudamos os estados físicos
ROTEIRO DE RECUPERAÇÃO DE CIÊNCIAS Nome: Nº 6º Ano Data: / / 2015 Professor(a): Nota: (Valor 1,0) 3º Bimestre A Introdução: Neste bimestre, tivemos como tema principal a água. Estudamos os estados físicos
Capítulo 1: Eletricidade. Corrente continua: (CC ou, em inglês, DC - direct current), também chamada de
 Capítulo 1: Eletricidade É um fenômeno físico originado por cargas elétricas estáticas ou em movimento e por sua interação. Quando uma carga encontra-se em repouso, produz força sobre outras situadas em
Capítulo 1: Eletricidade É um fenômeno físico originado por cargas elétricas estáticas ou em movimento e por sua interação. Quando uma carga encontra-se em repouso, produz força sobre outras situadas em
COLÉGIO NOSSA SENHORA DE LOURDES 2ª SÉRIE Ensino Médio -2015. Roteiro de estudos para recuperação trimestral
 COLÉGIO NOSSA SENHORA DE LOURDES 2ª SÉRIE Ensino Médio -2015 Disciplina: Professor (a): QUÍMICA LUÍS FERNANDO Roteiro de estudos para recuperação trimestral Conteúdo: Referência para estudo: Sites recomendados:
COLÉGIO NOSSA SENHORA DE LOURDES 2ª SÉRIE Ensino Médio -2015 Disciplina: Professor (a): QUÍMICA LUÍS FERNANDO Roteiro de estudos para recuperação trimestral Conteúdo: Referência para estudo: Sites recomendados:
Evolução do Modelo Atómico
 Evolução do Modelo Atómico Desde a antiguidade que os homens se preocupavam em saber de que é que as «coisas» são feitas. No entanto, existiam perspectivas diversas sobre o assunto, a mais conhecida das
Evolução do Modelo Atómico Desde a antiguidade que os homens se preocupavam em saber de que é que as «coisas» são feitas. No entanto, existiam perspectivas diversas sobre o assunto, a mais conhecida das
Identificar os reagentes, produtos e processos básicos da fotossíntese e da respiração celular.
 1 D1 (B) Identificar os reagentes, produtos e processos básicos da fotossíntese e da respiração celular. D2 (b) Explicar a inter-relação entre fotossíntese e respiração celular nas células dos organismos
1 D1 (B) Identificar os reagentes, produtos e processos básicos da fotossíntese e da respiração celular. D2 (b) Explicar a inter-relação entre fotossíntese e respiração celular nas células dos organismos
UNIVERSIDADE ESTADUAL DO MATO GROSSO DO SUL UEMS CURSO DE FÍSICA LABORATÓRIO DE FÍSICA II. Gerador de Van De Graaff
 UNIVERSIDADE ESTADUAL DO MATO GROSSO DO SUL UEMS CURSO DE FÍSICA LABORATÓRIO DE FÍSICA II Gerador de Van De Graaff Objetivos gerais: Ao término desta atividade o aluno deverá ser capaz de: - identificar
UNIVERSIDADE ESTADUAL DO MATO GROSSO DO SUL UEMS CURSO DE FÍSICA LABORATÓRIO DE FÍSICA II Gerador de Van De Graaff Objetivos gerais: Ao término desta atividade o aluno deverá ser capaz de: - identificar
ATIVIDADES EM QUÍMICA Recuperação paralela de conteúdos
 Nova Friburgo, de de 2014. Aluno (a): Gabarito Professor(a): ATIVIDADES EM QUÍMICA Recuperação paralela de conteúdos Nº: Turma:100 Assuntos: Estrutura atômica; Tabela Periódica; Propriedades periódicas;
Nova Friburgo, de de 2014. Aluno (a): Gabarito Professor(a): ATIVIDADES EM QUÍMICA Recuperação paralela de conteúdos Nº: Turma:100 Assuntos: Estrutura atômica; Tabela Periódica; Propriedades periódicas;
41 Por que não bebemos água do mar?
 A U A UL LA Por que não bebemos água do mar? Férias no verão! Que maravilha! Ir à praia, tomar um solzinho, nadar e descansar um pouco do trabalho. Enquanto estamos na praia nos divertindo, não devemos
A U A UL LA Por que não bebemos água do mar? Férias no verão! Que maravilha! Ir à praia, tomar um solzinho, nadar e descansar um pouco do trabalho. Enquanto estamos na praia nos divertindo, não devemos
LEI DE OHM. Professor João Luiz Cesarino Ferreira. Conceitos fundamentais
 LEI DE OHM Conceitos fundamentais Ao adquirir energia cinética suficiente, um elétron se transforma em um elétron livre e se desloca até colidir com um átomo. Com a colisão, ele perde parte ou toda energia
LEI DE OHM Conceitos fundamentais Ao adquirir energia cinética suficiente, um elétron se transforma em um elétron livre e se desloca até colidir com um átomo. Com a colisão, ele perde parte ou toda energia
APSA 2 - Tabela Periódica 10º Ano Novembro de 2011
 1. Dada a distribuição eletrónica dos elementos a seguir, indique qual deles apresenta maior e menor raio atómico 3Li: 1s 2 2s 1 7N: 1s 2 2s 2 2p 3 9F: 1s 2 2s 2 2p 5 R: Maior raio Atómico = Li Menor raio
1. Dada a distribuição eletrónica dos elementos a seguir, indique qual deles apresenta maior e menor raio atómico 3Li: 1s 2 2s 1 7N: 1s 2 2s 2 2p 3 9F: 1s 2 2s 2 2p 5 R: Maior raio Atómico = Li Menor raio
Exercícios Sobre Atomística - Início dos modelos atômicos I
 Exercícios Sobre Atomística - Início dos modelos atômicos I 01. (Cftmg) O filme Homem de Ferro 2 retrata a jornada de Tony Stark para substituir o metal paládio, que faz parte do reator de seu peito, por
Exercícios Sobre Atomística - Início dos modelos atômicos I 01. (Cftmg) O filme Homem de Ferro 2 retrata a jornada de Tony Stark para substituir o metal paládio, que faz parte do reator de seu peito, por
INTRODUÇÃO REDUZIR OS IMPACTOS AMBIENTAIS. POR OUTRO
 INTRODUÇÃO OS METAIS SÃO ATUALMENTE ESSENCIAIS PARA O NOSSO COTIDIANO. OS QUE SÃO MAIS UTILIZADOS SÃO O ALUMÍNIO (EM LATAS), O COBRE (NOS CABOS DE TELEFONE), O CHUMBO (EM BATERIAS DE AUTOMÓVEIS), O NÍQUEL
INTRODUÇÃO OS METAIS SÃO ATUALMENTE ESSENCIAIS PARA O NOSSO COTIDIANO. OS QUE SÃO MAIS UTILIZADOS SÃO O ALUMÍNIO (EM LATAS), O COBRE (NOS CABOS DE TELEFONE), O CHUMBO (EM BATERIAS DE AUTOMÓVEIS), O NÍQUEL
DESENVOLVENDO HABILIDADES CIÊNCIAS DA NATUREZA I - EM
 Olá Caro Aluno, Você já reparou que, no dia a dia quantificamos, comparamos e analisamos quase tudo o que está a nossa volta? Vamos ampliar nossos conhecimentos sobre algumas dessas situações. O objetivo
Olá Caro Aluno, Você já reparou que, no dia a dia quantificamos, comparamos e analisamos quase tudo o que está a nossa volta? Vamos ampliar nossos conhecimentos sobre algumas dessas situações. O objetivo
Ernesto entra numa fria!
 A UU L AL A Ernesto entra numa fria! Segunda-feira, 6 horas da tarde, Cristiana e Roberto ainda não haviam chegado do trabalho. Mas Ernesto, filho do casal, já tinha voltado da escola. Chamou a gangue
A UU L AL A Ernesto entra numa fria! Segunda-feira, 6 horas da tarde, Cristiana e Roberto ainda não haviam chegado do trabalho. Mas Ernesto, filho do casal, já tinha voltado da escola. Chamou a gangue
grandeza do número de elétrons de condução que atravessam uma seção transversal do fio em segundos na forma, qual o valor de?
 Física 01. Um fio metálico e cilíndrico é percorrido por uma corrente elétrica constante de. Considere o módulo da carga do elétron igual a. Expressando a ordem de grandeza do número de elétrons de condução
Física 01. Um fio metálico e cilíndrico é percorrido por uma corrente elétrica constante de. Considere o módulo da carga do elétron igual a. Expressando a ordem de grandeza do número de elétrons de condução
Água e Solução Tampão
 União de Ensino Superior de Campina Grande Faculdade de Campina Grande FAC-CG Curso de Fisioterapia Água e Solução Tampão Prof. Dra. Narlize Silva Lira Cavalcante Fevereiro /2015 Água A água é a substância
União de Ensino Superior de Campina Grande Faculdade de Campina Grande FAC-CG Curso de Fisioterapia Água e Solução Tampão Prof. Dra. Narlize Silva Lira Cavalcante Fevereiro /2015 Água A água é a substância
Gabarito Química - Grupo A. 1 a QUESTÃO: (1,0 ponto) Avaliador Revisor
 VESTIB LAR Gabarito Química - Grupo A 1 a QUESTÃO: (1,0 ponto) Avaliador Revisor Muitos álcoois, como o butanol (C 4 H 10 O), têm importância comercial como solventes e matériasprimas na produção industrial
VESTIB LAR Gabarito Química - Grupo A 1 a QUESTÃO: (1,0 ponto) Avaliador Revisor Muitos álcoois, como o butanol (C 4 H 10 O), têm importância comercial como solventes e matériasprimas na produção industrial
Exercícios de Propriedades Coligativas e Coloides
 Exercícios de Propriedades Coligativas e Coloides 1. Considere o gráfico da pressão máxima de vapor em função da temperatura para um solvente puro e para uma solução desse solvente contendo um soluto molecular
Exercícios de Propriedades Coligativas e Coloides 1. Considere o gráfico da pressão máxima de vapor em função da temperatura para um solvente puro e para uma solução desse solvente contendo um soluto molecular
PLANO DE TRABALHO DOCENTE DOCENTE RESPONSÁVEL : MARIA LUIZA TONUSSI DE OLIVEIRA
 COLÉGIO ESTADUAL BARBOSA FERRAZ Ensino Médio, Normal e Profissional Rua Rio Grande do Sul, 1200 Centro - Telefone: (43) 3472-5009 www.colegiobarbosa.com.br e.mail: colbarbosa@ig.com.br CEP: 86870-000 -
COLÉGIO ESTADUAL BARBOSA FERRAZ Ensino Médio, Normal e Profissional Rua Rio Grande do Sul, 1200 Centro - Telefone: (43) 3472-5009 www.colegiobarbosa.com.br e.mail: colbarbosa@ig.com.br CEP: 86870-000 -
Corrente elétrica corrente elétrica.
 Corrente elétrica Vimos que os elétrons se deslocam com facilidade em corpos condutores. O deslocamento dessas cargas elétricas é chamado de corrente elétrica. A corrente elétrica é responsável pelo funcionamento
Corrente elétrica Vimos que os elétrons se deslocam com facilidade em corpos condutores. O deslocamento dessas cargas elétricas é chamado de corrente elétrica. A corrente elétrica é responsável pelo funcionamento
Nosso objetivo será mostrar como obter informações qualitativas sobre a refração da luz em um sistema óptico cilíndrico.
 Introdução Nosso objetivo será mostrar como obter informações qualitativas sobre a refração da luz em um sistema óptico cilíndrico. A confecção do experimento permitirá também a observação da dispersão
Introdução Nosso objetivo será mostrar como obter informações qualitativas sobre a refração da luz em um sistema óptico cilíndrico. A confecção do experimento permitirá também a observação da dispersão
DNA Darwin Não Atento?
 DNA Darwin Não Atento? PÁGINA 1 DE 6 CIÊNCIAS BIOLOGIA QUÍMICA Darwin foi um dos maiores cientistas de todos os tempos. Ele percebeu que variações ocorrem nas populações ou seja, diferenças são encontradas
DNA Darwin Não Atento? PÁGINA 1 DE 6 CIÊNCIAS BIOLOGIA QUÍMICA Darwin foi um dos maiores cientistas de todos os tempos. Ele percebeu que variações ocorrem nas populações ou seja, diferenças são encontradas
IX Olimpíada Catarinense de Química 2013. Etapa I - Colégios
 I Olimpíada Catarinense de Química - 2013 I Olimpíada Catarinense de Química 2013 Etapa I - Colégios Imagem: Oxidação Fonte:Gilson Rocha Reynaldo, 2013 Primeiro Ano Conselho Regional de Química CRQ III
I Olimpíada Catarinense de Química - 2013 I Olimpíada Catarinense de Química 2013 Etapa I - Colégios Imagem: Oxidação Fonte:Gilson Rocha Reynaldo, 2013 Primeiro Ano Conselho Regional de Química CRQ III
ATIVIDADE II COLÉGIO TIA IVONE - CTI. PROFESSOR: NEW CRISTIAN SÉRIE: 1ª SÉRIE DO ENSINO MÉDIO Aluno(a): 1. Conceitue:
 COLÉGIO TIA IVONE - CTI DISCIPLINA: QUÍMICA Data: / /2012 PROFESSOR: NEW CRISTIAN SÉRIE: 1ª SÉRIE DO ENSINO MÉDIO Aluno(a): ATIVIDADE II 1. Conceitue: a) Matéria b) Energia 2. Qual a relação entre matéria
COLÉGIO TIA IVONE - CTI DISCIPLINA: QUÍMICA Data: / /2012 PROFESSOR: NEW CRISTIAN SÉRIE: 1ª SÉRIE DO ENSINO MÉDIO Aluno(a): ATIVIDADE II 1. Conceitue: a) Matéria b) Energia 2. Qual a relação entre matéria
Ensino Fundamental II
 Ensino Fundamental II Valor da prova: 2.0 Nota: Data: / /2015 Professora: Angela Disciplina: Geografia Nome: n o : Ano: 6º 4º bimestre Trabalho de Recuperação de Geografia Orientações: - Leia atentamente
Ensino Fundamental II Valor da prova: 2.0 Nota: Data: / /2015 Professora: Angela Disciplina: Geografia Nome: n o : Ano: 6º 4º bimestre Trabalho de Recuperação de Geografia Orientações: - Leia atentamente
TIPOS DE termômetros. e termômetros ESPECIAIS. Pirômetros ópticos
 Pirômetros ópticos TIPOS DE termômetros e termômetros ESPECIAIS A ideia de construir um pirômetro óptico surgiu em meados do século XIX como consequência dos estudos da radiação dos sólidos aquecidos.
Pirômetros ópticos TIPOS DE termômetros e termômetros ESPECIAIS A ideia de construir um pirômetro óptico surgiu em meados do século XIX como consequência dos estudos da radiação dos sólidos aquecidos.
Informações Gerais Trocadores de Calor / Chiller de Placas
 Informações Gerais Trocadores de Calor / Chiller de Placas Somos especializados em trocadores de calor e importamos desde 2009. Eles são fabricados sob a supervisão de um técnico nosso e foram adaptados
Informações Gerais Trocadores de Calor / Chiller de Placas Somos especializados em trocadores de calor e importamos desde 2009. Eles são fabricados sob a supervisão de um técnico nosso e foram adaptados
Prova de Química e Biologia
 Provas Especialmente Adequadas Destinadas a Avaliar a Capacidade para a Frequência dos Cursos Superiores do IPVC dos Maiores de 23 Anos Prova de Química e Biologia Prova modelo Prova Específica de Química
Provas Especialmente Adequadas Destinadas a Avaliar a Capacidade para a Frequência dos Cursos Superiores do IPVC dos Maiores de 23 Anos Prova de Química e Biologia Prova modelo Prova Específica de Química
Lista de Exercícios de Recuperação do 3 Bimestre
 Lista de Exercícios de Recuperação do 3 Bimestre Instruções gerais: Resolver os exercícios à caneta e em folha de papel almaço ou monobloco (folha de fichário). Copiar os enunciados das questões. Entregar
Lista de Exercícios de Recuperação do 3 Bimestre Instruções gerais: Resolver os exercícios à caneta e em folha de papel almaço ou monobloco (folha de fichário). Copiar os enunciados das questões. Entregar
PORTAS E JANELAS: A LIGAÇÃO DA CASA COM O MUNDO
 PORTAS E JANELAS: A LIGAÇÃO DA CASA COM O MUNDO É dito no ditado popular que os olhos de uma pessoa são as janelas de sua alma, trazendo este pensamento para uma residência, podemos entender que as janelas
PORTAS E JANELAS: A LIGAÇÃO DA CASA COM O MUNDO É dito no ditado popular que os olhos de uma pessoa são as janelas de sua alma, trazendo este pensamento para uma residência, podemos entender que as janelas
Aluno (a): Nº. Disciplina: Química Goiânia, / / 2014
 Lista de Exercícios Aluno (a): Nº. Professora: Núbia de Andrade Série: 1º ano (Ensino médio) Turma: Disciplina: Química Goiânia, / / 2014 01) A mudança de fase denominada sublimação ocorre quando a) o
Lista de Exercícios Aluno (a): Nº. Professora: Núbia de Andrade Série: 1º ano (Ensino médio) Turma: Disciplina: Química Goiânia, / / 2014 01) A mudança de fase denominada sublimação ocorre quando a) o
Como os seres vivos modificam o ambiente?
 Como os seres vivos modificam o ambiente? O ar e a água possibilitam a integração dos seres vivos na dinâmica planetária. Por que a parede do copo com água fria fica molhada? Será? Toda matéria é constituída
Como os seres vivos modificam o ambiente? O ar e a água possibilitam a integração dos seres vivos na dinâmica planetária. Por que a parede do copo com água fria fica molhada? Será? Toda matéria é constituída
REVISÃO PARA AVALIAÇÃO 1º BIMESTRE CIÊNCIAS
 REVISÃO PARA AVALIAÇÃO 1º BIMESTRE CIÊNCIAS 1) A partir das informações dadas, enumere as informações, em ordem sequencial, de acordo com as etapas do método científico: ( ) Conclusões ( ) Possíveis respostas
REVISÃO PARA AVALIAÇÃO 1º BIMESTRE CIÊNCIAS 1) A partir das informações dadas, enumere as informações, em ordem sequencial, de acordo com as etapas do método científico: ( ) Conclusões ( ) Possíveis respostas
