LABORATÓRIO DE QUÍMICA UMA ABORDAGEM PARA O MEIO AMBIENTE
|
|
|
- Gabriel Henrique Viveiros Desconhecida
- 6 Há anos
- Visualizações:
Transcrição
1 LABORATÓRIO DE QUÍMICA UMA ABORDAGEM PARA O MEIO AMBIENTE OBJETIVOS Após o estudo deste capítulo, você deverá ser capaz de: Observar e cumprir as normas de segurança de laboratórios; Observar e zelar pelas boas práticas de laboratório; Identificar as principais vidrarias presentes em um laboratório; Aplicar corretamente as principais técnicas e rotinas básicas de um laboratório. INTRODUÇÃO Em um laboratório de química, muitas atividades podem ser realizadas. Dentre estas, as análises químicas, com certeza, é uma das principais. Quando as análises químicas são efetuadas para realizar o monitoramento ambiental, podemos chamá-las de análises ambientais O monitoramento ambiental de águas, solos, ar, sedimentos, efluentes industriais e domésticos é feito através do acompanhamento contínuo e sistemático de variáveis ambientais. Por exemplo, as análises de ph, turbidez, DBO (Demanda Bioquímica de Oxigênio), DQO (Demanda Química de Oxigênio), OD (Oxigênio Dissolvido), cor, odor entre outras, são análises que fornecem informações sobre a qualidade da água. Este capítulo pretende mostrar algumas das principais técnicas básicas de laboratório, de forma que você possa executar de forma correta e segura, as metodologias mais usuais de um laboratório de análises ambientais. De forma alguma pretendemos esgotar cada uma das técnicas neste espaço, nem tampouco abordar todas as técnicas possíveis de serem utilizadas num laboratório de análises ambientais. Iniciaremos com algumas orientações básicas sobre segurança em laboratório, mostrando que nosso corpo tem a capacidade de interagir com diversas substâncias químicas, de maneiras diferentes. Por esse motivo, ao trabalhar num laboratório, manuseando os mais variados produtos químicos, devemos ter cuidado e, acima de tudo, postura. Em um laboratório, manipulamos variadas substâncias químicas. Todas elas podem interagir, em maior ou menor grau, com nosso organismo, que é um organismo químico e que oferece várias possibilidades e formas de acesso e de absorção destes produtos.
2 Por este motivo, é fundamental termos prudência e conhecimento de como manusear cada produto, assim como utilizar proteção adequada para minimizar os efeitos danosos que tais produtos podem causar. Esse conhecimento deve ser dominado por quem trabalha em laboratório. No entanto, todas as empresas necessitam possuir uma equipe especializada em segurança no trabalho (técnicos e engenheiros de segurança no trabalho) a fim de realizar análise permanente das condições de trabalho. DICA: Os capítulos 12 e 13 deste livro possuem o aprofundamento necessário sobre esse tema. No capítulo 12, temos a abordagem da segurança no trabalho, prevenção e controle de riscos ambientais. No capítulo 13, uma importante abordagem sobre biossegurança. Por fim, gostaríamos de destacar que todos os assuntos abordados não se esgotam neste capítulo. Muito aprofundamento ainda é necessário, na medida em que um campo muito fértil se abre para o desenvolvimento de novas metodologias e técnicas com o desenvolvimento da metrologia química a ciência das medições em química analítica. PARA SABER MAIS: A metrologia química é a parte da metrologia que estuda a ciência das medições em química, especialmente em química analítica. Nos últimos 30 anos, a metrologia química tem criado raízes e hoje já possui um caule robusto, se constituindo numa ciência reconhecida. Tanto isto é verdade que atualmente já não é mais possível pensar em laboratórios de análises sem acreditação e ter acreditação significa seguir rigorosas normas que incluem cálculos de incertezas das medidas. Portanto, as questões de como efetuar medidas de volumes estão inseridas neste contexto. Nesse sentido, as leituras de volumes por interpolação já não podem mais ter uma abordagem como até pouco tempo atrás, quando se aceitava uma leitura de 23,46 ml em uma bureta com resolução de 0,1 ml. Ao efetuar essa leitura, o operador do instrumento está informando que é capaz de olhar para a menor divisão de escala da bureta, que normalmente tem em torno de 1 mm, dividir a olho nú em dez partes iguais e ler seis!!! Ora, isso não é razoável. E, por esse motivo, a recomendação metrológica de que a leitura da interpolação seja feita somente até a metade da menor divisão de escala, em qualquer circunstância. COMO GARANTIR A SEGURANÇA NO LABORATÓRIO? Boa postura: o segredo do negócio Podemos minimizar muitas situações de risco no trabalho em laboratório com boa postura e boas práticas de laboratório. Nesse sentido, Del Pino e Krüger (1997) fornecem importantes orientações de comportamento, apresentadas a seguir: É importante ter domínio dos procedimentos que serão realizados, a fim de sabermos exatamente os momentos de maior risco e o que fazer em caso de algum sinistro. A preparação prévia dos procedimentos, incluindo o conhecimento das características e grau de toxicidade dos produtos químicos manipulados é importante. NA INTERNET: Todas as informações de segurança de produtos químicos, além de outras propriedades importantes são encontradas no sítio MSDS (Material Safety Data Sheet) Acesse e faça a pesquisa do produto que for necessário.
3 Você deve considerar que todos os produtos químicos que são manipulados no laboratório são tóxicos, sem distinção. Você deve lembrar que é importante ter um procedimento padrão para manipulação e descarte destes produtos, independente do grau de toxicidade. Quando estiver manipulando mais de um produto químico, sempre observe as incompatibilidades dos mesmos. DICA: Todos os produtos químicos possuem um número que os identificam. É o chamado número CAS (Chemical Abstract Service), que pertence a um banco de dados único, sob responsabilidade da Chemical American Society, e pode ser considerado a identidade (RG) do produto químico. O número CAS é especialmente importante quando precisamos comprar um determinado produto, a fim de não haver erros na hora da compra. Faça uma pesquisa na internet e veja alguns exemplos. O uso dos EPI sempre que estiver dentro do laboratório é fundamental: guarda pó longo, totalmente abotoado; óculos de segurança; luvas, sempre que necessário; calçados fechados e calças compridas. Seja organizado em seu espaço de trabalho, pois a organização é meio caminho andado para um bom trabalho. Em caso de dúvidas, pergunte! Nunca tome iniciativas sem ter absoluta certeza do que está fazendo e, principalmente, sem ter certeza das consequências dos seus atos, pois um acidente também é causado por atos inseguros. Alguns cuidados específicos A seguir, apresentamos alguns cuidados importantes que devem ser observados no trabalho em laboratório. Quando estamos preparando uma solução de ácido, sempre adicionamos o Ácido na água, e nunca o contrário; Quando estamos utilizando fontes de aquecimento, nunca deixamos substâncias combustíveis ou inflamáveis por perto; Quando utilizamos certa quantidade de reagente (sólido ou líquido), jamais devolvemos as sobras aos frascos originais. O correto é evitar a sobra ou descartála no resíduo adequado; Quando estamos manipulando qualquer produto químico, jamais utilizamos a
4 espátula ou pipeta em outro produto, para evitar contaminações; Quando estamos manipulando vidraria utilizada em aquecimento, sempre fazê-lo com o auxílio de pinças, para evitar queimaduras; Quando estamos fazendo transferência de líquidos, sempre utilizamos provetas ou pipetas com pipetador (nunca pipetar com a boca); Quando estamos promovendo a transferência de sólidos, sempre utilizamos espátulas com formato adequado à quantidade. E quando ocorrer um acidente? A ação imediata é fundamental. No caso de fogo, pode-se promover a extinção de três formas: isolamento do combustível; resfriamento e abafamento. Mantenha sempre em lugar visível um frasco com areia e extintores de incêndio adequados (nunca usamos água para extinguir fogo em laboratório). No caso de exposição de produto à pele, lavar abundantemente com água corrente. Se o produto aderir à pele, nunca esfregue para retirá-lo. Leve a pessoa diretamente ao hospital. No caso de ferimentos nos olhos (devemos sempre usar óculos de segurança), lavá-los com água em abundância se o contato for com líquidos. Se cair algum objeto sólido (estilhaços de vidro ou metal) nunca tente retirar com pinças ou as próprias mãos (não esfregue os olhos). Busque assitência médica imediata. Se você se cortar no manuseio de vidrarias (cortes pequenos), deixe sair um pouco de sangue para evitar o ingresso de substâncias químicas no corpo e logo lave com água em abundância. Cortes pequenos podem ser cobertos posteriormente com uma bandagem apropriada. Se necessário, leve ao hospital. Existem vastas referências indicando como se comportar dentro de um laboratório para garantir a segurança. Aqui, indicamos apenas algumas. No entanto consideramos que as pessoas que trabalham em laboratório devem passar por treinamentos periódicos para garantir uma postura preventiva em primeiro lugar. E, caso haja algum sinistro, garantir também que se tenha o conhecimento para agir da forma correta. VIDRARIAS DE LABORATÓRIO: você conhece este universo de possibilidades? Existe uma gama de utensílios de vidro para as mais diversas aplicações em laboratório. A figura 1 mostra algumas das principais vidrarias e materiais de uso cotidiano
5 em laboratório. Apresentaremos uma breve exposição das principais utilidades de cada uma deles. Figura 1: Principais vidrarias e materiais de uso em laboratório. 1) Erlenmeyer: vidraria que possui escala de graduação sem nível de exatidão (os volumes indicados são aproximados). Seu principal uso é para realização de titulações em função de seu formato cônico, que facilita a agitação de líquidos sem perder material, mas também pode ser utilizado para aquecimentos. 2) Bequer: uma das vidrarias mais utilizadas em laboratório. Serve, dentre outras, para preparo de soluções, realização de reações e aquecimentos em geral sobre tela de amianto ou chapas de aquecimento. Possui escala graduada, mas esta escala não possui nível de exatidão. 3) Proveta: tubo cilíndrico graduado cujo principal objetivo é medir e transferir volumes de líquidos. Podem ser produzidas em vidro comum e vidro borossilicato e até em plástico. Possuem modelos com tampa e sem tampa. Para alguns casos específicos, são calibradas e possuem certo nível de exatidão. 4) Balão Volumétrico: são instrumentos confeccionados em vidro borossilicato, calibrados para conter volumes específicos de líquidos e seu único objetivo é o de preparo de soluções padrão, de concentração conhecida. Soluções comuns (cuja concentração é incerta) não são preparadas em balões volumétricos. 5) Frasco Kitassato: frasco de vidro resistente com saída lateral para sucção do ar. É utilizado nos processos de filtração a vácuo ou a pressão reduzida. 6) Funil de Büchner: funil de porcelana, com rolha adaptada, utilizado em conjunto com o frasco kitassato em processos de filtração a vácuo ou a pressão reduzida. 7) Pipeta Volumétrica: instrumento de vidro borossilicato que, assim como os balões volumétricos, são calibrados. São utilizados para medir e transferir volumes específicos de líquidos quando a medida requer alto nível de exatidão. 8) Pipeta Graduada: instrumento de vidro com escala graduada. Pode medir volumes variados de líquidos. Também é calibrado, mas possui nível de exatidão um pouco menor que as pipetas volumétricas. São muito utilizadas em medidas e transferências de líquidos. 9) Agarrador para Bureta: tipo Castaloy, serve para fixar a bureta na haste universal a fim de realizar a titulação.
6 10) Haste Universal: possui a importante finalidade de fixar as vidrarias e os aparatos de laboratório, tais como: titulação, filtração, sistemas de destilação, extrações, dentre outros. 11) Bureta: tubo cilíndrico com escala graduada de alto nível de exatidão para medidas de volumes de líquidos. Seu principal uso é nas titulações. Deve ser calibrado periodicamente, assim como pipetas volumétricas e balões volumétricos. 12) Funil de Separação: Utilizado na separação de misturas heterogêneas de líquidos não miscíveis e na extração líquido/líquido. 13) Triângulo de Porcelana: os triângulos de porcelana servem de suporte para aquecimento de cadinhos direto à chama do bico de Bunsen. 14) Tripé: o tripé metálico é um suporte para servir de base às telas de amianto ou aos triângulos de porcelana. É utilizado em processos de aquecimento de líquidos (usando tela de amianto) ou de sólidos (usando cadinhos acoplados em triângulos de porcelana). 15) Tela de Amianto: utilizado como suporte para as vidrarias contendo líquidos a serem aquecidos. A função do amianto é distribuir uniformemente o calor recebido pelo bico de Bunsen. 16) Funil de Vidro: é um aparato de vidro usado para filtrações simples, em processos de separação de misturas sólido/líquido. 17) Argola com mufa: as argolas são utilizadas para sustentar os funis de decantação, em processos de separação líquido-líquido ou extração. Também podem servir para sustentar telas de amianto, quando necessitamos aquecer líquidos com Bico de Bunsen, ou quando necessitamos sustentar um funil de vidro para filtração simples. A mufa é o sistema de fixação da argola, normalmente fixa nas hastes universais. 18) Bastão de Vidro: bastão de vidro maciço usado para agitação mecânica de líquidos e para auxílio na transferência de líquidos. 19) Estante para Tubos de Ensaio: as estantes servem para suporte de tubos de ensaio. Existem em diversos tamanhos, a depender das dimensões dos tubos usados. 20) Frasco lavador: frasco de polipropileno com bico curvo cuja principal finalidade é a lavagem de materiais ou recipientes através dos jatos de água expelidos pelo bico. Pode ser usado com água, álcool etílico ou outros solventes não agressivos.
7 21) Pipeta de Pasteur: é um tubo de vidro com ponta bastante fina e cuja principal finalidade é transferir volumes variados e pequenos de líquidos. Também serve com bastante propriedade para ajustes de menisco. 22) Frasco Pesa-filtro: frasco de vidro com tampa de vidro esmerilhado utilizado para processo de pesagem de reagentes por diferença, e também para secagem de reagentes em estufa e seu armazenamento em dessecador. 23) Almofariz e Pistilo: instrumento confeccionado em porcelana resistente, com função de trituração e pulverização de amostras e sólidos em geral. 24) Cadinho de Porcelana: peça confeccionada em porcelana cuja finalidade é o aquecimento de substâncias a seco e a altas temperaturas, em forno mufla ou bico de Bunsen. 25) Cápsula de Porcelana: seu principal uso é para evaporação de líquidos. Pode ser usado em bico de Bunsen sobre tela de amianto, estufa e banhos-maria. 26) Pipetador tipo Pipump: utilizado para auxiliar na sucção de líquidos em pipetas graduadas e volumétricas. 27) Pipetador de 3 Vias: utilizado para auxiliar na sucção de líquidos em pipetas graduadas e volumétricas. 28) Pinça Tenaz: constituída de material metálico e com formato específico para manipular objetos aquecidos. 29) Espátula Metálica: são utilizadas para transferência de sólidos, principalmente em pesagens por adição. Existem em diversos tamanhos e formatos, a depender do tipo de transferência e do produto a ser transferido. 30) Vidro de Relógio: confeccionado em vidro com formato redondo e côncavo, serve basicamente para análises e evaporações. 31) Agarrador de Madeira para Tubos de Ensaio: aparato utilizado para prender os tubos de ensaio durante o seu aquecimento. COMO MEDIR VOLUMES DE LÍQUIDOS? Um dos procedimentos mais cotidianos e importantes no trabalho de laboratório consiste na medida de volumes de líquidos. Inúmeras são as vidrarias disponíveis e a boa escolha dos instrumentos de medida de volume que podemos utilizar nesta tarefa é fundamental para o sucesso do trabalho. A depender da escolha da vidraria a ser usada, o domínio de uma técnica mais ou menos aprimorada é necessário para não colocar em risco os resultados de todo o
8 trabalho. Nesse sentido, o segredo da boa medida de volume de líquido é ter claro o nível de exatidão que a medida requer. Mas, afinal, o que essa afirmação quer dizer? De uma forma simplificada destaca que, para cada procedimento, é necessária utilizar a vidraria adequada e, para isso, é importante o conhecimento das características de cada vidraria, sua classe de exatidão, sua resolução, dentre outras. Por exemplo: se a tarefa é preparar uma solução comum (não padrão) como hidróxido de sódio de qualquer concentração, utiliza-se vidraria comum (de baixo nível de exatidão). Por outro lado, quando há necessidade de prepararmos uma solução padrão, é importante usar vidraria de alto nível de exatidão (balão volumétrico e pipeta volumétrica), além de balança analítica, quando necessário o procedimento de pesagem. Existe, então, algum controle das características e fabricação e vidrarias? Com a crescente necessidade de normatização dos procedimentos, a metrologia em especial a metrologia química tem crescido sobremaneira nos últimos 20 anos. E com esta necessidade, surgiu a normatização das vidrarias de laboratório, principalmente das vidrarias volumétricas. Quando se trata de vidraria volumétrica, podemos seguir as normas ISO (International Organization for Standardization) da ABNT (Associação Brasileira de Normas Técnicas), que são muito parecidas com as normas americanas da ASTM (American Society for Testing and Materials) e as normas alemãs da DIN (Deutsches Institut für Normung). PARA SABER MAIS: O conteúdo destas normas não está disponível, pois se tratam de normas de propriedade dos respectivos órgãos e são comercializadas. No entanto, você tem acesso aos catálogos com as listagens das normas disponíveis para compra. As normas ABNT e ISO podem ser consultadas no sítio As normas DIN você pode consultar em As normas americanas da ASTM você encontra em A norma ISO 4787:2010 é uma norma geral, que apresenta formas de uso, calibração, procedimento para testes, visualização de meniscos e manuseio para vidraria de volumes variáveis. Além desta norma, que é geral e possui informações complementares em relação às normas para os instrumentos individuais, existem também normas específicas para
9 cada vidraria, tais como: ISO 4788:2005, para provetas; ISO 648:2008, para pipetas volumétricas; ISO 835:2007, para pipetas graduadas; ISO 385:2005, para buretas, dentre outras. Quais as principais características das vidrarias de laboratório? As vidrarias de laboratório possuem a gravação dos traços de referência ou das escalas graduadas sempre a uma temperatura de referência de 20ºC. A marcação pode ser feita diretamente no vidro ou por gravação com ácido. Mas normalmente é feita por um processo de serigrafia chamado silk screen, utilizando tintas especiais com alta resistência a agentes químicos. Quando há escala graduada, a espessura das linhas deve ser em torno de 0,4 mm e de 0,6 mm para instrumentos com um único traço de referência, tipo, balão volumétrico. Existem dois tipos principais de vidrarias: as vidrarias a conter (TC = to contain, ou In ) e as vidrarias a verter (TD = to deliver, ou Ex ). As vidrarias TC são vidrarias que contém um certo volume de líquido e são calibrados para conter um volume específico à 20ºC quando cheios até o traço de referência, como por exemplo, os balões volumétricos. Por sua vez, as vidrarias TD são vidrarias que entregam ou liberam volumes fixos ou variáveis de líquidos e também são calibradas à 20ºC. São exemplos as pipetas graduadas. Estas são as principais características técnicas das vidrarias de laboratório, em especial as volumétricas. Mas de nada adianta ter uma vidraria de excelente qualidade e nível de exatidão se não dominarmos também a técnica de medida de volumes de cada uma. Dominando a Técnica de Medida de Volumes Líquidos A leitura de volumes líquidos em vidraria de laboratório consiste, via de regra, em obter medidas da quantidade de um líquido contido em um tubo de vidro (gargalo de um balão volumétrico, bureta, pipetas, provetas, dentre outros). Nestas condições, e devido à tensão superficial do líquido, ocorre a formação de um menisco pequena deformação da superfície do líquido na interface entre o ar e o líquido a ser medido (figura 2). A boa leitura do menisco depende de técnica a ser aprimorada e consiste em um procedimento delicado e é o ponto nevrálgico do processo de medida de volume. Basicamente, com a vidraria na altura dos olhos, deve-se buscar o ponto inferior do
10 menisco e imaginar uma reta tangente a esse ponto. Esta reta tangente deve coincidir com o traço de referência do instrumento de medida de volume. PENSANDO CRITICAMENTE: Para termos um exemplo de como a boa leitura de menisco é importante, Faria (2004) apresenta uma estimativa que impressiona: um erro de 0,1 mm na posição do menisco representa 20% da tolerância de um balão volumétrico de 20 ml e 16% da tolerância de uma bureta de 25 ml. Busque o artigo da referência citada e verifique a importância da boa leitura de menisco. O uso de um material escuro (papel preto) imediatamente abaixo do menisco, pela parte de trás do vidro, ajuda a visualizar o ponto mais baixo do mesmo. Da mesma forma, a utilização de vidraria com faixa azul, mais conhecida como franja de Schellbach (figura 2). Figura 2: Formação de menisco em buretas: (a) Formação de menisco em bureta comum, com volume de 17,05 ml; (b) Formação de menisco em bureta comum, utilizando contraste, com volume de 17,05 ml; (c) formação de menisco em bureta com franja de Schellbach, com volume de 17,20 ml. Por que a leitura do menisco deve ser feita na altura dos olhos? Essa condição para medir o menisco é necessária para evitar o erro de paralaxe. Esse erro consiste em uma distorção da posição do menisco a depender da localização dos olhos do operador: se os olhos estiverem numa posição mais acima em relação ao menisco, a tendência é de uma leitura de volume menor que a real; se os olhos estiverem em uma posição mais abaixo em relação ao menisco, a tendência é de uma leitura de volume maior que a real (figura 3). Figura 3: Exemplificando o erro de paralaxe: (a) Ajuste do menisco com o instrumento acima do nível dos olhos; (b) Ajuste correto do menisco; (c) Ajuste do menisco com o instrumento abaixo do nível dos olhos. PARA REFLETIR: Você saberia ler o volume contido num instrumento de escala graduada quando o menisco fica entre os dois traços da menor divisão de escala? Figura 4: Que volume é esse? A figura 4 mostra uma escala graduada de uma bureta na qual precisamos efetuar a leitura de menisco entre os traços da menor divisão de escala. Independentemente da resolução do instrumento, a leitura do menisco nesta faixa tem um limite razoável, que é o limite do olho humano aliado às recomendações metrológicas (ISOGUM, 1995).
11 A recomendação para a leitura por interpolação em escalas graduadas (analógicas) é a realização da leitura até a metade da menor divisão de escala. Portanto, no caso acima, a resolução real da bureta, obtida por interpolação, passa a ser de 0,05 ml, o que nos permite concluir que uma leitura de volume nesse instrumento específico somente poderá ter duas casas decimais, sendo que a última casa decimal só poderá ser zero ou cinco. Nesse sentido, o volume a ser lido na figura 4, por interpolação, é 10,10 ml. Como medir Volumes em Vidrarias com Baixo Nível de Exatidão? Bequer e erlenmeyer são vidrarias cujas escalas graduadas não possuem nível de exatidão, ou seja, suas medidas de volume são aproximadas e, portanto, não são utilizadas com a finalidade de medir volumes líquidos com um nível de exatidão aceitável. No entanto, existem instrumentos considerados volumétricos e utilizados para medidas de volume de líquidos, que possuem nível de exatidão menor, mas que servem para inúmeros procedimentos em laboratório: as provetas graduadas e as pipetas graduadas. Estes instrumentos são largamente utilizados para procedimentos que não necessitam de alto rigor analítico, como o preparo de soluções comuns, algumas transferências de volumes e algumas determinações de quantidades de constituintes de amostras. Nesses casos, a técnica que envolve a medida de volume em provetas e pipetas graduadas recai basicamente na leitura de menisco dos instrumentos, incluindo eventualmente o processo de interpolação até a metade da menor divisão de escala. Como Medir Volumes em Vidrarias com Alto Nível de Exatidão? As vidrarias com alto nível de exatidão são basicamente as pipetas volumétricas, os balões volumétricos e as buretas. São instrumentos confeccionados de vidro borossilicato (80% de SiO2 em peso), extremamente resistente a ataques químicos, suportando praticamente todas as temperaturas de trabalho de um laboratório. No entanto, a principal característica desse vidro, aliada às demais, é o seu baixo coeficiente de dilatação volumétrica. Essa particularidade faz com que esse vidro sofra menos deformações com o aumento ou diminuição de temperatura, tornando o volume nominal dos instrumentos menos variável em relação a este fator.
12 Obviamente, isso não é motivo para que instrumentos como balões e pipetas volumétricas, assim como buretas sejam expostos à temperaturas elevadas. Na verdade, estes instrumentos devem ser conservados e manuseados sempre em locais cujas temperaturas estão próximas à 20ºC, que é a temperatura de referência na qual eles foram calibrados. Da mesma forma, não devem entrar em contato com soluções aquecidas ou resfriadas. Estas devem ser levadas à temperatura próxima à 20ºC antes de entrarem em contato com os instrumentos volumétricos. Também não devem ser levados à estufa para secagem. Medindo Volumes em Balões Volumétricos Os balões são instrumentos volumétricos que contém (calibrados TC) volumes específicos de líquidos e são utilizados exclusivamente para o preparo de soluções padrão ou de referência. ASSISTA AO VÍDEO: O vídeo Medida de Volumes Balão Volumétrico postado por adrramos133 e disponível no link mostra a técnica de medidas de volumes em um balão volumétrico. Assista e observe os detalhes das boas práticas de laboratório. Medindo Volumes em Pipetas Volumétricas As pipetas volumétricas são instrumentos que possuem alto nível de exatidão, pois a leitura dos volumes é realizada numa região cujo diâmetro do tubo é o menor possível. Essa característica faz com que o erro de leitura seja menor e, consequentemente, o nível de exatidão seja maior. ASSISTA AO VÍDEO: O vídeo Medida de Volumes Líquidos Pipeta Volumétrica postado por adrramos133 e disponível no link mostra a técnica de medidas de volumes neste instrumento. Assista e reflita sobre as diferenças entre as técnicas da pipeta e do balão. Medindo Volumes em Buretas Buretas são instrumentos utilizados em titulação, que é o procedimento básico da análise volumétrica. Existem buretas de volumes nominais variados e a escolha do melhor instrumento vai depender do volume total estimado a ser gasto. Normalmente, faz-se um cálculo para um gasto de aproximadamente 2/3 do volume nominal da bureta em uma titulação a fim de diminuir o erro relativo. Nesse sentido, uma titulação usando uma bureta cujo volume nominal é de 50 ml, deveria gastar em torno de 30 à 35 ml, por exemplo.
13 ASSISTA AO VÍDEO: O vídeo Medida de Volume Uso de Bureta postado por adrramos133 e disponível no link mostra a técnica de manuseio da bureta em uma titulação. MEDIDAS DE MASSA: como obter a informação da quantidade do mundo físico? Depois das medidas de volume, as medidas de massa são os procedimentos mais comuns em um laboratório. As análises gravimétricas baseiam-se em medidas de massa. Além disso, muitos procedimentos simples, como preparar soluções com solutos sólidos envolvem o processo de pesagem. Existem inúmeros modelos de balanças para laboratório, com várias capacidades de carga, de diferentes resoluções e demais características. A Portaria INMETRO nº 236/1994 estabelece as condições que deverão ser observadas para a fabricação e utilização destes instrumentos. Todos os modelos de balanças, antes de ser lançados no mercado, devem ser aprovados pelo INMETRO (Instituto Nacional de Metrologia, Normalização e Qualidade Industrial). Você sabe identificar os diferentes Instrumentos de Medida de Massa? No laboratório, costumamos utilizar balanças analíticas e semi-analíticas (figura 5). As primeiras possuem quatro casas decimais (depois da vírgula) e capela de proteção para o prato de pesagem. Já as semi-analíticas possuem três e até duas casas decimais e não há a exigência da capela protetora. Figura 5: Sistema de Medição de Massa: Balança analítica (a); Princípio de medição de massa por compensação eletromagnética (b); Balança semi-analítica (c). PENSANDO CRITICAMENTE: As balanças de laboratório são constituídas pelo princípio da compensação eletromagnética (AFONSO e SILVA, 2004). O prato da balança é fixado sobre um cilindro metálico que está envolto por uma bobina. Quando ligamos a balança, uma corrente elétrica de aproximadamente 900 ma percorre a bobina, gerando um campo magnético capaz de sustentar o conjunto no ponto zero, indicado por um braço indicador (ligado ao próprio cilindro) que se comunica com um processador de sinais por uma fotocélula. Quando colocamos um corpo qualquer sobre o prato da balança, o conjunto desce, deslocando-se da posição de repouso e do ponto zero. Imediatamente, o braço indicador se desloca do lugar e indica ao processador que o cilindro e o prato da balança se deslocaram. O processador, então, emite um sinal a um gerador de corrente, proporcional à intensidade da luz que atinge a fotocélula. Desta forma, uma corrente excedente suficiente para compensar a diferença e manter o conjunto na posição nula é gerada e levada à bobina. A diferença da intensidade da corrente elétrica necessária é convertida em massa e mostrada no display (visor) da balança. (ver figura 5.b). Ao observarmos o princípio de medição da balança, podemos perceber quais fatores influenciam na medida. Um primeiro deles é a estabilidade da rede elétrica. Se
14 uma corrente de 900 ma mantém o prato da balança na posição nula (zero), é fácil imaginar que variações na rede (picos de tensão) podem ocasionar desvios nessa condição. Outro fator importante são as correntes de ar. As balanças, normalmente, ficam localizadas em salas de balanças com um mínimo de janelas possíveis (ANDRADE e CUSTÓDIO, 2000) para evitar a luz direta do sol e correntes de ar. A ausência de vibrações também é importante para dar estabilidade à medida, assim como condições ambientais adequadas, dentre elas o controle de temperatura e umidade. Conhecendo as Técnicas de Pesagem Existem, basicamente, duas técnicas distintas de pesagem: pesagem por adição e pesagem por diferença. No entanto, alguns procedimentos prévios são comuns a ambas as técnicas, quais sejam: Estabilizar o equipamento Observar a limpeza da balança Verificar se a mesma está nivelada. A explicação relativa ao uso de cada técnica, bem como as principais diferenças entre ambas e, principalmente quando utilizar uma ou outra encontram-se a seguir e, principalmente, nos vídeos indicados. Pesagem por Adição: um procedimento mais cotidiano A pesagem por adição é a forma direta de determinação de massa e consiste em uma técnica de pesagem mais simples. É utilizada com balanças semi-analíticas e exclusivamente no preparo de soluções comuns e em pesagens nas quais não são necessários muitos rigores de exatidão. Nesta técnica, o reagente ou material a ser pesado é adicionado diretamente ao recipiente de pesagem, que se encontra previamente em tara na balança. ASSISTA AO VÍDEO: O vídeo Técnicas de Pesagem Pesagem por Adição, postado por adrramos133 e disponível no link mostra detalhadamente esta técnica. Assista e observe. Pesagem por Diferença: um procedimento mais criterioso A pesagem por diferença é a forma indireta de determinação de massa. O processo é considerado mais exato que o de pesagem por adição, por ser menos suscetível a erros. Por este motivo, a pesagem por diferença é utilizada para procedimentos analíticos, tais como: preparo de soluções padrão ou de referência,
15 padronizações, pesagens de amostras para análises, dentre outros procedimentos que necessitem de rigor analítico e exatidão. ASSISTA AO VÍDEO: O vídeo Pesagem por Diferença PARTE 1 e Pesagem por Diferença PARTE 2, postado por adrramos133 e disponível nos links e respectivamente, mostra detalhadamente esta técnica. Assista, observe e compare ambas as técnicas e suas aplicabilidades. TÉCNICAS DE PREPARO DE SOLUÇÃO A maioria dos procedimentos executados no dia-a-dia em um laboratório envolve uso de soluções. Por isso, o conhecimento sobre o preparo destas é uma das técnicas mais fundamentais, importantes e cotidianas realizadas. O preparo correto de uma solução exige o domínio dos cálculos que envolvem concentração de soluções, das técnicas de medidas de volume e de pesagem. Para saber mais: Para você revisar, exercitar e aprofundar os cálculos que envolvem concentrações de soluções consulte o livro Princípios de Química (ATKINS e JONES, 2001). Uma solução pode ser definida como uma mistura homogênea entre duas ou mais substâncias, e o processo utilizado para obter essa mistura é chamado de dissolução. As soluções podem ser sólidas, líquidas e gasosas, que são formadas por combinações envolvendo os três estados da matéria. O solvente é o componente que está em maior quantidade e o soluto aquele que se encontra em menor quantidade, uma solução pode ter mais de um soluto. Iremos abordar as técnicas para preparar soluções líquidas, onde o soluto sólido ou líquido é dissolvido em um solvente. Além da classificação quanto ao estado físico, as soluções podem ser classificadas como solução comum e solução padrão. Estas soluções diferem quanto às características do soluto (padrão ou não), que vão ter como consequência a escolha da técnica a ser empregada no seu preparo. Solução comum Solução comum é uma solução que não apresenta a concentração exata do soluto. Estas soluções são usadas em procedimentos nos quais não seja necessário ter rigor sobre a concentração do soluto, ou seja, em procedimentos não quantitativos.
16 O soluto empregado não é considerado um reagente padrão. Por isso, o preparo não necessita de um rigor analítico. Neste caso, as massas de solutos sólidos podem ser medidas em balanças semi-analíticas (com resolução de 0,01 g ou 0,001 g) e os volumes de solução podem ser medidos em provetas. A figura 6 mostra os utensílios necessários para o preparo de solução padrão (figura 6.a) e comum (figura 6.b) a partir da dissolução de um sólido. Figura 6. Materiais empregados no preparo de solução (a) padrão: balança analítica, frasco pesa-filtro, bequer, balão volumétrico, frasco lavador, pipeta de Pasteur; (b) comum: balança semi-analítica, espátula, bequer, frasco lavador e proveta. Outra forma de preparo de solução comum é a partir da diluição de uma solução de mesmo soluto, porém mais concentrada. Neste caso, é possível utilizar pipetas graduadas e provetas para as medidas de volume. ASSISTA AO VÍDEO: Para aprender a técnica de preparo de solução comum assista ao vídeo Preparo de solução comum, postado por adrramos133 e disponível no sítio Uma das soluções comum mais preparadas na rotina de um laboratório são soluções ácidas a partir de diluição de ácido concentrado. PREPARO DE SOLUÇÃO ÁCIDA A PARTIR DE DILUIÇÃO DE ÁCIDO CONCENTRADO Cuidado!! Você deve ter muito cuidado no preparo dessas soluções, pois a dissolução de ácidos em água um processo exotérmico!!!! Para preparar essas soluções de forma correta e segura, você deve transferir lentamente, com o auxílio de uma proveta ou pipeta graduada, e aos poucos o volume do ácido concentrado calculado para uma proveta de volume adequado que já contenha OBRIGATORIAMENTE um pouco de água deionizada ou destilada. Caso a solução se aqueça muito, não tenha pressa. Espere um pouco a temperatura diminuir, para adicionar o volume restante. Em alguns casos a liberação de calor é tanta que há a necessidade da proveta estar em banho de resfriamento (água com gelo).
17 Solução padrão As soluções padrão são utilizadas nas determinações quantitativas, ou seja, em ensaios que têm por objetivo determinar, com bom nível de exatidão, quantidades de uma substância. Por este motivo, o preparo destas soluções deve ter alto rigor analítico. As massas de soluto são pesadas em balanças analíticas (com resolução mínima de 0,0001 g) e os volumes medidos em vidrarias volumétricas com classes de exatidão elevadas, como pipetas volumétricas e balões volumétricos. O preparo de solução padrão utiliza como soluto uma substância denominada padrão (material de referência ou material de referência certificado). Este tipo de soluto caracteriza-se por apresentar elevada pureza química, fórmula estequiométrica conhecida e estabilidade nas condições ambientais (ALVES e MORAES, 2003). A solução padrão também pode ser obtida a partir da diluição de uma solução padrão mais concentrada (solução estoque). Veja na figura 6.a, os materiais empregados no preparo de solução padrão quando é utilizado um soluto sólido. ASSISTA AO VÍDEO: Para aprender a técnica de preparo de solução padrão assista ao vídeo Preparo de solução padrão, postado por adrramos133 e disponível no sítio AGORA É A SUA VEZ! Após assistir os vídeos Preparo de solução comum e Preparo de solução padrão, faça uma tabela comparativa elencando as principais características de cada técnica. Destaque quais utensílios são empregados em seus preparos e avalie criticamente em qual momento utilizar a respectiva técnica. PARA SABER MAIS: Outra forma de se obter uma solução padrão é a partir do processo de padronização de solução comum. A padronização de uma solução é feita através da titulação desta solução com uma solução considerada padrão!!! Os assuntos de padronização de soluções e técnica de titulação podem consultados no livro Fundamentos de Química Analítica (SKOOG, 2009).... ÁCIDO OU BÁSICO? TÉCNICAS DE MEDIDAS DE ph A determinação do ph é uma das análises mais comuns no contexto das análises ambientais. O controle do ph é importante no monitoramento de uma estação de tratamento de água, na fiscalização do limite de emissão de efluentes industriais, no
18 tratamento de lodos de estação de tratamento de esgoto, na determinação de potabilidade de águas, na correção de solos, dentre outros. A determinação de ph pode ser feita em amostras coletadas, devidamente preservadas e posteriormente analisadas em um laboratório ou, dependendo de suas características, podem ser analisadas no momento da coleta, utilizando phmetro portátil. A determinação de ph de soluções aquosas pode ser feita utilizando dois métodos: Método colorimétrico e Método instrumental. O método colorimétrico apresenta valores aproximados de ph (baixa resolução) e o método instrumental fornece valores com maior resolução. Método colorimétrico para a determinação do ph: usando as cores para nos auxiliar O método colorimétrico emprega indicadores para determinar o ph de soluções aquosas. Indicadores de ph ou indicadores ácido-base são substâncias que possuem a capacidade de apresentar diferentes colorações em função do ph do meio em que se encontram. Podem ser substâncias artificiais ou naturais. Os indicadores ácido-base podem ser utilizados na forma de papel indicador ou na forma de solução. Os indicadores na forma de solução apresentam a grande limitação de serem usados somente em amostras incolores. Os papéis indicadores mais utilizados em um laboratório são o tornassol e o universal (Figura 7). Estes últimos possibilitam uma determinação de ph com menor margem de erro, podendo ser encontrados na forma de fitas de polietileno ou papel. Os indicadores universais de polietileno possuem numa das extremidades quatro faixas de escala de ph. A análise simultânea das variações de cor das quatro faixas com o confrontamento da escala de padrão de cores permite a determinação de ph da solução, na escala de zero até quatorze. Os indicadores universais de papel consistem numa tira de papel de uma única cor, que possuem indicadores de largo espectro. Dessa forma, quando em contato com uma solução, a coloração do papel será alterada e o ph determinado pelo confrontamento com uma escala padrão de cores que varia de ph = 0 até ph=14. O papel tornassol é usado somente para indicar o caráter da solução, ou seja, se é ácida ou básica. Já o papel universal pode ser usado para determinar, com a aproximação máxima de uma unidade, o ph de soluções aquosas, preferencialmente não coloridas, pois o papel indicador vem acompanhado de uma escala padrão de cores que permite converter a cor manifestada pelo indicador no respectivo valor de ph.
19 Figura 7. Papéis indicadores: (a) papel indicador universal; (b) tornassol vermelho e (c) tornassol azul. O papel tornassol pode ser azul ou vermelho. O papel tornassol azul é indicado para determinar se uma solução é ou não ácida pela mudança de cor do azul para o vermelho. Se uma gota de uma solução ácida é vertida sobre o papel azul, este irá mudar para a cor vermelho, conforme figura 8.a, que mostra os papéis universais que indicam ph 1. Já, o papel tornassol vermelho é empregado para determinar se uma solução é ou não básica pela mudança de cor do vermelho para o azul. Colocando-se uma gota de uma solução básica sobre o papel vermelho, este mudará a sua cor original (vermelho) para o azul, conforme figura 8.b, que mostra os papéis universais que indicam ph 13. Figura 8. Papéis indicadores universais, tornassol azul e vermelho e suas mudanças em: (a) meio ácido e (b) meio básico. AGORA É A SUA VEZ: Corantes naturais como indicadores de ph. Os indicadores ácido-base naturais podem ser extraídos de alguns legumes, flores, etc. Agora você tem condições de elaborar seu próprio indicador. Faça uma busca na internet e após selecionar alguns procedimentos, que tal colocar a mão na massa? Como utilizar papel indicador para determinação de ph? Para determinarmos o ph de uma amostra aquosa com papel indicador, basta colocar um pedaço do mesmo sobre um vidro de relógio e umedecê-lo com a solução, usando uma pipeta de Pasteur. Aguarda-se alguns segundos, observando e comparando a cor obtida no papel indicador com a escala padrão. Se o indicador for a fita de ph universal, introduz-se a mesma numa amostra da solução, aguarda-se de 1 a 3 segundos e faz-se a comparação com o padrão de cores presente na embalagem. PARA SABER MAIS: Como vimos acima, os indicadores comumente usados são as fitas de ph universal com escala de ph de zero a 14 e o papel tornassol. Entretanto, as fitas de ph universal possuem uma gama diversificada de faixas de ph, com resolução de até 0,1 unidade de ph. Pesquise na internet as diversas opções de papel de ph universal e fita de ph universal disponíveis para compra e veja qual é o mais adequado para as suas necessidades.
20 Método instrumental para a determinação do ph Os aparelhos utilizados para as medidas de ph são os potenciômetros ou os peagâmetros (phmetros) e as medidas efetuadas são realizadas de forma rápida e com boa resolução. A maioria dos phmetros utiliza o eletrodo de vidro (eletrodo de medição) e o eletrodo de referência (eletrodo de calomelano) combinados. O ph varia em função da temperatura, por esse motivo, para obter uma maior exatidão da medição do ph, a temperatura deve ser levada em consideração. Alguns potenciômetros possuem um acessório para compensação automática de temperatura da medida de ph (termopar). Em outros, devemos medir a temperatura da solução e ajustar no aparelho. Na figura 9, a seguir, temos exemplos de dois phmetros. Na 9.a, um phmetro sem compensação automática de temperatura e na 9.b um com compensação automática. Figura 9: phmetro sem compensação automática (9.a) e phmetro com compensação automática (9.b). Como utilizar o peagâmetro para determinação de ph? Antes de ser usado, o phmetro deve ser calibrado. A calibração é feita usando soluções padrão de ph (também conhecida como solução tampão). No texto abaixo, para explicar o processo de calibração, utilizamos soluções padrão de ph=7, ph=4 e ph=9, entretanto, as soluções padrão de ph estão disponíveis comercialmente em várias unidades de ph, tais como: ph=4,01; ph=6,86; ph=9,18; dentre outras. Essas soluções padrões de ph devem ser conservadas em refrigeração e no momento da calibração devem estar a temperatura ambiente. a) Calibração do phmetro: Independente do equipamento, a calibração geralmente compreende as seguintes etapas: 1. Liga-se o phmetro e espera-se por 30 minutos para estabilização; 2. Retira-se a capa plástica que protege o bulbo de vidro durante a estocagem. Dentro desta capa plástica há uma solução de descanso (KCl 3 mol L -1 ) na qual o eletrodo fica mergulhado (isso garante a hidratação da membrana); 3. Lava-se o eletrodo e o termopar com jatos de água deionizada ou destilada, com o auxílio de um frasco lavador;
21 4. Seca-se o eletrodo, absorvendo o excesso de água com um papel absorvente macio, para isso, simplesmente toca-se o eletrodo com o papel (não esfregar o papel no bulbo!!); 5. Introduz-se o eletrodo e o termopar na solução padrão ph=7, aguarda-se estabilização da medida. Caso o valor registrado pelo aparelho seja diferente do esperado para solução padrão, fazer o ajuste no botão de calibração até coincidir o valor; 6. Retira-se a solução padrão e repete-se os passos 3 e 4; 7. Seleciona-se uma segunda solução padrão cujo ph situe-se próximo do ph da amostra (faixa ácida ou básica). É comum o uso dos padrões de ph=4 ou ph=9, dependendo da faixa em que se situe o ph da amostra; 8. Introduz-se o eletrodo e o termopar na segunda solução padrão selecionada (ph=4 ou ph=9); 9. Aguarda-se estabilização da medida. Se o valor registrado for diferente do esperado, faz-se os ajustes no botão de ajuste do ph; 10, Retira-se a solução padrão e lava-se o eletrodo e o termopar novamente, tendo-se os devidos cuidados; 11. O phmetro está calibrado e pronto para ser usado quando não há mais necessidade de nenhum ajuste após a medida em ambos os padrões. Caso ele não seja usado imediatamente, mergulhar o eletrodo na solução de descanso. PARA SABER MAIS: Os phmetros possuem dois botões de calibração: um para ajustar o ph=7 ou 6,86 e o outro para o ph=4 ou ph=10. Cada fabricante possui um nome padrão para denominar cada botão. Normalmente o botão que ajusta o ph=7 é denominado de STANDARD e o botão que ajusta o outro ponto de ph é denominado de SLOPE, mas não há uma padronização quanto a nomenclatura. Recomendamos para o domínio completo do equipamento, a leitura do manual que acompanha o equipamento! b) Medida do ph da amostra: Agora que o phmetro já foi calibrado, ele está pronto para fazer as medidas de ph das amostras. Para isso devemos seguir os seguintes passos: 1. Agita-se levemente a amostra; 2. Introduz-se o eletrodo e o termopar na solução da amostra e aguarda-se a estabilização da medida, fazendo-se posteriormente a leitura do ph; 3. Retira-se a solução da amostra, lava-se o eletrodo e o termopar, conforme descrito anteriormente.
22 4. Após o uso, e sempre que o phmetro estiver ocioso, coloca-se o eletrodo imerso na solução de descanso para preservar a membrana. SEPARAÇÃO DE MISTURAS: quais as diferentes técnicas? Outra prática muito empregada em um laboratório é a separação de misturas, de forma a obter os componentes isolados. Existem vários métodos de separação específicos para cada tipo de mistura. Neste item abordaremos as principais técnicas de separação de misturas heterogêneas sólido-líquido e líquido-líquido. PARA SABER MAIS: Se você estiver interessado em relembrar alguns conceitos fundamentais sobre MISTURAS e as demais TÉCNICAS DE SEPARAÇÃO, consulte o livro Química na abordagem do cotidiano, volume 1 (TITO e CANTO, 2006). Técnicas de separação de misturas heterogêneas Veremos as técnicas mais comuns para a separação de misturas heterogêneas sólido-líquido e líquido-líquido. Sólido-líquido As misturas heterogêneas sólido-líquido podem ser separadas por decantação, centrifugação e filtração. A decantação não exige nenhuma vidraria especial, podendo ser feita em qualquer recipiente. É um método onde a fase sólida, a mais densa, deposita-se espontaneamente no fundo do recipiente. Esse processo de separação pode ser lento ou rápido. Uma maneira de acelerar a decantação é usar uma centrífuga. Uma das maneiras mais usadas para promover a separação de misturas sólidolíquido é a filtração. Filtração Nesta técnica a separação dos componentes é feita passando a mistura através de um meio filtrante que retêm a fase sólida da mistura. Existem dois tipos de filtração, a filtração simples e a filtração a pressão reduzida. Filtração simples
23 A filtração simples também chamada de filtração gravitacional é o tipo de filtração, onde a mistura a ser separada é adicionada ao papel de filtro (adaptado ao funil) e o líquido é filtrado por ação da gravidade. A fase sólida fica retida no papel de filtro e a fase líquida recolhida em outro recipiente. Uma filtração para ser bem sucedida, requer o preparo correto do papel-filtro. A filtração comum normalmente utiliza os seguintes equipamentos: haste metálica, argola, funil de vidro, papel filtro, bastão de vidro e recipiente para receber a fase líquida. A figura 10 mostra a montagem usual para a realização de uma filtração comum. Figura 10. Montagem para a filtração comum. Como na filtração simples, a separação das fases sólida-líquida ocorre devido à ação da gravidade, uma maneira de acelerar esse processo, é utilizar o papel de filtro pregueado (o papel de filtro com a dobradura sanfonado). ASSISTA AO VÍDEO: O vídeo Filtração Simples: a técnica e a dobradura de papel postado por adrramos133 e disponível no link mostra as técnicas de preparo de papel filtro para ser utilizado na filtração simples: dobra comum e dobra papel pregueado. Filtração a pressão reduzida Nesta filtração, a separação dos componentes é feita passando a mistura através de um meio filtrante que retêm a fase sólida da mistura, e o líquido é filtrado pela redução de pressão no recipiente. Esta filtração também é conhecida como, filtração a vácuo ou por sucção. A filtração à pressão reduzida utiliza, normalmente, os seguintes equipamentos: frasco de Kitasato; funil de Büchner com rolha; bomba de vácuo ou trompa d água; frasco de segurança; haste metálica, papel de filtro e mangueiras. A figura 12 ilustra a montagem usual de uma filtração a pressão reduzida. Figura 11. Aparelhagem para filtração a pressão reduzida. Assim como na filtração comum, na filtração à pressão reduzida, o papel filtro apresenta grande importância para uma perfeita separação das fases. Entretanto, na
MATERIAIS BÁSICOS DO LABORATÓRIO DE QUÍMICA. Tópicos de Química Experimental. Débora Alvim/ Willian Miguel
 MATERIAIS BÁSICOS DO LABORATÓRIO DE QUÍMICA Tópicos de Química Experimental Débora Alvim/ Willian Miguel BÉQUER OU BECHER É de uso geral em laboratório: Serve para fazer reações entre soluções Dissolver
MATERIAIS BÁSICOS DO LABORATÓRIO DE QUÍMICA Tópicos de Química Experimental Débora Alvim/ Willian Miguel BÉQUER OU BECHER É de uso geral em laboratório: Serve para fazer reações entre soluções Dissolver
Complemento das Aulas 13 e 14: Os principais equipamentos presentes em um laboratório
 MATERIAL EXTRA 2 BIMESTRE ENSINO MÉDIO Prof.: Cotrim 1ª Série Data: 18/04/2017 Complemento das Aulas 13 e 14: Os principais equipamentos presentes em um laboratório A execução de experimentos, em um laboratório
MATERIAL EXTRA 2 BIMESTRE ENSINO MÉDIO Prof.: Cotrim 1ª Série Data: 18/04/2017 Complemento das Aulas 13 e 14: Os principais equipamentos presentes em um laboratório A execução de experimentos, em um laboratório
Aula prática 1: Materiais de laboratório, exatidão e precisão. 1. Material de laboratório
 Aula prática 1: Materiais de laboratório, exatidão e precisão 1. Material de laboratório 1.1.Material de vidro o Tubo de ensaio utilizado para efetuar reações químicas em pequena escala. o Béquer recipiente
Aula prática 1: Materiais de laboratório, exatidão e precisão 1. Material de laboratório 1.1.Material de vidro o Tubo de ensaio utilizado para efetuar reações químicas em pequena escala. o Béquer recipiente
EQUIPAMENTO BÁSICO DE LABORATÓRIO
 1 EQUIPAMENTO BÁSICO DE LABORATÓRIO MATERIAL DE VIDRO: TUBO DE ENSAIO Utilizado principalmente para efetuar reações químicas em pequena escala. 2 BÉQUER ou BÉCKER Recipiente com ou sem graduação, utilizado
1 EQUIPAMENTO BÁSICO DE LABORATÓRIO MATERIAL DE VIDRO: TUBO DE ENSAIO Utilizado principalmente para efetuar reações químicas em pequena escala. 2 BÉQUER ou BÉCKER Recipiente com ou sem graduação, utilizado
Professor Daniel Rossi Janeiro de 2012
 Equipamentos de Laboratório Professor Daniel Rossi Janeiro de 2012 [Escolha a data] O LABORATORIO A palavra laboratório provém da união de duas palavras latinas: labor = trabalho + oratorium = lugar de
Equipamentos de Laboratório Professor Daniel Rossi Janeiro de 2012 [Escolha a data] O LABORATORIO A palavra laboratório provém da união de duas palavras latinas: labor = trabalho + oratorium = lugar de
Alguns materiais utilizados no Laboratório de Química
 Alguns materiais utilizados no Laboratório de Química 02 04 05 01 03 06 07 08 09 10 11 12 13 14 15 19 16 17 18 20 21 22 23 24 25 01. Suporte universal: utilizado para sustentar peças. 02. Tripé de ferro:
Alguns materiais utilizados no Laboratório de Química 02 04 05 01 03 06 07 08 09 10 11 12 13 14 15 19 16 17 18 20 21 22 23 24 25 01. Suporte universal: utilizado para sustentar peças. 02. Tripé de ferro:
ESTRUTURA DO MICROSCÓPIO ÓPTICO
 ESTRUTURA DO MICROSCÓPIO ÓPTICO Lembre-se que o microscópio utilizado em nosso laboratório possui uma entrada especial para uma câmera de vídeo. Parte Mecânica: Base ou Pé: Placa de apoio do microscópio
ESTRUTURA DO MICROSCÓPIO ÓPTICO Lembre-se que o microscópio utilizado em nosso laboratório possui uma entrada especial para uma câmera de vídeo. Parte Mecânica: Base ou Pé: Placa de apoio do microscópio
1º trimestre Sala de Estudo Química Data: 26/02/18 Ensino Médio 2º ano classe: A_B Profª Danusa Nome: nº. Conteúdo: Vidrarias de laboratório
 1º trimestre Sala de Estudo Química Data: 26/02/18 Ensino Médio 2º ano classe: A_B Profª Danusa Nome: nº Conteúdo: Vidrarias de laboratório Legenda: 1 Tubos de ensaio: Usado em reações químicas, principalmente
1º trimestre Sala de Estudo Química Data: 26/02/18 Ensino Médio 2º ano classe: A_B Profª Danusa Nome: nº Conteúdo: Vidrarias de laboratório Legenda: 1 Tubos de ensaio: Usado em reações químicas, principalmente
APARELHAGEM DE LABORATÓRIO 1. BICO DE BÜNSEN
 APARELHAGEM DE LABORATÓRIO 1. BICO DE BÜNSEN Aparelho ligado ao gás, utilizado para aquecimento de materiais não inflamáveis. Possui em sua base um regulador de entrada de ar para controlar o tipo de chama:
APARELHAGEM DE LABORATÓRIO 1. BICO DE BÜNSEN Aparelho ligado ao gás, utilizado para aquecimento de materiais não inflamáveis. Possui em sua base um regulador de entrada de ar para controlar o tipo de chama:
IQ-UFG. Curso Experimental de Química Geral e Inorgânica. Prof. Dr. Anselmo
 IQ-UFG Curso Experimental de Química Geral e Inorgânica Aula 02 Reconhecimento de Vidrarias e Introdução às Técnicas de Laboratório Prof. Dr. Anselmo Vidrarias e equipamentos usuais em laboratórios de
IQ-UFG Curso Experimental de Química Geral e Inorgânica Aula 02 Reconhecimento de Vidrarias e Introdução às Técnicas de Laboratório Prof. Dr. Anselmo Vidrarias e equipamentos usuais em laboratórios de
BIOSSEGURANÇA EM LABORATÓRIO
 BIOSSEGURANÇA EM LABORATÓRIO Laboratório Ambiente de risco/ Propenso a Acidentes A prevenção ou redução do risco Práticas seguras para a saúde e meio ambiente As práticas seguras no laboratório são um
BIOSSEGURANÇA EM LABORATÓRIO Laboratório Ambiente de risco/ Propenso a Acidentes A prevenção ou redução do risco Práticas seguras para a saúde e meio ambiente As práticas seguras no laboratório são um
02/05/2016. Normas de laboratório INTRODUÇÃO INSTITUTO FEDERAL DE EDUCAÇÃO, CIÊNCIA E TECNOLOGIA RIO GRANDE DO NORTE SEGURANÇA NO LABORATÓRIO:
 INSTITUTO FEDERAL DE EDUCAÇÃO, CIÊNCIA E TECNOLOGIA RIO GRANDE DO NORTE Disciplina: Análise de Alimentos Normas de laboratório INTRODUÇÃO Acidente de trabalho é todo evento: inesperado e indesejável que
INSTITUTO FEDERAL DE EDUCAÇÃO, CIÊNCIA E TECNOLOGIA RIO GRANDE DO NORTE Disciplina: Análise de Alimentos Normas de laboratório INTRODUÇÃO Acidente de trabalho é todo evento: inesperado e indesejável que
NORMAS DE SEGURANÇA NO LABORATÓRIO
 NORMAS DE SEGURANÇA NO LABORATÓRIO Usar guarda-pó abotoado; Usar preferencialmente calças compridas; Sapatos fechados; Cabelos presos; Não pipetar produto algum com a boca; Não usar produto que não esteja
NORMAS DE SEGURANÇA NO LABORATÓRIO Usar guarda-pó abotoado; Usar preferencialmente calças compridas; Sapatos fechados; Cabelos presos; Não pipetar produto algum com a boca; Não usar produto que não esteja
Unidade V - Determinação de umidade e sólidos totais
 Unidade V - Determinação de umidade e sólidos totais O método empregado depende do objetivo. O que estou necessitando? Rapidez? Precisão? Exatidão? Medir em tempo real? Umidade: métodos Quantitativos Métodos
Unidade V - Determinação de umidade e sólidos totais O método empregado depende do objetivo. O que estou necessitando? Rapidez? Precisão? Exatidão? Medir em tempo real? Umidade: métodos Quantitativos Métodos
RECONHECIMENTO E MANUSEIO DE VIDRARIAS E OUTROS MATERIAIS DE LABORATÓRIO
 RECONHECIMENTO E MANUSEIO DE VIDRARIAS E OUTROS MATERIAIS DE LABORATÓRIO PIPETAS DE VIDRO Aparelhos volumétricos destinados a medir e transferir determinados volumes de líquidos. São tubos abertos nas
RECONHECIMENTO E MANUSEIO DE VIDRARIAS E OUTROS MATERIAIS DE LABORATÓRIO PIPETAS DE VIDRO Aparelhos volumétricos destinados a medir e transferir determinados volumes de líquidos. São tubos abertos nas
Disciplina: Química Experimental Semestre/Ano: 01/2012 INTRODUÇÃO ÀS TÉCNICAS DE LABORATÓRIO
 1 UNIVERSIDADE DO ESTADO DE SANTA CATARINA - UDESC CENTRO DE CIÊNCIAS TECNOLÓGICAS - CCT DEPARTAMENTO DE QUÍMICA - DQMC Disciplina: Química Experimental Semestre/Ano: 01/2012 Curso: Engenharia Elétrica
1 UNIVERSIDADE DO ESTADO DE SANTA CATARINA - UDESC CENTRO DE CIÊNCIAS TECNOLÓGICAS - CCT DEPARTAMENTO DE QUÍMICA - DQMC Disciplina: Química Experimental Semestre/Ano: 01/2012 Curso: Engenharia Elétrica
Introdução ás técnicas experimentais de Química Laboratório Normas e Segurança
 Introdução ás técnicas experimentais de Química Laboratório Normas e Segurança A segurança no laboratório é uma responsabilidade que deve ser assumida por professores, monitores e alunos. No recinto não
Introdução ás técnicas experimentais de Química Laboratório Normas e Segurança A segurança no laboratório é uma responsabilidade que deve ser assumida por professores, monitores e alunos. No recinto não
Segurança no Laboratório e Vidrarias Disciplina: Química Aplicada à Engenharia Objetivo: Informar ao aluno a respeito dos riscos e cuidados que devem
 Segurança no Laboratório e Vidrarias Disciplina: Química Aplicada à Engenharia Objetivo: Informar ao aluno a respeito dos riscos e cuidados que devem ser tomados em um laboratório de Química e mostrar
Segurança no Laboratório e Vidrarias Disciplina: Química Aplicada à Engenharia Objetivo: Informar ao aluno a respeito dos riscos e cuidados que devem ser tomados em um laboratório de Química e mostrar
Moacir Cardoso Elias
 Moacir Cardoso Elias eliasmc@ufpel.tche.br Universidade Federal de Pelotas Faculdade de Agronomia Eliseu Maciel Curso de Graduação em Agronomia Disciplina Química I VIDRARIAS E EQUIPAMENTOS DE LABORATÓRIO
Moacir Cardoso Elias eliasmc@ufpel.tche.br Universidade Federal de Pelotas Faculdade de Agronomia Eliseu Maciel Curso de Graduação em Agronomia Disciplina Química I VIDRARIAS E EQUIPAMENTOS DE LABORATÓRIO
Técnicas de Trabalho com Material Volumétrico
 Universidade Federal de Goiás Instituto de Química Curso Experimental de Transformações Químicas 2010 Prof. Dr. Anselmo (adaptado, Agustina) Técnicas de Trabalho com Material Volumétrico 1 Objetivo Nesta
Universidade Federal de Goiás Instituto de Química Curso Experimental de Transformações Químicas 2010 Prof. Dr. Anselmo (adaptado, Agustina) Técnicas de Trabalho com Material Volumétrico 1 Objetivo Nesta
QUÍMICA GERAL EXPERIMENTAL CURSO Engenharia de Produção e Engenharia Ambiental PERÍODO: BIMESTRE Primeiro PROFESSOR Priscila de Freitas Siqueira
 DISCIPLINA QUÍMICA GERAL EXPERIMENTAL CURSO Engenharia de Produção e Engenharia Ambiental PERÍODO: BIMESTRE Primeiro PROFESSOR Priscila de Freitas Siqueira DATA 1 Instruções gerais para as aulas práticas
DISCIPLINA QUÍMICA GERAL EXPERIMENTAL CURSO Engenharia de Produção e Engenharia Ambiental PERÍODO: BIMESTRE Primeiro PROFESSOR Priscila de Freitas Siqueira DATA 1 Instruções gerais para as aulas práticas
Aprender a preparar soluções aquosas, realizar diluições e determinar suas concentrações.
 EXPERIMENTO 2 Preparação e Padronização de Soluções OBJETIVOS Rever os conceitos de concentração de soluções. Aprender a preparar soluções aquosas, realizar diluições e determinar suas concentrações. Exercitar
EXPERIMENTO 2 Preparação e Padronização de Soluções OBJETIVOS Rever os conceitos de concentração de soluções. Aprender a preparar soluções aquosas, realizar diluições e determinar suas concentrações. Exercitar
SUBSTÂNCIAS E MISTURAS
 Universidade de São Paulo Instituto de Química de São Carlos Departamento de Físico-Química SUBSTÂNCIAS E MISTURAS Prof. Dr. Edson Antonio Ticianelli edsont@iqsc.usp.br Monitor: Dr. Wanderson Oliveira
Universidade de São Paulo Instituto de Química de São Carlos Departamento de Físico-Química SUBSTÂNCIAS E MISTURAS Prof. Dr. Edson Antonio Ticianelli edsont@iqsc.usp.br Monitor: Dr. Wanderson Oliveira
VIDRARIAS. Tubos de ensaio devem ser aquecidos de forma que a extremidade aberta não esteja virada para uma pessoa.
 AULA 2 Vidrarias, equipamentos e técnicas básicas OBJETIVOS Identificar as principais vidrarias e equipamentos usados no laboratório de química; Apresentar técnicas básicas usadas no laboratório de química;
AULA 2 Vidrarias, equipamentos e técnicas básicas OBJETIVOS Identificar as principais vidrarias e equipamentos usados no laboratório de química; Apresentar técnicas básicas usadas no laboratório de química;
Aula Prática Assunto Normas de utilização, segurança no Laboratório e materiais utilizados.
 Aula Prática 01 1. Assunto Normas de utilização, segurança no Laboratório e materiais utilizados. 2. Objetivos Nesta aula o aluno deverá conhecer os perigos e cuidados existentes no laboratório, bem como
Aula Prática 01 1. Assunto Normas de utilização, segurança no Laboratório e materiais utilizados. 2. Objetivos Nesta aula o aluno deverá conhecer os perigos e cuidados existentes no laboratório, bem como
VIDRARIAS DE LABORATÓRIO Parte I. Maira Gazzi Manfro e Giseli Menegat
 VIDRARIAS DE LABORATÓRIO Parte I Maira Gazzi Manfro e Giseli Menegat maira.manfro@caxias.ifrs.edu.br giseli.menegat@caxias.ifrs.edu.br Tubo de Ensaio Reações químicas Teste de reação Figura 1. Tubo de
VIDRARIAS DE LABORATÓRIO Parte I Maira Gazzi Manfro e Giseli Menegat maira.manfro@caxias.ifrs.edu.br giseli.menegat@caxias.ifrs.edu.br Tubo de Ensaio Reações químicas Teste de reação Figura 1. Tubo de
CATÁLOGO DE MATERIAL LABORATORIAL
 UNIVERSIDADE FEDERAL DE OURO PRETO PRÓ-REITORIA DE PLANEJAMENTO E DESENVOLVIMENTO DIRETORIA DE ORÇAMENTOS E FINANÇAS COORDENADORIA DE SUPRIMENTOS CATÁLOGO DE MATERIAL LABORATORIAL OURO PRETO MARÇO / 2016
UNIVERSIDADE FEDERAL DE OURO PRETO PRÓ-REITORIA DE PLANEJAMENTO E DESENVOLVIMENTO DIRETORIA DE ORÇAMENTOS E FINANÇAS COORDENADORIA DE SUPRIMENTOS CATÁLOGO DE MATERIAL LABORATORIAL OURO PRETO MARÇO / 2016
VIDRARIAS. Tubos de ensaio devem ser aquecidos de forma que a extremidade aberta não esteja virada para uma pessoa.
 AULA 2 Vidrarias, equipamentos e técnicas básicas OBJETIVOS Identificar as principais vidrarias e equipamentos usados no laboratório de química; Apresentar técnicas básicas usadas no laboratório de química;
AULA 2 Vidrarias, equipamentos e técnicas básicas OBJETIVOS Identificar as principais vidrarias e equipamentos usados no laboratório de química; Apresentar técnicas básicas usadas no laboratório de química;
RESPOSTAS AOS RECURSOS AO CARGO DE TÉCNICO DE LABORATÓRIO Área: QUÍMICA D
 RESPOSTAS AOS RECURSOS AO CARGO DE TÉCNICO DE LABORATÓRIO Área: QUÍMICA D QUESTÃO 27 O técnico do laboratório pesou uma pequena barra de alumínio em uma balança cuja incerteza é ± 0,1 g e o valor obtido
RESPOSTAS AOS RECURSOS AO CARGO DE TÉCNICO DE LABORATÓRIO Área: QUÍMICA D QUESTÃO 27 O técnico do laboratório pesou uma pequena barra de alumínio em uma balança cuja incerteza é ± 0,1 g e o valor obtido
1. PREPARO DE SOLUÇÕES E TITULAÇÃO
 1. PREPARO DE SOLUÇÕES E TITULAÇÃO I. INTRODUÇÃO Solução é uma mistura homogênea de uma ou mais substâncias. A substância presente em maior quantidade é denominada solvente, e as outras substâncias na
1. PREPARO DE SOLUÇÕES E TITULAÇÃO I. INTRODUÇÃO Solução é uma mistura homogênea de uma ou mais substâncias. A substância presente em maior quantidade é denominada solvente, e as outras substâncias na
TÉCNICAS LABORATORIAIS BÁSICAS
 TÉCNICAS LABORATORIAIS BÁSICAS Seu comportamento no laboratório é um fator determinante na sua segurança e no desenvolvimento eficiente de seus experimentos. Para desenvolver suas atividades laboratoriais
TÉCNICAS LABORATORIAIS BÁSICAS Seu comportamento no laboratório é um fator determinante na sua segurança e no desenvolvimento eficiente de seus experimentos. Para desenvolver suas atividades laboratoriais
Cargo: D-43 - Tecnólogo Laboratório Meio ambiente
 da Prova Prática QUESTÃO 1: Cargo: D-43 - Tecnólogo Laboratório Meio ambiente A titulometria volumétrica envolve a medida de volume de uma solução de concentração conhecida, necessária para reagir essencial
da Prova Prática QUESTÃO 1: Cargo: D-43 - Tecnólogo Laboratório Meio ambiente A titulometria volumétrica envolve a medida de volume de uma solução de concentração conhecida, necessária para reagir essencial
MAL CLORO LÍQUIDO - DETERMINAÇÃO DE RESÍDUO NÃO VOLÁTIL - GRAVIMETRIA
 1. INTRODUÇÃO: A amostra de Cloro líquido (do cilindro de amostragem) que é transferida para erlenmeyers, é evaporada e o resíduo não volátil permanece no frasco. A determinação fornece o resíduo não volátil
1. INTRODUÇÃO: A amostra de Cloro líquido (do cilindro de amostragem) que é transferida para erlenmeyers, é evaporada e o resíduo não volátil permanece no frasco. A determinação fornece o resíduo não volátil
Vidraria. versão
 Vidraria Os vidros da Ionglass alinham durabilidade e estabilidade. Alta transparência e resistência superior a produtos químicos, contaminantes, mudanças drásticas de temperatura e intenso uso. Vidros
Vidraria Os vidros da Ionglass alinham durabilidade e estabilidade. Alta transparência e resistência superior a produtos químicos, contaminantes, mudanças drásticas de temperatura e intenso uso. Vidros
EXTRAÇÃO DO ÓLEO DE LARANJA A PARTIR DAS CASCAS DE LARANJA DESTILAÇÃO POR ARRASTAMENTO DE VAPOR
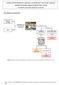 EXTRAÇÃO DO ÓLEO DE LARANJA A PARTIR DAS CASCAS DE LARANJA DESTILAÇÃO POR ARRASTAMENTO DE VAPOR Procedimento experimental adaptado de J. H. Beatty 1 Procedimento experimental Figura 1. Esquema resumo do
EXTRAÇÃO DO ÓLEO DE LARANJA A PARTIR DAS CASCAS DE LARANJA DESTILAÇÃO POR ARRASTAMENTO DE VAPOR Procedimento experimental adaptado de J. H. Beatty 1 Procedimento experimental Figura 1. Esquema resumo do
11. O uso de pérolas ou pedaços de vidro ou ainda de cerâmica porosa no aquecimento de soluções tem por objetivo:
 ASSISTENTE DE LABORATÓRIO 4 CONHECIMENTOS ESPECÍFICOS QUESTÕES DE 11 A 25 11. O uso de pérolas ou pedaços de vidro ou ainda de cerâmica porosa no aquecimento de soluções tem por objetivo: a) Acelerar a
ASSISTENTE DE LABORATÓRIO 4 CONHECIMENTOS ESPECÍFICOS QUESTÕES DE 11 A 25 11. O uso de pérolas ou pedaços de vidro ou ainda de cerâmica porosa no aquecimento de soluções tem por objetivo: a) Acelerar a
UNIGLAS UNIFIL UNILAB
 ÍNDICE UNIGLAS Balão Fundo Chato Gargalo Longo Balão Fundo Redondo Gargalo Longo Balão Fundo Chato com Junta Esmerilhada Balão Fundo Redondo com Junta Esmerilhada Balão Volumétrico Rolha de Polietileno
ÍNDICE UNIGLAS Balão Fundo Chato Gargalo Longo Balão Fundo Redondo Gargalo Longo Balão Fundo Chato com Junta Esmerilhada Balão Fundo Redondo com Junta Esmerilhada Balão Volumétrico Rolha de Polietileno
UNIGLAS UNIFIL UNILAB
 ÍNDICE UNIGLAS Balão Fundo Chato Gargalo Longo Balão Fundo Redondo Gargalo Longo Balão Fundo Chato com Junta Esmerilhada Balão Fundo Redondo com Junta Esmerilhada Balão Volumétrico Rolha de Polietileno
ÍNDICE UNIGLAS Balão Fundo Chato Gargalo Longo Balão Fundo Redondo Gargalo Longo Balão Fundo Chato com Junta Esmerilhada Balão Fundo Redondo com Junta Esmerilhada Balão Volumétrico Rolha de Polietileno
Noções Básicas de Laboratório
 Universidade Federal de Campina Grande Centro de Ciências e Tecnologia Agroalimentar Profa. Roberlucia A. Candeia Disciplina: Química Geral Noções Básicas de Laboratório 1 Sumário 1. O laboratório 2. Segurança
Universidade Federal de Campina Grande Centro de Ciências e Tecnologia Agroalimentar Profa. Roberlucia A. Candeia Disciplina: Química Geral Noções Básicas de Laboratório 1 Sumário 1. O laboratório 2. Segurança
VIDRARIAS DE LABORATÓRIO Parte II. Maira Gazzi Manfro e Giseli Menegat
 VIDRARIAS DE LABORATÓRIO Parte II Maira Gazzi Manfro e Giseli Menegat maira.manfro@caxias.ifrs.edu.br giseli.menegat@caxias.ifrs.edu.br Almofariz e Pistilo Triturar sólidos Pulverizar sólidos Figura 1.
VIDRARIAS DE LABORATÓRIO Parte II Maira Gazzi Manfro e Giseli Menegat maira.manfro@caxias.ifrs.edu.br giseli.menegat@caxias.ifrs.edu.br Almofariz e Pistilo Triturar sólidos Pulverizar sólidos Figura 1.
QUI095 - Análise Volumétrica
 Universidade Federal de Juiz de Fora Instituto de Ciências Exatas Departamento de Química Disciplina QUI095 - Análise Volumétrica 2 semestre 2018 Prof. Renato Caamrgo Matos Download aulas: http://www.ufjf.br/nupis/
Universidade Federal de Juiz de Fora Instituto de Ciências Exatas Departamento de Química Disciplina QUI095 - Análise Volumétrica 2 semestre 2018 Prof. Renato Caamrgo Matos Download aulas: http://www.ufjf.br/nupis/
4) Balão Volumétrico: Recipiente calibrado de precisão, utilizado no preparo de soluções de concentrações definidas. PROVETA OU CILINDRO GRADUADO 5) P
 QUÍMICA I AULA 03: MATÉRIA E MEDIDAS TÓPICO 01: MEDIDAS EM QUÍMICA: MASSA E VOLUME 1.1 MEDIDAS EM QUÍMICA: MASSA E VOLUME OBJETIVOS: 1. Identificar os principais equipamentos e recipientes volumétricos;
QUÍMICA I AULA 03: MATÉRIA E MEDIDAS TÓPICO 01: MEDIDAS EM QUÍMICA: MASSA E VOLUME 1.1 MEDIDAS EM QUÍMICA: MASSA E VOLUME OBJETIVOS: 1. Identificar os principais equipamentos e recipientes volumétricos;
Soluções. Solução, soluto e solvente
 Solução, soluto e solvente Os químicos chamam soluções às misturas homogéneas. Por isso, sempre que obténs uma mistura homogénea podes dizer que tens uma solução. É uma solução. Não é uma solução. Solução,
Solução, soluto e solvente Os químicos chamam soluções às misturas homogéneas. Por isso, sempre que obténs uma mistura homogénea podes dizer que tens uma solução. É uma solução. Não é uma solução. Solução,
FACULDADE PITÁGORAS CAMPUS GOVERNADOR VALADARES / MG DISCIPLINA: PROFESSORA: Andiara Assis NATUREZA DO TRABALHO: Química Geral e Experimental
 FACULDADE PITÁGORAS CAMPUS GOVERNADOR VALADARES / MG DISCIPLINA: PROFESSORA: Andiara Assis NATUREZA DO TRABALHO: Química Geral e Experimental SEGURANÇA NO LABORATÓRIO AULA PRÁTICA É muito importante que
FACULDADE PITÁGORAS CAMPUS GOVERNADOR VALADARES / MG DISCIPLINA: PROFESSORA: Andiara Assis NATUREZA DO TRABALHO: Química Geral e Experimental SEGURANÇA NO LABORATÓRIO AULA PRÁTICA É muito importante que
Com recursos limitados, buscaremos alternativas viáveis para ativação deste espaço destinado às práticas docentes no ensino de química.
 Diagnostico Físico EEEM Carlos Kluwe Há mais de sete anos desativado, o laboratório de ciências vinha sendo utilizado como deposito da banda da escola. O espaço físico geral do laboratório de ciências
Diagnostico Físico EEEM Carlos Kluwe Há mais de sete anos desativado, o laboratório de ciências vinha sendo utilizado como deposito da banda da escola. O espaço físico geral do laboratório de ciências
AULA PRÁTICA 4 Série de sólidos
 SANEAMENTO AMBIENTAL EXPERIMENTAL TH 758 DHS PPGERHA - UFPR AULA PRÁTICA 4 Série de sólidos 1. Série de sólidos Resíduos ou sólidos são todas as matérias suspensas ou dissolvidas na água, provenientes
SANEAMENTO AMBIENTAL EXPERIMENTAL TH 758 DHS PPGERHA - UFPR AULA PRÁTICA 4 Série de sólidos 1. Série de sólidos Resíduos ou sólidos são todas as matérias suspensas ou dissolvidas na água, provenientes
I) Comparação da precisão em medidas volumétricas
 EXPERIMENTO 1 PROCEDIMENTOS DE LABORATÓRIO MEDIDAS DE MASSA, VOLUME E TEMPERATURA I) Comparação da precisão em medidas volumétricas Procedimento Experimental Materiais necessários: bureta de 50 ml (1);
EXPERIMENTO 1 PROCEDIMENTOS DE LABORATÓRIO MEDIDAS DE MASSA, VOLUME E TEMPERATURA I) Comparação da precisão em medidas volumétricas Procedimento Experimental Materiais necessários: bureta de 50 ml (1);
IDENTIFICAÇÃO DE SUBSTÂNCIAS E AVALIAÇÃO DA SUA PUREZA
 IDENTIFICAÇÃO DE SUBSTÂNCIAS E AVALIAÇÃO DA SUA PUREZA O que se pretende Utilizar técnicas experimentais de determinação de propriedades físicas características das substâncias como métodos de identificação
IDENTIFICAÇÃO DE SUBSTÂNCIAS E AVALIAÇÃO DA SUA PUREZA O que se pretende Utilizar técnicas experimentais de determinação de propriedades físicas características das substâncias como métodos de identificação
QMC 5119 II Semestre de 2014 EXPERIÊNCIA Nº1 MEDIDAS E TRATAMENTO DE DADOS
 EXPERIÊNCIA Nº1 MEDIDAS E TRATAMENTO DE DADOS 1. Introdução: Química é uma ciência experimental e por isso consideramos importante que você inicie a disciplina Introdução ao Laboratório de Química realizando
EXPERIÊNCIA Nº1 MEDIDAS E TRATAMENTO DE DADOS 1. Introdução: Química é uma ciência experimental e por isso consideramos importante que você inicie a disciplina Introdução ao Laboratório de Química realizando
Escola Básica e Secundária de Vila Franca do Campo. Curso Profissional de Técnico de Proteção Civil. Físico-Química
 Escola Básica e Secundária de Vila Franca do Campo Físico-Química Ano letivo 2016/2017 Módulo Q2 - Soluções FICHA INFORMATIVA 1 Guia de laboratório (I) NOME: N.º TURMA DATA DA REALIZAÇÃO: / / 1. INTRODUÇÃO
Escola Básica e Secundária de Vila Franca do Campo Físico-Química Ano letivo 2016/2017 Módulo Q2 - Soluções FICHA INFORMATIVA 1 Guia de laboratório (I) NOME: N.º TURMA DATA DA REALIZAÇÃO: / / 1. INTRODUÇÃO
Prática de Laboratório 1
 Prática de Laboratório 1 12 pontos Preparação do ácido 2-iodobenzóico [Tempo aprox: 1 hr] Essa prática de laboratório envolve a preparação do acido 2-iodobenzóico a partir do acido 2-aminobenzóico. O procedimento
Prática de Laboratório 1 12 pontos Preparação do ácido 2-iodobenzóico [Tempo aprox: 1 hr] Essa prática de laboratório envolve a preparação do acido 2-iodobenzóico a partir do acido 2-aminobenzóico. O procedimento
EXPERIMENTOS DE QUIMICA ORGANICA I(QUI 127, QUI 186 E QUI 214) EXPERIMENTO 7 TÉCNICAS DE EXTRAÇÃO
 EXPERIMENTO 7 TÉCNICAS DE EXTRAÇÃO 1.1. Fundamentação teórica A extração é um processo de separação de compostos que consiste em transferir uma substância da fase na qual essa se encontra (dissolvida ou
EXPERIMENTO 7 TÉCNICAS DE EXTRAÇÃO 1.1. Fundamentação teórica A extração é um processo de separação de compostos que consiste em transferir uma substância da fase na qual essa se encontra (dissolvida ou
NOME DO LABORATÓRIO CERTIFICADO DE CALIBRAÇÃO
 da Prova Prática QUESTÃO 1: Cargo: D-46 Técnico em Química Metrologia Química Esboce um certificado de calibração com as informações mínimas obrigatórias que nele devem estar contidas. Use o formato a
da Prova Prática QUESTÃO 1: Cargo: D-46 Técnico em Química Metrologia Química Esboce um certificado de calibração com as informações mínimas obrigatórias que nele devem estar contidas. Use o formato a
QUÍMICA FARMACÊUTICA
 INSTITUTO DE CIÊNCIAS DA SAÚDE CURSO DE FARMÁCIA ROTEIRO PARA S PRÁTICAS DISCIPLINA: QUÍMICA FARMACÊUTICA Título da Aula: Determinação do coeficiente de partição óleo-água (P) do ácido benzóico 1 Demonstrar
INSTITUTO DE CIÊNCIAS DA SAÚDE CURSO DE FARMÁCIA ROTEIRO PARA S PRÁTICAS DISCIPLINA: QUÍMICA FARMACÊUTICA Título da Aula: Determinação do coeficiente de partição óleo-água (P) do ácido benzóico 1 Demonstrar
PCT SERINGA de vidro de 5,0 ml, reusavel, termo-resistente, utilizada em anestesia
 1 de 8 //1 17:04 PCT Licitação: PE007/1 Data e Hora da Entrega das Propostas: 29//1-08:4 Grupo: 6 - EQUIPAMENTOS E ARTIGOS DE USO MEDICO, DENTARIO E VETERINARIO Órgão/Entidade: SECRETARIA DA EDUCACAO idade
1 de 8 //1 17:04 PCT Licitação: PE007/1 Data e Hora da Entrega das Propostas: 29//1-08:4 Grupo: 6 - EQUIPAMENTOS E ARTIGOS DE USO MEDICO, DENTARIO E VETERINARIO Órgão/Entidade: SECRETARIA DA EDUCACAO idade
Figura 2: Surgimento do menisco nos equipamentos volumétricos.
 1. Introdução Uso da Vidraria Volumétrica e Determinação de Densidade A medição de volumes líquidos é uma parte importante de muitos experimentos. Em alguns casos, os volumes medidos precisam de uma grande
1. Introdução Uso da Vidraria Volumétrica e Determinação de Densidade A medição de volumes líquidos é uma parte importante de muitos experimentos. Em alguns casos, os volumes medidos precisam de uma grande
BC-1302 QUÍMICA DOS ELEMENTOS
 PRÁTICA 5: Oxigênio e Enxofre Objetivos Preparar o gás oxigênio, por método laboratorial e estudar algumas de suas propriedades. Estudar o enxofre nas suas variações alotrópicas e algumas de suas reações.
PRÁTICA 5: Oxigênio e Enxofre Objetivos Preparar o gás oxigênio, por método laboratorial e estudar algumas de suas propriedades. Estudar o enxofre nas suas variações alotrópicas e algumas de suas reações.
(3) É terminantemente PROIBIDO FUMAR em qualquer laboratório. (4) É PROIBIDO trazer COMIDA ou BEBIDA para o laboratório.
 TÍTULO DA AULA PRÁTICA Introdução ao Laboratório de química e técnicas de pesagem INTRODUÇÃO A ocorrência de acidentes em laboratórios, infelizmente, não é tão rara como possa parecer. É muito importante
TÍTULO DA AULA PRÁTICA Introdução ao Laboratório de química e técnicas de pesagem INTRODUÇÃO A ocorrência de acidentes em laboratórios, infelizmente, não é tão rara como possa parecer. É muito importante
SELEÇÃO E MANUSEIO DE REAGENTES E OUTROS PRODUTOS QUÍMICOS
 QFL0230 2014 SELEÇÃO E MANUSEIO DE REAGENTES E OUTROS PRODUTOS QUÍMICOS CLASSIFICAÇÃO! reagent-grade, grau de pureza analítico, p.a. de acordo com o comitê de reagents da ACS (American Chemical Society);
QFL0230 2014 SELEÇÃO E MANUSEIO DE REAGENTES E OUTROS PRODUTOS QUÍMICOS CLASSIFICAÇÃO! reagent-grade, grau de pureza analítico, p.a. de acordo com o comitê de reagents da ACS (American Chemical Society);
INTRODUÇÃO A TITULAÇÃO
 Introdução a Analise Química I sem/2018 Profa Ma Auxiliadora - 1 Universidade Federal de Juiz de Fora Instituto de Ciências Exatas Departamento de Química Disciplina QUIO94 - Introdução à Análise Química
Introdução a Analise Química I sem/2018 Profa Ma Auxiliadora - 1 Universidade Federal de Juiz de Fora Instituto de Ciências Exatas Departamento de Química Disciplina QUIO94 - Introdução à Análise Química
CURSO PRÁTICO QUI 328 e 128 SÍNTESE DE COMPOSTOS ORGÂNICOS
 CURSO PRÁTICO QUI 328 e 128 SÍNTESE DE COMPOSTOS ORGÂNICOS Síntese I ( p-red) Nitrobenzeno Anilina Acetanilida p-nitro Acetanilida p-nitro Anilina p-red 1- OBTENÇÃO DA ANILINA -Estanho -Àcido clorídrico
CURSO PRÁTICO QUI 328 e 128 SÍNTESE DE COMPOSTOS ORGÂNICOS Síntese I ( p-red) Nitrobenzeno Anilina Acetanilida p-nitro Acetanilida p-nitro Anilina p-red 1- OBTENÇÃO DA ANILINA -Estanho -Àcido clorídrico
RESINA FENÓLICA PARA FUNDIÇÃO - DETERMINAÇÃO DO TEOR DE FENOL LIVRE
 SUMÁRIO Método de Ensaio Folha : 1 de 5 1_ Objetivo 2_ Princípio do método 3_ Definição 4_ Aparelhagem / reagentes 5_ Execução do ensaio 6_ Resultados 7_ Anexo A 1_ OBJETIVO 1.1_ Esta recomendação prescreve
SUMÁRIO Método de Ensaio Folha : 1 de 5 1_ Objetivo 2_ Princípio do método 3_ Definição 4_ Aparelhagem / reagentes 5_ Execução do ensaio 6_ Resultados 7_ Anexo A 1_ OBJETIVO 1.1_ Esta recomendação prescreve
PÓ DE CARVÃO MINERAL PARA FUNDIÇÃO - DETERMINAÇÃO DO TEOR DE ENXOFRE TOTAL PELO PROCESSO DE ESCHKA (GRAVIMETRIA)
 SUMÁRIO Método de Ensaio Folha : 1 de 6 1_ Objetivo 2_ Documentos a consultar 3_ Princípio do método 4_ Definição 5_ Aparelhagem/reagentes 6_ Preparação das soluções 7_ Execução do ensaio 8_ Segurança
SUMÁRIO Método de Ensaio Folha : 1 de 6 1_ Objetivo 2_ Documentos a consultar 3_ Princípio do método 4_ Definição 5_ Aparelhagem/reagentes 6_ Preparação das soluções 7_ Execução do ensaio 8_ Segurança
TÍTULO: ANÁLISE TITRIMÉTRICA (Volumétrica)
 Componente Curricular: Química dos Alimentos Prof. Barbosa e Prof. Daniel 4º Módulo de Química Procedimento de Prática Experimental Competências: Identificar as propriedades dos alimentos. Identificar
Componente Curricular: Química dos Alimentos Prof. Barbosa e Prof. Daniel 4º Módulo de Química Procedimento de Prática Experimental Competências: Identificar as propriedades dos alimentos. Identificar
MF-420.R-3 - MÉTODO DE DETERMINAÇÃO DE AMÔNIA (MÉTODO DO INDOFENOL).
 MF-420.R-3 - MÉTODO DE DETERMINAÇÃO DE AMÔNIA (MÉTODO DO INDOFENOL). Notas: Aprovada pela Deliberação CECA nº 686, de 25 de julho de 1985. Publicada no DOERJ de 14 de julho de 1985. 1. OBJETIVO O objetivo
MF-420.R-3 - MÉTODO DE DETERMINAÇÃO DE AMÔNIA (MÉTODO DO INDOFENOL). Notas: Aprovada pela Deliberação CECA nº 686, de 25 de julho de 1985. Publicada no DOERJ de 14 de julho de 1985. 1. OBJETIVO O objetivo
AULA 3. Soluções: preparo e diluição. Laboratório de Química QUI OBJETIVOS
 AULA 3 Soluções: preparo e diluição OBJETIVOS Preparar soluções a partir de reagentes sólidos e líquidos; Fazer cálculos prévios da quantidade de reagentes sólidos ou líquidos necessários para o preparo
AULA 3 Soluções: preparo e diluição OBJETIVOS Preparar soluções a partir de reagentes sólidos e líquidos; Fazer cálculos prévios da quantidade de reagentes sólidos ou líquidos necessários para o preparo
MATERIAIS PARA FUNDIÇÃO - DETERMINAÇÃO DO ÓXIDO DE FERRO
 Folha : 1 de 5 SUMÁRIO 1_ Objetivo 2_ Princípio do método 3_ Definição 4_ Aparelhagem / reagentes 5_ Execução do ensaio 6_ Padronização da solução de dicromato de potássio 0,05 N 7_ Resultados 1_ OBJETIVO
Folha : 1 de 5 SUMÁRIO 1_ Objetivo 2_ Princípio do método 3_ Definição 4_ Aparelhagem / reagentes 5_ Execução do ensaio 6_ Padronização da solução de dicromato de potássio 0,05 N 7_ Resultados 1_ OBJETIVO
PORCENTAGEM DE CIMENTO POR TITULAÇÃO QUÍMICA
 PORCENTAGEM DE CIMENTO POR TITULAÇÃO QUÍMICA C D T - CENTRO DE DESENVOLVIMENTO TECNOLÓGICO Setembro de 2014 DESIGNAÇÃO - ARTERIS T- 008 09/2014 T 008 pg 1 - Centro de Desenvolvimento Tecnológico ARTERIS
PORCENTAGEM DE CIMENTO POR TITULAÇÃO QUÍMICA C D T - CENTRO DE DESENVOLVIMENTO TECNOLÓGICO Setembro de 2014 DESIGNAÇÃO - ARTERIS T- 008 09/2014 T 008 pg 1 - Centro de Desenvolvimento Tecnológico ARTERIS
Experiência 1: ALGARISMOS SIGNIFICATIVOS, MEDIDAS E TRATAMENTO DE DADOS: Calibração de Equipamentos Volumétricos.
 Experiência 1: ALGARISMOS SIGNIFICATIVOS, MEDIDAS E TRATAMENTO DE DADOS: Calibração de Equipamentos Volumétricos. 1. Objetivos Efetuar medidas de temperatura, de massa e de volume e posteriormente realizar
Experiência 1: ALGARISMOS SIGNIFICATIVOS, MEDIDAS E TRATAMENTO DE DADOS: Calibração de Equipamentos Volumétricos. 1. Objetivos Efetuar medidas de temperatura, de massa e de volume e posteriormente realizar
Aula 4 PREPARO DE SOLUÇÕES. META Introduzir técnicas básicas de preparo de soluções.
 PREPARO DE SOLUÇÕES META Introduzir técnicas básicas de preparo de soluções. OBJETIVOS Ao final desta aula o aluno deverá: Fornecer conhecimento necessário para o preparo de soluções. Calcular a concentração
PREPARO DE SOLUÇÕES META Introduzir técnicas básicas de preparo de soluções. OBJETIVOS Ao final desta aula o aluno deverá: Fornecer conhecimento necessário para o preparo de soluções. Calcular a concentração
Vidrarias Balão Destilação Fundo Redondo Saída Lateral Borosilicato Cap Ø bulbo x Altura 50ml 60 x 145 mm
 Vidrarias Balão Destilação Fundo Redondo Saída Lateral Borosilicato Cap Ø bulbo x Altura 50ml 60 x 145 mm 125ml 250ml 500ml 1000ml 70 x 190 mm 88 x 250 mm 110 x 280 mm 140 x 250 mm Balão Fundo Chato -
Vidrarias Balão Destilação Fundo Redondo Saída Lateral Borosilicato Cap Ø bulbo x Altura 50ml 60 x 145 mm 125ml 250ml 500ml 1000ml 70 x 190 mm 88 x 250 mm 110 x 280 mm 140 x 250 mm Balão Fundo Chato -
3016 Oxidação do ácido ricinoléico a ácido azeláico (a partir de óleo de rícino) com KMnO 4
 6 Oxidação do ácido ricinoléico a ácido azeláico (a partir de óleo de rícino) com KMnO 4 CH -(CH ) OH (CH ) -COOH KMnO 4 /KOH HOOC-(CH ) -COOH C H 4 O (.) KMnO 4 KOH (.) (6.) C H 6 O 4 (.) Classificação
6 Oxidação do ácido ricinoléico a ácido azeláico (a partir de óleo de rícino) com KMnO 4 CH -(CH ) OH (CH ) -COOH KMnO 4 /KOH HOOC-(CH ) -COOH C H 4 O (.) KMnO 4 KOH (.) (6.) C H 6 O 4 (.) Classificação
Práticas de. Química Geral e Orgânica. para Engenharia Ambiental
 Práticas de Química Geral e Orgânica para Engenharia Ambiental INTRODUÇÂO A química é uma ciência experimental e se ocupa especialmente das transformações das substâncias, de sua composição e das relações
Práticas de Química Geral e Orgânica para Engenharia Ambiental INTRODUÇÂO A química é uma ciência experimental e se ocupa especialmente das transformações das substâncias, de sua composição e das relações
Professor: Melissa Kayser Unidade Curricular: CPGL Aluno: Turma: Data: / /
 MINISTÉRIO DA EDUCAÇÃO SECRETARIA DE EDUCAÇÃO PROFISSIONAL E TECNOLÓGICA INSTITUTO FEDERAL DE EDUCAÇÃO, CIÊNCIA E TECNOLOGIA DE SANTA CATARINA CÂMPUS LAGES Professor: Melissa Kayser Unidade Curricular:
MINISTÉRIO DA EDUCAÇÃO SECRETARIA DE EDUCAÇÃO PROFISSIONAL E TECNOLÓGICA INSTITUTO FEDERAL DE EDUCAÇÃO, CIÊNCIA E TECNOLOGIA DE SANTA CATARINA CÂMPUS LAGES Professor: Melissa Kayser Unidade Curricular:
Apresentar as principais vidrarias e equipamentos de uso corrente em laboratórios de química.
 1 Universidade Estadual Paulista Júlio de Mesquita Filho Faculdade de Ciências Agrárias e Veterinárias Curso: Agronomia 1º Semestre de 2015 Disciplina: Química Geral Docente: Profa. Dra. Luciana Maria
1 Universidade Estadual Paulista Júlio de Mesquita Filho Faculdade de Ciências Agrárias e Veterinárias Curso: Agronomia 1º Semestre de 2015 Disciplina: Química Geral Docente: Profa. Dra. Luciana Maria
Medições e incertezas associadas
 Medições e incertezas associadas Adaptado pelo Prof. Luís Perna Medições diretas e indiretas Quais são as diferenças entre medir, medição e medida de uma grandeza? Medir é comparar uma grandeza com uma
Medições e incertezas associadas Adaptado pelo Prof. Luís Perna Medições diretas e indiretas Quais são as diferenças entre medir, medição e medida de uma grandeza? Medir é comparar uma grandeza com uma
23/03/2017 Química Licenciatura Prof. Udo Eckard Sinks PESAGEM, MEDIDAS DE TEMPERATURA E MANUSEIO COM RECIPIENTES VOLUMÉTRICOS
 PESAGEM, MEDIDAS DE TEMPERATURA E MANUSEIO COM RECIPIENTES VOLUMÉTRICOS 1. Objetivos No final desta experiência o aluno deverá: Reconhecer a importância das medidas em química. Usar corretamente e ler
PESAGEM, MEDIDAS DE TEMPERATURA E MANUSEIO COM RECIPIENTES VOLUMÉTRICOS 1. Objetivos No final desta experiência o aluno deverá: Reconhecer a importância das medidas em química. Usar corretamente e ler
SÍNTESE DO SULFATO DE TETRAAMINA COBRE (II) MONO HIDRATADO
 SÍNTESE DO SULFATO DE TETRAAMINA COBRE (II) MONO HIDRATADO O que se pretende Realizar laboratorialmente a síntese do sal sulfato de tetraaminacobre (II) monohidratado, uma substância usado como fungicida
SÍNTESE DO SULFATO DE TETRAAMINA COBRE (II) MONO HIDRATADO O que se pretende Realizar laboratorialmente a síntese do sal sulfato de tetraaminacobre (II) monohidratado, uma substância usado como fungicida
Instruções de laboratório
 LCE0182 Química Analítica Quantitativa Instruções de laboratório Wanessa Melchert Mattos wanemelc@usp.br RECOMENDAÇÕES INICIAIS O curso de Química Analítica Quantitativa constará de aulas teóricas e trabalhos
LCE0182 Química Analítica Quantitativa Instruções de laboratório Wanessa Melchert Mattos wanemelc@usp.br RECOMENDAÇÕES INICIAIS O curso de Química Analítica Quantitativa constará de aulas teóricas e trabalhos
LISTA SOBRE VIDRARIAS. Questão 01 - (UECE)
 LISTA SOBRE VIDRARIAS Questão 01 - (UECE) O verbete laboratório deriva da expressão latina labora et ora (trabalha e reza), indicando que ali se realiza trabalho sério e cuidadoso. Apoiando-se nessa premissa,
LISTA SOBRE VIDRARIAS Questão 01 - (UECE) O verbete laboratório deriva da expressão latina labora et ora (trabalha e reza), indicando que ali se realiza trabalho sério e cuidadoso. Apoiando-se nessa premissa,
XVI Maratona Cearense de Química º Ano. Experiência 1
 - 2013 8º Ano Experiência 1 Material: 1. Erlenmeyer 500mL com tampa 2. Cinco béqueres de 150 ml 3. 100 ml de mel (Karo) 4. 100 ml de glicerina 5. 100 ml de água com corante 6. 100 ml de óleo de cozinha
- 2013 8º Ano Experiência 1 Material: 1. Erlenmeyer 500mL com tampa 2. Cinco béqueres de 150 ml 3. 100 ml de mel (Karo) 4. 100 ml de glicerina 5. 100 ml de água com corante 6. 100 ml de óleo de cozinha
MINISTÉRIO DA EDUCAÇÃO UNIVERSIDADE FEDERAL DE OURO PRETO UFOP Coordenadoria de Suprimentos - CSU
 ITEM QTDE. UND DESCRIÇÃO SALDO 30.35.000117-PAPEL TORNASSOL VERMELHO INDICADOR DE MEIO ÁCIDO, CADERNO C/ 100 TIRAS 1 CX 2 UN 3 UN 30.35.000481-COPO DE VIDRO TIPO CÁLICE, GRADUADO EM 30ML. CATMAT:412619
ITEM QTDE. UND DESCRIÇÃO SALDO 30.35.000117-PAPEL TORNASSOL VERMELHO INDICADOR DE MEIO ÁCIDO, CADERNO C/ 100 TIRAS 1 CX 2 UN 3 UN 30.35.000481-COPO DE VIDRO TIPO CÁLICE, GRADUADO EM 30ML. CATMAT:412619
Bolsistas do subprojeto de Química: Ana Claudia Liz Mariela Matheus Marques Nayara Mendes Gabriela Camila Zanetti
 Bolsistas do subprojeto de Química: Ana Claudia Liz Mariela Matheus Marques Nayara Mendes Gabriela Camila Zanetti Alguns equipamentos e vidrarias comumente utilizados em laboratórios de Química e necessários
Bolsistas do subprojeto de Química: Ana Claudia Liz Mariela Matheus Marques Nayara Mendes Gabriela Camila Zanetti Alguns equipamentos e vidrarias comumente utilizados em laboratórios de Química e necessários
Experimento 03: Cinética Química
 Experimento 03: Cinética Química 1 OBJETIVO - Verificar alguns fatores que influenciam na velocidade das reações químicas: temperatura, superfície de contato e efeito do catalisador. 2 INTRODUÇÃO A cinética
Experimento 03: Cinética Química 1 OBJETIVO - Verificar alguns fatores que influenciam na velocidade das reações químicas: temperatura, superfície de contato e efeito do catalisador. 2 INTRODUÇÃO A cinética
PRÁTICA 01 - INTRODUÇÃO AO TRABALHO NO LABORATÓRIO DE QUÍMICA ANALÍTICA E PREPARO E PADRONIZAÇÃO DE SOLUÇÕES
 PRÁTICA 01 - INTRODUÇÃO AO TRABALHO NO LABORATÓRIO DE QUÍMICA ANALÍTICA E PREPARO E PADRONIZAÇÃO DE SOLUÇÕES METAS Apresentar o objetivo da parte prática da disciplina; apresentar as instruções de trabalho
PRÁTICA 01 - INTRODUÇÃO AO TRABALHO NO LABORATÓRIO DE QUÍMICA ANALÍTICA E PREPARO E PADRONIZAÇÃO DE SOLUÇÕES METAS Apresentar o objetivo da parte prática da disciplina; apresentar as instruções de trabalho
REALIZAÇÃO EXPERIMENTAL - MICROESCALA (adaptada de Pike et al, Microscale Inorganic Chemistry, exp.16, p )
 REALIZAÇÃO EXPERIMENTAL - MICROESCALA (adaptada de Pike et al, Microscale Inorganic Chemistry, exp.16, p204-207) PARTE B: PREPARAÇÃO QUANTITATIVA DO TETRATIONATO DE SÓDIO A MICROESCALA Reagentes Tiossulfato
REALIZAÇÃO EXPERIMENTAL - MICROESCALA (adaptada de Pike et al, Microscale Inorganic Chemistry, exp.16, p204-207) PARTE B: PREPARAÇÃO QUANTITATIVA DO TETRATIONATO DE SÓDIO A MICROESCALA Reagentes Tiossulfato
Funcionamento de um sistema tampão
 Funcionamento de um sistema tampão Actividade Laboratorial Química 12. ANO 1. Questão problema o o Verificar experimentalmente o funcionamento de um sistema tampão, por titulação ácido forte-base fraca
Funcionamento de um sistema tampão Actividade Laboratorial Química 12. ANO 1. Questão problema o o Verificar experimentalmente o funcionamento de um sistema tampão, por titulação ácido forte-base fraca
MATERIAIS PARA FUNDIÇÃO - DETERMINAÇÃO DO PONTO DE EBULIÇÃO EM LÍQUIDOS
 Método de Ensaio Folha : 1 de 7 SUMÁRIO 1_ Objetivo 2_ Princípio do método 3_ Definição 4_ Aparelhagem 5_ Execução do ensaio 6_ Resultados 7_ Anexos A, B e C 1_ OBJETIVO 1.1_ Esta recomendação prescreve
Método de Ensaio Folha : 1 de 7 SUMÁRIO 1_ Objetivo 2_ Princípio do método 3_ Definição 4_ Aparelhagem 5_ Execução do ensaio 6_ Resultados 7_ Anexos A, B e C 1_ OBJETIVO 1.1_ Esta recomendação prescreve
Catálogo - Itens para Laboratório
 Catálogo - Itens para Laboratório Orçamento / Contato: (32)34222525 Email: comercial@textechbrasil.com.br http://www.textechbrasil.com.br Item Produto 180 Acídimetro de Dornic 10ml - 0-100 187 Balão Volumétrico
Catálogo - Itens para Laboratório Orçamento / Contato: (32)34222525 Email: comercial@textechbrasil.com.br http://www.textechbrasil.com.br Item Produto 180 Acídimetro de Dornic 10ml - 0-100 187 Balão Volumétrico
1 Extração Líquido-Líquido
 Ministério da Educação Universidade Tecnológica Federal do Paraná Campus de Curitiba Departamento de Química _ Extração Líquido-Líquido Disciplina: Práticas de Química Orgânica Materiais e Reagentes Mesa
Ministério da Educação Universidade Tecnológica Federal do Paraná Campus de Curitiba Departamento de Química _ Extração Líquido-Líquido Disciplina: Práticas de Química Orgânica Materiais e Reagentes Mesa
MATERIAIS PARA FUNDIÇÃO - DETERMINAÇÃO DO FATOR DA SOLUÇÃO DE AZUL DE METILENO POR TITULAÇÃO COM SOLUÇÃO DE CLORETO TITANOSO (TiCl 3 )
 Padronização Folha : 1 de 6 SUMÁRIO 1_ Objetivo 2_ Princípio do método 3_ Aparelhagem 4_ Procedimento 1_ OBJETIVO 1.1_ Esta recomendação prescreve o método de fatoração da solução de azul de metileno utilizada
Padronização Folha : 1 de 6 SUMÁRIO 1_ Objetivo 2_ Princípio do método 3_ Aparelhagem 4_ Procedimento 1_ OBJETIVO 1.1_ Esta recomendação prescreve o método de fatoração da solução de azul de metileno utilizada
PURIFICAÇÃO DO ÉTER ETÍLICO PARTE 2. Instituição, alunos que irão proferir, curso, ano, professores e estagiários docentes
 PURIFICAÇÃO DO ÉTER ETÍLICO PARTE 2 Instituição, alunos que irão proferir, curso, ano, professores e estagiários docentes ASSUNTOS ABORDADOS: Filtração Fontes de aquecimento Ponto de Ebulição Destilação
PURIFICAÇÃO DO ÉTER ETÍLICO PARTE 2 Instituição, alunos que irão proferir, curso, ano, professores e estagiários docentes ASSUNTOS ABORDADOS: Filtração Fontes de aquecimento Ponto de Ebulição Destilação
UFSC Departamento de Química QMC 5119 Introdução ao Laboratório de Química 2015/1
 1 UFSC Departamento de Química QMC 5119 Introdução ao Laboratório de Química 2015/1 Experiência 01: Algarismos significativos, medidas e tratamento de dados. Calibração de equipamentos volumétricos 1.
1 UFSC Departamento de Química QMC 5119 Introdução ao Laboratório de Química 2015/1 Experiência 01: Algarismos significativos, medidas e tratamento de dados. Calibração de equipamentos volumétricos 1.
SEGURANÇA EM LABORATÓRIO
 Por que devemos nos preocupar com a segurança nos Laboratórios? SEGURANÇA EM LABORATÓRIO Declaração dos Direitos Humanos: Todo ser humano tem direito à vida Preservação da vida Por que os acidentes acontecem?
Por que devemos nos preocupar com a segurança nos Laboratórios? SEGURANÇA EM LABORATÓRIO Declaração dos Direitos Humanos: Todo ser humano tem direito à vida Preservação da vida Por que os acidentes acontecem?
Experiência 7. PREPARO DE SOLUÇÃO A PARTIR DE SUBSTÂNCIAS SÓLIDAS, LIQUIDAS E DE SOLUÇÃO CONCENTRADA
 Experiência 7. PREPARO DE SOLUÇÃO A PARTIR DE SUBSTÂNCIAS SÓLIDAS, LIQUIDAS E DE SOLUÇÃO CONCENTRADA 1. Objetivos Após a realização desta aula experimental, espera-se que o graduando do curso de Química
Experiência 7. PREPARO DE SOLUÇÃO A PARTIR DE SUBSTÂNCIAS SÓLIDAS, LIQUIDAS E DE SOLUÇÃO CONCENTRADA 1. Objetivos Após a realização desta aula experimental, espera-se que o graduando do curso de Química
SOLUBILIDADE DE SÓLIDOS EM LÍQUIDOS
 EXPERIMENTO 4 SOLUBILIDADE DE SÓLIDOS EM LÍQUIDOS OBJETIVOS Observar soluções insaturadas, saturadas e supersaturadas; Construir a curva de solubilidade de um sal inorgânico. INTRODUÇÃO Os depósitos naturais
EXPERIMENTO 4 SOLUBILIDADE DE SÓLIDOS EM LÍQUIDOS OBJETIVOS Observar soluções insaturadas, saturadas e supersaturadas; Construir a curva de solubilidade de um sal inorgânico. INTRODUÇÃO Os depósitos naturais
Alcance, A - Dá o valor máximo que um aparelho pode medir. Pode existir também uma gama de valores, isto é, um valor máximo e um mínimo.
 6. APARELHOS DE MEDIDA E MEDIÇÕES ------- Alcance, A - Dá o valor máximo que um aparelho pode medir. Pode existir também uma gama de valores, isto é, um valor máximo e um mínimo. Menor divisão da escala
6. APARELHOS DE MEDIDA E MEDIÇÕES ------- Alcance, A - Dá o valor máximo que um aparelho pode medir. Pode existir também uma gama de valores, isto é, um valor máximo e um mínimo. Menor divisão da escala
EXPERIMENTO 3 SUBSTÂNCIAS E MISTURAS OBJETIVOS INTRODUÇÃO
 EXPERIMENTO 3 SUBSTÂNCIAS E MISTURAS OBJETIVOS Observar a diferença entre uma substância e uma mistura de substâncias; Aprender algumas formas de separação e purificação de misturas; Determinar a pureza
EXPERIMENTO 3 SUBSTÂNCIAS E MISTURAS OBJETIVOS Observar a diferença entre uma substância e uma mistura de substâncias; Aprender algumas formas de separação e purificação de misturas; Determinar a pureza
Reconhecer as vidrarias volumétricas utilizadas no preparo de soluções;
 AULA 5 Preparo e diluição de soluções OBJETIVOS Preparar soluções a partir de reagentes sólidos e líquidos; Fazer cálculos prévios da quantidade de reagentes sólidos ou líquidos necessários para o preparo
AULA 5 Preparo e diluição de soluções OBJETIVOS Preparar soluções a partir de reagentes sólidos e líquidos; Fazer cálculos prévios da quantidade de reagentes sólidos ou líquidos necessários para o preparo
SEGURANÇA EM LABORATÓRIO
 SEGURANÇA EM LABORATÓRIO Por que devemos nos preocupar com a segurança nos Laboratórios? Declaração dos Direitos Humanos: Todo ser humano tem direito à vida Preservação da vida Por que os acidentes acontecem?
SEGURANÇA EM LABORATÓRIO Por que devemos nos preocupar com a segurança nos Laboratórios? Declaração dos Direitos Humanos: Todo ser humano tem direito à vida Preservação da vida Por que os acidentes acontecem?
