Avaliação e tratamento das alterações do equilibrio ácido-base
|
|
|
- Salvador Luiz Sanches de Santarém
- 7 Há anos
- Visualizações:
Transcrição
1 Avaliação e tratamento das alterações do equilibrio ácido-base - Regras práticas - Prof. Doutor António Vaz Carneiro Disciplina de Introdução à Clínica Disciplina de Medicina I Centro de Estudos de Medicina Baseada na Evidência Faculdade de Medicina da Universidade de Lisboa CENTRO ACADÉMICO DE MEDICINA DE LISBOA
2 I - CONSIDERAÇÕES TEÓRICAS Glossário H + hidrogenião [H + ] concentração de hidrogeniões HCO3 - ou HCO3 ião bicarbonato [HCO3 - ]p concentração plasmática de bicarbonato PaCO2 pressão parcial de anidrido carbónico no sangue arterial Cl - ou Cl ião cloro Na + ião sódio a-b ácido-base A resposta homeostática do organismo às variações da concentração plasmática de H + ([H + ]p) - que normalmente se expressa sob a forma de ph ( ph = -log [H + ] ) - processa-se em três estádios sequenciais: 1. tamponamento químico imediato por solutos-tampão intra e extracelulares 2. alteração da ventilação pulmonar (minutos a horas mais tarde) tendo como resultante a modulação da pressão arterial de CO2 (PaCO2) 3. alterações da excreção renal de H+ (horas a dias mais tarde), com consequente regulação da concentração plasmática de HCO3 - ([HCO3 - ] p ) num novo estado de equilíbrio. A homeostase do equilíbrio ácido-base pode ser fácilmente compreendida em termos do sistema-tampão bicarbonato: H + + HCO3 - = H2CO3 = H2O + CO2-2 -
3 Em estado de equilíbrio, a relação entre estes compostos pode ser exprimida pela equação de Henderson: [H + ] = 24 x PaCO2 (eq. de Henderson) [HCO3-]p ou, fazendo a conversão de [H + ] para ph, pela equação de Henderson-Hasselbach ph = 6,10 + log [HCO3 - ]p (eq. Henderson-Hasselbach) 0,03 x PaCO2 Este sistema tem papel central na manutenção do equilíbrio ácido-base, porque a [HCO3 - ]p pode ser regulada pela excreção renal de H +, e, independentemente, a PaCO2 pode ser regulada através da ventilação pulmonar. Em circunstâncias fisiológicas normais existe um estado de equilíbrio, devido ao facto dos índices de produção de H + e de CO2 serem equilibrados pelos seus índices de excreção. Assim, a [H + ] é mantida dentro de limites relativamente estritos (quadro I): Quadro I - Valores normais ácido-base Plasma ph [H + ] nanomol/l PaCO2 mmhg [HCO3]p meq/l Arterial 7,37-7, Venoso 7,32-7,
4 As alterações da homeostase ácido-básica definem-se utilizando os seguintes termos: Acidose: processo fisiopatológico tendente a acidificar o organismo Alcalose: processo fisiopatológico tendente a alcalinizar o organismo Acidémia: subida da [H + ]p, com baixa do ph (<7.35) Alcalémia: baixa da [H + ]p, com subida do ph (>7.45) Normocápnia: PaCO2 normal Hipercápnia: subida da PaCO2 (>44 mmhg) Hipocápnia: baixa da PaCO2 (<36 mmhg) Normobicarbonatémia: [HCO3 - ]p normal Hiperbicarbonatémia: subida da [HCO3 - ]p (>26 mmhg) Hipobicarbonatémia: baixa da [HCO3 - ]p (<22 mmhg) Acidose metabólica: alteração do equilíbrio a-b iniciada por redução da [HCO3]p Alcalose metabólica: alteração do equilíbrio a-b iniciada por aumento da [HCO3]p Acidose respiratória: alteração do equilíbrio a-b iniciada por aumento da PaCO2 Alcalose respiratória: alteração do equilíbrio a-b iniciada por diminuição da PaCO2 Alterações simples do equilíbrio ácido-base: presença de uma alteração primária, juntamente com a respectiva resposta secundária (compensadora) Alterações mistas do equilíbrio ácido-base: presença simultânea de 2 ou mais alterações primárias (por ex.. acidose respiratória + alcalose metabólica) Como se pode constatar, as alterações clínicas do equilíbrio ácido-base classificam-se de acordo com a variável fisiológica que é directamente afectada pelo processo fisiopatológico inicial: [HCO3 - ]p ou PaCO2. Assim, as que se caracterizam por alteração inicial (subida ou descida) da concentração plasmática de bicarbonato ([HCO3 - ]p) designam-se por metabólicas, enquanto que as alterações do equilíbrio ácido-base caracterizadas por subida ou descida inicial da pressão parcial de anidrido carbónico (PaCO2) se designam por respiratórias
5 O processo inicial responsável por cada uma destas quatro alterações principais do equilíbrio ácido-base (acidose e alcalose metabólicas e acidose e alcalose respiratórias), provoca não só uma mudança da acidez plasmática, mas também o início de uma série de processos fisiológicos secundários de resposta, que vão alterar o valor do outro membro-par do sistema tampão bicarbonato; por outras palavras, as alterações metabólicas induzem respostas secundárias ventilatórias que alteram a PaCO2, enquanto que as alterações respiratórias induzem respostas secundárias renais que vão alterar a [HCO3 - ]p (quadro II). Quadro II - As quatro alterações principais do equilíbrio ácido-base TIPO Alteração primária Resposta secundária Mecanismo da resposta secundária Acidose metabólica diminuição da [HCO3 - ]p diminuição da PaCO2 hiperventilação Alcalose metabólica aumento da [HCO3 - ]p aumento da PaCO2 hipoventilação Acidose respiratória aumento da PaCO2 aumento da [HCO3 - ]p titulação dos solutos tampão tecidulares, com aumento transitório da excreção de ácido e aumento mantido da reabsorção de HCO3 - pelo rim Alcalose respiratória diminuição da PaCO2 diminuição da [HCO3 - ]p titulação dos solutos tampão tecidulares, com supressão transitória da excreção de ácido e redução mantida da reabsorção de HCO3 - pelo rim - 5 -
6 II - CONSIDERAÇÕES PRÁTICAS NA AVALIAÇÃO CLÍNICA DAS ALTERAÇÕES DO EQUILÍBRIO ÁCIDO-BASE As alterações do equilíbrio ácido-base devem ser sistemáticamente procuradas por duas razões fundamentais: em primeiro lugar para obter a sua correcção, e em segundo lugar porque as referidas alterações podem ser a indicação inicial da existência de uma situação patológica subjacente, clinicamente não evidente. Tendo em vista a complexidade e a variabilidade de expressão das alterações ácidobásicas, é fundamental uma abordagem sistemática daquelas, quando de posse dos valores laboratoriais mínimos para uma interpretação inicial correcta (gasometria arterial, ionograma sérico). A referida abordagem obtém-se respondendo às seguintes questões: Existe alteração do equilíbrio ácido-base? De que tipo de alteração primária (metabólica ou respiratória) se trata? É uma alteração simples ou mista? Qual a sua etiologia? Existe alteração do equilíbrio ácido-base? Muitas vezes a descoberta de uma alteração do equilíbrio ácido-base é puramente casual, na interpretação de gases no sangue ou ionograma de rotina. A necessidade de se obter gasometria arterial deve basear-se na história e no exame clínico do doente, e no conhecimento das patologias que provocam mais frequentemente alterações do ph sérico: Acidose metabólica: sépsis, insuficiência renal, coma, diarreia, ceto-cetose diabética, insuficiência hepática, ingestão crónica de salicilatos e certas intoxicações (metanol, etc.) - 6 -
7 Alcalose metabólica: vómitos/aspiração gástrica, uso de diuréticos (não incluidos os poupadores de potássio) Acidose respiratória: paragem cárdio-respiratória, coma, DPCO, intoxicação por sedativos Alcalose respiratória: sépsis, tromboembolismo pulmonar, insuficiência hepática, intoxicação por salicilatos (fase inicial) Baseados nestes quadros clínicos, a obtenção dos gases no sangue pode dar o diagnóstico correcto na maior parte das situações. Raramente, os valores de ph, PaCO2 e HCO3 podem estar dentro dos limites da normalidade e mesmo assim haver alteração do equilíbrio ácido-base: é o caso das situações mistas (acidose respiratória e alcalose metabólica no mesmo doente, por ex.). 2. De que tipo de alteração primária se trata? Uma vez que se tenha chegado à conclusão que existe alteração do equilíbrio ácidobase, é fundamental caracterizá-la em metabólica ou respiratória (vide supra). Para isso, torna-se necessário estudar os valores do ph, da PaCO2 e do HCO3 dos gases do sangue, usando o quadro III para obtenção do diagnóstico inicial. Quadro III - Padrões de alterações primárias ácido-básicas ph [HCO3 - ]p meq/l PaCO2 mmhg Diagnóstico < 7,35 < 24 < 40 Acidose metabólica > 7,45 < 24 < 40 Alcalose respiratória < 7,35 > 24 > 40 Acidose respiratória > 7,45 > 24 > 40 Alcalose metabólica 3. Trata-se de alteração simples ou mista? A descrição inicial do transtorno ácido-base usando o quadro III nem sempre é correcta, porque pode estar-se em presença simultânea de mais do que um processo primário. Para o esclarecimento desta questão, há que estudar se as respostas secundárias (compensadoras) às alterações primárias do equilíbrio ácido
8 base são as que se encontrariam em condições normais. Estas respostas são bem previsíveis e estão definidas no quadro IV. Quadro IV - Regras para interpretação de alterações do equilíbrio ácido-base: compensações fisiológicas ALTERAÇÃO A-B Acidose metabólica Alcalose metabólica Acidose respiratória aguda Acidose respiratória crónica Alcalose respiratória aguda Alcalose respiratória crónica REGRA por cada meq de [HCO3 - ]p inferior a 24 meq/l, a PaCO2 deve baixar 1 a 1,5 mmhg por cada meq de [HCO3 - ]p superior a 24 meq/l, a PaCO2 deve subir 0,25 a 1 mmhg por cada 10 mmhg de PaCO2 superior a 40, a [HCO3 - ]p deve subir 1 meq/l por cada 10 mmhg de PaCO2 superior a 40, a [HCO3 - ]p deve subir 4 meq/l por cada 10 mmhg de PaCO2 inferior a 40, a [HCO3 - ]p deve baixar 1 a 3 meq/l (até um mínimo de 18 meq/l) por cada 10 mmhg de PaCO2 inferior a 40, a [HCO3 - ]p deve baixar 2 a 5 meq/l (até um mínimo de 14 meq/l) Ao aplicar este quadro (ou, em seu lugar, um nomograma baseado nas mesmas relações) deverão ter-se em mente vários pontos cruciais: 1. se as alterações do equilíbrio ácido-base forem de muito pequena amplitude, pode ser difícil a sua caracterização, já que os valores cairão dentro dos limites da normalidade; 2. o facto dos valores serem sobreponíveis aos calculados utilizando esta tabela, não nos dá garantia da existência de uma alteração simples; a clínica e restantes testes laboratoriais deverão confirmar o diagnóstico; 3. estes valores são baseados em estudos feitos em estados de equilíbrio, pelo que não se deverão aplicar tão directamente em situações de rápida evolução clínica (estados de não-equilíbrio)
9 4. Qual a etiologia da alteração ácido-básica encontrada? A lista de situações capazes de provocar alterações do equilíbrio ácido-base é muito extensa. Procuraremos incluir as situações mais frequentes, e também algumas raras, que são responsáveis por cada uma das quatro alterações principais do equilíbrio ácido-base. ACIDOSE METABÓLICA No diagnóstico diferencial da acidose metabólica o valor mais importante é o do hiato aniónico ("anion gap"). Este é calculado através da diferença entre a concentração de sódio no plasma e dos aniões mais importantes (cloretos e bicarbonato): A.G. = Na + - (Cl - + HCO3 - ) (Valor normal: 10 a 14 meq/l) Quadro V - Anion gap no diagnóstico diferencial da acidose metabólica A. Anion gap normal (acidose hiperclorémica): diarreia drogas inibidoras da anidrase carbónica acidoses tubulares renais (tipo 1, 2 e 4) insuficiência renal moderada (IFG> 20 ml/mn) insuficiência suprarenal doenças túbulo-intersticiais hiperalimentação parentérica B. Anion gap aumentado cetose diabética ou alcoólica, acidose láctica insuficiência renal aguda, insuficiência renal crónica terminal (IFG<10 ml/mn) intoxicações (salicilatos, etilenoglicol, metanol), rabdomiólise - 9 -
10 TRATAMENTO: como na maior parte das situações clínicas, o tratamento da acidose metabólica aguda deve ser etiológico, isto é, deve dirigir-se à correcção das causas que induziram a alteração do equilíbrio ácido-base (por exemplo: insulinoterápia e hidratação na cetocetose diabética). Estas medidas, no entanto, levam algum tempo a produzir o seu efeito máximo, pelo que quando o grau de acidémia plasmática é muito marcado (ph < 7,20) impõe-se correcção imediata: um doente com um ph inferior a 7,20 corre o risco de disritmias e de sofrer uma depressão marcada da função cardíaca com hipotensão e resistência à terapêutica vasopressora. O cálculo de administração de bicarbonato baseia-se na seguinte fórmula: DÉFICIT DE HCO3 (em meq/l) = ([HCO3]p desejada - [HCO3]p medida em meq/l) x (pêso em Kg) x 0,4 em que a [HCO3]p desejada é de meq/l (não se deve tentar alcançar os valores normais de [HCO3]p de imediato). A administração de bicarbonato de sódio deve ser por via e.v. utilizando os dois tipos de soluções ao nosso dispôr: uma solução isotónica a 1,4% (com uma concentração de 167 mmol/l de HCO3 - e Na + ), ou, no caso de haver contraindicação para administração de grandes volumes líquidos, uma solução hipertónica a 8,4% (com uma concentração de 1000 mmol/l de HCO3 - e Na + ). Deve infundir-se cerca de metade da dose calculada nas primeiras 3-4 horas (caso não haja insuficiência cardíaca) e o resto durante as 12 horas seguintes, parando quando o ph sérico atinge o valor de 7,20, e deixando os processos regulatórios do organismo normalizar progressivamente a concentração de H + do sangue. A decisão sobre a administração de doses ulteriores de bicarbonato deverá ser decidida na base de controle clínico e iónico periódicos. Não esquecer: 1) a alcalinização excessiva pode provocar tetania, convulsões, arritmias e produção aumentada de ácido láctico; 2) a correcção da acidémia sem correcção de um déficit de potássio concomitante pode induzir hipokaliémia grave (passagem de K + para o
11 espaço intra-celular), devendo iniciar-se suplementação de K + logo que a acidémia esteja parcialmente corrigida, com a concentração de K + sérico ainda dentro da normalidade, e 3) a concentração sérica de cálcio deve ser monitorizada e a hipocalcémia corrigida se necessário (nunca juntar no mesmo soro Ca ++ com HCO3 -, pelo risco de precipitação). ALCALOSE METABÓLICA No diagnóstico diferencial da alcalose metabólica, a concentração de cloretos na urina é o valor clinicamente mais útil: Quadro VI - Concentração de cloretos na urina em doentes com alcalose metabólica < 15 meq/l > 20 meq/l Vómitos Aspiração naso-gástrica Diuréticos Pós-hipercápnia Excesso de mineralocorticóides Sindromes de Cushing e de Bartter Administração de HCO3 Hipokaliémia (< 2 meq/l) TRATAMENTO: a alcalose metabólica aguda por deplecção de cloretos envolve, para além da correcção do mecanismo subjacente (parar a aspiração naso-gástrica, por exemplo), a correcção do déficit de K +, a administração de cloro e a correcção da [HCO3 - ]p. A correcção de K + obtém-se administrando este ião sob forma e.v. (10-60 meq em cada litro de soro) e/ou oral (comprimidos de 8 meq) sendo a rapidez de administração dependente da sua concentração sérica: se K + <2 meq com alterações do ECG, dar até 40 meq/hora em soluções não glucosadas; nas outras situações, dar 10 meq/hora e.v. mais suplementos orais, num total que não deve ser superior a 200 meq/dia
12 A administração de cloro é já parcialmente conseguida através do sal potássico (KCl), e também através de ClNa isotónico a 0,9% (154 mmol/l de Na + e Cl - ) ou hipertónico a 5% (855 mmol/l de Na + e Cl - ). No caso dos doentes em que a terapêutica com ClNa é contraindicada por excesso de volume intravascular, pode corrigir-se a alcalose utilizando a acetazolamida (LEDIAMOX ), em doses de mg per os ou e.v. de 8/8 horas. Perante uma alcalose metabólica severa (ph>7.60) por exemplo em doentes com encefalopatia hepática, arritmias, intoxicação digitálica, alterações do SNC e contraindicação à terapêutica parentérica com ClNa, dever-se-á iniciar terapêutica com ácido, utilizando uma infusão hipertónica de cloreto de amónio a 2% (contendo 374 meq de Cl - e de NH3 por litro). A quantidade teórica de ácido a infundir pode ser calculada através da seguinte fórmula: DÉFICIT DE H + (em meq/l) = ([HCO3]p medida - [HCO3]p desejada em meq/l) x (peso em Kg) x 0,5 A [HCO3]p desejada situa-se à volta dos meq/l, e deve ser corrigida apenas até se obter um valor mediano entre o medido e o desejado, deixando os mecanismos fisiológicos corrigir o resto. ACIDOSE RESPIRATÓRIA As causas de acidose respiratória podem, duma maneira geral, ser divididas em vários grupos, não havendo nenhum teste específico para a sua diferenciação: inibição do centro respiratório medular (intoxicações, paragem cardíaca), alterações da parede e dos músculos torácicos (cifoescoliose, polio, síndrome de Guillain- Barré), obstrução das vias aéreas (corpo estranho, laringoespasmo), alterações da difusão gasosa (DPCO, ARDS, edema pulmonar) e ventilação mecânica inapropriada. TRATAMENTO: o tratamento da acidose respiratória difere se esta fôr aguda ou se fôr crónica (em que os valores de po2 e pco2 estão crónicamente alterados), mas
13 em qualquer dos casos consiste na melhoria da ventilação pulmonar (com ou sem utilização da ventilação mecânica). A insuficiência respiratória define-se por critérios clínicos e gasimétricos: frequência respiratória < 10/mn ou > 35/mn e adejo nasal com uso dos músculos respiratórios acessórios, associado a PaO2 < 60 mmhg com FIO2 > 60%, ou PCO2 > 55 mmhg. A administração de bicarbonato nesta situação é contraindicada (visto o ph ser um estímulo importante para a respiração), e deve ser guardada para as situações em que existe acidose metabólica concomitante. ALCALOSE RESPIRATÓRIA A alcalose respiratória é provàvelmente a mais rara das 4 alterações principais do equilíbrio ácido-base e pode ser causada por situações que provocam hipoxémia (tromboembolismo pulmonar, insuficiência cardíaca congestiva, anemia grave, pneumonia intersticial), por doença pulmonar, por estimulação directa dos centros respiratórios medulares (sépsis, insuficiência hepática, AVC, histeria) e por uso indevido de ventilação mecânica. TRATAMENTO: em geral, a única terapêutica eficaz para a alcalose respiratória é a correcção da situação de base, e raramente é necessário tratamento urgente se o ph se mantiver inferior a Nos doentes com síndrome de ansiedade/hiperventilação e alcalose respiratória aguda, pode corrigir-se a hipocápnia (desde que não exista hipoxémia concomitante) fazendo o doente respirar para dentro de um saco de papel (provocando assim um aumento da FICO2)
14 III - REGRAS PRÁTICAS NO DIAGNÓSTICO DE ALTERAÇÕES DO EQUILÍBRIO ÁCIDO-BASE 1º. Obter simultâneamente ionograma do sangue venoso e gasimetria arterial. 2º. Comparar os valores de [HCO3 - ]p do ionograma (que é medido directamente) e dos gases no sangue (que é calculado pelo computador do aparelho utilizando a equação de Henderson-Hasselbalch, baseando-se nos valores medidos de ph e de PaCO2). Se houver diferença superior a 1-2 meq/l, calcular a [HCO3 - ]p dos gases do sangue, utilizando a equação de Henderson: [H + ] (neq/l) = PaCO2 (mm Hg) [HCO3 - ]p (meq/l) Para isso, dever-se-á converter o ph em [H + ], utilizando uma tabela própria ou, em alternativa, pode-se obter esta conversão utilizando a seguinte mnemónica: a um ph de 7,40 corresponde uma [H + ] de 40 neq/l; entre ph 7,20 e 7,50, cada mudança de 0,01 no ph corresponde uma mudança de [H + ] de 1 neq/l, na direcção oposta. Por ex.: a um ph de 7,41 corresponde uma [H + ] de 39, e a um ph de 7,39 corresponde uma [H + ] de 41 (e assim por diante). 3º. Calcular o "anion gap": [Na + ]p - ([Cl - ]p + [HCO3 - ]p) 4º. Calcular o grau de compensação que se espera encontrar, utilizando o quadro IV. 5º. Comparar a mudança da concentração sérica de Na + com Cl, o "anion gap" com a concentração sérica de bicarbonato e o Cl - com [HCO3 - ]p. 6º. Combinar os resultados dos cálculos efectuados com os dados clínicos. 7º. Decidir do tratamento da situação de base ou dos valores séricos (se extremos)
15 IV - BIBLIOGRAFIA Adrogué HJ, Madias NE. Management of life-threatening acid-base disorders. N Engl J Med 1998; 338: Adrogué HJ, Madias NE. Management of life-threatening acid-base disorders. N Engl J Med 1998; 338:26-34 Gluck SL. Acid-base. Lancet 1998; 352: Hekking M, Ulenkate HJLM, Speelberg B, Puyenbrock MJEV, Goldschmidt HMJ, Gelsema ES. A re-appraisal of the tri-axial chart for monitoring arterial acid-base values. Intensive Care Med 1998; 24: Hood VL, Tannen RL. Protection of acid-base balance by ph regulation of acid production. N Engl J Med 1998; 339: Rose BD, Post TW eds. Clinical Physiology of Acid-Base and Electrolyte Disorders. McGraw-Hill, 2001 Schrier RW ed. Renal and Electrolyte Disorders. Lippincott-Raven, 2003 Adrogué HJ et al. Assessing acid-base disorders. Kidney International 2009;76: Andreoli & Carpenter eds. Cecil s Essentials of Medicine. Saunders
VI SEMINÁRIO. Tema: BIOQUÍMICA DO EQUILÍBRIO ÁCIDO-BASE. Subtemas: Bioquímica do equilíbrio ácido-base Acidoses e alcaloses.
 EQUILÍBRIO ÁCIDOBASE Actas Bioq. 2007, 8: 185192 VI SEMINÁRIO Tema: BIOQUÍMICA DO EQUILÍBRIO ÁCIDOBASE Subtemas: Bioquímica do equilíbrio ácidobase Acidoses e alcaloses Intervenientes: Docentes convidados:
EQUILÍBRIO ÁCIDOBASE Actas Bioq. 2007, 8: 185192 VI SEMINÁRIO Tema: BIOQUÍMICA DO EQUILÍBRIO ÁCIDOBASE Subtemas: Bioquímica do equilíbrio ácidobase Acidoses e alcaloses Intervenientes: Docentes convidados:
Petr Soares de Alencar DISTÚRBIOS DO EQUILÍBRIO ÁCIDO BASE
 Petr Soares de Alencar DISTÚRBIOS DO EQUILÍBRIO ÁCIDO BASE GASOMETRIA ARTERIAL GASOMETRIA ARTERIAL Paciente com os seguintes valores na gasometria arterial: ph = 7,08; HCO - 3 = 10mEq/litro; PCO 2 = 35
Petr Soares de Alencar DISTÚRBIOS DO EQUILÍBRIO ÁCIDO BASE GASOMETRIA ARTERIAL GASOMETRIA ARTERIAL Paciente com os seguintes valores na gasometria arterial: ph = 7,08; HCO - 3 = 10mEq/litro; PCO 2 = 35
Profª Allana dos Reis Corrêa Enfermeira SAMU BH Mestranda em Enfermagem UFMG
 Gasometria Arterial Profª Allana dos Reis Corrêa Enfermeira SAMU BH Mestranda em Enfermagem UFMG Gasometria arterial Por quê a Gasometria se temos o Oxímetro de pulso e Capnógrafo? Gasometria Arterial
Gasometria Arterial Profª Allana dos Reis Corrêa Enfermeira SAMU BH Mestranda em Enfermagem UFMG Gasometria arterial Por quê a Gasometria se temos o Oxímetro de pulso e Capnógrafo? Gasometria Arterial
Disciplina de BIOQUÍMICA do Ciclo Básico de MEDICINA Universidade dos Açores 1º Ano ENSINO PRÁTICO 5ª AULA PRÁTICA
 Disciplina de BIOQUÍMICA do Ciclo Básico de MEDICINA Universidade dos Açores 1º Ano ENSINO PRÁTICO 5ª AULA PRÁTICA EQUILÍBRIO ÁCIDO-BASE NO ORGANISMO HUMANO REGULAÇÃO DA CONCENTRAÇÃO HIDROGENIÓNICA - IMPORTÂNCIA
Disciplina de BIOQUÍMICA do Ciclo Básico de MEDICINA Universidade dos Açores 1º Ano ENSINO PRÁTICO 5ª AULA PRÁTICA EQUILÍBRIO ÁCIDO-BASE NO ORGANISMO HUMANO REGULAÇÃO DA CONCENTRAÇÃO HIDROGENIÓNICA - IMPORTÂNCIA
Distúrbios do equilíbrio ácido básico. Fisiologia do equilíbrio ácido básico (6,80) 7,35 7,45 (7,80)
 Renato Ribeiro Nogueira Ferraz Mestre e Doutor em Nefrologia pela Universidade Federal de São Paulo UNIFESP, com Pós Doutorado também em Nefrologia pela mesma Universidade. Organizador do livro Nefrologia:
Renato Ribeiro Nogueira Ferraz Mestre e Doutor em Nefrologia pela Universidade Federal de São Paulo UNIFESP, com Pós Doutorado também em Nefrologia pela mesma Universidade. Organizador do livro Nefrologia:
21/07/14. Processos metabólicos. Conceitos Básicos. Respiração. Catabolismo de proteínas e ácidos nucleicos. Catabolismo de glicídios
 Prof. Dr. Adriano Bonfim Carregaro Medicina Veterinária FZEA USP www.anestesia.vet.br Processos metabólicos Respiração Catabolismo de proteínas e ácidos nucleicos Ácidos acético, sulfúrico, fosfórico e
Prof. Dr. Adriano Bonfim Carregaro Medicina Veterinária FZEA USP www.anestesia.vet.br Processos metabólicos Respiração Catabolismo de proteínas e ácidos nucleicos Ácidos acético, sulfúrico, fosfórico e
ph do sangue arterial = 7.4
 Regulação do Equilíbrio Ácido Base ph do sangue arterial = 7.4 < 6.9 ou > 7.7 = MORTE 1 Importância do ph nos processos biológicos Protonação ou desprotonação de radicais proteicos Variação da carga total
Regulação do Equilíbrio Ácido Base ph do sangue arterial = 7.4 < 6.9 ou > 7.7 = MORTE 1 Importância do ph nos processos biológicos Protonação ou desprotonação de radicais proteicos Variação da carga total
Distúrbios Ácido Básicos
 Distúrbios Ácido Básicos Prof. Vinicius Coca Fisioterapeuta Especialista em Pneumofuncional Mestre em Terapia Intensiva - SOBRATI Mestre em Ensino na Saúde - UGF Equilíbrio Acidobásico O Equilíbrio acidobásico
Distúrbios Ácido Básicos Prof. Vinicius Coca Fisioterapeuta Especialista em Pneumofuncional Mestre em Terapia Intensiva - SOBRATI Mestre em Ensino na Saúde - UGF Equilíbrio Acidobásico O Equilíbrio acidobásico
Faculdade de Medicina da Universidade de Coimbra Ano Lectivo 2011/2012. Unidade Curricular de BIOQUÍMICA I Mestrado Integrado em MEDICINA 1º Ano
 Faculdade de Medicina da Universidade de Coimbra Ano Lectivo 2011/2012 Unidade Curricular de BIOQUÍMICA I Mestrado Integrado em MEDICINA 1º Ano ENSINO PRÁTICO E TEORICOPRÁTICO 5ª AULA TEÓRICOPRÁTICA RESOLUÇÃO
Faculdade de Medicina da Universidade de Coimbra Ano Lectivo 2011/2012 Unidade Curricular de BIOQUÍMICA I Mestrado Integrado em MEDICINA 1º Ano ENSINO PRÁTICO E TEORICOPRÁTICO 5ª AULA TEÓRICOPRÁTICA RESOLUÇÃO
Lembrando. Ácidos são quaisquer substâncias capazes de ceder H+ Exemplos: ácido clorídrico, ácido lático, ácido úrico
 GASOMETRIA Lembrando Ácidos são quaisquer substâncias capazes de ceder H+ Exemplos: ácido clorídrico, ácido lático, ácido úrico Lembrando Bases são quaisquer substâncias capazes de captar H+ Exemplos:
GASOMETRIA Lembrando Ácidos são quaisquer substâncias capazes de ceder H+ Exemplos: ácido clorídrico, ácido lático, ácido úrico Lembrando Bases são quaisquer substâncias capazes de captar H+ Exemplos:
EXAMES COMPLEMENTARES GASOMETRIA GASOMETRIA ARTERIAL EQUILÍBRIO ÁCIDO - BÁSICO EQUILÍBRIO ÁCIDO - BÁSICO
 GASOMETRIA ARTERIAL EXAMES COMPLEMENTARES GASOMETRIA A gasometria arterial é um exame invasivo que mede as concentrações de oxigênio, a ventilação e o estado ácido-básico. Prof. Carlos Cezar I. S. Ovalle
GASOMETRIA ARTERIAL EXAMES COMPLEMENTARES GASOMETRIA A gasometria arterial é um exame invasivo que mede as concentrações de oxigênio, a ventilação e o estado ácido-básico. Prof. Carlos Cezar I. S. Ovalle
GASOMETRIA ARTERIAL- ARTIGO DE REVISÃO. interpretação
 TRABALHO DE CONCLUSÃO DE CURSO GASOMETRIA ARTERIAL- ARTIGO DE REVISÃO interpretação Dra Leticia Godoy Dias Sanderson Porto Ferreira, fevereiro 2012 Resumo O objetivo do estudo é identificar na literatura
TRABALHO DE CONCLUSÃO DE CURSO GASOMETRIA ARTERIAL- ARTIGO DE REVISÃO interpretação Dra Leticia Godoy Dias Sanderson Porto Ferreira, fevereiro 2012 Resumo O objetivo do estudo é identificar na literatura
Conceito de ph ph = - Log [H + ] Aumento [H + ] => diminuição do ph => acidose Diminuição [H + ] => aumento do ph => alcalose Alterações são dependent
![Conceito de ph ph = - Log [H + ] Aumento [H + ] => diminuição do ph => acidose Diminuição [H + ] => aumento do ph => alcalose Alterações são dependent Conceito de ph ph = - Log [H + ] Aumento [H + ] => diminuição do ph => acidose Diminuição [H + ] => aumento do ph => alcalose Alterações são dependent](/thumbs/50/27125458.jpg) Equilíbrio ácido-básico A concentração de H no FEC é mantida dentro de um limite extremamente estreito: 40 nmol/l = 1.000.000 menor que a Concentração dos outros íons!! [H] tem profundo efeito nos eventos
Equilíbrio ácido-básico A concentração de H no FEC é mantida dentro de um limite extremamente estreito: 40 nmol/l = 1.000.000 menor que a Concentração dos outros íons!! [H] tem profundo efeito nos eventos
DISTÚRBIO HIDRO- ELETROLÍTICO E ÁCIDO-BÁSICO. Prof. Fernando Ramos Gonçalves -Msc
 DISTÚRBIO HIDRO- ELETROLÍTICO E ÁCIDO-BÁSICO Prof. Fernando Ramos Gonçalves -Msc Distúrbio hidro-eletrolítico e ácido-básico Distúrbios da regulação da água; Disnatremias; Alterações do potássio; Acidoses
DISTÚRBIO HIDRO- ELETROLÍTICO E ÁCIDO-BÁSICO Prof. Fernando Ramos Gonçalves -Msc Distúrbio hidro-eletrolítico e ácido-básico Distúrbios da regulação da água; Disnatremias; Alterações do potássio; Acidoses
SISTEMA TAMPÃO NOS ORGANISMOS ANIMAIS
 SISTEMA TAMPÃO NOS ORGANISMOS ANIMAIS Regulação do Equilíbrio Ácido-Básico ph = Potencial Hidrogeniônico Concentração de H + Quanto mais ácida uma solução maior sua concentração de H + e menor o seu ph
SISTEMA TAMPÃO NOS ORGANISMOS ANIMAIS Regulação do Equilíbrio Ácido-Básico ph = Potencial Hidrogeniônico Concentração de H + Quanto mais ácida uma solução maior sua concentração de H + e menor o seu ph
Alterações do equilíbrio hídrico Alterações do equilíbrio hídrico Desidratação Regulação do volume hídrico
 Regulação do volume hídrico Alteração do equilíbrio hídrico em que a perda de líquidos do organismo é maior que o líquido ingerido Diminuição do volume sanguíneo Alterações do equilíbrio Hídrico 1. Consumo
Regulação do volume hídrico Alteração do equilíbrio hídrico em que a perda de líquidos do organismo é maior que o líquido ingerido Diminuição do volume sanguíneo Alterações do equilíbrio Hídrico 1. Consumo
Equilíbrio ácido-básico. Monitor: Tarcísio Alves Teixeira Professor: Guilherme Soares Fisiologia Veterinária / MFL / IB / UFF
 Equilíbrio ácido-básico Monitor: Tarcísio Alves Teixeira Professor: Guilherme Soares Fisiologia Veterinária / MFL / IB / UFF O que são Ácidos e Bases Ácido: substância que, em solução, é capaz de doar
Equilíbrio ácido-básico Monitor: Tarcísio Alves Teixeira Professor: Guilherme Soares Fisiologia Veterinária / MFL / IB / UFF O que são Ácidos e Bases Ácido: substância que, em solução, é capaz de doar
Hidroclorotiazida. Diurético - tiazídico.
 Hidroclorotiazida Diurético - tiazídico Índice 1. Definição 2. Indicação 3. Posologia 4. Contraindicação 5. Interação medicamentosa 1. Definição A Hidroclorotiazida age diretamente sobre os rins atuando
Hidroclorotiazida Diurético - tiazídico Índice 1. Definição 2. Indicação 3. Posologia 4. Contraindicação 5. Interação medicamentosa 1. Definição A Hidroclorotiazida age diretamente sobre os rins atuando
ALCALOSES 1. Introdução HA H + +A -.
 ALCALOSES 1 Introdução Acidose e alcalose referem-se aos mecanismos fisiopatológicos que causam acúmulo de ácido ou base no organismo. Os termos acidemia e alcalemia referem-se ao ph no fluido extracelular.
ALCALOSES 1 Introdução Acidose e alcalose referem-se aos mecanismos fisiopatológicos que causam acúmulo de ácido ou base no organismo. Os termos acidemia e alcalemia referem-se ao ph no fluido extracelular.
Tampão. O que é? MISTURA DE UM ÁCIDO FRACO COM SUA BASE CONJUGADA, QUE ESTABILIZA O P H DE UMA SOLUÇÃO
 Tampões biológicos Relembrar os conceitos de ácido e base (Brönsted-Lowry), ph, pka; Compreender a importância do ph na manutenção da estrutura tridimensional das biomoléculas; Conhecer os valores de ph
Tampões biológicos Relembrar os conceitos de ácido e base (Brönsted-Lowry), ph, pka; Compreender a importância do ph na manutenção da estrutura tridimensional das biomoléculas; Conhecer os valores de ph
BIOQUÍMICA II SISTEMAS TAMPÃO NOS ORGANISMOS ANIMAIS 3/1/2012
 BIOQUÍMICA II Professora: Ms. Renata Fontes Medicina Veterinária 3º Período O conteúdo de Bioquímica II utiliza os conhecimentos adquiridos referentes ao estudo do metabolismo celular e fenômenos físicos
BIOQUÍMICA II Professora: Ms. Renata Fontes Medicina Veterinária 3º Período O conteúdo de Bioquímica II utiliza os conhecimentos adquiridos referentes ao estudo do metabolismo celular e fenômenos físicos
TRANSTORNOS ÁCIDOS-BÁSICOS
 TRANSTORNOS ÁCIDOS-BÁSICOS Marcos Mendes Disciplina de Fisiologia FMABC Conceitos ph = 7,40 0,04 (compatível com a vida 6,8 a 7,8) ph < 7,36 ACIDEMIA ph > 7,44 ALCALEMIA pco2 (a) = (40 4) mmhg TRANST.
TRANSTORNOS ÁCIDOS-BÁSICOS Marcos Mendes Disciplina de Fisiologia FMABC Conceitos ph = 7,40 0,04 (compatível com a vida 6,8 a 7,8) ph < 7,36 ACIDEMIA ph > 7,44 ALCALEMIA pco2 (a) = (40 4) mmhg TRANST.
GASOMETRIA ph E GASES SANGUÍNEOS
 GASOMETRIA ph E GASES SANGUÍNEOS CBHPM 4.03.0.01-6 AMB 8.01.096-5 CBHPM 4.14.01.16-6 Sinonímia: Gasometria de Siggaard-Andersen. Teste de exercício em ergômetro com realização de gasometria arterial. Gasometria
GASOMETRIA ph E GASES SANGUÍNEOS CBHPM 4.03.0.01-6 AMB 8.01.096-5 CBHPM 4.14.01.16-6 Sinonímia: Gasometria de Siggaard-Andersen. Teste de exercício em ergômetro com realização de gasometria arterial. Gasometria
INSUFICIÊNCIA RESPIRATÓRIA
 Clínica Médica e Cirúrgica I INSUFICIÊNCIA RESPIRATÓRIA João Adriano de Barros Disciplina de Pneumologia Universidade Federal do Paraná Objetivos da Aula... Importância da IRA devido a sua alta mortalidade
Clínica Médica e Cirúrgica I INSUFICIÊNCIA RESPIRATÓRIA João Adriano de Barros Disciplina de Pneumologia Universidade Federal do Paraná Objetivos da Aula... Importância da IRA devido a sua alta mortalidade
Ácidos, bases e sistemas tampão
 Ácidos, bases e sistemas tampão Ionização da água A água pura tem uma baixa concentração de iões hidrónio (H 3 O + ) e uma igual concentração de iões hidróxido (OH - ) Os ácidos são dadores de protões
Ácidos, bases e sistemas tampão Ionização da água A água pura tem uma baixa concentração de iões hidrónio (H 3 O + ) e uma igual concentração de iões hidróxido (OH - ) Os ácidos são dadores de protões
Reconhecendo os agravos clínicos em urgência e emergência. Prof.º Enfº. Diógenes Trevizan
 Reconhecendo os agravos clínicos em urgência e emergência Prof.º Enfº. Diógenes Trevizan Cuidando do cliente com agravos respiratórios em urgência e emergência Introdução Em atenção às urgências, a insuficiência
Reconhecendo os agravos clínicos em urgência e emergência Prof.º Enfº. Diógenes Trevizan Cuidando do cliente com agravos respiratórios em urgência e emergência Introdução Em atenção às urgências, a insuficiência
Fisiologia do Sistema Urinário
 Sistema Urinário Fisiologia do Sistema Urinário Funções do sistema urinário Anatomia fisiológica do aparelho urinário Formação de urina pelos rins Filtração glomerular Reabsorção e secreção tubular Equilíbrio
Sistema Urinário Fisiologia do Sistema Urinário Funções do sistema urinário Anatomia fisiológica do aparelho urinário Formação de urina pelos rins Filtração glomerular Reabsorção e secreção tubular Equilíbrio
Manutenção do ph do sangue
 Manutenção do ph do sangue Muitos dos fluidos biológicos, quer no interior, quer no exterior das células, apresentam intervalos de ph muito apertados, ou seja um valor de ph praticamente constante, uma
Manutenção do ph do sangue Muitos dos fluidos biológicos, quer no interior, quer no exterior das células, apresentam intervalos de ph muito apertados, ou seja um valor de ph praticamente constante, uma
98% intracelular extracelular
 DISTRIBUIÇÃO CORPORAL DE 98% intracelular extracelular 2% HOMEOSTASE DE POTÁSSIO BALANÇO EXTERNO vs BALANÇO INTERNO BALANÇO INTERNO BALANÇO EXTERNO HOMEOSTASE DE POTÁSSIO BALANÇO EXTERNO vs BALANÇO INTERNO
DISTRIBUIÇÃO CORPORAL DE 98% intracelular extracelular 2% HOMEOSTASE DE POTÁSSIO BALANÇO EXTERNO vs BALANÇO INTERNO BALANÇO INTERNO BALANÇO EXTERNO HOMEOSTASE DE POTÁSSIO BALANÇO EXTERNO vs BALANÇO INTERNO
Profa Maria Clorinda EV/UFG
 Escola de Veterinária e Zootecnia da UFG Departamento de Medicina Veterinária Maria Clorinda Soares Fioravanti (clorinda@vet.ufg.br) Disciplina: Clínica Médica de Pequenos Animais Profa Maria Clorinda
Escola de Veterinária e Zootecnia da UFG Departamento de Medicina Veterinária Maria Clorinda Soares Fioravanti (clorinda@vet.ufg.br) Disciplina: Clínica Médica de Pequenos Animais Profa Maria Clorinda
Homeostase do potássio, cálcio e fosfato
 Homeostase do potássio, cálcio e fosfato Regulação dos eletrólitos Homeostase do potássio Intracellular ADP ATP P Extracellular Hipocalemia: baixo Repolarização mais lenta do potencial de membrana. - Fraqueza
Homeostase do potássio, cálcio e fosfato Regulação dos eletrólitos Homeostase do potássio Intracellular ADP ATP P Extracellular Hipocalemia: baixo Repolarização mais lenta do potencial de membrana. - Fraqueza
Considerações Gerais sobre Hemogasometria
 Considerações Gerais sobre Hemogasometria Exame hemogasométrico Grande importância na avaliação do equilíbrio ácido-básico Diagnóstico e prognóstico de inúmeras enfermidades Cuidados importantes para obtenção
Considerações Gerais sobre Hemogasometria Exame hemogasométrico Grande importância na avaliação do equilíbrio ácido-básico Diagnóstico e prognóstico de inúmeras enfermidades Cuidados importantes para obtenção
HOSPITAL PEDIÁTRICO de COIMBRA Protocolos do Serviço de Urgência REHIDRATAÇÃO em PEDIATRIA
 HOSPITAL PEDIÁTRICO de COIMBRA Protocolos do Serviço de Urgência REHIDRATAÇÃO em PEDIATRIA 1 ETAPAS FUNDAMENTAIS ❶ - Reparação das perdas ❷ - Compensação das perdas persistentes ❸ - Manutenção - PESAR
HOSPITAL PEDIÁTRICO de COIMBRA Protocolos do Serviço de Urgência REHIDRATAÇÃO em PEDIATRIA 1 ETAPAS FUNDAMENTAIS ❶ - Reparação das perdas ❷ - Compensação das perdas persistentes ❸ - Manutenção - PESAR
ph arterial entre 7,35 e 7,45 [H+] ~ 40 nanomoles/l (10-9) CO2 (Ácido volátil) O CO 2 não se acumula no organismo, é eliminado pelos pulmões
![ph arterial entre 7,35 e 7,45 [H+] ~ 40 nanomoles/l (10-9) CO2 (Ácido volátil) O CO 2 não se acumula no organismo, é eliminado pelos pulmões ph arterial entre 7,35 e 7,45 [H+] ~ 40 nanomoles/l (10-9) CO2 (Ácido volátil) O CO 2 não se acumula no organismo, é eliminado pelos pulmões](/thumbs/60/44575873.jpg) Regulação do ph dos líquidos Regulação do ph dos líquidos ph = log[ ] LEC =, ±, (, mm) ph , Alcalose Ojetivo: Manutenção do ph sistêmico na faixa de normalidade. ph arterial entre, e, [H]
Regulação do ph dos líquidos Regulação do ph dos líquidos ph = log[ ] LEC =, ±, (, mm) ph , Alcalose Ojetivo: Manutenção do ph sistêmico na faixa de normalidade. ph arterial entre, e, [H]
D) Como seria a correção desse distúrbio? A correção seria atuar na causa e proporcionar eliminação de CO2 por aumento da ventilação alveolar.
 Exercícios de Gasometria Arterial - Gabarito Docente responsável: Profª Paula C Nogueira Para as situações abaixo, responda às seguintes questões: Considere os seguintes valores de referência: ph: 7,35-7,45
Exercícios de Gasometria Arterial - Gabarito Docente responsável: Profª Paula C Nogueira Para as situações abaixo, responda às seguintes questões: Considere os seguintes valores de referência: ph: 7,35-7,45
TROCAS GASOSAS TRANSPORTE DE O 2 E CO 2 FUNÇOES DA HEMOGLOBINA QUÍMICA DA RESPIRAÇÃO. Profa. Dra. Celene Fernandes Bernardes
 TROCAS GASOSAS TRANSPORTE DE O 2 E CO 2 FUNÇOES DA HEMOGLOBINA QUÍMICA DA RESPIRAÇÃO Profa. Dra. Celene Fernandes Bernardes Plasma sanguíneo ph normal Acidose Alcalose Líquido extracelular Sangue arterial
TROCAS GASOSAS TRANSPORTE DE O 2 E CO 2 FUNÇOES DA HEMOGLOBINA QUÍMICA DA RESPIRAÇÃO Profa. Dra. Celene Fernandes Bernardes Plasma sanguíneo ph normal Acidose Alcalose Líquido extracelular Sangue arterial
PROTOCOLO MÉDICO MANEJO DO RECÉM-NASCIDO NOS PRIMEIROS DIAS DE VIDA
 Página: 1 de 8 1.Introdução: Sabendo-se que: * A grande proporção de água extracelular nos RN pré-termo dificulta ainda mais a manutenção de seu equilíbrio hídrico. * A reabsorção tubular do sódio está
Página: 1 de 8 1.Introdução: Sabendo-se que: * A grande proporção de água extracelular nos RN pré-termo dificulta ainda mais a manutenção de seu equilíbrio hídrico. * A reabsorção tubular do sódio está
UNIVERSIDADE FEDERAL DO CEARÁ PROGRAMA DE ENSINO TUTORIAL (PET) FACULDADE DE MEDICINA DISTÚRBIO HIDROELETROLÍTICO E ÁCIDO-BÁSICO
 UNIVERSIDADE FEDERAL DO CEARÁ PROGRAMA DE ENSINO TUTORIAL (PET) FACULDADE DE MEDICINA DISTÚRBIO HIDROELETROLÍTICO E ÁCIDO-BÁSICO Petiano(a): Flora Cruz de Almeida ÁGUA CORPORAL Sexo - Homem: 60% - Mulher:
UNIVERSIDADE FEDERAL DO CEARÁ PROGRAMA DE ENSINO TUTORIAL (PET) FACULDADE DE MEDICINA DISTÚRBIO HIDROELETROLÍTICO E ÁCIDO-BÁSICO Petiano(a): Flora Cruz de Almeida ÁGUA CORPORAL Sexo - Homem: 60% - Mulher:
Homeostase do ph. Ácidos e Bases. HA H + + A - HCl H + + Cl - H 2 CO 3 H + + HCO H + + NH 3. Escala de ph
 Frederico Gueiros Filho Formação: Bacharelado em Biologia - UERJ Mestrado em Genética - UFRJ Doutorado - Harvard Medical School - EUA Pós-doutorado - Harvard, Depto. MCB - EUA Interesse de pesquisa: Mecanismo
Frederico Gueiros Filho Formação: Bacharelado em Biologia - UERJ Mestrado em Genética - UFRJ Doutorado - Harvard Medical School - EUA Pós-doutorado - Harvard, Depto. MCB - EUA Interesse de pesquisa: Mecanismo
Eletrólitos na Nutrição Parenteral
 Unesp Eletrólitos na Nutrição Parenteral Sergio A R Paiva Complicações da NP Mecânicas Infecciosas Distúrbios metabólicos Complicações da NP Mecânicas Infecciosas Distúrbios metabólicos Complicações da
Unesp Eletrólitos na Nutrição Parenteral Sergio A R Paiva Complicações da NP Mecânicas Infecciosas Distúrbios metabólicos Complicações da NP Mecânicas Infecciosas Distúrbios metabólicos Complicações da
Aula-8Gasometria Arterial. Profª Tatiani
 Aula-8Gasometria Arterial Profª Tatiani Gasometria Arterial A gasometria arterial é um exame invasivo que mede as concentrações de oxigênio, a ventilação e o estado ácido-básico. Tipicamente, os valores
Aula-8Gasometria Arterial Profª Tatiani Gasometria Arterial A gasometria arterial é um exame invasivo que mede as concentrações de oxigênio, a ventilação e o estado ácido-básico. Tipicamente, os valores
Impact Factor: 1,75. Gabriela Bueno Luz Maria Amélia A. Weiller Vinicius Copes
 Impact Factor: 1,75 Gabriela Bueno Luz Maria Amélia A. Weiller Vinicius Copes Fósforo Função estrutural em tecidos Metabolismo de células Rigidez óssea Equilíbrio ácido-base DNA e RNA Algumas definições
Impact Factor: 1,75 Gabriela Bueno Luz Maria Amélia A. Weiller Vinicius Copes Fósforo Função estrutural em tecidos Metabolismo de células Rigidez óssea Equilíbrio ácido-base DNA e RNA Algumas definições
Biofísica renal. Estrutura e função dos rins
 Biofísica renal Estrutura e função dos rins Múltiplas funções do sistema renal Regulação do balanço hídrico e eletrolítico (volume e osmolaridade) Regulação do equilíbrio ácidobásico (ph) Excreção de produtos
Biofísica renal Estrutura e função dos rins Múltiplas funções do sistema renal Regulação do balanço hídrico e eletrolítico (volume e osmolaridade) Regulação do equilíbrio ácidobásico (ph) Excreção de produtos
3) Complicações agudas do diabetes
 73 3) Complicações agudas do diabetes Hiperglicemias As emergências hiperglicêmicas do diabetes melitus são classificadas em: cetoacidose diabética (CAD) e estado hiperglicêmico hiperosmolar (EHH), que
73 3) Complicações agudas do diabetes Hiperglicemias As emergências hiperglicêmicas do diabetes melitus são classificadas em: cetoacidose diabética (CAD) e estado hiperglicêmico hiperosmolar (EHH), que
ESTUDO DIRIGIDO SOBRE FISIOLOGIA RENAL. Abaixo, encontram-se os pontos que precisam ser estudados na área de Fisiologia Renal.
 1 ESTUDO DIRIGIDO SOBRE FISIOLOGIA RENAL Abaixo, encontram-se os pontos que precisam ser estudados na área de Fisiologia Renal. Anatomia funcional do rim As diferenças entre a circulação cortical e medular
1 ESTUDO DIRIGIDO SOBRE FISIOLOGIA RENAL Abaixo, encontram-se os pontos que precisam ser estudados na área de Fisiologia Renal. Anatomia funcional do rim As diferenças entre a circulação cortical e medular
Alterações às secções relevantes do resumo das características do medicamento e do folheto informativo
 Anexo III Alterações às secções relevantes do resumo das características do medicamento e do folheto informativo Nota: Estas alterações das secções relevantes do resumos das carcterísticas do medicamento
Anexo III Alterações às secções relevantes do resumo das características do medicamento e do folheto informativo Nota: Estas alterações das secções relevantes do resumos das carcterísticas do medicamento
Fisioterapia em Terapia Intensiva
 Ácidos e Bases Fisioterapia em Terapia Intensiva ÁCIDO moléculas que contem átomos de hidrogênio capazes de liberar íons de hidrogênio. HCl H + + Cl BASE molécula que pode aceitar um íon de hidrogênio
Ácidos e Bases Fisioterapia em Terapia Intensiva ÁCIDO moléculas que contem átomos de hidrogênio capazes de liberar íons de hidrogênio. HCl H + + Cl BASE molécula que pode aceitar um íon de hidrogênio
Desequilíbrio Hidroeletrolítico. Prof.º Enfº. Esp. Diógenes Trevizan
 Desequilíbrio Hidroeletrolítico Prof.º Enfº. Esp. Diógenes Trevizan Muitos pacientes que dão entrada na unidade de atendimento de urgência podem ter o equilíbrio hidroeletrolítico comprometido em função
Desequilíbrio Hidroeletrolítico Prof.º Enfº. Esp. Diógenes Trevizan Muitos pacientes que dão entrada na unidade de atendimento de urgência podem ter o equilíbrio hidroeletrolítico comprometido em função
Como interpretar a Gasometria de Sangue Arterial
 Como interpretar a Gasometria de Sangue Arterial Sequência de interpretação e estratificação de risco 08/01/2013 Daniela Carvalho Objectivos da Tertúlia Sequência de interpretação da GSA - Método dos 3
Como interpretar a Gasometria de Sangue Arterial Sequência de interpretação e estratificação de risco 08/01/2013 Daniela Carvalho Objectivos da Tertúlia Sequência de interpretação da GSA - Método dos 3
Drogas que atuam no sistema cardiovascular, respiratório e urinário
 Drogas que atuam no sistema cardiovascular, respiratório e urinário Drogas que atuam no sistema cardiovascular As principais classes terapêuticas: 1. Antihipertensivos 2. Antiarrítmicos 3. Antianginosos
Drogas que atuam no sistema cardiovascular, respiratório e urinário Drogas que atuam no sistema cardiovascular As principais classes terapêuticas: 1. Antihipertensivos 2. Antiarrítmicos 3. Antianginosos
Classificação. Diuréticos Tiazídicos Hidroclorotiazida Diuréticos de Alça Furosemida Diuréticos Poupadores de Potássio Espironolactona e Amilorida
 Diuréticos Classificação Diuréticos Tiazídicos Hidroclorotiazida Diuréticos de Alça Furosemida Diuréticos Poupadores de Potássio Espironolactona e Amilorida Diuréticos Tiazídicos Hidroclorotiazida Hidroclorotiazida:
Diuréticos Classificação Diuréticos Tiazídicos Hidroclorotiazida Diuréticos de Alça Furosemida Diuréticos Poupadores de Potássio Espironolactona e Amilorida Diuréticos Tiazídicos Hidroclorotiazida Hidroclorotiazida:
FISIOLOGIA GERAL INTRODUÇÃO
 FISIOLOGIA GERAL INTRODUÇÃO FISIOLOGIA Fisiologia (do grego physis = natureza, função ou funcionamento; e logos =estudo) A fisiologia: - estuda as funções mecânicas, físicas e bioquímicas nos seres vivos.
FISIOLOGIA GERAL INTRODUÇÃO FISIOLOGIA Fisiologia (do grego physis = natureza, função ou funcionamento; e logos =estudo) A fisiologia: - estuda as funções mecânicas, físicas e bioquímicas nos seres vivos.
Fisiologia Renal. Mecanismos tubulares I ESQUEMAS SOBRE FISIOLOGIA RENAL. Profa. Ms Ana Maria da Silva Curado Lins Universidade Católica de Goiás
 ESQUEMAS SOBRE FISIOLOGIA RENAL. Mecanismos tubulares I Fisiologia Renal Profa. Ms Ana Maria da Silva Curado Lins Universidade Católica de Goiás Mecanismos de manipulação do filtrado pelos túbulos renais:
ESQUEMAS SOBRE FISIOLOGIA RENAL. Mecanismos tubulares I Fisiologia Renal Profa. Ms Ana Maria da Silva Curado Lins Universidade Católica de Goiás Mecanismos de manipulação do filtrado pelos túbulos renais:
Tetania da. Lactação e das. Pastagens
 Tetania da Lactação e das Pastagens Tetania da Lactação e das Pastagens Hipomagnesemia Conjunto de fatores: Desequilíbrio da ingestão e excreção de Mg Estresse - esteróides endógenos Cátions com ação neuromuscular
Tetania da Lactação e das Pastagens Tetania da Lactação e das Pastagens Hipomagnesemia Conjunto de fatores: Desequilíbrio da ingestão e excreção de Mg Estresse - esteróides endógenos Cátions com ação neuromuscular
Regulação renal do equilíbrio ácido base
 Universidade de São Paulo Faculdade de Medicina de Ribeirão Preto Informática Biomédica Regulação renal do equilíbrio ácido base Gabriela Silva Borges O que é ácido e base? Função Química conjunto de compostos
Universidade de São Paulo Faculdade de Medicina de Ribeirão Preto Informática Biomédica Regulação renal do equilíbrio ácido base Gabriela Silva Borges O que é ácido e base? Função Química conjunto de compostos
Embalagens de 20, 60 e 100 comprimidos de libertação modificada
 Acalka (Citrato de Potássio) Embalagens de 20, 60 e 100 comprimidos de libertação modificada Cada comprimido contém como princípio activo 1080 mg de citrato de potássio (equivalente a 10 meq de potássio).
Acalka (Citrato de Potássio) Embalagens de 20, 60 e 100 comprimidos de libertação modificada Cada comprimido contém como princípio activo 1080 mg de citrato de potássio (equivalente a 10 meq de potássio).
Balanço Eletrolítico e Equilíbrio Ácido-Base
 Balanço Eletrolítico e Equilíbrio Ácido-Base Junio Flávio Barroso DSM Nutritional Products Realização Balanço Eletrolítico e Equilíbrio Ácido-Base Agenda: -O que é BE? -Cálculo do BE: -Níveis de BE: -Equilíbrio
Balanço Eletrolítico e Equilíbrio Ácido-Base Junio Flávio Barroso DSM Nutritional Products Realização Balanço Eletrolítico e Equilíbrio Ácido-Base Agenda: -O que é BE? -Cálculo do BE: -Níveis de BE: -Equilíbrio
Sistema Respiratório. Superior. Língua. Inferior
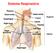 Sistema Respiratório Língua Superior Inferior Funções 1. Troca de gases entre a atmosfera e o sangue. 2. Regulação homeostática do ph corporal 3. Proteção contra substâncias irritantes e patógenos 4. Vocalização
Sistema Respiratório Língua Superior Inferior Funções 1. Troca de gases entre a atmosfera e o sangue. 2. Regulação homeostática do ph corporal 3. Proteção contra substâncias irritantes e patógenos 4. Vocalização
Bicarbonato de Sódio 8,4% Forma farmacêutica:solução injetável
 Bicarbonato de Sódio 8,4% Forma farmacêutica:solução injetável MODELO DE BULA bicarbonato de sódio Forma farmacêutica e apresentações: Solução injetável. bicarbonato de sódio 8,4%: solução em frasco de
Bicarbonato de Sódio 8,4% Forma farmacêutica:solução injetável MODELO DE BULA bicarbonato de sódio Forma farmacêutica e apresentações: Solução injetável. bicarbonato de sódio 8,4%: solução em frasco de
Lesão Renal Aguda. Revista Qualidade HC. Autores e Afiliação: Área: Objetivos: Definição / Quadro Clínico:
 Lesão Renal Aguda Autores e Afiliação: Caio Pereira Miarelli. Ex-Médico Residente Cínica Médica do HCFMRP USP; Dr. Gustavo Frezza. Médico Assistente da Divisão de Nefrologia; Dra. Valéria Takeuchi Okino.
Lesão Renal Aguda Autores e Afiliação: Caio Pereira Miarelli. Ex-Médico Residente Cínica Médica do HCFMRP USP; Dr. Gustavo Frezza. Médico Assistente da Divisão de Nefrologia; Dra. Valéria Takeuchi Okino.
FARMACOLOGIA. Aula 11 Continuação da aula anterior Rim Diuréticos Antidiuréticos Modificadores do transporte tubular ANTIGOTOSOS
 FARMACOLOGIA Aula 11 Continuação da aula anterior Rim Diuréticos Antidiuréticos Modificadores do transporte tubular ANTIGOTOSOS RIM RIM RIM Filtra perto de 150 litros por dia! Após secreção e reabsorção
FARMACOLOGIA Aula 11 Continuação da aula anterior Rim Diuréticos Antidiuréticos Modificadores do transporte tubular ANTIGOTOSOS RIM RIM RIM Filtra perto de 150 litros por dia! Após secreção e reabsorção
Universidade Federal de Pelotas Núcleo de Pesquisa, Ensino e Extensão em Pecuária. Pelotas, 11 de novembro de 2015
 Universidade Federal de Pelotas Núcleo de Pesquisa, Ensino e Extensão em Pecuária Pelotas, 11 de novembro de 2015 Carlos Loures Pires Josiane de Oliveira Feijó Escolha do artigo Cálcio Homeostase Hormônios
Universidade Federal de Pelotas Núcleo de Pesquisa, Ensino e Extensão em Pecuária Pelotas, 11 de novembro de 2015 Carlos Loures Pires Josiane de Oliveira Feijó Escolha do artigo Cálcio Homeostase Hormônios
Testes de Consumo máximo de Oxigênio (Vo 2 máx) Fisiologia Do Esforço Prof.Dra. Bruna Oneda 2016
 Testes de Consumo máximo de Oxigênio (Vo 2 máx) Fisiologia Do Esforço Prof.Dra. Bruna Oneda 2016 Tamponamento Substâncias que se dissociam em solução e liberam H + são denominadas ácidos Compostos que
Testes de Consumo máximo de Oxigênio (Vo 2 máx) Fisiologia Do Esforço Prof.Dra. Bruna Oneda 2016 Tamponamento Substâncias que se dissociam em solução e liberam H + são denominadas ácidos Compostos que
Diuréticos. Classificação da diurese. FUNÇÕES RENAIS A manutenção do meio interno através s da: Secreção de hormônios. Excreção de drogas
 Diuréticos Os diuréticos são fármacos f que tem a propriedade de causar Diuréticos aumento do volume urinário rio e cujo mecanismo é a inibição da reabsorção tubular de sódio s e água. Prof. Carlos Cezar
Diuréticos Os diuréticos são fármacos f que tem a propriedade de causar Diuréticos aumento do volume urinário rio e cujo mecanismo é a inibição da reabsorção tubular de sódio s e água. Prof. Carlos Cezar
Rui Marques dos Santos
 Rui Marques dos Santos Doente Urgente Abordagem do doente crítico Doente Terminal Doente em fase terminal Morte Tempo é o factor crítico Avaliação do doente com doença aguda implica Não um diagnóstico
Rui Marques dos Santos Doente Urgente Abordagem do doente crítico Doente Terminal Doente em fase terminal Morte Tempo é o factor crítico Avaliação do doente com doença aguda implica Não um diagnóstico
Disciplina de BIOQUÍMICA do Ciclo Básico de MEDICINA Universidade dos Açores 1º Ano ENSINO PRÁTICO 4ª AULA PRÁTICA
 Disciplina de BIOQUÍMICA do Ciclo Básico de MEDICINA Universidade dos Açores 1º Ano ENSINO PRÁTICO 4ª AULA PRÁTICA CONCEITO DE SOLUÇÕES TAMPÃO, ph E pk 1. Conceito de soluções tampão (ph e pk) 2. Principais
Disciplina de BIOQUÍMICA do Ciclo Básico de MEDICINA Universidade dos Açores 1º Ano ENSINO PRÁTICO 4ª AULA PRÁTICA CONCEITO DE SOLUÇÕES TAMPÃO, ph E pk 1. Conceito de soluções tampão (ph e pk) 2. Principais
Cetoacidose Diabética
 Cetoacidose Diabética Introdução A Cetoacidose diabética (CAD) é a complicação aguda do Diabetes Mellitus mais clássica e, embora não seja a mais comum (perde para hipoglicemia), é de longe a mais cobrada
Cetoacidose Diabética Introdução A Cetoacidose diabética (CAD) é a complicação aguda do Diabetes Mellitus mais clássica e, embora não seja a mais comum (perde para hipoglicemia), é de longe a mais cobrada
PROCESSO-CONSULTA CFM Nº 25/2017 PARECER CFM Nº 25/2018 INTERESSADOS: I.M.S. R.S.R.
 PROCESSO-CONSULTA CFM Nº 25/2017 PARECER CFM Nº 25/2018 INTERESSADOS: I.M.S. R.S.R. ASSUNTO: RELATOR: Diagnóstico de morte encefálica. Teste de apneia. Cons. Hideraldo Luis Souza Cabeça EMENTA: No diagnóstico
PROCESSO-CONSULTA CFM Nº 25/2017 PARECER CFM Nº 25/2018 INTERESSADOS: I.M.S. R.S.R. ASSUNTO: RELATOR: Diagnóstico de morte encefálica. Teste de apneia. Cons. Hideraldo Luis Souza Cabeça EMENTA: No diagnóstico
Status Epilepticus. Neurologia - FEPAR. Neurofepar Dr. Carlos Caron
 Status Epilepticus Neurologia - FEPAR Neurofepar Dr. Carlos Caron Classificação das Epilepsias n Status Epilepticus: Definição Crise epiléptica com duração de pelo menos 5 minutos. Duas ou mais crises
Status Epilepticus Neurologia - FEPAR Neurofepar Dr. Carlos Caron Classificação das Epilepsias n Status Epilepticus: Definição Crise epiléptica com duração de pelo menos 5 minutos. Duas ou mais crises
MECANISMOS DE ACIDIFICAÇÃO URINÁRIA. Carlos Balda UNIFESP
 MECANISMOS DE ACIDIFICAÇÃO URINÁRIA Carlos Balda UNIFESP - 2012 Steady State Equilíbrio Dinâmico VALORES NORMAIS ph H+ (nanoeq/l) pco 2 (mmhg) HCO 3 (meq/l) ARTERIAL 7,37-7,43 37-43 36-44 22-26 VENOSO
MECANISMOS DE ACIDIFICAÇÃO URINÁRIA Carlos Balda UNIFESP - 2012 Steady State Equilíbrio Dinâmico VALORES NORMAIS ph H+ (nanoeq/l) pco 2 (mmhg) HCO 3 (meq/l) ARTERIAL 7,37-7,43 37-43 36-44 22-26 VENOSO
Fundamentos de Química Profa. Janete Yariwake. Equilíbrio químico em solução aquosa. Soluções-tampão. Soluções tampão
 Equilíbrio químico em solução aquosa Soluções-tampão 1 Soluções tampão Definição: soluções que podem resistir a variações significativas de ph. (se adicionamos quantidades pequenas de ácidos fortes ou
Equilíbrio químico em solução aquosa Soluções-tampão 1 Soluções tampão Definição: soluções que podem resistir a variações significativas de ph. (se adicionamos quantidades pequenas de ácidos fortes ou
Interpretação da Gasometria Arterial. Dra Isabel Cristina Machado Carvalho
 Interpretação da Gasometria Arterial Dra Isabel Cristina Machado Carvalho Distúrbios Ácido-Base O reconhecimento dos mecanismos homeostáticos que controlam o equilíbrio ácido-base é fundamental, pois os
Interpretação da Gasometria Arterial Dra Isabel Cristina Machado Carvalho Distúrbios Ácido-Base O reconhecimento dos mecanismos homeostáticos que controlam o equilíbrio ácido-base é fundamental, pois os
Status Epilepticus. Neurologia - FEPAR. Neurofepar Dr. Roberto Caron
 Status Epilepticus Neurologia - FEPAR Neurofepar Dr. Roberto Caron Estado de Mal Epiléptico Classificação das Epilepsias Definição Status Epilepticus: Crise epiléptica com duração de pelo menos 5 minutos.
Status Epilepticus Neurologia - FEPAR Neurofepar Dr. Roberto Caron Estado de Mal Epiléptico Classificação das Epilepsias Definição Status Epilepticus: Crise epiléptica com duração de pelo menos 5 minutos.
ENTENDENDO OS DISTÚRBIOS HIDROELETROLÍTICOS E O EQUILÍBRIO ÁCIDO-BÁSICO
 ENTENDENDO OS DISTÚRBIOS HIDROELETROLÍTICOS E O EQUILÍBRIO ÁCIDO-BÁSICO Diego Ustárroz Cantali Ana Maria Teixeira Verçoza UNITERMOS DESEQUILIBRIO HIDROELETROLITICO/classificação; DESEQUILIBRIO HIDROELETROLITICO/fisiopatologia;
ENTENDENDO OS DISTÚRBIOS HIDROELETROLÍTICOS E O EQUILÍBRIO ÁCIDO-BÁSICO Diego Ustárroz Cantali Ana Maria Teixeira Verçoza UNITERMOS DESEQUILIBRIO HIDROELETROLITICO/classificação; DESEQUILIBRIO HIDROELETROLITICO/fisiopatologia;
Livro Eletrônico Aula 00 Questões Comentadas de Fisioterapia - Terapia Intensiva
 Livro Eletrônico Questões Comentadas de Fisioterapia - Terapia Intensiva Professor: Fábio Cardoso 1 APRESENTAÇÃO.... 2 2 -QUESTÕES COMENTADAS...5 RESUMO....7 LISTA DE QUESTÕES SEM COMENTÁRIOS... 7 GABARITO...8
Livro Eletrônico Questões Comentadas de Fisioterapia - Terapia Intensiva Professor: Fábio Cardoso 1 APRESENTAÇÃO.... 2 2 -QUESTÕES COMENTADAS...5 RESUMO....7 LISTA DE QUESTÕES SEM COMENTÁRIOS... 7 GABARITO...8
R1CM HC UFPR Dra. Elisa D. Gaio Prof. CM HC UFPR Dr. Mauricio Carvalho
 R1CM HC UFPR Dra. Elisa D. Gaio Prof. CM HC UFPR Dr. Mauricio Carvalho CASO CLÍNICO Homem, 45 anos, com cirrose por HCV foi admitido com queixa de fraqueza e icterícia de início recente. O paciente possuía
R1CM HC UFPR Dra. Elisa D. Gaio Prof. CM HC UFPR Dr. Mauricio Carvalho CASO CLÍNICO Homem, 45 anos, com cirrose por HCV foi admitido com queixa de fraqueza e icterícia de início recente. O paciente possuía
Equilíbrio Ácido básico Enfa. Profa. Dra. Paula C Nogueira
 UNIVERSIDADE DE SÃO PAULO Escola de Enfermagem Departamento de Enfermagem Médico-Cirúrgica Equilíbrio Ácido básico Enfa. Profa. Dra. Paula C Nogueira Objetivos Conhecer e identificar os distúrbios ácido-básico
UNIVERSIDADE DE SÃO PAULO Escola de Enfermagem Departamento de Enfermagem Médico-Cirúrgica Equilíbrio Ácido básico Enfa. Profa. Dra. Paula C Nogueira Objetivos Conhecer e identificar os distúrbios ácido-básico
APROVADO EM INFARMED
 Folheto informativo: Informação para o utilizador Dextrose em Soro Fisiológico 55 mg/ml + 9 mg/ml solução para perfusão Glucose + Cloreto de sódio Leia com atenção todo este folheto antes de começar a
Folheto informativo: Informação para o utilizador Dextrose em Soro Fisiológico 55 mg/ml + 9 mg/ml solução para perfusão Glucose + Cloreto de sódio Leia com atenção todo este folheto antes de começar a
AVALIAÇÃO LABORATORIAL DA FUNÇÃO RENAL
 AVALIAÇÃO LABORATORIAL DA FUNÇÃO RENAL AVALIAÇÃO LABORATORIAL DA FUNÇÃO RENAL 1. EXAME DE URINA Cor Aspecto Densidade urinária ph Glicosúria Proteinúria Pigmentos e Sais biliares Hemoglobinúria e Mioglobinúria
AVALIAÇÃO LABORATORIAL DA FUNÇÃO RENAL AVALIAÇÃO LABORATORIAL DA FUNÇÃO RENAL 1. EXAME DE URINA Cor Aspecto Densidade urinária ph Glicosúria Proteinúria Pigmentos e Sais biliares Hemoglobinúria e Mioglobinúria
Principais exames bioquímicos de. tratamento do paciente intoxicado
 Universidade Estadual de Londrina Centro de Ciências da Saúde Departamento de Patologia e Análises Clínicas e Toxicológicas Principais exames bioquímicos de importância no diagnóstico e tratamento do paciente
Universidade Estadual de Londrina Centro de Ciências da Saúde Departamento de Patologia e Análises Clínicas e Toxicológicas Principais exames bioquímicos de importância no diagnóstico e tratamento do paciente
ALCALOSES 1. Introdução
 ALCALOSES 1 Introdução O organismo é responsável por manter em equilíbrio o ph dos fluidos corpóreos presentes nos espaços extracelulares e intracelular através de diversos sistemas e mecanismos compensatórios
ALCALOSES 1 Introdução O organismo é responsável por manter em equilíbrio o ph dos fluidos corpóreos presentes nos espaços extracelulares e intracelular através de diversos sistemas e mecanismos compensatórios
DISTÚRBIOS DO EQUILÍBRIO ÁCIDO-BÁSICO REVISÃO DE LITERATURA
 DISTÚRBIOS DO EQUILÍBRIO ÁCIDO-BÁSICO REVISÃO DE LITERATURA SOUZA, Camila Carolina Discente do Curso de Medicina Veterinária da FAMED Garça SACCO, Soraya Regina ZAPPA, Vanessa Docente do Curso de Medicina
DISTÚRBIOS DO EQUILÍBRIO ÁCIDO-BÁSICO REVISÃO DE LITERATURA SOUZA, Camila Carolina Discente do Curso de Medicina Veterinária da FAMED Garça SACCO, Soraya Regina ZAPPA, Vanessa Docente do Curso de Medicina
Equilíbrio ácido-básico 2010
 Iuri Marques de Oliveira & Renato Moreira Rosa O grau de acidez é uma propriedade química importante do sangue e outros líquidos corpóreos. A acidez é expressa na escala de ph e o valor de ph fisiológico
Iuri Marques de Oliveira & Renato Moreira Rosa O grau de acidez é uma propriedade química importante do sangue e outros líquidos corpóreos. A acidez é expressa na escala de ph e o valor de ph fisiológico
PLANO DE DISCIPLINA. 1. Identificação: 2. Ementa: 3. Objetivo Geral:
 PLANO DE DISCIPLINA 1. Identificação: Departamento: Ciências Básicas (FCB) Disciplina: Fisiologia Humana Cód.: FCB00006 Período Ministrado / Semestre / Ano / Turma: 2 0 / 1ºS/2010/F1 Responsável: Prof.
PLANO DE DISCIPLINA 1. Identificação: Departamento: Ciências Básicas (FCB) Disciplina: Fisiologia Humana Cód.: FCB00006 Período Ministrado / Semestre / Ano / Turma: 2 0 / 1ºS/2010/F1 Responsável: Prof.
DISTÚRBIOS HIDROELETROLÍTICOS HIPONATREMIA - I
 DISTÚRBIOS HIDROELETROLÍTICOS HIPONATREMIA - I Déficit de H 2 O Corporal total e déficit maior de Na + corporal total Déficit de H 2 O Corporal total e déficit maior de Na + corporal total Excesso de Na
DISTÚRBIOS HIDROELETROLÍTICOS HIPONATREMIA - I Déficit de H 2 O Corporal total e déficit maior de Na + corporal total Déficit de H 2 O Corporal total e déficit maior de Na + corporal total Excesso de Na
DISTÚRBIO HIDRO- ELETROLÍTICO E ÁCIDO-BÁSICO. Prof. Fernando Ramos Gonçalves -Msc
 DISTÚRBIO HIDRO- ELETROLÍTICO E ÁCIDO-BÁSICO Prof. Fernando Ramos Gonçalves -Msc Distúrbio hidro-eletrolítico e ácido-básico Distúrbios da regulação da água; Disnatremias; Alterações do potássio; Acidoses
DISTÚRBIO HIDRO- ELETROLÍTICO E ÁCIDO-BÁSICO Prof. Fernando Ramos Gonçalves -Msc Distúrbio hidro-eletrolítico e ácido-básico Distúrbios da regulação da água; Disnatremias; Alterações do potássio; Acidoses
Biologia. Identidade dos Seres Vivos. Sistema Respiratório Humano. Prof.ª Daniele Duó
 Biologia Identidade dos Seres Vivos Prof.ª Daniele Duó Fisiologia do Sistema Respiratório Pode ser interpretada como um processo de trocas gasosas entre o organismo e o meio, ou conjunto de reações químicas
Biologia Identidade dos Seres Vivos Prof.ª Daniele Duó Fisiologia do Sistema Respiratório Pode ser interpretada como um processo de trocas gasosas entre o organismo e o meio, ou conjunto de reações químicas
Informação importante para os profissionais de saúde acerca dos riscos graves associados a CAPRELSA
 CAPRELSA (vandetanib) Informação importante para os profissionais de saúde acerca dos riscos graves associados a CAPRELSA Estes materiais educacionais estão focados no risco de prolongamento do intervalo
CAPRELSA (vandetanib) Informação importante para os profissionais de saúde acerca dos riscos graves associados a CAPRELSA Estes materiais educacionais estão focados no risco de prolongamento do intervalo
Objetivos da Respiração. Prover oxigênio aos tecidos Remover o dióxido de carbono
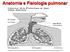 Anatomia e Fisiologia pulmonar Objetivos da Respiração Prover oxigênio aos tecidos Remover o dióxido de carbono PatologiasRespiratórias Mais Comuns Patologias Respiratórias Mais Comuns Insuficiência Respiratória
Anatomia e Fisiologia pulmonar Objetivos da Respiração Prover oxigênio aos tecidos Remover o dióxido de carbono PatologiasRespiratórias Mais Comuns Patologias Respiratórias Mais Comuns Insuficiência Respiratória
Distúrbios Hidroeletrolíticos. Hiponatremia - I
 Distúrbios Hidroeletrolíticos Hiponatremia - I Déficit de H 2 O corporal total e déficit maior de Na + corporal total Excesso de H 2 O corporal total Excesso de Na + corporal total. Excesso mais acentuado
Distúrbios Hidroeletrolíticos Hiponatremia - I Déficit de H 2 O corporal total e déficit maior de Na + corporal total Excesso de H 2 O corporal total Excesso de Na + corporal total. Excesso mais acentuado
Universidade Federal Rural de Pernambuco
 Universidade Federal Rural de Pernambuco Departamento de Morfologia e Fisiologia Animal Área de Biofísica Medindo o potencial Hidrogeniônico Prof. Romildo Nogueira 1. Entendendo as bases A manutenção da
Universidade Federal Rural de Pernambuco Departamento de Morfologia e Fisiologia Animal Área de Biofísica Medindo o potencial Hidrogeniônico Prof. Romildo Nogueira 1. Entendendo as bases A manutenção da
Desequilíbrio Ácido básico Enfa. Profa. Dra. Paula C Nogueira
 UNIVERSIDADE DE SÃO PAULO Escola de Enfermagem Departamento de Enfermagem Médico-Cirúrgica Desequilíbrio Ácido básico Enfa. Profa. Dra. Paula C Nogueira Objetivos Conhecer e identificar os distúrbios ácido-básico
UNIVERSIDADE DE SÃO PAULO Escola de Enfermagem Departamento de Enfermagem Médico-Cirúrgica Desequilíbrio Ácido básico Enfa. Profa. Dra. Paula C Nogueira Objetivos Conhecer e identificar os distúrbios ácido-básico
Reabsorção tubular. substâncias. reabsorção tubular.
 Reabsorção tubular Tanto a filtração glomerular quanto a reabsorção tubular ocorrem em muito maior escala do que a excreção da maioria das substâncias. Reabsorção tubular é altamente seletiva. Como a filtração
Reabsorção tubular Tanto a filtração glomerular quanto a reabsorção tubular ocorrem em muito maior escala do que a excreção da maioria das substâncias. Reabsorção tubular é altamente seletiva. Como a filtração
Objetivo: Estudar os mecanismos fisiológicos responsáveis pelas trocas gasosas e pelo controle do transporte de gases Roteiro:
 TROCAS GASOSAS E CONTROLE DO TRANSPORTE DE GASES Objetivo: Estudar os mecanismos fisiológicos responsáveis pelas trocas gasosas e pelo controle do transporte de gases Roteiro: 1. Trocas gasosas 1.1. Locais
TROCAS GASOSAS E CONTROLE DO TRANSPORTE DE GASES Objetivo: Estudar os mecanismos fisiológicos responsáveis pelas trocas gasosas e pelo controle do transporte de gases Roteiro: 1. Trocas gasosas 1.1. Locais
METABOLISMO DE ÁGUA E ELETRÓLITOS NA SAÚDE E NA DOENÇA
 METABOLISMO DE ÁGUA E ELETRÓLITOS NA SAÚDE E NA DOENÇA Prof. José Aroldo Filho goncalvesfilho@nutmed.com.br ÁGUA CORPORAL A água e eletrólitos são componentes essenciais do meio interno do organismo. São
METABOLISMO DE ÁGUA E ELETRÓLITOS NA SAÚDE E NA DOENÇA Prof. José Aroldo Filho goncalvesfilho@nutmed.com.br ÁGUA CORPORAL A água e eletrólitos são componentes essenciais do meio interno do organismo. São
EQUILIBRIO HIDRICO. Prof. Dr. Rodolfo C. Araujo Berber Médico Veterinário, MSc. PhD. UFMT-Sinop
 EQUILIBRIO HIDRICO Prof. Dr. Rodolfo C. Araujo Berber Médico Veterinário, MSc. PhD. UFMT-Sinop Porque os organismos de mamíferos possuem grande quantidade de água? Alto ponto de ebulição (controle da temperatura);
EQUILIBRIO HIDRICO Prof. Dr. Rodolfo C. Araujo Berber Médico Veterinário, MSc. PhD. UFMT-Sinop Porque os organismos de mamíferos possuem grande quantidade de água? Alto ponto de ebulição (controle da temperatura);
DISTÚRBIOS DO SÓDIO E DO POTÁSSIO
 DISTÚRBIOS DO SÓDIO E DO POTÁSSIO HIPONATREMIA Dosagem de sódio ( Na ) sérico < 130mEq/L Oferta hídrica aumentada; Baixa oferta de sódio; Redistribuição osmótica de água ( p.ex. hiperglicemia); Excreção
DISTÚRBIOS DO SÓDIO E DO POTÁSSIO HIPONATREMIA Dosagem de sódio ( Na ) sérico < 130mEq/L Oferta hídrica aumentada; Baixa oferta de sódio; Redistribuição osmótica de água ( p.ex. hiperglicemia); Excreção
