EXPRESSÃO DE RECEPTORES DE EGF, INIBIDORES E REGULADORES DO CICLO CELULAR EM LESÕES PROLIFERATIVAS DA PRÓSTATA CANINA
|
|
|
- Benedicta Belmonte Minho
- 7 Há anos
- Visualizações:
Transcrição
1 UNIVERSIDADE FEDERAL DE GOIÁS ESCOLA DE VETERINÁRIA E ZOOTECNIA PROGRAMA DE PÓS-GRADUAÇÃO EM CIÊNCIA ANIMAL EXPRESSÃO DE RECEPTORES DE EGF, INIBIDORES E REGULADORES DO CICLO CELULAR EM LESÕES PROLIFERATIVAS DA PRÓSTATA CANINA Mariana Batista Rodrigues Faleiro Orientadora: Prof.ª Dr.ª Veridiana Maria Brianezi Dignani de Moura GOIÂNIA 2014
2
3 ii MARIANA BATISTA RODRIGUES FALEIRO EXPRESSÃO DE RECEPTORES DE EGF, INIBIDORES E REGULADORES DO CICLO CELULAR EM LESÕES PROLIFERATIVAS DA PRÓSTATA CANINA Tese apresentada junto ao Programa de Pós- Graduação em Ciência Animal da Escola de Veterinária da Universidade Federal de Goiás para obtenção do título de Doutorem Ciência Animal. Área de Concentração: Patologia, Clínica e Cirurgia Animal Linha de Pesquisa: Patobiologia animal, experimental e comparada Orientadora: Prof.ª Dr.ª Veridiana Maria Brianezi Dignani de Moura-EVZ/UFG Comitê de Orientação: Prof. Dr. Adilson Donizeti Damasceno (EVZ / UFG) Prof. Dr. Eugênio Gonçalves de Araújo (EVZ / UFG) GOIÂNIA 2014
4
5 iii MARIANA BATISTA RODRIGUES FALEIRO Tese defendida e aprovada em 14/11/2014 pela banca examinadora constituída pelos professores:
6 iv Dedico este trabalho: A vocês que abriram mão de momentos de convívio, que sofreram com a ausência quando o dever do estudo chamava; A vocês que muitas vezes receberam-me com silenciosa mágoa ou muda revolta quer pela ausência, quer por saudade ou impaciência; A vocês que agora vêem com alívio este fim de etapa e que, por mais que não queiram demonstrar, estão mais felizes do que eu; Pois amaram suficientemente para aplaudir, chorar, tolerar e encorajar. Essa vitória é nossa. Marido, Pai, Mãe, Irmão, Sogra, Sogro, Cunhada, Cunhado...
7 v AGRADECIMENTOS A Deus, por ter dado meu anjo da guarda e meu mentor, que me auxiliaram dando força maior que me impulsiona e guia, fazendo chegar até aqui e ainda a seguir em frente por qualquer que seja o caminho. Ao meu companheiro, meu ídolo, meu modelo, Neylon Teixeira Faleiro, que vem me acompanhando nos último quatorze anos, sendo fonte inesgotável e incessante de compreensão, atenção, amor e carinho. Sempre presente, paciente e disposto a ensinar. Em especial agradeço a minha mãe, Eunice Batista da Silva Rodrigues,por seu exemplo de luta, vida e superação. E ao meu Pai, Rivalino Rodrigues, que mesmo longe se faz presente em minhas orações. Ao meu irmão, Bruno Batista Rodrigues, por ser amigo companheiro, braço direito, mesmo sendo tão perfeccionista e certinho. As minhas meninas Teka, Kika e Mila e o menino Tupi, por serem minha fonte inspiradora e carregadores de energias. Companheiros fiéis e presentes nos bons e maus momentos. Agradeço a minha orientadora, amiga, mãe verdadeira, Veridiana Maria Brianezi Dignani de Moura, por ter tido fé em mim, apoiado e confiado nas minhas loucuras pela biologia molecular. Ao Dr. Rafael Malagoli, Carlos Ferreira Nascimento, Suely Nonogaki e demais funcionários do hospital do câncer A.C. Camargo, São Paulo, pela ajuda e acolhida. Àprofessora Rosália Santos Amorim Jesuíno,por ter me acolhido não só no seu laboratório, mas também em sua vida. Quando tudo parecia escuro, sem luz, eis que surge com a lanterna ao fim do túnel e fez tangível grande parte deste projeto tornandosonho em realidade. Aos novos amigos,lorena Cintra Cardoso, Saulo Siqueirae Marcelo Ramada, por terem aberto as portas do conhecimento e passeado comigo pelo mundo da PCR e do gel de agarose. Aos professores, funcionários e alunos do laboratório de Biotecnologia de Fungos,laboratório de Enzimologia e laboratório de Engenharia Genética doinstituto de Ciências Biológicas II da Universidade Federal de Goiás, pelo carisma e excelente recepção a mim conferidos.
8 vi Ao comitê de orientação, composto pelos professores doutores Adilson Donizeti Damasceno e Eugênio Gonçalves de Araújo, pela co-orientação e auxílio na formação profissional. Aos professores do Setor de Patologia Animal da EVZ/UFG, doutores Ana Paula Iglesias Santin, Eugênio Gonçalves de Araújo, Luiz Augusto Batista Brito, Moema Pacheco Chediak Matos e Regiani Nascimento Gagno Pôrto, que quando deveriam ser simplesmente professores foram mestres, quando deveriam ser simplesmente mestres foram amigos e em sua amizade me compreenderam e incentivaram a seguir o caminho. Meu maior agradecimento e o meu profundo respeito que sempre serão poucos diante do muito que me foi oferecido. As amigas irmãs Caroline Rocha de Oliveira Lima, Léa Resende Moura e Denise Caroline Toledo, pela amizade e auxílio durante o curso. Aos alunos, amigos, irmãos companheiros de toda hora do Setor de Patologia Animal da EVZ/UFG, Aline Maria Vasconcelos Lima, Danilo Rezende e Silva e Paula Lima Magalhães, pela grande colaboração e amizade. ÀEscola de Veterinária e Zootecnia da UFG, que se tornou minha segunda casa nesses últimos anos e me preparou profissionalmente, conferindo-me conhecimentos necessários a tão sonhada pós-graduação. Ao Programa de Pós-Graduação em Ciência Animal da EVZ/UFG e ao seu corpo docente, que mais do que ensinar um ofício ensinou-me uma filosofia de vida. Ao Conselho Nacional de Desenvolvimento Científico e Tecnológico (CNPQ) e à Coordenação de Aperfeiçoamento de pessoal de Nível Superior (CAPES)pela bolsa cedida, permitindo que me dedicasseexclusivamente ao desenvolvimento deste trabalho. Aos demais professores, funcionários e alunos da EVZ/UFG. Meu especial agradecimento àqueles que tornaram tudo isso possível,os animais. A todos aqueles que em algum momento fizeram parte da minha vida. MEUS SINCEROS AGRADECIMENTOS.
9 vii Lentamente, os cromossomas adquirem a sua apresentação peculiar, em forma de ponto alça bastonete bengala, e a evolução que lhes diz respeito na cariocinese, desde a prófase à telófase, merece a melhor atenção dos Construtores Divinos, que através do centro celular mantêm a junção das forças físicas e espirituais, ponto esse em que se verifica o impulso mental, de natureza eletromagnética, pelo qual se opera o movimento dos cromossomas, na direção do equador para os pólos da célula, cunhando as leis da hereditariedade e da afinidade que se vão exercer, dispondo nos cromatídeos, em forma de granulações perfeitamente identificáveis entre o leptptênio e o paquitênio, os genes ou fatores da hereditariedade, que, no transcurso dos séculos, são fixados em número e valores diferentes para cada espécie. André Luiz (Francisco Cândido Xavier e Waldo Vieira) Evolução em dois mundos (1959)
10 viii A cada um é dadosegundo suas Obras! Mateus 16:27
11 ix SUMÁRIO LISTA DE FIGURAS... xi LISTA DE TABELAS... xiv LISTA DE QUADROS... xv LISTA DE ABREVIATURAS... xvi RESUMO... xix ABSTRACT... xx CAPÍTULO 1 - CONSIDERAÇÕES INICIAIS Morfofisiologia e enfermidades da próstata canina Hiperplasia prostática benigna (HPB) Atrofia inflamatória proliferativa (PIA) Neoplasia intraepitelial prostática (PIN) Carcinoma prostático (PC) Carcinogênese Ciclo e crescimento celular Fatores de crescimento Receptores de Fator de Crescimento Epidérmico - EGFR/Her1 e Her2/cerbB Inibidores de ciclina dependente de quinase - p21, p27 e p Ciclina D1 (CD1) Proteínas c-myc OBJETIVOS Referências CAPÍTULO 2 EGF receptors expression in canine prostate with proliferative inflammatory atrophy and carcinoma ABSTRACT RESUMO INTRODUCTION MATERIAL AND METHODS RESULTS DISCUSSION CONCLUSIONS REFERENCES... 55
12 x CAPÍTULO 3 - Cell cycle inhibitors expression in canine prostate with prostatic inflammatory atrophy and carcinoma ABSTRACT RESUMO INTRODUCTION MATERIAL AND METHODS RESULTS DISCUSSION CONCLUSIONS REFERENCES CAPÍTULO 4 Immunoexpression of cell cycle regulators in canine prostate with proliferative lesions ABSTRACT RESUMO INTRODUCTION MATERIAL AND METHODS RESULTS DISCUSSION CONCLUSIONS REFERENCES CAPÍTULO 5 - CONSIDERAÇÕES FINAIS ANEXO A APÊNDICE A...101
13 xi LISTA DE FIGURAS CAPÍTULO 1 - CONSIDERAÇÕES INICIAIS Figura 1 Figura 2 A) Vista ventral da cavidade pélvica canina. 1) Bexiga urinária; 2) próstata; 3) reto; 4) uretra. B) Fotomicrografia da histomorfologia normal da próstata canina. Glândula túbulo-alveolar ramificada (ácinos), recobertas por epitélio colunar simples (seta preta). Lúmen glandular (asterisco), estroma de sustentação fibromuscular (seta amarela) e célula basal (seta verde). HE, 200x Fotomicrografia da próstata canina com HPB cística. Evidenciação de ácinos acentuadamente dilatados (asterisco vermelho), irregulares e proliferação estromal adjacente (asterisco preto). HE, 200x Figura 3 Figura 4 Figura 5 Figura 6 Figura 7 Figura 8 Figura 9 Figura 10 Figura 11 Fotomicrografia de próstata canina com foco de atrofia inflamatória proliferativa (PIA). A) PIA com infiltrado inflamatório mononuclear intersticial (asterisco) e atipias epiteliais com mais de uma camada de células epiteliais (seta), citoplasma marcadamente reduzido, núcleos aumentados e nucléolos evidentes (PIA-moderada), HE, 400x; B) Atrofia acinar, dupla camada de células epiteliais (seta) e infiltrado inflamatório mononuclear intersticial (asterisco) (PIA-acentuada), HE, 200x Fotomicrografia de próstata canina com foco de PIN. Epitélio acinar estratificado e displásico, com variação do tamanho nuclear, nucléolo evidente e perda de diferenciação citoplasmática (seta). HE, 400x Fotomicrografia de carcinoma prostático canino. Áreas de proliferação celular com atipias e perda da conformação acinar. HE, 400x Representação esquemática das fases da carcinogênese. Iniciação, promoção, progressão e manifestação Ciclo celular. A) Representação gráfica esquemática do ciclo celular com as fases G0, G1, S, G2 e M, e os pontos de checagem do ciclo (setas vermelhas). B) As fases da mitose. Interfase, prófase, metáfase, anáfase e telófase O número de células de um tecido pode ser alterado pelo aumento ou diminuição da taxa de recrutamento das células tronco, pela morte celular por apoptose ou por alterações nas taxas de proliferação ou diferenciação Receptores da família do EGF (EGFR, Her2, Her3, Her4) apresentando sítio de ligação extracelular, porção transmembrana e domínio da tirosina quinase intracelular Representação esquemática do ciclo celular com as fases G0, G1, G2 e M, e ação de proteínas estimuladoras (ciclinas e cdk s), inibidoras (p21, p27, p57, p16, p15, p18 e p19), e de controle do ciclo (c-myc). TGF-β induz a produção dos inibidores Representação gráfica da atividade dos complexos Cdk/ciclina durante o ciclo celular. A largura das faixas coloridas é aproximadamente proporcional à atividade dos complexos indicados... 28
14 xii CAPÍTULO 2 - EGF receptors expression in canine prostates with proliferative inflammatory atrophy and carcinoma Figura 1 Figure 2 Figura 3 Figura 4 Immunostaining intensity of EGFR and Her2 antibodies in canine prostatic tissue EGFR immunostaining membrane through cytoplasm (arrow). A) Human placenta. Positive control with 3+ immunostaining score (200X); B) Canine PC tissue with 1+score (400X); C) Normal canine prostatic tissue with 1+ score (400X); D) Canine prostatic tissue with PIA and 2+labeling score (200X). IHC, DAB with H&E counterstain Her2 immunostaining membrane through cytoplasm (arrow). A) Human mammary carcinoma. Positive control with 3+ immunostaining intensity score (400X); B) Canine PC tissue with 3+score (400X); C) Normal canine prostatic tissue with 0- score (200X); D) Canine prostatic tissue with PIA and 2+ labeling score (400X); IHC, DAB with H&E counterstain Agarose gel images showing amplification products of β-actin, ErbB1 and ErbB2 genes from canine prostatic tissue. A) RT-PCR for β-actin expression as samples positive control. All samples amplified. B) RT-PCR for ErbB1.Prostatic samples N3, N4, PIA2, all PC, and MC amplified. C) RT- PCR for ErbB2. Prostatic samples PIA2, PIA3, all PC and MC amplified. MW = Molecular weight (GeneRuler 1Kb Plus DNA Ladder - Thermo scientific, CA, USA, #SM1331); MC= canine mammary carcinoma (ErbB1 and ErbB2 positive control); N=Canine normal prostatic tissue; PIA=Canine proliferative inflammatory atrophy; PC=Canine prostatic carcinoma 53 CAPÍTULO 3 - Cell cycle inhibitors expression in canine prostate with prostatic inflammatory atrophy and carcinoma Figura 1 Figura 2 Immunohistochemistry photomicrography on nuclear immunostaining (arrow). A) Canine PC tissue with score three for labeling intensity and four for number of labeled cells for p X. B) Human colon carcinoma; p21 positive control with score two for labeling intensity and four for number of labeled cells. 400X. C) Canine PIA tissue with score three for labeling intensity and four for number of labeled cells for p x. D) Human colon carcinoma; p27 positive control with score three for labeling intensity and four for number of labeled cells. 400X E) Canine PC tissue with score three for labeling intensity and four for number of labeled cells for p X. F) Human mammary carcinoma; p53 positive control with score three for labeling intensity and three for number of labeled cells. 200X. IHC, DAB with H&E counterstain Images from agarose gels showing the amplification products of ACTG1 (βactin), CDKN1A, CDKN1B and TP53 genes from canine prostatic tissue. (A) RT-PCR for β-actin expression (positive control). (B) RT-PCR for CDKN1A. Prostatic samples PC6, PC7, PC8, PC9 and MC amplified. (C) RT-PCR for CDKN1B. Prostatic samples PC7, PC8, PC9 and MC amplified. (D) RT-PCR for TP53. Prostatic samples PIA1, PIA2, PIA3, PC1, PC2, PC3, PC4, PC5, PC6, PC7, PC8, PC9 and MC amplified. MW = Molecular weight (Gene Ruler 1Kb Plus DNA Ladder - Thermo scientific, CA, USA, #SM1331); MC= canine mammary carcinoma (CDKN1A, CDKN1B and
15 xiii TP53 positive control); N=Normal tissue; PIA= Canine proliferative inflammatory atrophy; PC= Canine prostatic carcinoma Figura 3 Fold expression levels of CDKN1A, CDKN1B and TP53 in canine normal, PIA and PC normalized by β-actin. Values>1.6 were considered overexpression and values<0.4 were considered decrease of gene expression CAPÍTULO 4 - Immunoexpression of cell cycle regulators in canine prostate with proliferative lesions Figura 1 Figura 2 Immunohistochemistry photomicrography on nuclear immunostaining (arrow). A) Canine PIN tissue with score three for labeling intensity and four for number of labeled cells for p x. B) Human colon carcinoma. Positive control for p21 with scores two for labeling intensity and four for number of labeled cells. 400x. C) Normal canine prostatic tissue with one for labeling intensity and one for number of labeled cells for p21 (400X) D) Canine PIN with score two for labeling intensity and two for number of labeled cells for p x. E) Human colon carcinoma. Positive control of p27 with score three for labeling intensity and four for number of labeled cells. 400X. F) Canine PIA with score three for labeling intensity and four for number of labeled cells for p X. G) Mammary carcinoma. Positive control of p53 with score three for labeling intensity and three for number of labeled cells. 200X. H) Normal canine prostatic tissue with 0- score for p-53 (400X). IHC, DAB, counterstained with H&E Immunohistochemistry photomicrography on nuclear through cytoplasmic and membrane immunostaining.a) Canine PIN tissue with score one for labeling intensity and three for number of labeled cells of cytoplasmic cyclin D1 (arrow) (400X). B) Canine lymph node. Positive control of cytoplasmic cyclin D1 (arrow) with score two for labeling intensity and two for number of labeled cells. (400X) C) Normal canine prostatic tissue with 0- score for cyclin D1 (200X) D) Canine PC tissue with score three for labeling intensity and four for number of labeled cells for nuclear through cytoplasmic c-myc (arrow). (400X) E) Canine lymph node. Positive control of nuclear through cytoplasmic c-myc (arrow), with score two for labeling intensity and four for number of labeled cells. (200X) F) Normal canine prostatic tissue with score three for labeling intensity and four for number of labeled cells for c-myc (arrow). (200X). IHC 400x. DAB with H&E counterstain... 85
16 xiv LISTA DE TABELAS CAPÍTULO 2 - EGF receptors expression in canine prostates with proliferative inflammatory atrophy and carcinoma Tabela 1 Labeling intensity scores of EGFR and Her2 antibodies in normal prostate tissue and with PIA and PC.. 50 Tabela 2 Tabela 3 Means of comparison between EGFR and Her2 immunostaining intensity in canine normal prostatic tissue and with PIA and PC Comparison results of EGFR and Her2 immunostaining scores by immunohistochemistry (IHC) and ErbB1 and ErbB2 detection by RT- PCR in normal canine prostatic tissue and with PIA and PC CAPÍTULO 3 - Cell cycle inhibitors expression in canine prostate with prostatic inflammatory atrophy and carcinoma Tabela 1 Number of cases sorted by scores applied to variable number of labeled cells and intensity of labeling to p21, p27, and p53 antibodies in canine normal prostatic tissue and with PIA and PC. 66 Tabela 2 Tabela 3 Comparison between p21, p27, and p53 immunostaining regarding number of stained cells and intensity of staining in canine normal prostatic tissue, PIA and PC Comparison between p21, p27, and p53 immunostaining regarding number of stained cells and intensity of staining in canine normal prostatic tissue, PIA and PC CAPÍTULO 4 - Immunoexpression of cell cycle regulators in canine prostate with proliferative lesions Tabela 1 Distribution of cases according to the scores applied to variable number of labeled cells and intensity of labeling to p21, p27, p53, ciclyn D1 and c-myc antibodies in normal prostate tissues and with BPH, PIA, PIN and PC Tabela 2 Tabela 3 Means of comparison between p21, p27, p53, cyclin D1 and c-myc immunostaining regarding the number of stained cells and intensity of staining cells in canine normal prostatic tissue and with BPH, PIA, PIN and PC Means of correlation between antibodies expression regarding the number of stained cells and intensity of staining of the normal canine prostate and with BPH, PIA, PIN and PC.. 89
17 xv LISTA DE QUADROS CAPÍTULO 1 - CONSIDERAÇÕES INICIAIS Quadro 1 Fatores de crescimento, células de origem, sítios alvo e suas funções no tecido prostático normal e neoplásico Quadro 2 Fatores de crescimento que ativam (+) a família de receptores EGFR... 20
18 xvi LISTA DE ABREVIATURAS ACTG1 - Gene que decodifica proteína da Beta actina AKT - Quinase PI-3 dependente da serina tireonina quinase AR - Receptor de andrógeno ARF - Alternate reading frame Bcl-2 - Proteína do Gene B-cell lymphoma/leukemia-2 bfgf- Fator de crescimento básico do fibroblasto BLAST - Basic Local Alignment Search Tool BPH - Benign Prostatic Hyperplasia BSA - Bovine serum Albumin - Albumina serica bovina BTC - Betacellulin CCND1 - Gene que codifica protein ciclina D1 CD1 - Ciclina D1 Cdk - Ciclina dependente quinase CdkI - Inibidor de Ciclina dependente quinase CDKN1A - Inibidor de Ciclina dependente quinase 1A gene (gene do p21) CDKN1B - Inibidor de Ciclina dependente quinase 1B gene (gene do p27) cdna - Fita Complementar do Àcido Desoxirribonucleico c-erbb-2 - Mesmo que Her-2: Erythroblastic leucemia viral oncogene homologo 2 c-erbb-3 - Mesmo que Her-3: Erythroblastic leucemia viral oncogene homologo 3 c-erbb-4 - Mesmo que Her-4: Erythroblastic leucemia viral oncogene homologo 4 Cip/Kip - Familia ciclina dependente quinase CIP1 - Cdk-interacting protein 1 CLN - Gene neuronal ceroid lipofuscinosis que codifica proteínas semelhantes a ciclina CMT-U229 - Linhagem de cultura de células de cancer de mama - Tumor misto benigno c-myc - Proto oncogene Myelocytomatosis c-myc Proteína produto do Proto oncogene Myelocytomatosis COX-2 - Cicloxigenase-2 CP - Carcinoma prostático CSC - Cancer stem cell like DAB - Diaminobenzidine datp - 2'-deoxyadenosine 5'-triphosphate - Adenina dctp - 2'-deoxyadenosine 5'-triphosphate - Citosina DEPC - Dietilpirocarbonate dgtp - 2'-deoxyadenosine 5'-triphosphate - Guanina DNA Àcido Desoxirribonucleico dntp - 2 -deoxynucleoside 5`-triphosphate - Conjunto de Adenina, Citosina, Guanina e Tiamina dttp - 2'-deoxyadenosine 5'-triphosphate - Tiamina DU145 - linhagem de cultura de células de PChumano DuPro - Linhagem de cultura de célula de PC andrógeno independentes E2F - Proteína de regulação gênica - fator de transcrição E-box - Enhancer Box EGF - Fator de crescimento epidérmico EGFR - Receptor do Fator de Crescimento Epidermico ELISA - Enzyme Linked Immuno Sorbent Assay EPR - Epiregulin ErbB1-Gene do EGFR ou Her1: Erythroblasticleucemia viral oncogene homologo 1 ErbB2-Gene do Her2ou c-erbb-2: Erythroblastic leucemia viral oncogenes homologo 2 ErbB3-Gene do Her3 ouc-erbb-3: Erythroblastic leucemia viral oncogene homologo 3
19 ErbB4-Gene do Her4 ou c-erbb-4: Erythroblastic leucemia viral oncogene homologo 4 ERK - Proteína quinase regulada extracelularmente FC - Fator de Crescimento FC - Fold Change - Utilizado para identificar diferença significativa na expressão gênica FFPE - formalin-fixed-paraffin-embedded FGF - Fator de Crescimento Fibroblástico FGFR - Receptor do Fator de Crescimento Fibroblástico Fw - Forward G0 - Fase de quiescência (Gap 0) G1 - Fase de intérfase (Gap 1) G2 - Fase de intérfase (Gap 2) GA - Agarose gel electrophoresis Gel de agarose GSTP-1 - Glutathione S-transferase pi 1 HB-EFG - Heparina EGF HB-EGFR - fator de crescimento epitelial ligador de heparina, HE - Hematoxylina and Eosina Her-1 - Proteína codificada pelo gene ErB1 Her-2 - Proteína codificada pelo gene ErbB2 Her-3 - Proteína codificada pelo gene ErbB3 Her-4 - Proteína codificada pelo gene ErbB4 HGPIN - Neoplasia intra-epitelial prostática de alto grau HPB - Hiperplasia prostática benigna IGF1R - Receptor de fator de crescimento semelhante a insulina 1 IGF2R - Receptor de fator de crescimento semelhante a insulina 2 IGF-I - Fator de crescimento semelhante a insulina IHQ - Imunohistoquímica INCA - Instituto nacional de câncer INK4 - Inibidor de CDK4 IRF1 - Interferon regulatory factor 1 KGF - fator de crescimento queratinócito Ki-67 - Proteína nuclear responsável pela proliferação celular KIP - Kinase inhibitor protein (inibidor de proteína quinase) LGPIN - Neoplasia intra-epitelial prostática de baixo grau LH-RH - Hormônio hipotalâmico LNCaP - Linhagem de cultura de célula de PC andrógeno dependentes M - Fase Mitótica MAPK - Proteína quinase ativadora de mitose MC - Mammary carcinoma MCF-7 - Linhagem de cultura de célula de câncer de mama Mdm - protein murine double minutes 2 MDM2 - Gene que codifica a proteína murine double minutes MEC - Matriz extracelular MEK - Mitogenactivated protein kinase MgCl 2 - Cloreto de Magnésio mrna - Mesmo que RNAm (Ácido ribonucléico mensageiro) na versão inglês MSeA- Àcidocompostos de seléniode segunda geração do metil selénio, agente anti-câncer N -Tecido normal NaN 3 - sodium azide NGR1 - Neuregulinas 1 NGR2 - Neuregulinas 2 xvii
20 NKX3.1 - NK3 homeobox 1 é: homeobox-containing transcription factor 1 NOS-2 - Óxido nítrico sintase 2 OSH - Ovariohisterectomia P114 - Linhagem de cultura de célula de carcinoma mamário anaplásico primário P15 - Proteina de 15 kda, p15 P16 - Proteina de 16 kda, p16 p21 - Proteina de 21 kda, p21 p27 - Proteina de 27 kda, p27 p53 - Proteina de 53 kda, p53 p63 - Proteina de 63 kda, p63 pb - Pares de bases PBS - Phosphatebuffered saline PC - Prostate carcinoma-carcinoma prostático PCR - Polymerase chain reaction - Reação de cadeia de polimerase PDGF - Fator de crescimento plaquetário PDGFα - Receptor Fator de crescimento plaquetário alfa PI3K- fosfatidil inositol 3,4,5 quinase PIA - Atrofia inflamatória proliferativa PIN - Neoplasia intra-epitelial prostática Ponto R - Ponto de restrição prb - proteína do gene retinoblastoma PSA - Antígeno prostático específico PTEN - Phosphataseand tensin homolog deleted from chromosome 10 RAD51 - RecA recombinase RAS - proteínas G monoméricas Rev - reverse RNA - Ácido ribonucléico RNAm - Ácido ribonucléico mensageiro RNase - Enzima que cliva / hidrolisa RNA RT - Reverse transcription - Transcriptase Reversa RT-PCR - Reação em cadeia de polimerase com transcriptase reversa RT-qPCR - Real-time quantitative reverse-transcription polymerase chain reaction S - Fase de síntese do ciclo celular T 2 3 N 1 3 M 0 - Estadiamento tumoral: Tamanho, Localização próxima em linfonodos pélvico mais não metástase a distância Taq - Thermus aquaticus DNA polimerase TGF-α - Fator de crescimento transformador alfa TGF-β - Fator de crescimento transformador beta TIMP-1 - Inibidor tecidual de metaloproteinase -1 TIMP-2 - Inibidor tecidual de metaloproteinase 2 TMA - Tissue microarray - Micro arranjo Tecidual TP53 - Gene que codifica Tumour Protein 53 TVT - Tumor Venéreo Transmissível UFG - Universidade Federal de Goiás upar - Receptor de ativador de plasminogênio tipo uroquinase VEGF - fator de crescimento vascular endotelial WAF1 - wild type p53 activated factor 1 WM - Weight Molecular - peso Molecular ZO2 occludens - Membro da Membranaassociadaguanilato/quinaseproteína homóloga a família -MAGUK (Membrane-associated guanylate kinases) xviii
21 xix RESUMO Algumas lesões displásicas da próstata, como a atrofia inflamatória proliferativa (PIA) e a neoplasia intraepitelial prostática (PIN), são proliferativas, consideradas pré-malignas e podem evoluir para carcinoma prostático (PC). Outras, como a hiperplasia prostática benigna (HPB), apesar de proliferativas, não possuem relação com malignidade. Sendo o PC humano uma das neoplasias que mais matam, e o cão aúnica espécie animal que apresenta a enfermidade com características semelhantes, esta tem sido utilizada como modelo para o estudo do câncer de próstata. Assim, com o intuito de melhor compreender os mecanismos moleculares envolvidos na regulação do ciclo celular e evolução das lesões proliferativas na próstata canina, este estudo teve por objetivo avaliar a expressão gênica de ErbB1, ErbB2, CDKN1A, CDKN1B e TP53,e imunomarcação deegfr (Her1), Her2 (c-erbb-2), p21, p27 e p53 em próstatas com PIA e PC. Também foi avaliada a imunomarcação de p21, p27, p53, c- myc e cyclin D1 em próstatas com HPB, PIA, PIN e PC. Para tal, foram obtidas de um bloco de microarranjo tecidual (TMA) 106 amostras de tecido prostático canino, sendo 15 normais, 16com HBP, 30com PIA,20com PIN, e25com PC. As técnicas de RT-PCR e RT-qPCR foram empregadas na avaliação da expressão gênica, assim como a técnica de imunoistoquímica foi utilizada para verificar o imunofenótipo das lesões prostáticas. Quanto aos receptores EGFReHer2 foi observado que esses atuam naslesões de PIAePCcanino, com ação importante do receptor Her2, sugerindoqueessesestão envolvidosna carcinogênese e no desenvolvimentotumoral da prostata canina.em relação aos inibidores do ciclo celular councluiu-se que quando superexpressos em próstatas com PIA e PC, p21 e p27 controlam a proliferação celular, atuando comofator protetivo na evolução da PIA para PC, e no desenvolviemento do PC, mesmo quando da alteração de p53. Na avaliação da imunoexpressão dos reguladores do ciclo celular (p21, p27, p53, ciclina D1 e c-myc) em próstatas caninas com lesões proliferativas foi constatado que os carcinomas possivelmente apresentam baixo potencial de crescimento quando da superexpressãop21 ep27, menor subexpressão de ciclina D1e expressão inalterada de c-myc, mesmo na presença de p53 tipo mutante. Ainda, considerando o imunofenótipo semelhante nas glândulas com PIA, PIN e PC no que se refere aos reguladores daprogressão do ciclo celular, reforça o potencial prémaligno da PIA e PIN na próstata canina. Palavras-chave:carcinoma prostático, FFPE, PIA,PIN, imunoistoquímica, RT-PCR.
22 xx ABSTRACT Somedysplastic lesionsof prostate, such as proliferativeinflammatoryatrophy (PIA) and prostatic intraepithelial neoplastic(pin) are proliferative,consideredpremalignant andcan progress toprostatic carcinoma (PC). Others, such asbenign prostatichyperplasia(bph) are proliferative, butare not related tomalignancy.the humanpc is the one ofcancers that more kill,and dog`sthe onlyanimal species thatpresentsadiseasewith similarcharacteristics, thishas been usedas a modelfor studyof prostatecancer. Thus, in order tobetter understandthe molecular mechanisms involvedin repairand cell cycleevolution ofproliferative lesionsincanine prostate, this study aimed to evaluatethe gene expression oferbb1, ErbB2, CDKN1A, CDKN1BandTP53andimmunostaining ofegfr(her1), Her2(c-erbB-2), p21, p27and p53 inprostateswithpiaandpc. Also was evaluatedtheimmunostaining ofp21, p27, p53, c-myc andcyclind1inprostateswith BPH, PIA, PINandPC. For this purpose,wereobtained from atissue microarray (TMA)block, 106samplesofcanineprostate tissue, which 15 normal, 16with BPH, 30 withpia, 20 with PIN, and 25with CP. The RT-PCR andrt-qpcr techniques wereused to evaluategene expression, as well as immunohistochemistrywas used to determinetheimmunophenotypeofprostatic lesions.as foregfrand Her2has beenobserved that thesereceptorsactin canine lesions withpia and with PCan importantaction ofher2, suggesting that theyare involvedin carcinogenesisandtumor development in canineprostate. Regarding to cellcycleinhibitor concludethat whenoverexpressedin canine prostateswithpiaandpc, p21andp27control cellproliferation, acting as a protective factorin the evolution of PIA to PC, and in the PC development, even in the presence of altereted p53.in assessing ofimmunostaining ofcell cycle regulators(p21, p27, p53, cyclind1andc-myc) in canineprostateswithproliferative lesionswas observedthatcarcinomas probably have lowgrowth potentialwhenoverexpressed of p21andp27, reduced expression of cyclind1and unalteredexpression ofc-myc, even in the presence ofmutant p53type.further,considering thesimilarimmunophenotypein canine glands with PIA, PINandPC considered the regulatorsofcell cycle progression, it is reinforce the pre-malignant potential of PIA andpinin the canineprostate. Keywords:FFPE, immunohistochemistry, PIA, PIN, prostatic carcinoma, RT-PCR.
23 CAPÍTULO 1 - CONSIDERAÇÕES INICIAIS 1.1.Morfofisiologia e enfermidades da próstata canina No cão, a próstata representa a única glândula sexual acessória, compondo-se por órgão retroperitonial músculo-glandular, ovóide e bilobulado, que circunda a uretra proximal 1. Localiza-se caudal à bexiga, ventral ao reto e dorsal à sínfise púbica 1,2, podendo variar de posição a depender da idade, distensão da bexiga e enfermidades envolvendo a glândula 3 (Figura 1A). Sua principal função é a produção do líquido prostático, que atua como meio de transporte, proteção e nutrição para os espermatozóides durante a ejaculação 5. Além disso, auxilia no metabolismo da testosterona em diidrotestosterona 3. A próstata canina possui dois lobos, separados por um septo medial de tecido fibroso 1,2. Esses lobos subdividem-se em lóbulos, contendo glândulas túbulo-alveolares ramificadas (ácinos), recobertas por epitélio colunar simples 5, sustentadas por delicado estroma e que se estendem desde sua abertura no ducto uretral até a cápsula fibromuscular prostática, a qual limita e protege o parênquima glandular 1,6. O epitélio glandular prostático é composto por dois tipos celulares, as células epiteliais secretoras colunares altas e as células epiteliaisda camada basal, estas localizadas ao longo da membrana basal. O estroma consiste de fibroblastos e células musculares lisas, envoltos em colágeno, com vasos sanguíneos e nervos 3,6 (Figura 1B) A B FIGURA 1 - A) Vista ventral da cavidade pélvica canina. 1) Bexiga urinária; 2) próstata; 3) reto; 4) uretra. B) Fotomicrografia da histomorfologia normal da próstata canina. Glândula túbulo-alveolar ramificada (ácinos), recobertas por epitélio colunar simples (seta preta). Lúmen glandular (asterisco), estroma de sustentação fibromuscular (seta amarela) e célula basal (seta verde). HE, 200x. Fonte: Faleiro 7,8
24 2 As doenças prostáticas representam um problema comum em cães adultos e idosos, semelhante ao que ocorre na próstata do homem Dentre as enfermidades que acometem a prostáta dos cães, destacam-se a hiperplasia prostática benigna 12 (HPB), as prostatites 3,4, as lesões displásicas 12 e o carcinoma prostático (PC) 6, Quanto às lesões displásicas da próstata, consideradas pré-malignas, destacam-se a neoplasia intraepitelial prostática (PIN) 15,18 e a atrofia inflamatória proliferativa (PIA) 13,16. A caracterização diagnóstica das prostatopatias caninas é um constante desafio, uma vez que a similaridade dos sinais nas diferentes enfermidades e a substancial possibilidade de ocorrência concomitante de duas ou mais alterações limitam diagnósticos precisos, somado ao fato da inexistência de testes bioquímicos apropriados para a espécie, como biomarcadores de detecção precoce de enfermidades como HPB e câncer. Ressalte-se que à exceção da prostatite aguda, cães com doenças prostáticas são comumenteassintomáticos 3,5,19. Similaridades em relação à ocorrência natural e influência hormonal no desenvolvimento das afecções prostáticas, principalmente HPB 17, PIN 18, PIA 13 e PC 6, têm feito do cão modelo experimental para o estudo de algumas dessas prostatopatias na glândula humana 10,11,17,18, contribuindo para o conhecimento médico e médico-veterinário acerca das doenças prostáticas nessas espécies. Considerando essas similaridades e o contexto do estudo, apresentam-se a seguir as enfermidades relacionadas aos objetivos desta pesquisa Hiperplasia prostática benigna (HPB) A hiperplasia prostática benigna (HPB) é a prostatopatia mais comum no cão 20 eestá associada ao envelhecimento e a desequilíbrios hormonais envolvendo a testosterona, a diidrotestosterona (DHT) e o estrogênio 3,12,17. A HPB no cão envolve preferencialmente o componente epitelial e ocorre de forma difusa 19,21, enquanto no homem costuma ser estromal e nodular 20. Apesar disso, o cão é a única espécie não humana que desenvolve HPB espontaneamente, o que reforça sua utilização como modelo experimental para essa doença no homem 20,22. Em decorrência do desequilíbrio entre andrógenos prostáticos, há alteração da interação entre estroma e epitélio, havendo resposta das células epiteliais aos fatores de crescimento produzidos pelas células estromais. Observa-se tanto aumento no número de células (hiperplasia), quanto aumento no tamanho das mesmas (hipertrofia) 19. Essa alteração resulta em descontrole na proliferação, migração e morte celular, sendo um dos fatores que
25 3 contribuem para o desenvolvimento da HPB 20. Quanto ao padrão histológico da HPB canina há dois tipos bem caracterizados, a hiperplasia glandular, com proliferação das células secretoras; e hiperplasia complexa, com hiperplasia glandular intercalada a focos de atrofia. Neste último, há proliferação dos elementos estromais em associação a áreas atróficas ou de ácinos dilatados, císticos e preenchidos por material eosinofílico 12,20,21 (Figura 2). FIGURA 2 - Fotomicrografia da próstata canina com HPB cística. Evidenciação deácinos acentuadamente dilatados (asterisco vermelho), irregulares e proliferação estromal adjacente (asterisco preto). HE, 200x. Fonte: Faleiro 8 Embora a HPB possa ocorrer concomitantemente a lesões potencialmente prémalignas, como a PIN e PIA, e malignas, como o PC 22,23, é improvável que a HPB represente lesão pré-neoplásica Atrofia inflamatória proliferativa (PIA) O termo atrofia inflamatória proliferativa, do inglês proliferative inflammatory atrophy (PIA), foi proposto para designar focos de epitélio glandular proliferativo com o aspecto morfológico de atrofia focal simples e inflamação concomitante 24. A atrofia da próstata é identificada pela redução no volume glandular e estroma pré-existentes, sendo caracterizada em dois padrões, difuso e focal. A forma difusa resulta da diminuição de andrógenos circulantes e envolve a próstata como um todo, de maneira relativamente uniforme. Ao contrário, a atrofia focal não se relaciona unicamente à diminuição de andrógenos circulantes e ocorre como áreas de epitélio atrófico intercaladas com áreas de epitélio de aspecto normal e são proliferativas, sendo que a ampla maioria associa-se à
26 4 inflamação, de maneira que essas lesões podem se originar em um cenário de estresse oxidativo aumentado, possivelmente derivado das células inflamatórias próximas A inflamação é sugerida como fator etiológico capaz de incitar a carcinogênese por causar dano celular e no genoma, promover a substituição celular e criar um microambiente rico em radicais livres tóxicos, ácido aracdônico, proteases, citocinas e fatores de crescimento que elevam a replicação celular, antiapoptóticos e a angiogênese 27,28. Portanto, no que refere à carcinogênese, a inflamação pode atuar como agente iniciador, via efeitos genotóxicos, ou como agente promotor, via efeitos citotóxicos 29. Ainda, segundo Nonomura et al. 30 e Sfanos e De Marzo 26, a inflamação crônica em tecidos benignos prediz o desenvolvimento de câncer de alto grau (com escore de Gleason entre 7-10). Sugar 31 e Tomas et al. 14 sugerem que na PIA ocorre equilíbrio entre proliferação e perda celular por mecanismos que não os apoptóticos, uma vez que nessas lesões há proliferação, mas não há perda celular por apoptose, e mesmo assim não há crescimento em volume. Ainda, acreditam em injúria celular direta e que as células lesadas caem no lúmen glandular e são eliminadas no ejaculado ou capturadas por macrófagos. Além disso, inferem que o epitélio em regeneração suprima a morte celular programada, ao menos temporariamente, para substituir as células perdidas, fato que poderia explicar a expressão aumentada de B-cell lymphoma/leukemia-2 (Bcl-2) nas células secretoras da PIA, resultando em níveis muito baixos de apoptose e embasando o conceito de que a PIA é uma lesão regenerativa. Ainda, os fatores de crescimento poderiam estar sendo liberados tanto pelas células epiteliais lesadas quanto pelas células inflamatórias presentes. Há vários critérios para que se considere uma lesão pré-maligna, como a relação epidemiológica, a presença anterior ao câncer, assemelhanças morfológicas e a proximidade ou equivalência às suas características de malignidade 32. A PIN é considerada a lesão precursora mais provável do carcinoma prostático invasivo por atender a tais critérios 32. Apesar da PIA também ser apresentada como lesão prostática pré-maligna, destaca-se que Anton et al. 34 e Billis e Magna 35, não encontraram associações entre a atrofia prostática e câncer. Já Wang et al. 36 observaram que 70% das lesões de PIN e 28% das de PC eram margeadas por PIA. Com isso, concluíram sobre a evidência direta entre as lesões e mostraram transições morfológicas entre PIA e PIN, e PIA e PC na próstata humana. Além disso, muitos focos de PIA compartilham alterações fenotípicas, genotípicas e moleculares com PIN e PC, podendo esses focos compor o principal alvo de transformação neoplásica Putzi e De Marzo 38 avaliaram a relação entre PIA, PIN e adenocarcinoma prostático em humanos e observaram concomitância entre PIA e PIN, PIA e PC, e PIN e PC,
27 5 sendo as combinações de topografia variada, observando-se desde lesões adjacentes a distantes. Dessa forma, os autores acreditam que embora não caracterize regra, a PIA pode representar um precursor da PIN e/ou do PC, embora assumam que a relação topográfica não seja prova definitiva dessa proposta. Enfatizam ainda que nem todas as lesões de PIN ou pequenas lesões de PC estão associadas à atrofia, assim como nem todas as lesões atróficas são precursoras de PIN ou PC. Segundo Palapattu et al. 27, a PIA compreende resposta das células epiteliais prostáticas normais a um microambiente de estresse, e regiões individuais de PIA que são inábeis em debelar o dano oxidativo ao genoma podem progredir para PIN ou PC. Assim, as células epiteliais da PIA são possíveis alvos de transformação neoplásica, passando ou não por PIN, o que significa dizer que dão origem ao PC indireta ou diretamente. Contudo, alguns tumores parecem se desenvolver diretamente da PIN enquanto outros ocorrem sem evidência de lesões precursoras 36,37. Em cães, alguns autores estudaram a relação da PIA com a evolução do PC 13,15,16,39,40. Di Santis 41 caracterizou morfologicamente e imunofenotipicamente a PIA e a PIN, validando o potencial pré-maligno dessas lesões na próstata do cão. Rodrigues et al. 15 embora não tenham examinado o aspecto proliferativo da PIA, encontraram imunomarcação para cicloxigenase-2 (COX-2) e fator de crescimento transformador beta (TGF-β) em quantidade intermediária entre o tecido normal e o PC, concluindo tratar-se de lesão pré-neopásica, já que o aumento na expressão desses reguladores de atividades celulares é observado em processos neoplásicos. Toledo et al. 13, com base nos critérios de De Marzo et al. 25 e Di Santis 41, propuseram a subdivisão da PIA canina de acordo com o grau de inflamação adjacente aos focos atróficos, sendo discreta, quando há poucas células inflamatórias e estas são esparsas em sua maioria; moderada, quando há agregados de células inflamatórias sem destruição tecidual ou formação de folículos ou nódulos linfoides (Figura 3A); e acentuada, quando da presença de agregados confluentes de células inflamatórias com destruição tecidual ou formação de folículos ou nódulos linfoides (Figura 3B).
28 6 A B FIGURA 3 - Fotomicrografia de próstata canina com foco de atrofia inflamatória proliferativa (PIA). A)PIA cominfiltrado inflamatório mononuclear intersticial (asterisco) e atipias epiteliais com mais de uma camada de células epiteliais (seta), citoplasma marcadamente reduzido, núcleos aumentados e nucléolos evidentes (PIA-moderada), HE, 400x; B) Atrofia acinar, dupla camada de células epiteliais (seta) e infiltrado inflamatório mononuclear intersticial (asterisco) (PIA-acentuada), HE, 200x. Fonte: Toledo et al. 13 Croce et al. 40 avaliaram a expressão imunoistoquímica de óxido nítrico sintase 2 (NOS-2), COX-2, p53 e Glutathione S-transferase pi 1 (GSTP-1) em focos de PIA e PC canino e concluíram que o aumento na expressão de NOS-2, COX-2 relaciona-se ao estresse oxidativo, muitas vezes gerado pelo infiltrado inflamatório, podendo o epitélio prostático ser foco de alteração genética e transformação neoplásica. Ainda, a expressão aumentada do GSTP-1 poderia conferir certa proteção ao dano oxidativo ao tecido prostático. Faleiro et al. 16 avaliaram a expressão imunoistoquímica das metaloproteinases de matriz 2 e 9 (MMP-2 e MMP-9) e receptor de ativador de plasminogênio tipo uroquinase (upar) na próstata canina com PIA e concluíram que a inflamação influencia positivamente a atividade dessas enzimas. Com isso, ocorre maior atividade proteolítica na matriz extracelular (MEC), possivelmente contribuindo para a remodelação e o processo de invasão tumoral e metástase. Essa idéia é reforçada nos achados de Toledo 42, que observou maior expressão de inibidor tecidual de metaloproteinase-1 (TIMP-1) no tecido prostático com PIA, PIN e PC e menor expressão de TIMP-2, demonstrando o desequilíbrio dessas proteínas nos focos de PIA, o que contribui com a remodelação tecidual e possível grau de invasão tumoral e metástase. Rodrigues et al. 15 ao analisar a expressão gênica de COX-2 e estudar ascélulas da camada basal pela marcação imunoistoquímica de p63 na PIA e no PC canino, observarammaior expressão gênica de COX-2 no estroma em relação às células epiteliais, e
29 7 aumento da proliferação e redução daapoptose das células secretoras na PIA e no PC. O mesmo ocorreu com as célulasbasais na PIA, que apresentaram maior índice proliferativo e menor taxa de apoptose.ainda, sendo a expressão de COX-2 na PIA maior no compartimento estromal, revela o importante papel dessa enzima na carcinogênese prostática canina. Fonseca-Alves et al. 39 analisaram por imunoistoquímica a expressão de c-myc, NKX3.1,E-caderina e p63no tecido prostático canino com HPB, PIA e PC, e observaram que a expressão de c-myc eleva-se nos casos de PC e PIA em comparação ao tecido prostático normal. A proteína NKX3.1 apresentou-se reduzida em 94,75% dos casos de PC e em 100% dos de PIA em comparação ao tecido normal. Ainda, a expressão de E-caderina apresentou menor expressão nos tecidos com PC em relação aos com PIA e normal, bem como a expressão de p63 foi maior em PC e PIA do que no tecido normal. Dessa forma, demonstram que a carcinogênese do tecido prostático canino pode estar relacionada com a proliferação de células basais, ganho de função de c-myc e perda da expressão da proteína NKX3.1 e E- caderina, bem como potencial envolvimento das células basais no desenvolvimento da PIA para PC Neoplasia intraepitelial prostática (PIN) Inicialmente, o termo displasia foi utilizado para designar alterações não usuais no epitélio glandular prostático e diferenciá-las de lesões inquestionavelmente benignas e de proliferações verdadeiramente neoplásicas, e abrangia várias alterações, como as de natureza atrófica, inflamatória e metaplásica, além de hiperplasias atípicas glandulares e intraductais 43. Em 1986, Mcneal e Bostwick 44 propuseram que a displasia intraductal na próstata humana poderia representar uma lesão pré-maligna, constituindo-se no precursor biológico direto do PC. O termo neoplasia intraepitelial prostática (PIN) foi proposto por Bostwick e Brawer 43 e endossado consensualmente por Drago et al. 45, com o intuito de substituir termos sinônimos como displasia intraductal, hiperplasia atípica acinar, hiperplasia com alterações malignas, marcada atipia e displasia ductoacinar, unificando a terminologia PIN para designar as alterações displásicas intraepiteliais da próstata humana 46. A PIN é observada em mais de 85% dos casos de PC e em 43% de forma contígua às lesões prostáticas benignas da próstata humana 44,46, sendo que estudos acerca do comportamento biológico dessa lesão comprovaram seu aspecto pré-maligno Os mecanismos de proliferação e diferenciação celular estão alterados na PIN, pois são observadas células basais atípicas, com potencial proliferativo, migrando para o compartimento secretor, enquanto no tecido normal ou hiperplásico a capacidade proliferativa
30 8 é restrita à camada basal 15,41. Com a indiferenciação celular, tende a ocorrer perda gradativa das células basais, facilitando a extensão da lesão para o estroma e sua transformação em carcinoma invasivo, com aumento da atividade proliferativa, neovascularização, instabilidade genética e variação na quantidade de DNA 44,46. Histologicamente, a PIN consiste de alterações nos ductos ou ácinos, geralmente multifocais. A lesão pode ser de baixo grau (LGPIN) ou de alto grau (HGPIN). Focos de LGPIN caracterizam-se por ductos ou ácinos com epitélio hipercelular, condensado e irregular, com marcada variação do tamanho nuclear. Núcleos alongados, hipercromáticos e pequenos nucléolos podem estar presentes. A HGPIN é semelhante à LGPIN, porém a alta celularidade e a estratificação celular são mais evidentes e a variação do volume nuclear entre as células é menor, pois a maioria possui núcleo aumentado. Nucléolo proeminente e frequentemente múltiplo é uma característica da HGPIN. Além disso, a membrana basal do epitélio da próstata humana apresenta-se íntegra e a lesão apresenta crescimento lento 46 (Figura 4). O primeiro relato mencionando PIN em cães descreve a presença da lesão em 19 (66%) de 29 glândulas com diagnóstico de adenocarcinoma 18. As características histológicas da PIN na próstata canina são similares àquelas descritas na glândula humana 48, a exceção da continuidade da camada de células basais, a qual no cão é naturalmente descontínua 18. Assim como Waters e Bostwick 48, que observaram incidência de 55% de PIN em cães idosos e não castrados sem que apresentassem evidências clínicas de câncer, Di Santis 41 observou 12,5% de PIN canina nas mesmas condições. No entanto, Aquilina et al. 49 observaram PIN em 72% dos animais com PC. Os autores consideraram a frequente associação entre PIN e adenocarcinoma um forte indicativo de que a PIN compreenda lesão pré-maligna. Apesar da incidência da lesão ter sido baixa nos animais sem câncer prostático, os mesmos acreditam que a lesão possa ter sido subestimada pelo fato de se ter avaliado apenas uma amostra do tecido prostáticodesses animais. Ainda segundo esses autores 48,49, a prevalência da PIN em cães e humanos é influenciada pela idade e por andrógenos testiculares, constituindo a única espécie não humana em que a PIN se desenvolve espontaneamente.
31 9 FIGURA 4 - Fotomicrografia de próstata canina com foco de PIN. Epitélio acinar estratificado e displásico, com variação do tamanho nuclear, nucléolo evidente e perda de diferenciação citoplasmática (seta). HE, 400x. Fonte: Faleiro 8 A PIN nas próstatas canina e humana apresenta-se de forma semelhante no que diz respeito à morfologia e associação com o câncer 46,48. Assim, a próstata canina é apontada como modelo para a determinação dos fatores que regulam a aparente progressão do epitélio benigno para PIN, e deste para o carcinoma invasivo 18, Carcinoma prostático(pc) As neoplasias da próstata canina são comumente epiteliais malignas, de estrutura glandular ou acinar 50, sendo o adenocarcinoma e o carcinoma indiferenciado os tipos histológicos mais comuns 50,51. Nos cães, os PC são raros, de baixa prevalência e relatados com maior frequência em animais adultos e idosos 21,52, oposto ao que ocorre no homem, para o qual o PC é a forma mais comum de câncer e a segunda causa de óbito entre os homens 10,11. Vale destacar que a lesão é extremamente rara em qualquer outra espécie animal 52,53. A maioria dos PC no homem e no cão apresenta padrão intra-alveolar e morfologia heterogênea, variando de pequenos focos de células relativamente bem diferenciadas a camadas de células anaplásicas, lembrando carcinoma de células renais claras ou carcinoma de células transicionais 52,54 (Figura 5). Em associação aos focos de PC canino é possível encontrar focos de HBP, dilatação glandular e inflamação supurativa ou linfoplasmocitária significativa 3. Os PC no homem são classificados de acordo com o sistema
32 10 de Gleason, em que escores são atribuídos aos tumores com base na diferenciação arquitetônica, padrões de crescimento em relação ao estroma e atipias nucleares das células em amostras coradas em HE, tornando o sistema um bom indicador da progressão e evolução clínica da doença 55.Padrões semelhantes aos observados no sistema Gleason foram encontrados nas neoplasias da glândula canina, mas sem significado prognóstico, restringindo sua utilização na rotina diagnóstica 6. Acredita-se que o PC na espécie humana tem início em lesões pré-malignas, a exemplo das displasias, em que as células sofrem alterações substanciais, diferem-se das normais e adquirem características proliferativas e de dominância sobre as células adjacentes 56. Nesse contexto, postula-se que a fase inicial do PC corresponda à PIN de alto grau 25,43,47, encontrada em 82% dos PC invasivos e em 43% das glândulas de homens acima de 50 anos sem sinais de câncer 44. No cão, a ocorrência da PIN de alto grau com PC concomitante foi relatada entre 30-72% dos casos 49,57. Em contraste, na ausência de PC, a PIN foi encontrada em 3% dos casos por Madewell et al. 57 e não relatada por Aquilina et al. 49. É sabido que o PC no homem está associado a mutações em genes prostáticos susceptíveis, como TP53 e ErbB2, juntamente a defeitos somáticos em genes como NKX3.1, C-MYC, ErbB1, PTEN, CCND1, CDKN1B, CDKN1A e o gene receptor de andrógeno 58 (AR). Já em cães, pouco se conhece sobre a patogênese molecular e origem dos PC 91. De acordo com Leroy e Northrup 52, não foram identificadas mutações somáticas predispondo os cães ao maior risco para o desenvolvimento de PC, maswinkler et al. 59 afirmam que há anormalidades cromossômicas no PC canino. Entretanto, Ganem et al. 60 destacam que não se pode afirmar se essas anormalidades cromossômicas no PC humano ou canino são causa ou consequência da transformação neoplásica. Fatores endógenos e exógenos têm sido considerados predisponentes ao risco do desenvolvimento do PC humano, incluindo histórico familiar, raça, idade e fatores nutricionais 8,52, o que não se extrapola aos cães e dificulta a identificação das alterações genéticas associadas ao processo 52. Devido à natureza agressiva da neoplasia e da falta de um teste de identificação de cães com PC em estágio inicial, metástases são observadas em aproximadamente 80% dos casos e localizadas preferencialmente nos linfonodos pélvicos, ilíacos internos e externos, até corpos vertebrais, sistema esquelético e pulmões 11,52,61. No cão considera-se espontânea a etiologia do PC, mas não há dúvidas quanto ao envolvimento hormonal 62. Johnston et al. 1 relataram que a depleção andrógena pósorquiectomia resulta em involução de lesões proliferativas prostáticas benignas, mas não de PC. Nesse sentido, Bell et al. 63 estudaram o comportamento biológico do PC em cães
33 11 castrados e não castrados. Observaram metástases em 89% dos animais e curiosamente as lesões pulmonares prevaleceram nos cães orquiectomizados. Além disso, o tipo histológico observado com maior frequência foi o adenocarcinoma pouco diferenciado. Por isso, sugerese que o PC seja mais agressivo nos cães castrados, mesmo considerando que os não castrados são mais susceptíveis a doenças prostáticas 63,64. Para Teske et al. 61, a castração favorece a progressão do processo neoplásico. Já Mahapokai et al. 65 descreveram que o aumento no número de células basais na próstata de animais castrados sugere que os PC mais agressivos possam ter origem nessas células, visto que as mesmas são andrógeno-independentes, sobrevivem e proliferam ativamente na ausência desses hormônios. Interessante que Garnick 66 também apresenta a possibilidade da vasectomia aumentar o risco de PC na espécie humana. Já Swinney 67 apresentou duas hipóteses de etiologia para a PC em cães orquiectomizados: 1) as células envolvidas no tumor são hormônio-independentes; 2) as neoplasias sofrem influências de hormônios extratesticulares, como os produzidos na adrenal. FIGURA 5 - Fotomicrografia de carcinoma prostático canino. Áreas de proliferação celular com atipias e perda da conformação acinar. HE, 400x. Fonte: Faleiro 8 Para Pylkkänen et al. 68, diferenças significativas entre o PC humano e canino, como baixa incidência, longo período de latência e grau de resposta hormonal descartam o
34 12 cão como modelo prático para a carcinogênese prostática humana. Contudo, Waters e Bostwick 18, Madewellet al. 57, Lai et al. 6,Leroy e Northrup 52, Anidjar et al. 10 e Keller et al. 11 apontaram semelhanças relevantes entre as espécies, incluindo desenvolvimento embrionário, anatomia macroscópica e microscópica, desenvolvimento em idade avançada, concomitância com focos de PIN, localização anatômica e propensão para metástases ósseas que, segundo os autores, fazem do cão modelo experimental adequado para o estudo do PC humano. 1.2.Carcinogênese Os processos neoplásicos sejam benignos ou malignos ocorrem em decorrência de alterações nos genes, cujas mutações podem ser de origem hereditária ou adquiridas pelas células somáticas 69,70. Os eventos moleculares envolvidos na gênese neoplásica são os mesmos entre as diferentes espécies animais, e geralmente resultam de mudança do estado celular a partir do acúmulo de alterações genéticas e epigenéticas, que desorganizam os eventos celulares normais 68. De acordo com Clark 71, o processo neoplásico é considerado uma forma aberrante de vida, de enorme complexidade pelo ponto de vista evolutivo, não sendo explicável única e exclusivamente por suas modificações no material genético celular. Segundo Solomon et al. 72, um neoplasma é decorrente de uma série progressiva de alterações gênicas irreversíveis que ocorrem em um único clone celular, como resultado de uma série de fatores, incluindo alterações nos oncogenes sob a ação de fatores de crescimento, assim como nos genes supressores tumorais. É necessário ainda ocorrer fixação da lesão e conversão gênica após a replicação do DNA e a divisão celular, o que compreende a primeira etapa (iniciação) de um evento complexo,de quatro fases, conhecido como carcinogênese ou gênese neoplásica 69,70. Na fase subsequente, a promoção, acontece diferenciação celular entre célula normal e neoplásica pela capacidade de escape aos mecanismos homeostáticos do organismo, favorecendo uma proliferação desorganizada e descontrolada, só cessada quando a neoplasia já não consegue mais realizar o metabolismo apenas por difusão. Se continuar crescendo, as células ao centro morrerão por necrose ou apoptose. Acredita-se que microtumores nesse estágio possam sobreviver em estado dormente, em que o número de células que proliferam se equivaleria ao das que morrem 69,70. Para continuar a progredir e se manifestar, na terceira e quarta fases da gênese, a célula neoplásica precisa induzir a produção de fatores pró-angiogênicos capazes de estimular as células endoteliais dos vasos sanguíneos adjacentes a degradar sua lâmina basal e migrar
35 13 em sua direção. Isso confere ao tumor maior potencial invasivo e consequentemente maior potencial metastático 70,72 (Figura 6). FIGURA 6 - Representação esquemática das fases da carcinogênese. Iniciação, promoção, progressão e manifestação. Fonte: Adaptado de INCA 73. Diante disso, alterações na expressão de proto-oncogenes e genes supressores tumorais desempenham papel-chave na gênese neoplásica. A disfunção na produção de seus produtos protéicos leva à regulação anormal das vias de sinalização que controlam o ciclo celular, a apoptose, a estabilidade genética, a diferenciação celular e as reações de morfogênese. Alterações nesses importantes processos fisiológicos são responsáveis tanto pelas etapas iniciais de transformação das células neoplásicas, quanto pela determinação da progressão do tumor, resultando no desenvolvimento de tumores malignos 72. Uma das características mais importantes das células malignas é a capacidade de proliferação, ou seja, a célula normal perde o controle da sua própria divisão, rompendo assim uma série de barreiras fisiológicas, os pontos de controle ou checagem do ciclo celular, para tornar-secancerosa 71, Ciclo e crescimento celular O ciclo celular é composto de uma sequência ordenada de fases, incluindo G0, G1, S, G2 e M. Em G0, a célula atinge sua diferenciação terminal e está quiescente. Quando estimulada a proliferar, esta entra em gap 1(G1 ou primeiro intervalo), período em que aumenta de tamanho e prepara as proteínas de que necessita para a síntese de DNA. Em G1, a célula é susceptível às condições do microambiente, que pode parar a divisão em condição desfavorável. No entanto, se ultrapassar o ponto de restrição (ponto R), a divisão celular ocorrerá independente dessas condições. Na fase subsequente, de síntese (fase S), ocorre a síntese de DNA, que será replicado na fase gap 2 (G2 ou segundo intervalo). No início de G2
36 14 há outro ponto de controle importante, em que será verificada a qualidade do DNA replicado. Na fase mitótica (M), os cromossomos se condensam na prófase, na metáfase se alinham ao centro da célula pela ligação ao centrômero, na anáfase separam e migram para os pólos opostos do fuso e, na telófase, as células se dividem e o DNA duplicado será dividido igualmente dentre as duas células filhas. Em caso de anormalidades na divisão dos cromossomos, a mitose é interrompida 70,72,76-78 (Figura 7). FIGURA 7 -Ciclo celular. A) Representação gráfica esquemática do ciclo celular com as fases G0, G1, S, G2 e M, e os pontos de checagem do ciclo (setas vermelhas). B) As fases da mitose. Interfase, prófase, metáfase, anáfase e telófase. Fonte: Nessa sequência ordenada de fases há quatro pontos de verificação que garantem que uma fase não se inicie antes do término da anterior, bem como confirmam o êxito dos eventos moleculares de cada fase. Assim, o primeiro ponto de checagem ocorre ao final de G1; o segundo na fase S, impedindo a célula de avançar no ciclo antes que o DNA complete sua duplicação; o terceiro ocorre ao final de G2, com a principal função de conferência da integridade do DNA; e o quarto ponto ocorre em M, mais precisamente na anáfase, verificando o correto funcionamento do fuso mitótico e associação às fibras dos mesmos, para que a divisão celular aconteça corretamente 72,76,77. Esses eventos são controlados pela expressão coordenada do gene da proteínaretinoblastoma (prb), e pela interação entre as ciclinas e as quinases dependentes da
37 15 ciclina (CDK), e as proteínas inibidoras de CDK (CDKIs) 70,75,77. Essas são, portanto, responsáveis por regular a atividade de um amplo número de proteínas que implicam na duplicação do DNA e na mitose, com a fosforilação das mesmas em sítios reguladores específicos, ativando algumas e inibindo outras, mas coordenando-lhes as atividades 76,77. O crescimento e a diferenciação celular são processos essenciais para os seres vivos, pois a proliferação das células é necessária para que ocorra a embriogênese, o crescimento e o funcionamento adequado de diversos tecidos adultos 75,76. Dessa forma, a população celular é controlada por sinais do microambiente, que podem estimular ou inibir a sua proliferação. Um excesso de estimuladores ou a deficiência de inibidores levam a célula a proliferar, entretanto, em casos neoplásicos essa proliferação se dá de forma descontrolada 70. O principal foco da investigação sobre a proliferação celular tem sido o entendimento dos mecanismos que regulam o estado proliferativo, trabalho que remete à identificação dos fatores e dos respectivos receptores de crescimento, bem como das vias de transdução de sinais e transcrição que permitem as células iniciar e manter o ciclo celular 78. Em um tecido adulto, o tamanho da população celular é determinado pelo balanço entre proliferação, diferenciação celular e morte por apoptose 70,76 (Figura 8). Entre as alterações promovidas pelas células neoplásicas, encontram-se as anormalidades na resposta celular a fatores de crescimento e seus receptores que promovem a proliferação celular, que inibem apoptose e habilitam células cancerosas a disseminar e a estimular a angiogênese 70,75. FIGURA 8 - O número de células de um tecido pode ser alterado pelo aumento ou diminuição da taxa de recrutamento das células tronco, pela morte celular por apoptose ou por alterações nas taxas de proliferação ou diferenciação. Fonte: Adaptado de McGavineZachary 70.
38 16 A síntese de proteínas é a manifestação de um gene. Por isso, genes que codificam proteínas que são sintetizadas em um evento de divisão celular normal são denominados proto-oncogenes, e sua principal função é induzir ou estimular a progressão do ciclo. Quando esses genes sofrem mutações são chamados oncogenes, cuja ação permitirá ganho de função à célula mutante, conferindo a esta vantagens de crescimento e desenvolvimento sobre as células normais. Há ainda genes conhecidos como supressores tumorais ou antioncogenes, que possuem ação de proteção ou são bloqueadores do ciclo celular, que quando sofrem mutações perdem a capacidade de realizar suas funções e acabam por permitir a proliferação celular descontrolada Esses genes codificam proteínas que estão envolvidas na inibição da proliferação celular e que são cruciais para o desenvolvimento e diferenciação celulares Fatores de crescimento Os fatores de crescimento são um conjunto de substâncias, a maioria de natureza protéica, que juntamente com hormônios e neurotransmissores desempenham importante função na comunicação intercelular 70,78. Em baixas concentrações, atuam em células alvo in vivo ou in vitro como mitógenos, isolados ou sinergicamente a outros fatores, por meio da interação primária com receptores específicos da superfície celular. Fosforilam e ativam uma cascata de sinais que culmina em ativação de um ou vários genes (transdução de sinal). A função dos fatores de crescimento é regulada por diferentes mecanismos que controlam a ativação do gene do fator de crescimento por mecanismos regulatórios em nível transcricional e da traducional e a modulação da emissão do sinal pelo receptor 70,76,78. Os fatores de crescimento atuam por três mecanismos, autócrino, parácrino e endócrino. No primeiro, uma mesma célula produz e responde ao fator de crescimento. No segundo, uma célula recebe a ação do fator de crescimento produzido por uma célula adjacente. No terceiro, o fator de crescimento é secretado por uma célula, transportado pela circulação e age em células distantes 76,78. Dentre os fatores de crescimento de interesse na gênese do PC destacam-se: fator de crescimento epidérmico (EGF), fator de crescimento transformador alfa e beta (TGF-α; TGF-β), fator de crescimento semelhante à insulina (IGF), fator de crescimento de queratinócito (KGF), fator de crescimento fibroblástico (FGF), fator de crescimento plaquetário (PDGF) e fator de crescimento vascular endotelial (VEGF) 81 (Quadro 1).
39 17 QUADRO 1 - Fatores de crescimento, células de origem, sítios alvo e suas funções no tecido prostático normal e neoplásico FC Célula origem Sítios alvo Papel napróstata Papel no PC EGF Superfície luminal do tecido epitelial EGFR na superfície do tecido epitelial baso lateral TGF-α Estroma EGFR na superfície de células epiteliais basolaterais TGF- β Estroma e músculo esquelético TβRI e TβRII na superfície das células epiteliais IGF-I Estroma IGF1R na superfície da célula epitelial, sequestrado e degradado por IGF2R FGF Estroma bfgf receptor em células estromais no tecido normal e presente nas células epiteliais no KGF Estroma e epitelial PC FGFR2 receptorna célula epitelial normal Regula o crescimento Regulação do crescimento Induz apoptose, controla crescimento celular via bfgf Promove crescimento e diferenciação celular Regulação do crescimento Mediador da ativação androgênica Superexpressão em metástase e invasão tumoral Superexpressão nas células epiteliais Superexpressão no PC Expressão epitelial e níveis séricos aumentados Superexpresso em metástase e promove angiogênese Produção epitelial com progressão independente de andrógenos PDGF Estroma e epitelial no PC PDGFα receptor em células epiteliais no PC Baixa expressão Aumento da expressão dos receptores no PC VEGF Epitelial Células endoteliais Não definido Expressão aumentada no PC PC - carcinoma prostático Fonte: Adaptado de Hellawell e Brewster Receptores de fator de crescimento epidérmico -EGFR/Her1 e Her2/c-erbB-2 O fator de crescimento epidérmico (EGF) é um membro da família dos fatores de crescimento (FC) que compartilha o mesmo receptor, o receptor de fator de crescimento epidérmico (EGFR), com o fator de crescimento transformador alfa (TGF- α). É detectado em praticamente todo o organismo, principalmente saliva, secreções mamárias, prostáticas, da vesícula seminal e na urina, na qual se encontra em alta concentração O eixo EGF, composto pelos fatores de crescimento EGF e TGF-α, seus receptores (EGFR), receptores de andrógenos (AR), testosterona, hormônio hipotalâmico (LH-RH) e antígeno prostático específico (PSA), é considerado uma das formas de ativação não androgênica dos receptores androgênicos nas alterações prostáticas malignas, sendo esse eixo relacionado à progressão do PC. Nesse âmbito, a mediação da atividade mitogênica dos ligantes EGF e TGF-α, utilizando vias de ativação parácrina e autócrina, é feita pelos
40 18 receptores EGFR e AR, por modulação do LH-RH ou da testosterona e por ação direta do EGF em ambos os receptores, mesmo em meio ausente de andrógenos, no qual o PSA representa importante protease do EGFR 84. Na próstata, o EGF é produzido no tecido normal, na HPB e no PC 82,84,86, sendo que, para Pina et al. 82, não há relação entre níveis séricos de EGF e carga tumoral ou escala de Gleason. Embora no PC o EGF circulante se manifeste com hiperprodução autóloga em aproximadamente 50% dos casos, provavelmente o seu principal papel será o da atividade autócrina, não só na diferenciação neuroendócrina, como também no estímulo migratório celular do câncer em fase androgênica. Contudo, a baixa imunorreatividade de EGFR está associada a prognóstico favorável em pacientes com câncer de próstata 86. A família do EGFR, um receptor tirosina-quinase, desempenha papel importante na determinação da linhagem celular, na morfogênese de vários órgãos e na sobrevivência das células no adulto. A superexpressão contribui para a tumorigênese, induzindo as células a proliferar e resistir a apoptose A família compreende os receptores EGFR ou Her1, Her2 ou c-erbb-2, Her3 ou c-erbb-3 e Her4 ou c-erbb-4, codificados pelos genes ErbB (erythroblastic leukemia viral oncogene homolog) 1, ErbB2, ErbB3 e ErbB4,respectivamente. As proteínas produzidas pelos membros dessa família possuem em comum estrutura composta de domínio de ligação extracelular, este constituído por quatro subdomínios (L1, CR1, L2 e CR2 - I, II, III, IV), dispostos em repetição de duas unidades e separados por resíduos ricos em cisteína; um segmento lipofílico transmembrana; e área citoplasmática com domínio de atividade tirosina-quinase, a qual possui locais de auto fosforilação para regulação em cauda c-terminal 85,87-89 (Figura 9). O receptor EGFRpossuiestrutura que compreendedomíniode ligação extracelular, domínio hidrofóbico transmembrânico edomínio intracelularcom domínio de tirosina-quinase para a transdução desinal. Ao ser ativado pela ligação com o EGF ou TGF-α, promove sua dimerização ou a heterodimerização comoutro membrodafamíliaerbb. Issoleva àativaçãoda tirosina-quinase associadaao receptoreresulta em uma cascata de sinalização de efeitos diversos, incluindo migração de células, maturação, diferenciação, metástase, angiogêneseeinibição daapoptose 85,89, O receptor EGFR pode estar superexpresso em uma variedade detumores sólidos,incluindo cancer de mama, cabeçaepescoço, pulmão e próstata 90, sendo, nesse caso, associado à estadio avançado, prognóstico ruim e resistência à quimioterapia, hormonioterapia e radioterapia
41 19 FIGURA 9 - Receptores da família do EGF (EGFR, Her2, Her3, Her4) apresentando sítio de ligação extracelular, porção transmembrana e domínio da tirosina quinase intracelular. Fonte: Adaptado de Ciardello e Tortora 144. Segundo Nicholson et al. 54 e CiardielloeTortora 90, o EGFRpodeseravaliadode várias formas, sendo a imunoistoquímica (IHQ) a melhor e mais comum técnica utilizada para essa avaliação. O método da PCR para detectar DNA proporciona informações sobrea amplificação, deleçãooumutaçãodo gene. No entanto, nãoreflete a quantidade deproteína produzida. Ainda, a técnica de PCR utilizada para avaliaros níveis de mrna pode resultar em problemasde degradação econtaminação do RNA. Os receptores Her2e Her3funcionam como co-receptores, pois Her3 possui domínio quinase inativo, que se ativa ao ligar com Her2, o qual não possui ligante específico para ser ativado e, para isso, utiliza outros membros da família (EGFR, Her3 ou Her4) 95. Yarden e Sliwkowski 96 ressaltaram que homodímerossão menosmitogênicos em comparação aos heterodímeros, e assim possuem baixa atividade detransformação. Dessa forma, o Her2 por ser preferencialmente heterodímero e possuir maior atividade de tirosinaquinase tende a ser mais potente e gerar sinais intracelulares intensos, o que confere maior potencial mitogênico. Portanto, níveis deoutrosreceptores da famíliaerbb, em particular Her2, pode afetar significativamente asinalizaçãodo EGFRno câncer em humanos. Ainda, para Daly et al. 97 e Pal e Pegram 98, o Her2é o par de eleição aos demais membros da família no processo de heterodimerização. Isso ocorre devido à sua conformação estrutural, que promove a exposição permanente dos domínios de dimerização 99. Os ligantes para a família EGFR incluem EGF, amphiregulin e TGF-α, os quais se ligam preferencialmente ao EGFR, enquanto betacellulin (BTC), heparina EGF (HB-EFG)
42 20 e epiregulin (EPR) ligam-se ao EGFR e Her4. Neuregulinas 1 (NGR1) e 2 (NGR2) ligam-se preferencialmente a Her3 e Her4, e NGR3 e NGR4 somente a Her4 89,100 (Quadro 2). Assim, a formação do complexo para a ativação do Her2 ocorre pela sua união com um fator de crescimento, por meio de um ligante, quando é desencadeada sua função tirosina-quinase e autofosforilação da tirosina. Isso desencadeia uma série de eventos em cascata, resultado da transmissão de sinais através da membrana celular e do citoplasma até o núcleo, onde ocorre ativação gênica, estimulação da mitose, bloqueio da apoptose e estimulação da neoangiogênese tumoral 100. QUADRO 2 - Fatores de crescimento que ativam (+) a família de receptores EGFR. Fonte: Adaptado de Linggi e Carpenter 100. Embora a IHQ constitua a técnica comumente utilizada para avaliaros níveis protéicos de EGFR no tecido, compreende método estritamentequalitativo, sem sistemade pontuação validado, de interpretação subjetiva e que avalia apenas a presença e não a atividade da proteína. Além disso,mostrauma imagemestática, não funcionaldoestadocelular, quando écada vez maisevidenteque o EGFR épartedeumsistemaaltamentedinâmico, ondealteraçõessignificativas podem ocorreremcurtos períodos detempo. Assim, para uma abordagem dinâmica da funcionalidade deegfrse faz necessária a avaliação conjunta dos níveis da proteína pela expressão de seu RNAm utilizando a técnica de PCR.No entanto, pode ser simplistaconsiderar a IHQcomo o único fator ao fracasso da correlação entre EGFR e prognósticoou eficácia de tratamento,deve-se considerar auniãocom aexpressão de Her2 89. O receptor Her2pode ter sua expressão aumentada no processo de transformação e progressão tumoral, sendo que a redução de p27, um inibidor de ciclinas, pode induzir superexpressão desse receptor 100. Ainda, o aumento de Her2e a redução de EGFR estão
43 21 relacionados à carcinogênese prostática 101. A expressão de Her2é regulada por fatores de crescimento e sua transformação a oncogene ocorre geralmente por amplificação gênica, originando síntese protéica elevada. Quando o gene HER-2 é superexpresso, a concentração protéicaéde dez a 100 vezes maior do que no epitélio normal, porém sem que ocorra alteração estrutural da proteína 100, ou seja, o gene está superexpresso na ausência de mutação gênica. Geralmente, os carcinomas com expressão positiva para Her2 apresentam alto grau de indiferenciação histológica, alta taxa de proliferação, baixa expressão de bcl-2 e dos receptores de estrógeno e progesterona 103. O aumento na expressão de Her2 relaciona-se à maior agressividade dos carcinomas em estágio inicial ou avançado, podendo ser indicador de prognóstico de recidivas e de estimativa da sobrevida 103. Ainda, segundo Gutierrez e Schiff 104, tumores que expressam Her2 possuem maior percentagem de aneuploidia, maior propensão de metástase e resistência à terapia endócrina. Em veterinária, a expressão deegfrjá foidetectada nos tumoresmamários 105,106, cerebrais primários 107, carcinomas nasais 108, carcinomas de pulmão 109, e gástricos 110. A superexpressão de Her2 foi relatada entre8,3% 168 e 40% 173 das neoplasias mamárias caninas 105,106, e em 61% dos tumores gástricos em cães 110. Entretanto, não há relatos acerca da expressão desses receptores na próstata canina. Ressalte-se que EGFR e Her2 são biologicamente semelhantes nas espécies canina e humana, com 80% de homologia quanto aos genes que codificam as proteínas 111. Beselga 112 em um estudo com tumores mamários de cadela comparou a imunoexpressão de Her2 utilizando anticorpos de diferentes clones (CB11, 4B5, TAB250 e SP3) e observou que apenas aqueles que reconhecem o domínio intracelular (CB11 e 4B5) detectam o receptor Her2nos tecidos neoplásicos de mama canina. Ainda, o autor não observou correlação positiva entre a superexpressão de Her2 e o grau de malignidade ou o tipo histológico. Já Hus et al. 175 observaram que cadelas com tumor de mama Her2 negativo apresentaram menor taxa de sobrevivência em um período de dois anos. Segundo os autores, não se conhece a razão da diferença observada entre as espécies canina e humana no que diz respeito a superexpressão de Her2 e sua relação com agressividade tumoral a sobrevida. Os autores complementam que os resultados sugerem queher2desempenha papel naformação de tumormamáriocanino,mas a agressividade tumoral pode não estar diretamenteassociada a superexpressão de Her2. Hsu et al. 113 também observaram associação significativa entre superexpressão de Her2 eovariosalpingohisterectomia (OSH). Os tumores de cadelassubmetidas aohsantes ou nomomento da retirada dotumor apresentaram maior propensão à superexpressão de Her2 em
44 22 comparação àqueles tumores provenientes de cadelas não submetidas a OSH. Também não observaram correlação entre expressão tumoral de Her2 e peso corporal, estágio e tamanho do tumor, glândula afetada, número de tumores, classificação histológica, infiltração linfática, metástases à distância e morte. Já Dutraetal. 114, utilizando 48 amostras de tumor de mama canino maligno e 22de tumorbenigno observaram superexpressão de Her2em35,4% das amostras malignas, sendo as amostras benignas negativas para Her2. Os autores também encontraramcorrelação positiva entreher2epleomorfismonuclear, contagem de mitosee diferenciação histológica, oposto relatado por Hsuetal. 113 ebeselga 112, sugerindo que a expressão de Her2está associada a crescimento e divisão celular nos tumores mamários caninos. Ao final, os autores concluiram quanto a estreita relação entre morfologia e imunofenótipo nos tumores mamários das cadelas, a exemplo do que ocorre nos tumores mamários da mulher Inibidores de ciclina dependente de quinase - p21, p27 e p53 O ciclo celular é regulado por um grupo de inibidores de ciclina dependentes de quinase (CdkI) que inibem a produção de Cdk. Duas famílias de CdkI são descritas de acordo com seu mecanismo de ação, a família dos inibidores de Cdk4 (INK4), que compreende as proteínas p16 INK4A, p15 INK4B, p18 INK4C e p19 INK4D (ou p14 ARF ), responsáveis por inibir os complexos Cdk4/ciclina D1 e Cdk6/ciclina D1 na transição G1-S; e a família dos Cdkinteracting protein 1/inibidor de proteína quinase (CIP/KIP), que compreende as proteínas p21 WAF1/CIP1, p27 KIP1 e p57 KIP2, que atuam inibindo a atividade de múltiplos complexos Cdk1- Cdk2-Cdk4-Cdk6/ciclina D1 76,115 (Figura 10).
45 23 FIGURA 10 - Representação esquemática do ciclo celular com as fases G0, G1, G2 e M,e ação de proteínas estimuladoras (ciclinas e cdk s),inibidoras(p21, p27,p57, p16, p15,p18 e p19), e de controle do ciclo (c-myc).tgf-β induz a produção dos inibidores. Fonte: adaptado de Ward 74. O inibidor de ciclina dependente de quinase1a(cdkn1a) é o genequecodifica a proteína p21, a qual se associa a mecanismosde parada do ciclo celular entre as fases G1-S, a reparo do DNA, a mecanismos antiapoptóticos 116, a proliferação e diferenciação celular com indução à senescência e mecanismo de proteção contra transformações malignas A função da p21, mediada pela proteína p53, relaciona-se a sua concentração, já que em baixos níveis de p21 ocorre efeito estimulante aos complexos Cdk4/ciclina D A ausência de p21 leva a um déficit na capacidade de parada do ciclo celular em G1, em resposta aos danos no DNA. No entanto, o aumento da expressãodep21nãoestá necessariamente ligado àparada do crescimento, tendo em vista que esta desempenha papelduplo, atuando como inibidor e estimulador da atividadede ciclina/cdk 117. Aredução ouausênciadep21temsidomostradaem culturas celulares detumoressemp53,ouque contenham uma forma mutanteafuncionaldo genetp e do gene que codifica aproteína fosfatase tensina homologa (PTEN) 121, uma vez que a expressão da proteína p21 reflete o estado funcional da proteína p Mutações somáticas no gene CDKN1A foram descritas em PC 123, mas não correlacionada sua expressão ao grau histológico, estágio clínico ou prognóstico do câncer, seja de forma isolada ou combinada a p Além disso, estudostêm revelado que adiminuição da expressãoda proteínap21é frequente no cãncergástrico, da vesícula biliar, do colorretal, e carcinomasdo endométrio em humanos 124,125. Já nos cães a redução de expressão
46 24 da p21 foi observada em melanomas 125, tumores de mama 205, de terceira pálpebra 127 e renais 128, mas ainda não se conhece quanto à expressão de p21 na próstata desses animais. De acordo com Li et al. 124, ap21quando fosforilada por AKT tende a ser estável, sendo observada comumente no núcleo celular 117. No entanto, há relatos de localizaçãocitoplasmáticade p21 resultante da ativaçãodeaktcomher2 esubsequentefosforilaçãode p A p21 quando acumulada no citoplasma contribui para o crescimento ativo egera resistência da célula a apoptose 118,125. Ainda, Lin et al. 124 ao avaliar p21 epten por meio da imunoistoquímicamostraramrelação inversamente proporcionalentre a expressãodeptenelocalização citoplasmáticade p21, reiterando sua ação antiapoptose 124 e implicando em comportamento mais agressivo do tumor e pior prognóstico 118,124,130. No entanto, temsidodescritoque a proteína PTEN inibe a degradaçãode p53 mediada por Mdm , por isso épossívelqueoaumento observadonos níveis dep21 seja mediado pela proteína p53 oumdm-2, oupor mecanismo independente dep Segundo Majid et al. 134, a expressão aumentada de p21 pode significar bom prognóstico, uma vez que em testes utilizando modelos animais e o potente agente terapêutico anticâncer inibidor de tirosina quinase, genisteína, foi observado aumento da expressão do gene CDKN1A, codificador de p21, com concomitante declínio de ciclinas em cultura de células prostáticas andrógeno dependentes (LNCaP) e independentes (DuPro). TambémWangetal. 74, emestudocom o agente anticâncer ácido metilselénico (MSeA) sobre cultura de células de PChumano (DU145),relataramaumento significativodonívelde RNAm parap21 ep27, e redução de RNAm para ciclina D1(CD1)apóstratamento com MSeAdurante 24horas. Ainda, esse aumento foi maioremais rápidopara o RNAm de p21 (3horas) em comparação ao RNAm dep27 (12horas). Segundo os autores, essesdados sustentamqueoaumentodep21 ep27remetema bomprognóstico, easdiferenças noespaço de tempodep21 ep27sugeremque a indução dep21seria maisimportante do que a de p27paraaparada do ciclo celular em G1 124,125. Aaltomaaetal. 135 relataram o oposto, quep21está significativamente relacionado aprognóstico desfavorável. Concluíram quea expressão da proteínap21associa-se à proliferação celulare à sobrevida do paciente com PC. Ainda, segundo Huang et al. 123, a p21 pode ter participação na patogênese da HPB, pois uma alteração no gene CDKN1A pode causar desequilíbrio entre a proliferação de células epiteliais e do estroma da próstata e falha da apoptose, contribuindo para o acúmulo de células característico da HPB. No entanto, vale ressaltar que as alterações relacionadas à expressão p21 nem sempre têm origem em mutação do CDKN1A, podendo também ocorrer alterações epigenéticas, ou seja, aquelas que
47 25 envolvem metilação, acetilação e aumento ou modificação de histonas, já que CDKN1A é frequentemente silenciado por metilação no PC humano, reduzindo a síntese de p21. Da mesma forma, é possível que ocorra aumento na síntese de p21 quando da ativação do mecanismo de modificação de histonas 136. O inibidor de ciclina dependentede quinase1b(cdkn1b) é o genequecodifica a proteína p27, membro dafamíliacip/kip, que atua de forma a inibir a proliferação celularea carcinogênese 136,137. Contrariamente à p21, que parece ser uma CdkI universal, já que atua sobre diferentes complexos Cdk/ciclina, a p27 exerce função de modulação inibitória apenas sobre o complexo Cdk2/ciclina E, o que resulta em bloqueio da entrada da célula na fase S. Ressalte-se que essa função inibitória do p27 só é possível a partir de sua ligação aos receptores de TGF-β 113,115. Portanto, a ausência de sinalização de TGF-β contribui para a proliferação celular anormal e para a malignidade 117 Segundo Coqueret 138, aredução da expressão dep27 sugere prognóstico desfavorável, tendo em vista que em sua ausência ocorre manutenção da célula no ciclo celular. Essa redução de expressão de p27 tem sido observada em várias neoplasias, incluindo as da próstata. Yang et al. 135 e De Marzo et al. 26 observaram menor expressão de p27 em lesões como HPB, PIN e PC, concluindo que isso contribui para a alta taxa de mitose nessas lesões proliferativas. Também Wangetal. 139 observaram expressãoelevada dep27 em células normais, comlesões hiperplásicasmuito precoceseem células com PIN e concluíram que o aumento da expressãodep27 contribui para a prevençãoe inibe aprogressão das lesõesde PINparaPCinvasivo. Da mesma forma, Majumderetal. 140 e DiCristofanoet al. 141 observaram elevada expressão dep27emlesões de PIN experimentalmente induzidas em camundongos. Tayloretal. 142 completaram que na redução ou ausência de expressão de p27 a PIN possui maior potencial de progressão edesenvolvimento de um fenótipo mais agressivo. Wang et al. 139 demonstraram que o epitélio nas lesões de PIA possui suas próprias características moleculares, com fenótipo intermediário entre o das células basais e luminais, isto é, expressa fatores de crescimento que podem aumentar a atividade de proliferação e regular a expressão de p27, podendo, dessa forma, servir como marcador de evolução tumoral e prognóstica 75,26. Em tumores mamários de cadelas, Klopfleisch et al. 143 observaram redução da imunoexpressão de p27, já que as amostras de epitélio mamário normal apresentaram maior expressão dessa proteína em comparação às amostras de tecido mamário com adenomas e carcinomas. Em outro estudo de neoplasias mamárias em cadelas, Klopfleische Gruber 126 tambémrelataramredução significativadonível deexpressão de RNAm dep27em40%
48 26 dos adenomas, 90% de adenocarcinomase80% dasmetástases nos nódulos linfáticos regionais,quandocomparado àglândulamamárianão neoplásica. Os autores concluíram que o controle do ciclocelular via p27 é falho na maioria dos tumores mamários caninos e ainda que essa redução representa papel importante na evolução do processo tumoral, apesar de não terem observado diferençasignificativa na expressão de p27 entretumoresmamários benignosemalignos. Isso limita a utilização dessa proteína como marcador de malignidade para os tumores mamários caninos, mas não descarta o envolvimento da mesma na regulação do crescimento tumoral 79. O produto do gene TP53, a proteína p53, é considerada a guardiã do genoma, a chave reguladora, pois é responsável por regular grande parte dos processos celulares, incluindo o ciclo celular, reparo do DNA, estabilização do genoma, morte celular programada, diferenciação, senescência e angiogênese 144. Em condições normais a proteína p53, conhecida como p53 tipo selvagem, possui meia-vida curta, sendo degradada imediatamente após o término de sua função. Assim, é sabido que mutações no gene TP53 resultam em falha da proteção celular, desestabilização do genoma e permite a produção de proteína p53 afuncional, que se acumula na célula e é eliminada lentamente, o que permite sua detecção nuclear pela técnica da IHQ 76. O ciclo celular prossegue normalmente sob a vigilância passiva de p53 em níveis baixos. Quando um erro ocorre na transcrição do DNA, esta interrompe o ciclo na fase S para a atuação dos mecanismos de reparação, ou seja, os níveis de p53 se elevam e há indução da expressão de p21, que impedirá a ligação Cdk-ciclina. Consequentemente, prb não será fosforilada, impedindo assim a liberação do fator de transcrição (E2F), com parada do ciclo na fase S. Nesse momento, a célula pode promover reparo do DNA e seguir no ciclo ou acionar eventos apoptóticos para que ocorra a destruição da célula danificada 70,115,122. A ação da p53 é inibida quando da ligação à proteína murine double minutes (Mdm2), impedindo-a de reativar a transcrição da proteína p21. No entanto, o gene que codifica a proteína Mdm2, gene MDM2, é ativado por transcrição pela p53, evitando o excesso funcional da mesma. Em células tumorais, os níveis de Mdm2 estão aumentados e há o decréscimo na concentração de p53 117, mas também pode haver mutação do gene TP53, seguida de ausência de expressão da proteína p53. Nesses casos, as células com danos no DNA escapam do reparo ou do processo de apoptose, dando início a um clone maligno 115,122,145,146. Entre as neoplasias humanas, o TP53 é considerado o gene mais comumente alterado 146. Nos animais, alterações nogene TP53foram identificados em vários tipos de
49 27 tumor, como de tiroide 147, papilomaoral 148, mamário , osteossarcoma 151, adenomada glândula hepatoide 152, linfoma 153 e próstata 55,154. Segundo Stricker et al. 155, Cheng et al. 156, Leite et al. 157 e Tsujimoto et al. 158, em humanos com PIN e PC quanto maior a expressão da p53 maior a probabilidade de progressão da doença devido a índices proliferativos mais elevados e a um fenótipo mais agressivo. Ainda, de acordo com Stricker et al. 155, nos casos de carcinoma prostático humano em que a expressão da p53 foi pouco expressiva o câncer não progredia. Ressalte-se que a avaliação imunoistoquímica da proteína p53 não deve ser considerada isoladamente na determinação do prognóstico das alterações prostáticas de caráter maligno, considerando que devido a meia-vida curta da proteína, é possível reação cruzada entre as formas selvagem e mutante, como demonstrado por Wang et al. 47. Na próstata canina, a expressão de p53 foi relatada em alguns trabalhos, mas com resultados antagônicos. Di Santis 58 não detectou a expressão de p53 nas afecções da próstata canina. De outra parte, Croce et al. 55 verificaram sua expressão tanto no tecido prostático normal quanto com PC, e ainda nas lesões proliferativas e atípicas da próstata canina, sendo que 95% das amostras de PIA e PC apresentavam-se intensamente marcadas quando comparadas às amostras de tecido normal. Embora não tenham observado imunomarcação de p53 no tecido prostático normal, Faleiro e De Moura 154 obtiveram resultados semelhantes aos de Croce et al. 55, já que observaram imunomarcação de p53 em amostras de próstata canina com PIA, PIN e PC. Nesse estudo, os autores argumentaram que a elevada expressão de p53 constatada nos casos de PIA se justifica em decorrência do microambiente inflamatório, fator importante na promoção da alteração da p53. Ainda, segundo Wang et al. 47, a p53 mutante é frequentemente detectada em tecidos com inflamação crônica, incluindo colangioepatites, gastrites e colites, assim como Tsujimoto et al. 158 também referiram a expressão de p53 na atrofia inflamatória pós-atrófica da próstata humana Ciclina D1 (CD1) As ciclinas, produtos do gene CLN (neuronal ceroid lipofuscinosis), são enzimas reguladoras das subunidades das ciclinas dependentes de quinase (Cdk). Diferentes ciclinas se associam a diferentes Cdk, podendo associar-se a mais de uma Cdk nas diferentes fases do ciclo celular. Esse grupo de enzimas, por sua vez, fosforila uma série de substratos-chave que permitirão a progressão de uma fase à outra do ciclo 75-77,159. Em G0 não há expressão de ciclinas nem de Cdk. Em G1 há expressão dos complexos Cdk4/ciclina D1 e Cdk6/ciclina D1 e, ao passo que se aproxima o ponto de restrição, ocorre aumento do complexo Cdk2/ciclina
50 28 E. Já em S há expressão de Cdk2/ciclina A e, em G2, de Cdk1/ciclina B e Cdk1/ciclina A, que se intensifica em M 75-77,161 (Figura 11). FIGURA 11 - Representação gráfica da atividade dos complexos Cdk/ciclina durante o ciclo celular. A largura das faixas coloridas é aproximadamente proporcional à atividade dos complexos indicados. Fonte: Lodish et al. 76. Na fase G1, a CD1 representa um ponto crítico de regulação e, por isso, alterações na sua expressão estão relacionadas à tumorigênese e à progressão tumoral de diferentes tipos neoplásicos, incluindo os prostáticos. Ainda, em muitos casos há correlação entre essa alteração e a expressão e regulação esteróide, com aumento de receptores de andrógenos 77,162. Dessa forma, a avaliação da expressão da CD1 pode fornecer informações de prognóstico, tendo em vista que maior expressão foi observada em lesões indiferenciadas e avançadas 135. Quanto às outras ciclinas, pouco se conhece acerca do seu papel na carcinogênese prostática 77. O geneda CD1, CCND1, é reguladoem nívelde transcriçãopela interação entre a proteínas guanilato quinase (ZO-2), E-box, e c-myc, e recrutamento de histonas desacetiladas 159,160, sendo essa transcrição reprimida pelas proteínas fosfatase tensina homologa (PTEN) 162 e p Segundo Tapia et al. 159, a expressão aumentada de ZO-2 é capaz de induzir a redução da expressão de CD1 em células epiteliais e, dessa forma, há redução na proliferação celular, com bloqueio na fase G0/G1 do ciclo celular e manutenção da taxa de apoptose. A CD1éimportante na regulaçãodociclo celular e estudos em modelos animais sugerem que essa enzima pode atuar como oncogene de predileção, pois a superexpressão de CD1 nas células mamárias de camundongos transgênicos levou ao desenvolvimento de
51 29 hiperplasia e neoplasia 164. Oncogene de predileção é um termo utilizado para descrever o fenômeno em que a superatividade de determinado oncogene é requisito para que as células neoplásicas sobrevivam e proliferem. Assim, oncogenes de predileção são alvos para o desenvolvimento de drogas que possam bloquear seus efeitos sobre as células neoplásicas, mas sem afetar a viabilidade de células normais 163. ACD1é uma proteínainstável e de meia-vida curta, sendo que seu acúmulo induz arápida progressãodociclo celular da fase G1 paras. A CD1 também atua em conjunto com a proteína RecA recombinase (RAD51), ativando vias de reparo de DNA, com redução de sua expressão nessas situações, embora isso não necessariamente implique em redução da proliferação de células prostáticas neoplásicas 161, o que sugere que a CD1 não é a única envolvida no processo de proliferação neoplásica. Entretanto, muitos autores relataram a relação entre superexpressão de CD1 e proliferação de vários tipos de câncer em humanos 164, Proteínas c-myc Outro importante elemento relacionado à regulação do ciclo celular é o oncogene C-MYC, que codifica as proteínas myc1 ou p67 e myc2 ou p64, ou simplesmente proteínas c- myc 165,166. Essas proteínas suprimem a transcrição de genes como o CDKN1A (transcritor da proteína p21) e CDKN1B (transcritor da proteína p27) e ativam a transcrição das proteínas Cdk2, Cdk4 e prb, com consequente liberação de E2F e superação do efeito inibitório do TGF-β sobre o ciclo celular, culminando com a passagem da fase G1 para S 75,115,167. Assim, participa de forma direta e indireta nos processos associados à transformação e metabolismo celulares, apoptose e instabilidade genômica 52,75,165, A ativação inapropriada do C-MYC pode contribuir para o desenvolvimento neoplásico por diferentes mecanismos, incluindo translocaçãocromossômica, amplificação gênica einserção do generetroviral 165,166.Outrosestudossugeriramque as proteínas c-myc estimulamaproduçãomitocondrialderadicais livres, o que comprometeo DNA, causando instabilidade genômica. No entanto, não são consideradasessenciaispara mecanismos que envolvem metástase 165,168,169. Sendo ogene C-MYC um elemento-chave no processo de tumorigênese, já foi observado em váriostipos de câncer, incluindo osmamários 165, e prostáticos em humanos 175,176 e cães 39, bem como palpebrais em cães 127, osteossarcomas caninos 265, tumor venéreo transmissível canino 177, mamários em ratas 170 e prostáticos em camundongos 179.
52 30 De acordo comsong etal. 180, Iwataetal. 181 e Kohetal. 175, a proteína c-myc está elevadaem87% dos casospc humano esignificativamente aumentada em relação ao tecido prostático normal e não neoplásico. Ainda, segundo Qianetal. 168 e Kohetal. 175, a c-myc está associada ao grau de diferenciação e estágio avançado do tumor, sendo observada nos casos de PC com escore de Gleason maior que cinco e naqueles com metástases, caracterizando pior prognóstico 115,184. Fonseca-Alves etal. 39 relataram maior positividade de c-myc na prostáta canina com PIA e PCem comparaçãoàquelas normais, sendo observada imunoexpressão aumentada nas amostras de PIA. Os autores completaram que a proteína c-myc é normalmente expressanocitoplasmadas célulasepiteliais da próstata com PC equeestá associada à perdado gene NKX3.1, um gene supressor detumor, e da proteína de junção E-caderina. Entretanto, também descrevem imunomarcação nuclear de c-myc em algunscasosde PC concomitante a focos depin, o que já havia sido relatado por Gureletal. 182 eprowatkeetal Ellwood-Yen etal. 184, Iwataetal. 181, Kohet al. 175 enakagawaeyamanaka 185 hipotetizaram que oaumento daexpressão de c-myc no PChumanopromovea proliferação e diferenciaçãode células tumorais,emespecial das célulasbasais, bem como alterações na viaapoptótica, uma vez que a superexpressãonuclearde c-myc correlaciona-se a PINe sua transiçãopara PC.Civennietal. 176 estudaram a expressão do gene C-MYC em uma subpopulação de células neoplásicas semelhantes a células tronco (CSC - cancer stem cell like) e observaram redução das CSCem resposta ao silenciamento desse gene, concluindo que na ausência de ação do C-MYC ocorre ativaçãodos mecanismos desenescência e redução do potencial tumorigênico e metastático. Os autores estudaram ainda a expressão de C-MYC em diferentes tipos tumorais e obtiveram o mesmo silenciamento gênico nos casos de PC. Entretanto, concluíram que a relação entre redução de proliferação celular e silenciamento do C-MYC não compreende mecanismo único envolvido no crescimento tumoral, tendo em vista que também foi observada proliferação de células quando do C-MYC silenciado. 2. Objetivos Com o intuito de melhor compreender os mecanismos celulares envolvidos em lesões proliferativas da próstata canina, este trabalho teve por objetivo avaliar a expressão gênica de ErbB1, ErbB2, CDKN1A, CDKN1B e TP53, e a imunomarcação de EGFR, Her2, p21, p27, p53, ciclina D1 e c-myc no tecido prostático canino normal e com HPB, PIA, PIN e PC.Para a avaliação da expressão gênica foram utilizadas as técnicasrt-pcr e RT-
53 31 qpcrcomrnam de amostras próstata canina parafinizada e para a imunomarcação a técnica de imunoistoquímica em lâminas demicroarranjo tecidual. 3. Referências 1. Johnston SD, Kustritz MR, Olson PMS. Sexual differentiation and normal anatomy the dog. In: Canine and Feline. Philadelphia:WB Saunders, 2001, 592p 2. Leroy C, Conchou F, Layssol Lamour C, Deviers A, Sautet J, Concordet D, Mogicato G. Normal Canine Prostate Gland: Repeatability, Reproducibility, Observer Dependent Variability of Ultrasonographic Measurements of the Prostate in Healthy Intact Beagles. Anato. Histol. Embryo.2013;42(5), Barsanti J, Finco DR. Moléstias prostáticas. In: Ettinger SJ.; FELDMAN, E. C, editors. Tratado de medicina interna veterinária: moléstias do cão e do gato. 4. ed. São Paulo: Manole, Cap. 128, v.2, p Benoist S, Panis Y, Pannegeon V, Soyer P, Watrin T, Boudiaf M, Valleur P. Can failure of percutaneous drainage of postoperative abdominal abscesses be predicted? Am. J. Surg. 2002;184(2): , Cartee RE, Hudson JA, Finn-Bodner S. Ultrasonography. Vet. Clinic. North Am. Small An. Pract. 1993;23(2): Lai CL, Van Den Ham R, Van Leenders G, Van Der Lugt J, Mol JA, Teske E. Histopathological and immunohistochemical characterization of canine prostate cancer. Prostate. 2008;68(5): Faleiro, MBR. Fotografia de peça macroscópica [arquivo pessoal]. Altura: 3456 pixels. Largura: 2592 pixels. 72 dpi. 3.5 Mb. Formato JPEG. Realizada em [05 Out 2011]. 8. Faleiro, MBR. Fotomicrografia da lâmina de TMA [arquivo pessoal]. Altura: 1024 pixels. Largura: 768 pixels. 300dpi. 3.5 Mb. Formato JPEG. Realizada em [10 abril 2014]. 9. Fonseca-Alves CE, Corrêa AG, Santos-Junior HL, Elias F, Costa SS, De Moura VMBD. Prostatic abscess in dogs: Report of 15 cases. Semin. Cienc. Agrar. 2012;33(3): Anidjar M, Scarlata E, Cury FL, Rocha J, Hamel L, Luz M, Chevalier S. Refining the orthotopic dog prostate cancer (DPC)-1 model to better bridge the gap between rodents and men. Prostate 2012;72(7): Keller JM, Schade GR, Ives K, Cheng X, Rosol TJ, Piert M, Siddiqui J, Roberts WW, Keller ET. A novel canine model for prostate cancer. The Prostate, 2013; 73(9), Fonseca-Alves CE, Faleiro MB, Laufer-Amorim R, de Moura VMBD. Prostatic histological evaluation in adult not castrated dogs. Arq. Bras. Med. Vet. Zootec. 2010;62: Toledo DC, Faleiro MBR, Rodrigues MMP, Di Santis GW, Amorim RL, De Moura VMBD.Histomorphological characterization of proliferative inflammatory atrophy in canine prostate. Ciênc. Rural. 2010;40: Tomas D, Kruslin B, Rogatsch H, Schafer G, Belicza M, Mikuz G. Different types of atrophy in the prostate with and without adenocarcinoma. Eur.Urology. 2007;51(1): Rodrigues MMP, Di Santis GW, De Moura VMBD, Amorim RL.COX-2 and TGF- β expression in proliferative disorders of canine prostate. Braz. J. Vet. Pathol. 2010;3: Faleiro MBR, Croce GB, Toledo DC, Rodrigues MMP, Batista AC, Damasceno AD, Laufer Amorim R, Moura VMBDD. Matrix metalloproteinases 2 and 9 expression in canine normal prostate and with proliferative disorders. Ciência Rural, 2013;43(6):
54 Leav I, Schelling KH, Adams JY, Merk FB, Alroy J. Role of canine basal cells in prostatic post natal development, induction of hyperplasia, sex hormone stimulated growth and the ductal origin of carcinoma.prostate, 2001; 47(1): , Waters DJ, Bostwick DG. Prostatic intraepithelial neoplasia occurs spontaneously in the canine prostate. J Urol. 1997; 157: Smith J. Canine prostatic disease: A review of anatomy, pathology, diagnosis, and treatment. Theriogenology. 2008;70(3): Klausner JS, Bell FW, Hayden DW, Johnston SD, Lund EM. Recent developments in the diagnosis and treatment of BPH and prostatic carcinoma.proced. Am. College. Vet. Int. Med. 1994;547: Juniewicz PE, Berry SJ, Coffey DS, Strandberg JD, Ewing LL. The requirement of the testis in establishing the sensitivity of the canine prostate to develop benign prostatic hyperplasia, J. urol. 1994;152(3): Sciarra A, Voria G, Mariotti G, Gentile V, Pastore A, Di Silverino F. Histopathological aspects associated with the diagnosis of benign prostatic hyperplasia: Clinical implications. Urologia Internat. 2002;69(4): Di Silverino F, Gentile V, De Matteis A, Mariotti G, Giuseppe V, Luigi PA, Sciarra A. Distribution of inflammation, pre-malignant lesions, incidental carcinoma in histologically confirmed benign prostatic hyperplasia: a retrospective analysis. Eur. Urol. 2003;43(2): De Marzo AM, Marchi VL, Epstein JI, Nelson WG. Proliferative inflammatory atrophy of the prostate: Implications for prostatic carcinogenesis. Am. J. Pathol. 1999;155(6): De Marzo AM, Platz EA, Epstein JI, Ali T, Billis A, Chan TY, Cheng L, Datta M, Egevad L, Ertoy-Baydar D, Farre X, Fine SW, Iczkowski KA, Ittmann M, Knudsen BS, Loda M, Lopez-Beltran A, Magi-Galluzzi C, Mikuz G, Montironi R, Pikarsky E, Pizov G, Rubin MA, Samaratunga H, Sebo T, Sesterhenn IA, Shah RB, Signoretti S, Simko J, Thomas G, Troncoso P, Tsuzuki TT, Van Leenders GJ, Yang XJ, Zhou M, Figg WD, Hoque A, Lucia MS. A working group classification of focal prostate atrophy lesions. Am. J. Surgi. Pathol. 2006;30(10): Sfanos, K.S.; De Marzo, A.M. Prostate cancer and inflammation: the evidence. Histopathol. 2012;60(1): Palapattu GS, Sutcliffe S, Bastian PJ, Platz EA, De Marzo AM, Isaacs WB, Nelson WG. Prostate carcinogenesis and inflammation: emerging insights. Carcinogenesis, 2004;26(7): Wagenlehner FM, Elkahwaji JE, Algaba F, Bjerklund Johansen T, Naber KG, Hartung R, Weidner W. The role of inflammation and infection in the pathogenesis of prostate carcinoma. BJU internat. 2007;100(4): Platz EA, De Marzo AM. Epidemiology of inflammation and prostate cancer. J. Urology. 2004;171(2):S36-S Nonomura N, Takayama H, Nakayama M, Nakai Y, Kawashima A, Mukai M, Nagahara A, Aozasa K, Tsujimura A. Infiltration of tumour-associated macrophages in prostate biopsy specimens is predictive of disease progression after hormonal therapy for prostate cancer. BJU Int. 2011;107(12); Sugar LM. Inflammation and prostate cancer. CJU. 2006;13(supl.1): Vis AN, Van Der Kwast TH. Prostatic intraepithelial neoplasia and putative precursor lesions of prostate cancer: A clinical perspective. BJU. 2001;88(2): Billis, A. Prostatic atrophy: An autopsy study of a histologic mimic of adenocarcinoma. Modern Pathol. 1998;11(1): Anton RC, Kattan MW, Chakraborty S, Wheeler TM. Postatrophic hyperplasia of the prostate: Lack of association with prostate cancer. Am. J. Surg. Pathol. 1999;23(8):
55 Billis A, Magna LA. Inflammatory atrophy of the prostate. Prevalence and significance. Arch. pathol. Lab. Med.2003;127(7): Wang W, Bergh A, Damber JE. Morphological Transition of Proliferative inflammatory atrophy to high grade intraepithelial neoplasia and cancer in human prostate. Prostate. 2009;69(13): Van Leenders GJLH, Gage WR, Hicks JL, Van Balken B, Aalders TW, Schalken JA, De Marzo AM. Intermediate cells in human prostatic epithelium are enriched in proliferative inflammatory atrophy. Am. J. Pathol. 2003;162(5): Putzi MJ, De Marzo AM. Morphologic transitions between proliferative inflammatory atrophy and high-grade prostatic intraepithelial neoplasia.urology. 2000;56(5): Fonseca-Alves CE, Rodrigues MMP, De Moura VMBD, Rogatto SR, Laufer-Amorim R. Alterations of C-MYC, NKX3.1, and E-Cadherin Expression in Canine Prostate Carcinogenesis. Microsc. Res. Tech. 2013;76: Croce GB, Rodrigues MMP, Faleiro MBR, De Moura VMBD, Laufer-Amorim R.Óxido nítrico, GSTP-1 e p53: qual o papel desses biomarcadores nas lesões prostáticas do cão? Arq. Bras.Med. Vet. Zoot. 2011;63(6): Di Santis GW. Padrão histopatológico, perfil imunoistoquímico e potencial pré-maligno das lesões displásicas da próstata canina. [Tese] Botucatu: Universidade Estadual Paulista, Faculdade de Medicina Veterinária e Zootecnia; Toledo, DC. Expressão de fator de crescimento transformador β e inibidores teciduais de metaloproteinases 1 e 2 em próstatas caninas normais e com lesões proliferativas. [Dissertação]. Goiânia: Universidade Federal de Goiás, Escola de Veterinária e Zootecnia; [acesso 5 set 2014]. Disponível em: Bostwick DG, Brawer MK. Prostatic intra-epithelial neoplasia and early invasion in prostate cancer. Cancer. 1987;59: McNeal JE, Bostwick DG. Intraductal dysplasia: a premalignant lesion of the prostate. Human pathol. 1986;17(1): Drago JR, Mostofi FK, Lee F. Introductory remarks and workshop summary. Urology, 1989;34(suppl): Bostwick DG. High-grade prostatic intraepithelial neoplasia: the most likely precursor of prostate cancer. Cancer. 1995; 75(7): Joniau S, Goeman L, Pennings J, Van Poppel H. Prostatic intraepithelial neoplasia(pin): Importance and clinical management. Eur. Urol. 2005;48(3): Waters DJ, Bostwick DG. The canine is a spontaneous model of intraepithelial neoplasia and prostate cancer progression. Anticancer Res. 1997;17: Aquilina JW, McKinney L, Pacelli A, Richman LK, Waters DJ; Thompson I, Burghardt JR, Bostwick DG. High grade prostatic intraepithelial neoplasia in military working dogs with and without prostate cancer. Prostate. 1998;36: Winter MD, Locke JE, Penninck DG. Imaging diagnosis urinary obstruction secondary to prostatic lymphoma in a young dog. Vet. Radiol. Ultras. 2006;47(6): Waters DJ, Patronek GJ, Bostwick DG, Glickman LT. Comparing the age at prostate cancer diagnosis in humans and dogs Cancer Inst. 1996;88(22): Leroy BE, Northrup N. Prostate cancer in dogs: Comparative and clinical aspects VetJ. 2009;180(2): Coffey DS. Similarities of prostate and breast cancer: evolution, diet, and estrogens. Urology. 2001;57(4ª):31-38.
56 Epstein JI, Murphy WM. Diseases of the prostate gland and seminar vesicles. In: Murphy, W.M. (Ed.), Urological Pathology. W.B. Saunders, Philadelphia, 1997, p Humphrey PA. Gleason grading and prognostic factors in carcinoma of the prostate. Modern Pathol. 2004;17: O shaughnessy JA, Kelloff GJ, Gordon GB, Dannenberg AJ, Hong WK, Fabian CJ. Treatment and prevention of intraepithelial neoplasia: an important target for accelerated new agent development. Clin Can Res. 2002;8: Madewell BR, Gandour-Edwards R, White RWDV. Canine prostatic intraepithelial neoplasia: Is the comparative model relevant? Prostate 2004;58: De Muga S, Hernández S, Agell L, Salido M, Juanpere N, Lorenzo M, Lloreta J. Molecular alterations of EGFR and PTEN in prostate cancer: association with high-grade and advanced-stage carcinomas.modern Pathol.2010;23(5), Winkler S, Reimann-Berg N, Murua EH, Loeschke S, Eberle N, Hoinghaus R, Nolte I, Bullerdiek J. Polysomy 13 in a canine prostate carcinoma underlining its significance in the development of prostate cancer. Cancer Genet. Cytogenet. 2006;169(2): Ganem NJ, Storchova Z, Pellman D. Tetraploidy, aneuploidy and cancer. Curr. Opin. Genet. Devel. 2007;17(2): Teske E.; Naan, E.C.; Van Dijk, E.M.; Van Garderen, E.; Schalken, J.A. Canine prostate carcinoma: epidemiological evidence of an increased risk in castrated dogs. Mol. Cellular Endocrinol. 2002;197: Bonkhoff H, Fixemer T, Husicker I, Remberger K. Estrogen receptor expression in prostate cancer and premalignant prostatic lesions. Am. J. Pathol. 1999;155(2): Bell FW, Klausner JS, Hayden DW, Feeney DA, Johnston SD. Clinical and pathologic features of prostatic adenocarcinoma in sexually intact and castrated dogs: 31 cases ( ). J.Am. Vet. Med. Assoc. 1991;199(11): , Bryan JN, Keeler MR, Henry CJ, Bryan ME, Hahn AW, Caldwell CW, A population study of neutering status as a risk factor for canine prostate cancer. Prostate, 2007;67(1): Mahapokai W, Xue Y, Van Garderen E,Van Sluijs, F.J.; Mol JA, Schalken JA. Cell kinetics and differentiation after hormonal induced prostatic hyperplasia in the dog.prostate. 2000;44: Garnick, M. B. Prostate cancer. Scient. Am. 1997;10: Swinney GR. Prostatic neoplasia in five dogs. Austr. Vet. J.1998;76(10): Pylkkänen L, Mäkelä S, Santti R. Animal models for the preneoplastic lesions of the prostate.eur. Urology,1996;30(2): Daleck CR, Nardi AB, Rodaski S. Oncologia em cães e gatos. São Paulo: ROCA, p. 70. McGavin MD, Zachary JF. Bases da Patologia em Veterinária. 4.ed. Rio de Janeiro: ELSEVIER (MOSBY), p. 71. Clark WH. The nature of cancer: morphogenesis and progressive (self)-disorganization in neoplastic development and progression. Acta Oncologica 1995;34: Almeida VL, Leitão A, Reina LCB, Montanari CA, Donnici CL. Câncer e agentes antineoplásicos ciclo-celular específicos e ciclo-celular não específicos que interagem com o DNA: uma introdução. Sao Paulo: Quimica Nova. 2005;28: , INCA-Brasil. Ministério da Saúde. Instituto Nacional de Câncer. Estimativa 2010: incidência de câncer no Brasil / Instituto Nacional de Câncer. Rio de Janeiro: INCA, p. 74. Ward LS.Entendendo o Processo Molecular da Tumorigênese. Arq. Bras. Endocrinol.Metabol. 2002;46(4):
57 Fernandez PL, Thomson TM. Alterations of Genes and Their Expression in Prostate Carcinoma. In: HAYAT, M.A. Handbook of Immunohistochemistry and in situ Hybridization of Human Carcinomas. Molecular Pathology, Colorectal Carcinoma and Prostate Carcinoma. 1. ed. New York: Elsevier Academic Press, Cap. 3, v. 2, p Lodish H, Berk A, Zipursky SL, Matsudaira P, Baltimore D, Darnell J. Biologia cellular e molecular. 4ed. Rio de Janeiro: REVINTER, p. 77. Sanchez I, Dynlacht BD. New insights into cyclins, CDKs, and cell cycle control. Semin. Cell Dev. Biol. 2005;16: Berardinis RJ, Lum JJ, Hatzivassiliou G, Craig B. Thompson, C.B. The Biology of Cancer: Metabolic Reprogramming Fuels Cell Growth and Proliferation. Cell Metabol. 2008;7(1): Zuccari D, Terzian A, Pereira R, Pavam M, Ruiz C, Sueiro F, Andrade JCA, Cordeiro J. Avaliação imuno-histoquímica do gene p53 nas neoplasias mamárias caninas.ars Vet. 2008;21(3): Hellawell GO, Brewster SF. Growth Factors and their Receptors in Prostate Cancer. Brit. J. Urol. Inter. 2002;89: Wu W, O Reilly MS, Langley RR, Tsan RZ, Baker CH, Bekele N, Tang XM, Onn A, Fidler IJ, Herbst RS.Expression of epidermal growth factor (EGF)/transforming growth factor-a by human lung cancer cells determines their response to EGF receptor tyrosine kinase inhibition in the lungs of mice. Mol. Cancer Therap. 2007;6(10): Pina FM, Figueiredo MG, Lunet N, Reis F, Castro H, Cruz F, Barros H. O eixo EGF e o Cancro da Próstata. O Epidermal Growth Factor (EGF) - Experiência clínica. Acta Urológica. 2008;25(2): Mimeault M, Pommery N, Henichart JP. New advances on prostate carcinogenesis and therapies: involvement of EGF-EGFR transduction system. Growth Factors. 2003;21(1): Pina FM. O Eixo EGF e o Cancro da Próstata: O Epidermal Growth Factor (EGF). Revisão teórica. ActaUrológica. 2007; 24(3): Madshus IH, Stang E. Internalization and intracellular sorting of the EGF receptor: a model for understanding the mechanisms of receptor trafficking.j. cell sci. 2009;122(19): Pina FM. O eixo EGF e o cancro da próstata A - O eixo EGF (Epidermal Growth Factor): Introdução B - O Transforming Growth Factor Alfa(TGF-α ) no cancro da próstata: Revisão teórica. Acta Urol. 2006;23(3): Nair P. Epidermal growth factor receptor family and its role in cancer progression. Cur.Sci. 2005;88(6) Henson ES, Gibson S.B. Surviving cell death through epidermal growth factor (EGF) signal transduction pathways: Implications for cancer therapy. Cellular Sign. 2006;18(12): Jimeno A, Hidalgo M. Blockade of epidermal growth factor receptor (EGFR) activity. Critical reviews in oncology/hematology, 2005; 53(3): Ciardiello F, Tortora G. Epidermal growth factor receptor (EGFR) as a target in cancer therapy: understanding the role of receptor expression and other molecular determinants that could influence the response to anti-egfr drugs. Eur. J. Cancer. 2003; 39: Citri A and Yarden Y: EGF-ERBB signalling: towards the systems level. Nat Rev Mol Cell Biol. 7: Carlsson J: Potential for clinical radionuclide-based imaging and therapy of common cancers expressing EGFR-family receptors. Tumour Biol. 33: Carlsson J, Shen L, Xiang J, Xu J, Wei Q. Tendencies for higher co-expression of EGFR and HER2 and downregulation of HER3 in prostate cancer lymph node metastases compared with corresponding primary tumors. ONCOLOGY LETTERS. 2013; 5:
58 Nicholson RI, Gee JMW, Harper ME. EGFR and cancer prognosis. Eur J Cancer 2001, 37(Suppl. 4), S Amler LC. HER3 mrna as a predictive biomarker in anticancer therapy. Exp. Opin. Biol. Ther. 2010;10(9): Yarden Y, Sliwkowski MX. Untangling the ErbB signalling network. Nat Rev Mol Cell Biol 2001, 2, Daly JM, Jannot CB, Beerli RR, Graus-Porta D, Maurer FG, Hynes NE. Neu differentiation factor induces HER-2 downregulation and apoptosis of HER-2-overexpressing breast tumor cells. Cancer Research, 1997; 57(17): Pal SK, Pegram M. HER2 targeted therapy in breast cancer... beyond Herceptin.Rev. Endo. Metab. Disor. 2007;8(3), Pinkas-Kramarski R, Soussan L, Waterman H, Levkowitz G, Alroy I, Klapper L, Lavi S, Seger R, Ratzkin BJ, Sela M, Yarden Y. Diversification of Neu differentiation factor and epidermal growth factor signaling by combinatorial receptor interactions. The EMBO J.1996; 15(10): Linggi B, Carpenter G. ErbB receptors: New insights on mechanisms and biology. Trends Cell Biol. 2006;16(12): Feng S, Wang F, Matsubara A, Kan M, McKeehan WL. Fibroblast growth factor receptor 2 limits and receptor 1 accelerates tumorigenicity of prostate epitelial cells. Cancer Res. 1997;57: Bacchi CE. HER-2/neu (c-erbb-2) e câncer da mama. Revis. Brasil. Mastol. 2001;11(4): Révillion F, Bonneterre J, Peyrat JP. ErbB-2 oncogene in human breast cancer and its clinical significance. Eur. J.Cancer. 1998;34: Gutierrez C and Schiff R: HER2: biology, detection, and clinical implications. Arch Pathol Lab Med 135: 55-62, Martín de Las Mulas J, Ordás J,Millán Y, Fernández-Soria V, Cajal SR. Oncogene HER-2 in canine mammary gland carcinomas: an immunohistochemical and chromogenic in situ hybridization study. Breast Cancer Res Treat 2003;80: Gama A, Alves A, Schmitt F. Identification of molecular phenotypes in canine mammary carcinomas with clinical implications: application of the human classification. Virchows Arch, 2008; 453: Higgins RJ, Dickinson PJ, Lecouteur RA, Bollen AW, Wang H. Spontaneous canine gliomas: overexpression of EGFR, PDGFRalpha and IGFBP2 demonstrated by tissue microarray immunophenotyping. J Neurooncol : Shiomitsu K, Johnson CL, Malarkey DE, Pruitt AF, Thrall DE. Expression of epidermal growth factor receptor and vascular endothelial growth factor in malignant canine epithelial nasal tumors. Vet Comp Oncol 2009;7: Sabattini, S., Mancini, F. R., Marconato, L., Bacci, B., Rossi, F., Vignoli, M., & Bettini, G. (2012). EGFR overexpression in canine primary lung cancer: pathogenetic implications and impact on survival. Veterinary and comparative oncology Terragni R, Gardini AC, Sabattini S, Bettini G, Amadori D, Talamonti C, Vignoli M, Capelli L, Saunders JH, Ricci M, Ulivi P. EGFR, HER-2 and KRAS in Canine Gastric Epithelial Tumors: A Potential Human Model? PLoS ONE 2014; 9(1): e doi: /journal.pone Singer J, Weichselbaumer M, Stockner T, Mechtcheriakova D, Sobanov Y, Bajna E, Wrba F, Horvat R, Thalhammer JG, Willmann M, Jensen-Jarolim E. Comparative oncology: ErbB-1 and ErbB- 2 homologues in canine cancer are susceptible to cetuximab and trastuzumab targeting. Molecular Immunology. 2012; 50:
59 Beselga AG. Avaliação da expressão do receptor Her-2 em carcinomas mamários caninos. [Dissertação]. Lisboa: Universidade De Lisboa - Faculdade de Medicina Veterinária, Hsu WL, Huang HM, Liao JW, Wong ML, Chang SC. Increased survival in dogs with malignant mammary tumours overexpressing HER-2 protein and detection of a silent single nucleotide polymorphism in the canine HER-2 gene. Vet J., 2009; 180(1): Dutra AP, Granja NV, Schmitt FC, Cassali GD. c-erbb-2 expression and nuclear pleomorphism in canine mammary tumors. Braz J Med Biol Res. 2004; 37(11): Sherr CJ, Roberts JM. Inhibitors of mammalian G1 cyclin-dependent kinases. Genes Dev. 1995; 9(10): Weiss RH, Marshall D, Howard L, Corbacho AM, Cheung AT, Sawai ET: Suppression of breast cancer growth and angiogenesis by an antisense oligodeoxynucleotide to p21(waf1/cip1). Cancer Lett. 2003, 189: Dotto GP. p21 WAF1/Cip1 : more than a break to the cell cycle? [minireview]. Biochim. Biophys. Acta. 2000;1471:M43-M Chen Z, Trotman LC, Shaffer D, Lin HK, Dotan ZA, Niki M, Koutcher JA, Scher HI, Ludwig T, Gerald W, Cordon-Cardo C, Pandolfi PP. Crucial role of p53-dependent cellular senescence in suppression of Pten-deficient tumorigenesis. Nature, 2005; 436 (7051): El-Deiry WS, Tokino T, Velculescu VE, Levy DB, Parsons R, Trent JM, Lin D, Mercer WE, Kinzler KW, Vogelstein B. WAF1, a potential mediator of p53 tumor suppression. Cell. 1993;75(4): Xiong Y, Hannon GJ, Zhang H, Casso D, Kobayashi R, Beach D. p21 is a universal inhibitor of cyclin kinases. Nature. 1993;366(6456): Lin PY, Fosmire SP, Park SH, Park JY, Baksh S, Modiano JF, Weiss RH. Attenuation of PTEN increases p21 stability and cytosolic localization in kidney cancer cells: a potential mechanism of apoptosis resistance. Mol. Cancer. 2007;6(72):16 doi: / Cazzalini O, Scovassi I, Savio M, Stivala LA, Prosperi E. Multiple roles of the cell cycle inhibitor p21cdkn1a in the DNA damage response. Mutat. Res.- Rev. Mutat. Res. 2010;704: Huang SP, Wu WJ, Chang WSW, Wu MT, Chen YY, Chen YJ, Yu CC, Wu TT, Lee YH, Huang JK, Huang CH. p53 Codon 72 and p21 Codon 31 Polymorphisms in Prostate Cancer. Cancer Epid. Biomar. Prev. 2004;13(12): Lin PY, Fosmire SP, Park SH, Park JY, Baksh S, Modiano JF, Weiss RH. Attenuation of PTEN increases p21 stability and cytosolic localization in kidney cancer cells: a potential mechanism of apoptosis resistance. Mol. Cancer. 2007;6(72):16 doi: / Ritt MG, Mayor J, Wojcieszyn J, Smith R, Barton CL, Modiano JF: Sustained nuclear localization of p21/waf-1 upon growth arrest induced by contact inhibition. Cancer Lett 2000, 158: Klopfleisch R, Gruber AD. Differential expression of cell cycle regulators p21, p27 and p53 in metastasizing canine mammary adenocarcinomas versus normal mammary glands. Res. Vet. Sci. 2009;87: Lopes RA, Cardoso TC, Luvizotto MCR, Andrade AL. Occurrence and expression of p53 suppressor gene and c-myc oncogene in dog eyelid tumors. Vet.Ophthalmol. 2010;13(2): Yan X, Zhang J, Sun Q, Tuazon PT, Wu X, Traugh JA, Chen YG. p21-activated Kinase 2 (PAK2) Inhibits TGF-BSignaling in Madin-Darby Canine Kidney (MDCK) Epithelial Cells by Interfering with the Receptor-Smad Interaction. J. Biol. Chem. 2012;287(17): Winters ZE, Hunt NC, Bradburn MJ, Royds JA, Turley H, Harris AL, Norbury CJ. Subcellular localisation of cyclin B, Cdc2 and p21 (WAF1/CIP1) in breast cancer. association with prognosis. Eur. J. Cancer. 2001;37(18):
60 Winters ZE, Leek RD, Bradburn MJ, Norbury CJ, Harris AL. Cytoplasmic p21 Waf1/Cip1 expression is correlated with HER-2/ neu in breast cancer and is an independent predictor of prognosis. Breast Cancer Res. 2003;5: Weiss RH, Borowsky AD, Seligson D, Lin PY, Dillard-Telm L, Belldegrun AS, Figlin RA, Pantuck AD. p21 is a prognostic marker for renal cell carcinoma: implications for novel therapeutic approaches. J. Urol. 2007;177(1): Freeman DJ, Li AG, Wei G, Li HH, Kertesz N, Lesche R, Whale AD, Martinez-Diaz H, Rozengurt N, Cardiff RD, Liu X, Wu H: PTEN tumor suppressor regulates p53 protein levels and activity through phosphatase-dependent and -independent mechanisms. Cancer Cell 2003, 3: Majid S, Kikuno N, Nelles J, Noonan E, Tanaka Y, Kawamoto K, Hirata H, Li LC, Zhao H, Okino ST, Place RF, Pookot D, Dahiya R. Genistein Induces the p21waf1/cip1 and p16ink4a Tumor Suppressor Genes in Prostate Cancer Cells by Epigenetic Mechanisms Involving Active Chromatin Modification. Cancer Res. 2008;68(8): Shaffer DR, Viale A, Ishiwata R, Leversha M, Olgac S, Manova K, Satagopan J, Scher H, Koff A: Evidence for a p27 tumor suppressive function independent of its role regulating cell proliferation in the prostate. Proc Natl Acad Sci USA 2005, 102(1): Aaltomaa S, Lipponen P, Eskelinen M, Ala-Opas M, Kosma VM. Prognostic value and expression of p21 (waf1/cip1) protein in prostate cancer. Prostate. 1999; 39(1): Hu L, Ibrahim S, Liu C, Skaar J, Pagano M, Karpatkin S: Thrombin induces tumor cell cycle activation and spontaneous growth by down-regulation of p27kip1, in association with the upregulation of Skp2 and MiR-222. Cancer Res 2009, 69(8): Yang RM, Naitoh J, Murphy M, Wang HJ, Phillipson J, Dekernion JB, Loda M, Reiter RE. Low p27 expression predicts poor disease-free survival in patients with prostate cancer. J. Urology. 1998;159(3): Coqueret O. New roles for p21 and p27 cell-cycle inhibitors: a function for each cell compartment?trends cell biol. 2003;13(2), Wang H, Xu Y, Fang Z, Chen S, Balk SP, Yuan X. Doxycycline Regulated Induction of AKT in Murine Prostate Drives Proliferation Independently of p27 Cyclin Dependent Kinase Inhibitor Downregulation. PLoS ONE, 2012;7(7):e Majumder PK, Yeh JJ, George DJ, Febbo PG, Kum J, Xue Q, Bikoff R, Ma H, Kantoff PW, Golub TR, Loda M, Sellers WR. Prostate intraepithelial neoplasia induced by prostate restricted AKT activation: the MPAKT model. Proc. Natl. Acad. Sci. 2003;100(13), Di Cristofano A, De Acetis M, Koff A, Cordon-Cardo C, Pandolfi PP. Pten and p27kip1 cooperate in prostate cancer tumor suppression in the mouse. Nature Genet. 2001;27(2): Taylor W, Mathias A, Ali A, Ke H, Stoynev N, Shilkaitis A, Green A, Kiyokawa H, Christov K. p27kip1 deficiency promotes prostate carcinogenesis but does not affect the efficacy of retinoids in suppressing the neoplastic process. BMC Cancer, 2010;10(1): Klopfleisch R, Schutze M, Gruber AD. Loss of p27 expression in canine mammary tumors and their metastases. Res. Vet Sci. 2010;88(2): May P. Twenty years of p53 research: structural and functional aspects of the p53 protein. Oncogene.1999;18: Levine AJ, Momand J, Finlay CA. The p53 is a tumor suppressor gene. Nature.1991;351(6326): Schmitt F.C. Marcadores prognósticos em carcinomas mamários. In: ALVES VAF. Manual de imuno-histoquímica, São Paulo:Sociedade Brasileira de Patologia, 1999, p Devilee P, Van Leeuwen IS, Voesten A. The canine p53 gene is subject to somatic mutations in thyroid carcinoma. Anticancer Res. 1994;14:
61 Mayr B, Schellander K, Schleger W. Sequence of an exon of the canine p53 gene-mutation in a papiloma. Br. Vet. J. 1994; 150: Chu LL, Rutteman GR, Kong JM, Ghahremani M, Schmeing M, Misdorp W, Pelletier J. Genomic organization of the canine p53 gene and its mutational status in canine mammary neoplasia. Breast cancer res. Treat. 1998;50(1), Souza DMB, Barros MGO, Silva JSC, Silva MB, Coleto ZF, Jimenez GC, Adrião M, Wischral A. Detection of mutations within exons 4 to 8 of the p53 tumor suppressor gene in canine mammary glands. Arq. Bras. Med. Vet. Zoot. 2012;64(2): Van Leeuwen IS, Hellmen E, Cornelisse CJ. P53 gene mutations in osteosarcomas in the dog. Anticancer Res. 1996; 16: Mayr B, Schellander K, Botto I. Canine tumour suppressor gene p53-mutation in a case of adenoma of circumanal glands. Vet. Res. Commun. 1997; 21: Veldhoen N, Milner J. Isolation of canine p53 cdna and detailed chracterization of full length canine p53 protein. Oncogene. 1998; 16: Faleiro MBR, De Moura VMBD. Imunomarcação de p53 na próstata canina com lesões proliferativas. In: IX Congresso de Ensino, Pesquisa e Extensão - Conpeex, 2012, Goiânia. Anais do IX Conpeex. Goiânia: UFG, v Stricker HJ, Jay JK, Linden MD, Tamboli P, Amin MB. Determing prognosis of clinically localized prostate cancer by immunohistochemical detection of mutant p53. Urology. 1996;47(3): Cheng L, Sebo TJ, Cheville JC, Pisansky TM, Slezak J, Bergstralh EJ, Pacelli A, Neumann RM, Zincke H, Bostwick DG. p53 overexpression is associated with increased cell proliferation in patients withlocally recurrent prostate carcinoma after radiation therapy. Cancer. 1999; 85(6): Leite KRM, Srougi M, Nesralhah LJ, Camara-Lopes LH. Analisis of p53 expression and proliferative assessment using PCNA in localized prostate carcinoma. Braz. J. Medic. Biol. Res. 1999;32(3): Tsujimoto Y, Takayama H, Nonomura N, Okuyama A, Aozasa K. Postatrophic hyperplasia of the prostate in Japan: Histologic and immunohistochemical features and p53 gene mutation analysis. Prostate. 2002;52: Tapia R, Huerta M, Islas S, Avila-Flores A, Lopez-Bayghen E, Weiske J, Huber O, González- Mariscal L. Zona Occludens-2 Inhibits Cyclin D1 Expression and Cell Proliferation and Exhibits Changes in Localization along the Cell Cycle. Mol. Biol. Cell. 2009;20: Huerta M, Munoz R, Tapia R, Soto-Reyes E, Ramirez L, Recillas-Targa F, Gonzalez-Mariscal L, Lopez-Bayghen E. Cyclin D1 is transcriptionally down-regulated by ZO-2 via an E box and the transcription factor c-myc. Mol. Biol. Cell. 2007;18: Jirawatnotai S, Hu Y, Michowski W, Elias JE, Becks L,Bienvenu F, Zagozdzon A, Goswami T, Wang YE, Clark AB, Kunkel TA, Harn TV, Xia B, Correll M, Quackenbush J, Livingston DM, Gygi SP, Sicinski P. A function for cyclin D1 in DNA repair uncovered by interactome analyses in human cancers. Nature. 2011;474(7350): doi: /nature Kaltz-Wittmer C, Klenk U, Glaessgen A, Aust DE, Diebold J, Lohrs U, Baretton GB. FISH analysis of gene aberrations (MYC,CCND1,ERBB2,RB, and AR) in advanced prostatic carcinomas before and after androgen deprivation therapy. Lab. Inves. 2000;80(9): Rocha S, Martin AM, Meek DW, Perkins ND. p53 represses cyclin D1 transcription through down regulation of Bcl-3 and inducing increased association of the p52 NF-kappaB subunit with histone deacetylase 1. Mol. Cell. Biol. 2003; 23: Lee JT, Shan J, Gu W. Targeting the degradation of cyclin D1 will help to eliminate oncogene addiction. Cell cycle. 2010; 9(5):
62 Faria MHG, Rabenhorst SHB. Impacto do oncogene C-MYC no câncer. Rev. Bras. Cancerol. 2006;52(2); Pelengaris S, Khan M, Evan G. c-myc: More than just a matter of life and death. Nat Rev Cancer. 2002;2: Bernard D, Pourtier-Manzanedo A, Gil J, Beach DH. Myc confers androgen-independent prostate cancer cell growth. J. Clin. Invest. 2003;112(11): Qian J, Hirasawa K, Bostwick DG, Bergstralh EJ, Slezak JM, Anderl KL, Borell TJ, Lieber MM, Jenkins RB. Loss of p53 and c-myc Overrepresentation in Stage T2-3N1-3M0 Prostate Cancer are Potential Markers for Cancer Progression. Mod Pathol. 2002;15(1): Kumaraguruparan R, Karunagaran D, Balachandran C, Manohar BM, Nagini S. Of humans and canines: a comparative evaluation of heat shock and apoptosis-associated proteins in mammary tumors. Clinica Chimica Acta 2006; 365: Barathidasan R, Pawaiya RS, Rai RB, Dhama K. Upregulated Myc Expression in N-Methyl Nitrosourea (MNU)- induced Rat Mammary Tumours. Asi. Paci. J. Cancer Prev. 2013; 14(8): Kang J, Sergio CM, Sutherland RL, Musgrove EA. Targeting cyclin-dependent kinase 1 (CDK1) but not CDK4/6 or CDK2 is selectively lethal to MYC-dependent human breast cancer cells. BMC Cancer. 2014;14(1): Wang X, Cunningham M, Zhang X, Tokarz S, Laraway B, Troxell M, Sears RC. Phosphorylation Regulates c-myc's Oncogenic Activity in the Mammary Gland. Molecular and Cellular Pathobiology Am. Assoc. Cancer Res. 2011; 71(3): Pawaiya RVS, Ramkumar. c-myc expression pattern in canine mammary and human breast cancer. Indian J Vet Pathol, 2009;33: Gavhane DS, Singh A, Sood NK, Gupta K, Baig MR, Mugale M. Immunolocalisation of c-myc an Oncoprotein of Canine Mammary Tumors. Israel J. Vet. Med. 2013;68: Koh CM, Bieberich CJ, Dang CV, Nelson WG, Yegnasubramanian S, De Marzo AM. MYC and prostate cancer. Genes Cancer. 2010;1: Civenni G, Malek A, Albino D, Garcia-Escudero R, Napoli S, Di Marco S, Pinton S, Sarti M, Carbone GM, Catapano CV. RNAi-Mediated Silencing of Myc Transcription Inhibits Stemlike Cell Maintenance and Tumorigenicity in Prostate Cancer. Cancer Res. 2013;73(22): LIMA CRO. Classificação morfológica, critérios de malignidade, expressão gênica de c-myc imunoistoquímica de c-myc, p53, p21 e p27 no tumor venéreo transmissível canino. Goiânia, 2013, 103p. Tese (Doutorado) - Escola de Veterinária E Zootecnia Universidade Federal de Goiás 178. Yeh ES, Belka GK, Vernon AE, Chen CC, Jung JJ, Chodosh LA. Hunk negatively regulates c- myc to promote Akt-mediated cell survival and mammary tumorigenesis induced by loss of Pten. PNASA 2013;110(15): Kim JY, Valencia T, Abu-Baker S, Linares J. Lee SJ. Yajima T. chen J, Eroshkin A, Castilla EA, Brill LM, Medvedovic M, Moscat J, Diaz-Meco MT. c-myc phosphorylation by PKCζ represses prostate tumorigenesis. PNASA. 2013;110(16): Song H, Zhang B, Watson MA, Humphrey PA, Lim H, Milbrandt J. Loss of Nkx3.1 leads to the activation of discrete downstream target genes during prostate tumorigenesis. Oncogene. 2009;28(37): Iwata T, Schultz D, Hicks J, Hubbard GK, Mutton LN, Lotan TL, Bethel C, Lotz MT, Yegnasubramanian S, Nelson WG, Dang CV, Xu MM, Anele U, Koh CM, Bieberich CJ, De Marzo AM. MYC overexpression induces prostatic intraepithelial neoplasia and loss of Nkx3. 1 in mouse luminal epithelial cells. PloS one, 2010;5(2), e9427.
63 Gurel B, Iwata T, Koh CM, Jenkins RB, Lan F, Van Dang C, Hicks JL, Morgan J, Cornish TC, Sutcliffe S, Isaacs WB, Luo J, De Marzo AM. Nuclear MYC protein overexpression is an early alteration in human prostate carcinogenesis. Mod Pathol 2008;21: Prowatke I, Devens F, Benner A, Greone EF, Mertens D, Greone HJ, Lichter P, Joos S. Expression analysis of imbalanced genes in prostate carcinoma using tissue microarrays. Br J Cancer 2007;96: Ellwood-Yen K, Graeber TG, Wongvipat J, Iruela-Arispe ML, Zhang JF, Matusik R, Thomas GV, Sawyers CL. Myc-driven murine prostate cancer shares molecular features with human prostate tumors. Cancer Cell. 2003;4(3): Nakagawa M, Yamanaka S. Function of Myc for generation of induced pluripotent stem cells. Stem Cells Cancer Stem Cells. 2012;6:79 85
64 O corpo herda naturalmente do corpo, segundo as disposições da mente que se ajusta a outras mentes, nos circuitos da afinidade, cabendo, pois, ao homem responsável reconhecer que a hereditariedade relativa, mas compulsória lhe talhará o corpo físico de que necessita (...) unidades de força psicossomática que atuam no citoplasma, projetando sobre as células e, consequentemente, sobre o corpo os estados da mente... André Luiz (Francisco Cândido Xavier e Waldo Vieira) Evolução em dois mundos (1959)
65 43 CAPÍTULO 2 - EGF receptors expression in canine prostate with proliferative inflammatory atrophy and carcinoma ABSTRACT In this study, gene expression of ErbB1 and ErbB2 and immunostaining of EGFR (Her1) and Her2 (c-erbb-2) were evaluated to verify if those receptors are involved in canine premalignant and malignant prostatic lesions, proliferative inflammatory atrophy (PIA) and carcinoma (PC). From 70 prostatic samples obtained, 15 were considered normal, 30 had PIA and 25 PC. Regarding EGFR immunostaining intensity there was no difference between normal prostatic tissue and PIA or PC. In contrast, in relation to immunostainig intensity for Her2, differences between normal prostatic tissue and with PIA and PC, and also between PIA and PC, were recorded. There was no correlation between EGFR and Her2 immunostaining. RT-PCR was performed in sixteen samples of canine prostatic formalinfixed paraffin embedded tissue (FFPE), four of which were considered normal, three had PIA and nine PC. ErbB1 gene product was detected in two normal samples, in one with PIA, and in all samples with PC. ErbB2 mrna was recorded in two canine samples with PIA, in all with PC, but not detected in normal prostatic tissue. It was concluded that EGFR and Her2 play an important role in canine PIA and early lesions of canine PC, particularly Her2, suggesting that those receptors may be involved in canine prostatic carcinogenesis and tumoral development. Key words: c-erbb-2, growth factor receptor, Her1, PIA, RT-PCR.
66 44 Expressão de receptores EGF na próstata canina com atrofia inflamatória proliferativa e carcinoma RESUMO Neste estudo a expressão gênica de ErbB1 e ErbB2 e a imunomarcação de EGFR (Her1) e Her2 (c-erbb-2) foram avaliadas com o objetivo de verificar quanto ao envolvimento desses receptores nas lesões pré malignas e malignas da próstata canina,como a atrofia proliferativa inflamatória (PIA) e o carcinoma prostático (PC). Foram obtidas 70 amostras de próstata canina, sendo 15 normais, 30 com PIA e 25 com PC. Em relação àintensidade de imunomarcação de membrana para EGFR, não houve diferença estatística entre os tecidos prostáticos normais e com PIA e PC. Em relação a Her2, observou-se diferença estatística de imunomarcação entre o tecido prostático normal e aqueles com PIA e PC e entre os com PIA e PC. Não houve correlação de imunoexpressão de EGFR e Her2. Foram utilizadas dezesseis amostras de cdna de próstata canina FFPE para a realização da RT-PCR, sendo quatro normais, três com PIA e nove com PC. O gene ErbB1 foi detectado em duas amostras normais, uma de PIA e em todas as amostras de PC. O gene ErbB2 foi detectado em duas amostras de PIA e em todas as amostras de PC, não sendo detectado no tecido prostático normal. Concluiu-se que o EGFRe Her2atuam nas lesões de PIA e PC, com ação importante do receptor Her2, sugerindo que esses receptores estão envolvidos na carcinogênese e no desenvolvimento tumoral da próstata canina. Palavra chave: c-erbb2, Her1, PIA, receptor de fator de crescimento,rt-pcr.
67 45 INTRODUCTION The canine prostate has been extensively studied due to similarities to human gland regarding natural occurrence of diseases and hormonal influence in their development, as in prostatic carcinoma 1-3 (PC). Dysplastic lesions of the human prostate, such as prostatic intraepithelial neoplasia (PIN), may be considered premalignant due to morphological similarities to cancer or potentially carcinogenicfactorsinvolvement 4. Proliferative inflammatory atrophy (PIA) is another lesion that has been investigated to determine its premalignant potential 5.In dogs, Rodrigues et al. 6 reported PIA in canine prostate and Toledo et al. 7 described its histological aspects. Dogs are the only animals besides humans that develop spontaneous PC with high frequency 1. The canine PC model is used to study molecular mechanisms of carcinogenesis and potential therapies, pathogenesis, development, angiogenesis, and tumoral progression 2,3.Amongmanychanges introduced by neoplastic cells, abnormalities in cellular response to the growth factors and their receptors promote cell proliferation, apoptosis inhibition and ability of cancer cells to spread and angiogenesis stimulation 8. Growth factor activity is regulated by different mechanisms that control growth factor gene activation and signal output modulation by receptors 9.In this context, ErbB receptors, particularly EGFR (Her1) and Her2 (c-erbb-2), have been implicated in the development and progression of PC 10. The ErbB family is a group of tyrosine kinase receptors, comprised by EGFR or Her1, Her2 or c-erbb-2, Her3 or c-erbb-3, and Her4 or c- erbb-4. They are coded by ErbB (erythroblastic leukemia viral oncogene homolog) 1, ErbB2, ErbB3 and ErbB4, respectively, and also are widely expressed in epithelial tissues where they play crucial roles in regulation of cell differentiation, proliferation and survival 11,12. EGFR has an extracellular ligand-binding domain, a transmembrane domain and an intracellular domain with tyrosine kinase activity for signal transduction. The domains are activated by binding with epidermal growth factor (EGF) or transforming growth factor alfa (TGF-α), resulting in dimerization with Her1 or heterodimerization with other ErbB member. This leads to receptor-linked tyrosine kinase activation and results in a signaling cascade that produces effects including cell migration, maturation, differentiation, metastasis, angiogenesis and inhibition of apoptosis 11, EGFR is expressed or overexpressed in solid tumors including breast, head and neck, non-small cell lung and PC. Also, it has been associated with advanced tumor stage, poor prognosis, and resistance to chemotherapy, hormone therapy and radiation 11,16.
68 46 Furthermore Yarden and Sliwkowski 17 enhance that homodimers are less mitogenic than heterodimers, and have low transformation activity. Thus, Her2 are heterodimer preferably, have more tyrosine kinase activity tends to be more potent andgenerate intracellular signals more intense, which gives increased mitogenic potential. Therefore, levels of the other ErbB family receptors, especially HER2, can significantly affect the EGFR signaling in human`s cancer. For Daly et al. 18 and Pal and Pegram 19, Her2 is the election pair to the other members of the family in heterodimerization process. This is due to its structural form, which promotes permanent exhibition of domain dimerização 20. Her2 and Her3 receptors work as co-receptors, since Her2 has a kinase domain that is activated when bound to Her3. Also, Her2 does not require a specific binder to be activated; therefore, it may bind to another ErbB family member 21. Her2 overexpression has been reported in a range of 20-70% in human PC 14,22,23.In contrast, other studies also report almost no Her2 expression 24, and even expression in 90% of samples of human PC 25. In domestic animals, EGFR immunostaininghas been reported in canine breast tumors 26,27, primary brain tumors 24, nasal carcinomas 29, lung carcinomas 30, and gastric tumors 31. Likewise, Her2 cases overexpression was reported in 19-35% of canine mammary tumors 32,33, and in 57.9% of canine gastric neoplasms 31. However, there are no reports regarding both EGFR and Her2 receptors expression in canine prostate. Therefore, in order to clarify molecular mechanisms involving those receptors in canine premalignant and malignant prostatic tissue, RNA detection of ErbB1 and ErbB2, and immunostaining of EGFR and Her2 were evaluated in the prostate of dogs with PIA and PC. MATERIAL AND METHODS The samples were derived from the necropsied animal s on pathology service of the School of Veterinary Medicine and Animal Science of the Federal University of Goiás (UFG), Goiânia, Goiás, Brazil, registered from 2008 to The research was approved by committee on publication ethics COPE/UFG number 353/2010.Three-µm-sections were obtained from formalin-fixed-paraffin-embedded (FFPE) tissue blocks and stained with hematoxylin and eosin (HE) for microscopic examination. Histomorphological evaluation was used to identify normal, PIA 7 and PC 34 prostates. All prostatic samples were obtained from with pure or mixed-breed adult dogs and normal prostatic tissues were harvested from dogs with no lesions in the gland. Prostate tissue microarray (TMA) was carried out according to criteria described by Rubin et al. 35. From the previous defined areas in histomorphological evaluation, tissue
69 47 cores with a dimension of 1.0 mm were taken from FFPE tissue samples and arrayed on a recipient paraffin block, in duplicate, using the tissue microarray (Beencher Instruments, Silver Spring, USA). Three-µm-sections were obtained from recipient block and distended on charged slides (Starfrost White, Sakura Adhesion microscope slide with Cut Edges, ready to use, Germany - Dako ) for HE staining and immunohistochemistry. Immunohistochemistry was performed in TMA slides, in duplicate, which were deparaffinized, rehydratated and washed in distilled water. Endogenous peroxidase and nonspecific protein were blocked with 3% hydrogen peroxide incubation for 20min (for EGFR and c-erbb-2), protein block (Leica, Newcastle, UK, #RE7102) incubation for 5min at 37 C (EGFR), and milk powder 10% (Molico, Brazil - 10g/100 ml distilled in water) incubation for 1h at 37ºC (c-erbb-2). EGFR antigen retrieval was performed with 10mM pre-heated citrate buffer, ph 6.0, for 3min, in a pressure cooker (Solar, Rapid Express, Tramontina, Brazil). Novocastra tm mouse monoclonal antibody anti-human EGFR (Leica, Newcastle, UK, #NCL-L-EGFR-384), clone EGFR-25 was diluted at 1:50 and incubated overnight at 4 C in a wet chamber. C-erbB-2 antigen retrieval was carried out in a water bath at 96ºC for 40min, with 10 mm of pre-heated citrate buffer, ph 6.0. Polyclonal rabbit anti-human c-erbb-2 oncoprotein (Dako, Carpinteria, CA, USA, #A0485) was diluted at 1:200 and applied overnight at 4 C in a wet chamber. A polymer kit (New Link Max Polymer, UK, #RE7260-K) was used to incubate sections with polymer enzyme, chromogen and HRP substrate for signal detection. Sections were counterstained with Mayer's hematoxylin, washed, dehydrated, cleared, cover slipped, and examined by light microscopy. Samples from human placenta for EGFR and human mammary carcinoma for c- erbb-2 were used as positive control. For negative control, primary antibody was replaced by ph 7.4 PBS buffer. The intensity of EGFR and c-erbb-2 reactivity was scored following adapted criteria from Bilous et al. 36, including 0- (negative, no staining), 1+ (mild, weak membrane staining in <10% of cells), 2+ (moderate, weak to moderate incomplete membrane staining in >10% of cells), and 3+ (intense, strongly positive with strong complete membrane staining in >10% of cells) (Figure 1). Samples scored as 0 and 1+ were assigned as normal expression (or negative), and those scored as 2+ and 3+ were considered overexpressed for EGFR and Her2.
70 48 Intensity Score Negative (0-) Mild (1+) Moderate (2+) Intense (3+) 100µm 50µm 100µm 50µm FIGURE 1 - Immunostaining intensity of EGFR and Her2 antibodies in canine prostatic tissue Before working with RNA, the microtome, the entire lab bench, pipettors, and sectioning equipment were cleaned with an RNase decontamination solution (Ambion RNaseZap Solution, Life Technologies, CA, USA, #AM9780). Also, RNase-free pipette tips were used. The analysis were performed in duplicate using 20 sections with 12 μm from each paraffin block, which were placed into 1.5 ml sterilized polypropylene micro tubes. The tubes were kept at -20 C until deparaffinization, digestion and RNA extraction. The RecoverAll Total Nucleic Acid Isolation Kit (Life technologies, CA, USA, #AM1975) was used to extract total nucleic acids (RNA and DNA) from all FFPE tissues sample that were used in the TMA. Twelve-μm-sections were deparaffinized using xylene and ethanol washes followed by protein digestion with protease K, incubation in water bath for 16h at 50 C, and 15min at 80 C. Sequentially, RNA isolation and purification samples were treated with DNase mix for 30min followed by washing and finishing with the elution. The solution containing the nucleic acid (RNA) was stored at -20 C until proceeding the cdna synthesis using High Capacity RNA-to-cDNA Kit (Applied Biosystems : CA, USA, # ). After purification of RNA, the yield and quality was measured by NanoVue Plus Spectrophotometer (GE Healthcare, UK AC). The yield was estimated by UV absorbance at 260 nm and quality for rate between A260/A280, using samples higher than Likewise, presence of RNA was confirmed by 1% agarose gel electrophoresis on PowerPac TM Basic Power Supply (Bio-Rad, CA, USA, # ) and the images of gels were obtained by Gel Doc TM EZ System (Bio-Rad, CA, USA, # ). The High Capacity RNA-to-cDNA Kit (Applied Biosystems : CA, USA, # ) was used for reverse transcription (RT) of total RNA to single-stranded cdna using a reaction size of 20 µl. All the RT reaction was prepared on ice and in duplicate. In a 0.6 ml micro centrifuge tube was added 10 µl of 2 RT buffer, 1.0 µl of 20 RT enzyme
71 49 mix, 2µg of each sample, and nuclease-free water until complete 20 µl. This solution was incubated at Thermal Cycler T100 TM (Bio Rad, CA, USA, # ) at 37 C for 60min, followed by 95 C for 5min, and storage at -20 C until proceeding the RT-PCR reaction. The polymerase chain reaction (PCR) was performed in duplicate for cdna amplification of ErbB1 - (GenBank: AY ) - Canis lupus familiaris epidermal growth factor receptor (EGFR), locus chromosome 18; ErbB2 (GenBank: AB ) C. l. familiaris ErbB2 - erythroblastic leukemia viral oncogene homolog 2, locus chromosome 9; and beta-actin, (canine housekeeping gene - GenBank: AF ) - C. l. familiaris actin, gamma 1 (ACTG1) locus chromosome 9. PCR amplified gene fragments with 149pb, 157pb, and 151pb respectively. In each PCR micro tube, we inserted 100 ng of DNA; 1x of 10X PCR buffer (200 mm Tris-HCl ph 8.4, 500 Mm KCl); 2.5 mm of Magnesium Chloride (MgCl 2-50 mm); 0.2 mm of 2 -deoxynucleoside 5`-triphosphate (100 mm dntp set, PCR grade - datp, dctp, dgtp, dttp- Invitrogen by life Technologies TM CA, USA, # ); 0.4 mm of each oligonucleotide primer [EGFR Forward (Fw): CCAAGATCCCATCCATT - reverse (Rev): CTCGACAAGCTCTCTTT; Her2 Fw: AGTGCTGGATGATAGAC, Rev: AGTAGTGAACGGTAGAAG; β-actin, Fw: TGGAATCATGCGGTATC, Rev: GGCTGTGATTTCCTTCT]; 1U of Thermus aquaticus (Taq) DNA polymerase recombinant (Invitrogen CA, USA, # ); and Diethylpyrocarbonate (DEPC) treated until complete 25 µl of solution. Followed conditions at Thermal Cycler T100 TM (Bio Rad, CA, USA, # ): 95ºC for 5min; 95ºC for 1min; 58ºC for 30s; 72ºC for 1min and 72ºC for 5min; repeated 50 times. Electrophoresis in 1% Ultra Pure TM agarose gel (Invitrogen, CA, USA, # ) with 0.5 µg/ml of Ultra Pure TM 10mg/ml ethidium bromide (EtBr, Invitrogen, CA, USA, # ) was performed in duplicate by 1h of running in 80 V on PowerPac TM Basic Power Supply (Bio Rad, CA, USA, # ) with GeneRuler 1Kb Plus DNA Ladder (Thermo scientific, CA, USA, #SM1331). The RT-PCR amplified products were visualized on Gel Doc TM EZ System (Bio Rad, CA, USA, # ). The ErbB1, ErbB2 and β-actin primers were obtained from Primer Quest Advanced tool ( The oligonucleotides were synthesized by Eurofins MWG Operon, and diluted with nuclease free water at concentration according to manufacturer s directions. Chi-square, Kruskal-Wallis and descriptive data were used to compare the scores of intensity positive cells. Association between EGFR and Her2 expression in normal prostatic tissue with PIA and PC was achieved by Spearman test. It was used SPSS (IBM Corp. Released IBM SPSS Statistics for Windows, Version Armonk, NY: IBM
72 50 Corp.) and R (R Development Core Team (2008) R Foundation for Statistical Computing, Vienna, Austria). All values were in rank and were considered with 5% of significance level. RESULTS From the TMA slide, 15 (21.43%) samples of normal tissue, 30 (42.86%) of PIA, and 25 (35.71%) of PC were obtained and scored according intensity of immunostaining to EGFR and Her2 (Table 1). The immunostaining was present in the membrane going through cytoplasm, is shown in Figures 2 and Figure 3. Even using human antibodies, the results from this study are reliable since Singer et al. 37 demonstrated by BLAST alignments that canine ErbB1 and ErbB2 are homologues in 91% and 92%, respectively, with the equivalent human homologues, and identities of 95% for both molecules with the human counterparts. They conclude that both targets indicated almost perfect evolutionary conservation which makes canine cancer an excellent method suited for proof-of-concept studies in clinical comparative oncology settings, especially for research working on the ErbB-family 37. TABLE 1- Labeling intensity scores of EGFR and Her2 antibodies in normal prostate tissue and with PIA and PC. EGFR Labeling Intensity Normal (n=15) PIA (n=30) PC (n=25) 0- Negative 20% (3) 6.67% (2) 24% (6) 1+ (Mild) 53.33% (8) 56.67% (17) 44% (11) 2+(Moderate) 26.67% (4) 33.33% (10) 28% (7) 3+(Intense) 0% (0) 3.33% (1) 4% (1) Her2 Labeling Intensity 0- Negative 87.7% (13) 13.33% (4) 0% (0) 1+(Mild) 13.3% (2) 26.67% (8) 16% (4) 2+(Moderate) 0% (0) 23.33% (7) 12% (3) 3+(Intense) 0% (0) 36.67% (11) 72% (18)
73 51 A B C D FIGURE 2 - EGFR immunostainingmembrane through cytoplasm (arrow). A) Human placenta. Positive control with 3+ immunostainingscore(200x); B) Canine PC tissue with 1+score(400X); C) Normal canine prostatic tissue with 1+ score (400X); D) Canine prostatic tissue with PIA and 2+labeling score (200X). IHC, DAB with H&E counterstain. A B C D FIGURE 3 - Her2 immunostainingmembrane through cytoplasm (arrow). A) Human mammary carcinoma. Positive control with 3+ immunostaining intensity score (400X); B) Canine PC tissue with 3+score(400X); C) Normal canine prostatic tissue with 0- score (200X); D) Canine prostatic tissue with PIA and 2+ labeling score (400X); IHC, DAB with H&E counterstain.
74 52 Regarding EGFR immunostaining intensity, there was no difference between normal prostate and PIA and PC (p<0.05). In contrast, difference was noticed in Her2 immunostaining intensity between normal prostatic tissue and with PIA and PC, and between PIA and PC (p<0.05) (Table 2). When comparing immunostaining intensity of EGFR and Her2, there was no difference between normal prostatic tissue and with PIA and PC (p<0.05). TABLE 2 - Means of comparison between EGFR and Her2 immunostaining intensity in canine normal prostatic tissue and with PIA and PC. Diagnoses Rank of Staining Intensity EGFR Her2 Normal (n=15) a a PIA (n=30) a b PC (n=25) a c Similar letters in the same column are not different by Kruskal-Wallis test (p>0.05). From 70 samples, sixteen cdna samples of canine prostatic tissue with rate between A260/A280 higher than 1.70, were obtained to perform RT-PCR, being four (25%) normal tissue, three (18.75%) with PIA, and nine (56.25%) with PC. A commercial kit for extraction enabled us to obtain DNA and RNA from FFPE canine prostate tissue with good enough quality and quantity to perform the RT-PCR test successfully. Isolating nucleic acids from tissues in sufficient amount, purity and integrity is an essential step in the practice of molecular biology. The quantity, purity and integrity of nucleic acid extracted depend on time of pre-fixation, and time and temperature used in FFPE process 38,39. Thus, extracting RNA with good quality and quantity is a feasible and valuable tool in diagnostic routine and retrospective studies 40,41. The ErbB1 gene mrna was detected in two normal, one PIA and in all PC samples. ErbB2 mrna was detected in PIA2, PIA3, and all PC, but no in normal prostatic tissue samples (Figure 4). A parallel of EGFR and Her2 immunostaining by IHC and ErbB1 and ErbB2 detection by RT-PCR is shown in Table 3.
75 53 FIGURE 4 - Agarose gel images showing amplification products of β-actin, ErbB1 and ErbB2 genes from canine prostatic tissue. A) RT-PCR for β-actin expression as samples positive control. All samples amplified. B) RT-PCR for ErbB1.Prostatic samples N3, N4, PIA2, all PC, and MC amplified. C) RT-PCR for ErbB2. Prostatic samples PIA2, PIA3, all PC and MC amplified. MW = Molecular weight (GeneRuler 1Kb Plus DNA Ladder - Thermo scientific, CA, USA, #SM1331); MC= canine mammary carcinoma (ErbB1 and ErbB2 positive control); N=Canine normal prostatic tissue; PIA=Canine proliferative inflammatory atrophy; PC=Canine prostatic carcinoma. TABLE 3- Comparison results of EGFR and Her2 immunostaining scores by immunohistochemistry (IHC) and ErbB1 and ErbB2 detection by RT-PCR in normal canine prostatic tissue and with PIA and PC. Samples IHC RT-PCR EGFR Her2 ErbB1 ErbB2 N1 0 (-) 0 (-) - - N2 1 (-) 0 (-) - - N3 2 (+) 1 (-) + - N4 1 (-) 0 (-) + - PIA1 1 (-) 1 (-) - - PIA2 2 (+) 2 (+) + + PIA3 1 (-) 2 (+) - + PC1 1 (-) 2 (+) + + PC2 2 (+) 2 (+) + + PC3 1 (-) 3 (+) + + PC4 2 (+) 3 (+) + + PC5 1 (-) 2 (+) + + PC6 0 (-) 3 (+) + + PC7 1 (0) 2 (+) + + PC8 2 (+) 3 (+) + + PC9 2 (+) 2 (+) + + MC 3 (+) 3 (+) + + MC=canine mammary carcinoma; N=canine normal prostatic tissue; PIA=canine proliferative inflammatory atrophy; PC=canine prostatic carcinoma; 0,1,2,3 IHC scores; + positive; - negative.
76 54 DISCUSSION It was observed immunostaining of EGFR in 80% of canine normal prostatic tissue, and also detected ErbB1 mrna in 50% of canine normal prostatic tissue by RT-PCR. It is according to Carlsson et al. 15, Peraldo-Neia et al. 42 and Gama et al. 43 that reported EGFR expression in normal tissues such as liver, digestive tract, human prostate and canine mammary tissue. However, Terragni et al. 31 have reported no expression of EGFR in canine normal gastric epithelium, similar to observed here in 20% of canine normal prostatic tissue. In this study, 36.6% of prostates with PIA and 32% with canine PC presented EGFR immunostaining. Similar results were reported by Carlsson et al. 15 in a study with human PC and lymph node metastasis, observing EGFR immunostaining in roughly41% of primary tumors and in one case of metastasis. In contrast, Schlomm et al. 44 observed EGFR immunostaining in 17.5% of human prostates with PC. In this context, Carlsson et al. 15 suggest that EGFR could have an important role in initial lesions of PC and it would be negligible in tumors of stage advanced. Thus, since in this study there was no difference of EGFR immunostaining between prostate with PIA and PC, it is possible that EGFR play a role in pre-malignant and early lesions of canine prostate. Corroborating that idea, Di Palma et al. 45 and Matsubayashi and Yoshihara 46 reported ErbB1 amplification and EGFR overexpression in early events of carcinogenesis in tumors of human salivary glands. Also, Bertagnolli et al. 47 have studied EGFR in canine mammary tumors and concluded that EGFR expression may contribute to malignant epithelial transformation. Those authors also has been referring that EGFR is associated with increased tumor proliferative activity, angiogenesis and metastatic potential, working as a predictive factor in these neoplasms. Her2immunostaining was observed in two samples of canine normal prostatic tissues, also it was scored as 1+, considered here as negative. These results are accordingly to Terragni et al. 31 that have not observed Her2 expression in non-neoplastic canine gastric mucosa. However, Carlsson et al. 15 reported that Her2immunostaining may occur in normal tissues. Also, the IHC results concerning Her2were coherent with those obtained in RT-PCR technique, since there was expression of ErbB2 in normal prostatic tissue. Canine prostates with PC presented 84% of Her2 overlabeling and 100% ErbB2 expression. In human PC Her2overexpression is reported in 20-70% of PC samples 14,22,23 and was associated to high Gleason score 44,48, tumor recurrence and cancer advanced stage 44. However, Liu et al. 24 reported no expression of Her2in primary human PC. On the other hand, Carles et al. 25 reported Her2 expression in up to 90% of PC cases, and Carlsson et al. 15, when
77 55 studying human PC and lymph node metastases, observed nearly 33% Her2 immunostaining in primary tumors and 66.6% in metastases. Those authors reported higher frequency of Her2overexpression in human PC cases with metastases when compared to cases where PC was confined to the prostate, and have suggested up regulation of Her2in metastases. Based on this, our results would indicate the canine PC as having great potential of aggressively as mentioned by Leroy & Northrup 2. However, even without evaluation for canine PC metastasis, it is likely that Her2 may have a single role in canine prostate tissue regarding PC evolution and metastasis, since canine PC is less frequent and with later onset if compared with PC in humans. Perchance, mechanisms of Her2 interaction with inhibitors proteins involved in cell cycle, such as p21 and p27, are more efficient in canine prostatic tissue than in human gland. In this study, Her2 overlabeling and ErbB2 expression were found in 60% and 66% of canine prostates with PIA, respectively, confirming the proliferative pattern of this prostatic disease and supporting its pre-malignant potential 2,4. Terragni et al. 31 observed that Her2 was more expressed in dysplastic areas of canine benign gastric tumors, suggesting its potential relevance in pre-malignant lesions. It is a relevant remark that Her2 immunostaining was significantly weaker in canine prostates with PIA than those with PC. Also, ErbB2 mrna was less detected in prostates with PIA than PC. Taken together, the results are suggestive that Her2 growth factor receptor plays an important role in canine prostatic carcinogenesis and tumoral development. CONCLUSIONS EGFR and Her2 are expressed in canine PIA and early lesions of canine PC, particularly Her2, which was overexpressed, pointing to the involvement of these receptors in canine prostatic carcinogenesis and tumoral development. Considering these findings, the next step would be exploring the association of EGFR and Her2 action and tumoral disease evolution, metastasis, and prognosis. REFERENCES 1. Winter SF, Cooper AB, Greenberg NM. Models of metastatic prostate cancer: A transgenic perspective. Prostate cancer prostatic diseases. 2003;6(3): Leroy BE, Northrup N. Prostate cancer in dogs: Comparative and clinical aspects Vet J. 2009;180(2): Fonseca-Alves CE, Faleiro MBR, Laufer-Amorim R, de Moura VMBD. Prostatic histological evaluation in adult not castrated dogs. Arq. Bras. Med. Vet Zootec. 2010;62:10-29.
78 56 4. De Marzo AM, Platz EA, Epstein JI, Ali T, Billis A, Chan TY, Cheng L, Datta M, Egevad L, Ertoy-Baydar D, Farre X, Fine SW, Iczkowski KA, Ittmann M, Knudsen BS, Loda M, Lopez-Beltran A, Magi-Galluzzi C, Mikuz G, Montironi R, Pikarsky E, Pizov G, Rubin MA, Samaratunga H, Sebo T, Sesterhenn IA, Shah RB, Signoretti S, Simko J, Thomas G, Troncoso P, Tsuzuki TT, Van Leenders GJ, Yang XJ, Zhou M, Figg WD, Hoque A, Lucia MS. A working group classification of focal prostate atrophy lesions. Am. J. Surgi. Pathol. 2006;30(10): Wang W, Bergh A, Damber JE. Morphological Transition of Proliferative inflammatory atrophy to high grade intraepithelial neoplasia and cancer in human prostate. Prostate. 2009;69(13): Rodrigues MMP, Di Santis GW, De Moura VMBD, Amorim RL.COX-2 and TGF- β expression in proliferative disorders of canine prostate. Braz. J. Vet Pathol. 2010;3: Toledo DC, Faleiro MBR, Rodrigues MMP, Di Santis GW, Amorim RL, De Moura VMBD.Histomorphological characterization of proliferative inflammatory atrophy in canine prostate. Ciênc. Rural. 2010;40: Henson ES, Gibson S.B. Surviving cell death through epidermal growth factor (EGF) signal transduction pathways: Implications for cancer therapy. Cellular Sign. 2006;18(12): Lodish H, Berk A, Zipursky SL, Matsudaira P, Baltimore D, Darnell J. Biologia cellular e molecular. 4ed. Rio de Janeiro: Revinter p. 10. Pina FM, Figueiredo MG, Lunet N, Reis F, Castro H, Cruz F, Barros H. O eixo EGF e o Cancro da Próstata. O Epidermal Growth Factor (EGF) - Experiência clínica. Acta Urológica. 2008;25(2): Ciardello F, Tortora G. EGFR Antagonists in Cancer Treatment. New Engl. J. Med. 2008;358(11): Ellina MI, Bouris P, Aletras AJ, Theocharis AD, Kletsas D, Karamanos NK. EGFR and HER2 exert distinct roles on colon cancer cell functional properties and expression of matrix macromolecules. BBA-General Subjects. 2014;1840(8): Citri A and Yarden Y. EGF-ERBB signalling: towards the systems level. Nat Rev Mol Cell Biol. 2006;7: Carlsson J. Potential for clinical radionuclide-based imaging and therapy of common cancers expressing EGFR-family receptors. Tumour Biol. 2012;33: Carlsson J, Shen L, Xiang J, Xu J, Wei Q. Tendencies for higher co-expression of EGFR and HER2 and downregulation of HER3 in prostate cancer lymph node metastases compared with corresponding primary tumors. Oncology Letters. 2013;5: Brabender J, Danenberg KD, Metzger R. Epidermal growth factor receptor and HER2-neu mrna expression in non small cell lung cancer is correlated with survival. Clin. Cancer Res. 2001;7, Yarden Y, Sliwkowski MX. Untangling the ErbB signalling network. Nat Rev Mol Cell Biol 2001, 2, Daly JM, Jannot CB, Beerli RR, Graus-Porta D, Maurer FG, Hynes NE. Neu differentiation factor induces HER-2 downregulation and apoptosis of HER-2-overexpressing breast tumor cells. Cancer Research, 1997; 57(17): Pal SK, Pegram M. HER2 targeted therapy in breast cancer... beyond Herceptin.Rev. Endo. Metab. Disor. 2007;8(3), Pinkas-Kramarski R, Soussan L, Waterman H, Levkowitz G, Alroy I, Klapper L, Lavi S, Seger R, Ratzkin BJ, Sela M, Yarden Y. Diversification of Neu differentiation factor and epidermal growth factor signaling by combinatorial receptor interactions. The EMBO J.1996; 15(10): Amler LC. HER3 mrna as a predictive biomarker in anticancer therapy. Exp. Opin. Biol. Ther. 2010;10(9):
79 Hernes E, Fossá SD, Berner A, Otnes B and Nesland JM: Expression of the epidermal growth factor receptor family in prostate carcinoma before and during androgen-independence. Br. J. Cancer. 2004;90: Bartlett JM, Brawley D, Grigor K, Munro AF, Dunne B and Edwards J: Type I receptor tyrosine kinases are associated with hormone escape in prostate cancer. J Pathol. 2005;205: Liu HL, Gandour-Edwards R, Lara PN Jr, de Vere White R and LaSalle JM: Detection of low level HER-2/neu gene amplification in prostate cancer by fluorescence in situ hybridization. Cancer J. 2001;7: Carles J, Lloreta J, Salido M, Font A, Suarez M, Baena V, Nogue M, Domenech M and Fabregat X: Her-2/neu expression in prostate cancer: a dynamic process? Clin Cancer Res. 2004;10: Martín de Las Mulas J, Ordás J, Millán Y, Fernández-Soria V, Cajal SR. Oncogene HER-2 in canine mammary gland carcinomas: an immunohistochemical and chromogenic in situ hybridization study. Breast Cancer Res Treat. 2003;80: Gama A, Alves A, Schmitt F. Identification of molecular phenotypes in canine mammary carcinomas with clinical implications: application of the human classification. Virchows Arch. 2008;453: Higgins RJ, Dickinson PJ, Lecouteur RA, Bollen AW, Wang H. Spontaneous canine gliomas: overexpression of EGFR, PDGFRalpha and IGFBP2 demonstrated by tissue microarray immunophenotyping. J Neurooncol. 2010;98: Shiomitsu K, Johnson CL, Malarkey DE, Pruitt AF, Thrall DE. Expression of epidermal growth factor receptor and vascular endothelial growth factor in malignant canine epithelial nasal tumors. Vet Comp Oncol. 2009;7: Sabattini, S., Mancini, F. R., Marconato, L., Bacci, B., Rossi, F., Vignoli, M., & Bettini, G. EGFR overexpression in canine primary lung cancer: pathogenetic implications and impact on survival.vet. comparative oncology. 2014;12(3): Terragni R, Gardini AC, Sabattini S, Bettini G, Amadori D, Talamonti C, Vignoli M, Capelli L, Saunders JH, Ricci M, Ulivi P. EGFR, HER-2 and KRAS in Canine Gastric Epithelial Tumors: A Potential Human Model? PLoS ONE 2014;9(1):e doi: /journal.pone Hsu WL, Huang HM, Liao JW, Wong ML, Chang SC. Increased survival in dogs with malignant mammary tumours overexpressing HER-2 protein and detection of a silent single nucleotide polymorphism in the canine HER-2 gene. Vet J. 2009;180(1): Ressel L, Puleio R, Loria GR, Vannozzi I, Millanta F. HER-2 expression in canine morphologically normal, hyperplastic and neoplastic mammary tissues and its correlation with the clinical outcome. Res Vet Sci. 2013;94: Lai CL, Van Den Ham R, Van Leenders G, Van Der Lugt J, Mol JA, Teske E. Histopathological and immunohistochemical characterization of canine prostate cancer. Prostate. 2008;68(5): Rubin MA, Dunn R, Strawderman M, Pienta K J. Tissue microarray sampling strategy for prostate cancer biomarker analysis. Am. J. surg. Pathol. 2002;26(3): Bilous M, Dowsett M, Hanna W, Isola J, Lebeau A, Moreno A, Penault-Llorca F, Rüschoff J, Tomasic G and van de Vijver M: Current perspectives on HER2 testing: a review of national testing guidelines. Mod Pathol. 2003;16: Singer J, Weichselbaumer M, Stockner T, Mechtcheriakova D, Sobanov Y, Bajna E, Wrba F, Horvat R, Thalhammer JG, Willmann M, Jensen-Jarolim E. Comparative oncology: ErbB-1 and ErbB- 2 homologues in canine cancer are susceptible to cetuximab and trastuzumab targeting. Molecular Immunology. 2012;50: Lehmann U, Kreipe H. Real-time PCR analysis of DNA and RNA extracted from formalin-fixed and paraffin-embedded biopsies. Methods. 2001;25(4):
80 Scorsato AP, Telles JEQ. Factors that affect the quality of DNA extracted from biological samples stored in paraffin blocks. J. Bras. Patol. Med. Lab. 2011;47(5): Simonato LE, Garcia JF, Nunes CM, Miyahara GI.Evaluation of two methods of DNA extraction from paraffin-embedded material for PCR amplification. J. Bras. Patol. Med. Lab. 2007;43(2): Ribeiro-Silva A, Garcia SB. Comparative study of three different procedures for RNA extraction from formalin-fixed paraffin-embedded samples. J. Bras. Patol. Med. Lab. 2008;44(2): Peraldo-Neia C, Migliardi G, Mello-Grand M, Montemurro F, Segir R, Pignochino Y, Aglietta M. Epidermal Growth Factor Receptor (EGFR) mutation analysis, gene expression profiling and EGFR protein expression in primary prostate cancer.bmc cancer. 2011;11(1), 31, doi: / Gama A, Gärtner F, Alves A, Schmitt F. Immunohistochemical expression of Epidermal Growth Factor Receptor (EGFR) in canine mammary tissues.res. Vet. Sci. 2009;87(3), Schlomm T, Steuber T, Haese A, Isbarn H, Erbersdobler A, Simon R,. Graefen M, Sauter G, Huland, H. Epidermal growth factor receptor family members (EGFR and HER2) are prognostic markers and potential therapeutic targets in prostate cancer. Eur. Urol. Sup. 2006;5(2): Di Palma S, Skalova A, Vanieek T, Simpson RHW, Starek I, Leivo I. Non invasive (intracapsular) carcinoma ex pleomorphic adenoma: recognition of focal carcinoma by HER 2/neu and MIB1 immunohistochemistry. Histopathology, 2005;46(2): Matsubayashi S,Yoshihara T. Carcinoma ex pleomorphic a denoma of the salivary gland: an immunohistochemical study. Eur Arch Otorhinolaryngol. 2007;264: Bertagnolli AC, Ferreira E, Dias EJ, Cassali GD. Canine mammary mixed tumours: immunohistochemical expressions of EGFR and HER 2. Australian vet J. 2011;89(8): Charalambous H, Doran E, Roberts E, Mathers M, Pedley I, Roberts T. Role of Epidermal Growth Factor Receptor (EGFR) and HER2-neu Receptor Expression in Predicting Biochemical Failure after Radical Radiotherapy for Prostate Cancer. Inter. J. Radiation Oncology Biol. Physics. 2010;78(3):S661.
81 Eis porque, interpretando os cromossomas à guisa de caracteres em que a mente inscreve, nos corpúsculos celulares que a servem, as disposições e os significados dos seus próprios destinos, caracteres que sãoconstituídos pelos genes, como as linhas são formadas de pontos. André Luiz (Francisco Cândido Xavier e Waldo Vieira) Evolução em dois mundos (1959)
82 60 CAPÍTULO 3 - Cell cycle inhibitors expression in canine prostate with prostatic inflammatory atrophy and carcinoma ABSTRACT Gene expression of CDKN1A, CDKN1B, and TP53, and immunostaining of p21, p27 and p53 were evaluated to verify the role of these cell cycle inhibitors in canine prostates with proliferative inflammatory atrophy (PIA) and prostatic carcinoma (PC). From 70 prostatic samples obtained, 15 were considered normal, 30 had PIA and 25 PC. Regarding the number of p27 and p53 labeled cells, difference between normal and PIA and PC was observed, as well as between PIA and PC for p53. Immunostaining intensities of p21, p27 and p53 were different when comparing normal tissues to PIA and PC. Sixteen cdna samples of canine prostatic FFPE tissue were subjected to RT-PCR and RT-qPCR, four considered normal tissue, three diagnosed as PIA, and nine as PC. CDKN1A mrna was detected in four PC cases by RT-PCR, and it was overexpressed when compared to normal by RT-qPCR, in one PIA and six PC samples. CDKN1B mrna was detected in three PC cases by RT-PCR and it was overexpressed in three PC and decreased in one PC case. TP53 mrna, detected in all canine prostates with PIA and PC, was also overexpressed in one gland with PIA and three with PC. It was conclude that when overexpressed in canine prostate with premalignant and malignant lesions, p21 and p27 play role controlling cell proliferation, most likely working as a protective factor in the evolution of PIA to PC, and in the PC development, even in the presence of altered p53. Thus, the next step would be verifying these cell cycle proteins in canine PC with metastasis. Key words: p21, p27, p53, PIA, RT-qPCR.
83 61 Expressão de inibidores do ciclo celular na próstata canina com atrofia inflamatória proliferativa e carcinoma RESUMO A expressão gênica de CDKN1A, CDKN1B e TP53, e imunoexpressão de p21, p27 e p53 foram avaliados, a fim de verificar o papel desses inibidores do ciclo celular na próstata canina com atrofia inflamatória proliferativa (PIA) e carcinoma prostático (PC).Foram obtidos um total de 70 amostras de próstata canina, sendo 15 de tecido normal, 30 de PIA e 25 de PC. Quanto ao número de células imunomarcadas foi observado diferença entre normal, PIA e PC para p27 e p53, também para p53 houve diferença entre PIA e PC. Para a intensidade de imunomarcação houve diferença entre os tecidos normais e com PIA e PC para p21, p27 e p53. Foram obtidas dezesseis amostras de cdna a partir de tecido FFPE de próstata canina para realização da RT-PCR e RT-qPCR, sendo quatro tecidos normais, três com PIA, e nove com o PC. O gene CDKN1A foi detectado em quatro das PC por RT-PCR, e pela RT-qPCR este estava super expresso em uma PIA e em seis PC quando comparado com o tecido prostático normal. O CDKN1B foi detectado em três PC por RT-PCR e pela RT-qPCR estava super expresso em três PC e reduzido em um PC. O TP53 foi detectado em todas as próstatas caninas com PIA e PC por RT-PCR, sendo também superexpresso em uma glândula com PIA e em três com PC. Concluiu-se que p21 e p27 quando superexpressas na próstata canina com lesões pré-malignas e malignasdesmpenham ação no controle da proliferaçãocelular,possivelmenteatuando como fator de proteção na evolução da PIA para PC, e no desenvolvimento do PC, mesmo na presença de p53 alterada. Assim, o próximo passo seria avaliar essas proteínas do ciclo celular em casos de PC canino com metástase. Palavra chave: p21, p27, p53, PIA, RT-qPCR.
84 62 INTRODUCTION The canine prostate has similarities with the human gland regarding occurrence of benign and malignant diseases as benign prostatic hyperplasia (BPH) and prostatic carcinoma (PC) 1,2. Proliferative inflammatory atrophy (PIA) is also a human prostate lesion with premalignant potential and involvement in carcinogenesis of PC 3,4. In dogs, Rodrigues et al. 5 have mentioned PIA in canine prostate and Toledo et al. 6 described its histological aspects. The proliferation of eukaryotic cells is controlled at specific points in the cell cycle, particularly at G1-S and G2-M transitions, and regulated by interaction of cyclins and cyclin-dependent kinases (Cdk) and their inhibitors (CdkI`s). The major step in malignant transformation in tumors is the loss of cell cycle control. Knowing how regulators work is a key step to understand malignant transformations that occur in tumor types Cyclin-dependent kinase inhibitor 1A (CDKN1A) gene encodes the p21 protein, which has been implicated in mechanisms of cell-cycle arrest from G1-S phase through different steps that allow cell DNA repair or apoptosis Those tasks are performed by cyclin A/cyclin dependent kinase 2 (Cdk2) and cyclin D/Cdk4 complexes 13. Increased expression of CDKN1A is not necessarily linked to cell growth blocking, since p21 protein may have dual a function, inhibiting cyclin/cdk activity and also acting as positive modulator of cyclin/cdk complex formation 12. Furthermore, studies have revealed decreased expression of p21 associated with poor prognostic in human tumors, including gastric, colorectal, prostatic, and endometrial carcinomas The p27 protein is encoded by cyclin-dependent kinase inhibitor 1B (CDKN1B) gene. This protein has been implicated in cell-cycle blocking mechanisms in S phase. It is regulated by extracellular stimuli, like transforming growth factor beta (TGF-β) Yang et al. 20 and De Marzo et al. 21 observed decreased expression of p27 in lesions such as BPH, PIN and PC, contributing to the high rate of mitosis in these proliferative lesions. Also, Fredersdorf et al. 22 and Tan et al. 23 refer that the loss of p27 protein is a negative prognostic factor for human breast cancer. An important protein controlling the cell cycle is p53, well known as the "guardian" of the genome. If an error in DNA transcription occurs, p53 stops cell cycle and promote repair mechanisms or triggers apoptotic events leading to cell death. The p53 protein stimulates p21, which has regulatory functions and blocks the cell cycle progression 24,25. In normal cells, wild-type p53 has a short half-life and does not accumulate in the tissue at detectable levels. Mutations or deletions of TP53 gene may lead to altered production of p53 protein, which fails to perform its function and accumulates in the nucleus, when is possible
85 63 to be detected it by immunohistochemistry 19,24. The p53 immunostaining in canine prostate has been reported as increased in PIA and PC 26, but its role in canine prostatic tissue with proliferative lesions is not yet clear. Thus, in order to further understand the molecular mechanisms of cell cycle blocking in canine premalignant and malignant prostatic tissue, CDKN1A, CDKN1B, and TP53 mrna expression and immunostaining of p21, p27 and p53 were evaluated in canine prostate with PIA and PC. MATERIAL AND METHODS The samples were derived from the necropsied animal s on pathology service of the School of Veterinary Medicine and Animal Science of the Federal University of Goiás (UFG), Goiânia, Goiás, Brazil, registered from 2008 to The research was approved by committee on publication ethics COPE/UFG number 353/2010.Three-µm-sections were obtained from formalin-fixed-paraffin-embedded (FFPE) tissue blocks and stained with hematoxylin and eosin (HE) for microscopic examination. Histomorphological evaluation was used to identify normal, PIA 6 and PC 27 prostates. All prostatic samples were obtained from with pure or mixed-breed adult dogs and normal prostatic tissues were harvested from dogs with no lesions in the gland. Prostate tissue microarray (TMA) was carried out according to criteria described by Rubinet al. 28. From the previous defined areas in histomorphological evaluation, tissue cores with a dimension of 1.0 mm were taken from FFPE tissue samples and arrayed on a recipient paraffin block, in duplicate, using the tissue microarray (Beencher Instruments, Silver Spring, USA). Three-µm-sections were obtained from recipient block and distended on charged slides (Starfrost White, Sakura Adhesion microscope slide with Cut Edges, ready to use, Germany, Dako #9545-1) for HE staining and immunohistochemistry. Immunohistochemistry was performed in TMA slides, in duplicate, which were deparaffinized, rehydratated and washed in distilled water. Endogenous peroxidase and nonspecific protein were blocked with 3% hydrogen peroxide incubation for 20min, protein block (Leica, Newcastle, UK, #RE7102) incubation for 5min at 37 C. Antigen retrieval for p21, p27 and p53 was performed with 10 mm pre-heated citrate buffer, ph 6.0, for 3min, in a pressure cooker (Solar, Rapid Express, Tramontina, Brazil). Mouse monoclonal anti-human p21 WAF1/Cip1 clone SX118 (Dako, Carpinteria, CA, USA, #M7202), monoclonal mouse anti- Human p27 Kip1 clone SX53G8 (Dako Carpinteria, CA, USA, #M7203), and monoclonal mouse p53 clone 5G176 (Santa Cruz Biotechnology, CA, USA, #sc-71785) were diluted at 1:50, 1:200, and 1:500 respectively and incubated overnight, at 4 C in wet chamber. A
86 64 polymer kit (NovoLink Max Polymer, UK, #RE7260-K) was used to incubate sections with polymer enzyme, chromogen and HRP substrate for signal detection. Sections were counterstained with Mayer's hematoxylin, washed, dehydrated, cleared, cover slipped, and examined by light microscopy. Sample from human colon carcinoma were used as positive control for p21 and p27, and human mammary carcinoma for p53. For negative control, primary antibody was replaced by ph 7.4 PBS buffer. The intensity of p21, p27, and p53 reactivity was scored as: 0=negative, 1=mild, 2=moderate, and 3=intense. The number of stained cells to p21, p27, and p53 was scored as: 0=negative, 1=1-25%, 2=26-50%, 3=51-75% and 4=76-100%. Before working with RNA, the microtome, the entire lab bench, pipettors, and sectioning equipment were cleaned with an RNase decontamination solution (Ambion RNaseZap Solution, Life Technologies, CA, USA, #AM9780). Also, RNase-free pipette tips were used. The analysis were performed in duplicate using 20 sections with 12 μm from each paraffin block, which were placed into 1.5 ml sterilized polypropylene microtubes. The tubes were kept at -20 C until deparaffinization, digestion and RNA extraction. The RecoverAll Total Nucleic Acid Isolation Kit (Life technologies, CA, USA, #AM1975) was used to extract total nucleic acids (RNA and DNA) from all FFPE tissues sample that were used in the TMA. Twelve-μm-sections were deparaffinized using xylene and ethanol washes followed by protein digestion with protease K, incubation in water bath for 16h at 50 C, and 15min at 80 C. Next, RNA isolation and purification samples were treated with DNase mix for 30min followed by washing and finishing with the elution. The solution containing the nucleic acid (RNA) was stored at -20 C until proceeding the cdna synthesis using High Capacity RNA-to-cDNA Kit (Applied Biosystems : CA, USA, # ). After purification of RNA, the yield and quality was measure by NanoVue Plus Spectrophotometer (GE Healthcare, UK AC). The yield was estimated by UV absorbance at 260 nm and quality for rate between A260/A280, using samples higher than Likewise, confirmed by 1% agarose gel electrophoresis on PowerPac TM Basic Power Supply (Bio-Rad, CA, USA, # ) and the images of gels were obtained by Gel Doc TM EZ System (Bio-Rad, CA, USA, # ). The High Capacity RNA-to-cDNA Kit (Applied Biosystems : CA, USA, # ) was used for reverse transcription (RT) of total RNA to single-stranded cdna using a reaction size of 20 µl. All the RT reaction was prepared on ice and in duplicate. In a 0.6 ml micro centrifuge tube was added 10 µl of 2 RT buffer, 1.0 µl of 20 RT enzyme mix, 2 µg of each sample, and nuclease-free water until complete 20 µl. This solution was
87 65 incubated at Thermal Cycler T100 TM (Bio Rad, CA, USA, # ) at 37 C for 60min, followed by 95 C for 5min, and storage at -20 C until proceeding the RT-PCR reaction. The polymerase chain reaction (PCR) was performed in duplicate for cdna amplification of p21 (GenBank: AJ ) - Canis l. familiaris cyclin-dependent kinase inhibitor 1A (CDKN1A) locus chromosome 12; p27(genbank: NM ) - C. l. familiaris cyclin-dependent kinase inhibitor 1B (CDKN1B) locus chromosome 27; p53 (GenBank: NM_ ) - C. l. familiaris tumor protein p53 (TP53) locus chromosome 5; and β-actin, (canine housekeeping gene - GenBank: AF ) - C. l. familiaris actin, gamma 1 (ACTG1) locus chromosome 9. These genes amplify fragments with 88 pb, 124 pb, 118 pb, 151 pb, respectively. In each PCR microtube, we inserted 100 ng of DNA; 1x of 10X PCR buffer (200 mm Tris-HCl ph 8.4, 500 Mm KCl); 2.5 mm of Magnesium Chloride (MgCl 2-50 mm); 0.2 mm of 2 - deoxynucleoside 5`- triphosphate (100 mm dntp set, PCR grade - datp, dctp, dgtp, dttp - Invitrogen by life Technologies TM CA, USA, # ); 0.4 mm of each oligonucleotides primer [p21 Forward (Fw): ACCTCTCAGGGCCGAAAAC, reverse (Rev): TAGGGCTTCCTCTTGGAGAA; p27 Fw: CAGAGGACACACACTTGGTAGA Rev: TCTTTTGTTTTGAGGAGAGGAA; p53, Fw: CGCAAAAGAAGAAGCCACTA, Rev: TCCACTCTGGGCATCCTT; β-actin, Fw: TGGAATCATGCGGTATC Rev: GGCTGTGATTTCCTTCT] 1U of Thermus aquaticus (Taq) DNA polymerase recombinant (Invitrogen CA, USA, # ) and Diethylpyrocarbonate (DEPC) treated water until complete 25 µl of solution. Followed conditions at Thermal Cycler T100 TM (Bio Rad CA, USA, # ): 95ºC for 5min; 95ºC for 1min; 58ºC for 30s; 72ºC for 1min and 72ºC for 5min; repeated 50 times. Electrophoresis in 1% Ultra Pure TM agarose gel (Invitrogen CA, USA,# ) with 0.5 µg/ml of Ultra Pure TM 10mg/ml ethidium bromide (EtBr, Invitrogen CA, USA, # ) was performed in duplicate by 1h of running in 80 V on PowerPac TM Basic Power Supply (Bio-Rad, CA, USA, # ) with Gene Ruler 1Kb Plus DNA Ladder (Thermo scientific, CA, USA, #SM1331). The RT-PCR-amplified products were visualized in a Gel Doc TM EZ System (Bio-Rad, CA, USA, # ). The CDKN1A, CDKN1B and TP53 primers were obtained from Klopfleisch and Gruber 29, and β-actin primers were obtained from Primer Quest Advanced tool ( The oligonucleotides were synthesized by Eurofins MWG Operon, and diluted with nuclease free water at concentration according to manufacturer s directions. The cdna samples underwent real-time quantitative reverse-transcription polymerase chain reaction (RT-qPCR) to evaluate CDKN1A, CDKN1B and TP53 gene
88 66 expression. β-actin reference canine gene was used as positive control. The reactions and data analyses were performed in iq5 real-time PCR system (Bio-Rad, CA, USA, # ). The 20 µl total reactions were carried out in a 96-well polypropylene plates (iq TM - 96 well PCR plates, Bio-Rad, CA, USA, # ) containing 10 µl of MAXIMA SYBR-green Fluorescein qpcr Master mix 2x (Thermo Scientific, Fermentas, CA, USA, #K0241), 500 nm of each primer (forward and reverse are the same used at RT-PCR), 100 ng of synthesized cdna template, and nuclease free water. All plates were covered with optical sealing tape (Microseal Adhesive seals Bio-Rad, CA, USA, #MSB-1001). RT-qPCR cycling conditions were 10min at 95ºC, followed by 40 cycles of 30s at 95ºC, 1min at 58ºC, and 30s at 72ºC. The plates contained triplicates of each cdna sample and β-actin gene as internal reference to normalize the amount of total cdna. Specificity of amplified products was confirmed by melting curve analyses. The expression level of the genes was calculated from the threshold cycle according to the 2 -ΔΔCT method by Livak and Schmittgen 30 in iq5 real-time PCR software (Bio-Rad, CA, USA, # ). The Chi-square, Kruskal-Wallis, and descriptive data were used to compare the scores of percentage of positive cells and their intensity. For all data we used SPSS (IBM Corp. Released IBM SPSS Statistics for Windows, Version Armonk, NY: IBM Corp.) and R (R Development Core Team (2008) R Foundation for Statistical Computing, Vienna, Austria). All values were considered with 5% of significance level. RESULTS From the TMA slide, 15 (21.43%) samples of normal tissue, 30 (42.86%) with PIA and 25 (35.71%) with PC were obtained and scored according to the number of stained cells and immunostaining intensity of p21, p27 and p53 (Table 1). The nuclear immunostainingfor p21, p27, and p53 is shown in Figure 1. The number of p21 stained cells in normal prostatic tissue was neither different from those with PIA and PC, nor between PIA and PC. Immunostaining intensity was different between normal prostatic tissue and PIA and normal compared to PC, but not between PIA and PC. The number of p27 stained cells and immunostaining intensity was different between normal prostatic tissue and PIA and between normal and PC, but not between PIA and PC. The number of p53 stained cells was different between normal prostatic tissue and PIA and PC, as well as between prostates with PIA and PC. According to Immunostaining intensity of p53 was difference between normal prostatic tissue and PIA and PC, but not between PIA and PC (p< 0.05) (Table 2).
89 TABLE 1 Number of cases sorted by scores applied to variable number of labeled cells and intensity of labeling to p21, p27, and p53 antibodies in canine normal prostatic tissue and with PIA and PC. Number of Labeled Cells Scores (%) Intensity of Labeling Cells (%) Diagnoses Antibodies 0 (0%) 1 (1-25%) 2 (26-50%) 3 (51-75%) 4 (76-100%) 0 Negative 1 (mild) 2 (moderate) 3 (intense) p % (7) 0% 26.67% (4) 20% (3) 6.67% (1) 46.67% (7) 53.33% (8) 0% 0% Normal N=15 p % (7) 6.67% (1) 33.33% (5) 13.33% (2) 0% 46.67% (7) 53.33% (8) 0% 0% p % (11) 20% (3) 6.67% (1) 0% 0% 73.33% (11) 26.67% (4) 0% 0% p % (4) 6.67% (2) 13.33% (4) 40% (12) 26.67% (8) 13.33% (4) 56.67% (17) 23.33% (7) 6.67% (2) PIA N=30 p % (4) 6.67% (2) 23.33% (7) 43.33% (13) 13.33% (4) 13.33% (4) 36.67% (11) 40% (12) 6.67% (2) p % (2) 0% 70% (21) 10% (3) 13.33% (4) 6.67% (2) 83.33% (25) 10% (3) 0% p21 24% (6) 8% (2) 8% (2) 12% (3) 48% (12) 24% (6) 24% (6) 12% (3) 40% (10) Carcinoma N=25 p27 16% (4) 0% 24% (6) 20% (5) 40% (10) 16% (4) 24% (6) 20% (5) 40% (10) p53 4% (1) 4% (1) 24% (6) 8% (2) 60% (15) 4% (1) 60% (15) 28% (7) 8% (2)
90 FIGURE 1 - Immunohistochemistry photomicrography on nuclear immunostaining(arrow). A) Canine PC tissue with score three for labeling intensity and four for number of labeled cells for p X. B) Human colon carcinoma; p21 positive control with score two for labeling intensity and four for number of labeled cells.400x. C) Canine PIA tissue with score three for labeling intensity and four for number of labeled cells for p x. D) Human colon carcinoma; p27 positive control with score three for labeling intensity and four for number of labeled cells. 400X E) Canine PC tissue with score three for labeling intensity and four for number of labeled cells for p X. F) Human mammary carcinoma; p53 positive control with score three for labeling intensity and three for number of labeled cells. 200X. IHC, DAB with H&E counterstain. 68
91 69 TABLE2 -Comparison between p21, p27, and p53 immunostaining regarding number of stained cells and intensity of staining in canine normal prostatic tissue, PIA and PC. Diagnoses N Rank of Number of Stained Cells Rank of Staining Intensity p21 p27 p53 p21 p27 p53 Normal a 34.4 a 16.9 a 33.9 a 31.6 a 23.0 a PIA a 60.1 b 54.6 b 55.8 b 60.4 b 55.7 b Carcinoma a 67.4 b 75.2 c 64.3 b 68.6 b 68.2 b Similar letters in the same column are not different by non parametric multiple comparison test for paired contrasts the relative effects with Tukey correction. (p value =<0.05). Sixteen cdna samples of canine prostatic tissue were obtained to perform RT- PCR, being 4 (25%) normal tissue, 3 (18.75%) with PIA, and 9 (56.25%) with PC. CDKN1A mrna was detected in four of nine PC (4/9 - PC6, PC7, PC8, PC9) and CDKN1B mrna in three of nine PC (3/9 PC7, PC8, PC9). TP53 gene expression was detected in all PIA and PC samples, but not in normal prostatic tissue (Figure 2). FIGURE 2 Images from agarose gels showing the amplification products of ACTG1 (β-actin), CDKN1A, CDKN1B and TP53 genes from canine prostatic tissue. (A) RT-PCR for β- actin expression (positive control). (B) RT-PCR for CDKN1A. Prostatic samples PC6, PC7, PC8, PC9 and MC amplified. (C) RT-PCR for CDKN1B. Prostatic samples PC7, PC8, PC9 and MC amplified. (D) RT-PCR for TP53. Prostatic samples PIA1, PIA2, PIA3, PC1, PC2, PC3, PC4, PC5, PC6, PC7, PC8, PC9 and MC amplified. MW = Molecular weight (Gene Ruler 1Kb Plus DNA Ladder - Thermo scientific, CA, USA, #SM1331); MC= canine mammary carcinoma (CDKN1A, CDKN1B and TP53 positive control); N=Normal tissue; PIA= Canine proliferative inflammatory atrophy; PC= Canine prostatic carcinoma.
92 70 The expression of CDKN1A, CDKN1B and TP53 in canine normal prostate, with PIA and PC was determined by RT-qPCR and fold change (FC) normalized with β-actin expression from the same dog and with normal gland with T melt 84.8ºC. The CDKN1A was overexpressed in seven of sixteen tissues investigated (PIA1, PC1, PC3, PC4, PC7, PC8 and PC9) with FC>1.6 when compared to normal gland N1 to N4 and T melt 76.9ºC. The CDKN1B was overexpressed in three of nine PC tumors (PC7, PC8, PC9) with FC>1.6, and it was under expressed in one of nine PC (PC2) based on FC<0.4 and T melt 80.5ºC. Regarding TP53, overexpression was present in five of sixteen prostatic samples (PIA1, PC4, PC6, PC8, PC9) with FC>1.6, and decreased expression was observed in two of sixteen prostatic tissues (PIA2, PC2) based on FC<0.4 and T melt 78.8ºC (Figure 3). FIGURE 3 Fold expression levels of CDKN1A, CDKN1B and TP53 in canine normal, PIA and PC normalized by β-actin. Values>1.6 were considered overexpression and values<0.4 were considered decrease of gene expression. A commercial kit for extraction enabled us to obtain DNA and RNA from FFPE canine prostate tissue with good enough quality and quantity to perform the RT-PCR test successfully. Isolating nucleic acids from tissues in sufficient amount, purity and integrity is an essential step in the practice of molecular biology. The quantity, purity and integrity of nucleic acid extracted depend on time of pre-fixation, and time and temperature used in FFPE process 31,32. Thus, extracting RNA with good quality and quantity is a feasible and valuable tool in diagnostic routine and retrospective studies 33,34.
93 71 Comparison of results referring to p21, p27 and p53 immunostaining by IHC and CDKN1A, CDKN1B and TP53 detection by RT-PCR and expression by RT-qPCR are described in Table 3. TABLE 3 Comparison between p21, p27, and p53 immunostaining regarding number of stained cells and intensity of staining in canine normal prostatic tissue, PIA and PC Samples IHC RT-PCR RT-qPCR p21 p27 p53 CDKN1A CDKN1B TP53 CDKN1A CDKN1B TP53 N R R R N R R R N3 2/1 2/ R R R N / R R R PIA1 4/3 2/1 4/ O R O PIA2 2/2 2/1 1/ R R D PIA3 0 2/1 2/ R R R PC1 4/3 4/3 2/ O R R PC R D D PC3 4/3 4/3 2/ O R R PC4 4/3 4/3 4/ O R O PC5 2/1 3/2 2/ R R R PC6 3/2 3/2 4/ R R O PC7 4/3 4/3 3/ O O R PC8 4/3 4/3 3/ O O O PC9 4/3 4/3 4/ O O O MC 4/3 4/3 4/ R R R MC=canine mammary carcinoma; N=canine normal prostatic tissue; PIA=canine proliferative inflammatory atrophy; PC=canine prostatic carcinoma; N/N= score of number of stained cells/ score of intensity of staining; R=regular expression; D=decreased expression; and O=overexpression DISCUSSION It was observed in this study that p21 immunostaining protein was overexpressed in 40% of PC and 6.7% of PIA, and in normal tissue the expression was weak in 53.3% and absent in 46.7%. Protein p21 play an important function in the cell cycle and its increased expression may mean a crucial step in the cell growth blocking, inducing senescence or apoptosis, a mechanism which seems to protect against malignant transformation Thus, loss of p21 expression has been associated with shorter survival in human with PC 16. Also, according to Matsushima et al. 39, immunostaining of p21 was more likely to be expressed in well-differentiated areas. Also, there was difference between normal prostatic tissue with PIA and PC regarding intensity of immunostaining, and there was no difference between groups
94 72 considering the number of stained cells. In this context, our results suggest that p21 could work as a protective factor in canine PC progression, since in human PC p21 overexpression is associated with good prognosis 16. Furthermore, even considering the possibility that canine PC shows high aggressively when present 2,40, this tumor is not as common in canine prostate as compared to the human prostate. It seems that canine PC has longer time development, which could be linked to action of inhibitors as p21 and p27 during canine PC progression. This hypothesis was mentioned before in canine prostate, but referring proteins from other regulatory pathways as GSTP1 26. Also, it seems that immunostaining intensity of p21 in canine prostate tumors should be considered. Klopfleisch and Gruber 29 reported p21 overexpression in canine malignant mammary tumors, but concluded that its increase alone did not avoid metastasis and an explanation for that would be a loss of p21 function by missense mutations. On the other hand, Wang et al. 16 add that overexpression of p21 in human prostate may be associated with poor prognostic due to CDKN1A instability, or its function may be altered indirectly by TGFβ 41, PTEN deficiency 36, and TP53 mutated Since p21 may play a double function, acting as tumoral suppressor or oncogene 12 depending on tumor type, and considering our results, it seems that p21 could be involved in controlling cell proliferation in canine prostate with proliferative lesions as observed in human breast cancer 45. Taken together, the results from this research concerning p21 and p27 inhibitors indicate that positive relation for their overexpression in canine proliferative prostatic tissue could work by controlling cell proliferation. Similar to p21, p27 protein is an important cell proliferation inhibitor 46,47, once increased levels of p27 result in cell cycle blocking in the S phase 19, The p27 expression may be lost or decreased in human PC 20,52-55, a feature associated with tumor cell undifferentiation, proliferation and poor prognostic 48,51,56,57. In contrast to p21, p27overexpression is mostly related to better prognosis, acting as a tumoral suppressor 58. However, it seems important to evaluate these cell cycle inhibitors together, since there are studies showing association of malignant progression and the presence of negative relation between p21 (overexpressed) and p27 (underexpressed) expression in canine mammary tumor 29, as well as malignant progression and positive relation between p21 (underexpressed) and p27 (underexpressed) expression in human tumors 59. In contrast, in canine prostate with premalignant and malignant lesions the positive relation for p21 and p27 overexpression would be related to a good prognosis. Another important protein in cell cycle control is the product of TP53 gene, the p53 protein 24,25. In this study, the number of stained cells for p53 was significantly higher in
95 73 canine prostates with PC than with PIA. TP53 mrna was detected by RT-PCR in all prostates with PIA and PC, but TP53 overexpression by RT-qPCR was present in a higher number of prostates with PC than with PIA. According to Quian et al. 60, Tsujimoto et al. 61, and Stangelberger et al. 44, in human prostates with PIN and PC, the increased expression of p53 has been associated ith high proliferative index and more aggressive phenotype. Since accumulations of p53 in the presence of TP53 gene mutation are usual, our results indicate that alterations related to p53 protein may start in canine prostates with PIA and later accentuates in canine glands with PC, emphasizing its malignant potential as described before in dogs 26 and humans 60,61. This hypothesis is also supported by the fact that inflammatory microenvironment in PIA promotes changes in TP53 gene, as mentioned by Wang et al. 4 and Tsujimoto et al. 61. Furthermore, according to Wang et al. 4,p53 accumulations occur in the presence of a TP53 gene mutation, especially in tissues with chronic inflammation, such as cholangiohepatitis, gastritis and colitis. Tsujimoto et al. 61 also detected TP53 overexpression in human post-atrophic hyperplasia. Taken together, our results have showed that is important evaluate different cell pathways in order to better understand the carcinogenis and tumoral development steps in different types of tissue and species, since one lesion in the organism may evolute by different mechanisms with similar biological results 26. Based on that, it seems that in canine premalignant and malignant prostate the overexpression of p21 and p27 plays controlling cell proliferation and lesion progression even with the evidence of alterations involving p53. CONCLUSIONS It was concluded that when overexpressed in canine premalignant and malignant prostate, p21 and p27 possible play role controlling cell proliferation, most likely working as a protective factor in the evolution of PIA to PC, and in the PC development, even in the presence of altered p53.thus, the next step would be verifying these cell cycle proteins in canine prostate with PC and metastasis. REFERENCES 1. Winter SF, Cooper AB, Greenberg NM. Models of metastatic prostate cancer: A transgenic perspective. Prostate cancer prostatic diseases. 2003;6(3): Leroy BE, Northrup N. Prostate cancer in dogs: Comparative and clinical aspects Vet J. 2009;180(2): De Marzo AM, Platz EA, Epstein JI, Ali T, Billis A, Chan TY, Cheng L, Datta M, Egevad L, Ertoy-Baydar D, Farre X, Fine SW, Iczkowski KA, Ittmann M, Knudsen BS, Loda M, Lopez-Beltran
96 74 A, Magi-Galluzzi C, Mikuz G, Montironi R, Pikarsky E, Pizov G, Rubin MA, Samaratunga H, Sebo T, Sesterhenn IA, Shah RB, Signoretti S, Simko J, Thomas G, Troncoso P, Tsuzuki TT, Van Leenders GJ, Yang XJ, Zhou M, Figg WD, Hoque A, Lucia MS. A working group classification of focal prostate atrophy lesions. Am. J. Surgi. Pathol. 2006;30(10): Wang W, Bergh A, Damber JE. Morphological Transition of Proliferative inflammatory atrophy to high grade intraepithelial neoplasia and cancer in human prostate. Prostate. 2009;69(13): Rodrigues MMP, Di Santis GW, De Moura VMBD, Amorim RL.COX-2 and TGF- β expression in proliferative disorders of canine prostate. Braz. J. Vet Pathol. 2010;3: Toledo DC, Faleiro MBR, Rodrigues MMP, Di Santis GW, Amorim RL, De Moura VMBD.Histomorphological characterization of proliferative inflammatory atrophy in canine prostate. Ciênc. Rural. 2010;40: Lodish H, Berk A, Zipursky SL, Matsudaira P, Baltimore D, Darnell J. Biologia cellular e molecular. 4ed. Rio de Janeiro: REVINTER, p. 8. Sherr CJ, McCormick F. The RB and p53 pathways in cancer. Cancer Cell. 2002;2: Almeida VL, Leitão A, Reina LCB, Montanari CA, Donnici CL. Câncer e agentes antineoplásicos ciclo-celular específicos e ciclo-celular não específicos que interagem com o DNA: uma introdução. Quimica Nova. 2005;28(1): Sanchez I, Dynlacht BD. New insights into cyclins, CDKs, and cell cycle control. Semin. Cell Dev. Biol. 2005;16: Sherr CJ, Roberts JM. Inhibitors of mammalian G1 cyclin-dependent kinases. Genes Dev. 1995;9(10): Dotto GP. p21waf1/cip1: more than a break to the cell cycle? [minireview]. Biochim. Biophys. Acta. 2000;1471:M43-M Gartel AL; Radhakrishnan SK. Lost in transcription: p21 repression, mechanisms, and consequences. Cancer Res. 2005;65: Li X, Hui A-M, Shi Y-Z, Takyama T, Makuuchi M. Reduced p21waf1/cip1 expression is an early event in gallbladder carcinogenesis and is of prognostic significance for patients with carcinomas of the gallbladder. Hum. Pathol. 2001;32: Liu XP, Kawauchi S, Oga A, Suehiro Y, Tsushimi K, Tsushimi M, Sasaki K. Combined examination of p27kip1, p21waf1/cip1 and p53 expression allows precise estimation of prognosis in patients with gastric carcinoma. Histopathol. 2001;39: Wang Z, Lee HJ, Chai Y, Hu H, Wang L, Zhang YC, Jiang C, Lü J. Persistent P21Cip1 Induction Mediates G1 Cell Cycle Arrest by MethylseleninicAcid in DU145 Prostate Cancer Cells. Curr. Cancer Drug Targets. 2010;10(3): Sherr CJ, Roberts JM. CDK inhibitors: positive and negative regulators of G1-phase progression. Genes Dev. 1999;13: Sgambato A, Cittadini A, Faragila B, Weinstein IB,Multiple functions of p27kip1 and its alterataions in tumor cells: A review. J Cell Physiol. 2000;183: Fernandez PL, Thomson TM. Alterations of Genes and Their Expression in Prostate Carcinoma. In: HAYAT, M.A. Handbook of Immunohistochemistry and in situ Hybridization of Human Carcinomas. Molecular Pathology, Colorectal Carcinoma and Prostate Carcinoma. 1. ed. New York: Elsevier Academic Press, Cap. 3, v. 2, p Yang RM, Naitoh J, Murphy M, Wang HJ, Phillipson J, Dekernion JB, Loda M, Reiter RE. Low p27 expression predicts poor disease-free survival in patients with prostate cancer. J. Urology. 1998;159(3):
97 De MarzoAM, Meeker AK, Epstein JI, Coffey DS. Prostate stem cell compartments: Expression of the cell cycle inhibitor p27kip 1 in normal, hyperplastic, and neoplastic cells. Am. J. Pathol. 1998;153: Fredersdorf S, Burns J, Milne AM, Packham G, Fallis L, Gillett CE, Royds JA, Peston D, Hall PA, Hanby AM, Barnes DM, Shousha S, O Hare MJ, Lu X.. High level expression of p27(kip1) and cyclin D1 in some human breast cancer cells: inverse correlation between the expression of p27(kip1) and degree of malignancy in human breast and colorectal cancers. Proce. Nat. Aca. Sci. 1997;94: Tan P, Cady B, Wanner M, Worland P, Cukor B, Magi-Galluzzi C, Lavin P, Draetta G, Pagano M, Loda M. The cell cycle inhibitor p27 is an independent prognostic marker in small (T1a, b) invasive breast carcinomas. Cancer Res. 1997;57: Schmitt F.C. Marcadores prognósticos em carcinomas mamários. In: ALVES, V.A.F. Manual de imunoistoquímica, São Paulo:Sociedade Brasileira de Patologia, 1999, p Kirkness EF, Bafna V, Halpern AL, Levy S, Remington K, Rusch DB, Delcher AL, Pop M, Wang W, Fraser CM, Venter JC. The dog genome: survey sequencing and comparative analysis. Sci. 2003;301: Croce GB, Rodrigues MMP, Faleiro MBR, De Moura VMBD, Laufer-Amorim R.Óxido nítrico, GSTP-1 e p53: qual o papel desses biomarcadores nas lesões prostáticas do cão? Arq. Bras.Med. Vet Zoot. 2011;63(6): Lai CL, Van Den Ham R, Van Leenders G, Van Der Lugt J, Mol JA, Teske E. Histopathological and immunohistochemical characterization of canine prostate cancer. Prostate. 2008;68(5): Rubin MA, Dunn R, Strawderman M, Pienta K J. Tissue microarray sampling strategy for prostate cancer biomarker analysis. Am. J. surg. Pathol. 2002;26(3): Klopfleisch R, Gruber AD. Differential expression of cell cycle regulators p21, p27 and p53 in metastasizing canine mammary adenocarcinomas versus normal mammary glands. Res. Vet Sci. 2009;87: Livak KJ, Schmittgen TD. Analysis of Relative Gene Expression Data Using Real-Time Quantitative PCR and the 2 ΔΔCT Method. Methods. 2001;25(4): Simonato LE, Garcia JF, Nunes CM, Miyahara GI.Evaluation of two methods of DNA extraction from paraffin-embedded material for PCR amplification. J. Bras. Patol. Med. Lab. 2007;43(2): Ribeiro-Silva A, Garcia S.B. Comparative study of three different procedures for RNA extraction from formalin-fixed paraffin-embedded samples. J. Bras. Patol. Med. Lab. 2008;44(2): Scorsato AP, Telles JEQ. Factors that affect the quality of DNA extracted from biological samples stored in paraffin blocks. J. Bras. Patol. Med. Lab. 2011;47(5): Ribeiro-Silva A, Garcia SB. Comparative study of three different procedures for RNA extraction from formalin-fixed paraffin-embedded samples. J. Bras. Patol. Med. Lab. 2008;44(2): Inoue M, Wu H, Une S. Immunohistochemical detection of p27 and p21 proteins in canine hair follicle and epidermal neoplasms. J. Vet Med. Sci.2006;68(8): Lin PY, Fosmire SP, Park SH, Park JY, Baksh S, Modiano JF, Weiss RH. Attenuation of PTEN increases p21 stability and cytosolic localization in kidney cancer cells: a potential mechanism of apoptosis resistance. Mol. Cancer. 2007;6(72):16 doi: / Majid S, Kikuno N, Nelles J, Noonan E, Tanaka Y, Kawamoto K, Hirata H, Li LC, Zhao H, Okino ST, Place RF, Pookot D, Dahiya R. Genistein Induces the p21waf1/cip1 and p16ink4a Tumor Suppressor Genes in Prostate Cancer Cells by Epigenetic Mechanisms Involving Active Chromatin Modification. Cancer Res. 2008;68(8):
98 Inoue S, Hao Z, Elia AJ, Cescon D, Zhou L, Silvester J, Snow B, Harris IS, Sasaki M, Li WY, Itsumi M, Yamamoto K, Ueda T, Dominguez-Brauer C, Gorrini C, Chio LC, Haight J, You-Ten A, Mccracken S, Wakeham A, Ghazarian D, Penn LJZ, Melino G, Mak TW.Mule/Huwe1/Arf-BP1 suppresses Ras-driven tumorigenesis by preventing c-myc/miz1-mediated down-regulation of p21 and p15. Genes Dev. 2013;27: Matsushima H, Sasaki T, Goto T, Hosaka Y, Homma Y, Kitamura T, Kawabe K, Sakamoto A, Murakami T, Machinami R. Immunohistochemical study of p21waf1 and p53 protein in prostate cancer and their prognostic significance. Hum. Pathol. 1998;29: Cornell KK, Bostwick DG, Cooley DM, Hall G, Harvey HJ, Hendrick MJ, Pauli BU, Render JA, Stoica G, Sweet DC, Waters DJ. Clinical and pathologic aspects of spontaneous canine prostate carcinoma: a retrospective analysis of 76 cases. Prostate. 2000;45(1): Datto MB, Yu Y, Wang XF. Functional analysis of the transforming growth factor h responsive elements in the WAF1/Cip1/p21 promoter. J. Biol. Chem. 1995;270(48): Hu YX, Watanabe H, Ohtsubo K, Yamaguchi Y, Ha A, Motoo Y, Okai T, Sawabu N. Infrequent expression of p21 is related to altered p53 protein in pancreatic carcinoma. Clin Cancer Res 1998;4(5): Vikhanskaya F, Lee MK, Mazzoletti M, Broggini M, Sabapathy K. Cancer-derived p53 mutants suppress p53 target gene expression: Potential mechanism for gain of function of mutant p53. Nucleic Acids Res. 2007;35(6) Stangelberger A, Schally AV, Rick FG, Varga JL, Baker B, Zarandi M, Halmos G. Inhibitory Effects of Antagonists of Growth Hormone Releasing Hormone on Experimental Prostate Cancers Are Associated With Upregulation of Wild-Type p53 anddecrease in p21andmutant p53 Proteins. Prostate. 2012;72(5): Knappskog S, Chrisanthar R, Staalesen V, Borresen-Dale AL, Gram IT, Lillehaug JR, Lonning PE. Mutations and polymorphisms of the p21b transcript in breast cancer. Int. J. Cancer 2007;121: Shaffer DR, Viale A, Ishiwata R, Leversha M, Olgac S, Manova K, Satagopan J, Scher H, Koff A: Evidence for a p27 tumor suppressive function independent of its role regulating cell proliferation in the prostate. Proc Natl Acad Sci USA 2005, 102(1): Hu L, Ibrahim S, Liu C, Skaar J, Pagano M, Karpatkin S: Thrombin induces tumor cell cycle activation and spontaneous growth by down-regulation of p27kip1, in association with the upregulation of Skp2 and MiR-222. Cancer Res 2009, 69(8): Chu IM, Hengst L, Slingerland JM. The Cdk inhibitor p27 in human cancer: prognostic potential and relevance to anticancer therapy. Nature Rev. Cancer. 2008;8(4): Klopfleisch R, Schutze M, Gruber AD. Loss of p27 expression in canine mammary tumors and their metastases. Res. Vet Sci. 2010;88(2): Rico-Bautista E, Yang CC, Lu L, Roth GP, Wolf DA. Chemical genetics approach to restoring p27kip1 reveals novel compounds with antiproliferative activity in prostate cancer cells. BMC Biol. 2010;8(1): Wang H, Xu Y, Fang Z, Chen S, Balk SP, Yuan X.Doxycycline Regulated Induction of AKT in Murine Prostate Drives Proliferation Independently of p27 Cyclin Dependent Kinase Inhibitor Downregulation. PLoS ONE, 2012;7(7):e Guo Y, Sklar GN, Borkowski A, Kyprianou N. Loss of the cyclin-dependent kinase inhibitor p27kip1 protein in human prostate cancer correlates with tumor grade. Clin. Cancer Res. 1997;3: Cordon-Cardo C, Koff A, Drobnjak M, Capodieci P, Osman I, Millard SS, Gaudin PB, Fazzari M, Zhang ZF, Massague J, Scher HI. Distinct altered patterns of p27 KIP1 gene expression in benign prostatic hyperplasia and prostatic carcinoma. J. Natl Cancer Inst. 1998;90(17):
99 Tsihlias J, Kapusta LR, Deboer G, Morava-Protzner I, Zbieranowski I, Bhattacharya N, Catzavelos GC, Klotz LH, Slingerland JM. Loss of cyclin-dependent kinase inhibitor p27 Kip1 is a novel prognostic factor in localized human prostate adenocarcinoma. Cancer Res. 1998;58(3): Halvorsen OJ, Haukaas SA, Akslen LA. Combined Loss of PTEN and p27 Expression Is Associated with Tumor Cell Proliferation by Ki-67 and Increased Risk of Recurrent Disease in Localized Prostate Cancer. Clin. Cancer Res. 2003;9(4): Alkarain A, Slingerland J. Deregulation of p27 by oncogenic signaling and its prognostic significance in breast cancer. Breast Cancer Res. 2004;6 (1): Taylor W, Mathias A, Ali A, Ke H, Stoynev N, Shilkaitis A, Green A, Kiyokawa H, Christov K.p27Kip1 deficiency promotes prostate carcinogenesis but does not affect the efficacy of retinoids in suppressing the neoplastic process. BMC Cancer, 2010;10(1): Yong F, Yihong W, Yulei W, Yan M, Junlan Z, Honglei J, Chuanshu H. A new tumor suppression mechanism by p27kip1: EGFR down-regulation mediated by JNK/c-Jun pathway inhibition. Biochemical J. 2014; Immediate Publication, doi: /bj Abukhdeir AM, Park BH. P21 and p27: roles in carcinogenesis and drug resistance. Expert rev. molecular medi. 2008;10:e Qian J, Hirasawa K, Bostwick DG, Bergstralh EJ, Slezak JM, Anderl KL, Borell TJ, Lieber MM, Jenkins RB. Loss of p53 and c-myc Overrepresentation in Stage T2-3N1-3M0 Prostate Cancer are Potential Markers for Cancer Progression. Mod. Pathol. 2002;15(1): Tsujimoto Y, Takayama H, Nonomura N, Okuyama A, Aozasa K. Postatrophic hyperplasia of the prostate in Japan: Histologic and immunohistochemical features and p53 gene mutation analysis. Prostate. 2002;52:
100 Lembremo-nos de que o homem interior se renova sempre. A luta enriquece-o de experiência, a dor aprimora-lhe as emoções e o sacrifício tempera-lhe o caráter. O espírito encarnado sofre constantes transformações por fora, a fim de acrisolar-se e engrandecer-se por dentro. André Luiz (Francisco Cândido Xavier e Waldo Vieira) Evolução em dois mundos (1959)
101 79 CAPÍTULO 4 - Immunoexpression of cell cycle regulators in canine prostate with proliferative lesions ABSTRACT In this study immunostaining of p21, p27, p53, cyclin D1, c-myc was evaluated in normal canine prostate and with proliferative disorders to verify the interaction between these regulators of cell cycle progression. From 106 samples of canine prostate obtained from a TMA block, 15 were considered normal, 16 diagnosed as benign prostatic hyperplasia (BPH), 30 as proliferative inflammatory atrophy (PIA), 20 as prostatic intraepithelial neoplasia (PIN), and 25 as prostatic carcinoma (PC). Difference in immunostaining of p21, p27, cyclin D1 and p53 in acinar epithelium in relation to the prostate condition was observed. There was positive correlation between p21 and p27 for number of stained cells and staining intensity in all conditions and between c-myc and p53 in prostates with PIN. Considering the number of labeled cells, there was positive correlation between p21 and p53 in the normal prostate. Also, regarding the intensity of staining, there was positive correlation between p21 and p53 in prostate tissue with PIN and between p27 and c-myc in prostates with PIA. Negative correlation between c-myc and cyclin D1 was also found in the glands with PIN, considering the number of labeled cells, and between p27 and c-myc in the prostates with PC for staining intensity. In conclusion, the expression of p21, p27, p53, cyclin D1 and c-myc varies according to type of proliferative lesion in canine prostate. Together, the results of this study suggest low growth potential for canine PC in the presence of p21 and p27 overexpression, cyclin D1seeming underexpression and regular expression of c-myc, also with the p53 mutant type presence. Further, considering the similar immunophenotype presented by glands with PIA, PIN and PC regarding these regulators of cell cycle progression, it is possible reaffirm the premalignant potential of PIA and PIN in canine prostate. Key words: c-myc, cyclin D1,benign prostatic hyperplasia, proliferative inflammatory atrophy, prostatic intraepithelial neoplasia, prostatic carcinoma.
102 80 Imunoexpressão de reguladores do ciclo celular em próstatas caninas com alterações proliferativas RESUMO Neste estudo a imunomarcação de p21, p27, p53, ciclina D1 e c-myc foi avaliada na próstata canina normal e com desordens proliferativas para verificar quanto a interação desses reguladores na progressão do ciclo celular. Um total de 106 amostras de próstata canina foi obtido a partir de um bloco de TMA, sendo 15 normais, 16 hiperplasia prostática benigna (HPB), 30 atrofia inflamatória proliferativa (PIA), 20 neoplasia intra-epitelial prostática (PIN), e 25 carcinoma prostático (PC). Foi encontrada diferença na imunomarcação de p21, p27, ciclina D1 e p53 no epitélio acinar em relação aos diagnósticos. Houve correlação positiva entre p21 e p27 para as variáveis número de células marcadas e intensidade de imunomarcação em todos os diagnósticos (normal, HPB, PIA, PIN e PC), e entre c-myc e p53 nas próstatas com PIN. De acordo com o número de células marcadas, houve correlação positiva entre p21 e p53 na próstata normal. De acordo com a intensidade de imunomarcação houve correlação positiva entre p21 e p53 no tecido prostático com PIN e entre p27 e c-myc em próstatas com PIA. Foi observado também correlação negativa entre c-myc e ciclina D1 nas glândulas com PIN, considerando o número de células marcadas, e entre p27 e c-myc na próstata com PC, para a variável intensidade de imunomarcação. Conclui-se quea expressão de p21, p27, p53, ciclina D1 e c-myc variam na próstata canina de acordo com o tipo de lesão proliferativa. Em conjunto, os resultados deste estudo sugerem baixo potencial de crescimento dos carcinomas da próstata canina quando há superexpressão de p21 e de p27, aparente subexpressão ciclina D1 e expressão normal de c-myc, mesmo na presença de p53 tipo mutante. Ainda, considerando o imunofenótipo semelhante nas glândulas com PIA, PIN e PC no que se refere aos reguladores da progressão do ciclo celular, reitera-se o potencial prémaligno da PIA e PIN na próstata canina. Palavra chave:c-myc, ciclina D, hiperplasia prostática benigna, atrofia inflamatória proliferativa, neoplasia intraepitelial prostática, carcinoma prostático.
103 81 INTRODUCTION According to Brazilian National Institute of cancer (INCA) 1, prostate cancer (PC) is one of the largest cancer incidents among men in Brazil. There are estimated new cases of PC in Brazil in 2014 year, these means new cases per human. Due to similarities in natural occurrence and hormonal influence in development of benign prostatic hyperplasia (BPH) and prostatic carcinoma (PC) between canine and human, canine prostate have been studied as prostate carcinogenesis model 2-4. Furthermore, dysplastic lesions of human prostate, such as prostatic intraepithelial neoplastic (PIN) and proliferative inflammatory atrophy (PIA), are considered premalignant, because they show morphological similarities to cancer and PIA commonly contain somatic mutations that are present in PIN and PC 3,5. The proliferation of cells is controlled at specific points in the cell cycle, particularly at the G1-S and the G2-M transitions, with the evolvement of cyclins and cyclindependent kinases (Cdk) and their inhibitors (CdkI`s). The major step in malignant transformation in tumors is the uncontrolled cell cycle. Knowing the regulators is important to understanding malignant transformations that occurred in tumor types 6-9. One of the important proteins that control the cell cycle is the p53 protein, known as guardianof genome, because if an error occurs in DNA transcription, it will stop the cell cycle and action repair mechanisms or trigger apoptotic events, to death the cell. It occur by stimulating p21 that has regulatory functions and blocks the cell cycle progression from G1-S phase through different steps 10,11. Those protein p21 allow cell DNA repair, differentiation and apoptosis 12,13. These tasks are performed by the interaction with cyclin A-cyclin dependent kinase 2 (Cdk2), and cyclin D1-Cdk4 complexes 14. A reduction or a total absence of p21 has been shown in tumors cell lines lacking p53 or containing a non-functional mutant form of TP Cyclin D1 (CD1) is positive regulator of G1 phase progression in the cell cycle, binds to and activates the cyclin-dependent kinases Cdk4 and Cdk6, regulate phosphorylation of the retinoblastoma gene (Rb) product, thereby activating E2F transcription factors 16,17. Also the CD1 protein is down-regulated by c-myc factor 18,19. In dogs, CD1 protein is also overexpressed in mammary carcinoma, squamous cell carcinoma and basal cell carcinoma 20-22, but not in cutaneous mast cell tumors 23. Another important cell cycle inhibitor it is p27 protein, that increasing levels result in blocking cell cycle in S phase 12,24,25. Yang et al. 26 and De Marzo et al. 27 observed lower expression of p27 in lesions such as BPH, PIN and PC, concluding that this contributes
104 82 to the high rate of mitosis in these proliferative lesions. Also, Fredersdorf et al. 28 and Tan et al. 29 infer that loss of p27 protein is a negative prognostic factor for human breast cancer. The c-myc has been suggested as a key element of carcinogenesis in different tumor type, with direct and indirect participation in a regulation of cell cycle and apoptosis Expression of c-myc has been found in many types of canine neoplasm, as transmissible venereal tumors (TVT) 33, eyelid tumors 32, osteosarcomas 34, mammary tumors 35 and canine prostate 36. In canine prostate the expression of c-myc protein is elevated in tissues with PIA and PC and has been associated with loss of the tumor suppressor proteins NKX3.1 and E- cadherin 36. In order to verify the interaction between the regulators of cell cycle progression in canine prostate with proliferative lesions, p21, p27, p53, ciclina D1 and c- mycimmunostaining was evaluated in normal glands and with BPH, PIA, PIN and PC. MATERIAL AND METHODS The samples were derived from the necropsied animal s on pathology service of the School of Veterinary Medicine and Animal Science of the Federal University of Goiás (UFG), Goiania, Brazil recorded from 2008 to The research was approved by committee on publication ethics COPE/UFG number 353/2010. Three-µm-sections were obtained from formalin-fixed-paraffin-embedded (FFPE) tissue blocks and stained with hematoxylin and eosin (HE) for microscopic examination. Histomorphological evaluation included normal prostates and with BPH 37, PIA 38, PIN 39, and PC 40. All prostatic samples were from adult dogs with pure or mixed breeds and normal prostatic tissues were from dogs with no lesions in the gland. The prostate tissue microarray (TMA) was carried out according to criteria described by Rubin et al. 41. From the previous defined areas in histomorphological evaluation, tissue cores with a dimension of 1.0 mm were taken from FFPE tissue samples and arrayed on a recipient paraffin block using the tissue microarray (Beencher Instruments, Silver Spring, USA). Three-µm-sections were obtained from recipient block and distended on charged slides (Starfrost White, Sakura Adhesion microscope slide with Cut Edges, ready to use, Germany - Dako ) for HE staining and immunohistochemistry. Immunohistochemistry was performed in duplicate, in TMA slides, which were deparaffinized, rehydratated and washed in distilled water. Endogenous peroxidase and nonspecific protein were blocked with 3% hydrogen peroxide incubation for 20min, protein block (Leica, Newcastle, UK, #RE7102) incubation for 5min at 37 C. For mouse monoclonal antihuman p21 WAF1/Cip1 clone SX118 (Dako, Carpinteria, CA, USA, #M7202), monoclonal mouse
105 83 anti-human p27 Kip1 clone SX53G8 (Dako Carpinteria, CA, USA, #M7203), monoclonal mouse p53 clone 5G176 (Santa Cruz Biotechnology, CA, USA, #sc-71785), monoclonal mouse cyclin D1 clone A12 (Santa Cruz Biotechnology, Ca, USA, #sc-8396) and anti-human C-MYC Ab-2 clone 9E10.3 (Thermo Fisher Scientific, Neomarkes, #MS-139-P0).Antigen retrieval was performed with 10 mm pre-heated citrate buffer, ph 6.0, for 3min, in pressure cooker (Solar, Rapid Express, Tramontina, Brazil). The antibory was diluted at 1:50, 1:200, 1:500, 1:50, 1:50 respectively and incubated overnight, at 4 C, in wet chamber. Incubation with polymer enzyme, chromogen and HRP substrate for signal detection were done using reagents from polymer kit (New Link Max Polymer, United Kingdom, #RE7260-K) and following manufacturer s directions. Sections were counterstained with Mayer's hematoxylin, washed, dehydrated, cleared, covers lipped, and examined by light microscopy. Sample from human colon carcinoma for p21 and p27, human mammary carcinoma for p53, and canine lymph node to cyclin D1 and c-myc were used as positive control. For negative control the primary antibody was replaced by PBS buffer, ph 7.4. The intensity of p21, p27, p53, cyclin D1 and c-myc reactivity was scored as: 0=negative, 1=mild, 2=moderate and 3=intense. Regarding the number of stained cells, the scores were: 0=negative, 1=1-25%, 2=26-50%, 3=51-75% and 4=76-100%. The Chi-square, Kruskal-Wallis, nonparametric multiple comparison test for paired contrasts the relative effects with Tukey correction, as well as descriptive data were used to compare the scores of percentage of positive cells and their intensity. Association between p21, p27, p53, cyclin D1and c-myc expression in normal prostatic tissue and with the different lesions studied was achieved by Spearman test. For all it was used SPSS (IBM Corp. Released IBM SPSS Statistics for Windows, Version Armonk, NY: IBM Corp.) and R (R Development Core Team (2008) R Foundation for Statistical Computing, Vienna, Austria). All values were considered with 5% of significance level. RESULTS From TMA slide were obtained 15 (14.15%) were normal tissues, 16 (15.09%) BPH, 30 (28.3%) PIA, 20 (18.87%) PIN, and 25 (23.58%) PC (Table 1).The immunostaining was nuclear for p21, p27 and p53is shown in Figure 1, cytoplasmic for cyclin D1and nuclear through cytoplasmic and membrane for c-mycis shown in Figure 2.
106 84 A B C D E F G FIGURE 1 - Immunohistochemistry photomicrography on nuclear immunostaining(arrow). A) Canine PIN tissue with score three for labeling intensity and four for number of labeled cells for p x. B) Human colon carcinoma. Positive control for p21 with scores two for labeling intensity and four for number of labeled cells. 400x. C) Normal canine prostatic tissue with one for labeling intensity and one for number of labeled cells for p21 (400X) D) Canine PIN with score two for labeling intensity and two for number of labeled cells for p x. E) Human colon carcinoma. Positive control of p27 with score three for labeling intensity and four for number of labeled cells. 400X. F) Canine PIA with score three for labeling intensity and H
107 85 four for number of labeled cells for p X. G) Mammary carcinoma. Positive control of p53 with score three for labeling intensity and three for number of labeled cells. 200X. H)Normal canine prostatic tissue with 0- score for p-53 (400X). IHC, DAB, counterstained with H&E. A B C D E F FIGURE 2.Immunohistochemistry photomicrography on nuclearthrough cytoplasmic and membrane immunostaining.a) Canine PIN tissue with score one for labeling intensity and three for number of labeled cells of cytoplasmic cyclin D1 (arrow)(400x). B) Canine lymph node. Positive control of cytoplasmic cyclin D1 (arrow) with score two for labeling intensity and two for number of labeled cells.(400x) C) Normal canine prostatic tissue with 0- score for cyclin D1 (200X) D) Canine PC tissue with score three for labeling intensity and four for number of labeled cells for nuclear through cytoplasmic c-myc (arrow).(400x) E) Canine lymph node. Positive control of nuclear through cytoplasmic c-myc (arrow), with score two for labeling intensity and four for number of labeled cells.(200x) F) Normal canine prostatic tissue with scorethree for labeling intensity and four for number of labeled cells for c-myc(arrow). (200X). IHC 400x. DAB with H&E counterstain.
Caracterização histomorfológica da atrofia inflamatória proliferativa na próstata canina
 Ciência 1372 Rural, Santa Maria, v.40, n.6, p.1372-1377, jun, 2010 Toledo et al. ISSN 0103-8478 Caracterização histomorfológica da atrofia inflamatória proliferativa na próstata canina Histomorphological
Ciência 1372 Rural, Santa Maria, v.40, n.6, p.1372-1377, jun, 2010 Toledo et al. ISSN 0103-8478 Caracterização histomorfológica da atrofia inflamatória proliferativa na próstata canina Histomorphological
EXPRESSÃO DE MMP-2, MMP-9 E upar EM PRÓSTATAS CANINAS NORMAIS E COM LESÕES PROLIFERATIVAS
 UNIVERSIDADE FEDERAL DE GOIÁS ESCOLA DE VETERINÁRIA PROGRAMA DE PÓS-GRADUAÇÃO EM CIÊNCIA ANIMAL EXPRESSÃO DE MMP-2, MMP-9 E upar EM PRÓSTATAS CANINAS NORMAIS E COM LESÕES PROLIFERATIVAS Mariana Batista
UNIVERSIDADE FEDERAL DE GOIÁS ESCOLA DE VETERINÁRIA PROGRAMA DE PÓS-GRADUAÇÃO EM CIÊNCIA ANIMAL EXPRESSÃO DE MMP-2, MMP-9 E upar EM PRÓSTATAS CANINAS NORMAIS E COM LESÕES PROLIFERATIVAS Mariana Batista
Ciclo celular. Patricia Coltri
 Ciclo celular Patricia Coltri coltri@usp.br Nesta aula: Controle do ciclo celular Fatores que estimulam/inibem o ciclo celular Métodos para estudo do ciclo Ciclo celular Células se reproduzem com a duplicação
Ciclo celular Patricia Coltri coltri@usp.br Nesta aula: Controle do ciclo celular Fatores que estimulam/inibem o ciclo celular Métodos para estudo do ciclo Ciclo celular Células se reproduzem com a duplicação
Ciclo celular. Patricia Coltri
 Ciclo celular Patricia Coltri coltri@usp.br Nesta aula: Controle do ciclo celular Fatores que interferem no ciclo Métodos de estudo Ciclo celular e proliferação Eventos sequenciais coordenados: geração
Ciclo celular Patricia Coltri coltri@usp.br Nesta aula: Controle do ciclo celular Fatores que interferem no ciclo Métodos de estudo Ciclo celular e proliferação Eventos sequenciais coordenados: geração
AVALIAÇÃO DA IMUNOEXPRESSÃO DE PROTEÍNAS DA VIA DE SINALIZAÇÃO WNT CANÔNICA E NÃO CANÔNICA NO ADENOCARCINOMA GÁSTRICO
 AVALIAÇÃO DA IMUNOEXPRESSÃO DE PROTEÍNAS DA VIA DE SINALIZAÇÃO WNT CANÔNICA E NÃO CANÔNICA NO ADENOCARCINOMA GÁSTRICO PROGRAMA DE INICIAÇÃO CIENTÍFICA PIBIC DO IAMSPE ACADÊMICO: PEDRO AUGUSTO SOFFNER CARDOSO
AVALIAÇÃO DA IMUNOEXPRESSÃO DE PROTEÍNAS DA VIA DE SINALIZAÇÃO WNT CANÔNICA E NÃO CANÔNICA NO ADENOCARCINOMA GÁSTRICO PROGRAMA DE INICIAÇÃO CIENTÍFICA PIBIC DO IAMSPE ACADÊMICO: PEDRO AUGUSTO SOFFNER CARDOSO
Reparação. Regeneração Tecidual 30/06/2010. Controlada por fatores bioquímicos Liberada em resposta a lesão celular, necrose ou trauma mecânico
 UNIVERSIDADE FEDERAL DO PARANÁ COORDENAÇÃO DO CURSO DE MEDICINA VETERINÁRIA DISCIPLINA DE PATOLOGIA VETERINÁRIA Reparação Prof. Raimundo Tostes Reparação Regeneração: reposição de um grupo de células destruídas
UNIVERSIDADE FEDERAL DO PARANÁ COORDENAÇÃO DO CURSO DE MEDICINA VETERINÁRIA DISCIPLINA DE PATOLOGIA VETERINÁRIA Reparação Prof. Raimundo Tostes Reparação Regeneração: reposição de um grupo de células destruídas
Neoplasias. Benignas. Neoplasias. Malignas. Características macroscópicas e microscópicas permitem diferenciação.
 - Neoplasias- Neoplasias Benignas Neoplasias Malignas Características macroscópicas e microscópicas permitem diferenciação. Neoplasias Neoplasias Benignas PONTO DE VISTA CLÍNICO, EVOLUTIVO E DE COMPORTAMENTO
- Neoplasias- Neoplasias Benignas Neoplasias Malignas Características macroscópicas e microscópicas permitem diferenciação. Neoplasias Neoplasias Benignas PONTO DE VISTA CLÍNICO, EVOLUTIVO E DE COMPORTAMENTO
ONCOLOGIA. Aula I Profª.Enfª: Darlene Carvalho (www.darlenecarvalho.webnode.com.br)
 ONCOLOGIA Aula I Profª.Enfª: Darlene Carvalho (www.darlenecarvalho.webnode.com.br) CLASSIFICAÇÃO DAS CÉLULAS Lábeis Estáveis Perenes CLASSIFICAÇÃO DAS CÉLULAS Células lábeis: São aquelas em constante renovação
ONCOLOGIA Aula I Profª.Enfª: Darlene Carvalho (www.darlenecarvalho.webnode.com.br) CLASSIFICAÇÃO DAS CÉLULAS Lábeis Estáveis Perenes CLASSIFICAÇÃO DAS CÉLULAS Células lábeis: São aquelas em constante renovação
DIAGNÓSTICO DE TUMORES DE MAMA: PARTE II
 DIAGNÓSTICO DE TUMORES DE MAMA: PARTE II EXAME HISTOPATOLÓGICO O exame histopatológico de biópsias incisionais ou excisionais é o método de diagnóstico mais seguro. Além de facilitar a classificação da
DIAGNÓSTICO DE TUMORES DE MAMA: PARTE II EXAME HISTOPATOLÓGICO O exame histopatológico de biópsias incisionais ou excisionais é o método de diagnóstico mais seguro. Além de facilitar a classificação da
Microambiente tumoral. Cristiane C. Bandeira A. Nimir
 Microambiente tumoral Cristiane C. Bandeira A. Nimir cristiane@nimir.com.br PROGRESSÃO E AGRESSÃO TUMORAL CÉLULA NEOPLÁSICA: - Acúmulo de mutações CONTROLE DO CICLO CELULAR!! PROGRESSÃO E AGRESSÃO TUMORAL
Microambiente tumoral Cristiane C. Bandeira A. Nimir cristiane@nimir.com.br PROGRESSÃO E AGRESSÃO TUMORAL CÉLULA NEOPLÁSICA: - Acúmulo de mutações CONTROLE DO CICLO CELULAR!! PROGRESSÃO E AGRESSÃO TUMORAL
UNIVERSIDADE FEDERAL DE GOIÁS ESCOLA DE VETERINÁRIA E ZOOTECNIA PROGRAMA DE PÓS-GRADUAÇÃO EM CIÊNCIA ANIMAL
 UNIVERSIDADE FEDERAL DE GOIÁS ESCOLA DE VETERINÁRIA E ZOOTECNIA PROGRAMA DE PÓS-GRADUAÇÃO EM CIÊNCIA ANIMAL EXPRESSÃO DE FATOR DE CRESCIMENTO TRANSFORMADOR β E INIBIDORES TECIDUAIS DE METALOPROTEINASES
UNIVERSIDADE FEDERAL DE GOIÁS ESCOLA DE VETERINÁRIA E ZOOTECNIA PROGRAMA DE PÓS-GRADUAÇÃO EM CIÊNCIA ANIMAL EXPRESSÃO DE FATOR DE CRESCIMENTO TRANSFORMADOR β E INIBIDORES TECIDUAIS DE METALOPROTEINASES
UNIVERSIDADE ESTADUAL PAULISTA FACULDADE DE MEDICINA VETERINÁRIA E ZOOTECNIA DEPARTAMENTO DE CLÍNICA VETERINÁRIA
 UNIVERSIDADE ESTADUAL PAULISTA FACULDADE DE MEDICINA VETERINÁRIA E ZOOTECNIA DEPARTAMENTO DE CLÍNICA VETERINÁRIA IMUNOMARCAÇÃO DE COX-2 E TGF-β NAS LESÕES PROLIFERATIVAS DA PRÓSTATA DO CÃO MARCELA MARCONDES
UNIVERSIDADE ESTADUAL PAULISTA FACULDADE DE MEDICINA VETERINÁRIA E ZOOTECNIA DEPARTAMENTO DE CLÍNICA VETERINÁRIA IMUNOMARCAÇÃO DE COX-2 E TGF-β NAS LESÕES PROLIFERATIVAS DA PRÓSTATA DO CÃO MARCELA MARCONDES
CHRISTIANE TEIXEIRA CARTELLE. PROLIFERAÇÃO EPITELIAL GÁSTRICA EM CRIANÇAS INFECTADAS POR Helicobacter pylori
 CHRISTIANE TEIXEIRA CARTELLE PROLIFERAÇÃO EPITELIAL GÁSTRICA EM CRIANÇAS INFECTADAS POR Helicobacter pylori Dissertação apresentada ao Curso de Pós- Graduação em Patologia da Universidade Federal de Minas
CHRISTIANE TEIXEIRA CARTELLE PROLIFERAÇÃO EPITELIAL GÁSTRICA EM CRIANÇAS INFECTADAS POR Helicobacter pylori Dissertação apresentada ao Curso de Pós- Graduação em Patologia da Universidade Federal de Minas
A Genética do Câncer
 A Genética do Câncer 2 Câncer O câncer é considerado uma doença genética por ser desencadeado por uma série de alterações no DNA da célula Esporádico - alterações de origem somática resultantes da interação
A Genética do Câncer 2 Câncer O câncer é considerado uma doença genética por ser desencadeado por uma série de alterações no DNA da célula Esporádico - alterações de origem somática resultantes da interação
05/01/2016. Letícia Coutinho Lopes 1. Definição Fibroma Ossificante Epidemiologia Oncogênese
 Neoplasias Tópicos da Aula A. Neoplasia B. Carcinogênese C. Tipos de Neoplasia D. Características das Neoplasias E. Invasão e Metástase 2 Definição Fibroma Ossificante Epidemiologia Oncogênese A. Neoplasia
Neoplasias Tópicos da Aula A. Neoplasia B. Carcinogênese C. Tipos de Neoplasia D. Características das Neoplasias E. Invasão e Metástase 2 Definição Fibroma Ossificante Epidemiologia Oncogênese A. Neoplasia
Universidade Federal do Amazonas ICB Dep. Morfologia Disciplina: Biologia Celular Aulas Teóricas
 Universidade Federal do Amazonas ICB Dep. Morfologia Disciplina: Biologia Celular Aulas Teóricas Noções básicas da Mitose e Meiose Ciclo Celular Noções básicas da Mitose e Meiose Ciclo Celular Fase S e
Universidade Federal do Amazonas ICB Dep. Morfologia Disciplina: Biologia Celular Aulas Teóricas Noções básicas da Mitose e Meiose Ciclo Celular Noções básicas da Mitose e Meiose Ciclo Celular Fase S e
UNIVERSIDADE ESTADUAL PAULISTA FACULDADE DE MEDICINA VETERINÁRIA E ZOOTECNIA
 UNIVERSIDADE ESTADUAL PAULISTA FACULDADE DE MEDICINA VETERINÁRIA E ZOOTECNIA ÓXIDO NÍTRICO, GSTP-1 E P53: QUAL O PAPEL DESSES BIOMARCADORES E SUAS CORRELAÇÕES COM AS AFECÇÕES PROSTÁTICAS NO CÃO? GIULIANA
UNIVERSIDADE ESTADUAL PAULISTA FACULDADE DE MEDICINA VETERINÁRIA E ZOOTECNIA ÓXIDO NÍTRICO, GSTP-1 E P53: QUAL O PAPEL DESSES BIOMARCADORES E SUAS CORRELAÇÕES COM AS AFECÇÕES PROSTÁTICAS NO CÃO? GIULIANA
AULA 1: Introdução à Quimioterapia Antineoplásica
 FARMACOLOGIA DOS QUIMIOTERÁPICOS AULA 1: Introdução à Quimioterapia Antineoplásica Profª. MsC Daniele Cavalheiro Oliveira Zampar Farmacêutica Especialista em Oncologia - Sobrafo Campo Grande, 29/09/2012
FARMACOLOGIA DOS QUIMIOTERÁPICOS AULA 1: Introdução à Quimioterapia Antineoplásica Profª. MsC Daniele Cavalheiro Oliveira Zampar Farmacêutica Especialista em Oncologia - Sobrafo Campo Grande, 29/09/2012
Fases do ciclo celular O ciclo celular dos eucariotos está dividido em quatro fases separadas: M, G 1
 CICLO CELULAR A vida das células é formada por dois períodos: INTÉRFASE: inicia no fim da mitose e estende até iniciar a próxima mitose. MITOSE: Reprodução celular, com as seguintes finalidades: Nos unicelulares:
CICLO CELULAR A vida das células é formada por dois períodos: INTÉRFASE: inicia no fim da mitose e estende até iniciar a próxima mitose. MITOSE: Reprodução celular, com as seguintes finalidades: Nos unicelulares:
O CONTROLE DO CICLO CELULAR / PROLIFERAÇÃO EM CÂNCER: CONCEITOS E POTENCIAIS APLICAÇÕES TERAPÊUTICAS
 Universidade Federal do Rio Grande do Sul Laboratório de Sinalização e Plasticidade Celular O CONTROLE DO CICLO CELULAR / PROLIFERAÇÃO EM CÂNCER: CONCEITOS E POTENCIAIS APLICAÇÕES TERAPÊUTICAS Msc. Eduardo
Universidade Federal do Rio Grande do Sul Laboratório de Sinalização e Plasticidade Celular O CONTROLE DO CICLO CELULAR / PROLIFERAÇÃO EM CÂNCER: CONCEITOS E POTENCIAIS APLICAÇÕES TERAPÊUTICAS Msc. Eduardo
Núcleo celular. Responsável pela transmissão da hereditariedade e centro de comando das atividades celulares. Carioteca
 Núcleo celular Responsável pela transmissão da hereditariedade e centro de comando das atividades celulares Carioteca Dupla camada de lipídios, contendo poros (passagem de grandes moléculas) Cariolinfa
Núcleo celular Responsável pela transmissão da hereditariedade e centro de comando das atividades celulares Carioteca Dupla camada de lipídios, contendo poros (passagem de grandes moléculas) Cariolinfa
UNIVERSIDADE ESTADUAL DA BAHIA - UNEB DEPARTAMENTO DE CIÊNCIAS DA VIDA DCV CCS006 - BIOLOGIA CELULAR. Sinalização Celular SALVADOR - BA 2016
 UNIVERSIDADE ESTADUAL DA BAHIA - UNEB DEPARTAMENTO DE CIÊNCIAS DA VIDA DCV CCS006 - BIOLOGIA CELULAR Sinalização Celular PROFª POLYANNA CARÔZO DE OLIVEIRA SALVADOR - BA 2016 Introdução Evolução da multicelularidade
UNIVERSIDADE ESTADUAL DA BAHIA - UNEB DEPARTAMENTO DE CIÊNCIAS DA VIDA DCV CCS006 - BIOLOGIA CELULAR Sinalização Celular PROFª POLYANNA CARÔZO DE OLIVEIRA SALVADOR - BA 2016 Introdução Evolução da multicelularidade
Importância dos processos de sinalização. Moléculas sinalizadoras (proteínas, peptídeos, aminoácidos, hormônios, gases)
 Sinalização celular Importância dos processos de sinalização Seres unicelulares Seres multicelulares Moléculas sinalizadoras (proteínas, peptídeos, aminoácidos, hormônios, gases) Receptores Proteínas -
Sinalização celular Importância dos processos de sinalização Seres unicelulares Seres multicelulares Moléculas sinalizadoras (proteínas, peptídeos, aminoácidos, hormônios, gases) Receptores Proteínas -
LISTA DE EXERCÍCIOS 3º ANO
 A amostra 3 é a que apresenta maior temperatura de desnaturação, pois é a que possui maior proporção de G+C, o que significa dizer que é a amostra que possui maior números de ligação de hidrogênio (ponte
A amostra 3 é a que apresenta maior temperatura de desnaturação, pois é a que possui maior proporção de G+C, o que significa dizer que é a amostra que possui maior números de ligação de hidrogênio (ponte
Agentes físicos, químicos e biológicos podem induzir agressão ao. genoma e ocasionar alterações fenotípicas configurando uma
 .Carcinogênese: Agentes físicos, químicos e biológicos podem induzir agressão ao genoma e ocasionar alterações fenotípicas configurando uma neoplasia. O processo pelo qual se desenvolvem as neoplasias
.Carcinogênese: Agentes físicos, químicos e biológicos podem induzir agressão ao genoma e ocasionar alterações fenotípicas configurando uma neoplasia. O processo pelo qual se desenvolvem as neoplasias
Universidade Federal do Ceará Módulo em Cirurgia de Cabeça e Pescoço. Tumores das Glândulas Salivares. Ubiranei Oliveira Silva
 Universidade Federal do Ceará Módulo em Cirurgia de Cabeça e Pescoço Tumores das Glândulas Salivares Ubiranei Oliveira Silva 1. INTRODUÇÃO Glândulas salivares maiores / menores Embriologicamente: Tubuloacinares
Universidade Federal do Ceará Módulo em Cirurgia de Cabeça e Pescoço Tumores das Glândulas Salivares Ubiranei Oliveira Silva 1. INTRODUÇÃO Glândulas salivares maiores / menores Embriologicamente: Tubuloacinares
Biologia Professor Leandro Gurgel de Medeiros
 Biologia Professor Leandro Gurgel de Medeiros Divisão Celular Ciclo Celular e Mitose; Meiose. 1. Aspectos Mantidos na Divisão Celular Constância do volume celular; Relação área x volume. Lei de Driesch
Biologia Professor Leandro Gurgel de Medeiros Divisão Celular Ciclo Celular e Mitose; Meiose. 1. Aspectos Mantidos na Divisão Celular Constância do volume celular; Relação área x volume. Lei de Driesch
HISTOLOGIA. Tecido Epitelial
 HISTOLOGIA Tecido Epitelial Geralmente avascularizado Características Escassez de matriz extracelular Membrana basal: separa e prende o epitélio ao tecido conjuntivo Células justapostas com junções intercelulares
HISTOLOGIA Tecido Epitelial Geralmente avascularizado Características Escassez de matriz extracelular Membrana basal: separa e prende o epitélio ao tecido conjuntivo Células justapostas com junções intercelulares
Cada célula é programada para responder a combinações específicas de moléculas sinalizadoras
 Sinalização celular Cada célula é programada para responder a combinações específicas de moléculas sinalizadoras Etapas da Sinalização 1) Síntese e liberação da molécula sinalizadora pela célula sinalizadora
Sinalização celular Cada célula é programada para responder a combinações específicas de moléculas sinalizadoras Etapas da Sinalização 1) Síntese e liberação da molécula sinalizadora pela célula sinalizadora
UNIVERSIDADE ESTADUAL PAULISTA FACULDADE DE MEDICINA VETERINÁRIA E ZOOTECNIA
 UNIVERSIDADE ESTADUAL PAULISTA FACULDADE DE MEDICINA VETERINÁRIA E ZOOTECNIA PADRÃO HISTOPATOLÓGICO, PERFIL IMUNOISTOQUÍMICO E POTENCIAL PRÉ-MALIGNO DAS LESÕES DISPLÁSICAS DA PRÓSTATA CANINA GIOVANA WINGETER
UNIVERSIDADE ESTADUAL PAULISTA FACULDADE DE MEDICINA VETERINÁRIA E ZOOTECNIA PADRÃO HISTOPATOLÓGICO, PERFIL IMUNOISTOQUÍMICO E POTENCIAL PRÉ-MALIGNO DAS LESÕES DISPLÁSICAS DA PRÓSTATA CANINA GIOVANA WINGETER
Alterações do Crescimento Celular
 Alterações do Crescimento Celular Profa. Tópicos da Aula A. Adaptações do Crescimento e Diferenciação Celulares B. Alterações do Crescimento I C. Alterações do Crescimento II D. Alterações de Adaptação
Alterações do Crescimento Celular Profa. Tópicos da Aula A. Adaptações do Crescimento e Diferenciação Celulares B. Alterações do Crescimento I C. Alterações do Crescimento II D. Alterações de Adaptação
Patologia da mama. [Business Plan]
![Patologia da mama. [Business Plan] Patologia da mama. [Business Plan]](/thumbs/78/76999130.jpg) Patologia da mama [Business Plan] Maria João Martins Março 2014 Estudo macroscópico Tipos de abordagem diagnóstica/terapêutica Biópsias por agulha Por tumor Por microcalcificações Ressecção de galactóforos
Patologia da mama [Business Plan] Maria João Martins Março 2014 Estudo macroscópico Tipos de abordagem diagnóstica/terapêutica Biópsias por agulha Por tumor Por microcalcificações Ressecção de galactóforos
Responda às perguntas seguintes usando exclusivamente o glossário.
 Responda às perguntas seguintes usando exclusivamente o glossário. 1 - Um homem de 50 anos com queixas de fadiga muito acentuada fez um exame médico completo que incluiu RX do tórax. Identificaram-se lesões
Responda às perguntas seguintes usando exclusivamente o glossário. 1 - Um homem de 50 anos com queixas de fadiga muito acentuada fez um exame médico completo que incluiu RX do tórax. Identificaram-se lesões
UNIVERSIDADE DE CUIABÁ NÚCLEO DE DISCIPLINAS INTEGRADAS DISCIPLINA DE CIÊNCIAS MORFOFUNCIONAIS IV
 UNIVERSIDADE DE CUIABÁ NÚCLEO DE DISCIPLINAS INTEGRADAS DISCIPLINA DE CIÊNCIAS MORFOFUNCIONAIS IV NEOPLASIAS Definições O neoplasma é uma massa anormal de tecido, cujo crescimento é excessivo e não coordenado
UNIVERSIDADE DE CUIABÁ NÚCLEO DE DISCIPLINAS INTEGRADAS DISCIPLINA DE CIÊNCIAS MORFOFUNCIONAIS IV NEOPLASIAS Definições O neoplasma é uma massa anormal de tecido, cujo crescimento é excessivo e não coordenado
TRANSDUÇÃO DE SINAL E VIAS DE SINALIZAÇÃO
 TRANSDUÇÃO DE SINAL E VIAS DE SINALIZAÇÃO Raphael Bessa Parmigiani, PhD Centro de Oncologia Molecular Instituto Sírio-Libanes de Ensino e Pesquisa Curso de Introdução à Biologia Molecular Goiânia, Maio
TRANSDUÇÃO DE SINAL E VIAS DE SINALIZAÇÃO Raphael Bessa Parmigiani, PhD Centro de Oncologia Molecular Instituto Sírio-Libanes de Ensino e Pesquisa Curso de Introdução à Biologia Molecular Goiânia, Maio
FMRP - USP Biologia do Câncer RCB: Invasão e Metástase. Prof a : LETICIA FRÖHLICH ARCHANGELO Ribeirão Preto
 FMRP - USP Biologia do Câncer RCB: 0306 Invasão e Metástase Prof a : LETICIA FRÖHLICH ARCHANGELO Ribeirão Preto Tomografia por emissão de pósitrons e tomografia computadorizada (PET/CT) Metástase Metástase
FMRP - USP Biologia do Câncer RCB: 0306 Invasão e Metástase Prof a : LETICIA FRÖHLICH ARCHANGELO Ribeirão Preto Tomografia por emissão de pósitrons e tomografia computadorizada (PET/CT) Metástase Metástase
UNIVERSIDADE FEDERAL DE GOIÁS ESCOLA DE VETERINÁRIA E ZOOTECNIA PROGRAMA DE PÓS-GRADUAÇÃO EM CIÊNCIA ANIMAL
 UNIVERSIDADE FEDERAL DE GOIÁS ESCOLA DE VETERINÁRIA E ZOOTECNIA PROGRAMA DE PÓS-GRADUAÇÃO EM CIÊNCIA ANIMAL IMUNOMARCAÇÃO DOS RECEPTORES DE EGF (EGFR E c-erbb2) NO CARCINOMA DE CÉLULAS ESCAMOSAS EM CÃES
UNIVERSIDADE FEDERAL DE GOIÁS ESCOLA DE VETERINÁRIA E ZOOTECNIA PROGRAMA DE PÓS-GRADUAÇÃO EM CIÊNCIA ANIMAL IMUNOMARCAÇÃO DOS RECEPTORES DE EGF (EGFR E c-erbb2) NO CARCINOMA DE CÉLULAS ESCAMOSAS EM CÃES
BIOLOGIA MOLECULAR EM ENDOCRINOLOGIA
 BIOLOGIA MOLECULAR EM ENDOCRINOLOGIA Curso de Atualização em Endocrinologia 2013 Denise Pires de Carvalho Instituto de Biofísica Carlos Chagas Filho / UFRJ DNA Sequência de Nucleotídeos RNA Sequência de
BIOLOGIA MOLECULAR EM ENDOCRINOLOGIA Curso de Atualização em Endocrinologia 2013 Denise Pires de Carvalho Instituto de Biofísica Carlos Chagas Filho / UFRJ DNA Sequência de Nucleotídeos RNA Sequência de
WALTER ARTHUR SILVA VALENTE
 WALTER ARTHUR SILVA VALENTE ANÁLISE IMUNOISTOQUÍMICA DA EXPRESSÃO DE Ki-67, Bcl-2, EGF e CD57 NO ESPECTRO EVOLUTIVO DE GRANULOMAS E CISTOS PERIRRADICULARES 2016 i WALTER ARTHUR SILVA VALENTE ANÁLISE IMUNOISTOQUÍMICA
WALTER ARTHUR SILVA VALENTE ANÁLISE IMUNOISTOQUÍMICA DA EXPRESSÃO DE Ki-67, Bcl-2, EGF e CD57 NO ESPECTRO EVOLUTIVO DE GRANULOMAS E CISTOS PERIRRADICULARES 2016 i WALTER ARTHUR SILVA VALENTE ANÁLISE IMUNOISTOQUÍMICA
Caso do mês Abril/2016 -A. Shenia Lauanna O. Rezende Bringel Médica residente (R3) Departamento de Anatomia Patológica
 Caso do mês Abril/2016 -A Shenia Lauanna O. Rezende Bringel Médica residente (R3) Departamento de Anatomia Patológica História clínica Masculino, 64 anos, ex-tabagista, HIV-positivo e diabético insulino-dependente,
Caso do mês Abril/2016 -A Shenia Lauanna O. Rezende Bringel Médica residente (R3) Departamento de Anatomia Patológica História clínica Masculino, 64 anos, ex-tabagista, HIV-positivo e diabético insulino-dependente,
MicroRNAs: nova classe de reguladores gênicos envolvidos na função endócrina e câncer
 FACULDADE DE MEDICINA DE SÃO JOSÉ DO RIO PRETO Novas tecnologias de biologia molecular no câncer MicroRNAs: nova classe de reguladores gênicos envolvidos na função endócrina e câncer Filho J.C.M Ricarte,
FACULDADE DE MEDICINA DE SÃO JOSÉ DO RIO PRETO Novas tecnologias de biologia molecular no câncer MicroRNAs: nova classe de reguladores gênicos envolvidos na função endócrina e câncer Filho J.C.M Ricarte,
Sistema Reprodutor Masculino. Acadêmica de Veterinária Gabriela de Carvalho Jardim
 Sistema Reprodutor Masculino Acadêmica de Veterinária Gabriela de Carvalho Jardim Introdução Neste breve capítulo, será abordado o sistema reprodutor masculino do ponto de vista histológico, utilizando
Sistema Reprodutor Masculino Acadêmica de Veterinária Gabriela de Carvalho Jardim Introdução Neste breve capítulo, será abordado o sistema reprodutor masculino do ponto de vista histológico, utilizando
Reparo Tecidual: Regeneração e Cicatrização. Processos Patológicos Gerais Profa. Adriana Azevedo Prof. Archangelo P. Fernandes
 Reparo Tecidual: Regeneração e Cicatrização Processos Patológicos Gerais Profa. Adriana Azevedo Prof. Archangelo P. Fernandes Reparo Tecidual Ferida (lesão) 3 processos envolvidos no reparo: 1.Hemostasia
Reparo Tecidual: Regeneração e Cicatrização Processos Patológicos Gerais Profa. Adriana Azevedo Prof. Archangelo P. Fernandes Reparo Tecidual Ferida (lesão) 3 processos envolvidos no reparo: 1.Hemostasia
Aparelho reprodutor masculino
 Pontifícia Universidade Católica de Goiás Departamento de Biologia Aparelho reprodutor masculino Aparelho reprodutor masculino Prof. Msc. Macks Wendhell Gonçalves Anatomia do testículo Componentes do aparelho
Pontifícia Universidade Católica de Goiás Departamento de Biologia Aparelho reprodutor masculino Aparelho reprodutor masculino Prof. Msc. Macks Wendhell Gonçalves Anatomia do testículo Componentes do aparelho
TÉCNICAS DE ESTUDO EM PATOLOGIA
 TÉCNICAS DE ESTUDO EM PATOLOGIA Augusto Schneider Carlos Castilho de Barros Faculdade de Nutrição Universidade Federal de Pelotas TÉCNICAS Citologia Histologia Imunohistoquímica/imunofluorescência Biologia
TÉCNICAS DE ESTUDO EM PATOLOGIA Augusto Schneider Carlos Castilho de Barros Faculdade de Nutrição Universidade Federal de Pelotas TÉCNICAS Citologia Histologia Imunohistoquímica/imunofluorescência Biologia
Prof. Juliana -
 Mitose e Meiose CICLO CELULAR Célula encaminhada à progressão no ciclo por mecanismos de regulação relacionados a crescimento multiplicação diferenciação celular condição de latência. Falhas nos mecanismos
Mitose e Meiose CICLO CELULAR Célula encaminhada à progressão no ciclo por mecanismos de regulação relacionados a crescimento multiplicação diferenciação celular condição de latência. Falhas nos mecanismos
Divisão celular. A única situação em que dividir e multiplicar significam a mesma coisa
 Divisão celular A única situação em que dividir e multiplicar significam a mesma coisa Todos as células se dividem: 1. Em organismos unicelulares, divisão celular é o modo principal de reprodução 2. Em
Divisão celular A única situação em que dividir e multiplicar significam a mesma coisa Todos as células se dividem: 1. Em organismos unicelulares, divisão celular é o modo principal de reprodução 2. Em
DIVISÃO CELULAR. Multiplicação celular:
 DIVISÃO CELULAR Multiplicação celular: Para que uma célula se multiplique o genoma também precisa se multiplicar REPLICAÇÃO do DNA precede multiplicação celular DIVISÃO CELULAR MITOSE: divisão das células
DIVISÃO CELULAR Multiplicação celular: Para que uma célula se multiplique o genoma também precisa se multiplicar REPLICAÇÃO do DNA precede multiplicação celular DIVISÃO CELULAR MITOSE: divisão das células
SISTEMA REPRODUTOR MASCULINO. Prof. Dr. José Gomes Pereira
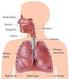 Prof. Dr. José Gomes Pereira 1. CONSIDERAÇÕES PRELIMINARES 2. CONSTITUINTES 2.1. Testículos 2.2. Ductos Genitais 2.3. Glândulas Genitais Acessórias 2.4. Uretra 2.5. Pênis Testículos Envoltórios testiculares
Prof. Dr. José Gomes Pereira 1. CONSIDERAÇÕES PRELIMINARES 2. CONSTITUINTES 2.1. Testículos 2.2. Ductos Genitais 2.3. Glândulas Genitais Acessórias 2.4. Uretra 2.5. Pênis Testículos Envoltórios testiculares
PCR Reação de Polimerase em Cadeia. Termociclador
 PCR Reação de Polimerase em Cadeia Termociclador REAÇÃO EM CADEIA DA POLIMERASE (PCR) Técnica que permite a amplificação da quantidade de DNA específico utilizando a enzima Taq DNA polimerase, sequências
PCR Reação de Polimerase em Cadeia Termociclador REAÇÃO EM CADEIA DA POLIMERASE (PCR) Técnica que permite a amplificação da quantidade de DNA específico utilizando a enzima Taq DNA polimerase, sequências
Errata: Tatiana Guimarães de Freitas Matos. Pg. 69. Legenda Figura 1
 Pg. 69 Legenda Figura 1 Onde se lê: Foram plaqueadas 5.104, leia-se: Foram plaqueadas 5.10 4. Pg. 70 Legenda Tabela 1 Onde se lê: Foram plaqueadas 5.104, leia-se: Foram plaqueadas 5.10 4. Pg. 72 Legenda
Pg. 69 Legenda Figura 1 Onde se lê: Foram plaqueadas 5.104, leia-se: Foram plaqueadas 5.10 4. Pg. 70 Legenda Tabela 1 Onde se lê: Foram plaqueadas 5.104, leia-se: Foram plaqueadas 5.10 4. Pg. 72 Legenda
Prostatic Stromal Neoplasms: Differential Diagnosis of Cystic and Solid Prostatic and Periprostatic Masses
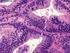 Universidade Federal de São Paulo Escola Paulista de Medicina Departamento de Diagnóstico por Imagem Setor Abdome Prostatic Stromal Neoplasms: Differential Diagnosis of Cystic and Solid Prostatic and Periprostatic
Universidade Federal de São Paulo Escola Paulista de Medicina Departamento de Diagnóstico por Imagem Setor Abdome Prostatic Stromal Neoplasms: Differential Diagnosis of Cystic and Solid Prostatic and Periprostatic
PERFIL EPIDEMIOLÓGICO DE PACIENTES COM NEOPLASIA DE MAMA EM TRATAMENTO COM TRANSTUZUMABE EM HOSPITAL NO INTERIOR DE ALAGOAS
 PERFIL EPIDEMIOLÓGICO DE PACIENTES COM NEOPLASIA DE MAMA EM TRATAMENTO COM TRANSTUZUMABE EM HOSPITAL NO INTERIOR DE ALAGOAS Andreia Herculano da Silva Casa de Saúde e Maternidade Afra Barbosa Andreiah.silva@hotmail.com
PERFIL EPIDEMIOLÓGICO DE PACIENTES COM NEOPLASIA DE MAMA EM TRATAMENTO COM TRANSTUZUMABE EM HOSPITAL NO INTERIOR DE ALAGOAS Andreia Herculano da Silva Casa de Saúde e Maternidade Afra Barbosa Andreiah.silva@hotmail.com
Hiperplasia Fibromuscular Glandular da Próstata
 Hiperplasia Fibromuscular Glandular da Próstata 6.4.2011 Como todas as glândulas secretoras, temos células produtoras de secreção com células mioepiteliais localizadas a nível basal com função de propulsão
Hiperplasia Fibromuscular Glandular da Próstata 6.4.2011 Como todas as glândulas secretoras, temos células produtoras de secreção com células mioepiteliais localizadas a nível basal com função de propulsão
UNIVERSIDADE ESTADUAL PAULISTA JULIO DE MESQUITA FILHO FACULDADE DE MEDICINA VETERINÁRIA E ZOOTECNIA CAMPUS DE BOTUCATU
 UNIVERSIDADE ESTADUAL PAULISTA JULIO DE MESQUITA FILHO FACULDADE DE MEDICINA VETERINÁRIA E ZOOTECNIA CAMPUS DE BOTUCATU ATIPIA DO EPITÉLIO PROSTÁTICO CANINO: ASPECTOS MOLECULARES E IMUNOFENOTÍPICOS Marcela
UNIVERSIDADE ESTADUAL PAULISTA JULIO DE MESQUITA FILHO FACULDADE DE MEDICINA VETERINÁRIA E ZOOTECNIA CAMPUS DE BOTUCATU ATIPIA DO EPITÉLIO PROSTÁTICO CANINO: ASPECTOS MOLECULARES E IMUNOFENOTÍPICOS Marcela
Iniciação e progressão neoplásica
 Biopatologia Iniciação e progressão neoplásica Diana Santos Ana Isabel Teixeira Doenças degenerativas -Nos indivíduos novos - a etiologia é hereditária: são sobretudo doenças catabólicas que ocorrem em
Biopatologia Iniciação e progressão neoplásica Diana Santos Ana Isabel Teixeira Doenças degenerativas -Nos indivíduos novos - a etiologia é hereditária: são sobretudo doenças catabólicas que ocorrem em
Aspectos gerais da estrutura celular
 Ciclo celular Aspectos gerais da estrutura celular A célula é a unidade básica da vida Altamente organizada, dividida em compartimentos As células surgem de outras células préexistentes As células são
Ciclo celular Aspectos gerais da estrutura celular A célula é a unidade básica da vida Altamente organizada, dividida em compartimentos As células surgem de outras células préexistentes As células são
Óxido nítrico, GSTP-1 e p53: qual o papel desses biomarcadores nas lesões prostáticas do cão?
 Arq. Bras. Med. Vet. Zootec., v.63, n.6, p.1368-1376, 2011 Óxido nítrico, GSTP-1 e p53: qual o papel desses biomarcadores nas lesões prostáticas do cão? [Nitric oxide, GSTP-1 and p53: what's the role of
Arq. Bras. Med. Vet. Zootec., v.63, n.6, p.1368-1376, 2011 Óxido nítrico, GSTP-1 e p53: qual o papel desses biomarcadores nas lesões prostáticas do cão? [Nitric oxide, GSTP-1 and p53: what's the role of
Ciclo Celular e Divisão Celular (Mitose e Meiose)
 Ciclo Celular e Divisão Celular (Mitose e Meiose) CICLO CELULAR Eventos que preparam e realizam a divisão celular Mecanismos responsáveis pelo crescimento e desenvolvimento Células somáticas célula duplica
Ciclo Celular e Divisão Celular (Mitose e Meiose) CICLO CELULAR Eventos que preparam e realizam a divisão celular Mecanismos responsáveis pelo crescimento e desenvolvimento Células somáticas célula duplica
Os fatores que promovem o crescimento de um órgão ou organismo podem ser funcionalmente divididos em três classes principais:
 1 Os fatores que promovem o crescimento de um órgão ou organismo podem ser funcionalmente divididos em três classes principais: 1. Mitógenos, que estimulam a divisão celular, principalmente por aliviar
1 Os fatores que promovem o crescimento de um órgão ou organismo podem ser funcionalmente divididos em três classes principais: 1. Mitógenos, que estimulam a divisão celular, principalmente por aliviar
TERAPIAS MOLECULARES CONTRA O CÂNCER
 TERAPIAS MOLECULARES CONTRA O CÂNCER Paulo Cesar Naoum Pós-Doutorado pela Cambridge University, Inglaterra, e Professor Titular pela Unesp. Diretor da Academia de Ciência e Tecnologia de São José do Rio
TERAPIAS MOLECULARES CONTRA O CÂNCER Paulo Cesar Naoum Pós-Doutorado pela Cambridge University, Inglaterra, e Professor Titular pela Unesp. Diretor da Academia de Ciência e Tecnologia de São José do Rio
Tumores Malignos do Endométrio
 Tumores Malignos do Endométrio Francisco José Candido dos Reis Departamento de Ginecologia e Obstetrícia da F.M.R.P.U.S.P. Conteúdo Estrutura e fisiologia do endométrio Carcinogênese do endométrio Epidemiologia
Tumores Malignos do Endométrio Francisco José Candido dos Reis Departamento de Ginecologia e Obstetrícia da F.M.R.P.U.S.P. Conteúdo Estrutura e fisiologia do endométrio Carcinogênese do endométrio Epidemiologia
Biologia molecular dos meningiomas
 Biologia molecular dos meningiomas Antonio Santos de Araújo Júnior Neurocirurgião Hospital Sírio-Libanês São Paulo Pós-graduando do Departamento de Cirurgia da Faculdade de Medicina da Universidade Federal
Biologia molecular dos meningiomas Antonio Santos de Araújo Júnior Neurocirurgião Hospital Sírio-Libanês São Paulo Pós-graduando do Departamento de Cirurgia da Faculdade de Medicina da Universidade Federal
Núcleo. Vera Andrade Robert Brown (1833) descreveu o núcleo celular
 Vera Andrade http://histologiavvargas.wordpress.com/ Núcleo Robert Brown (1833) descreveu o núcleo celular Nux (grego) = semente, por ser considerado tão importante para a célula quanto a semente é para
Vera Andrade http://histologiavvargas.wordpress.com/ Núcleo Robert Brown (1833) descreveu o núcleo celular Nux (grego) = semente, por ser considerado tão importante para a célula quanto a semente é para
CROMOSSOMOS. Profa. Dra. Viviane Nogaroto
 CROMOSSOMOS Cromossomos EUCARIOTOS Cada cromossomo carrega um subconjunto de genes que são arranjados linearmente ao longo do DNA Tamanho: -DNA de cromossomo de E. coli: 1.200 µm -DNA de cromossomo humano:
CROMOSSOMOS Cromossomos EUCARIOTOS Cada cromossomo carrega um subconjunto de genes que são arranjados linearmente ao longo do DNA Tamanho: -DNA de cromossomo de E. coli: 1.200 µm -DNA de cromossomo humano:
TÍTULO: IMUNOMARCAÇÃO DE COX-2 DE MODELO CARCINOGÊNESE MAMARIA POR INDUÇÃO QUÍMICA
 TÍTULO: IMUNOMARCAÇÃO DE COX-2 DE MODELO CARCINOGÊNESE MAMARIA POR INDUÇÃO QUÍMICA CATEGORIA: EM ANDAMENTO ÁREA: CIÊNCIAS BIOLÓGICAS E SAÚDE SUBÁREA: FARMÁCIA INSTITUIÇÃO: FACULDADE DE JAGUARIÚNA AUTOR(ES):
TÍTULO: IMUNOMARCAÇÃO DE COX-2 DE MODELO CARCINOGÊNESE MAMARIA POR INDUÇÃO QUÍMICA CATEGORIA: EM ANDAMENTO ÁREA: CIÊNCIAS BIOLÓGICAS E SAÚDE SUBÁREA: FARMÁCIA INSTITUIÇÃO: FACULDADE DE JAGUARIÚNA AUTOR(ES):
Biologia da célula neoplásica e interacção com o hospedeiro (I)
 Biologia da célula neoplásica e interacção com o hospedeiro (I) Rui Henrique Departamento de Patologia e Imunologia Molecular Instituto de Ciências Biomédicas Abel Salazar Universidade do Porto & Serviço
Biologia da célula neoplásica e interacção com o hospedeiro (I) Rui Henrique Departamento de Patologia e Imunologia Molecular Instituto de Ciências Biomédicas Abel Salazar Universidade do Porto & Serviço
A intensidade de imunocoloração predominante nesta fase mostrou-se. moderada e de forma homogênea nas células epiteliais alveolares e ductais que
 4. Resultados 4.1 Localização da cadeia βa Ativina/Inibina 4.1.1 Não gestantes A intensidade de imunocoloração predominante nesta fase mostrou-se moderada e de forma homogênea nas células epiteliais alveolares
4. Resultados 4.1 Localização da cadeia βa Ativina/Inibina 4.1.1 Não gestantes A intensidade de imunocoloração predominante nesta fase mostrou-se moderada e de forma homogênea nas células epiteliais alveolares
Adagmar Andriolo 19 a 22 de outubro de 2005
 Adagmar Andriolo adagmar.andriolo@fleury.com.br 19 a 22 de outubro de 2005 Novos marcadores diagnósticos e prognósticos do câncer da próstata CARCINOMA DA PRÓSTATA Estimativas para 2003: 189.000 novos
Adagmar Andriolo adagmar.andriolo@fleury.com.br 19 a 22 de outubro de 2005 Novos marcadores diagnósticos e prognósticos do câncer da próstata CARCINOMA DA PRÓSTATA Estimativas para 2003: 189.000 novos
BIOLOGIA MOLECULAR EM ENDOCRINOLOGIA. Denise Pires de Carvalho Instituto de Biofísica Carlos Chagas Filho / UFRJ
 BIOLOGIA MOLECULAR EM ENDOCRINOLOGIA Denise Pires de Carvalho Instituto de Biofísica Carlos Chagas Filho / UFRJ DNA Sequência de Nucleotídeos RNA Sequência de Nucleotídeos PROTEÍNA Sequência de Aminoácidos
BIOLOGIA MOLECULAR EM ENDOCRINOLOGIA Denise Pires de Carvalho Instituto de Biofísica Carlos Chagas Filho / UFRJ DNA Sequência de Nucleotídeos RNA Sequência de Nucleotídeos PROTEÍNA Sequência de Aminoácidos
Superlista núcleo 1.
 Superlista núcleo 1. (Unicamp) Em relação a um organismo diploide, que apresenta 24 cromossomos em cada célula somática, pode-se afirmar que a) seu código genético é composto por 24 moléculas de DNA de
Superlista núcleo 1. (Unicamp) Em relação a um organismo diploide, que apresenta 24 cromossomos em cada célula somática, pode-se afirmar que a) seu código genético é composto por 24 moléculas de DNA de
LESÃO INTRA-EPITELIAL ESCAMOSA DE BAIXO GRAU (LSIL) NIC 1 - DL
 LESÃO INTRA-EPITELIAL ESCAMOSA DE BAIXO GRAU (LSIL) NIC 1 - DL Predominância de alterações discarióticas em células intermediárias e superficiais Aumento nuclear, variação na forma Bi/multinucleação Rabelo,S.H./UFG
LESÃO INTRA-EPITELIAL ESCAMOSA DE BAIXO GRAU (LSIL) NIC 1 - DL Predominância de alterações discarióticas em células intermediárias e superficiais Aumento nuclear, variação na forma Bi/multinucleação Rabelo,S.H./UFG
Princípios e Aplicações da Técnica de PCR
 Universidade Federal de Santa Catarina Centro de Ciências Biológicas XVIII Semana Acadêmica da Biologia- UFSC Curso teórico-prático Princípios e Aplicações da Técnica de PCR Prof. Dr. Rafael D Rosa Departamento
Universidade Federal de Santa Catarina Centro de Ciências Biológicas XVIII Semana Acadêmica da Biologia- UFSC Curso teórico-prático Princípios e Aplicações da Técnica de PCR Prof. Dr. Rafael D Rosa Departamento
Comunicação e sinalização celular
 Comunicação e sinalização celular ------------------------------------------------------------------------------------- Do simples para o complexo, moléculas organizadas formam as células, que unidas formam
Comunicação e sinalização celular ------------------------------------------------------------------------------------- Do simples para o complexo, moléculas organizadas formam as células, que unidas formam
Fisiologia celular I. Fisiologia Prof. Msc Brunno Macedo
 celular I celular I Objetivo Conhecer os aspectos relacionados a manutenção da homeostasia e sinalização celular Conteúdo Ambiente interno da célula Os meios de comunicação e sinalização As bases moleculares
celular I celular I Objetivo Conhecer os aspectos relacionados a manutenção da homeostasia e sinalização celular Conteúdo Ambiente interno da célula Os meios de comunicação e sinalização As bases moleculares
CICLO CELULAR Eduardo Montagner Dias
 CICLO CELULAR Eduardo Montagner Dias O ciclo celular é um processo através do qual uma célula somática duplica seu material genético e o reparte igualmente às suas células-filhas. É didaticamente dividido
CICLO CELULAR Eduardo Montagner Dias O ciclo celular é um processo através do qual uma célula somática duplica seu material genético e o reparte igualmente às suas células-filhas. É didaticamente dividido
BIOLOGIA. Moléculas, células e tecidos. Ciclo celular. Professor: Alex Santos
 BIOLOGIA Moléculas, células e tecidos Professor: Alex Santos Tópicos em abordagem I Conceitos fundamentais II Estágios do ciclo celular III Visão geral da regulação do ciclo celular IV Importância do ciclo
BIOLOGIA Moléculas, células e tecidos Professor: Alex Santos Tópicos em abordagem I Conceitos fundamentais II Estágios do ciclo celular III Visão geral da regulação do ciclo celular IV Importância do ciclo
CÂNCER DE BOCA E OROFARINGE
 CÂNCER DE BOCA E OROFARINGE EQUIPE MULTIDISCIPLINAR LOCAIS MAIS FREQUÊNTES DAS LESÕES PRECOCES Mashberg e Meyer LESÕES PRE- CANCEROSAS CAMPO DE CANCERIZAÇÃO FOCOS MÚLTIPLOS MAIOR PROBABILIDADE DE ALTERAÇÕES
CÂNCER DE BOCA E OROFARINGE EQUIPE MULTIDISCIPLINAR LOCAIS MAIS FREQUÊNTES DAS LESÕES PRECOCES Mashberg e Meyer LESÕES PRE- CANCEROSAS CAMPO DE CANCERIZAÇÃO FOCOS MÚLTIPLOS MAIOR PROBABILIDADE DE ALTERAÇÕES
Ciclo e Divisão Celular
 Universidade de São Paulo Escola de Engenharia de Lorena Departamento de Biotecnologia Curso: Engenharia Ambiental Ciclo e Divisão Celular Prof: Tatiane da Franca Silva tatianedafranca@usp.br 1 Herança
Universidade de São Paulo Escola de Engenharia de Lorena Departamento de Biotecnologia Curso: Engenharia Ambiental Ciclo e Divisão Celular Prof: Tatiane da Franca Silva tatianedafranca@usp.br 1 Herança
Tecido Epitelial e Conjuntivo
 Tecido Epitelial e Conjuntivo Objetivos os estudantes deverão ser capazes de... - descrever as características (constituintes e sua organização) e funções gerais do epitélio de revestimento e do epitélio
Tecido Epitelial e Conjuntivo Objetivos os estudantes deverão ser capazes de... - descrever as características (constituintes e sua organização) e funções gerais do epitélio de revestimento e do epitélio
BIOLOGIA MOLECULAR EM ENDOCRINOLOGIA
 BIOLOGIA MOLECULAR EM ENDOCRINOLOGIA Curso de Atualização em Endocrinologia 2017 Denise Pires de Carvalho Instituto de Biofísica Carlos Chagas Filho / UFRJ DNA Sequência de Nucleotídeos RNA Sequência de
BIOLOGIA MOLECULAR EM ENDOCRINOLOGIA Curso de Atualização em Endocrinologia 2017 Denise Pires de Carvalho Instituto de Biofísica Carlos Chagas Filho / UFRJ DNA Sequência de Nucleotídeos RNA Sequência de
Aluna: Bianca Doimo Sousa Orientador: Prof. Dr. Jaques Waisberg. Hospital do Servidor Público Estadual
 Hospital do Servidor Público Estadual Programa de Iniciação Científica em Gastroenterologia Cirúrgica EXPRESSÃO IMUNO-HISTOQUÍMICA DO RECEPTOR DE FATOR DE CRESCIMENTO EPIDÉRMICO (EGFR) NO CARCINOMA COLORRETAL:
Hospital do Servidor Público Estadual Programa de Iniciação Científica em Gastroenterologia Cirúrgica EXPRESSÃO IMUNO-HISTOQUÍMICA DO RECEPTOR DE FATOR DE CRESCIMENTO EPIDÉRMICO (EGFR) NO CARCINOMA COLORRETAL:
ENFERMAGEM ATENÇÃO BÁSICA E SAÚDE DA FAMÍLIA. Parte 14. Profª. Lívia Bahia
 ENFERMAGEM ATENÇÃO BÁSICA E SAÚDE DA FAMÍLIA Parte 14 Profª. Lívia Bahia Controle do câncer do colo do útero e de mama na Atenção Básica Controle do câncer da mama O câncer de mama é o mais incidente em
ENFERMAGEM ATENÇÃO BÁSICA E SAÚDE DA FAMÍLIA Parte 14 Profª. Lívia Bahia Controle do câncer do colo do útero e de mama na Atenção Básica Controle do câncer da mama O câncer de mama é o mais incidente em
Profa. MSc. Monyke Lucena
 Profa. MSc. Monyke Lucena Núcleo Celular Portador dos fatores hereditários e controlador das atividades metabólicas. Núcleo Interfásico - Intérfase 1. Carioteca - envoltório nuclear, formada por duas membranas
Profa. MSc. Monyke Lucena Núcleo Celular Portador dos fatores hereditários e controlador das atividades metabólicas. Núcleo Interfásico - Intérfase 1. Carioteca - envoltório nuclear, formada por duas membranas
Alterações do Crescimento Celular
 Alterações do Crescimento Celular Profa. Letícia Coutinho Lopes Moura Tópicos da Aula A. Adaptações do Crescimento B. Alterações do Crescimento I C. Alterações do Crescimento II D. Alterações de Adaptação
Alterações do Crescimento Celular Profa. Letícia Coutinho Lopes Moura Tópicos da Aula A. Adaptações do Crescimento B. Alterações do Crescimento I C. Alterações do Crescimento II D. Alterações de Adaptação
Curso de Medicina - 1º período Organização semestral.
 Curso de Medicina - 1º período Organização semestral. Legenda para a identificação das áreas integrantes dos módulos Fisiologia Bioquímica BioMol / Genética Biofísica Outras disciplinas do 1º período:
Curso de Medicina - 1º período Organização semestral. Legenda para a identificação das áreas integrantes dos módulos Fisiologia Bioquímica BioMol / Genética Biofísica Outras disciplinas do 1º período:
APOPTOSE, OU MORTE CELULAR PROGRAMADA
 APOPTOSE, OU MORTE CELULAR PROGRAMADA é um processo essencial para a manutenção do desenvolvimento dos seres vivos, sendo importante para eliminar células supérfluas ou defeituosas. As células têm um conjunto
APOPTOSE, OU MORTE CELULAR PROGRAMADA é um processo essencial para a manutenção do desenvolvimento dos seres vivos, sendo importante para eliminar células supérfluas ou defeituosas. As células têm um conjunto
FACULDADE DE EXCELÊNCIA EDUCACIONAL DO RIO GRANDE DO NORTE CURSO: FISIOTERAPIA INTRODUÇÃO A HISTOLOGIA
 FACULDADE DE EXCELÊNCIA EDUCACIONAL DO RIO GRANDE DO NORTE CURSO: FISIOTERAPIA INTRODUÇÃO A HISTOLOGIA Histologia Estuda os tecidos do corpo e como estes tecidos se organizam para constituir órgãos. Introdução
FACULDADE DE EXCELÊNCIA EDUCACIONAL DO RIO GRANDE DO NORTE CURSO: FISIOTERAPIA INTRODUÇÃO A HISTOLOGIA Histologia Estuda os tecidos do corpo e como estes tecidos se organizam para constituir órgãos. Introdução
Regulação gênica em Eucariotos. Prof. Dr. Marcelo Ricardo Vicari
 Regulação gênica em Eucariotos REGULAÇÃO GÊNICA Neurônio e célula de fígado: células de um mesmo indivíduo e que contêm a mesmo genoma REGULAÇÃO GÊNICA Diferenciação celular 1973 REGULAÇÃO GÊNICA Dolly:
Regulação gênica em Eucariotos REGULAÇÃO GÊNICA Neurônio e célula de fígado: células de um mesmo indivíduo e que contêm a mesmo genoma REGULAÇÃO GÊNICA Diferenciação celular 1973 REGULAÇÃO GÊNICA Dolly:
uterino com o objetivo de promover a redução volumétrica do leiomioma e GnRH. No entanto, CAMPUSANO et al.(1993), referem maior facilidade na
 6 DISCUSSÃO Discussão 54 O uso de análogo de GnRH tem sido indicado no tratamento do leiomioma uterino com o objetivo de promover a redução volumétrica do leiomioma e possibilitar a realização de tratamento
6 DISCUSSÃO Discussão 54 O uso de análogo de GnRH tem sido indicado no tratamento do leiomioma uterino com o objetivo de promover a redução volumétrica do leiomioma e possibilitar a realização de tratamento
Doutoramento em Actividade Física e Saúde
 Doutoramento em Actividade Física e Saúde 2º Semestre Disciplina de Análise de Dados 10 de Fevereiro de 2010 - José Carlos Ribeiro 17 de Fevereiro de 2010 - José Carlos Ribeiro Disciplina de Estilos de
Doutoramento em Actividade Física e Saúde 2º Semestre Disciplina de Análise de Dados 10 de Fevereiro de 2010 - José Carlos Ribeiro 17 de Fevereiro de 2010 - José Carlos Ribeiro Disciplina de Estilos de
Leia atentamente os textos e as questões que se seguem e indique a letra da opção correta no local indicado na folha de respostas no final.
 Escola Prof. Reynaldo dos Santos Vila Franca de Xira Biologia e Geologia - 11º ano - Teste de Avaliação Outubro 2017 Tema 6 Biologia: DNA, Síntese de Proteínas, Ciclo celular, Mitose, Diferenciação Leia
Escola Prof. Reynaldo dos Santos Vila Franca de Xira Biologia e Geologia - 11º ano - Teste de Avaliação Outubro 2017 Tema 6 Biologia: DNA, Síntese de Proteínas, Ciclo celular, Mitose, Diferenciação Leia
Patologia - orientações
 Patologia - orientações Padronização para Patologistas e Ginecologistas Elaborado pelas Sociedades Brasileiras de Citopatologia, de Patologia, de Patologia do Trato Genital Inferior e Colposcopia, FEBRASGO,
Patologia - orientações Padronização para Patologistas e Ginecologistas Elaborado pelas Sociedades Brasileiras de Citopatologia, de Patologia, de Patologia do Trato Genital Inferior e Colposcopia, FEBRASGO,
Adaptações Celulares. Processos Patológicos Gerais Profa. Adriana Azevedo Prof. Archangelo P. Fernandes Enf./2 o sem
 Adaptações Celulares Processos Patológicos Gerais Profa. Adriana Azevedo Prof. Archangelo P. Fernandes Enf./2 o sem Estímulo Lesivo Célula Normal Estresse Fisiológico/ Patógeno Lesão Celular Incapacidade
Adaptações Celulares Processos Patológicos Gerais Profa. Adriana Azevedo Prof. Archangelo P. Fernandes Enf./2 o sem Estímulo Lesivo Célula Normal Estresse Fisiológico/ Patógeno Lesão Celular Incapacidade
Lâmina 32 Neoplasia Benigna (Simples) Leiomioma Uterino Neoplasia benigna constituída pela proliferação de fibras musculares lisas, dispostas em
 Lâmina 32 Neoplasia Benigna (Simples) Leiomioma Uterino Neoplasia benigna constituída pela proliferação de fibras musculares lisas, dispostas em diversas direções. Apresenta áreas de hialinização (áreas
Lâmina 32 Neoplasia Benigna (Simples) Leiomioma Uterino Neoplasia benigna constituída pela proliferação de fibras musculares lisas, dispostas em diversas direções. Apresenta áreas de hialinização (áreas
14/03/2016. Letícia Coutinho Lopes 1. Características Alterações Celulares Adaptativas Mecanismos Bioquímicos
 Alterações do Crescimento Celular Profa. Letícia Coutinho Lopes Moura Tópicos da Aula A. Adaptações do Crescimento B. Alterações do Crescimento I C. Alterações do Crescimento II D. Alterações de Adaptação
Alterações do Crescimento Celular Profa. Letícia Coutinho Lopes Moura Tópicos da Aula A. Adaptações do Crescimento B. Alterações do Crescimento I C. Alterações do Crescimento II D. Alterações de Adaptação
Reprodutor Masculino
 Reprodutor Masculino Prof a Dr a Mariana Kiomy Osako RCG0146 Medicina Prof 1º ano a Dr a 03/10/2016 Mariana Kiomy Osako Sistema Reprodutor Masculino Ductos deferentes Secreção sêmen Vesículas Seminais
Reprodutor Masculino Prof a Dr a Mariana Kiomy Osako RCG0146 Medicina Prof 1º ano a Dr a 03/10/2016 Mariana Kiomy Osako Sistema Reprodutor Masculino Ductos deferentes Secreção sêmen Vesículas Seminais
III Tema: Exames de imuno-histoquimica em doenças de mama
 Parecer do Grupo Técnico de Auditoria em Saúde 0005/02 Tema: Imuno-histoquímica para doenças de mama I Data: 26/08/2002. II Grupo de Estudo: Dr.Adolfo Orsi Parenzi Dra. Clemilda Alvarenga Coelho Dra. Lélia
Parecer do Grupo Técnico de Auditoria em Saúde 0005/02 Tema: Imuno-histoquímica para doenças de mama I Data: 26/08/2002. II Grupo de Estudo: Dr.Adolfo Orsi Parenzi Dra. Clemilda Alvarenga Coelho Dra. Lélia
ESPECIALIZAÇÃO OU DIFERENCIAÇÃO CELULAR. Moisés Araújo
 ESPECIALIZAÇÃO OU DIFERENCIAÇÃO CELULAR O QUE É ESPECIALIZAÇÃO CELULAR? CONJUNTO DAS MODIFICAÇÕES QUIMICAS, FÍSICAS OU ESTRUTURAIS E FUNCIONAIS DAS CÉLULAS EMBRIONÁRIAS, INICIALMENTE SIMPLES E INDIFERENCIADAS,
ESPECIALIZAÇÃO OU DIFERENCIAÇÃO CELULAR O QUE É ESPECIALIZAÇÃO CELULAR? CONJUNTO DAS MODIFICAÇÕES QUIMICAS, FÍSICAS OU ESTRUTURAIS E FUNCIONAIS DAS CÉLULAS EMBRIONÁRIAS, INICIALMENTE SIMPLES E INDIFERENCIADAS,
