Cinética Química. Taxas de reação. e Mecanismos de reação. (Taxas de reação)
|
|
|
- Lucas Gabriel Galvão Figueiredo
- 7 Há anos
- Visualizações:
Transcrição
1 Cinética Química Taxas e reação Reações elementares e Mecanismos e reação (Taxas e reação)
2 Taxa e reacção Termoinâmica Cinética química Taxa e reação inica a ireção e um processo, qual o estao e equilíbrio a atingir, etc inica a rapiez a reação, qual a taxa a que esta ocorre em ireção ao equilíbrio variação a concentração mássica ou molar por uniae e tempo (p.ex.: g cm -3 s - mol m -3 s - ) As taxas e reação poem variar entre valores extremamente elevaos e extremamente baixos. Algumas reações completam-se em tempos a orem e 0-5 s e outras emoram milhares e anos A taxa e reação epene a reação química, a concentração as espécies químicas, a pressão e a temperatura,
3 m ν i i Escreva-se uma reação química na forma: Χ 0 ν - coeficiente estequeométrico Χ - reagente ou prouto + para proutos - para reagentes i ex: CO ½ O + CO 0 Por efinição: R V ν i n i e [ ] (-) Χ i R e ν i (-) R > 0 e o mesmo para toas as espécies químicas Nota - não confunir R (taxa e reação) com R (constante e um gás)
4 Para reações a volume constante: R ni V Χ ν ν i i [ ] i (-3) E se o gás é semi-perfeito: R R0ν i p T (-4) E para reações isotérmicas: R R 0 T ν i p (-5) É necessário achar uma expressão para o cálculo e R
5 Reações globais e reações elementares Uma reação global escreve um conjunto e processos que se poem trauzir na conversão e reagentes em proutos CH 4 + O CO + H O A colisão e uma molécula e metano com uas e oxigénio não é impossível mas é muito pouco provável, e muito possivelmente não alteraria as estruturas moleculares e moo a resultarem as três moléculas que estão nos proutos A reação global exprime apenas o balanço e massa e as espécies iniciais e finais
6 A reação global resulta e um conjunto (muito grane e complexo) e reações elementares (praticamente sempre bi-moleculares) As reações elementares são processos que ocorrem na realiae e corresponem à colisão e uas moléculas com conições para que se alterem as ligações químicas nas moléculas e formem novas moléculas Para que ocorram as reações elementares é necessário verificar-se a colisão entre moléculas e em conições especiais, tais como orientação aequaa as moléculas e energia cinética na colisão maior que um eterminao valor
7 Mecanismo e Reação Um mecanismo e reação (global) é um conjunto e reações elementares que explicam o processo global Os mecanismos e reação poem ser mais ou menos exaustivos, muitas vezes eliminano-se as reações elementares que contribuem menos para o processo global Introuzem-se simplificações para estimar a concentração e algumas espécies interméias
8 Reações globais e elementares Consiere-se a seguinte reação global: CH 4 + O CO + H O Esta reação global poe ser escrita pelo conjunto e reações elementares: O + M O + M Reações irecta e inversa (f e b) CH 4 + M CH 3 + H + M O + H OH + O CH 3 + O CH O + H CH 4 + O CH 3 + OH CH O + OH HCO + H O HCO + O CO + H Reações irecta e inversa Reações 3 irecta e inversa Reações 4 irecta e inversa Reações 5 irecta e inversa Reações 6 irecta e inversa Reações 7 irecta e inversa
9 Este mecanismo e reação é bastante simples: 4 equações, 0 espécies químicas Duas as espécies químicas são reagentes (a azul) Duas são proutos (a encarnao) CH 4 + O CO + H O O + M O + M () Seis são raicais (a vere) (M é qualquer espécie química ou uma paree) CH 4 + M CH 3 + H + M O + H OH + O CH 3 + O CH O + H CH 4 + O CH 3 + OH () (3) (4) (5) Os raicais são espécies químicas instáveis, muito reativas, responsáveis pelo prosseguimento as reações (reação em caeia) CH O + OH HCO + O HCO + H O CO + H (6) (7) Sem raicais a reação químca global não se realizaria
10 Note-se que: - toas as reações, excepto uas (b e b) são bi-moleculares - em quase toas as reações intervêm raicais são eles que mantêm a reação em caeia - as reações e (a issociação os reagentes) são fortemente enotérmicas! O + M O + M () CH 4 + M CH 3 + H + M () - as reações que ão origem ou multiplicam os raicais aceleram a oxiação o combustível O + H CH 3 + O OH + O CH O + H (3) (4) - as que reuzem os raicais retaram ou inibem a oxiação o combustível CH 4 + O CH O + OH CH 3 + OH HCO + H O (5) (6) - as que eliminam os raicais inibem a oxiação o combustível HCO + O CO + H (7)
11 Consierano apenas as reações irectas (para simplificar o exemplo!): - reações e iniciação e caeia: e - reações e propagação e caeia: 3, 4 e 5 - reações e inibição ou e quebra a caeia: 6 e 7 O + M O + M () CH 4 + M CH 3 + H + M () O + H CH 3 + O CH 4 + O CH O + OH HCO + O OH + O CH O + H CH 3 + OH HCO + H O CO + H (3) (4) (5) (6) (7)
12 A espécie inerte M é muito importante É ela que absorve a energia e uma colisão, permitino que a molécula formaa não se issocie e.g.: a colisão e ois raicais CH 3 teria como resultao ois raicais e CH 3 se a energia a colisão não fosse transferia para um terceiro corpo CH 3 + CH 3 C H 6 O terceiro corpo é, muitas vezes, uma paree sólia
13 Uma reação poe ser inibia: - aumentano a razão superfície / volume, aumentano assim o número e choques com as parees - aicionano um iluente, aumentano o número e colisões os raicais livres com moléculas estáveis - aumentano a pressão (mas não em toos os casos!), aumentano a probabiliae e colisão e raicais e átomos entre si (na verae, o aumento e pressão poe funcionar nos ois sentios!) - aicionano uma espécie química com grane afiniae para certos raicais muito activos (propagaores e caeia) e.g.: halogenatos (CCl 4, por exemplo) Uma reacção poe ser aceleraa se se introuzirem raicais muito activos na reação química e.g.: H e OH nas oxiações e CO e e hirocarbonetos pesaos
14 Expressão típica para [ ] Verifica-se experimentalmente que é geralmente a forma: [ A] A B + C [ A] N O 5 N O 4 + 0,5 O (-6) [ ] A + B C + D [ A] [ A][ B] (C H 5 ) 3 N + C 5 H 5 Br (C H 5 ) 4 N Br (-7) A B + C [ A] [ A] NO NO + O (-8) Estas expressões são particularmente verae para reações elementares Exceções:
15 Orem e reação Define-se orem e reação como o expoente obtio experimentalmente nas expressões inicaas [ A] [ A] [ A] [ A] [ A][ B] [ A] ª orem ª orem em A, ª orem em B, ª orem global ª orem Nota: não se poe inferir a orem a reação a partir os coeficientes estequeométricos Muitas reações têm orens e reação não inteiras, e algumas têm orem zero Tipicamente a orem e reação a combustão e hirocarbonetos está compreenia entre,7 e,. Valor mais habitual:,75 (-9) (-0) (-)
16 Orem parcial e reação relativamente ao combustível (n fu ) e ao oxigénio (n ox ) Combustível n fu n ox Combustível n fu n ox Combustível CH 4-0,30,30 C 7 H 6 0,5,50 C 6 H 6-0,0,85 C H 6 0,0,65 C 8 H 8 0,5,50 C 7 H 8-0,0,85 C 3 H 8 0,0,65 C 9 H 0 0,5,50 C H 4 0,0,65 C 4 H 0 0,5,60 C 0 H 0,5,50 C 3 H 6-0,0,85 C 5 H 0,5,50 CH 3 OH 0,5,50 C H 0,50,5 C 6 H 4 0,5,50 C H 5 OH 0,5,60 Westbroo, C K, & Dryer, F L: Simplifie reaction mechanism for the oxiation of hyrocarbon fuels in flames Combust. Sci. an Tech., vol. 7, pp (98) n fu n ox Note-se que o metano inibe a sua própria oxiação! Em menor escala, o mesmo se passa com o benzeno, tuloeno, e C 3 H 6 C 3 H 6 ciclopropano ou propeno?
17 Em geral: [ X ] ν X ' n va vb vc [ A] [ B] [ C]... com n ν + ν + ν +... A B C (n é a orem global e reação) (-) X espécie química genérica (reagente ou prouto) A, B, C,... reagentes (ver 3.5. o livro Combustão ) Muitas vezes conhecia a composição inicial a mistura e os ν i poe simplificar-se a expressão: [ A] seno n [ A] n n uma função e n, e composição e a temperatura (-) Para uma eterminaa mistura a uma eterminaa temperatura, n é uma constante. É esignaa por constante específica a taxa e reação
18 Integrano [ A] n [ A] n [ ] obtém-se n A n n t + const (n ) (-) n n t 0 [ A] [ A] 0 [ A] [ A] ( n ) t 0 n (-3) ln[ A] n [ A] ln [ A] ln[ ] t A 0 ln[ A] 0 eclive (-4) t n [ ] A A [ ] [ ] A 0 + t n [ A] eclive (-5) n 3 3 [ A] [ A] [ A ] t n [ A] 0 ( n ) n t (-6)
19 Semi-períoo Os valores e n e e n poem ser obtios os gráficos ilustraos, verificano-se qual o valor e n que á origem a uma variação linear nas coorenaas aequaas Define-se t /, chamao semi-períoo, como seno o tempo necessário para metae os reagentes iniciais serem consumios ln t, t, n n n [ A] n 0 n (-7) e (-8) ln[ A] ln[ A] 0 n [ A] n [ A] 0 eclive t eclive ( n ) n t t / não epene e [ ] 0 para n. A sua epenência com [ ] 0 torna-se caa vez maior com valores crescentes e n n O coeficiente em t / aumenta com valores crescentes e n. Logo n as reações e orem elevaa são lentas para baixos valores e [ ] 0
20 Efeito a pressão e a temperatura Numa reação isotérmica p na R T [ A] R T e p xa p V A 0 A [ ] A x A R 0 p T (cf (-) e (-4)) [ A] n [ A] n n x n A p R T 0 n (-9) Quano a temperatura varia verificou-se experimentalmente [ ] A varia com T. Como? ln n eclive n [ A] T t Verificou-se também E R 0 /T
21 Energia e ativação Arrhenius postulou [ ] A 0 ET n [ ] A R [ ] n n A e A (-0) one A e E são constantes empíricas (E poe ser obtio a partir a teoria cinética os gases) A é esignao por fator e frequência ou fator pré-exponencial E é esignao por energia e ativação A energia e ativação representa a barreira energética que tem que ser ultrapassaa para que a reação ocorra E exp R0 T E R 0 representa a fração e moléculas com energia superior a E - temperatura e ativação Ar E R T 0 - Número e Arrhenius
22 Energia e ativação complexo ativao A formação os proutos é preceia pela formação e uma espécie química interméia associaa ao estao e energia máxima o sistema reativo o chamao complexo ativao Variação e energia numa reação elementar a) Reação exotérmica b) Reação enotérmica
23 Taxa e reação Consierano uma orem e reação unitária para o combustível e para o oxigénio (simplificação razoavelmente habitual): y R N M S M M * fu 3 K p y fu yox T - Fração mássica [ ] E exp (-) R0 T com - Nº e Avogaro [nº e moléculas mol - ] - Diâmetro méio as moléculas (O) 3,5 0-0 m - Massa molecular [g mol-] - Steric factor - Massa molecular méia a mistura M fu M ox M + M fu ox K S N M fu R0 M * M R 0 (-)
24 R fu 3 K p y fu yox T E exp (-) R0 T Na expressão a taxa e reação note-se: - a fortíssima epenência com T (evio à exponencial!) - o T -,5 é virtualmente irrelevante em termos a epenência e R fu com T - apesar o fortíssimo aumento e R fu com T, R fu anula-se quano um os y se anula A expressão (-) é uma simplificação a expressão mais geral: R fu n + fu nox n 3 fu nox K p y fu yox T exp E R T 0 (-3) com as respetivas orens e reação relativas ao combustível n fu e ao oxiante n ox Para grane parte as reações e combustão E tem valores a orem e 65 J mol -
25 f, b, e K c Há reações que não são irreversíveis e, especialmente em combustão evio às temperaturas elevaas, tem-se reação inversa e.g.: H + I f b HI (ioeto e hirogénio) [ ] Para calcular HI tem que se consierar a sua formação e issociação, consierano f e b [ HI] [ ][ ] [ HI] f H I b (-4) (cf (-))
26 [ ] Em equilíbrio HI 0 (-5) [ H ] [ I ] [ ] f eq eq b HI eq (-6) f b [ HI] eq [ H ] [ I ] eq eq K c one K c é a constante e equilíbrio expressa em termos e concentração (-7) K c é uma quantiae termoinâmica conhecia [ HI] f f [ H ][ I ] [ ] HI Kc (-8) Para gases semi-perfeitos K c K p m ( R T) i 0 ν i (-9)
27 Orens e reação complexas Geralmente as reações são mais complexas, apresentano orens e reação não imeiatamente eutíveis Consiere-se a reação e H e Br para formar HBr (brometo e hirogénio) H + Br HBr Experimentalmente obtém-se ' [ HBr] exp[ H][ Br] '' [ HBr] + exp [ Br ] (-30) Note-se que HBr inibe a sua própria formação Existe um mecanismo e reação que permite chegar a este resultao experimental - Boenstein, M: Phys. Chem.85, 39 (93)
28 f H + M H + M b f Br + M Br + M b A ecomposição e H (f) á-se muito mais ificilmente o que a ecomposição e Br e a temperaturas mais elevaas H + Br f3 b3 HBr + Br As reações b e b3 são muito lentas e, consequentemente, irrelevantes Br + H f4 b4 HBr + H simplifique-se o mecanismo para: iniciação e caeia Br + M f Br + M quebra e caeia b Br + M Br + M propagação e caeia H + Br f3 HBr + Br propagação e caeia Br + H f4 HBr + H inibição e caeia Br + H b4 HBr + H
29 Hipótese e estao estacionário Br + M f Br + M HBr + H b4 Br + H H + Br Br + H f3 f4 HBr + Br HBr + H b Br + M Br + M [ HBr] [ H][ ] + [ Br][ ] [ H][ HBr] f 3 Br f 4 H b4 (-3) (cf (-)) Consiere-se agora que uma vez formaos e teno atingio uma concentração suficiente, a taxa e esaparecimento os raicais H e Br é extremamente elevaa e, como tal, as concentrações estes raicais não aumentarão mais Note-se também que também não iminuirão visto isso implicar uma iminuição as suas taxas e esaparecimento. Atinge-se então uma situação e equilíbrio inâmico Esta situação é conhecia por hipótese e estao estacionário ( steay state assumption ) [ Br ] 0 [ H ] 0 (-3) (-33)
30 Br + M f Br + M b Br + M Br + M H + Br f3 HBr + Br Br + H f4 HBr + H HBr + H b4 Br + H [ Br] [ H] [ Br ] + [ H][ Br ] + [ H][ HBr] [ Br] [ Br][ H ] 0 f f 3 b4 b f 4 [ Br][ H ] [ H][ Br ] [ HBr][ H] 0 f 4 f 3 b4 (-35) Resolveno para [Br] e [H] f [ Br] [ Br ] [ H] f 4 f 3 b f b [ H ][ Br ] [ Br ] + [ HBr] b4 Resolveno [Br] e [H] na equação (-3) para [HBr] (-34) (-36) (-37)
31 [ HBr] f 4 f + b b4 f 3 [ H ][ Br ] [ HBr] [ Br ] (-38) que é iêntico a (-30) ' [ HBr] exp[ H][ Br] '' [ HBr] + exp [ Br ] (-30) com ' exp f 4 f b e '' exp b4 f 3 A hipótese e estao estacionário surgia neste caso é e grane utiliae É geralmente possível aplicá-la à concentração os raicais e átomos livres, que são e grane reativiae
32 [X] / [X] max raical prouto reagente tempo5
33 Mecanismo e Zelovich Consiere-se a combustão e N N + O NO e o seguinte mecanismo simplificao (muito simplificao) N + O NO + N N + O NO + O [ NO] t [ O][ N ] + [ N][ ] O A primeira estas reações é muito mais lenta que a seguna Assim, após uma fase inicial e formação e aumento e N, too o N formao na reação é rapiamente consumio na reação Poe então aplicar-se a hipótese e estao estacionário a N
34 [ N] t [ O][ N ] [ N][ O ] 0 [ N] [ O][ N] [ O ] Substituino [N] na equação [ NO] t [ O][ N ] + [ N][ ] O obtém-se [ NO] t [ O][ ] N A taxa e formação e NO é proporcional a [O] e [N ] A obtenção [O] é muito complicaa Procura obter-se [O] em função e espécies estáveis e e fácil meição (ver 3.7. o livro Combustão )
PROVA MODELO 2 PROPOSTA DE RESOLUÇÃO
 PROVA MODELO PROPOSTA DE RESOLUÇÃO GRUPO I O nome os reagentes a reação trauzia pela equação é: NO " monóxio e azoto O 3 " ozono Qualquer uma as seguintes proprieaes é aceitável, ao que elas são praticamente
PROVA MODELO PROPOSTA DE RESOLUÇÃO GRUPO I O nome os reagentes a reação trauzia pela equação é: NO " monóxio e azoto O 3 " ozono Qualquer uma as seguintes proprieaes é aceitável, ao que elas são praticamente
CINÉTICA QUÍMICA. Profa. Loraine Jacobs DAQBI.
 CINÉTICA QUÍMICA Profa. Loraine Jacobs DAQBI lorainejacobs@utfpr.edu.br http://paginapessoal.utfpr.edu.br/lorainejacobs Reações de Segunda Ordem Exercício 05: Entre os possíveis destinos do NO 2 na química
CINÉTICA QUÍMICA Profa. Loraine Jacobs DAQBI lorainejacobs@utfpr.edu.br http://paginapessoal.utfpr.edu.br/lorainejacobs Reações de Segunda Ordem Exercício 05: Entre os possíveis destinos do NO 2 na química
Equilíbrio Químico. Prof. Alex Fabiano C. Campos
 6/09/010 Equilíbrio Químico rof. Alex Fabiano C. Campos rocessos Reversíveis e Irreversíveis Algumas reações são irreversíveis, ou seja, uma vez obtios os proutos não há previsão espontânea e regeneração
6/09/010 Equilíbrio Químico rof. Alex Fabiano C. Campos rocessos Reversíveis e Irreversíveis Algumas reações são irreversíveis, ou seja, uma vez obtios os proutos não há previsão espontânea e regeneração
Noções de Cinética Química
 QB70C:// Química (Turmas S7/S72) Noções de Cinética Química Prof. Dr. Eduard Westphal (http://paginapessoal.utfpr.edu.br/eduardw) Capítulo 4 Atkins (5ed.) Cinética X Termodinâmica O G para a reação abaixo
QB70C:// Química (Turmas S7/S72) Noções de Cinética Química Prof. Dr. Eduard Westphal (http://paginapessoal.utfpr.edu.br/eduardw) Capítulo 4 Atkins (5ed.) Cinética X Termodinâmica O G para a reação abaixo
CINÉTICA QUÍMICA. Profa. Loraine Jacobs DAQBI.
 CINÉTICA QUÍMICA Profa. Loraine Jacobs DAQBI lorainejacobs@utfpr.edu.br http://paginapessoal.utfpr.edu.br/lorainejacobs Cinética Química Lei de Velocidade Integrada Mostra a variação das concentrações
CINÉTICA QUÍMICA Profa. Loraine Jacobs DAQBI lorainejacobs@utfpr.edu.br http://paginapessoal.utfpr.edu.br/lorainejacobs Cinética Química Lei de Velocidade Integrada Mostra a variação das concentrações
C n i é n t é i t c i a
 Cinética Velocidade Média A velocidade média de consumo de um reagente ou de formação de um produto é calculada em função da variação da quantidade de reagentes e produtos pela variação do tempo. Vm =
Cinética Velocidade Média A velocidade média de consumo de um reagente ou de formação de um produto é calculada em função da variação da quantidade de reagentes e produtos pela variação do tempo. Vm =
Equilíbrios proteína-ligando
 Equilíbrios proteína-ligano Para que as reacções enzimáticas possam ocorrer, é necessário o encontro molecular entre o enzima e o substrato e a sua associação num complexo enzima-substrato O processo e
Equilíbrios proteína-ligano Para que as reacções enzimáticas possam ocorrer, é necessário o encontro molecular entre o enzima e o substrato e a sua associação num complexo enzima-substrato O processo e
10º ENTEC Encontro de Tecnologia: 28 de novembro a 3 de dezembro de 2016
 SIMULAÇÃO DE UM PROCESSO FERMENTATIVO EM UM BIORREATOR PERFEITAMENTE MISTURADO Ana Carolina Borges Silva 1 ; José Walir e Sousa Filho 2 1 Universiae Feeral e Uberlânia 2 Universiae e Uberaba carolina.borges87@gmail.com,
SIMULAÇÃO DE UM PROCESSO FERMENTATIVO EM UM BIORREATOR PERFEITAMENTE MISTURADO Ana Carolina Borges Silva 1 ; José Walir e Sousa Filho 2 1 Universiae Feeral e Uberlânia 2 Universiae e Uberaba carolina.borges87@gmail.com,
CINÉTICA QUÍMICA. Prof. Gabriel P. Machado
 CINÉTICA QUÍMICA Prof. Gabriel P. Machado Conceito de velocidade média (v m ) em Química O conceito de velocidade é uma taxa de variação de algum determinado parâmetro por intervalo de tempo. Na Física,
CINÉTICA QUÍMICA Prof. Gabriel P. Machado Conceito de velocidade média (v m ) em Química O conceito de velocidade é uma taxa de variação de algum determinado parâmetro por intervalo de tempo. Na Física,
Fenômenos de Transporte III. Aula 05. Prof. Gerônimo
 Fenômenos e Transporte III ula 5 Prof. Gerônimo 6- DIFUSÃO EM REGIME PERMETE SEM REÇÃO QUÍMIC 6.- Consierações a respeito Consiere uma sala ampla conteno ar a atm e 5C. Coloque no centro a sala uma mesa
Fenômenos e Transporte III ula 5 Prof. Gerônimo 6- DIFUSÃO EM REGIME PERMETE SEM REÇÃO QUÍMIC 6.- Consierações a respeito Consiere uma sala ampla conteno ar a atm e 5C. Coloque no centro a sala uma mesa
CINÉTICA QUÍMICA. Profa. Loraine Jacobs DAQBI.
 CINÉTICA QUÍMICA Profa. Loraine Jacobs DAQBI lorainejacobs@utfpr.edu.br http://paginapessoal.utfpr.edu.br/lorainejacobs Cinética Química Estudo da velocidade das reações químicas. REAGENTES PRODUTOS Termodinâmica
CINÉTICA QUÍMICA Profa. Loraine Jacobs DAQBI lorainejacobs@utfpr.edu.br http://paginapessoal.utfpr.edu.br/lorainejacobs Cinética Química Estudo da velocidade das reações químicas. REAGENTES PRODUTOS Termodinâmica
Velocidade de reação. Química Geral. Prof. Edson Nossol
 Velocidade de reação Química Geral Prof. Edson Nossol Uberlândia, 02/12/2016 Cinética química Estuda as velocidades das reações e os fatores que a influencia tempo Termodinâmica x cinética G = H - T S
Velocidade de reação Química Geral Prof. Edson Nossol Uberlândia, 02/12/2016 Cinética química Estuda as velocidades das reações e os fatores que a influencia tempo Termodinâmica x cinética G = H - T S
Cinética Química. Prof. Alex Fabiano C. Campos. Rapidez Média das Reações
 Cinética Química Prof. Alex Fabiano C. Campos Rapidez Média das Reações A cinética é o estudo da rapidez com a qual as reações químicas ocorrem. A rapidez de uma reação pode ser determinada pela variação
Cinética Química Prof. Alex Fabiano C. Campos Rapidez Média das Reações A cinética é o estudo da rapidez com a qual as reações químicas ocorrem. A rapidez de uma reação pode ser determinada pela variação
A Regra da Cadeia. 14 de novembro de u(x) = sen x. v(x) = cos x. w(x) = x 5
 A Regra a Caeia 4 e novembro e 0. As operações algébricas entre funções (soma, prouto, etc) fornecem uma grane iversiae e novas funções para os iferentes casos que vimos até agora. Porém, existe uma outra
A Regra a Caeia 4 e novembro e 0. As operações algébricas entre funções (soma, prouto, etc) fornecem uma grane iversiae e novas funções para os iferentes casos que vimos até agora. Porém, existe uma outra
Cinética Parte A. Introdução à Química II. Prof. Edson Nossol
 Cinética Parte A Introdução à Química II Prof. Edson Nossol Uberlândia, 03/11/2017 Cinética química Estuda as velocidades das reações e os fatores que a influencia tempo Termodinâmica x cinética G = H
Cinética Parte A Introdução à Química II Prof. Edson Nossol Uberlândia, 03/11/2017 Cinética química Estuda as velocidades das reações e os fatores que a influencia tempo Termodinâmica x cinética G = H
METAIS E COMPLEXOS. Um ácido de Lewis é uma espécie química que pode estabelecer uma ligação coordenada aceitando um par de eletrões de outra espécie.
 METAIS E COMPLEXOS BASE DE LEWIS Uma base e Lewis é uma espécie química que poe estabelecer uma ligação coorenaa oano um par e eletrões a outra espécie. ÁCIDO DE LEWIS Um ácio e Lewis é uma espécie química
METAIS E COMPLEXOS BASE DE LEWIS Uma base e Lewis é uma espécie química que poe estabelecer uma ligação coorenaa oano um par e eletrões a outra espécie. ÁCIDO DE LEWIS Um ácio e Lewis é uma espécie química
2. Aborda a rapidez com que os reagentes são consumidos e os produtos são formados;
 CINÉTICA QUÍMICA 1. Trata das velocidades das reações; 2. Aborda a rapidez com que os reagentes são consumidos e os produtos são formados; 3. A dependência da velocidade; 4. Estudo do mecanismo de reação.
CINÉTICA QUÍMICA 1. Trata das velocidades das reações; 2. Aborda a rapidez com que os reagentes são consumidos e os produtos são formados; 3. A dependência da velocidade; 4. Estudo do mecanismo de reação.
Cinética Química. Prof. Alex Fabiano C. Campos
 Cinética Química Prof. Alex Fabiano C. Campos Rapidez Média das Reações A cinética é o estudo da rapidez com a qual as reações químicas ocorrem. A rapidez de uma reação pode ser determinada pela variação
Cinética Química Prof. Alex Fabiano C. Campos Rapidez Média das Reações A cinética é o estudo da rapidez com a qual as reações químicas ocorrem. A rapidez de uma reação pode ser determinada pela variação
Cinética. Módulo I - Físico Química Avançada. Profa. Kisla P. F. Siqueira
 Cinética Módulo I - Físico Química vançada Profa. Introdução Estudo das velocidades das reações químicas; Velocidade em função das concentrações das espécies presentes; Leis de velocidade: equações diferenciais;
Cinética Módulo I - Físico Química vançada Profa. Introdução Estudo das velocidades das reações químicas; Velocidade em função das concentrações das espécies presentes; Leis de velocidade: equações diferenciais;
AULA 2. Equilíbrio Químico
 AULA 2 Equilíbrio Químico Objetivos Definir reações reversíveis. Definir equilíbrio químico. Escrever as expressões as constantes e equilíbrio. Conhecer os fatores que afetam o equilíbrio químico. Introução
AULA 2 Equilíbrio Químico Objetivos Definir reações reversíveis. Definir equilíbrio químico. Escrever as expressões as constantes e equilíbrio. Conhecer os fatores que afetam o equilíbrio químico. Introução
Aula: 28 Temática: Efeito da Temperatura na Velocidade de Reação
 Aula: 28 Temática: Efeito da Temperatura na Velocidade de Reação Em grande parte das reações, as constantes de velocidade aumentam com o aumento da temperatura. Vamos analisar esta dependência. A teoria
Aula: 28 Temática: Efeito da Temperatura na Velocidade de Reação Em grande parte das reações, as constantes de velocidade aumentam com o aumento da temperatura. Vamos analisar esta dependência. A teoria
CINÉTICA QUÍMICA TUTOR: LUIZ EDUARDO NOCHI DISCIPLINA: QUÍMICA (FÍSICO QUÍMICA) CURSO ALCANCE (TURMA A E B ) DATA: 17/09/2016
 CINÉTICA QUÍMICA TUTOR: LUIZ EDUARDO NOCHI DISCIPLINA: QUÍMICA (FÍSICO QUÍMICA) CURSO ALCANCE (TURMA A E B ) DATA: 17/09/2016 O QUE É CINÉTICA QUÍMICA? É a área da química que estuda a velocidade das reações
CINÉTICA QUÍMICA TUTOR: LUIZ EDUARDO NOCHI DISCIPLINA: QUÍMICA (FÍSICO QUÍMICA) CURSO ALCANCE (TURMA A E B ) DATA: 17/09/2016 O QUE É CINÉTICA QUÍMICA? É a área da química que estuda a velocidade das reações
QUI109 QUÍMICA GERAL (Ciências Biológicas) 9ª aula /
 QUI109 QUÍMICA GERAL (Ciências Biológicas) 9ª aula / 2016-2 Prof. Mauricio X. Coutrim (disponível em: http://professor.ufop.br/mcoutrim) LIGAÇÃO COVALENTE HIBRIDIZAÇÃO DE ORBITAIS sp 2 Orientação dos orbitais
QUI109 QUÍMICA GERAL (Ciências Biológicas) 9ª aula / 2016-2 Prof. Mauricio X. Coutrim (disponível em: http://professor.ufop.br/mcoutrim) LIGAÇÃO COVALENTE HIBRIDIZAÇÃO DE ORBITAIS sp 2 Orientação dos orbitais
QUÍMICA Cinética Química Velocidade de Reação, Energia de Ativação, Concentração, Pressão, Temperatura e Catalisador - Parte 4 Prof ª.
 QUÍMICA Cinética Química Concentração, Pressão, Temperatura e Catalisador - Parte 4 Prof ª. Giselle Blois CONCENTRAÇÃO DOS REAGENTES: O aumento da concentração dos reagentes acarreta em um aumento da velocidade
QUÍMICA Cinética Química Concentração, Pressão, Temperatura e Catalisador - Parte 4 Prof ª. Giselle Blois CONCENTRAÇÃO DOS REAGENTES: O aumento da concentração dos reagentes acarreta em um aumento da velocidade
Avenida Lourival Alfredo, 176, Poeira, Marechal Deodoro, Alagoas, Brasil,
 5 CINÉTICA QUÍMICA 1 Introdução A química é, por sua própria natureza, preocupada com a mudança. As reações químicas convertem substâncias com propriedades bem-definidas em outros materiais com propriedades
5 CINÉTICA QUÍMICA 1 Introdução A química é, por sua própria natureza, preocupada com a mudança. As reações químicas convertem substâncias com propriedades bem-definidas em outros materiais com propriedades
CINÉTICA QUÍMICA. Obs.: a variação da quantidade deverá ser sempre um valor positivo, então ela deverá ser em módulo. 1.
 CINÉTICA QUÍMICA 1. Introdução O Conhecimento e o estudo da velocidade das reações, além de ser muito importante em termos industriais, também está relacionado ao nosso dia-adia, verificamos que há algumas
CINÉTICA QUÍMICA 1. Introdução O Conhecimento e o estudo da velocidade das reações, além de ser muito importante em termos industriais, também está relacionado ao nosso dia-adia, verificamos que há algumas
Leis de Newton. 1.1 Sistemas de inércia
 Capítulo Leis e Newton. Sistemas e inércia Supomos a existência e sistemas e referência, os sistemas e inércia, nos quais as leis e Newton são válias. Um sistema e inércia é um sistema em relação ao qual
Capítulo Leis e Newton. Sistemas e inércia Supomos a existência e sistemas e referência, os sistemas e inércia, nos quais as leis e Newton são válias. Um sistema e inércia é um sistema em relação ao qual
Controle Estatístico de Qualidade. Capítulo 14 (montgomery)
 Controle Estatístico e Qualiae Capítulo 4 (montgomery) Amostragem e Aceitação Lote a Lote para Atributos Introução A Amostragem poe ser efinia como a técnica estatística usaa para o cálculo e estimativas
Controle Estatístico e Qualiae Capítulo 4 (montgomery) Amostragem e Aceitação Lote a Lote para Atributos Introução A Amostragem poe ser efinia como a técnica estatística usaa para o cálculo e estimativas
Cinética Química. a temperatura na qual a reação ocorre e a presença de um catalisador.
 Cinética Química Cinética é o estudo da velocidade com a qual as reações químicas ocorrem. Existem quatro fatores importantes que afetam as velocidades das reações: o estado físico do reagente, as concentrações
Cinética Química Cinética é o estudo da velocidade com a qual as reações químicas ocorrem. Existem quatro fatores importantes que afetam as velocidades das reações: o estado físico do reagente, as concentrações
FUP - Faculdade UnB Planaltina Disciplina: Energia e Dinâmica das Transformações Químicas Professor: Alex Fabiano C. Campos
 FUP - Faculdade UnB Planaltina Disciplina: Energia e Dinâmica das Transformações Químicas Professor: Alex Fabiano C. Campos 1. Conceitue colisão efetiva, colisão não-efetiva, energia de ativação e complexo
FUP - Faculdade UnB Planaltina Disciplina: Energia e Dinâmica das Transformações Químicas Professor: Alex Fabiano C. Campos 1. Conceitue colisão efetiva, colisão não-efetiva, energia de ativação e complexo
CQ110 : Princípios de FQ. Imagens de Rorschach
 Imagens de Rorschach 1 Leis de velocidade Velocidade de uma reação química: Variação de reagentes / produtos em função do tempo: a A+ b B produtos v = k [A] x [B] y Lei de velocidade k: constante de velocidade
Imagens de Rorschach 1 Leis de velocidade Velocidade de uma reação química: Variação de reagentes / produtos em função do tempo: a A+ b B produtos v = k [A] x [B] y Lei de velocidade k: constante de velocidade
Ignição ( 6 do livro Combustão )
 Ignição ( 6 do livro Combustão ) Para uma reacção se iniciar é necessário fornecer energia aos reagentes (que têm que estar misturados) Essa energia pode surgir de dois modos a própria mistura liberta-a
Ignição ( 6 do livro Combustão ) Para uma reacção se iniciar é necessário fornecer energia aos reagentes (que têm que estar misturados) Essa energia pode surgir de dois modos a própria mistura liberta-a
ANÁLISE COMPLEXA E EQUAÇÕES DIFERENCIAIS AULA TEÓRICA DE ABRIL DE 2017
 ANÁLISE COMPLEXA E EQUAÇÕES DIFERENCIAIS AULA TEÓRICA 21 17 DE ABRIL DE 2017 EQUAÇÕES DIFERENCIAIS Equações iferenciais são equações (algébricas) one figuram funções e erivaas e várias orens e funções.
ANÁLISE COMPLEXA E EQUAÇÕES DIFERENCIAIS AULA TEÓRICA 21 17 DE ABRIL DE 2017 EQUAÇÕES DIFERENCIAIS Equações iferenciais são equações (algébricas) one figuram funções e erivaas e várias orens e funções.
Estudo Físico dos Gases
 Estuo Físico os Gases eoria Cinética os Gases Gás é um estao a matéria; as partículas neste estao estão em movimento aleatório e caótico; São compressíveis; Os gases ocupam too o volume o recipiente e,
Estuo Físico os Gases eoria Cinética os Gases Gás é um estao a matéria; as partículas neste estao estão em movimento aleatório e caótico; São compressíveis; Os gases ocupam too o volume o recipiente e,
BCL 0307 Transformações Químicas
 BCL 0307 Transformações Químicas Prof. Dr. André Sarto Polo Bloco B S. 1014 ou L202 andre.polo@ufabc.edu.br Aula 09 http://pesquisa.ufabc.edu.br/pologroup/transformacoes_quimicas.html Concentrações, velocidades
BCL 0307 Transformações Químicas Prof. Dr. André Sarto Polo Bloco B S. 1014 ou L202 andre.polo@ufabc.edu.br Aula 09 http://pesquisa.ufabc.edu.br/pologroup/transformacoes_quimicas.html Concentrações, velocidades
TERMOQUÍMICA. 1 Fenômenos endotérmicos e exotérmicos
 TERMOQUÍMICA 1 Fenômenos endotérmicos e exotérmicos a) Processos exotérmicos: Ocorrem com liberação de calor. Possuem variação de entalpia ( H) negativa. Ex: Combustão do metano (CH4) CH4 (g) + 2 O2 (g)
TERMOQUÍMICA 1 Fenômenos endotérmicos e exotérmicos a) Processos exotérmicos: Ocorrem com liberação de calor. Possuem variação de entalpia ( H) negativa. Ex: Combustão do metano (CH4) CH4 (g) + 2 O2 (g)
Capítulo 4 Análises de Resultados Numéricos das Simulações
 Análises e Resultaos Numéricos as Simulações 56 Análises e Resultaos Numéricos as Simulações 4.1 Introução Um moelo e simulação foi utilizao para caracterizar o comportamento o canal e propagação e sistemas
Análises e Resultaos Numéricos as Simulações 56 Análises e Resultaos Numéricos as Simulações 4.1 Introução Um moelo e simulação foi utilizao para caracterizar o comportamento o canal e propagação e sistemas
PAG Química Cinética 1.
 1. 2. 3. errata: a reação é em mais de uma etapa, os gráficos devem apresentar pelo menos duas!! 4. 5. Explique se cada uma das alternativas abaixo é correta ou não, para reações químicas que ocorrem
1. 2. 3. errata: a reação é em mais de uma etapa, os gráficos devem apresentar pelo menos duas!! 4. 5. Explique se cada uma das alternativas abaixo é correta ou não, para reações químicas que ocorrem
LCE0182 Química Analítica Quantitativa. Equilíbrio Químico. Wanessa Melchert Mattos
 LCE0182 Química Analítica Quantitativa Equilíbrio Químico Wanessa Melchert Mattos Equilíbrio Químico Estalactites: CaCO 3 (s) + CO 2 (aq) + H 2 O (l) Ca 2+ (aq) + 2 HCO 3- (aq) Estalagmites: Ca 2+ (aq)
LCE0182 Química Analítica Quantitativa Equilíbrio Químico Wanessa Melchert Mattos Equilíbrio Químico Estalactites: CaCO 3 (s) + CO 2 (aq) + H 2 O (l) Ca 2+ (aq) + 2 HCO 3- (aq) Estalagmites: Ca 2+ (aq)
Equilíbrio Químico. Processos Reversíveis e Irreversíveis
 Equilíbrio Químico rocessos Reversíveis e Irreversíveis rocessos Reversíveis e I Algumas reações são irreversíveis, ou seja, uma vez obtios os proutos não há previsão espontânea e regeneração os reagentes.
Equilíbrio Químico rocessos Reversíveis e Irreversíveis rocessos Reversíveis e I Algumas reações são irreversíveis, ou seja, uma vez obtios os proutos não há previsão espontânea e regeneração os reagentes.
CÁLCULO DIFERENCIAL E INTEGRAL I LMAC, MEBIOM, MEFT 1 o SEM. 2010/11 3 a FICHA DE EXERCÍCIOS
 Instituto Superior Técnico Departamento e Matemática Secção e Álgebra e Análise CÁLCULO DIFERENCIAL E INTEGRAL I LMAC, MEBIOM, MEFT o SEM. / 3 a FICHA DE EXERCÍCIOS Primitivação é a operação inversa a
Instituto Superior Técnico Departamento e Matemática Secção e Álgebra e Análise CÁLCULO DIFERENCIAL E INTEGRAL I LMAC, MEBIOM, MEFT o SEM. / 3 a FICHA DE EXERCÍCIOS Primitivação é a operação inversa a
Aula 3 REAÇÕES ELEMENTARES. META Estudar as reações elementares e suas peculiaridades
 REAÇÕES ELEMENTARES Camilo Andrea Angelucci Aula META Estudar as reações elementares e suas peculiaridades OBJETIVOS Ao fi nal desta aula, o aluno deverá: reações Elementares molecularidade de uma reação
REAÇÕES ELEMENTARES Camilo Andrea Angelucci Aula META Estudar as reações elementares e suas peculiaridades OBJETIVOS Ao fi nal desta aula, o aluno deverá: reações Elementares molecularidade de uma reação
é o estudo da velocidade das reações, de como a velocidade varia em função das diferentes condições
 Cinética Química Cinética química é o estudo da velocidade das reações, de como a velocidade varia em função das diferentes condições Fatores que afetam a velocidade da reação: Concentração dos reagentes.
Cinética Química Cinética química é o estudo da velocidade das reações, de como a velocidade varia em função das diferentes condições Fatores que afetam a velocidade da reação: Concentração dos reagentes.
## RESOLUÇÃO DE EXERCÍCIOS DO MATERIAL BÁSICO DE ESTUDO ## , determine t 1 3. Isolando o vetor t : Temos o vetor t procurado!
 ## RESOLUÇÃO DE EXERCÍCIOS DO MATERIAL BÁSICO DE ESTUDO ## LISTA DE EXERCÍCIOS Operações com Vetores na Forma Algébrica [Analítica] no R [página 7] 5) Daos os vetores u i j Inicialmente, antes e substituir
## RESOLUÇÃO DE EXERCÍCIOS DO MATERIAL BÁSICO DE ESTUDO ## LISTA DE EXERCÍCIOS Operações com Vetores na Forma Algébrica [Analítica] no R [página 7] 5) Daos os vetores u i j Inicialmente, antes e substituir
SISTEMAS E SINAIS. Equações Diferenciais e às Diferenças Diagramas de Blocos
 SISTEMS E SINIS Equações Diferenciais e às Diferenças Diagramas e Blocos Introução O iagrama e blocos é uma representação o sistema mais etalhaa o que a resposta impulsional ou as equações iferenciais
SISTEMS E SINIS Equações Diferenciais e às Diferenças Diagramas e Blocos Introução O iagrama e blocos é uma representação o sistema mais etalhaa o que a resposta impulsional ou as equações iferenciais
Química II 1º Exame B 4 de Junho de ª Parte
 Química II 1º Exame B 4 de Junho de 2018 Nome nº MEQ MEBiol Sala Duração: 3h 1: 2: 3: 4: 5: 6: 7: 8: 9: 10: Total: Responda às perguntas 1B a 5B na folha do enunciado Responda às perguntas 6B a 16B em
Química II 1º Exame B 4 de Junho de 2018 Nome nº MEQ MEBiol Sala Duração: 3h 1: 2: 3: 4: 5: 6: 7: 8: 9: 10: Total: Responda às perguntas 1B a 5B na folha do enunciado Responda às perguntas 6B a 16B em
PQI 2321 Tópicos de Química para Engenharia Ambiental I
 PQI 2321 Tópicos de Química para Engenharia Ambiental I Aulas 14 e 15 Balanços de massa em processos com reações químicas. Cinética química. Ordem de reação Prof. Antonio Carlos S. C. Teixeira Centro de
PQI 2321 Tópicos de Química para Engenharia Ambiental I Aulas 14 e 15 Balanços de massa em processos com reações químicas. Cinética química. Ordem de reação Prof. Antonio Carlos S. C. Teixeira Centro de
4Parte. Relatórios das atividades laboratoriais OBJETIVO GERAL. Parte I Preparação da atividade laboratorial
 Relatórios as ativiaes laboratoriais Relatórios as ativiaes laboratoriais AL 1.1 QUEDA LIVRE: FORÇA GRAVÍTICA E ACELERAÇÃO DA GRAVIDADE OBJETIVO GERAL Determinar a aceleração a graviae num movimento e
Relatórios as ativiaes laboratoriais Relatórios as ativiaes laboratoriais AL 1.1 QUEDA LIVRE: FORÇA GRAVÍTICA E ACELERAÇÃO DA GRAVIDADE OBJETIVO GERAL Determinar a aceleração a graviae num movimento e
III Corpos rígidos e sistemas equivalentes de forças
 III Corpos rígios e sistemas equivalentes e forças Nem sempre é possível consierar toos os corpos como partículas. Em muitos casos, as imensões os corpos influenciam os resultaos e everão ser tias em conta.
III Corpos rígios e sistemas equivalentes e forças Nem sempre é possível consierar toos os corpos como partículas. Em muitos casos, as imensões os corpos influenciam os resultaos e everão ser tias em conta.
1.2. (C) RESPOSTA INCORRECTA... (A) Correcto. Há iões magnésio e cloro na água do mar, logo há MgCl
 1. Leia atentamente as informações seguintes. Mais e % a superfície a Terra está coberta por água, e 9% essa água encontra-se nos oceanos. A água os oceanos é uma solução aquosa extremamente complexa (Tabelas
1. Leia atentamente as informações seguintes. Mais e % a superfície a Terra está coberta por água, e 9% essa água encontra-se nos oceanos. A água os oceanos é uma solução aquosa extremamente complexa (Tabelas
QUESTÕES PROPOSTAS SINAIS E ONDAS (pp )
 Física Domínio Onas e eletromagnetismo QUESTÕES PROPOSTAS 4.. SINAIS E ONDAS (pp. 51-56) 4. Uma fonte emite onas sonoras e 00 Hz. A uma istância e 0 m a fonte está instalao um aparelho que regista a chegaa
Física Domínio Onas e eletromagnetismo QUESTÕES PROPOSTAS 4.. SINAIS E ONDAS (pp. 51-56) 4. Uma fonte emite onas sonoras e 00 Hz. A uma istância e 0 m a fonte está instalao um aparelho que regista a chegaa
PARTE III Balanço de massa
 PARTE III Balanço de massa 1. Procedimentos para cálculo de Balanço de Massa i. Escolha como base de cálculo uma quantidade ou vazão de uma das correntes do processo. ii. Desenhe o fluxograma e rotule
PARTE III Balanço de massa 1. Procedimentos para cálculo de Balanço de Massa i. Escolha como base de cálculo uma quantidade ou vazão de uma das correntes do processo. ii. Desenhe o fluxograma e rotule
Propagação e Antenas Teste 15 de Janeiro de Duração: 1 hora 30 minutos 15 de Janeiro de 2019
 Propagação e Antenas Teste 5 e Janeiro e 09 Docente Responsável: Prof Carlos R Paiva Duração: hora 30 minutos 5 e Janeiro e 09 Ano Lectivo: 08 / 09 SEGUNDO TESTE Uma placa ieléctrica e iamante, com um
Propagação e Antenas Teste 5 e Janeiro e 09 Docente Responsável: Prof Carlos R Paiva Duração: hora 30 minutos 5 e Janeiro e 09 Ano Lectivo: 08 / 09 SEGUNDO TESTE Uma placa ieléctrica e iamante, com um
É O ESTUDO DAS VELOCIDADES E MECANISMOS DAS REAÇÕES QUÍMICAS MECANISMO: SEQUÊNCIA DETALHADA DE ETAPAS SIMPLES, ELEMENTARES
 CINÉTICA QUÍMICA É O ESTUDO DAS VELOCIDADES E MECANISMOS DAS REAÇÕES QUÍMICAS MECANISMO: SEQUÊNCIA DETALHADA DE ETAPAS SIMPLES, ELEMENTARES REAÇÃO GLOBAL: MOSTRA APENAS A MODIFICAÇÃO GLOBAL VELOCIDADE
CINÉTICA QUÍMICA É O ESTUDO DAS VELOCIDADES E MECANISMOS DAS REAÇÕES QUÍMICAS MECANISMO: SEQUÊNCIA DETALHADA DE ETAPAS SIMPLES, ELEMENTARES REAÇÃO GLOBAL: MOSTRA APENAS A MODIFICAÇÃO GLOBAL VELOCIDADE
Acadêmico(a) Turma: Capítulo 4: Derivada. A derivada por ser entendida como taxa de variação instantânea de uma função e expressa como:
 1 Acaêmico(a) Turma: Capítulo 4: Derivaa 4.1 Definição A erivaa por ser entenia como taxa e variação instantânea e uma função e expressa como: f (x) = y = y x Eq. 1 Assim f (x) é chamao e erivaa a função
1 Acaêmico(a) Turma: Capítulo 4: Derivaa 4.1 Definição A erivaa por ser entenia como taxa e variação instantânea e uma função e expressa como: f (x) = y = y x Eq. 1 Assim f (x) é chamao e erivaa a função
Cinética Química 17/04/17. V m h. Prof. Xuxu. Velocidade das reações químicas. Velocidade das reações químicas. Velocidade Média. Hora da saída: 11:45
 Seja Bem-indo a Goiânia elocidade Média Cinética Química Hora da saída: 11:45 Δd 40km m 40 km Δt 1h h Distância Hidrolândia: 40 km Seja Bem-indo a Hidrolândia Prof. Xuxu Hora da chegada: 12:45 elocidade
Seja Bem-indo a Goiânia elocidade Média Cinética Química Hora da saída: 11:45 Δd 40km m 40 km Δt 1h h Distância Hidrolândia: 40 km Seja Bem-indo a Hidrolândia Prof. Xuxu Hora da chegada: 12:45 elocidade
Capítulo by Pearson Education
 QUÍMICA A Ciência Central 9ª Edição Cinética química David P. White Fatores que afetam a velocidade de reações A cinética é o estudo da velocidade na qual as reações químicas ocorrem. Existem quatro fatores
QUÍMICA A Ciência Central 9ª Edição Cinética química David P. White Fatores que afetam a velocidade de reações A cinética é o estudo da velocidade na qual as reações químicas ocorrem. Existem quatro fatores
Química C Semiextensivo V. 3
 Semiextensivo Exercícios 0) D CH 4 + O CO + H O mol -------- mol elocidade de consumo de CH 4 = velocidade de formação de CO em 00, min x mol 60 min (uma hora) x = 0,0 60 x = 0,6 mol 0) A 0) D 6CO + 6H
Semiextensivo Exercícios 0) D CH 4 + O CO + H O mol -------- mol elocidade de consumo de CH 4 = velocidade de formação de CO em 00, min x mol 60 min (uma hora) x = 0,0 60 x = 0,6 mol 0) A 0) D 6CO + 6H
Extensivo Física C V. 1
 Extensivo Física V Exercícios 0) Veraeira Veraeira Veraeira N o e próton N o e elétrons Veraeira Falsa Fornecer elétrons Veraeira Falsa Possui, porém, a mesma quantiae e cargas positivas e negativas Falsa
Extensivo Física V Exercícios 0) Veraeira Veraeira Veraeira N o e próton N o e elétrons Veraeira Falsa Fornecer elétrons Veraeira Falsa Possui, porém, a mesma quantiae e cargas positivas e negativas Falsa
PQI 3221 Cinética Química e Processos Ambientais
 PQI 3221 inética Química e Processos Ambientais Aula 14 Balanços de massa em processos com reações químicas. inética química. Ordem de reação Prof. Antonio arlos S.. Teixeira entro de Engenharia de Sistemas
PQI 3221 inética Química e Processos Ambientais Aula 14 Balanços de massa em processos com reações químicas. inética química. Ordem de reação Prof. Antonio arlos S.. Teixeira entro de Engenharia de Sistemas
QUESTÕES COMENTADAS DE MECÂNICA
 QUESTÕES COMENTDS DE MECÂNIC Prof. Inácio Benvegnú Morsch CEMCOM Depto. Eng. Civil UFGS ) Calcule as reações em para a viga isostática representaa na figura () kn/m,5 m Solução: Este cálculo fica simplificao
QUESTÕES COMENTDS DE MECÂNIC Prof. Inácio Benvegnú Morsch CEMCOM Depto. Eng. Civil UFGS ) Calcule as reações em para a viga isostática representaa na figura () kn/m,5 m Solução: Este cálculo fica simplificao
Curso Científico-Humanístico de Ciências e Tecnologias Disciplina de Física e Química A 10ºAno
 grupamento e Escolas João a Silva Correia DEPTMENTO DE CÊNCS NTS E EXPEMENTS Curso Científico-Humanístico e Ciências e Tecnologias Disciplina e Física e Química 0ºno FCH DE TBLHO Energia e fenómenos elétricos.
grupamento e Escolas João a Silva Correia DEPTMENTO DE CÊNCS NTS E EXPEMENTS Curso Científico-Humanístico e Ciências e Tecnologias Disciplina e Física e Química 0ºno FCH DE TBLHO Energia e fenómenos elétricos.
Faculdade de Educação, Ciências e Letras dos Inhamuns FECLIN Coordenação de Química Disciplina Química Geral II Professor: NOTA DE AULA
 Faculdade de Educação, Ciências e Letras dos Inhamuns FECLIN Coordenação de Química Disciplina Química Geral II Professor: NOTA DE AULA CINETICA QUÍMICA Velocidade média de uma reação Ex.1. Um balão contendo
Faculdade de Educação, Ciências e Letras dos Inhamuns FECLIN Coordenação de Química Disciplina Química Geral II Professor: NOTA DE AULA CINETICA QUÍMICA Velocidade média de uma reação Ex.1. Um balão contendo
MECANISMOS a descrição microscópica da reação; são propostos com base na lei de velocidade.
 MECANISMOS a descrição microscópica da reação; são propostos com base na lei de velocidade. 1 Mecanismo: como os reagentes são convertidos em produtos, no nível molecular. LEI DE VELOCIDADE ----> MECANISMO
MECANISMOS a descrição microscópica da reação; são propostos com base na lei de velocidade. 1 Mecanismo: como os reagentes são convertidos em produtos, no nível molecular. LEI DE VELOCIDADE ----> MECANISMO
as concentrações dos reagentes, a temperatura na qual a reação ocorre e a presença de um catalisador.
 CINÉTICA QUÍMICA A cinética é o estudo da velocidade na qual as reações químicas ocorrem. Existem quatro fatores importantes que afetam as velocidades das reações: o estado físico do reagente, as concentrações
CINÉTICA QUÍMICA A cinética é o estudo da velocidade na qual as reações químicas ocorrem. Existem quatro fatores importantes que afetam as velocidades das reações: o estado físico do reagente, as concentrações
Regras de Derivação Notas de aula relativas ao mês 11/2003 Versão de 13 de Novembro de 2003
 Regras e Derivação Notas e aula relativas ao mês 11/2003 Versão e 13 e Novembro e 2003 Já sabemos a efinição formal e erivaa, a partir o limite e suas interpretações como: f f a + h) f a) a) = lim, 1)
Regras e Derivação Notas e aula relativas ao mês 11/2003 Versão e 13 e Novembro e 2003 Já sabemos a efinição formal e erivaa, a partir o limite e suas interpretações como: f f a + h) f a) a) = lim, 1)
BIOENGENHARIA I PROF. MARCELO HENRIQUE ENGENHARIA DE ALIMENTOS
 BIOENGENHARIA I PROF. MARCELO HENRIQUE ENGENHARIA DE ALIMENTOS Introdução à Cinética das reações químicas O termo cinética está relacionado a movimento quando se pensa nele a partir de seu conceito físico.
BIOENGENHARIA I PROF. MARCELO HENRIQUE ENGENHARIA DE ALIMENTOS Introdução à Cinética das reações químicas O termo cinética está relacionado a movimento quando se pensa nele a partir de seu conceito físico.
P4 - PROVA DE QUÍMICA GERAL 30/06/12
 P4 - POVA DE QUÍMICA GEAL 30/06/ Nome: Nº de Matrícula: GABAITO Turma: Assinatura: Questão Valor Grau evisão a,5 a,5 3 a,5 4 a,5 Total 0,0 Constantes e equações: 73,5 K = 0 C = 0,08 atm L mol - K - = 8,345
P4 - POVA DE QUÍMICA GEAL 30/06/ Nome: Nº de Matrícula: GABAITO Turma: Assinatura: Questão Valor Grau evisão a,5 a,5 3 a,5 4 a,5 Total 0,0 Constantes e equações: 73,5 K = 0 C = 0,08 atm L mol - K - = 8,345
cas AULA 5 es Quími rmaçõ o sfo Tr C0307
 BC0307 Transfo ormaçõe es Químicas AULA 5 - Combustíveis (Termodinâmica x Cinética); - Por que uma reação ocorre? - Qual a velocidade d da reação? - Cinética: leis de velocidade, ordem de reação e sua
BC0307 Transfo ormaçõe es Químicas AULA 5 - Combustíveis (Termodinâmica x Cinética); - Por que uma reação ocorre? - Qual a velocidade d da reação? - Cinética: leis de velocidade, ordem de reação e sua
LCE-108 Química Inorgânica e Analítica. Equilíbrio Químico. Wanessa Melchert Mattos
 LCE-108 Química Inorgânica e Analítica Equilíbrio Químico Wanessa Melchert Mattos Equilíbrio Químico Estalactites: CaCO 3 (s) + CO 2 (aq) + H 2 O (l) Ca 2+ (aq) + 2 HCO 3- (aq) Estalagmites: Ca 2+ (aq)
LCE-108 Química Inorgânica e Analítica Equilíbrio Químico Wanessa Melchert Mattos Equilíbrio Químico Estalactites: CaCO 3 (s) + CO 2 (aq) + H 2 O (l) Ca 2+ (aq) + 2 HCO 3- (aq) Estalagmites: Ca 2+ (aq)
Exemplo 2: A baixas temperaturas a lei de velocidade da reação A + B C + D é r A =
 Determine a energia de ativação desta reação. Exemplo 1: Para a reação SO 2 + 1 2 O 2 SO 3, se a velocidade de formação de SO 3 é de 2 mol m -3 s -1, então as velocidades de desaparecimento de SO 2, de
Determine a energia de ativação desta reação. Exemplo 1: Para a reação SO 2 + 1 2 O 2 SO 3, se a velocidade de formação de SO 3 é de 2 mol m -3 s -1, então as velocidades de desaparecimento de SO 2, de
A Regra da Cadeia Continuação das notas de aula do mês 11/03 Versão de 20 de Novembro de 2003
 A Regra a Caeia Continuação as notas e aula o mês /03 Versão e 20 e Novembro e 2003 Agora queremos entener o que acontece com a erivaa e uma composição e funções. Antes e mais naa, lembremos a notação
A Regra a Caeia Continuação as notas e aula o mês /03 Versão e 20 e Novembro e 2003 Agora queremos entener o que acontece com a erivaa e uma composição e funções. Antes e mais naa, lembremos a notação
Pi Principais i i Tópicos Abordados dd
 BC0307 Transfo ormaçõe es Químicas Pi Principais i i Tópicos Abordados dd Combustíveis: Termodinâmica vs. Cinética; Por que uma reação ocorre e quanto rápida ela é; Leis de velocidade, ordem de reação
BC0307 Transfo ormaçõe es Químicas Pi Principais i i Tópicos Abordados dd Combustíveis: Termodinâmica vs. Cinética; Por que uma reação ocorre e quanto rápida ela é; Leis de velocidade, ordem de reação
Curso de Engenharia Civil
 Curso e Engenharia Civil Escoamento ao reor e corpos imersos: teoria a camaa limite CC75D Mecânica os fluios Prof. Fernano Oliveira e Anrae Definição e camaa limite É a camaa o escoamento na região ajacente
Curso e Engenharia Civil Escoamento ao reor e corpos imersos: teoria a camaa limite CC75D Mecânica os fluios Prof. Fernano Oliveira e Anrae Definição e camaa limite É a camaa o escoamento na região ajacente
FGE Eletricidade I
 FGE0270 - Eletriciae I 3 a Lista e eercícios 1. Duas granes placas conutoras, paralelas entre si e separaas por uma istância e 12 cm, têm cargas iguais e e sinais opostos nas faces ue se efrontam. Um elétron
FGE0270 - Eletriciae I 3 a Lista e eercícios 1. Duas granes placas conutoras, paralelas entre si e separaas por uma istância e 12 cm, têm cargas iguais e e sinais opostos nas faces ue se efrontam. Um elétron
Projeto 3. 8 de abril de y max y min. Figura 1: Diagrama de um cabo suspenso.
 Cabos suspensos Projeto 3 8 e abril e 009 A curva escrita por um cabo suspenso pelas suas etremiaes é enominaa curva catenária. y ma y min 0 Figura 1: Diagrama e um cabo suspenso. A equação que escreve
Cabos suspensos Projeto 3 8 e abril e 009 A curva escrita por um cabo suspenso pelas suas etremiaes é enominaa curva catenária. y ma y min 0 Figura 1: Diagrama e um cabo suspenso. A equação que escreve
Cinética Química. a b c p q r. As concentrações dos reagentes são funções do tempo:
 Cinética Química A cinética química estuda a evolução das reacções químicas no tempo a b c p q r A+ B+ C+... P+ Q+ R+... Concentrações: [A],[B],[C],... Coeficientes estequiométricos: a,b,c,... Constantes
Cinética Química A cinética química estuda a evolução das reacções químicas no tempo a b c p q r A+ B+ C+... P+ Q+ R+... Concentrações: [A],[B],[C],... Coeficientes estequiométricos: a,b,c,... Constantes
EQUILÍBRIO QUÍMICO Equilíbrio químico numa mistura:
 Equilíbrio químico numa mistura: Considere a seguinte reação: A + B C a) Se G mist < 0 reação expontânea (ocorre até atingir o equilíbrio G min ) b) Se G mist > 0 reação ocorre no sentido inverso. Para
Equilíbrio químico numa mistura: Considere a seguinte reação: A + B C a) Se G mist < 0 reação expontânea (ocorre até atingir o equilíbrio G min ) b) Se G mist > 0 reação ocorre no sentido inverso. Para
RC1- A reação abaixo foi feta num reator batelada, obtendo-se os dados da tabela abaixo: 2 N 2 O 4 + O 2
 33 - Exercícios resolvidos -cinética - reação abaixo foi feta num reator batelada, obtendo-se os dados da tabela abaixo: N O 5 N O + O Ela pode ser de primeira ou segunda ordem alcule a energia de ativação
33 - Exercícios resolvidos -cinética - reação abaixo foi feta num reator batelada, obtendo-se os dados da tabela abaixo: N O 5 N O + O Ela pode ser de primeira ou segunda ordem alcule a energia de ativação
Aula 7- Metodologia de verificação da segurança do EC7 para estruturas de suporte rígidas. Aplicações.
 Aula 7- Metoologia e verificação a segurança o EC7 para estruturas e suporte rígias. Aplicações. Paulo Coelho - FCTUC Mestrao em Engª. Civil - Construções Civis ESTG/IPLeiria Verificação a Segurança: M.
Aula 7- Metoologia e verificação a segurança o EC7 para estruturas e suporte rígias. Aplicações. Paulo Coelho - FCTUC Mestrao em Engª. Civil - Construções Civis ESTG/IPLeiria Verificação a Segurança: M.
Universidade Federal do Paraná Setor de Ciências Exatas Departamento de Física. Referências bibliográficas: H S T.
 Universiae eeral o Paraná Setor e Ciências Eatas Departamento e ísica ísica III Prof. Dr. Ricaro Luiz Viana Referências bibliográficas: H. -4 S. -5 T. 18- Aula Lei e Coulomb Charles Augustin e Coulomb
Universiae eeral o Paraná Setor e Ciências Eatas Departamento e ísica ísica III Prof. Dr. Ricaro Luiz Viana Referências bibliográficas: H. -4 S. -5 T. 18- Aula Lei e Coulomb Charles Augustin e Coulomb
4. FREQUÊNCIAS NATURAIS E CARGAS CRÍTICAS
 4. FREQUÊNCIAS NATURAIS E CARGAS CRÍTICAS O presente capítulo apresenta a análise linear e vigas e seção aberta e parees elgaas simplesmente apoiaas, mostrano o processo e iscretização por Galerkin e as
4. FREQUÊNCIAS NATURAIS E CARGAS CRÍTICAS O presente capítulo apresenta a análise linear e vigas e seção aberta e parees elgaas simplesmente apoiaas, mostrano o processo e iscretização por Galerkin e as
Equilíbrio Químico. É uma reação reversível na qual a velocidade da reação direta é igual à velocidade da reação inversa.
 Equilíbrio Químico É uma reação reversível na qual a velocidade da reação direta é igual à velocidade da reação inversa. CLASSIFICAÇÃO DAS REAÇÕES Uma reação química diz-se completa quando leva ao esgotamento
Equilíbrio Químico É uma reação reversível na qual a velocidade da reação direta é igual à velocidade da reação inversa. CLASSIFICAÇÃO DAS REAÇÕES Uma reação química diz-se completa quando leva ao esgotamento
"Introdução à Mecânica do Dano e Fraturamento" Parte I. São Carlos, outubro de 2000
 "Introução à Mecânica o Dano e Fraturamento" Texto n.3 : FUNDAMENTOS DA TERMODINÂMICA DOS SÓLIDOS Parte I São Carlos, outubro e 2000 Sergio Persival Baroncini Proença - Funamentos a termoinámica os sólios
"Introução à Mecânica o Dano e Fraturamento" Texto n.3 : FUNDAMENTOS DA TERMODINÂMICA DOS SÓLIDOS Parte I São Carlos, outubro e 2000 Sergio Persival Baroncini Proença - Funamentos a termoinámica os sólios
Equilíbrio Químico. Aulas 6. Equilíbrio Químico: Reações reversíveis. Equação de equilíbrio. Princípio de Le Chatelier
 Aulas 6 Equilíbrio Químico: Reações reversíveis Equação de equilíbrio. Princípio de Le Chatelier Reações Químicas REACÇÕES QUÍMICAS podem ser Irreversíveis Reversíveis CH 4 (g) + O 2 (g) CO 2 (g) + H 2
Aulas 6 Equilíbrio Químico: Reações reversíveis Equação de equilíbrio. Princípio de Le Chatelier Reações Químicas REACÇÕES QUÍMICAS podem ser Irreversíveis Reversíveis CH 4 (g) + O 2 (g) CO 2 (g) + H 2
OLIMPÍADAS DE FÍSICA. Selecção para as provas internacionais. 19 de Maio de Prova Teórica
 OLIMPÍADAS DE FÍSICA Selecção para as provas internacionais 19 e Maio e 000 Prova Teórica Duração a prova: 3H I. Vários tópicos Este problema é constituío por várias alíneas sem qualquer ligação entre
OLIMPÍADAS DE FÍSICA Selecção para as provas internacionais 19 e Maio e 000 Prova Teórica Duração a prova: 3H I. Vários tópicos Este problema é constituío por várias alíneas sem qualquer ligação entre
CURSO APOIO FÍSICA RESOLUÇÃO 20 /
 FÍSICA CURSO APOIO 0. Um veículo trafega por uma avenia retilínea e o gráfico mostra a variação o móulo e sua velociae, em função o tempo, em três trechos. Os intervalos e tempo ecorrios em caa um os trechos
FÍSICA CURSO APOIO 0. Um veículo trafega por uma avenia retilínea e o gráfico mostra a variação o móulo e sua velociae, em função o tempo, em três trechos. Os intervalos e tempo ecorrios em caa um os trechos
Cinética Química. Classe: 2 3 a série. Exercícios Complementares - Recuperação Paralela
 Ensino Médio Exercícios Complementares - Recuperação Paralela Classe: 2 3 a série QUÍMICA Cinética Química 1) (Ufmg) Uma chama queima metano completamente, na razão de 2L/min, medidos nas CNTP. O calor
Ensino Médio Exercícios Complementares - Recuperação Paralela Classe: 2 3 a série QUÍMICA Cinética Química 1) (Ufmg) Uma chama queima metano completamente, na razão de 2L/min, medidos nas CNTP. O calor
EQUILÍBRIO DA ALAVANCA
 EQUILÍBRIO DA ALAVANCA INTRODUÇÃO A Alavanca é uma as máquinas mais simples estuaas na Grécia antiga. Ela consiste e uma barra rígia que gira em torno e um ponto fixo enominao fulcro. A balança e ois braços
EQUILÍBRIO DA ALAVANCA INTRODUÇÃO A Alavanca é uma as máquinas mais simples estuaas na Grécia antiga. Ela consiste e uma barra rígia que gira em torno e um ponto fixo enominao fulcro. A balança e ois braços
LISTA3 - PROCESSOS ESTOCÁSTICOS (CE 211) Prof. Benito Olivares Aguilera 2 o Sem./ 2009
 UNIVERSIDADE FEDERAL DO PARANÁ SETOR DE CIÊNCIAS EXATAS DEPTO. DE ESTATÍSTICA LISTA3 - PROCESSOS ESTOCÁSTICOS (CE ) Prof. Benito Olivares Aguilera o Sem./ 9. Suponha que o último censo inica que as pessoas
UNIVERSIDADE FEDERAL DO PARANÁ SETOR DE CIÊNCIAS EXATAS DEPTO. DE ESTATÍSTICA LISTA3 - PROCESSOS ESTOCÁSTICOS (CE ) Prof. Benito Olivares Aguilera o Sem./ 9. Suponha que o último censo inica que as pessoas
Com base nos dados acima, responda as questões propostas (cuidado com as unidades):
 Curso: Farmácia Atenção, dois dos exercícios da lista entrarão na P1. Concentrações: 01. Em uma rápida pesquisa pela internet é possível achar diversas receitas relacionadas à preparação de alguns cosméticos
Curso: Farmácia Atenção, dois dos exercícios da lista entrarão na P1. Concentrações: 01. Em uma rápida pesquisa pela internet é possível achar diversas receitas relacionadas à preparação de alguns cosméticos
ocorridas na concentração dos participantes das reações em função do tempo:
 CINÉTICA QUÍMICA Fala Gás Nobre! Preparado para reagir? Então vamos para mais um resumo de química! Você já parou pra pensar, que a velocidade com que as reações químicas acontecem, podem estar relacionadas
CINÉTICA QUÍMICA Fala Gás Nobre! Preparado para reagir? Então vamos para mais um resumo de química! Você já parou pra pensar, que a velocidade com que as reações químicas acontecem, podem estar relacionadas
QUÍMICA 3 - APOSTILA 3. Prof. Msc João Neto
 QUÍMICA 3 - APOSTILA 3 Prof. Msc João Neto CINÉTICA QUÍMICA parte da Química que estuda a velocidade ou rapidez das reações. Prof. Msc João Neto Produtos (Formados) A + B AB Reagentes (Consumidos) Prof.
QUÍMICA 3 - APOSTILA 3 Prof. Msc João Neto CINÉTICA QUÍMICA parte da Química que estuda a velocidade ou rapidez das reações. Prof. Msc João Neto Produtos (Formados) A + B AB Reagentes (Consumidos) Prof.
QUESTÕES PROPOSTAS RESOLUÇÃO POR ETAPAS
 Fisica 1.. C Da Terra à Lua Pág. 30A 4.1. (C) As forças»f 1 e»f têm sentios contrários. 4.. (B) O bloco terá nas uas situações movimento uniformemente acelerao. Na situação A, como as forças têm o mesmo
Fisica 1.. C Da Terra à Lua Pág. 30A 4.1. (C) As forças»f 1 e»f têm sentios contrários. 4.. (B) O bloco terá nas uas situações movimento uniformemente acelerao. Na situação A, como as forças têm o mesmo
Determinação da abundância natural do isotópico 40 K
 Determinação a abunância natural o isotópico 40 I. Introução O potássio natural contem os isótopos 39, 40 e 41, os quais só o 40 é raioactivo. O objectivo este trabalho é meir a abunância natural o isótopo
Determinação a abunância natural o isotópico 40 I. Introução O potássio natural contem os isótopos 39, 40 e 41, os quais só o 40 é raioactivo. O objectivo este trabalho é meir a abunância natural o isótopo
METAIS COMO CATALIZADORES METAIS AMBIENTE E VIDA
 METAIS COMO CATALIZADORES METAIS AMBIENTE E VIDA Se somarmos as duas equações, a equação global é O bromo não se consome na reacção, sendo regenerado indefinidamente 2 Decomposição do peróxido de hidrogénio
METAIS COMO CATALIZADORES METAIS AMBIENTE E VIDA Se somarmos as duas equações, a equação global é O bromo não se consome na reacção, sendo regenerado indefinidamente 2 Decomposição do peróxido de hidrogénio
Cinética Química. Cinética Química: Velocidade média, instantânea e inicial. Lei cinética. Fatores que influenciam a velocidade.
 Cinética Química IV Cinética Química: Velocidade média, instantânea e inicial. Lei cinética. Fatores que influenciam a velocidade. Mecanismos reacionais. Catálise. Cinética Química Cinética Química é a
Cinética Química IV Cinética Química: Velocidade média, instantânea e inicial. Lei cinética. Fatores que influenciam a velocidade. Mecanismos reacionais. Catálise. Cinética Química Cinética Química é a
Receptor Ótimo. Implementação do receptor ótimo baseada em Filtro Casado. s 1 (t M t) a M. b 1. s M (t M t) Selecionar Maior. (t) + w(t) r(t) = s i
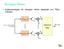 Receptor Ótimo Implementação o receptor ótimo baseaa em Filtro Casao s (t M t) t t M b r(t) s i (t) + w(t) a Selecionar m ˆ m i Maior s M (t M t) t t M a M b M Receptor Ótimo Implementação o receptor ótimo
Receptor Ótimo Implementação o receptor ótimo baseaa em Filtro Casao s (t M t) t t M b r(t) s i (t) + w(t) a Selecionar m ˆ m i Maior s M (t M t) t t M a M b M Receptor Ótimo Implementação o receptor ótimo
Cinética Química. c) A opção (C) está correta. B 3+ e B 4+ não aparecem na reação global, portanto, são intermediários da reação.
 Capítulo 6 Cinética Química 1. (ITA) Considere o seguinte mecanismo de reação genérica: A 4+ + B 2+ A 3+ + B 3+ (etapa lenta) A 4+ + B 3+ A 3+ + B 4+ (etapa rápida) C + + B 4+ C 3+ + B 2+ (etapa rápida)
Capítulo 6 Cinética Química 1. (ITA) Considere o seguinte mecanismo de reação genérica: A 4+ + B 2+ A 3+ + B 3+ (etapa lenta) A 4+ + B 3+ A 3+ + B 4+ (etapa rápida) C + + B 4+ C 3+ + B 2+ (etapa rápida)
