Olimpíada Brasileira de Química
|
|
|
- Leila Fragoso Azambuja
- 7 Há anos
- Visualizações:
Transcrição
1 Olimpíada Brasileira de Química Exame aplicado em Problema 1 Em um cadinho foi colocada uma mistura de carbonato de sódio decahidratado e carbonato ácido de sódio. Após aquece-la na mufla restou unicamente carbonato de sódio, verificando-se uma perda total de peso na ordem de 16 gramas. Se a quantidade de CO 2 seco desprendido do cadinho foi de 4,4 g e as reações ocorridas foram: Na 2 CO 3.10 H 2 O Na 2 CO H 2 O 2 NaHCO 3 Na 2 CO 3 + H 2 O + CO 2 Determine a quantidade, em gramas, de Na 2 CO 3.10 H 2 O existente na mistura. DADOS: M (H) =1 g/mol; M (C) = 12 g/mol; M (O) = 16 g/mol; M (Na) = 23 g/mol Problema 2 O hidrogênio é preparado em grande escala por diversos métodos. a. Passando vapor dágua sobre coque, C, aquecido ao rubro obtém-se gás de água, que é uma mistura de CO e H 2. Trata-se de um combustível industrial importante, pois é fácil de obter e queima liberando grande quantidade de calor. Escreva as equações químicas destes dois processos. b. Hidretos salinos, em contacto com a água, também produzem hidrogênio: LiH + H 2 O LiOH + H 2 Descreva e ilustre com exemplos: - hidretos iônicos ou salinos. - hidretos covalentes ou moleculares. - hidretos metálicos ou intersticiais. c. Mostre através da eletrólise de soluções de NaOH e KOH, numa célula com ânodos de níquel e cátodos de ferro, como o hidrogênio pode ser obtido. Escreva as semi-reações do ânodo e cátodo e a reação total. d. Em refinarias de petróleo, misturas naturais de hidrocarbonetos de elevada massa molar, tais como nafta e óleo combustível, são submetidas ao processo de craqueamento para formar novas misturas com hidrocarbonetos de menor massa molar que podem ser usados como gasolina. O hidrogênio é um subproduto deste processo. Descreva-o e apresente as reações. Problema 3 1 de 5 01/11/12 10:13
2 a. Encontre a distância I-I em cada um dos compostos isoméricos C 2 H 2 I 2. Raios de ligações covalentes, C - I = 2,10 pm; C = C = 1,33 pm; pm = m b. Nas moléculas ocorrem ligações de hidrogênio intermoleculares (pontes de hidrogênio). Em quais delas estas ligações são mais estáveis? Justifique sua resposta. c. O ângulo de ligação em SnCl 2 é 120 o e o ângulo em I 3 - é 180 o. Explique as diferenças, em termos de repulsões eletrônicas. d. Determine a geometria de cada uma das seguintes espécies e hibridações de cada átomo central: PbCl 4, PF 6 - e AlH 3 e. Para cada um dos pares indicados, qual espécie deve apresentar maior ângulo de ligação? Justifique sua resposta. I) H 2 O e NH 3 ; II) SF 2 e BeF 2 Problema 4 Dependendo do meio onde ocorre a reação, os alcenos podem sofrer oxidação branda ou enérgica. Assim, mostre por equações, o produto da reação do 2-metilpenteno-2 com: 1a. KMnO 4 em meio básico e água. 1b. KMnO 4 em meio ácido. 1c. ozônio e água. 2a. Na reação 1c são obtidos 2 (dois) produtos, que tipo de isomeria eles apresentam? 2b. Escreva as reações que representam processos através dos quais podem ser produzidos, separadamente, os produtos da reação 1c. 2 de 5 01/11/12 10:13
3 Problema 5 Sejam os compostos orgânicos: a. Qual a função e dê os nomes, segundo a nomenclatura IUPAC, para cada substância. b. Cite os principais usos do composto III. c. Mostre como se prepara o composto I através da redução de cloretos de ácidos. d. Complete as reações: Problema 6 Os dados abaixo foram obtidos para a reação de 1 a ordem A Produtos Medida a b c d e f Tempo(min) [A] mols/l 0,5 0,36 0,26 0,19 0,14 0,10 Log [A] - 0,301-0,444-0,585-0,721-0,854-1,0 a. Calcule a velocidade instantânea em 17,5 min, se o volume é constante. A tangente à curva, neste ponto, possui coordenadas (8,4; 0,25) e (29,4; 0,05). 3 de 5 01/11/12 10:13
4 b. Calcule a velocidade aproximada entre 5 e 10 min (pontos b e c) e entre 20 e 25 minutos (pontos e, f). c. Para este tipo de reação, estudos mostram que na plotação de Log [A] versus tempo (linha reta) a inclinação a = - k/2,303 (y = ax + b) onde k = constante de velocidade. Calcule a constante de velocidade para esta reação. Problema 7 A figura representa um equipamento montado para se verificar uma reação de óxido-redução. A experiência tem início com a montagem das vidrarias. Inicialmente, colocam-se 6,5 g de zinco no utensílio AA, completando o volume com água até um nível onde a haste da vidraria AB possa ficar submersa. Montada a primeira parte do equipamento e estando as vidrarias devidamente presas ao suporte, faz-se a ligação deste com um tubo horizontal onde há CaCl 2 anidro. Antes de fazer a conexão com a terceira parte do instrumento, introduz-se 1 ml de CuSO 4.5H 2 O de concentração 3 mol/l através da vidraria AA e, após encher na vidraria AA com H 2 SO 4, lentamente, abre-se a torneira. 1. Identifique os utensílios assinalados como AA, AB, AC, AD e cite suas principais formas de utilização em um laboratório. 2. Após gotejar H 2 SO 4 no recipiente AB observa-se evolução de um gás. 2a. Qual a composição deste gás? 2b. Escreva a equação desta reação. 2c. Se há bastante ácido, qual a máxima quantidade, em gramas, do gás produzido. 2d. Por que a haste do utensílio AA deve ficar submersa nágua? 3. Após fluir durante alguns minutos, o gás atravessa o tubo horizontal. Ao acender um fósforo em sua extremidade ocorre uma leve explosão. Repetir, outras vezes, esta ação até que não mais se observe explosões. 3a. Qual a causa da explosão? 3b. O que restou no interior deste tubo? 4 de 5 01/11/12 10:13
5 3c. Qual a função do CaCl 2 presente neste tubo? 4. Conecta-se, agora, a terceira parte do instrumento, a vidraria AC, que tem no seu interior 1,6 g de CuO. Aquecer o CuO até total eliminação desta substância e conseqüente formação de uma substância vermelha no interior da vidraria. 4a. Que alterações o calor provoca sobre a substância CuO? 4b. Qual a ação do gás gerado no recipiente AB sobre o CuO? 4c. Se a aparelhagem indicada demonstra um processo de óxido-redução, descreva-o e indique os agentes oxidante e redutor. DADOS: M (H) = 1 g/mol; M (Zn) = 65 g/mol. Problema 8 A figura mostra a aparelhagem utilizada para observar a eletrólise de uma solução aquosa de iodeto de potássio. Uma solução de KI é posta no tubo em U até atingir, aproximadamente, ¾ de seu volume. Após ligar a fonte de corrente contínua, observa-se a ocorrência da eletrólise durante 15 minutos. No eletrodo onde bolhas de gás são formadas, colocam-se 4 (quatro) gotas de fenolftaleína. a. Qual o gás liberado no cátodo? b. Por que em torno do cátodo observa-se coloração. c. Dê as reações que ocorrem, isoladamente, no ânodo e no cátodo e a reação total. d. Que aconteceria se a solução de KI fosse substituída por uma solução de NaCl? e. Por que em torno do ânodo a solução fica marrom escuro? f. Qual a razão de aplicar corrente contínua? 5 de 5 01/11/12 10:13
Em nosso planeta o hidrogênio é encontrado na forma combinada, na água, nos oceanos, nos rios, nos minerais e até nos seres vivos.
 Aula: 02 Temática: Hidrogênio Na última aula você aprendeu sobre os gases nobres. Nessa aula continuaremos nos gases, mas não nos nobres, falaremos então sobre o gás de grande abundância no universo: o
Aula: 02 Temática: Hidrogênio Na última aula você aprendeu sobre os gases nobres. Nessa aula continuaremos nos gases, mas não nos nobres, falaremos então sobre o gás de grande abundância no universo: o
REAÇÕES QUÍMICAS PRODUZINDO CORRENTE ELÉTRICA CORRENTE ELÉTRICA PRODUZINDO REAÇÃO QUÍMICA PROF. RODRIGO BANDEIRA
 REAÇÕES QUÍMICAS PRODUZINDO CORRENTE ELÉTRICA CORRENTE ELÉTRICA PRODUZINDO REAÇÃO QUÍMICA A relação entre as reações químicas e a corrente elétrica é estudada por um ramo da química chamado ELETROQUÍMICA
REAÇÕES QUÍMICAS PRODUZINDO CORRENTE ELÉTRICA CORRENTE ELÉTRICA PRODUZINDO REAÇÃO QUÍMICA A relação entre as reações químicas e a corrente elétrica é estudada por um ramo da química chamado ELETROQUÍMICA
QUÍMICA - 2 o ANO MÓDULO 27 ELETROQUÍMICA: ÍGNEA E AQUOSA
 QUÍMICA - 2 o ANO MÓDULO 27 ELETROQUÍMICA: ÍGNEA E AQUOSA bateria + _ ânodo + cátodo - e - e oxidação redução Formação de gás cloro no ânodo (não há deposição) Na + - Cl cloreto de sódio fundido Formação
QUÍMICA - 2 o ANO MÓDULO 27 ELETROQUÍMICA: ÍGNEA E AQUOSA bateria + _ ânodo + cátodo - e - e oxidação redução Formação de gás cloro no ânodo (não há deposição) Na + - Cl cloreto de sódio fundido Formação
(aq) + H 3 O + (aq) K 1 = 1,0 x (aq) + H 3 O + (aq) K 2 = 1,0 x 10-11
 Questão 1 O ácido carbônico é formado quando se borbulha o dióxido de carbono em água. Ele está presente em águas gaseificadas e refrigerantes. Em solução aquosa, ele pode sofrer duas dissociações conforme
Questão 1 O ácido carbônico é formado quando se borbulha o dióxido de carbono em água. Ele está presente em águas gaseificadas e refrigerantes. Em solução aquosa, ele pode sofrer duas dissociações conforme
Experiência 11 PILHA DE DANIELL PILHA DE DANIELL
 PILHA DE DANIELL 1. Objetivos - Compreensão do funcionamento de uma pilha - Medir o potencial de uma pilha de Daniell - Montagem de uma pilha - Aplicar os conceitos de oxi-redução ao experimento comparando
PILHA DE DANIELL 1. Objetivos - Compreensão do funcionamento de uma pilha - Medir o potencial de uma pilha de Daniell - Montagem de uma pilha - Aplicar os conceitos de oxi-redução ao experimento comparando
Fuvest 2009 (Questão 1 a 8)
 (Questão 1 a 8) 1. Água pode ser eletrolisada com a finalidade de se demonstrar sua composição. A figura representa uma aparelhagem em que foi feita a eletrólise da água, usando eletrodos inertes de platina.
(Questão 1 a 8) 1. Água pode ser eletrolisada com a finalidade de se demonstrar sua composição. A figura representa uma aparelhagem em que foi feita a eletrólise da água, usando eletrodos inertes de platina.
Olimpíada Brasileira de Química Fase III (Etapa 1 nacional)
 Page 1 of 5 Olimpíada Brasileira de Química - 2001 Fase III (Etapa 1 nacional) Questão 1 (48 th Chemistry Olympiad - Final National Competition - 2001 - Estonia) Exame aplicado em 01.09.2001 Os compostos
Page 1 of 5 Olimpíada Brasileira de Química - 2001 Fase III (Etapa 1 nacional) Questão 1 (48 th Chemistry Olympiad - Final National Competition - 2001 - Estonia) Exame aplicado em 01.09.2001 Os compostos
Professora Sonia IME 1972 FOLHA DE DADOS
 IME 1972 FOLHA DE DADOS Constante dos Gases Perfeitos cal atm L R 2,0 0,082 mol K mol K Pesos atômicos H 1,008; He 4,0026; O 16,000; Zn 65,4; Cu 6,5; I 127; C 5,5; Na 2,0; Ca 40,0; P 1,0; Ag 107,9; K 9,1.
IME 1972 FOLHA DE DADOS Constante dos Gases Perfeitos cal atm L R 2,0 0,082 mol K mol K Pesos atômicos H 1,008; He 4,0026; O 16,000; Zn 65,4; Cu 6,5; I 127; C 5,5; Na 2,0; Ca 40,0; P 1,0; Ag 107,9; K 9,1.
PROVA DE QUÍMICA. Tendo em vista as propriedades coligativas dessas soluções, é CORRETO afirmar
 17 PROVA DE QUÍMICA Q U E S T Ã O 2 6 Z e X são elementos químicos que apresentam respectivamente 2 e 6 elétrons no nível de valência. A fórmula química resultante da combinação entre átomos dos elementos
17 PROVA DE QUÍMICA Q U E S T Ã O 2 6 Z e X são elementos químicos que apresentam respectivamente 2 e 6 elétrons no nível de valência. A fórmula química resultante da combinação entre átomos dos elementos
QUÍMICA PRIMEIRA ETAPA
 QUÍMICA PRIMEIRA ETAPA - 1998 QUESTÃO 01 Uma mistura de hidrogênio, H 2 (g), e oxigênio, O 2 (g), reage, num recipiente hermeticamente fechado, em alta temperatura e em presença de um catalisador, produzindo
QUÍMICA PRIMEIRA ETAPA - 1998 QUESTÃO 01 Uma mistura de hidrogênio, H 2 (g), e oxigênio, O 2 (g), reage, num recipiente hermeticamente fechado, em alta temperatura e em presença de um catalisador, produzindo
Colégio FAAT Ensino Fundamental e Médio
 Colégio FAAT Ensino Fundamental e Médio Conteúdo: Pilhas e baterias Eletrólise Recuperação do 4 Bimestre disciplina Química 2ºano Lista de exercícios 1- Na pilha Al/ Al 3+ // Cu 2+ / Cu é correto afirmar
Colégio FAAT Ensino Fundamental e Médio Conteúdo: Pilhas e baterias Eletrólise Recuperação do 4 Bimestre disciplina Química 2ºano Lista de exercícios 1- Na pilha Al/ Al 3+ // Cu 2+ / Cu é correto afirmar
FUVEST 1981 Primeira fase e Segunda fase
 FUVEST 1981 Primeira fase e Segunda fase CONHECIMENTOS GERAIS 5. Nas condições ambientes, pastilhas de hidróxido de sódio, expostas ao ar durante várias horas, transformam-se em um líquido claro. Este
FUVEST 1981 Primeira fase e Segunda fase CONHECIMENTOS GERAIS 5. Nas condições ambientes, pastilhas de hidróxido de sódio, expostas ao ar durante várias horas, transformam-se em um líquido claro. Este
O hidrogênio é usado na fabricação de inúmeros produtos importantes:
 Q.01 O hidrogênio é usado na fabricação de inúmeros produtos importantes: I. H 2 + X metanol II. H 2 + Y ciclo-hexano III. H 2 + Z tripalmitato de glicerila (gordura saturada) a) Identifique X, Y e Z.
Q.01 O hidrogênio é usado na fabricação de inúmeros produtos importantes: I. H 2 + X metanol II. H 2 + Y ciclo-hexano III. H 2 + Z tripalmitato de glicerila (gordura saturada) a) Identifique X, Y e Z.
Olimpíada Brasileira de Química
 Olimpíada Brasileira de Química - 2006 Fase III MODALIDADE A Olimpíada Brasileira de Química PARTE I - QUESTÕES MÚLTIPLA ESCOLHA QUESTÃO 1 As espécies Fe 2+ e Fe 3+, provenientes de isótopos distintos
Olimpíada Brasileira de Química - 2006 Fase III MODALIDADE A Olimpíada Brasileira de Química PARTE I - QUESTÕES MÚLTIPLA ESCOLHA QUESTÃO 1 As espécies Fe 2+ e Fe 3+, provenientes de isótopos distintos
Pb 2e Pb E 0,13 v. Ag 2e Ag E +0,80 v. Zn 2e Zn E 0,76 v. Al 3e Al E 1,06 v. Mg 2e Mg E 2,4 v. Cu 2e Cu E +0,34 v
 QUÍMICA 1ª QUESTÃO Umas das reações possíveis para obtenção do anidrido sulfúrico é a oxidação do anidrido sulfuroso por um agente oxidante forte em meio aquoso ácido, como segue a reação. Anidrido sulfuroso
QUÍMICA 1ª QUESTÃO Umas das reações possíveis para obtenção do anidrido sulfúrico é a oxidação do anidrido sulfuroso por um agente oxidante forte em meio aquoso ácido, como segue a reação. Anidrido sulfuroso
REAÇÕES QUÍMICAS PRODUZINDO CORRENTE ELÉTRICA CORRENTE ELÉTRICA PRODUZINDO REAÇÃO QUÍMICA
 REAÇÕES QUÍMICAS PRODUZINDO CORRENTE ELÉTRICA CORRENTE ELÉTRICA PRODUZINDO REAÇÃO QUÍMICA Porque estudar eletroquímica para o ENEM? 2015 81 2016 64 2107 95; 121 2018 93; 116 A relação entre as reações
REAÇÕES QUÍMICAS PRODUZINDO CORRENTE ELÉTRICA CORRENTE ELÉTRICA PRODUZINDO REAÇÃO QUÍMICA Porque estudar eletroquímica para o ENEM? 2015 81 2016 64 2107 95; 121 2018 93; 116 A relação entre as reações
ROTEIRO DE ESTUDOS 1 ANO II - TRIMESTRE
 ROTEIRO DE ESTUDOS 1 ANO II - TRIMESTRE PARTE 1 SETOR A 1- Considere as seguintes informações sobre um átomo X: Um isótopo tem massa de 20 u e um contribuição de 91%; Um isótopo tem massa de 22 u e um
ROTEIRO DE ESTUDOS 1 ANO II - TRIMESTRE PARTE 1 SETOR A 1- Considere as seguintes informações sobre um átomo X: Um isótopo tem massa de 20 u e um contribuição de 91%; Um isótopo tem massa de 22 u e um
Associação Brasileira de Química XII Maratona Cearense de Química a Fase 8 o Ano 17/08/09. Experiência
 2 a Fase 8 o Ano 17/08/09 Experiência Material: 1. Manta aquecedora 2.Tubos de ensaio 3. α-naftol 4. Espátula 5. Água destilada 6. Pipeta de Pasteur 7. Clara de ovo 8. Béquer de 1000 ml 9. Tinta para carimbo
2 a Fase 8 o Ano 17/08/09 Experiência Material: 1. Manta aquecedora 2.Tubos de ensaio 3. α-naftol 4. Espátula 5. Água destilada 6. Pipeta de Pasteur 7. Clara de ovo 8. Béquer de 1000 ml 9. Tinta para carimbo
3ª Série / Vestibular. As equações (I) e (II), acima, representam reações que podem ocorrer na formação do H 2SO 4. É correto afirmar que, na reação:
 3ª Série / Vestibular 01. I _ 2SO 2(g) + O 2(g) 2SO 3(g) II _ SO 3(g) + H 2O(l) H 2SO 4(ag) As equações (I) e (II), acima, representam reações que podem ocorrer na formação do H 2SO 4. É correto afirmar
3ª Série / Vestibular 01. I _ 2SO 2(g) + O 2(g) 2SO 3(g) II _ SO 3(g) + H 2O(l) H 2SO 4(ag) As equações (I) e (II), acima, representam reações que podem ocorrer na formação do H 2SO 4. É correto afirmar
3º Tri TB Recuperação de Química Data: 14/12/17 Ensino Médio 2º ano classe: A_B_C Profª Danusa Nome: nº
 3º Tri TB Recuperação de Química Data: 14/12/17 Ensino Médio 2º ano classe: A_B_C Profª Danusa Nome: nº Conteúdo: Nox, pilha e eletrólise Questão 01 - (UFRR/2015) Nas substâncias Na2SO4, HPO3 2, KMnO4
3º Tri TB Recuperação de Química Data: 14/12/17 Ensino Médio 2º ano classe: A_B_C Profª Danusa Nome: nº Conteúdo: Nox, pilha e eletrólise Questão 01 - (UFRR/2015) Nas substâncias Na2SO4, HPO3 2, KMnO4
Observe o gráfico, cujas curvas representam as variações das massas desses radioisótopos ao longo das duas horas de duração do experimento.
 Revisão Específicas 1. (UERJ 2015) Os preços dos metais para reciclagem variam em função da resistência de cada um à corrosão: quanto menor a tendência do metal à oxidação, maior será o preço. Na tabela,
Revisão Específicas 1. (UERJ 2015) Os preços dos metais para reciclagem variam em função da resistência de cada um à corrosão: quanto menor a tendência do metal à oxidação, maior será o preço. Na tabela,
DISCIPLINA DE QUÍMICA
 DISCIPLINA DE QUÍMICA OBJETIVOS: 1ª série Traduzir linguagens químicas em linguagens discursivas e linguagem discursiva em outras linguagens usadas em Química tais como gráficos, tabelas e relações matemáticas,
DISCIPLINA DE QUÍMICA OBJETIVOS: 1ª série Traduzir linguagens químicas em linguagens discursivas e linguagem discursiva em outras linguagens usadas em Química tais como gráficos, tabelas e relações matemáticas,
A prova escrita é composta de 10 questões, sendo 4 obrigatórias e 6 eletivas.
 A prova escrita é composta de 10 questões, sendo 4 obrigatórias e 6 eletivas. O candidato deverá responder 8 questões: as 4 obrigatórias (questões de números 1 a 4) e outras 4 escolhidas dentre as eletivas
A prova escrita é composta de 10 questões, sendo 4 obrigatórias e 6 eletivas. O candidato deverá responder 8 questões: as 4 obrigatórias (questões de números 1 a 4) e outras 4 escolhidas dentre as eletivas
NOX EXERCÍCIOS QUÍMICA PROF- LEONARDO. 01)Quais são os números de oxidação do iodo nas substâncias l 2, Nal, NalO 4 e Al I 3?
 NOX EXERCÍCIOS QUÍMICA PROF- LEONARDO 01)Quais são os números de oxidação do iodo nas substâncias l 2, Nal, NalO 4 e Al I 3? 02. O número de oxidação do manganês no permanganato de potássio (KMnO4) é:
NOX EXERCÍCIOS QUÍMICA PROF- LEONARDO 01)Quais são os números de oxidação do iodo nas substâncias l 2, Nal, NalO 4 e Al I 3? 02. O número de oxidação do manganês no permanganato de potássio (KMnO4) é:
QUÍMICA. UFBA 99 2ª etapa Quím. 12
 QUÍMICA UFBA 99 2ª etapa Quím. 12 QUESTÕES DE 11 A 20 QUESTÕES DE 11 A 18 INSTRUÇÃO: Assinale as proposições verdadeiras, some os números a elas associados e marque o resultado na Folha de Respostas. Questão
QUÍMICA UFBA 99 2ª etapa Quím. 12 QUESTÕES DE 11 A 20 QUESTÕES DE 11 A 18 INSTRUÇÃO: Assinale as proposições verdadeiras, some os números a elas associados e marque o resultado na Folha de Respostas. Questão
Volumetria de Óxido-redução
 Volumetria de Óxido-redução LMBRANDO Reações de Oxi-redução Oxidação e redução 0 0 +1-1 0 0 +1-1 Reações redox e semi-células Zn 0 + Cu 2+ Zn 2+ + Cu 0 semi-célula do zinco: Zn 0 Zn 2+ + 2e - semi-célula
Volumetria de Óxido-redução LMBRANDO Reações de Oxi-redução Oxidação e redução 0 0 +1-1 0 0 +1-1 Reações redox e semi-células Zn 0 + Cu 2+ Zn 2+ + Cu 0 semi-célula do zinco: Zn 0 Zn 2+ + 2e - semi-célula
QUÍMICA PRIMEIRA ETAPA
 QUÍMICA PRIMEIRA ETAPA - 1999 QUESTÃO 46 Um limão foi espremido num copo contendo água e as sementes ficaram no fundo do recipiente. A seguir, foi adicionado ao sistema um pouco de açúcar, que se dissolveu
QUÍMICA PRIMEIRA ETAPA - 1999 QUESTÃO 46 Um limão foi espremido num copo contendo água e as sementes ficaram no fundo do recipiente. A seguir, foi adicionado ao sistema um pouco de açúcar, que se dissolveu
PROJETO DE RECUPERAÇÃO PARALELA 1º Trimestre
 PROJETO DE RECUPERAÇÃO PARALELA 1º Trimestre - 2018 Disciplina: Química Série: 2ª série do Ensino Médio Professor(a): Paola Araújo Objetivo: Recuperar o conteúdo referente ao 1º trimestre, mesclando conteúdos
PROJETO DE RECUPERAÇÃO PARALELA 1º Trimestre - 2018 Disciplina: Química Série: 2ª série do Ensino Médio Professor(a): Paola Araújo Objetivo: Recuperar o conteúdo referente ao 1º trimestre, mesclando conteúdos
UNIVERSIDADE ESTADUAL DO SUDOESTE DA BAHIA PROGRAMA DE PÓS-GRADUAÇÃO EM QUÍMICA EXAME GERAL EM QUÍMICA EDITAL N 002/2017
 UNIVERSIDADE ESTADUAL DO SUDOESTE DA BAHIA PROGRAMA DE PÓS-GRADUAÇÃO EM QUÍMICA EXAME GERAL EM QUÍMICA EDITAL N 002/2017 Seleção para o 1º Semestre de 2017 14 de Fevereiro de 2017 CADERNO DE QUESTÕES Tempo
UNIVERSIDADE ESTADUAL DO SUDOESTE DA BAHIA PROGRAMA DE PÓS-GRADUAÇÃO EM QUÍMICA EXAME GERAL EM QUÍMICA EDITAL N 002/2017 Seleção para o 1º Semestre de 2017 14 de Fevereiro de 2017 CADERNO DE QUESTÕES Tempo
Papiro 01 QUÍMICA. 1ª QUESTÃO Valor 1,0. 2ª QUESTÃO Valor 1,0
 Papiro 01 QUÍMICA 1ª QUESTÃO Valor 1,0 2ª QUESTÃO Valor 1,0 Cloreto de sulfurila, SO 2 Cl 2, se decompõe em fase gasosa, produzindo SO 2(g) e Cl 2(g). A concentração do SO 2 Cl 2, foi acompanhada em uma
Papiro 01 QUÍMICA 1ª QUESTÃO Valor 1,0 2ª QUESTÃO Valor 1,0 Cloreto de sulfurila, SO 2 Cl 2, se decompõe em fase gasosa, produzindo SO 2(g) e Cl 2(g). A concentração do SO 2 Cl 2, foi acompanhada em uma
Reações em Soluções Aquosas
 Reações em Soluções Aquosas Classificação Reações sem transferência de elétrons: Reações de precipitação; Reações de neutralização. Reações com transferência de elétrons: Reações de oxirredução. Reações
Reações em Soluções Aquosas Classificação Reações sem transferência de elétrons: Reações de precipitação; Reações de neutralização. Reações com transferência de elétrons: Reações de oxirredução. Reações
REVISÃO QUÍMICA 4 ELETROQUÍMICA - Prof Emanuele. d) KMnO 4 + H 2 C 2 O 4 + H 2 SO 4 K 2 SO 4 + MnSO 4 + CO 2 + H 2 O
 REVISÃO QUÍMICA 4 ELETROQUÍMICA - Prof Emanuele 1) Os números de oxidação dos halogênios nos compostos NaCl, NaClO 3, KI, I 2, NH 4 IO 3 são, respectivamente: a) +1, +3, 0, -2, +4 b) +1, -5, -1, 0, +5
REVISÃO QUÍMICA 4 ELETROQUÍMICA - Prof Emanuele 1) Os números de oxidação dos halogênios nos compostos NaCl, NaClO 3, KI, I 2, NH 4 IO 3 são, respectivamente: a) +1, +3, 0, -2, +4 b) +1, -5, -1, 0, +5
Q.02 Considere uma solução aquosa diluída de dicromato de potássio, a 25 ºC. Dentre os equilíbrios que estão presentes nessa solução, destacam-se:
 Q.01 Íons indesejáveis podem ser removidos da água, tratando-a com resinas de troca iônica, que são constituídas por uma matriz polimérica, à qual estão ligados grupos que podem reter cátions ou ânions.
Q.01 Íons indesejáveis podem ser removidos da água, tratando-a com resinas de troca iônica, que são constituídas por uma matriz polimérica, à qual estão ligados grupos que podem reter cátions ou ânions.
1 a Questão: Valor : 1,0 FOLHA DE DADOS. I ) Entalpias de Formação (H o f ) H 2. O (líquida) = - 68,3 kcal / mol. CO 2 (gasoso) = - 94,1 kcal / mol
 PROVA DE QUÍMICA DO VESTIBULAR 96/97 DO INSTITUTO MILITAR DE ENGENHARIA (04/12/96) FOLHA DE DADOS I ) Entalpias de Formação (H o f ) H 2 O (líquida) = - 68,3 kcal / mol CO 2 (gasoso) = - 94,1 kcal / mol
PROVA DE QUÍMICA DO VESTIBULAR 96/97 DO INSTITUTO MILITAR DE ENGENHARIA (04/12/96) FOLHA DE DADOS I ) Entalpias de Formação (H o f ) H 2 O (líquida) = - 68,3 kcal / mol CO 2 (gasoso) = - 94,1 kcal / mol
com o oxigênio, formando o trióxido de enxofre (SO 3 ), e deste com a água, resultando no H 2
 11 Em 2004 iniciou-se, no Brasil, a exploração de uma importante jazida de minério de cobre. Nestes minérios, o metal é normalmente encontrado na forma de sulfetos, como o CuS, e para sua obtenção o minério
11 Em 2004 iniciou-se, no Brasil, a exploração de uma importante jazida de minério de cobre. Nestes minérios, o metal é normalmente encontrado na forma de sulfetos, como o CuS, e para sua obtenção o minério
PRÉ-VESTIBULAR QUÍMICA PROF. EMANUEL
 ELETRÓLISE E LEIS DE FARADAY PRÉ-VESTIBULAR QUÍMICA PROF. EMANUEL 1) Segundo as previsões do prof. Labouriau, até 2000, o alumínio e suas ligas suplantariam o ferro, que é mais pesado e mais facilmente
ELETRÓLISE E LEIS DE FARADAY PRÉ-VESTIBULAR QUÍMICA PROF. EMANUEL 1) Segundo as previsões do prof. Labouriau, até 2000, o alumínio e suas ligas suplantariam o ferro, que é mais pesado e mais facilmente
LABORATÓRIO DE QUÍMICA QUI126 1ª LISTA DE EXERCÍCIOS
 1. Soluções básicas servem para a dissolução de gorduras sólidas que obstruem tubulações das cozinhas. O hidróxido de sódio é um exemplo, pois reage com gorduras e gera produtos solúveis. Qual a massa
1. Soluções básicas servem para a dissolução de gorduras sólidas que obstruem tubulações das cozinhas. O hidróxido de sódio é um exemplo, pois reage com gorduras e gera produtos solúveis. Qual a massa
10 QUÍMICA 3º DIA 2º Processo Seletivo/ NO e N 2 O são óxidos de nitrogênio com importantes atividades biológicas.
 10 QUÍMICA 3º DIA 2º Processo Seletivo/2004 10. NO e N 2 O são óxidos de nitrogênio com importantes atividades biológicas. a) Sabendo-se que NO (g) e H 2 O (g) podem ser obtidos a partir da oxidação de
10 QUÍMICA 3º DIA 2º Processo Seletivo/2004 10. NO e N 2 O são óxidos de nitrogênio com importantes atividades biológicas. a) Sabendo-se que NO (g) e H 2 O (g) podem ser obtidos a partir da oxidação de
Ministério da Educação UNIVERSIDADE TECNOLÓGICA FEDERAL DO PARANÁ Câmpus Curitiba
 Ministério da Educação UNIVERSIDADE TECNOLÓGICA FEDERAL DO PARANÁ Câmpus Curitiba Lista de Exercícios Eletroquímica Nome: Turma: S5/6 Data de Entrega: 1/9/14 Disciplina: Química (QB7D) Prof. Reinaldo Morita
Ministério da Educação UNIVERSIDADE TECNOLÓGICA FEDERAL DO PARANÁ Câmpus Curitiba Lista de Exercícios Eletroquímica Nome: Turma: S5/6 Data de Entrega: 1/9/14 Disciplina: Química (QB7D) Prof. Reinaldo Morita
Resolução UNIFESP 2015
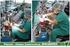 Resolução UNIFESP 2015 1-Utilizando o aparato indicado na figura, certo volume de solução aquosa de sulfato de cobre(ii) hidratado foi colocado dentro do béquer. Quando o plugue foi conectado à tomada
Resolução UNIFESP 2015 1-Utilizando o aparato indicado na figura, certo volume de solução aquosa de sulfato de cobre(ii) hidratado foi colocado dentro do béquer. Quando o plugue foi conectado à tomada
Questão 1 O composto químico abaixo representa um hidrocarboneto insaturado (alceno). Sobre ele, responda ao que se pede.
 Questão 1 O composto químico abaixo representa um hidrocarboneto insaturado (alceno). Sobre ele, responda ao que se pede. a) Escreva a fórmula estrutural do seu isômero geométrico. b) A reação de hidrogenação
Questão 1 O composto químico abaixo representa um hidrocarboneto insaturado (alceno). Sobre ele, responda ao que se pede. a) Escreva a fórmula estrutural do seu isômero geométrico. b) A reação de hidrogenação
ROTEIRO DE ESTUDOS - 4 BIMESTRE 2015 Disciplina: Química Ano: 2 Ensino: EM
 ROTEIRO DE ESTUDOS - 4 BIMESTRE 2015 Disciplina: Química Ano: 2 Ensino: EM Conteúdo do 4 bimestre: Pilhas, baterias Eletrólise Entalpia Sugestão de estudo: Refazer as listas de exercícios e as avaliações
ROTEIRO DE ESTUDOS - 4 BIMESTRE 2015 Disciplina: Química Ano: 2 Ensino: EM Conteúdo do 4 bimestre: Pilhas, baterias Eletrólise Entalpia Sugestão de estudo: Refazer as listas de exercícios e as avaliações
29/03/ TRANSFORMAÇÕES QUÍMICAS PROVA 1 GABARITO - prova tipo A
 29/03/2016 - TRANSFORMAÇÕES QUÍMICAS PROVA 1 GABARITO - prova tipo A Texto para as questões 1 a 10: O permanganato de potássio (KMnO 4 ) é um forte agente oxidante. Em laboratório, pode ser empregado para
29/03/2016 - TRANSFORMAÇÕES QUÍMICAS PROVA 1 GABARITO - prova tipo A Texto para as questões 1 a 10: O permanganato de potássio (KMnO 4 ) é um forte agente oxidante. Em laboratório, pode ser empregado para
UFU 2008/2-1ª FASE. 1-A substância, representada pela fórmula estrutural abaixo, é bastante utilizada como analgésico (aspirina).
 UFU 2008/2-1ª FASE 1-A substância, representada pela fórmula estrutural abaixo, é bastante utilizada como analgésico (aspirina). Com base nessas informações, marque a alternativa correta. A) Uma massa
UFU 2008/2-1ª FASE 1-A substância, representada pela fórmula estrutural abaixo, é bastante utilizada como analgésico (aspirina). Com base nessas informações, marque a alternativa correta. A) Uma massa
PROFESSORA: Núbia de Andrade. Antes de iniciar a lista de exercícios leia atentamente as seguintes orientações:
 GOIÂNIA, / / 2015 PROFESSORA: Núbia de Andrade DISCIPLINA:Química SÉRIE:3º ALUNO(a): No Anhanguera você é + Enem Antes de iniciar a lista de exercícios leia atentamente as seguintes orientações: - É fundamental
GOIÂNIA, / / 2015 PROFESSORA: Núbia de Andrade DISCIPLINA:Química SÉRIE:3º ALUNO(a): No Anhanguera você é + Enem Antes de iniciar a lista de exercícios leia atentamente as seguintes orientações: - É fundamental
REVISÃO QUÍMICA 4 ELETROQUÍMICA - Prof Emanuele. d) KMnO 4 + H 2 C 2 O 4 + H 2 SO 4 K 2 SO 4 + MnSO 4 + CO 2 + H 2 O. Ag. Redutor: H 2 C 2 O 4
 REVISÃO QUÍMICA 4 ELETROQUÍMICA - Prof Emanuele 1) Os números de oxidação dos halogênios nos compostos NaCl, NaClO 3, KI, I 2, NH 4 IO 3 são, respectivamente: a) +1, +3, 0, -2, +4 b) +1, -5, -1, 0, +5
REVISÃO QUÍMICA 4 ELETROQUÍMICA - Prof Emanuele 1) Os números de oxidação dos halogênios nos compostos NaCl, NaClO 3, KI, I 2, NH 4 IO 3 são, respectivamente: a) +1, +3, 0, -2, +4 b) +1, -5, -1, 0, +5
PROVA ESCRITA DE QUÍMICA. PRIMEIRA PARTE - QUESTÕES DISCURSIVAS (70 pontos)
 COLÉGIO PEDRO II DIRETORIA GERAL SECRETARIA DE ENSINO CONCURSO PÚBLICO PARA PROFESSORES DE ENSINO FUNDAMENTAL E MÉDIO = 2002 = PRIMEIRA PARTE - QUESTÕES DISCURSIVAS (70 pontos) Responda às questões propostas,
COLÉGIO PEDRO II DIRETORIA GERAL SECRETARIA DE ENSINO CONCURSO PÚBLICO PARA PROFESSORES DE ENSINO FUNDAMENTAL E MÉDIO = 2002 = PRIMEIRA PARTE - QUESTÕES DISCURSIVAS (70 pontos) Responda às questões propostas,
VII Olimpíada Catarinense de Química Etapa I - Colégios
 VII Olimpíada Catarinense de Química 2011 Etapa I - Colégios Fonte: Chemistryland Segunda Série 1 01 200 ml de uma solução de hidróxido de alumínio são diluídos em água destilada até a sua concentração
VII Olimpíada Catarinense de Química 2011 Etapa I - Colégios Fonte: Chemistryland Segunda Série 1 01 200 ml de uma solução de hidróxido de alumínio são diluídos em água destilada até a sua concentração
FUVEST ª Fase (Questões 1 a 7)
 1ª Fase (Questões 1 a 7) Provas de Vestibular 1. O ácido gama-hidroxibutírico é utilizado no tratamento do alcoolismo. Esse ácido pode ser obtido a partir da gamabutirolactona, conforme a representação
1ª Fase (Questões 1 a 7) Provas de Vestibular 1. O ácido gama-hidroxibutírico é utilizado no tratamento do alcoolismo. Esse ácido pode ser obtido a partir da gamabutirolactona, conforme a representação
Atividades de Recuperação Paralela de Química
 Atividades de Recuperação Paralela de Química 2ª série Ensino Médio Conteúdos para estudos:. Química A Livro-texto Coeficiente de solubilidade: compreender os gráficos e tabelas de solubilidade; fazer
Atividades de Recuperação Paralela de Química 2ª série Ensino Médio Conteúdos para estudos:. Química A Livro-texto Coeficiente de solubilidade: compreender os gráficos e tabelas de solubilidade; fazer
CPV seu pé direito também na Medicina
 seu pé direito também na Medicina UNIFESP 17/dezembro/2010 QUÍMICA 06. Ligas metálicas são comuns no cotidiano e muito utilizadas nas indústrias automobilística, aeronáutica, eletrônica e na construção
seu pé direito também na Medicina UNIFESP 17/dezembro/2010 QUÍMICA 06. Ligas metálicas são comuns no cotidiano e muito utilizadas nas indústrias automobilística, aeronáutica, eletrônica e na construção
Departamento de Química Inorgânica IQ / UFRJ IQG 128 / IQG ELETRÓLISE
 10. ELETRÓLISE I. INTRODUÇÃO Como já mencionado na aula prática de reações de oxirredução, a eletricidade também pode ser usada para realizarmos reações de transferência de elétrons não espontâneas. Por
10. ELETRÓLISE I. INTRODUÇÃO Como já mencionado na aula prática de reações de oxirredução, a eletricidade também pode ser usada para realizarmos reações de transferência de elétrons não espontâneas. Por
PADRÃO DE RESPOSTA - QUÍMICA - Grupo J
 PADRÃO DE RESPOSTA - QUÍMICA - Grupo J 1 a QUESTÃO: (2,0 pontos) Avaliador Revisor Num recipiente de 3,0 L de capacidade, as seguintes pressões parciais foram medidas: N 2 = 0,500 atm; H 2 = 0,400 atm;
PADRÃO DE RESPOSTA - QUÍMICA - Grupo J 1 a QUESTÃO: (2,0 pontos) Avaliador Revisor Num recipiente de 3,0 L de capacidade, as seguintes pressões parciais foram medidas: N 2 = 0,500 atm; H 2 = 0,400 atm;
Setor A LISTA DE EXERCÍCIOS PROVA MENSAL II TRIMESTRE. Nome: nº: Ano: 2º E.M. Professor: Cassio Pacheco
 LISTA DE EXERCÍCIOS PROVA MENSAL II TRIMESTRE Nome: nº: Ano: 2º E.M. Professor: Cassio Pacheco Setor A 1- A partir do esquema de diluições representado a seguir, qual será a concentração no frasco D, após
LISTA DE EXERCÍCIOS PROVA MENSAL II TRIMESTRE Nome: nº: Ano: 2º E.M. Professor: Cassio Pacheco Setor A 1- A partir do esquema de diluições representado a seguir, qual será a concentração no frasco D, após
Ocorrência de reações
 Ocorrência de reações Dados: Força de ácidos e bases Classificação dos hidrácidos mais conhecidos: Regra prática para a classificação dos oxiácidos Determine a diferença (D) entre a quantidade de átomos
Ocorrência de reações Dados: Força de ácidos e bases Classificação dos hidrácidos mais conhecidos: Regra prática para a classificação dos oxiácidos Determine a diferença (D) entre a quantidade de átomos
a) Escreva os nomes das substâncias presentes nos frascos A, B e C. A B C
 PROVA DE QUÍMICA 2ª ETAPA do VESTIBULAR 2006 (cada questão desta prova vale até cinco pontos) Questão 01 Foram encontrados, em um laboratório, três frascos A, B e C, contendo soluções incolores e sem rótulos.
PROVA DE QUÍMICA 2ª ETAPA do VESTIBULAR 2006 (cada questão desta prova vale até cinco pontos) Questão 01 Foram encontrados, em um laboratório, três frascos A, B e C, contendo soluções incolores e sem rótulos.
Na(s) questão(ões) a seguir, escreva no espaço apropriado a soma dos itens corretos.
 Na(s) questão(ões) a seguir, escreva no espaço apropriado a soma dos itens corretos. 1. Dados os potenciais de oxi-redução a seguir, Ag + 1e Ï Ag Fe + 2e Ï Fe Ag + 3e Ï Al Cu + 2e Ï Cu E = +0,80V E = -0,44V
Na(s) questão(ões) a seguir, escreva no espaço apropriado a soma dos itens corretos. 1. Dados os potenciais de oxi-redução a seguir, Ag + 1e Ï Ag Fe + 2e Ï Fe Ag + 3e Ï Al Cu + 2e Ï Cu E = +0,80V E = -0,44V
Atividades de Recuperação Paralela de Química Setor A
 Atividades de Recuperação Paralela de Química Setor A 2ª série Ensino Médio. Conteúdos para estudos: Livro-texto Coeficiente de solubilidade: compreender os gráficos e tabelas de solubilidade; fazer cálculos
Atividades de Recuperação Paralela de Química Setor A 2ª série Ensino Médio. Conteúdos para estudos: Livro-texto Coeficiente de solubilidade: compreender os gráficos e tabelas de solubilidade; fazer cálculos
Resumo e Listas Exercicios
 Resumo e Listas Exercicios OXIDAÇÃO E REDUÇÃO As reações de oxidação e redução envolvem a perda e ganho de elétrons. Algumas dessas reações são muito importantes para o nosso cotidiano, para a manutenção
Resumo e Listas Exercicios OXIDAÇÃO E REDUÇÃO As reações de oxidação e redução envolvem a perda e ganho de elétrons. Algumas dessas reações são muito importantes para o nosso cotidiano, para a manutenção
UNIVERSIDADE DE ÉVORA
 UNIVERSIDADE DE ÉVORA ACESSO AO ENSINO SUPERIOR DOS MAIORES DE 23 ANOS PROVA ESCRITA DE QUÍMICA 09 de maio de 2017 Duração: 2 horas DADOS NECESSÁRIOS À RESOLUÇÃO DA PROVA V m (PTN) = 22,4 L/mol Grupo I
UNIVERSIDADE DE ÉVORA ACESSO AO ENSINO SUPERIOR DOS MAIORES DE 23 ANOS PROVA ESCRITA DE QUÍMICA 09 de maio de 2017 Duração: 2 horas DADOS NECESSÁRIOS À RESOLUÇÃO DA PROVA V m (PTN) = 22,4 L/mol Grupo I
Exercício 3: (PUC-RIO 2007) Considere a célula eletroquímica abaixo e os potenciais das semi-reações:
 Exercício 1: (PUC-RIO 2008) O trabalho produzido por uma pilha é proporcional à diferença de potencial (ddp) nela desenvolvida quando se une uma meia-pilha onde a reação eletrolítica de redução ocorre
Exercício 1: (PUC-RIO 2008) O trabalho produzido por uma pilha é proporcional à diferença de potencial (ddp) nela desenvolvida quando se une uma meia-pilha onde a reação eletrolítica de redução ocorre
Curso Preparatório para o Ingresso no Ensino Superior (Pré-Vestibular)
 Curso Preparatório para o Ingresso no Ensino Superior (Pré-Vestibular) Os conteúdos conceituais de Química estão distribuídos em 5 frentes. Química Extensivo A)Meio ambiente; estrutura atômica; Classificação
Curso Preparatório para o Ingresso no Ensino Superior (Pré-Vestibular) Os conteúdos conceituais de Química estão distribuídos em 5 frentes. Química Extensivo A)Meio ambiente; estrutura atômica; Classificação
André Silva Franco ASF Escola Olímpica de Química Julho de 2011
 André Silva Franco ASF Escola Olímpica de Química Julho de 2011 Semirreações Reações de redução e oxidação sempre ocorrem juntas! Configuram, portanto, um par redox Apresentam os elétrons; configuram uma
André Silva Franco ASF Escola Olímpica de Química Julho de 2011 Semirreações Reações de redução e oxidação sempre ocorrem juntas! Configuram, portanto, um par redox Apresentam os elétrons; configuram uma
Programa de Pós-Graduação em Química UNIFAL-MG PROVA ESCRITA DE CONHECIMENTOS GERAIS EM QUÍMICA
 Programa de Pós-Graduação em Química UNIFAL-MG PROVA ESCRITA DE CONHECIMENTOS GERAIS EM QUÍMICA Orientações Importantes: 1) IDENTIFIQUE TODAS AS FOLHAS DA PROVA COM SEU NÚMERO DE INSCRIÇÃO. 2) EM HIPÓTESE
Programa de Pós-Graduação em Química UNIFAL-MG PROVA ESCRITA DE CONHECIMENTOS GERAIS EM QUÍMICA Orientações Importantes: 1) IDENTIFIQUE TODAS AS FOLHAS DA PROVA COM SEU NÚMERO DE INSCRIÇÃO. 2) EM HIPÓTESE
A hernandulcina é uma substância isolada em pequena proporção da erva Lippia dulcis (México) e é cerca de 1000 vezes mais doce que a sacarose.
 13 PROVA D E Q U Í M I C A Q U E S T Ã O 1 A hernandulcina é uma substância isolada em pequena proporção da erva Lippia dulcis (México) e é cerca de 1000 vezes mais doce que a sacarose. O OH H A hernandulcina
13 PROVA D E Q U Í M I C A Q U E S T Ã O 1 A hernandulcina é uma substância isolada em pequena proporção da erva Lippia dulcis (México) e é cerca de 1000 vezes mais doce que a sacarose. O OH H A hernandulcina
UNISA MEDICINA 2018 UNIVERSIDADE DE SANTO AMARO
 UNISA MEDIINA 018 UNIVERSIDADE DE SANT AMAR 01. A figura mostra a decomposição térmica do carbonato de cobre (II), produzindo óxido de cobre (II) e dióxido de carbono, conforme a equação: u (s) u(s) +
UNISA MEDIINA 018 UNIVERSIDADE DE SANT AMAR 01. A figura mostra a decomposição térmica do carbonato de cobre (II), produzindo óxido de cobre (II) e dióxido de carbono, conforme a equação: u (s) u(s) +
Questão 1 O composto químico abaixo representa um hidrocarboneto insaturado (alceno). Sobre ele, responda ao que se pede.
 Questão 1 O composto químico abaixo representa um hidrocarboneto insaturado (alceno). Sobre ele, responda ao que se pede. a) Escreva a fórmula estrutural do seu isômero geométrico. b) A reação de hidrogenação
Questão 1 O composto químico abaixo representa um hidrocarboneto insaturado (alceno). Sobre ele, responda ao que se pede. a) Escreva a fórmula estrutural do seu isômero geométrico. b) A reação de hidrogenação
Cinética Química. Classe: 2 3 a série. Exercícios Complementares - Recuperação Paralela
 Ensino Médio Exercícios Complementares - Recuperação Paralela Classe: 2 3 a série QUÍMICA Cinética Química 1) (Ufmg) Uma chama queima metano completamente, na razão de 2L/min, medidos nas CNTP. O calor
Ensino Médio Exercícios Complementares - Recuperação Paralela Classe: 2 3 a série QUÍMICA Cinética Química 1) (Ufmg) Uma chama queima metano completamente, na razão de 2L/min, medidos nas CNTP. O calor
UNIVERSIDADE DO ESTADO DO RIO DE JANEIRO INSTITUTO DE QUÍMICA PROGRAMA DE PÓS-GRADUAÇÃO EM QUÍMICA PROVA DE SELEÇÃO/2011 DO CURSO DE MESTRADO
 UNIVERSIDADE DO ESTADO DO RIO DE JANEIRO INSTITUTO DE QUÍMICA PROGRAMA DE PÓS-GRADUAÇÃO EM QUÍMICA PROVA DE SELEÇÃO/2011 DO CURSO DE MESTRADO 08/11/2010 PROVA ESCRITA Assinatura do candidato: Área de concentração:
UNIVERSIDADE DO ESTADO DO RIO DE JANEIRO INSTITUTO DE QUÍMICA PROGRAMA DE PÓS-GRADUAÇÃO EM QUÍMICA PROVA DE SELEÇÃO/2011 DO CURSO DE MESTRADO 08/11/2010 PROVA ESCRITA Assinatura do candidato: Área de concentração:
Para o estudo da densidade de alguns materiais, foram consideradas as duas amostras e a tabela abaixo. Densidade (g/cm 3, 25 o C)
 Questão 01 Para o estudo da densidade de alguns materiais, foram consideradas as duas amostras e a tabela abaixo. amostra I: um fio metálico de massa 135,00 g e volume 50,00 cm 3 amostra II: um líquido
Questão 01 Para o estudo da densidade de alguns materiais, foram consideradas as duas amostras e a tabela abaixo. amostra I: um fio metálico de massa 135,00 g e volume 50,00 cm 3 amostra II: um líquido
Professora Sonia ITA 1964
 ITA 964 (A prova está dividida por assuntos) Cada TESTE de múltipla-escolha admite sempre uma única resposta dentre as opções apresentadas. TODAS as respostas aos testes deverão ser justificadas no CADERNO
ITA 964 (A prova está dividida por assuntos) Cada TESTE de múltipla-escolha admite sempre uma única resposta dentre as opções apresentadas. TODAS as respostas aos testes deverão ser justificadas no CADERNO
GRUPO 15 NITROGÊNIO E SEUS COMPOSTOS
 GRUPO 15 NITROGÊNIO E SEUS COMPOSTOS O nitrogênio é um gás, sendo o principal componente da nossa atmosfera com cerca de 78% em massa do ar atmosférico. O elemento é também dotado de uma alta energia de
GRUPO 15 NITROGÊNIO E SEUS COMPOSTOS O nitrogênio é um gás, sendo o principal componente da nossa atmosfera com cerca de 78% em massa do ar atmosférico. O elemento é também dotado de uma alta energia de
TIPOS DE REAÇÕES QUÍMICAS
 Tipos de Reações químicas 1 TIPOS DE REAÇÕES QUÍMICAS Introdução Várias reações da química inorgânica podem ser classificadas em uma das quatro categorias: combinação, decomposição, deslocamento simples
Tipos de Reações químicas 1 TIPOS DE REAÇÕES QUÍMICAS Introdução Várias reações da química inorgânica podem ser classificadas em uma das quatro categorias: combinação, decomposição, deslocamento simples
Associação Brasileira de Química XIII Maratona Cearense de Química a Fase 1 o Ano 18/08/10. Experiência
 2 a Fase 1 o Ano 18/08/10 Material e Reagentes: Experiência Açúcar (sacarose) Bicarbonato de sódio Álcool etílico Recipiente com graduação (proveta ou seringa) Almofariz com pistilo Fósforo ou isqueiro
2 a Fase 1 o Ano 18/08/10 Material e Reagentes: Experiência Açúcar (sacarose) Bicarbonato de sódio Álcool etílico Recipiente com graduação (proveta ou seringa) Almofariz com pistilo Fósforo ou isqueiro
SIMULADO DE QUÍMICA INSTRUÇÕES QUÍMICA
 PROVA DISCURSIVA SIMULADO DE QUÍMICA INSTRUÇÕES Verifique se esse Caderno contém 4 questões discursivas de: QUÍMICA Se o Caderno estiver incompleto ou contiver imperfeição gráfica que prejudique a leitura,
PROVA DISCURSIVA SIMULADO DE QUÍMICA INSTRUÇÕES Verifique se esse Caderno contém 4 questões discursivas de: QUÍMICA Se o Caderno estiver incompleto ou contiver imperfeição gráfica que prejudique a leitura,
GOVERNO DO ESTADO DO RIO DE JANEIRO SECRETARIA DE ESTADO DE CIÊNCIA E TECNOLOGIA FUNDAÇÃO DE APOIO À ESCOLA TÉCNICA ESCOLA TÉCNICA ESTADUAL REPÚBLICA
 GOVERNO DO ESTADO DO RIO DE JANEIRO SECRETARIA DE ESTADO DE CIÊNCIA E TECNOLOGIA FUNDAÇÃO DE APOIO À ESCOLA TÉCNICA ESCOLA TÉCNICA ESTADUAL REPÚBLICA Aulas de Apoio Química 3ª Série Eletroquímica II 1.
GOVERNO DO ESTADO DO RIO DE JANEIRO SECRETARIA DE ESTADO DE CIÊNCIA E TECNOLOGIA FUNDAÇÃO DE APOIO À ESCOLA TÉCNICA ESCOLA TÉCNICA ESTADUAL REPÚBLICA Aulas de Apoio Química 3ª Série Eletroquímica II 1.
Resolução de Química UFRGS / 2012
 26. Resposta C Resolução de Química UFRGS / 2012 Água super-resfriada é água líquida em temperatura abaixo do seu ponto de congelamento. Geralmente ocorre num resfriamento lento e sem agitação onde qualquer
26. Resposta C Resolução de Química UFRGS / 2012 Água super-resfriada é água líquida em temperatura abaixo do seu ponto de congelamento. Geralmente ocorre num resfriamento lento e sem agitação onde qualquer
HIDROGÊNIO CQ133 FSN
 HIDROGÊNIO CQ133 FSN GASES NOBRES CQ133 FSN HIDROGÊNIO o hidrogênio é o elemento mais abundante do universo com 92% seguido do hélio (7%) e os demais elementos (1%); é quarto elemento mais abundante na
HIDROGÊNIO CQ133 FSN GASES NOBRES CQ133 FSN HIDROGÊNIO o hidrogênio é o elemento mais abundante do universo com 92% seguido do hélio (7%) e os demais elementos (1%); é quarto elemento mais abundante na
e - Zinco ZnSO 4 Zn(s) Zn 2 Zn(s) Zn 2+ (aq) + 2 e - + 0,76 V Cu(s) Cu 2+ (aq) + 2 e - - 0,34 V
 Capítulo 7 Introdução teórica Pilhas e baterias são células eletroquímicas ou células galvânicas que produzem energia elétrica por meio de reações de oxirredução. A diferença básica é que a bateria é formada
Capítulo 7 Introdução teórica Pilhas e baterias são células eletroquímicas ou células galvânicas que produzem energia elétrica por meio de reações de oxirredução. A diferença básica é que a bateria é formada
Ministério da Educação Universidade Tecnológica Federal do Paraná Diretoria de Pesquisa e Pós-Graduação Programa de Pós-Graduação em Química
 Ministério da Educação Universidade Tecnológica Federal do Paraná Diretoria de Pesquisa e Pós-Graduação Programa de Pós-Graduação em Química PR UNIVERSIDADE TECNOLÓGICA FEDERAL DO PARANÁ CADERNO DE PROVAS
Ministério da Educação Universidade Tecnológica Federal do Paraná Diretoria de Pesquisa e Pós-Graduação Programa de Pós-Graduação em Química PR UNIVERSIDADE TECNOLÓGICA FEDERAL DO PARANÁ CADERNO DE PROVAS
PROCESSO SELETIVO DE TRANSFERÊNCIA EXTERNA CADERNO DE PROVAS
 PROCESSO SELETIVO DE TRANSFERÊNCIA EXTERNA 20/10/2013 INSTRUÇÕES CADERNO DE PROVAS 1. Confira, abaixo, seu nome e número de inscrição. Confira, também, o curso e a série correspondentes à sua inscrição.
PROCESSO SELETIVO DE TRANSFERÊNCIA EXTERNA 20/10/2013 INSTRUÇÕES CADERNO DE PROVAS 1. Confira, abaixo, seu nome e número de inscrição. Confira, também, o curso e a série correspondentes à sua inscrição.
Programa de Pós-Graduação em Química
 1/12 Programa de Pós-Graduação em Química PROVA DE CONHECIMENTOS ESPECÍFICOS Nível: DOUTORADO Duração da Prova: 4 horas São José do Rio Preto, 16 de Março de 2015. QUESTÕES DE QUÍMICA 2/12 Código de Matrícula:
1/12 Programa de Pós-Graduação em Química PROVA DE CONHECIMENTOS ESPECÍFICOS Nível: DOUTORADO Duração da Prova: 4 horas São José do Rio Preto, 16 de Março de 2015. QUESTÕES DE QUÍMICA 2/12 Código de Matrícula:
UFJF CONCURSO VESTIBULAR PROVA DE QUÍMICA
 Questão 1 Sabe-se que compostos constituídos por elementos do mesmo grupo na tabela periódica possuem algumas propriedades químicas semelhantes. Entretanto, enquanto a água é líquida em condições normais
Questão 1 Sabe-se que compostos constituídos por elementos do mesmo grupo na tabela periódica possuem algumas propriedades químicas semelhantes. Entretanto, enquanto a água é líquida em condições normais
ELETROQUÍMICA: PILHAS GALVÂNICAS
 ELETROQUÍMICA: PILHAS GALVÂNICAS A Eletroquímica é a parte da Química que estuda as propriedades dos eletrólitos e os processos de interconversão de energia química em energia elétrica que ocorrem na superfície
ELETROQUÍMICA: PILHAS GALVÂNICAS A Eletroquímica é a parte da Química que estuda as propriedades dos eletrólitos e os processos de interconversão de energia química em energia elétrica que ocorrem na superfície
Exercícios sobre eletrólise em solução aquosa - Eletroquímica
 Exercícios sobre eletrólise em solução aquosa - Eletroquímica 01. (Cesgranrio) O voltômetro de Hoffman anterior, é usado para realizar a eletrólise da água. Se a eletrólise de uma solução diluída de H
Exercícios sobre eletrólise em solução aquosa - Eletroquímica 01. (Cesgranrio) O voltômetro de Hoffman anterior, é usado para realizar a eletrólise da água. Se a eletrólise de uma solução diluída de H
QUESTÕES. 1. Complete a tabela com os Números de Oxidação das espécies químicas: Espécie Química
 2º EM Química B Natalia Av. Dissertativa 30/03/16 INSTRUÇÕES PARA A REALIZAÇÃO DA PROVA LEIA COM MUITA ATENÇÃO 1. Verifique, no cabeçalho desta prova, se seu nome, número e turma estão corretos. 2. Esta
2º EM Química B Natalia Av. Dissertativa 30/03/16 INSTRUÇÕES PARA A REALIZAÇÃO DA PROVA LEIA COM MUITA ATENÇÃO 1. Verifique, no cabeçalho desta prova, se seu nome, número e turma estão corretos. 2. Esta
Determine o abaixamento relativo da pressão de vapor do solvente quando ) são dissolvidos em 117,2 ml de etanol a 25 o C.
 1 a QUESTÃO Valor: 1,0 Considerando os elementos químicos Be, B, F, Ca e Cs, classifique-os em ordem crescente de acordo com as propriedades periódicas indicadas: a. raio atômico; b. primeira energia de
1 a QUESTÃO Valor: 1,0 Considerando os elementos químicos Be, B, F, Ca e Cs, classifique-os em ordem crescente de acordo com as propriedades periódicas indicadas: a. raio atômico; b. primeira energia de
Exame 2º Ano Modalidade B
 Questão 01 O Bismuto é um elemento muito usado na indústria de cosméticos, devido sua baixa toxicidade. O isótopo mais estável do Bismuto apresenta número de massa 209 e dar origem ao íon Bi 3+ (forma
Questão 01 O Bismuto é um elemento muito usado na indústria de cosméticos, devido sua baixa toxicidade. O isótopo mais estável do Bismuto apresenta número de massa 209 e dar origem ao íon Bi 3+ (forma
Professor: Alfênio. 06- A ilustração a seguir ilustra a eletrólise de uma solução aquosa de cloreto de cobre (II).
 Professor: Alfênio 01- (MACK-SP) Na eletrólise ígnea de NaCl, verifica-se que: a) no cátodo, deposita-se sódio metálico. b) no ânodo, ocorre redução. c) no cátodo, ocorre oxidação. d) no ânodo, há deposição
Professor: Alfênio 01- (MACK-SP) Na eletrólise ígnea de NaCl, verifica-se que: a) no cátodo, deposita-se sódio metálico. b) no ânodo, ocorre redução. c) no cátodo, ocorre oxidação. d) no ânodo, há deposição
Faculdade de Ciências da Universidade do Porto Departamento de Química. Programa do 10º ano e do 11º ano de Química do Ensino Secundário
 Faculdade de Ciências da Universidade do Porto Departamento de Química Programa da Prova de Acesso de Química (2016): Exemplos de exercícios 1.Indique a afirmação correcta. Programa do 10º ano e do 11º
Faculdade de Ciências da Universidade do Porto Departamento de Química Programa da Prova de Acesso de Química (2016): Exemplos de exercícios 1.Indique a afirmação correcta. Programa do 10º ano e do 11º
Revisão Específicas. Química Monitores: Luciana Lima e Rafael França 02-08/11/2015. Material de Apoio para Monitoria
 Revisão Específicas 1. As conchas marinhas não se dissolvem apreciavelmente na água do mar, por serem compostas, na sua maioria, de carbonato de cálcio, um sal insolúvel cujo produto de solubilidade é
Revisão Específicas 1. As conchas marinhas não se dissolvem apreciavelmente na água do mar, por serem compostas, na sua maioria, de carbonato de cálcio, um sal insolúvel cujo produto de solubilidade é
Prática 01 Reações e equações químicas
 UNIVERSIDADE DO ESTADO DE SANTA CATARINA CENTRO DE CIÊNCIAS TECNOLÓGICAS CCT DEPARTAMENTO DE QUÍMICA DQMC Disciplina: Química Geral Experimental QEX0002 Prática 01 Reações e equações químicas 1. Introdução
UNIVERSIDADE DO ESTADO DE SANTA CATARINA CENTRO DE CIÊNCIAS TECNOLÓGICAS CCT DEPARTAMENTO DE QUÍMICA DQMC Disciplina: Química Geral Experimental QEX0002 Prática 01 Reações e equações químicas 1. Introdução
FUVEST Segunda Fase. Química 06/01/2003
 FUVEST 2003 Segunda Fase Química 06/01/2003 Q.01 Em 1861, o pesquisador Kekulé e o professor secundário Loschmidt apresentaram, em seus escritos, as seguintes fórmulas estruturais para o ácido acético
FUVEST 2003 Segunda Fase Química 06/01/2003 Q.01 Em 1861, o pesquisador Kekulé e o professor secundário Loschmidt apresentaram, em seus escritos, as seguintes fórmulas estruturais para o ácido acético
Gabarito Prova de Conhecimentos em Química Mestrado/Doutorado 1/2018 PPGQ/IQ/UnB
 Gabarito Prova de Conhecimentos em Química Mestrado/Doutorado 1/2018 PPGQ/IQ/UnB Questão 1 - Em 1888, Rydberg mostrou que o espectro de linhas do átomo de hidrogênio poderia ser descrito pela expressão
Gabarito Prova de Conhecimentos em Química Mestrado/Doutorado 1/2018 PPGQ/IQ/UnB Questão 1 - Em 1888, Rydberg mostrou que o espectro de linhas do átomo de hidrogênio poderia ser descrito pela expressão
RELATÓRIO: EXPERIMENTOS SOBRE ELETROQUÍMICA ENTREGA EM
 RELATÓRIO: EXPERIMENTOS SOBRE ELETROQUÍMICA ENTREGA EM 08-12-2017 IMPORTANTE Esse documento apresenta o roteiro que você deve seguir para elaborar o relatório sobre os experimentos de eletroquímica. Organize
RELATÓRIO: EXPERIMENTOS SOBRE ELETROQUÍMICA ENTREGA EM 08-12-2017 IMPORTANTE Esse documento apresenta o roteiro que você deve seguir para elaborar o relatório sobre os experimentos de eletroquímica. Organize
Química FUVEST b) Calcule a quantidade, em mols, de carbonato de amônio e de carbonato de cálcio na mistura original.
 Q.01 Uma mistura de carbonato de amônio e carbonato de cálcio foi aquecida até a completa decomposição. Obteve-se 0,20 mol de um resíduo sólido, além de uma mistura gasosa que, resfriada a 25 ºC, condensou-se
Q.01 Uma mistura de carbonato de amônio e carbonato de cálcio foi aquecida até a completa decomposição. Obteve-se 0,20 mol de um resíduo sólido, além de uma mistura gasosa que, resfriada a 25 ºC, condensou-se
Aluno(a): Instituição de Ensino: Município: Coordenador da Instituição de Ensino: ATENÇÃO: O DESENVOLVIMENTO TEÓRICO DAS QUESTÕES É OBRIGATÓRIO
 VIII Olimpíada Capixaba de Química 2010 Prova do Grupo I 1 a série do ensino médio Aluno(a): Instituição de Ensino: Município: Coordenador da Instituição de Ensino: ATENÇÃO: O DESENVOLVIMENTO TEÓRICO DAS
VIII Olimpíada Capixaba de Química 2010 Prova do Grupo I 1 a série do ensino médio Aluno(a): Instituição de Ensino: Município: Coordenador da Instituição de Ensino: ATENÇÃO: O DESENVOLVIMENTO TEÓRICO DAS
