2-Nos sistemas abaixo, diga quantos átomos, elementos, moléculas e substâncias estão representados:
|
|
|
- Heitor Back Veiga
- 7 Há anos
- Visualizações:
Transcrição
1 LISTA DE EXERCÍCIOS- 1 1-Classifique os processos em físicos ou químicos: a) Sublimação do gelo seco b) Solidificação da água c) Queima da gasolina d) Roupa secando no varal e) Amassar papel - f) Combustão do hidrogênio g) Furar um pneu h) Metabolismo do açúcar durante a respiração i) Enferrujamento de um prego j) Formação do ozônio a partir do oxigênio no ozonizador 2-Nos sistemas abaixo, diga quantos átomos, elementos, moléculas e substâncias estão representados: 3-A tabela a seguir fornece os pontos de fusão e de ebulição (sob pressão de 1atm) de algumas substâncias. Substância Fusão /ºC Ebulição/ºC Fenol Pentano Clorofórmio Etanol Considere essas substâncias na Antártida (temperatura de 3Cº), em Porto Alegre (temperatura de 2Cº) e no deserto do Saara (temperatura de Cº). Qual os estados físicos das substâncias em questão nos três locais indicados? 4)A seguir, observe a reprodução do rótulo de uma garrafa de água mineral: Composição química provável Sulfato de cálcio,38mg/l Bicarbonato de cálcio,167mg/l Com base nas informações contidas neste rótulo, podemos classificar a água mineral como uma substância pura ou uma mistura? Por quê? -Ao ser submetido à ebulição, observou-se que um sistema apresentou temperatura constante durante todo o processo (nada foi dito em relação a fusão). O que podemos concluir sobre a classificação deste sistema? Faça um gráfico T x t para representar este sistema. 1
2 6- Observe as figuras: Essas figuras mostram as posições de equilíbrio de um mesmo corpo, quando colocados em recipientes que contém três líquidos diferentes. Os líquidos não são miscíveis entre si. Se colocássemos os três líquidos em um mesmo recipiente, a posição final de equilíbrio poderia ser representada de que forma? (Sua resposta deve ser dada sob a forma de um desenho). 7)Classifique os sistemas em homogêneos ou heterogêneos. a)água + gasolina b)água + sal dissolvido c)água + sal dissolvido + sal não dissolvido d)água + gelo e)ar f)água + álcool g) água + óleo i)leite j)suco de laranja 8) Analise a tabela abaixo: SUBSTÂNCIA PF ( C) PE( C) I Clorofórmio II Éter etílico III Etanol IV Fenol V Pentano Com relação ao estado físico (sólido, líquido, gasoso) das substâncias da tabela quando se encontram em um ambiente a 4 C e na pressão a 1atm, a alternativa verdadeira é: A) IV, II e III são sólidos B)I II e V são líquidos C)II e V são vapores D)I, II, III e V são gases 9) Observe a tabela que apresenta as temperaturas de fusão e de ebulição de algumas substâncias. Substância TF ( C) TE ( C) I -117,3 78, II -93,9 6 III IV Em relação aos estados físicos das substâncias, a alternativa correta é: a) I é sólido a 2 C b)ii é líquido a 8 C c)iii é líquido a C d)iv é gasoso a 3 C 2
3 ) O gráfico abaixo representa a curva de resfriamento, temperatura em função do tempo, de uma substância pura. 18 A B C 6 D E t ( min 9) Com base no gráfico, responda: a)qual os estados físicos nos trechos A,B,C,D e E b)qual a temperatura de condensação? c) Qual a temperatura de solidificação? d)qual o estado físico e a temperatura 2 após decorridos 3 42 minutos? ) Uma amostra de uma espécie química foi analisada em um laboratório e, como resultado, obteve-se o seguinte gráfico: a)qual o ponto de fusão e ebulição? b)qual os estados físicos nos trechos 1,2,3,4, ) Durante a fusão de um material, verifica-se que a temperatura se mantém constante até o fim da fusão. Esse material: A)certamente é uma substância pura B)certamente é uma substância pura C)Pode ser uma substância pura ou uma mistura eutética D)Pode ser uma substância pura ou uma mistura azeotrópica 13) Qual(is) dos gráficos abaixo representa o aquecimento de uma substância pura: t ( min ) A B C D 4 3 3
4 14) No exercício anterior, qual dos 2 gráficos 3 abaixo 4 representa 6 uma 7mistura 8 azeotrópica? 9 1)Analisando o gráfico abaixo, referente ao aquecimento de uma substância sólida, podemos afirmar que: A)quando t=2minutos, tem-se um sistema monofásico B) quando t=4minutos, coexistem a substância sólida e a substância líquida C)em t=1minuto inicia-se a liquefação da substância D)a substância tem PF=4ºC E)no intervalo de a 8 minutos, a substância encontra-se totalmente na forma de vapor 16)Sabendo que o ouro 18 quilates é formado por 7% de ouro e 2% de prata E cobre, em massa. Identifique o gráfico que melhor representa a sua fusão. Justifique )A superfície externa de uma garrafa fria torna-se molhada quando exposta ao ar. Qual o nome desse fenômeno?. 18) Uma única substância (substância pura) sempre constituirá um sistema monofásico. Justifique se a afirmação é sempre correta. 19)Um vidro contém 2 cm 3 de mercúrio de densidade 13,6 g/cm 3. Qual a massa de mercúrio contida no vidro em kg? 2)Em condições ambientes, a densidade do mercúrio é de aproximadamente 13 g/cm 3. Qual a massa desse metal necessária para um garimpeiro encher completamente um frasco de meio litro? 21)Em uma cena de um filme, um indivíduo corre carregando uma maleta tipo 7 (volume de 2 dm 3 ) cheia de barras de um certo metal. Considerando que um adulto de massa (7kg) pode deslocar, com uma certa velocidade, no máximo o equivalente a sua massa, indique qual o metal contido na maleta, observando os dados a seguir. (Dado: 1dm 3 = 1L = cm 3 ).Densidades: alumínio: 2.7g/cm 3, zinco: 7.1g/cm 3, prata:.g/cm 3, chumbo: 11.4g/cm 3, ouro:19.3g/cm 3. 4
5 LISTA DE EXERCÍCIOS Qual é a massa de 2 cm 3 de ferro, sabendo que a densidade absoluta do ferro é de 7,86g/cm 3 2. Calcule a densidade da acetona, sabendo que a massa de 2,376g de acetona ocupam o volume de,3l. 3. Os pulmões bombeiam em média, 114L de ar por dia. Considerando que o ar possui uma densidade igual a 1,2g/L, qual o valor da massa de ar que participa desse fenômeno? Mostre o valor da massa em g e em Kg. 4. A massa de determinada substância é 24g e seu volume corresponde a 38cm 3. Qual a densidade da substância em g/ml.. Considere os átomos: 3 I 127 3I 131 Agora responda: a) Qual o número de prótons, elétrons e nêutrons de cada um desses átomos? b) Como você os classificaria? 6. Sabendo que o argônio 4 e o cálcio 4 podem ser representados por: 18 Ar 4 e 2 Ca 4. a) Determine seus números de prótons, elétrons e nêutrons. b) Responda se esses átomos são isótonos. Justifique. 7. ( PUC-SP) O átomo M é isótopo de 6 X e isóbaro de 7 Q. Sabendo que o átomo Q possui três nêutrons a menos que o átomo de flúor ( Z = 9 e A = 19), determine o número atômico e o número de massa do átomo M. 8.. (Mackenzie) Os elementos 2x 1 A 4x e 2x B 3x + 8 são isóbaros. Qual é o número de nêutrons de A e B? 9. A densidade de um material é 8,8g/ml. Esse material apresenta massa,2 ton. O volume que o material irá deslocar é de: a) 176 ml b) 2,27 ml c),44 ml d) 22,7 ml e) 227 ml. ( G1 ETESP) Os átomos X e Y são isótopos e apresentam as seguintes características: A + X 3A 2A Y 3A 2 O número de massa de X e Y são respectivamente: a) 4 e 43 b) 4 e 41 c) 43 e 43 d) 43 e 41 e) 41 e 4
6 11. (USF - Carlos Chagas)Um elemento cujo átomo possui 2 nêutrons e apresenta distribuição eletrônica no estado fundamental 1s 2 2s 2 2p 6 3s 2 3p 6 4s 1 tem: a) número atômico 2 e número de massa 39; b) número atômico 39 e número de massa 2; c) número atômico 19 e número de massa 2; d) número atômico 19 e número de massa 39; e) número atômico 39 e número de massa (FUVEST) O número de elétrons do cátion X +2 de um elemento X é igual ao número de elétrons do átomo no estado normal de um gás nobre. Este átomo de gás nobre apresenta número atômico e número de massa 2. O número atômico do elemento X é: a) 8 b) c) 12 d) 18 e) (UNIP SP) Qual a distribuição eletrônica, em subníveis, para o cátion Ca ++? Dado: nº atômico do cálcio = 2. a) 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 b) 1s 2 2s 2 2p 6 3s 2 3p 6 3d 2 c) 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 2 d) 1s 2 2s 2 2p 6 3s 2 e) 1s 2 2s 2 2p 6 3s 2 3p 6 14 Faça a distribuição eletrônica dos átomos e íons abaixo representados utilizando o Diagrama de Pauling e em camadas.. OBS: Os números atômicos dados são do átomo no estado normal. a. I (Z = 3) b. Br (Z = 3) c. Ba +2 (Z = 6) d. N -2 (Z = 7) e. Fe +2 (Z = 26) 6
Disciplina: Química Segmento: EM Ano/Série: 1º Turma: TA Assunto: Roteiro de Estudos Para Recuperação da I Etapa /2019 Aluno (a): Nº: Nota:
 Disciplina: Química Segmento: EM Ano/Série: 1º Turma: TA Assunto: Roteiro de Estudos Para Recuperação da I Etapa /2019 Aluno (a): Nº: Nota: Valor: 5,0 Pontos Professor (a): Rodrigo Xavier Querido (a) aluno
Disciplina: Química Segmento: EM Ano/Série: 1º Turma: TA Assunto: Roteiro de Estudos Para Recuperação da I Etapa /2019 Aluno (a): Nº: Nota: Valor: 5,0 Pontos Professor (a): Rodrigo Xavier Querido (a) aluno
ROTEIRO DE RECUPERAÇÃO FINAL DE QUÍMICA
 ROTEIRO DE RECUPERAÇÃO FINAL DE QUÍMICA Nome: Nº Série: 9º EFII Data: / /2015 Professor: Gustavo/Priscila Anual I. Introdução Caro aluno, Neste ano de 2015 você não obteve o mínimo de pontos e, por isso
ROTEIRO DE RECUPERAÇÃO FINAL DE QUÍMICA Nome: Nº Série: 9º EFII Data: / /2015 Professor: Gustavo/Priscila Anual I. Introdução Caro aluno, Neste ano de 2015 você não obteve o mínimo de pontos e, por isso
BIMESTRAL QUÍMICA - 1ºBIMESTRE
 BIMESTRAL QUÍMICA - 1ºBIMESTRE Série: 3ªEM Gabarito Questão 01) O vapor obtido pela ebulição das seguintes soluções: I. água e sal II. água e açúcar III. água e álcool é constituído de água pura apenas:
BIMESTRAL QUÍMICA - 1ºBIMESTRE Série: 3ªEM Gabarito Questão 01) O vapor obtido pela ebulição das seguintes soluções: I. água e sal II. água e açúcar III. água e álcool é constituído de água pura apenas:
Lista de Exercício. 1- Observe a representação dos sistemas I, II e III e seus componentes. Qual o número de fases em cada sistema?
 Professor: Cassio Pacheco Disciplina: Química 1 Ano Data de entrega: 07/04/2016 Lista de Exercício 1- Observe a representação dos sistemas I, II e III e seus componentes. Qual o número de fases em cada
Professor: Cassio Pacheco Disciplina: Química 1 Ano Data de entrega: 07/04/2016 Lista de Exercício 1- Observe a representação dos sistemas I, II e III e seus componentes. Qual o número de fases em cada
Roteiro de Estudo para a Recuperação Semestral QUÍMICA 9º ano
 Roteiro de Estudo para a Recuperação Semestral QUÍMICA 9º ano NOME: IMPRIMA AS FOLHAS. RESOLVA AS QUESTÕES DISSERTATIVAS EM FOLHA DE PAPEL ALMAÇO OU FOLHA DE FICHÁRIO; OS TESTES PODERÃO SER RESPONDIDOS
Roteiro de Estudo para a Recuperação Semestral QUÍMICA 9º ano NOME: IMPRIMA AS FOLHAS. RESOLVA AS QUESTÕES DISSERTATIVAS EM FOLHA DE PAPEL ALMAÇO OU FOLHA DE FICHÁRIO; OS TESTES PODERÃO SER RESPONDIDOS
PROMILITARES 09/08/2018 QUÍMICA. Professora Caroline Azevedo ASPECTOS MACROSCÓPICOS
 QUÍMICA Professora Caroline Azevedo ASPECTOS MACROSCÓPICOS Conteúdos abordados na aula de hoje: 1. Matéria, corpo e objeto; 2. Energias; 3. Fenômenos; 4. Classificação da matéria. Matéria e suas transformações
QUÍMICA Professora Caroline Azevedo ASPECTOS MACROSCÓPICOS Conteúdos abordados na aula de hoje: 1. Matéria, corpo e objeto; 2. Energias; 3. Fenômenos; 4. Classificação da matéria. Matéria e suas transformações
1. Considere a tabela de pontos de fusão e ebulição das substâncias a seguir, a 1 atm de pressão:
 1. Considere a tabela de pontos de fusão e ebulição das substâncias a seguir, a 1 atm de pressão: Substância PF ( C) PE ( C) Cloro -101,0-34,6 Flúor -219,6-188,1 Bromo -7,2 58,8 Mercúrio -38,8 356,6 Iodo
1. Considere a tabela de pontos de fusão e ebulição das substâncias a seguir, a 1 atm de pressão: Substância PF ( C) PE ( C) Cloro -101,0-34,6 Flúor -219,6-188,1 Bromo -7,2 58,8 Mercúrio -38,8 356,6 Iodo
FÍSICA PROFº JAISON MATTEI
 FÍSICA PROFº JAISON MATTEI A MATÉRIA E SUAS TRANSFORMAÇÕES As mudanças de estado físico da água. Diagrama de mudanças de estado físico. 01. Um cientista recebeu uma substância desconhecida, no estado sólido,
FÍSICA PROFº JAISON MATTEI A MATÉRIA E SUAS TRANSFORMAÇÕES As mudanças de estado físico da água. Diagrama de mudanças de estado físico. 01. Um cientista recebeu uma substância desconhecida, no estado sólido,
TC DE QUÍMICA 1ª ETAPA
 T( C) T( C) T( C) T( C) T( C) T( C) TC DE QUÍMICA 1ª ETAPA 1.Classifique os processos em físicos ou químicos: A. Sublimação do gelo seco B. Solidificação da água C. Queima da gasolina D. Roupa secando
T( C) T( C) T( C) T( C) T( C) T( C) TC DE QUÍMICA 1ª ETAPA 1.Classifique os processos em físicos ou químicos: A. Sublimação do gelo seco B. Solidificação da água C. Queima da gasolina D. Roupa secando
Disciplina: Química Professor: Cassio Pacheco Turma: 1 Ano
 Disciplina: Química Professor: Cassio Pacheco Turma: 1 Ano Roteiro de Estudos 1- A queima da gasolina; a sublimação da naftalina; o enferrujamento do prego e o derretimento de um bloco de gelo são respectivamente,
Disciplina: Química Professor: Cassio Pacheco Turma: 1 Ano Roteiro de Estudos 1- A queima da gasolina; a sublimação da naftalina; o enferrujamento do prego e o derretimento de um bloco de gelo são respectivamente,
Exercícios de Recuperação
 Ensino Fundamental Nível II Comp. Curricular: Ciências Data: 1º e 2º Período Aluno(a): Nº Turma: 1-9 Professor: Ana Cristina D Azevedo Visto: Nota: Exercícios de Recuperação Fenômenos 1. As transformações
Ensino Fundamental Nível II Comp. Curricular: Ciências Data: 1º e 2º Período Aluno(a): Nº Turma: 1-9 Professor: Ana Cristina D Azevedo Visto: Nota: Exercícios de Recuperação Fenômenos 1. As transformações
TRABALHO DE RECUPERAÇÃO 1º TRIMESTRE - QUÍMICA 9º ANO Nome: Turma:
 TRABALHO DE RECUPERAÇÃO 1º TRIMESTRE - QUÍMICA 9º ANO Nome: Turma: ROTEIRO E INSTRUÇÕES: Estados físicos da matéria. Mudanças de estado físico. Substâncias e misturas. O trabalho deve ser respondido à
TRABALHO DE RECUPERAÇÃO 1º TRIMESTRE - QUÍMICA 9º ANO Nome: Turma: ROTEIRO E INSTRUÇÕES: Estados físicos da matéria. Mudanças de estado físico. Substâncias e misturas. O trabalho deve ser respondido à
LISTA DE EXERCÍCIOS 1º TRIMESTRE
 LISTA DE EXERCÍCIOS 1º TRIMESTRE Nome: nº: Ano: 1 A E.M. Data: / / 218 Professor Cassio Pacheco 1- Faça a distribuição eletrônica em subníveis e níveis de energia para os elementos: a) 12 Mg b) 2 Ca c)
LISTA DE EXERCÍCIOS 1º TRIMESTRE Nome: nº: Ano: 1 A E.M. Data: / / 218 Professor Cassio Pacheco 1- Faça a distribuição eletrônica em subníveis e níveis de energia para os elementos: a) 12 Mg b) 2 Ca c)
Lista de Revisão para Prova Específica. Fazer em folha separada! (respostas com devida resolução). Entregar no final da aula.
 Lista de Revisão para Prova Específica Fazer em folha separada! (respostas com devida resolução). Entregar no final da aula. 1) alcule o volume ocupado por 320g de O 2 a 327 0 e sob pressão de 2 atm (R
Lista de Revisão para Prova Específica Fazer em folha separada! (respostas com devida resolução). Entregar no final da aula. 1) alcule o volume ocupado por 320g de O 2 a 327 0 e sob pressão de 2 atm (R
SUBSTÂNCIA PURA & MISTURAS
 SUBSTÂNCIA PURA & MISTURAS Química Professora: Danielle Átomos & Moléculas H + H H H H + H + O O H H Átomos Moléculas Sistemas Materiais Substância Pura Mistura Simples Composta Homogênea Heterogênea
SUBSTÂNCIA PURA & MISTURAS Química Professora: Danielle Átomos & Moléculas H + H H H H + H + O O H H Átomos Moléculas Sistemas Materiais Substância Pura Mistura Simples Composta Homogênea Heterogênea
Recursos para Estudo / Atividades
 COLÉGIO NOSSA SENHORA DA PIEDADE Programa de Recuperação Paralela 1ª Etapa 2014 Disciplina: QUÍMICA Ano: 1º Professora: Maria Luiza ENSINO MÉDIO Caro aluno, você está recebendo o conteúdo de recuperação.
COLÉGIO NOSSA SENHORA DA PIEDADE Programa de Recuperação Paralela 1ª Etapa 2014 Disciplina: QUÍMICA Ano: 1º Professora: Maria Luiza ENSINO MÉDIO Caro aluno, você está recebendo o conteúdo de recuperação.
Atividade extra. Questão 1 Cecierj Questão 2 Cecierj Ciências da Natureza e suas Tecnologias Química
 Atividade extra Questão 1 Cecierj - 2013 Desenhe uma esfera de ferro e outra de chumbo que tenham massas iguais. Para isso, considere as seguintes densidades: densidade do ferro = 7,9 g/cm3 densidade do
Atividade extra Questão 1 Cecierj - 2013 Desenhe uma esfera de ferro e outra de chumbo que tenham massas iguais. Para isso, considere as seguintes densidades: densidade do ferro = 7,9 g/cm3 densidade do
9 o EF. Jeosafá de P. Lima
 9 o EF QUÍMICA Estudo dirigido Jeosafá de P. Lima Todas 1- A combustão do gás de cozinha (gás butano) é representada pela equação química abaixo: C4H10 + 13 / 2 O2 4 CO2 + 5 H2O O número de substâncias
9 o EF QUÍMICA Estudo dirigido Jeosafá de P. Lima Todas 1- A combustão do gás de cozinha (gás butano) é representada pela equação química abaixo: C4H10 + 13 / 2 O2 4 CO2 + 5 H2O O número de substâncias
ASSINATURA DO RESPONSÁVEL:
 ED. INFANTIL, ENSINO FUNDAMENTAL, MÉDIO E TÉCNICO Av. Tancredo Neves, 3500 Bairro Universitário Cep.: 35.170-056 Coronel Fabriciano MG - Tel.: (31) 3846-5777 - e-mail: secretaria@padredeman.g12.br Mantenedora:
ED. INFANTIL, ENSINO FUNDAMENTAL, MÉDIO E TÉCNICO Av. Tancredo Neves, 3500 Bairro Universitário Cep.: 35.170-056 Coronel Fabriciano MG - Tel.: (31) 3846-5777 - e-mail: secretaria@padredeman.g12.br Mantenedora:
Atividades de Recuperação Paralela de Química
 Atividades de Recuperação Paralela de Química 1ª série Ensino Médio. Conteúdos para estudos: Química A Livro-texto Capítulo 1 SUBSTÂNCIAS QUÍMICAS: Diferenciar fenômenos químicos e físicos, diferenciar
Atividades de Recuperação Paralela de Química 1ª série Ensino Médio. Conteúdos para estudos: Química A Livro-texto Capítulo 1 SUBSTÂNCIAS QUÍMICAS: Diferenciar fenômenos químicos e físicos, diferenciar
Atividades de Recuperação Paralela de Química Setor A
 Atividades de Recuperação Paralela de Química Setor A 1ª série Ensino Médio. Conteúdos para estudos: Livro-texto Capítulo 1 SUBSTÂNCIAS QUÍMICAS: Diferenciar fenômenos químicos e físicos, diferenciar substâncias
Atividades de Recuperação Paralela de Química Setor A 1ª série Ensino Médio. Conteúdos para estudos: Livro-texto Capítulo 1 SUBSTÂNCIAS QUÍMICAS: Diferenciar fenômenos químicos e físicos, diferenciar substâncias
SUBSTÂNCIAS E MISTURAS
 SUBSTÂNCIAS E MISTURAS SUBSTÂNCIAS Uma substância química (ou apenas substância) é um material que apresenta um conjunto de propriedades bem definido e constante e tem composição fixa, independente da
SUBSTÂNCIAS E MISTURAS SUBSTÂNCIAS Uma substância química (ou apenas substância) é um material que apresenta um conjunto de propriedades bem definido e constante e tem composição fixa, independente da
Colégio Santa Dorotéia Área de Ciências da Natureza Disciplina: Química Ano: 1 o Ensino Médio Professora: Karine R. de Almeida
 Área de Ciências da Natureza Disciplina: Ano: 1 o Ensino Médio Professora: Karine R. de Almeida Atividades para Estudos Autônomos Data: 3 / 4 / 2019 QUESTÃO 1 (KRA-2019) Aluno(a): N o : Turma: ATIVIDADES
Área de Ciências da Natureza Disciplina: Ano: 1 o Ensino Médio Professora: Karine R. de Almeida Atividades para Estudos Autônomos Data: 3 / 4 / 2019 QUESTÃO 1 (KRA-2019) Aluno(a): N o : Turma: ATIVIDADES
III OLIMPÍADA DE QUÍMICA DO GRANDE ABC - 03/06/2017
 III OLIMPÍADA DE QUÍMICA DO GRANDE ABC - 03/06/2017 ENSINO FUNDAMENTAL 9. o ano - FASE 2 INSTRUÇÕES: 1. A prova consta de 3 questões discursivas (5 pontos cada) e de 17 questões objetivas (1 ponto cada),
III OLIMPÍADA DE QUÍMICA DO GRANDE ABC - 03/06/2017 ENSINO FUNDAMENTAL 9. o ano - FASE 2 INSTRUÇÕES: 1. A prova consta de 3 questões discursivas (5 pontos cada) e de 17 questões objetivas (1 ponto cada),
ED. INFANTIL, ENSINO FUNDAMENTAL, MÉDIO E TÉCNICO
 ED. INFANTIL, ENSINO FUNDAMENTAL, MÉDIO E TÉCNICO Av. Tancredo Neves, 3500 Bairro Universitário Cep.: 35.170-056 Coronel Fabriciano MG - Tel.: (31) 3846-5777 - e-mail: secretaria@padredeman.g12.br Mantenedora:
ED. INFANTIL, ENSINO FUNDAMENTAL, MÉDIO E TÉCNICO Av. Tancredo Neves, 3500 Bairro Universitário Cep.: 35.170-056 Coronel Fabriciano MG - Tel.: (31) 3846-5777 - e-mail: secretaria@padredeman.g12.br Mantenedora:
1) As substâncias puras benzeno, clorofórmio, hexano e álcool etílico encontram-se em frascos identificados apenas pelas letras A, B, C e D.
 Química Gabarito Avaliação de Sala 1B 1 os anos Décio mar/12 Nome: Nº: Turma: 1) As substâncias puras benzeno, clorofórmio, hexano e álcool etílico encontram-se em frascos identificados apenas pelas letras
Química Gabarito Avaliação de Sala 1B 1 os anos Décio mar/12 Nome: Nº: Turma: 1) As substâncias puras benzeno, clorofórmio, hexano e álcool etílico encontram-se em frascos identificados apenas pelas letras
1. (Vunesp) Nesta tabela periódica, os algarismos romanos substituem os símbolos dos elementos. Sobre tais elementos, é correto afirmar que:
 1º ano E.M. APE 1. (Vunesp) Nesta tabela periódica, os algarismos romanos substituem os símbolos dos elementos. Sobre tais elementos, é correto afirmar que: a) I e II são líquidos à temperatura ambiente.
1º ano E.M. APE 1. (Vunesp) Nesta tabela periódica, os algarismos romanos substituem os símbolos dos elementos. Sobre tais elementos, é correto afirmar que: a) I e II são líquidos à temperatura ambiente.
Classificação da Matéria (Substância e Alotropia), Introdução à Atomística, Modelo de Rutherford-Böhr e Distribuição Eletrônica
 Classificação da Matéria (Substância e Alotropia), Introdução à Atomística, Modelo de Rutherford-Böhr e Distribuição Eletrônica Classificação da Matéria (Substância e Alotropia), Introdução à Atomística,
Classificação da Matéria (Substância e Alotropia), Introdução à Atomística, Modelo de Rutherford-Böhr e Distribuição Eletrônica Classificação da Matéria (Substância e Alotropia), Introdução à Atomística,
ORIENTAÇÃO DE ESTUDOS
 ORIENTAÇÃO DE ESTUDOS RECUPERAÇÃO SEMESTRAL 9º Ano do Ensino Fundamental Disciplina: Química 1. Observe os fatos abaixo: I) Uma pedra de naftalina deixada no armário. II) Uma vasilha com água deixada no
ORIENTAÇÃO DE ESTUDOS RECUPERAÇÃO SEMESTRAL 9º Ano do Ensino Fundamental Disciplina: Química 1. Observe os fatos abaixo: I) Uma pedra de naftalina deixada no armário. II) Uma vasilha com água deixada no
3º EM. Química A Jaque / Lailson Aval. Mensal 06/03/13. Para efeitos de consulta, se necessário, utilize a tabela periódica abaixo:
 3º EM Química A Jaque / Lailson Aval. Mensal 06/03/13 Para efeitos de consulta, se necessário, utilize a tabela periódica abaixo: 1. (1,0) Tendo por base o modelo atômico atual, assinale (V) para verdadeiro
3º EM Química A Jaque / Lailson Aval. Mensal 06/03/13 Para efeitos de consulta, se necessário, utilize a tabela periódica abaixo: 1. (1,0) Tendo por base o modelo atômico atual, assinale (V) para verdadeiro
Química. A matéria, suas transformações e a energia Unidade 2
 Química A matéria, suas transformações e a energia Unidade 2 Matéria (p.23) É tudo aquilo que tem massa, volume e, por isso, ocupa um lugar no espaço. Não é possível compartilhar o espaço com outra porção
Química A matéria, suas transformações e a energia Unidade 2 Matéria (p.23) É tudo aquilo que tem massa, volume e, por isso, ocupa um lugar no espaço. Não é possível compartilhar o espaço com outra porção
EXERCÍCIOS DE CIÊNCIAS PARA O 9 ANO. 1- Considere as temperaturas de fusão e ebulição (pressão = 1 atm) de quatro compostos dados na tabela abaixo.
 EXERCÍCIOS DE CIÊNCIAS PARA O 9 ANO 1- Considere as temperaturas de fusão e ebulição (pressão = 1 atm) de quatro compostos dados na tabela abaixo. Com base nos dados da tabela, responda as questões a seguir.
EXERCÍCIOS DE CIÊNCIAS PARA O 9 ANO 1- Considere as temperaturas de fusão e ebulição (pressão = 1 atm) de quatro compostos dados na tabela abaixo. Com base nos dados da tabela, responda as questões a seguir.
Recursos para Estudo / Atividades
 COLÉGIO NOSSA SENHORA DA PIEDADE Programa de Recuperação Paralela 1ª Etapa 2012 Disciplina: Química Ano: 2012 Professor (a): Elisa Landim Turma: 1 o FG Caro aluno, você está recebendo o conteúdo de recuperação.
COLÉGIO NOSSA SENHORA DA PIEDADE Programa de Recuperação Paralela 1ª Etapa 2012 Disciplina: Química Ano: 2012 Professor (a): Elisa Landim Turma: 1 o FG Caro aluno, você está recebendo o conteúdo de recuperação.
Aluno(a): Instituição de Ensino: Município: Coordenador da Instituição de Ensino: ATENÇÃO: O DESENVOLVIMENTO TEÓRICO DAS QUESTÕES É OBRIGATÓRIO
 VIII Olimpíada Capixaba de Química 2010 Prova do Grupo I 1 a série do ensino médio Aluno(a): Instituição de Ensino: Município: Coordenador da Instituição de Ensino: ATENÇÃO: O DESENVOLVIMENTO TEÓRICO DAS
VIII Olimpíada Capixaba de Química 2010 Prova do Grupo I 1 a série do ensino médio Aluno(a): Instituição de Ensino: Município: Coordenador da Instituição de Ensino: ATENÇÃO: O DESENVOLVIMENTO TEÓRICO DAS
Recursos para Estudo / Atividades
 COLÉGIO NOSSA SENHORA DA PIEDADE Programa de Recuperação Paralela 1ª Etapa 2014 Disciplina: QUÍMICA Ano: 1º Professora: Maria Luiza ENSINO MÉDIO Caro aluno, você está recebendo o conteúdo de recuperação.
COLÉGIO NOSSA SENHORA DA PIEDADE Programa de Recuperação Paralela 1ª Etapa 2014 Disciplina: QUÍMICA Ano: 1º Professora: Maria Luiza ENSINO MÉDIO Caro aluno, você está recebendo o conteúdo de recuperação.
LISTA DE EXERCÍCIO PARA A PROVA MENSAL
 Professor: Cassio Pacheco Aluno (a) Disciplia Química 1 Ano LISTA DE EXERCÍCIO PARA A PROVA MENSAL 1-. Assinale a alternativa onde você encontra somente substâncias compostas: a) H 2, P 4, H 2 O, O 2 b)
Professor: Cassio Pacheco Aluno (a) Disciplia Química 1 Ano LISTA DE EXERCÍCIO PARA A PROVA MENSAL 1-. Assinale a alternativa onde você encontra somente substâncias compostas: a) H 2, P 4, H 2 O, O 2 b)
Conhecimento. Senso comum Religioso Filosófico Cientifico. Química. A matéria. propriedades. gerais funcionais específicas
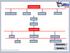 Conhecimento Senso comum Religioso Filosófico Cientifico Química A matéria propriedades gerais funcionais específicas físicas químicas organolépticas A importância da densidade Dentro da especificação
Conhecimento Senso comum Religioso Filosófico Cientifico Química A matéria propriedades gerais funcionais específicas físicas químicas organolépticas A importância da densidade Dentro da especificação
1º trimestre Sala de estudos Ciências Data: março/2017 Ensino Fundamental 9º ano Classe: Profª. Elisete Nome: nº
 . 1º trimestre Sala de estudos Ciências Data: março/2017 Ensino Fundamental 9º ano Classe: Profª. Elisete Nome: nº Conteúdo: Propriedades da matéria; mudanças de estado físico; transformações de unidades..
. 1º trimestre Sala de estudos Ciências Data: março/2017 Ensino Fundamental 9º ano Classe: Profª. Elisete Nome: nº Conteúdo: Propriedades da matéria; mudanças de estado físico; transformações de unidades..
COLÉGIO NOSSA SENHORA DO MONTE CALVÁRIO CIÊNCIAS
 COLÉGIO NOSSA SENHORA DO MONTE CALVÁRIO CIÊNCIAS SEGMENTO: ENSINO FUNDAMENTAL II ANO: 9º TÍTULO: ATIVIDADE DE REVISÃO PARA AVALIAÇÃO MENSAL II PROFESSORA: ALESSANDRA ARCA DATA: 20/ 04/ 2016 1. Classifique
COLÉGIO NOSSA SENHORA DO MONTE CALVÁRIO CIÊNCIAS SEGMENTO: ENSINO FUNDAMENTAL II ANO: 9º TÍTULO: ATIVIDADE DE REVISÃO PARA AVALIAÇÃO MENSAL II PROFESSORA: ALESSANDRA ARCA DATA: 20/ 04/ 2016 1. Classifique
Atenção: Leia o texto a seguir e responda à questão 1.
 PARA A VALIDADE DO QiD, AS RESPOSTAS DEVEM SER APRESENTADAS EM FOLHA PRÓPRIA, FORNECIDA PELO COLÉGIO, COM DESENVOLVIMENTO E SEMPRE A TINTA. TODAS AS QUESTÕES DE MÚLTIPLA ESCOLHA DEVEM SER JUSTIFICADAS.
PARA A VALIDADE DO QiD, AS RESPOSTAS DEVEM SER APRESENTADAS EM FOLHA PRÓPRIA, FORNECIDA PELO COLÉGIO, COM DESENVOLVIMENTO E SEMPRE A TINTA. TODAS AS QUESTÕES DE MÚLTIPLA ESCOLHA DEVEM SER JUSTIFICADAS.
9º Ano/Turma: Data / / ) Observe os sistemas onde as esferas representam átomos. Sobre esses sistemas, a afirmação incorreta é:
 Estudante: Educadora: Daiana Araújo 9º Ano/Turma: Data / /2015 C.Curricular: Ciências/ Química 1) Observe os sistemas onde as esferas representam átomos. Sobre esses sistemas, a afirmação incorreta é:
Estudante: Educadora: Daiana Araújo 9º Ano/Turma: Data / /2015 C.Curricular: Ciências/ Química 1) Observe os sistemas onde as esferas representam átomos. Sobre esses sistemas, a afirmação incorreta é:
Lista de exercícios de 4 a U.L
 Lista de exercícios de 4 a U.L 01-Dada a tabela a seguir, e levando-se em consideração que as substâncias se encontram à temperatura de 50 o C, responda o que se pede: SUBSTANCIA T.F ( o C) T.E ( o C)
Lista de exercícios de 4 a U.L 01-Dada a tabela a seguir, e levando-se em consideração que as substâncias se encontram à temperatura de 50 o C, responda o que se pede: SUBSTANCIA T.F ( o C) T.E ( o C)
Lista de exercícios 1 Química 1 Professor Sávio
 Lista de exercícios 1 Química 1 Professor Sávio 01 - (UEL PR/Janeiro) Quando Fahrenheit definiu a escala termométrica que hoje leva o seu nome, o primeiro ponto fixo definido por ele, o 0F, corresponde
Lista de exercícios 1 Química 1 Professor Sávio 01 - (UEL PR/Janeiro) Quando Fahrenheit definiu a escala termométrica que hoje leva o seu nome, o primeiro ponto fixo definido por ele, o 0F, corresponde
Conhecimento. Senso comum Religioso Filosófico Cientifico. Química. A matéria. propriedades. gerais funcionais específicas
 Conhecimento Senso comum Religioso Filosófico Cientifico Química A matéria propriedades gerais funcionais específicas físicas químicas organolépticas Estados de agregação da matéria Estado sólido Forma
Conhecimento Senso comum Religioso Filosófico Cientifico Química A matéria propriedades gerais funcionais específicas físicas químicas organolépticas Estados de agregação da matéria Estado sólido Forma
Química B Extensivo V. 2
 Extensivo V. 2 Resolva Aula 5 5.01) A 5.02) C 5.03) Colocar água para separar o salitre e decantar ou filtrar. Depois pôr sulfeto de carbono no sólido restante para retirar o enxofre. que sobra é o carvão.
Extensivo V. 2 Resolva Aula 5 5.01) A 5.02) C 5.03) Colocar água para separar o salitre e decantar ou filtrar. Depois pôr sulfeto de carbono no sólido restante para retirar o enxofre. que sobra é o carvão.
4) O íon de 11²³Na + contém: (Assinale a alternativa verdadeira)
 Componente Curricular: Química Professora: Adriana Aluno(a) Nº: Atividade: Lista de exercícios conceitos fundamentais da química, atomística, tabela periódica, ligações químicas e radioatividade. Menção:
Componente Curricular: Química Professora: Adriana Aluno(a) Nº: Atividade: Lista de exercícios conceitos fundamentais da química, atomística, tabela periódica, ligações químicas e radioatividade. Menção:
ROTEIRO DE ESTUDOS 1 ANO II - TRIMESTRE
 ROTEIRO DE ESTUDOS 1 ANO II - TRIMESTRE PARTE 1 SETOR A 1- Considere as seguintes informações sobre um átomo X: Um isótopo tem massa de 20 u e um contribuição de 91%; Um isótopo tem massa de 22 u e um
ROTEIRO DE ESTUDOS 1 ANO II - TRIMESTRE PARTE 1 SETOR A 1- Considere as seguintes informações sobre um átomo X: Um isótopo tem massa de 20 u e um contribuição de 91%; Um isótopo tem massa de 22 u e um
INSTITUTO GEREMARIO DANTAS COMPONENTE CURRICULAR: QUÍMICA EXERCÍCIOS DE RECUPERAÇÃO PARCIAL 2016
 INSTITUTO GEREMARIO DANTAS Educação Infantil, Ensino Fundamental e Médio Fone: (21) 21087900 Rio de Janeiro RJ www.igd.com.br Aluno(a): 9º Ano: Nº Professora: Lúcia Nascimento COMPONENTE CURRICULAR: QUÍMICA
INSTITUTO GEREMARIO DANTAS Educação Infantil, Ensino Fundamental e Médio Fone: (21) 21087900 Rio de Janeiro RJ www.igd.com.br Aluno(a): 9º Ano: Nº Professora: Lúcia Nascimento COMPONENTE CURRICULAR: QUÍMICA
Tarefa 09 à 12 Professor Willian. Com base no gráfico, assinale a alternativa que apresenta a afirmativa CORRETA.
 9º ano Química Tarefa 09 à 12 Professor Willian 01. Dois materiais sólidos, A e B, são aquecidos a uma velocidade de 10ºC.min 1. A figura a seguir representa o diagrama de aquecimento desses dois materiais.
9º ano Química Tarefa 09 à 12 Professor Willian 01. Dois materiais sólidos, A e B, são aquecidos a uma velocidade de 10ºC.min 1. A figura a seguir representa o diagrama de aquecimento desses dois materiais.
substância. químico (Q). c) Atração de uma agulha por um ímã. ( ) 2. Escrever uma equação química para a reação
 MOGI MIRIM Trabalho de Recuperação Final de Química Profº: Wardê Nome: 1ª Série EM Valor: 1º Trimestre 2011 Pré-vestibular Ensino Médio Ensino Fundamental Educação Infantil Nº: 1 1. Dado o sistema esquematizado
MOGI MIRIM Trabalho de Recuperação Final de Química Profº: Wardê Nome: 1ª Série EM Valor: 1º Trimestre 2011 Pré-vestibular Ensino Médio Ensino Fundamental Educação Infantil Nº: 1 1. Dado o sistema esquematizado
Aluno(a): Instituição de Ensino: Município: Coordenador da Instituição de Ensino: ATENÇÃO: O DESENVOLVIMENTO TEÓRICO DAS QUESTÕES É OBRIGATÓRIO
 IX Olimpíada Capixaba de Química 2011 Prova do Grupo II 2 a série do ensino médio Aluno(a): Instituição de Ensino: Município: Coordenador da Instituição de Ensino: ATENÇÃO: O DESENVOLVIMENTO TEÓRICO DAS
IX Olimpíada Capixaba de Química 2011 Prova do Grupo II 2 a série do ensino médio Aluno(a): Instituição de Ensino: Município: Coordenador da Instituição de Ensino: ATENÇÃO: O DESENVOLVIMENTO TEÓRICO DAS
09) Considere a tabela de pontos de fusão e ebulição das substâncias a seguir, a 1 atm de pressão:
 01) Indique a alternativa que completa corretamente as lacunas do seguinte período: Um elemento químico é representado pelo seu..., é identificado pelo número de... e pode apresentar diferentes números
01) Indique a alternativa que completa corretamente as lacunas do seguinte período: Um elemento químico é representado pelo seu..., é identificado pelo número de... e pode apresentar diferentes números
Colégio Avanço de Ensino Programado
 α Colégio Avanço de Ensino Programado Avaliação Contínua 1º Semestre - 1º Bim. /2016 Nota: Professor (a): Cíntia Sargo Disciplina: Química Turma: 1ª Série E. Médio Nome: Nº: Atividade deverá ser entregue
α Colégio Avanço de Ensino Programado Avaliação Contínua 1º Semestre - 1º Bim. /2016 Nota: Professor (a): Cíntia Sargo Disciplina: Química Turma: 1ª Série E. Médio Nome: Nº: Atividade deverá ser entregue
Projeto de Recuperação Semestral - 1ª Série (EM)
 Projeto de Recuperação Semestral - 1ª Série (EM) QUÍMICA 1 MATÉRIA A SER ESTUDADA Obs.: Fascículo1 A matéria e suas propriedades e Fascículo 2 Teoria Atômico-Molecular. Fascículo Capítulo páginas Exercícios
Projeto de Recuperação Semestral - 1ª Série (EM) QUÍMICA 1 MATÉRIA A SER ESTUDADA Obs.: Fascículo1 A matéria e suas propriedades e Fascículo 2 Teoria Atômico-Molecular. Fascículo Capítulo páginas Exercícios
esféricas maciças e indivisíveis.
 a) A-I, B-II, C-III b) A-II, B-III, C-I c) A-III, B-I, C-II d) A-III, B-II, C-I e) A-II, B-I, C-III LISTA DE EXERCÍCIOS DE QUÍMICA 1º Ano do Ensino Médio Professor: Anderson Paschôa É preciso estudar todos
a) A-I, B-II, C-III b) A-II, B-III, C-I c) A-III, B-I, C-II d) A-III, B-II, C-I e) A-II, B-I, C-III LISTA DE EXERCÍCIOS DE QUÍMICA 1º Ano do Ensino Médio Professor: Anderson Paschôa É preciso estudar todos
Como o átomo é um sistema eletricamente neutro, o número de prótons é sempre igual ao número de elétrons.
 Apostila de Química (3º bimestre-2009) Professor: Eduardo Mesquita 9º ano Ensino Fundamental A estrutura da matéria A concepção moderna do átomo Como o átomo é um sistema eletricamente neutro, o número
Apostila de Química (3º bimestre-2009) Professor: Eduardo Mesquita 9º ano Ensino Fundamental A estrutura da matéria A concepção moderna do átomo Como o átomo é um sistema eletricamente neutro, o número
LISTA DE EXERCÍCIOS: TRANSFORMAÇÕES FÍSICAS E QUÍMICAS PROPRIEDADES FÍSICAS E QUÍMICAS ALGARISMOS SIGNIFICATIVOS ESTEQUIOMETRIA
 UNIVERSIDADE FEDERAL D ESTAD D RI DE JANEIR (UNIRI) INSTITUT DE BICIÊNCIAS DEP. DE CIÊNCIAS NATURAIS DISCIPLINA: QUÍMICA GERAL E INRGÂNICA 2/2015 PRFª.: CLAUDIA JRGE D NASCIMENT LISTA DE EXERCÍCIS: MATÉRIA
UNIVERSIDADE FEDERAL D ESTAD D RI DE JANEIR (UNIRI) INSTITUT DE BICIÊNCIAS DEP. DE CIÊNCIAS NATURAIS DISCIPLINA: QUÍMICA GERAL E INRGÂNICA 2/2015 PRFª.: CLAUDIA JRGE D NASCIMENT LISTA DE EXERCÍCIS: MATÉRIA
02- Quais das propriedades a seguir são as mais indicadas para verificar se é pura uma certa amostra sólida de uma substância conhecida?
 PROFESSOR: EQUIPE DE QUÍMICA BANCO DE QUESTÕES - QUÍMICA - 9º ANO - ENSINO FUNDAMENTAL ============================================================================================= 01- Massa, extensão
PROFESSOR: EQUIPE DE QUÍMICA BANCO DE QUESTÕES - QUÍMICA - 9º ANO - ENSINO FUNDAMENTAL ============================================================================================= 01- Massa, extensão
ATIVIDADES RECUPERAÇÃO PARALELA
 ATIVIDADES RECUPERAÇÃO PARALELA Nome: Nº Ano: 6º Data: / /2012 Bimestre: 2 Professor: Vanildo Disciplina: Química Orientações para estudo: O que estudar (Conteúdo) Transformações e energia. Fenômenos físicos
ATIVIDADES RECUPERAÇÃO PARALELA Nome: Nº Ano: 6º Data: / /2012 Bimestre: 2 Professor: Vanildo Disciplina: Química Orientações para estudo: O que estudar (Conteúdo) Transformações e energia. Fenômenos físicos
ESCOLA SALESIANA DE MANIQUE TESTE DE AVALIAÇÃO DE CIÊNCIAS FÍSICO-QUÍMICAS ANO LECTIVO 2010/2011
 ESCOLA SALESIANA DE MANIQUE TESTE DE AVALIAÇÃO DE CIÊNCIAS FÍSICO-QUÍMICAS ANO LECTIVO 2010/2011 Nome: 7.º Ano Turma Nº: Encarregado de Educação: Classificação: Professor: 1. Assinale como verdadeiras
ESCOLA SALESIANA DE MANIQUE TESTE DE AVALIAÇÃO DE CIÊNCIAS FÍSICO-QUÍMICAS ANO LECTIVO 2010/2011 Nome: 7.º Ano Turma Nº: Encarregado de Educação: Classificação: Professor: 1. Assinale como verdadeiras
Lista de Exercício Para a Prova Trimestral Setor A. 1- Um elemento X apresenta os seguintes isótopos:
 Disciplina: Química Professor: Cássio Pacheco 1 Ano Lista de Exercício Para a Prova Trimestral Setor A 1- Um elemento X apresenta os seguintes isótopos: 40 X 80% 42 X 15% 44 X 5% Qual a massa atômica de
Disciplina: Química Professor: Cássio Pacheco 1 Ano Lista de Exercício Para a Prova Trimestral Setor A 1- Um elemento X apresenta os seguintes isótopos: 40 X 80% 42 X 15% 44 X 5% Qual a massa atômica de
Plano de Recuperação 1º Semestre EF2-2013
 Professor: Cybelle e Ângela Ano: 9º Objetivos: Proporcionar ao aluno a oportunidade de resgatar os conteúdos trabalhados em Ciências nos quais apresentou defasagens e os quais lhe servirão como pré-requisitos
Professor: Cybelle e Ângela Ano: 9º Objetivos: Proporcionar ao aluno a oportunidade de resgatar os conteúdos trabalhados em Ciências nos quais apresentou defasagens e os quais lhe servirão como pré-requisitos
Recuperação Final Química 9º Ano Professor Diego Estudar: Caderno 1 páginas ; Caderno 2 páginas Exercícios
 Recuperação Final Química 9º Ano Professor Diego Estudar: Caderno 1 páginas 244-257; Caderno 2 páginas 258-280. Exercícios 1. As substâncias podem ser encontradas em três estados físicos, sólido, líquido
Recuperação Final Química 9º Ano Professor Diego Estudar: Caderno 1 páginas 244-257; Caderno 2 páginas 258-280. Exercícios 1. As substâncias podem ser encontradas em três estados físicos, sólido, líquido
Lista de Exercicios 1 o ano Patrícia Cecilia abril/2015
 Química Lista de Exercicios 1 o ano Patrícia Cecilia abril/2015 1. (Ufv 1999 - adaptada) Dadas as afirmativas: I. A molécula de N 2 é diatômica. II. Substância composta é aquela formada por dois ou mais
Química Lista de Exercicios 1 o ano Patrícia Cecilia abril/2015 1. (Ufv 1999 - adaptada) Dadas as afirmativas: I. A molécula de N 2 é diatômica. II. Substância composta é aquela formada por dois ou mais
INTRODUÇÃO À QUÍMICA
 INTRODUÇÃO À QUÍMICA O QUE É QUÍMICA? É a ciência que estuda a matéria, suas propriedades, transformações e interações, bem como a energia envolvida nestes processos. QUAL A IMPORTÂNCIA DA QUÍMICA? Entender
INTRODUÇÃO À QUÍMICA O QUE É QUÍMICA? É a ciência que estuda a matéria, suas propriedades, transformações e interações, bem como a energia envolvida nestes processos. QUAL A IMPORTÂNCIA DA QUÍMICA? Entender
FUVEST 1984 Primeira fase e Segunda fase
 FUVEST 1984 Primeira fase e Segunda fase Professora Sonia 9. A melhor maneira de separar os três componentes de uma mistura de areia com solução aquosa de sal é: CONHECIMENTOS GERAIS 5. O peso atômico
FUVEST 1984 Primeira fase e Segunda fase Professora Sonia 9. A melhor maneira de separar os três componentes de uma mistura de areia com solução aquosa de sal é: CONHECIMENTOS GERAIS 5. O peso atômico
1) Se um corpo tem a massa de 20 g e um volume de 5 cm 3, quanto vale sua densidade? a) 10 g/cm 3 b) 4 g/cm 3 c) 5 g/cm 3 d) 15 g/cm 3 e) 20 g/cm 3
 1) Se um corpo tem a massa de 20 g e um volume de 5 cm 3, quanto vale sua densidade? a) 10 g/cm 3 b) 4 g/cm 3 c) 5 g/cm 3 d) 15 g/cm 3 e) 20 g/cm 3 2) Calcule o valor da massa de um objeto constituído
1) Se um corpo tem a massa de 20 g e um volume de 5 cm 3, quanto vale sua densidade? a) 10 g/cm 3 b) 4 g/cm 3 c) 5 g/cm 3 d) 15 g/cm 3 e) 20 g/cm 3 2) Calcule o valor da massa de um objeto constituído
https://edsonnossol.wordpress.com
 https://edsonnossol.wordpress.com enossol@ufu.br Classificação da matéria Química Fundamental I Prof. Edson Nossol Uberlândia, 12/04/2017 Matéria: é tudo aquilo que ocupa espaço e tem massa Química: estudo
https://edsonnossol.wordpress.com enossol@ufu.br Classificação da matéria Química Fundamental I Prof. Edson Nossol Uberlândia, 12/04/2017 Matéria: é tudo aquilo que ocupa espaço e tem massa Química: estudo
Recursos para Estudo / Atividades
 COLÉGIO NOSSA SENHORA DA PIEDADE Programa de Recuperação Paralela 1ª Etapa 2013 Disciplina: Química Série: 1ª Professora: Maria Luiza Turma: FG Caro aluno, você está recebendo o conteúdo de recuperação.
COLÉGIO NOSSA SENHORA DA PIEDADE Programa de Recuperação Paralela 1ª Etapa 2013 Disciplina: Química Série: 1ª Professora: Maria Luiza Turma: FG Caro aluno, você está recebendo o conteúdo de recuperação.
PUC Goiás MAF Coordenação de Química Lista de exercícios transformações Químicas Profa Sandra R. Longhin Goiânia. 05 de abril de 2011
 1 PUC Goiás MAF Coordenação de Química Lista de exercícios transformações Químicas Profa Sandra R. Longhin Goiânia. 05 de abril de 2011 01. A temperatura de ebulição é, entre outras, uma propriedade das
1 PUC Goiás MAF Coordenação de Química Lista de exercícios transformações Químicas Profa Sandra R. Longhin Goiânia. 05 de abril de 2011 01. A temperatura de ebulição é, entre outras, uma propriedade das
1. NOÇÕES FUNDAMENTAIS
 Universidade Estadual do Centro-Oeste - UNICENTRO 1. NOÇÕES FUNDAMENTAIS Prof. a M. a Nayara Lais Boschen QUÍMICA 2 MATÉRIA Tudo aquilo que possui massa e ocupa lugar no espaço; Pode ser na forma sólida,
Universidade Estadual do Centro-Oeste - UNICENTRO 1. NOÇÕES FUNDAMENTAIS Prof. a M. a Nayara Lais Boschen QUÍMICA 2 MATÉRIA Tudo aquilo que possui massa e ocupa lugar no espaço; Pode ser na forma sólida,
Aluno(a): nº: Turma: Sua prova deve ser feita à caneta azul ou preta. Não rasure e não use corretivo. Entregue no dia da prova.
 Aluno(a): nº: Turma: Nota Ano: 1º Ano E.M. Data: /08/2019 Série Professor(a): Virginia Trabalho Recuperação Matéria: Química Valor: 10,0 Sua prova deve ser feita à caneta azul ou preta. Não rasure e não
Aluno(a): nº: Turma: Nota Ano: 1º Ano E.M. Data: /08/2019 Série Professor(a): Virginia Trabalho Recuperação Matéria: Química Valor: 10,0 Sua prova deve ser feita à caneta azul ou preta. Não rasure e não
EXERCÍCIOS SUBSTÂNCIAS E MISTURAS
 EXERCÍCIOS SUBSTÂNCIAS E MISTURAS 1- Considere o sistema e responda as questões: A) Quantos átomos estão representados? B) Quantos elementos químicos há no sistema? C) Quantas moléculas estão representadas
EXERCÍCIOS SUBSTÂNCIAS E MISTURAS 1- Considere o sistema e responda as questões: A) Quantos átomos estão representados? B) Quantos elementos químicos há no sistema? C) Quantas moléculas estão representadas
Química B Extensivo V. 1
 Química B Extensivo V. 1 Resolva Aula 1 Aula 3 1.01) O açúcar se divide e preenche os espaços vazios existentes na água. 3.01) C 1.0) Plástico. 1.03) Acidez. Aula.01) C I Condensação II Fusão S III Ebulição
Química B Extensivo V. 1 Resolva Aula 1 Aula 3 1.01) O açúcar se divide e preenche os espaços vazios existentes na água. 3.01) C 1.0) Plástico. 1.03) Acidez. Aula.01) C I Condensação II Fusão S III Ebulição
Introdução ao estudo da Química. TEMA 1 Chemistry is Everywhere. Escola Beit Yaacov Profa. Renata Fogaça
 Introdução ao estudo da Química TEMA 1 Chemistry is Everywhere Escola Beit Yaacov Profa. Renata Fogaça A Alquimia e a Química Mãe da Química moderna Utilizada na antiguidade e Idade média Egito antigo,
Introdução ao estudo da Química TEMA 1 Chemistry is Everywhere Escola Beit Yaacov Profa. Renata Fogaça A Alquimia e a Química Mãe da Química moderna Utilizada na antiguidade e Idade média Egito antigo,
ROTEIRO DE RECUPERAÇÃO FINAL DE QUÍMICA 2016
 ROTEIRO DE RECUPERAÇÃO FINAL DE QUÍMICA 2016 Nome: N o 9 o Ano Data: / / 2016 Professor(a): Andreza / Priscila Nota: ( Valor: 2,0 ) I. Introdução Neste ano, seu total de pontos foi inferior a 60,0 e, portanto
ROTEIRO DE RECUPERAÇÃO FINAL DE QUÍMICA 2016 Nome: N o 9 o Ano Data: / / 2016 Professor(a): Andreza / Priscila Nota: ( Valor: 2,0 ) I. Introdução Neste ano, seu total de pontos foi inferior a 60,0 e, portanto
Curvas de aquecimento e diagrama de fases
 Curvas de aquecimento e diagrama de fases PROF : JOSÉ LUCAS FÍSICA B Curvas de aquecimento Curva de aquecimento e resfriamento é o gráfico que mostra a variação de temperatura de uma amostra quando aquecida
Curvas de aquecimento e diagrama de fases PROF : JOSÉ LUCAS FÍSICA B Curvas de aquecimento Curva de aquecimento e resfriamento é o gráfico que mostra a variação de temperatura de uma amostra quando aquecida
TRABALHO DE RECUPERAÇÃO 1 TRIMESTRE 2017
 TRABALHO DE RECUPERAÇÃO 1 TRIMESTRE 2017 ALUNO (A): TURMA: VALOR: 12,0 Nota: INSTRUÇÕES: Todas as questões devem ser respondidas a CANETA. (Sugestão: Utilize a tabela periódica para a consulta dos números
TRABALHO DE RECUPERAÇÃO 1 TRIMESTRE 2017 ALUNO (A): TURMA: VALOR: 12,0 Nota: INSTRUÇÕES: Todas as questões devem ser respondidas a CANETA. (Sugestão: Utilize a tabela periódica para a consulta dos números
9º Ano/Turma: Data / /2014 VELOCIDADE MÉDIA
 Estudante: Educadora: Daiana Araújo 9º Ano/Turma: Data / /2014 C. Curricular: Ciências Naturais/ Química 1. O quadro seguinte mostra a velocidade média de corrida de alguns animais. ANIMAIS cavalo coelho
Estudante: Educadora: Daiana Araújo 9º Ano/Turma: Data / /2014 C. Curricular: Ciências Naturais/ Química 1. O quadro seguinte mostra a velocidade média de corrida de alguns animais. ANIMAIS cavalo coelho
ESCOLA SALESIANA DE MANIQUE TESTE DE AVALIAÇÃO DE CIÊNCIAS FÍSICO-QUÍMICAS ANO LECTIVO 2010/2011
 ESCOLA SALESIANA DE MANIQUE TESTE DE AVALIAÇÃO DE CIÊNCIAS FÍSICO-QUÍMICAS ANO LECTIVO 2010/2011 Nome: 7.º Ano Turma Nº: Encarregado de Educação: Classificação: Professor: 1. Leia atentamente o texto que
ESCOLA SALESIANA DE MANIQUE TESTE DE AVALIAÇÃO DE CIÊNCIAS FÍSICO-QUÍMICAS ANO LECTIVO 2010/2011 Nome: 7.º Ano Turma Nº: Encarregado de Educação: Classificação: Professor: 1. Leia atentamente o texto que
COLÉGIO ESTADUAL DA POLÍCIA MILITAR DE GOIÁS HUGO DE CARVALHO RAMOS. Escola de Civismo e Cidadania
 COLÉGIO ESTADUAL DA POLÍCIA MILITAR DE GOIÁS HUGO DE CARVALHO RAMOS ANO LETIVO 2018 QUESTÃO 01 O QUE É QUÍMICA? QUESTÃO 02 O QUE É MATÉRIA? QUESTÃO 03 O QUE É TEMPERATURA? QUESTÃO 04 O QUE É TRANSFORMAÇÃO(OU
COLÉGIO ESTADUAL DA POLÍCIA MILITAR DE GOIÁS HUGO DE CARVALHO RAMOS ANO LETIVO 2018 QUESTÃO 01 O QUE É QUÍMICA? QUESTÃO 02 O QUE É MATÉRIA? QUESTÃO 03 O QUE É TEMPERATURA? QUESTÃO 04 O QUE É TRANSFORMAÇÃO(OU
FUVEST 1981 Primeira fase e Segunda fase
 FUVEST 1981 Primeira fase e Segunda fase CONHECIMENTOS GERAIS 5. Nas condições ambientes, pastilhas de hidróxido de sódio, expostas ao ar durante várias horas, transformam-se em um líquido claro. Este
FUVEST 1981 Primeira fase e Segunda fase CONHECIMENTOS GERAIS 5. Nas condições ambientes, pastilhas de hidróxido de sódio, expostas ao ar durante várias horas, transformam-se em um líquido claro. Este
ROTEIRO DE RECUPERAÇÃO DE QUÍMICA 1 o BIMESTRE DE 2016
 ROTEIRO DE RECUPERAÇÃO DE QUÍMICA 1 o BIMESTRE DE 2016 Nome: N o 9 o Ano Data: / / 2016 Professor(a): Andreza / Priscila Nota: ( Valor: 1,0 ) I. Introdução Neste bimestre, sua média foi inferior a 6,0
ROTEIRO DE RECUPERAÇÃO DE QUÍMICA 1 o BIMESTRE DE 2016 Nome: N o 9 o Ano Data: / / 2016 Professor(a): Andreza / Priscila Nota: ( Valor: 1,0 ) I. Introdução Neste bimestre, sua média foi inferior a 6,0
A MATÉRIA. O que é matéria? MATÉRIA: tudo que tem massa e ocupa espaço, isto é, volume.
 Disciplina: Química Prof.: Guilherme Turma: IU 16/ 03/2017 Tema da aula: A Matéria e suas Propriedades A MATÉRIA O que é matéria? MATÉRIA: tudo que tem massa e ocupa espaço, isto é, volume. - Massa e volume
Disciplina: Química Prof.: Guilherme Turma: IU 16/ 03/2017 Tema da aula: A Matéria e suas Propriedades A MATÉRIA O que é matéria? MATÉRIA: tudo que tem massa e ocupa espaço, isto é, volume. - Massa e volume
TRABALHO DE RECUPERAÇÃO
 Escola Estadual Virgínio Perillo Avenida José Bernardes Maciel, 471 Marília, Lagoa da Prata-MG Fone: (37) 3261-3222 / E-mail: escolavirginioperillo@gmail.com TRABALHO DE RECUPERAÇÃO DISCIPLINA QUÍMICA
Escola Estadual Virgínio Perillo Avenida José Bernardes Maciel, 471 Marília, Lagoa da Prata-MG Fone: (37) 3261-3222 / E-mail: escolavirginioperillo@gmail.com TRABALHO DE RECUPERAÇÃO DISCIPLINA QUÍMICA
NOME: N CADERNO DE REC. PARALELA DE QUÍMICA I - TURMA 212 PROFª MARICLEIDE 1º BIMESTRE
 DATA: / / 1925 *** COLÉGIO MALLET SOARES *** 2017 92 ANOS DE TRADIÇÃO, RENOVAÇÃO E QUALIDADE DEPARTAMENTO DE ENSINO NOTA: NOME: N CADERNO DE REC. PARALELA DE QUÍMICA I - TURMA 212 PROFª MARICLEIDE 1º BIMESTRE
DATA: / / 1925 *** COLÉGIO MALLET SOARES *** 2017 92 ANOS DE TRADIÇÃO, RENOVAÇÃO E QUALIDADE DEPARTAMENTO DE ENSINO NOTA: NOME: N CADERNO DE REC. PARALELA DE QUÍMICA I - TURMA 212 PROFª MARICLEIDE 1º BIMESTRE
LISTA 02 - TEORIA ATÔMICA MOLECULAR
 LISTA 02 - TEORIA ATÔMICA MOLECULAR 1º ano QUÍMICA PROF. PEDRO 2º Bimestre Questão 01) A massa de uma molécula de ácido acético, CH 3 COOH, é: a) 1,0. 10-21 g b) 1,0. 10-22 g c) 1,0. 10-23 g d) 1,0. 10-24
LISTA 02 - TEORIA ATÔMICA MOLECULAR 1º ano QUÍMICA PROF. PEDRO 2º Bimestre Questão 01) A massa de uma molécula de ácido acético, CH 3 COOH, é: a) 1,0. 10-21 g b) 1,0. 10-22 g c) 1,0. 10-23 g d) 1,0. 10-24
ROTEIRO DE RECUPERAÇÃO DE QUÍMICA 2 o SEMESTRE DE 2016
 ROTEIRO DE RECUPERAÇÃO DE QUÍMICA 2 o SEMESTRE DE 2016 Nome: N o 9 o Ano Data: / / 2016 Professor(a): Andreza / Priscila Nota: ( Valor: 2,0 ) I. Introdução Neste semestre, seu total de pontos foi inferior
ROTEIRO DE RECUPERAÇÃO DE QUÍMICA 2 o SEMESTRE DE 2016 Nome: N o 9 o Ano Data: / / 2016 Professor(a): Andreza / Priscila Nota: ( Valor: 2,0 ) I. Introdução Neste semestre, seu total de pontos foi inferior
Química é uma Ciência Experimental que estuda a estrutura, composição e a transformação da matéria.
 O Que é Química? Química é uma Ciência Experimental que estuda a estrutura, composição e a transformação da matéria. O Método Científico OBSERVAÇÕES PROBLEMA HIPÓTESE(S) EXPERIMENTOS CONCLUSÕES CIÊNCIA:
O Que é Química? Química é uma Ciência Experimental que estuda a estrutura, composição e a transformação da matéria. O Método Científico OBSERVAÇÕES PROBLEMA HIPÓTESE(S) EXPERIMENTOS CONCLUSÕES CIÊNCIA:
EXERCÍCIOS DE QUÍMICA
 INTRODUÇÃO AO ESTUDO DA QUÍMICA FENÔMENOS FÍSICOS E QUÍMICOS SUBSTÂNCIAS PURAS E MISTURAS ATOMICIDADE - ALOTROPIA 1. (UFPE) Em quais das passagens a seguir está ocorrendo transformação química? (1) O reflexo
INTRODUÇÃO AO ESTUDO DA QUÍMICA FENÔMENOS FÍSICOS E QUÍMICOS SUBSTÂNCIAS PURAS E MISTURAS ATOMICIDADE - ALOTROPIA 1. (UFPE) Em quais das passagens a seguir está ocorrendo transformação química? (1) O reflexo
DIAGRAMA DE FASES. 4) (ITA) Considere as seguintes afirmações relativas aos sistemas descritos a seguir, sob
 DIAGRAMA DE FASES 1) O gráfico abaixo apresenta a variação das pressões de vapor do sulfeto de carbono, metanol, etanol e água em função da temperatura. De acordo com o gráfico, assinale a afirmativa INCORRETA.
DIAGRAMA DE FASES 1) O gráfico abaixo apresenta a variação das pressões de vapor do sulfeto de carbono, metanol, etanol e água em função da temperatura. De acordo com o gráfico, assinale a afirmativa INCORRETA.
Substâncias e Misturas
 ESTADO DE SANTA CATARINA EEB DR JORGE LACERDA Substâncias e Misturas Profª Luiza P. R. Martins Química 1º ano Estados físicos (de agregação) da matéria Vapor Características microscópicas 2 Ebulição, Vaporização
ESTADO DE SANTA CATARINA EEB DR JORGE LACERDA Substâncias e Misturas Profª Luiza P. R. Martins Química 1º ano Estados físicos (de agregação) da matéria Vapor Características microscópicas 2 Ebulição, Vaporização
QiD 1 1ª SÉRIE PARTE 3 FÍSICA
 QiD 1 1ª SÉRIE PARTE 3 FÍSICA 1. (1,0) Estime a ordem de grandeza do numero de passos que um atleta dá durante uma prova de maratona, sabendo que seu deslocamento é cerca de 42km e que um passo de um atleta
QiD 1 1ª SÉRIE PARTE 3 FÍSICA 1. (1,0) Estime a ordem de grandeza do numero de passos que um atleta dá durante uma prova de maratona, sabendo que seu deslocamento é cerca de 42km e que um passo de um atleta
ESCOLA ESTADUAL DR. JOSÉ MARQUES DE OLIVEIRA - ANO 2017
 ESCOLA ESTADUAL DR. JOSÉ MARQUES DE OLIVEIRA - ANO 2017 1º ano Nome Nº Turma Data 15/12 Nota 08 Disciplina QUÍMICA TRABALHO Prof. ORLANDO Valor 30 ESTUDOS INDEPENDENTES DE RECUPERAÇÃO 01) Na química temos
ESCOLA ESTADUAL DR. JOSÉ MARQUES DE OLIVEIRA - ANO 2017 1º ano Nome Nº Turma Data 15/12 Nota 08 Disciplina QUÍMICA TRABALHO Prof. ORLANDO Valor 30 ESTUDOS INDEPENDENTES DE RECUPERAÇÃO 01) Na química temos
COLÉGIO XIX DE MARÇO excelência em educação
 COLÉGIO XIX DE MARÇO excelência em educação 1ª PROVA PARCIAL DE CIÊNCIAS Aluno(a): Nº Ano: 9º Turma: Data: 02/04/2011 Nota: Professora: Egberto Valor da Prova: 50 pontos Assinatura do responsável: Orientações
COLÉGIO XIX DE MARÇO excelência em educação 1ª PROVA PARCIAL DE CIÊNCIAS Aluno(a): Nº Ano: 9º Turma: Data: 02/04/2011 Nota: Professora: Egberto Valor da Prova: 50 pontos Assinatura do responsável: Orientações
ROTEIRO DE RECUPERAÇÃO DE QUÍMICA 3 o BIMESTRE DE 2016
 ROTEIRO DE RECUPERAÇÃO DE QUÍMICA 3 o BIMESTRE DE 2016 Nome: N o 9 o Ano Data: / / 2016 Professor(a): Andreza / Priscila Nota: ( Valor: 1,0 ) I. Introdução Neste bimestre, sua média foi inferior a 6,0
ROTEIRO DE RECUPERAÇÃO DE QUÍMICA 3 o BIMESTRE DE 2016 Nome: N o 9 o Ano Data: / / 2016 Professor(a): Andreza / Priscila Nota: ( Valor: 1,0 ) I. Introdução Neste bimestre, sua média foi inferior a 6,0
LISTA DE EXERCÍCIO PARA A PROVA MENSAL 1 Ano
 LISTA DE EXERCÍCIO PARA A PROVA MENSAL 1 Ano Professor: Cassio Pacheco Disciplina: Química 1-. Assinale a alternativa onde você encontra somente substâncias compostas: a) H2, P4, H2O, O2 b) Cl2, CO2, H2,
LISTA DE EXERCÍCIO PARA A PROVA MENSAL 1 Ano Professor: Cassio Pacheco Disciplina: Química 1-. Assinale a alternativa onde você encontra somente substâncias compostas: a) H2, P4, H2O, O2 b) Cl2, CO2, H2,
Conceitos importantes: a) Matéria : Tudo o que possui massa e ocupa lugar no espaço.
 SISTEMAS QUÍMICOS E SUAS TRANSFORMAÇÕES Prof. Ms. Mayanderson (Xuxu) QUÍMICA: A química estuda a natureza, as propriedades, a composição e as transformações da matéria. Ela está em nosso cotidiano e, ao
SISTEMAS QUÍMICOS E SUAS TRANSFORMAÇÕES Prof. Ms. Mayanderson (Xuxu) QUÍMICA: A química estuda a natureza, as propriedades, a composição e as transformações da matéria. Ela está em nosso cotidiano e, ao
54) Escreva o número de elétrons de valência e classifica quanto a configuração eletrônica dos elementos:
 CLASSIFICAÇÃO PERIÓDICA DOS ELEMENTOS 54) Escreva o número de elétrons de valência e classifica quanto a configuração eletrônica dos elementos: a) K b) B c) I d) Ne 55) Dê o nome da família e a camada
CLASSIFICAÇÃO PERIÓDICA DOS ELEMENTOS 54) Escreva o número de elétrons de valência e classifica quanto a configuração eletrônica dos elementos: a) K b) B c) I d) Ne 55) Dê o nome da família e a camada
UNIDADE 2: Aspectos Macroscópicos e Propriedades da Matéria.
 UNIDADE 2: Aspectos Macroscópicos e Propriedades da Matéria. MATÉRIA: Matéria é tudo aquilo que possui massa e ocupa lugar no espaço. A matéria pode ser um corpo ou um objeto: Corpo: É uma parte da matéria,
UNIDADE 2: Aspectos Macroscópicos e Propriedades da Matéria. MATÉRIA: Matéria é tudo aquilo que possui massa e ocupa lugar no espaço. A matéria pode ser um corpo ou um objeto: Corpo: É uma parte da matéria,
