EXTENSIVO SUPERMED 2016
|
|
|
- Maria de Lourdes Angelim Amaral
- 7 Há anos
- Visualizações:
Transcrição
1 EXTENSIVO SUPERMED 2016 LISTA DE EXERCÍCIOS DE QUÍMICA Prof.º Marcelo Cardoso 1. (Uerj 2016) No solo da floresta amazônica, são encontradas partículas ricas em fósforo, 1 trazidas pelos ventos, com velocidade constante de 0,1m s, desde o deserto do Saara. Admita que uma das partículas contenha 2,0% em massa de fósforo, o que equivale a 15 1,2 10 átomos desse elemento químico. A energia cinética de uma dessas partículas, em joules, ao ser trazida pelos ventos, equivale a: (Dado: MP 31g) a) 0, , , , (Fuvest 2015) A grafite de um lápis tem quinze centímetros de comprimento e dois milímetros de espessura. Dentre os valores abaixo, o que mais se aproxima do número de átomos presentes nessa grafite é Nota: 1) Assuma que a grafite é um cilindro circular reto, feito de grafita pura. A espessura da grafite é o diâmetro da base do cilindro. 2) Adote os valores aproximados de: ,2g / cm para a densidade da grafita; 2. 12g / mol para a massa molar do carbono; 3. a) ,0 10 mol para a constante de Avogadro 1 10 e) (Unifesp 2016) A descoberta das propriedades antitumorais do cisplatina, fórmula molecular [Pt(NH 3) 2C ], constituiu um marco na história da Química Medicinal. Esse composto é usado em vários tipos de neoplasias, como câncer de próstata, pulmão, cabeça, esôfago, estômago, linfomas, entre outros. O cisplatina sofre hidrólise ao penetrar na célula, e seu alvo principal é o DNA celular. A ligação deste fármaco ao DNA ocorre preferencialmente através de um dos átomos de nitrogênio das bases nitrogenadas adenina ou guanina.
2 No Brasil, um dos nomes comerciais do fármaco cisplatina é Platinil. Usualmente, os frascos deste medicamento acondicionam solução injetável, contendo 50 mg de cisplatina. Uma determinada indústria farmacêutica utilizou 0,050 mol de cisplatina na produção de um lote de frascos do medicamento Platinil do tipo descrito. ( Adaptado.) a) A interação da platina é mais estável com qual base nitrogenada? Justifique sua resposta. Determine o número de frascos de Platinil contidos no lote produzido por aquela indústria farmacêutica, supondo 100% de eficiência no processo. Apresente os cálculos efetuados. 4. (Puccamp 2016) O bronze campanil, ou bronze de que os sinos são feitos, é uma liga composta de 78% de cobre e % de estanho, em massa. Assim, a proporção em mol entre esses metais, nessa liga, é, respectivamente, de 1,0 para Dados: Massas molares (g mol) Cu 63,5 Sn 118,7 a) 0,15. 0,26. 0,48. 0,57. e) 0, (Puccamp 2016) O consumo excessivo de sal pode acarretar o aumento da pressão das artérias, também chamada de hipertensão. Para evitar esse problema, o Ministério da Saúde recomenda o consumo diário máximo de 5g de sal (1,7 g de sódio). Uma pessoa que consome a quantidade de sal máxima recomendada está ingerindo um número de íons sódio igual a Dados: Massa molar do Na,0 g mol. Constante de Avogadro: a) e) 1,0 10 2,4 10 3,8 10 4,4 10 6, ,0 10 mol.
3 6. (Unimontes 2014) Um procedimento depende de 0,9 g de sulfato cúprico anidro, CuSO 4, porém tem-se disponível o sulfato cúprico penta-hidratado, CuSO 4 5H2O. Para a realização do procedimento, deve-se pesar uma quantidade de CuSO 4 5H2O, aproximadamente, igual a a) 0,58 g. 1,56 g. 1,41 g. 0,90 g. 7. (Fuvest 2014) A tabela abaixo apresenta informações sobre cinco gases contidos em recipientes separados e selados. Recipiente Gás Temperatura (K) Pressão (atm) Volume (l) 1 O ,4 2 Ne 273 2,4 3 He 273 4,4 4 N ,4 5 Ar 273 1,4 Qual recipiente contém a mesma quantidade de átomos que um recipiente selado de,4 L, contendo H 2, mantido a 2 atm e 273 K? a) e) 5 8. (Ime 2014) Em 19,9 g de um sal de cálcio encontra-se 0,15 mol desse elemento. Qual a massa molar do ânion trivalente que forma esse sal? Dado: Ca 40 g / mol. a) 139 g / mol 278 g / mol 63,3 g / mol 126,6 g / mol e) 95 g / mol 9. (Enem 2013) O brasileiro consome em média 500 miligramas de cálcio por dia, quando a quantidade recomendada é o dobro. Uma alimentação balanceada é a melhor decisão pra evitar problemas no futuro, como a osteoporose, uma doença que atinge os ossos. Ela se caracteriza pela diminuição substancial de massa óssea, tornando os ossos frágeis e mais suscetíveis a fraturas. Disponível em: Acesso em: 1 ago (adaptado). 1 Considerando-se o valor de 6 10 mol para a constante de Avogadro e a massa molar do cálcio igual a 40 g/mol, qual a quantidade mínima diária de átomos de cálcio a ser ingerida para que uma pessoa supra suas necessidades? a) 7,5 10 e) 1,5 10 7, , ,8 10
4 10. (Unicamp 2013) Entre os vários íons presentes em 200 mililitros de água de coco há aproximadamente 320 mg de potássio, 40 mg de cálcio e 40 mg de sódio. Assim, ao beber água de coco, uma pessoa ingere quantidades diferentes desses íons, que, em termos de massa, obedecem à sequência: potássio sódio cálcio. No entanto, se as quantidades ingeridas fossem expressas em mol, a sequência seria: Dados de massas molares em g/mol: cálcio = 40; potássio = 39; sódio =. a) potássio > cálcio = sódio. cálcio = sódio > potássio. potássio > sódio > cálcio. cálcio > potássio > sódio. 11. (Unesp 2012) A ductilidade é a propriedade de um material deformar-se, comprimir-se ou estirar-se sem se romper. A prata é um metal que apresenta excelente ductilidade e a maior condutividade elétrica dentre todos os elementos químicos. Um fio de prata possui 10 m de comprimento (l) e área de 7 2 secção transversal (A) de 2,0 10 m. Considerando a densidade da prata igual a constante de Avogadro igual a nesse fio será a) 1,2 10 e) 1, , ,2 10 6, ,5 g/cm, a massa molar igual a 108 g/mol e a 1 6,0 10 mol, o número aproximado de átomos de prata
5 12. (Ufu 2012) A jadeíte, também chamada de silicato de alumínio e sódio NaA Si2O 6, é um mineral muito utilizado por artesãos para a confecção de peças de ornamentação e decoração, como joias e estatuetas. O número de mols de silício presente em uma estatueta, com massa igual a gramas, composta basicamente por jadeíte, é a) 28 mols. 14 mols. 3,5 mols. 7 mols. 13. (Fuvest 2012) Volumes iguais de uma solução de I 2 (em solvente orgânico apropriado) foram colocados em cinco diferentes frascos. Em seguida, a cada um dos frascos foi adicionada uma massa diferente de estanho (Sn), variando entre 0,2 e 1,0 g. Em cada frasco, formou-se uma certa quantidade de SnI 4, que foi, então, purificado e pesado. No gráfico abaixo, são apresentados os resultados desse experimento. Com base nesses resultados experimentais, é possível afirmar que o valor da relação é, aproximadamente, a) 1 : 8 1 : 4 1 : 2 2 : 1 e) 4 : 1 massa molar do I 2 massa molar do Sn
6 14. (Enem 2012) Aspartame é um edulcorante artificial (adoçante dietético) que apresenta potencial adoçante 200 vezes maior que o açúcar comum, permitindo seu uso em pequenas quantidades. Muito usado pela indústria alimentícia, principalmente nos refrigerantes diet, tem valor energético que corresponde a 4 calorias/grama. É contraindicado a portadores de fenilcetonúria, uma doença genética rara que provoca o acúmulo da fenilalanina no organismo, causando retardo mental. O IDA (índice diário aceitável) desse adoçante é 40 mg/kg de massa corpórea. Disponível em: Acesso em: 27 fev Com base nas informações do texto, a quantidade máxima recomendada de aspartame, em mol, que uma pessoa de 70 kg de massa corporal pode ingerir por dia é mais próxima de a) 1, , ,6. e) 8. Dado: massa molar do aspartame = 294g/mol 15. (Ime 2011) Sabendo que 18,0 g de um elemento X reagem exatamente com 7,75 g de oxigênio para formar um composto de fórmula X 2 O 5, a massa de um mol de X é: a) 99,2 g 92,9 g 74,3 g 46,5 g e) 18,6 g
QUÍMICA Prof. Marcelo MOL. NC Química Página 1 1, , , ,2g / cm para a densidade da grafita;
 QUÍMICA Prof. Marcelo MOL 01. (Uerj 016) No solo da floresta amazônica, são encontradas partículas ricas em fósforo, trazidas pelos 1 ventos, com velocidade constante de 0,1m s, desde o deserto do Saara.
QUÍMICA Prof. Marcelo MOL 01. (Uerj 016) No solo da floresta amazônica, são encontradas partículas ricas em fósforo, trazidas pelos 1 ventos, com velocidade constante de 0,1m s, desde o deserto do Saara.
QUÍMICA - 1 o ANO MÓDULO 21 RELAÇÕES NUMÉRICAS FUNDAMENTAIS - PARTE 1
 QUÍMICA - 1 o ANO MÓDULO 21 RELAÇÕES NUMÉRICAS FUNDAMENTAIS - PARTE 1 Unidade de massa atômica (u) Como pode cair no enem (CESGRANRIO) Um elemento X tem massa atômica 63,5 e apresenta os isótopos 63 X
QUÍMICA - 1 o ANO MÓDULO 21 RELAÇÕES NUMÉRICAS FUNDAMENTAIS - PARTE 1 Unidade de massa atômica (u) Como pode cair no enem (CESGRANRIO) Um elemento X tem massa atômica 63,5 e apresenta os isótopos 63 X
QUÍMICA - 3 o ANO MÓDULO 17 RELAÇÕES NUMÉRICAS FUNDAMENTAIS
 QUÍMICA - 3 o ANO MÓDULO 17 RELAÇÕES NUMÉRICAS FUNDAMENTAIS (U) Como pode cair no enem Certas ligas estanho-chumbo com composição específica formam um eutético simples, o que significa que uma liga com
QUÍMICA - 3 o ANO MÓDULO 17 RELAÇÕES NUMÉRICAS FUNDAMENTAIS (U) Como pode cair no enem Certas ligas estanho-chumbo com composição específica formam um eutético simples, o que significa que uma liga com
PRÉ-ENEM- LISTA DE EXERCÍCIOS PROF. LUCÃO - QUÍMICA (Ciências da Natureza e suas Tecnologias)
 PRÉ-ENEM- LISTA DE EXERCÍCIOS PROF. LUCÃO - QUÍMICA (Ciências da Natureza e suas Tecnologias) CÁLCULOS QUÍMICOS: MASSA ATÔMICA, MOLECULAR, CONSTANTE DE AVOGADRO E QUANTIDADE DE MATÉRIA (MOL) COMPETENCIA
PRÉ-ENEM- LISTA DE EXERCÍCIOS PROF. LUCÃO - QUÍMICA (Ciências da Natureza e suas Tecnologias) CÁLCULOS QUÍMICOS: MASSA ATÔMICA, MOLECULAR, CONSTANTE DE AVOGADRO E QUANTIDADE DE MATÉRIA (MOL) COMPETENCIA
LISTA DE EXERCÍCIOS DE QUÍMICA Data: / / 2017 Profa: Danusa Cassiano Nome: 2º ano EM: nº: LISTA DE EXERCÍCIOS (1) - 1º TRIMESTRE
 LISTA DE EXERCÍCIOS DE QUÍMICA Data: / / 2017 Profa: Danusa Cassiano Nome: 2º ano EM: nº: LISTA DE EXERCÍCIOS (1) - 1º TRIMESTRE Conteúdo: Massa atômica, massa molecular, mol e cálculo estequiométrico
LISTA DE EXERCÍCIOS DE QUÍMICA Data: / / 2017 Profa: Danusa Cassiano Nome: 2º ano EM: nº: LISTA DE EXERCÍCIOS (1) - 1º TRIMESTRE Conteúdo: Massa atômica, massa molecular, mol e cálculo estequiométrico
Relações numéricas. 25 abr. u.m.a, massa atômica, número de massa, massa molecular, massa molar, número de avogadro, volume molar,
 Relações numéricas 25 abr u.m.a, massa atômica, número de massa, massa molecular, massa molar, número de avogadro, volume molar, CNTP 01. Resumo 02. Exercício de Aula 03. Exercício de Casa 04. Questão
Relações numéricas 25 abr u.m.a, massa atômica, número de massa, massa molecular, massa molar, número de avogadro, volume molar, CNTP 01. Resumo 02. Exercício de Aula 03. Exercício de Casa 04. Questão
Questão 1. manter a dose recomendada diária é cerca de a) 30 comprimidos. b) 45 comprimidos. c) 60 comprimidos. d)15 comprimidos.
 Teoria atômico molecular 1º SÉRIE Química PROF. Cirilo Questão 1 (Ufu 18) A vitamina E tem sido relacionada à prevenção ao câncer de próstata, além de atuar como antioxidante para prevenir o envelhecimento
Teoria atômico molecular 1º SÉRIE Química PROF. Cirilo Questão 1 (Ufu 18) A vitamina E tem sido relacionada à prevenção ao câncer de próstata, além de atuar como antioxidante para prevenir o envelhecimento
Unidades de Concentração
 Unidades de Concentração Material de Apoio para Monitoria 1. (PUC -RS-2006) O Ministério da Saúde recomenda, para prevenir as cáries dentárias, 1,5 ppm (mg/l) como limite máximo de fluoreto em água potável.
Unidades de Concentração Material de Apoio para Monitoria 1. (PUC -RS-2006) O Ministério da Saúde recomenda, para prevenir as cáries dentárias, 1,5 ppm (mg/l) como limite máximo de fluoreto em água potável.
3º Trimestre Sala de Estudo - Química Data: 29/09/17 Ensino Médio 1º ano classe: A_B_C Profª Danusa Nome: nº
 3º Trimestre Sala de Estudo - Química Data: 29/09/17 Ensino Médio 1º ano classe: A_B_C Profª Danusa Nome: nº Conteúdo: Mol Questão 01 - (PUC Camp SP/2016) O consumo excessivo de sal pode acarretar o aumento
3º Trimestre Sala de Estudo - Química Data: 29/09/17 Ensino Médio 1º ano classe: A_B_C Profª Danusa Nome: nº Conteúdo: Mol Questão 01 - (PUC Camp SP/2016) O consumo excessivo de sal pode acarretar o aumento
SUBSTÂNCIAS /SEPARAÇÃO DE MISTURAS/ MASSA ATÔMICA E MOLECULAR / MOL 2016
 1. (UERJ ) No solo da floresta amazônica, são encontradas partículas ricas em fósforo, 1 trazidas pelos ventos, com velocidade constante de 0,1m s, desde o deserto do Saara. Admita que uma das partículas
1. (UERJ ) No solo da floresta amazônica, são encontradas partículas ricas em fósforo, 1 trazidas pelos ventos, com velocidade constante de 0,1m s, desde o deserto do Saara. Admita que uma das partículas
Lista de Exercício Para a Prova Trimestral Setor A. 1- Um elemento X apresenta os seguintes isótopos:
 Disciplina: Química Professor: Cássio Pacheco 1 Ano Lista de Exercício Para a Prova Trimestral Setor A 1- Um elemento X apresenta os seguintes isótopos: 40 X 80% 42 X 15% 44 X 5% Qual a massa atômica de
Disciplina: Química Professor: Cássio Pacheco 1 Ano Lista de Exercício Para a Prova Trimestral Setor A 1- Um elemento X apresenta os seguintes isótopos: 40 X 80% 42 X 15% 44 X 5% Qual a massa atômica de
Química Relações de massa. Olhar Químico. Prof. Romeu A. Nelo. (massa molecular, massa molar e mol)
 Olhar Químico Química Relações de massa Prof. Romeu A. Nelo. 1- Esta questão pretende exercitar a consulta à tabela periódica. Consulte-a e indique a massa atômica para o: a) Hidrogênio. b) Carbono. c)
Olhar Químico Química Relações de massa Prof. Romeu A. Nelo. 1- Esta questão pretende exercitar a consulta à tabela periódica. Consulte-a e indique a massa atômica para o: a) Hidrogênio. b) Carbono. c)
Professora Talita Marcília Lista de Exercícios
 assa Atômica 1. (Unimontes 2014) O cloro presente no PVC tem dois isótopos estáveis. O cloro-35, com massa 34,97u, constitui 75,77% do cloro encontrado na natureza. O outro isótopo é o cloro-37, de massa
assa Atômica 1. (Unimontes 2014) O cloro presente no PVC tem dois isótopos estáveis. O cloro-35, com massa 34,97u, constitui 75,77% do cloro encontrado na natureza. O outro isótopo é o cloro-37, de massa
QUÍMICA Prof. Marcelo ESTEQUIOMETRIA FIXAÇÃO. Nomelini Química Página 1. = 1 g mol; C = 12 g mol e O = 16 g mol
 QUÍMICA Prof. Marcelo ESTEQUIOMETRIA FIXAÇÃO 01. No Brasil, o etanol (álcool etílico) é obtido principalmente por processos fermentativos. O material a ser fermentado pode ser obtido de cana-de-açúcar,
QUÍMICA Prof. Marcelo ESTEQUIOMETRIA FIXAÇÃO 01. No Brasil, o etanol (álcool etílico) é obtido principalmente por processos fermentativos. O material a ser fermentado pode ser obtido de cana-de-açúcar,
1º trimestre Sala de Estudo Data: 16/03/17 Ensino Médio 3º ano classe: A_B_C Profª Danusa Nome: nº
 1º trimestre Sala de Estudo Data: 16/03/17 Ensino Médio 3º ano classe: A_B_C Profª Danusa Nome: nº Conteúdo: Fundamentos da química e Compostos Inorgânicos Questão 01 - (UEM PR/2016) Tendo em vista a tabela
1º trimestre Sala de Estudo Data: 16/03/17 Ensino Médio 3º ano classe: A_B_C Profª Danusa Nome: nº Conteúdo: Fundamentos da química e Compostos Inorgânicos Questão 01 - (UEM PR/2016) Tendo em vista a tabela
Qui. Allan Rodrigues Xandão (Renan Micha) (Gabriel Pereira)
 Semana 12 Allan Rodrigues Xandão (Renan Micha) (Gabriel Pereira) Este conteúdo pertence ao Descomplica. Está vedada a cópia ou a reprodução não autorizada previamente e por escrito. Todos os direitos reservados.
Semana 12 Allan Rodrigues Xandão (Renan Micha) (Gabriel Pereira) Este conteúdo pertence ao Descomplica. Está vedada a cópia ou a reprodução não autorizada previamente e por escrito. Todos os direitos reservados.
Colégio Equipe de Juiz de Fora Prof. Dr. Willian T. G. Novato Lista de Apoio para Reflexão no Feriado Data para correção: 17/04/2017
 TEXTO: 1 - Comum à questão: 1 A hidroxiapatita é um mineral constituído pelos íons cálcio, fosfato e hidróxido e tem fórmula unitária Ca10(PO4)6(OH)2. Ela é o principal constituinte dos osso e dentes.
TEXTO: 1 - Comum à questão: 1 A hidroxiapatita é um mineral constituído pelos íons cálcio, fosfato e hidróxido e tem fórmula unitária Ca10(PO4)6(OH)2. Ela é o principal constituinte dos osso e dentes.
LISTA 02 - TEORIA ATÔMICA MOLECULAR
 LISTA 02 - TEORIA ATÔMICA MOLECULAR 1º ano QUÍMICA PROF. PEDRO 2º Bimestre Questão 01) A massa de uma molécula de ácido acético, CH 3 COOH, é: a) 1,0. 10-21 g b) 1,0. 10-22 g c) 1,0. 10-23 g d) 1,0. 10-24
LISTA 02 - TEORIA ATÔMICA MOLECULAR 1º ano QUÍMICA PROF. PEDRO 2º Bimestre Questão 01) A massa de uma molécula de ácido acético, CH 3 COOH, é: a) 1,0. 10-21 g b) 1,0. 10-22 g c) 1,0. 10-23 g d) 1,0. 10-24
QUÍMICA GERAL PROF. PAULO VALIM
 QUÍMICA GERAL PROF. PAULO VALIM 3 QUANTIDADADES E MEDIDAS Gás Nobre para catalisar sua reação, vamos disponibilizar alguns exercícios com gabarito ao final de cada capítulo de estudo. Eles não fazem parte
QUÍMICA GERAL PROF. PAULO VALIM 3 QUANTIDADADES E MEDIDAS Gás Nobre para catalisar sua reação, vamos disponibilizar alguns exercícios com gabarito ao final de cada capítulo de estudo. Eles não fazem parte
ASSINATURA DO RESPONSÁVEL:
 ED. INFANTIL, ENSINO FUNDAMENTAL, MÉDIO E TÉCNICO Av. Tancredo Neves, 3500 Bairro Universitário Cep.: 35.170-056 Coronel Fabriciano MG - Tel.: (31) 3846-5777 - e-mail: secretaria@padredeman.g12.br Mantenedora:
ED. INFANTIL, ENSINO FUNDAMENTAL, MÉDIO E TÉCNICO Av. Tancredo Neves, 3500 Bairro Universitário Cep.: 35.170-056 Coronel Fabriciano MG - Tel.: (31) 3846-5777 - e-mail: secretaria@padredeman.g12.br Mantenedora:
Massa atômica, molecular e molar mol
 Segmento: Pré-vestibular Resoluções Coleção: Alfa, Beta e Gama. Disciplina: Química Volume: 1 Série: 7 Massa atômica, molecular e molar mol 1. D I. Verdadeira II. Verdadeira 12 6C (6 prótons + 6 nêutrons).
Segmento: Pré-vestibular Resoluções Coleção: Alfa, Beta e Gama. Disciplina: Química Volume: 1 Série: 7 Massa atômica, molecular e molar mol 1. D I. Verdadeira II. Verdadeira 12 6C (6 prótons + 6 nêutrons).
LISTA DE EXERCÍCIO PROVA MENSAL
 LISTA DE EXERCÍCIO PROVA MENSAL Nome: nº: Ano: 3º E.M. Professor: CASSIO PACHECO 1- O DDT, um inseticida largamente utilizado durante décadas e altamente tóxico, possui fórmula molecular C14H9Clx e massa
LISTA DE EXERCÍCIO PROVA MENSAL Nome: nº: Ano: 3º E.M. Professor: CASSIO PACHECO 1- O DDT, um inseticida largamente utilizado durante décadas e altamente tóxico, possui fórmula molecular C14H9Clx e massa
Estequiometria. Exercícios Objetivos
 Exercícios Objetivos 1. (2009) O álcool hidratado utilizado como combustível veicular é obtido por meio da destilação fracionada de soluções aquosas geradas a partir da fermentação de biomassa. Durante
Exercícios Objetivos 1. (2009) O álcool hidratado utilizado como combustível veicular é obtido por meio da destilação fracionada de soluções aquosas geradas a partir da fermentação de biomassa. Durante
mol). A massa, em mg, de cálcio (massa molar 40 g/mol) presente em 1 litro desse leite é
 CÁLCULOS QUÍMICOS - PIRES - OBJETIVAS 1-No rótulo de uma determinada embalagem de leite integral UHT, processo de tratamento térmico a alta temperatura, consta que um copo de 200 ml deste leite contém
CÁLCULOS QUÍMICOS - PIRES - OBJETIVAS 1-No rótulo de uma determinada embalagem de leite integral UHT, processo de tratamento térmico a alta temperatura, consta que um copo de 200 ml deste leite contém
2- (UEL-PR) Assinale a opção que apresenta as massas moleculares dos seguintes compostos: C 6 H 12 O 6 ; Ca 3 (PO 4 ) 2 e Ca(OH) 2, respectivamente:
 QUÍMICA 1- A magnetita, um minério do qual se extrai ferro possui fórmula molecular Fe 3 O x e sua massa molecular é 232u. Determine o valor de x e escreva a fórmula molecular correta da magnetita. 2-
QUÍMICA 1- A magnetita, um minério do qual se extrai ferro possui fórmula molecular Fe 3 O x e sua massa molecular é 232u. Determine o valor de x e escreva a fórmula molecular correta da magnetita. 2-
Química. Xandão (Renan Micha) Soluções
 Soluções Soluções 1. (FUVEST) Sabe-se que os metais ferro (Fe 0 ), magnésio (Mg 0 ) e estanho (Sn 0 ) reagem com soluções de ácidos minerais, liberando gás hidrogênio e formando íons divalentes em solução.
Soluções Soluções 1. (FUVEST) Sabe-se que os metais ferro (Fe 0 ), magnésio (Mg 0 ) e estanho (Sn 0 ) reagem com soluções de ácidos minerais, liberando gás hidrogênio e formando íons divalentes em solução.
2-A ductilidade é a propriedade de um material deformar-se, comprimir-se ou estirar-se sem se romper.
 UNESP 2012 1-O magma que sai dos vulcões durante as erupções é constituído por rochas fundidas e vários tipos de gases e vapores, tais como CO, CO 2, SO 2, SO 3, HCl e H 2 O. A respeito dessas substâncias,
UNESP 2012 1-O magma que sai dos vulcões durante as erupções é constituído por rochas fundidas e vários tipos de gases e vapores, tais como CO, CO 2, SO 2, SO 3, HCl e H 2 O. A respeito dessas substâncias,
1º trimestre Trabalho de Recuperação Data: 03/05/18 Ensino Médio 2º ano classe: A_B Profª Danusa Nome: nº
 1º trimestre Trabalho de Recuperação Data: 03/05/18 Ensino Médio 2º ano classe: A_B Profª Danusa Nome: nº Conteúdo: Mol e Soluções (Concentração Comum e Molar) *Entregar todos os exercícios resolvidos
1º trimestre Trabalho de Recuperação Data: 03/05/18 Ensino Médio 2º ano classe: A_B Profª Danusa Nome: nº Conteúdo: Mol e Soluções (Concentração Comum e Molar) *Entregar todos os exercícios resolvidos
Solvente: partículas responsáveis pela dissolução do soluto;
 Aula 18 20/ago Marcelo 2º Semestre Estudo das Soluções: Soluções: sinônimo de mistura homogênea. Componentes de uma solução: Soluto: partículas que são dissolvidas; Solvente: partículas responsáveis pela
Aula 18 20/ago Marcelo 2º Semestre Estudo das Soluções: Soluções: sinônimo de mistura homogênea. Componentes de uma solução: Soluto: partículas que são dissolvidas; Solvente: partículas responsáveis pela
1º Trimestre Sala de Estudos Química Data: 18/03/19 Ensino Médio 3º ano classe: A_B Profª Danusa Nome: nº
 1º Trimestre Sala de Estudos Química Data: 18/03/19 Ensino Médio 3º ano classe: A_B Profª Danusa ome: nº Conteúdo: Atividade complementar (Mais mol) Questão 01 - (PUC Camp SP/2016) consumo excessivo de
1º Trimestre Sala de Estudos Química Data: 18/03/19 Ensino Médio 3º ano classe: A_B Profª Danusa ome: nº Conteúdo: Atividade complementar (Mais mol) Questão 01 - (PUC Camp SP/2016) consumo excessivo de
Lista de Exercícios - Professor facebook.com/profrodrigoartuso. Grandezas Químicas e Estequiometria
 Grandezas Químicas e Estequiometria Criando base 1 - Em 100 gramas de alumínio, quantos átomos deste elemento estão presentes? Dados: M(Al) = 27 g/mol 1 mol = 6,02 x 10 23 átomos a) 3,7 x 10 23 b) 27 x
Grandezas Químicas e Estequiometria Criando base 1 - Em 100 gramas de alumínio, quantos átomos deste elemento estão presentes? Dados: M(Al) = 27 g/mol 1 mol = 6,02 x 10 23 átomos a) 3,7 x 10 23 b) 27 x
Disponível em: Acesso em: 27 jun (Adaptado)
 1. Na atual estrutura social, o abastecimento de água tratada desempenha papel fundamental para a prevenção de doenças. Entretanto, a população mais carente é a que mais sofre com a falta de água tratada,
1. Na atual estrutura social, o abastecimento de água tratada desempenha papel fundamental para a prevenção de doenças. Entretanto, a população mais carente é a que mais sofre com a falta de água tratada,
Prof. Msc João Neto 2
 Prof. Msc João Neto Prof. Msc João Neto 2 C 12 9 108 H 1 8 8 C9H8O4 O 16 4 64 180g / mol 180g N moléculas 500 10 3 g y 3 500 10 g N y 180g y 2,77 10 3 N moléculas C H O 9 8 4 C 12 9 108 H 1 8 8 O 16 4
Prof. Msc João Neto Prof. Msc João Neto 2 C 12 9 108 H 1 8 8 C9H8O4 O 16 4 64 180g / mol 180g N moléculas 500 10 3 g y 3 500 10 g N y 180g y 2,77 10 3 N moléculas C H O 9 8 4 C 12 9 108 H 1 8 8 O 16 4
QUÍMICA - 1 o ANO MÓDULO 25 ESTEQUIOMETRIA: TIPOS DE FÓRMULA
 QUÍMICA - 1 o ANO MÓDULO 25 ESTEQUIOMETRIA: TIPOS DE FÓRMULA Fixação 1) (PUC) A água oxigenada é uma solução de peróxido de hidrogênio (H 2 O 2 ) fortemente antis éptica por liberar O 2. Os percentuais,
QUÍMICA - 1 o ANO MÓDULO 25 ESTEQUIOMETRIA: TIPOS DE FÓRMULA Fixação 1) (PUC) A água oxigenada é uma solução de peróxido de hidrogênio (H 2 O 2 ) fortemente antis éptica por liberar O 2. Os percentuais,
RELAÇÕES DE MASSA E MOL
 RELAÇÃO DE MASSA E MOL A relação entre massa e quantidade Em uma gota de água de 0,05 ml há 1,67 sextilhão (1,67 x 10 21 ) de moléculas de água. A relação entre massa e quantidade A unidade de massa atômica
RELAÇÃO DE MASSA E MOL A relação entre massa e quantidade Em uma gota de água de 0,05 ml há 1,67 sextilhão (1,67 x 10 21 ) de moléculas de água. A relação entre massa e quantidade A unidade de massa atômica
Resolução UNIFESP 2015
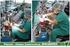 Resolução UNIFESP 2015 1-Utilizando o aparato indicado na figura, certo volume de solução aquosa de sulfato de cobre(ii) hidratado foi colocado dentro do béquer. Quando o plugue foi conectado à tomada
Resolução UNIFESP 2015 1-Utilizando o aparato indicado na figura, certo volume de solução aquosa de sulfato de cobre(ii) hidratado foi colocado dentro do béquer. Quando o plugue foi conectado à tomada
PROVA DE QUÍMICA 2 o TRIMESTRE DE 2015
 PROVA DE QUÍMICA 2 o TRIMESTRE DE 2015 PROF. MARCOS F. NOME N o 2 a SÉRIE A compreensão do enunciado faz parte da questão. Não faça perguntas ao examinador. A prova deve ser feita com caneta azul ou preta.
PROVA DE QUÍMICA 2 o TRIMESTRE DE 2015 PROF. MARCOS F. NOME N o 2 a SÉRIE A compreensão do enunciado faz parte da questão. Não faça perguntas ao examinador. A prova deve ser feita com caneta azul ou preta.
QUÍMICA 2 Prof Emanuele
 QUÍMICA 2 Prof Emanuele LISTA DE EXERCÍCIOS RELAÇÕES DE MASSA E ESTUDO DOS GASES 1) Silicatos são compostos de grande importância nas indústrias de cimento, cerâmica e vidro. Quantos gramas de silício
QUÍMICA 2 Prof Emanuele LISTA DE EXERCÍCIOS RELAÇÕES DE MASSA E ESTUDO DOS GASES 1) Silicatos são compostos de grande importância nas indústrias de cimento, cerâmica e vidro. Quantos gramas de silício
Programa de Pós-graduação em Ciência e Tecnologia de Materiais 1º semestre de Informações e instruções para a resolução da prova
 Programa de Pós-graduação em Ciência e Tecnologia de Materiais 1º semestre de 2014 Informações e instruções para a resolução da prova 1. A prova deve ser realizada sem consulta; 2. A duração da prova é
Programa de Pós-graduação em Ciência e Tecnologia de Materiais 1º semestre de 2014 Informações e instruções para a resolução da prova 1. A prova deve ser realizada sem consulta; 2. A duração da prova é
Qui. Semana. Allan Rodrigues Gabriel Pereira (Renan Micha)
 Qui. Semana 8 Allan Rodrigues Gabriel Pereira (Renan Micha) Este conteúdo pertence ao Descomplica. Está vedada a cópia ou a reprodução não autorizada previamente e por escrito. Todos os direitos reservados.
Qui. Semana 8 Allan Rodrigues Gabriel Pereira (Renan Micha) Este conteúdo pertence ao Descomplica. Está vedada a cópia ou a reprodução não autorizada previamente e por escrito. Todos os direitos reservados.
1º trimestre Sala de Estudos Data: 12/04/17 Ensino Médio 3º ano classe: A_B_C Profª Danusa Nome: nº
 1º trimestre Sala de Estudos Data: 12/04/17 Ensino Médio 3º ano classe: A_B_C Profª Danusa Nome: nº Conteúdo: Soluções (concentração comum e molaridade) e Gases Caso seja necessário, utilize a tabela periódica.
1º trimestre Sala de Estudos Data: 12/04/17 Ensino Médio 3º ano classe: A_B_C Profª Danusa Nome: nº Conteúdo: Soluções (concentração comum e molaridade) e Gases Caso seja necessário, utilize a tabela periódica.
TEXTO PARA A PRÓXIMA QUESTÃO: Leia o texto a seguir para responder à(s) seguinte(s) questão(ões).
 TEXTO PARA A PRÓXIMA QUESTÃO: Leia o texto a seguir para responder à(s) seguinte(s) questão(ões). A fotossíntese é um processo pelo qual as plantas e alguns micro-organismos utilizam energia luminosa para
TEXTO PARA A PRÓXIMA QUESTÃO: Leia o texto a seguir para responder à(s) seguinte(s) questão(ões). A fotossíntese é um processo pelo qual as plantas e alguns micro-organismos utilizam energia luminosa para
Programa de Pós-graduação em Ciência e Tecnologia de Materiais 2º semestre de Informações e instruções para a resolução da prova
 Programa de Pós-graduação em Ciência e Tecnologia de Materiais 2º semestre de 2014 Informações e instruções para a resolução da prova 1. A prova deve ser realizada sem consulta; 2. A duração da prova é
Programa de Pós-graduação em Ciência e Tecnologia de Materiais 2º semestre de 2014 Informações e instruções para a resolução da prova 1. A prova deve ser realizada sem consulta; 2. A duração da prova é
Determinar a massa de um corpo ("pesá-lo") é comparar sua massa com um padrão de massa conveniente e previamente escolhido
 Relações de massa Determinar a massa de um corpo ("pesá-lo") é comparar sua massa com um padrão de massa conveniente e previamente escolhido Quando pesamos um pacote de arroz e dizemos o quanto ele pesa
Relações de massa Determinar a massa de um corpo ("pesá-lo") é comparar sua massa com um padrão de massa conveniente e previamente escolhido Quando pesamos um pacote de arroz e dizemos o quanto ele pesa
ROTEIRO DE ESTUDOS 1 ANO II - TRIMESTRE
 ROTEIRO DE ESTUDOS 1 ANO II - TRIMESTRE PARTE 1 SETOR A 1- Considere as seguintes informações sobre um átomo X: Um isótopo tem massa de 20 u e um contribuição de 91%; Um isótopo tem massa de 22 u e um
ROTEIRO DE ESTUDOS 1 ANO II - TRIMESTRE PARTE 1 SETOR A 1- Considere as seguintes informações sobre um átomo X: Um isótopo tem massa de 20 u e um contribuição de 91%; Um isótopo tem massa de 22 u e um
GRANDEZAS QUÍMICAS MÓDULO 2 REPRESENTAÇÃO DAS TRANSFORMAÇÕES QUÍMICAS
 GRANDEZAS QUÍMICAS MÓDULO 2 REPRESENTAÇÃO DAS TRANSFORMAÇÕES QUÍMICAS GRANDEZAS QUÍMICAS Meça tudo o que for mensurável. O que não for, torne mensurável. Galileu Galilei (1564-1642) CARBONO: Atualmente,
GRANDEZAS QUÍMICAS MÓDULO 2 REPRESENTAÇÃO DAS TRANSFORMAÇÕES QUÍMICAS GRANDEZAS QUÍMICAS Meça tudo o que for mensurável. O que não for, torne mensurável. Galileu Galilei (1564-1642) CARBONO: Atualmente,
ESTEQUIOMETRIA - 3C13 - Profª
 ESTEQUIOMETRIA - 3C13 - Profª Estequiometria é a parte da Química que estuda as proporções dos elementos que se combinam ou que reagem. MASSA ATÔMICA (u) É a massa do átomo medida em unidades de massa
ESTEQUIOMETRIA - 3C13 - Profª Estequiometria é a parte da Química que estuda as proporções dos elementos que se combinam ou que reagem. MASSA ATÔMICA (u) É a massa do átomo medida em unidades de massa
ESTEQUIOMETRIA Folha 01 João Roberto Mazzei
 01. (UFC 2009) O principal componente da cal, importante produto industrial fabricado no Ceará, é o óxido de cálcio (CaO). A produção de CaO se processa de acordo com a seguinte reação química: CaCO 3(s)
01. (UFC 2009) O principal componente da cal, importante produto industrial fabricado no Ceará, é o óxido de cálcio (CaO). A produção de CaO se processa de acordo com a seguinte reação química: CaCO 3(s)
3º Trimestre Sala de Estudo Química Data:08/10/18 Ensino Médio 1º ano classe: A_B Profª Danusa Nome: nº
 3º Trimestre Sala de Estudo Química Data:08/10/18 Ensino Médio 1º ano classe: A_B Profª Danusa Nome: nº Conteúdo: Massa atômica, mol, massa molar e cálculo de fórmulas Questão 01 - (PUC RJ/2014) Oxigênio
3º Trimestre Sala de Estudo Química Data:08/10/18 Ensino Médio 1º ano classe: A_B Profª Danusa Nome: nº Conteúdo: Massa atômica, mol, massa molar e cálculo de fórmulas Questão 01 - (PUC RJ/2014) Oxigênio
21. Considere a seguinte expressão de constante de equilíbrio em termos de pressões parciais: K p =
 PASES 2 a ETAPA TRIÊNIO 2003-2005 1 O DIA GABARITO 1 13 QUÍMICA QUESTÕES DE 21 A 30 21. Considere a seguinte expressão de constante de equilíbrio em termos de pressões parciais: K p = 1 p CO2 Dentre as
PASES 2 a ETAPA TRIÊNIO 2003-2005 1 O DIA GABARITO 1 13 QUÍMICA QUESTÕES DE 21 A 30 21. Considere a seguinte expressão de constante de equilíbrio em termos de pressões parciais: K p = 1 p CO2 Dentre as
01- (UFRRJ 2004) Os sais de cobre são conhecidos por apresentarem coloração azul, inclusive
 01- (UFRRJ 2004) Os sais de cobre são conhecidos por apresentarem coloração azul, inclusive sendo utilizados em misturas destinadas a tratamento de água em piscinas. O sulfato cúprico penta-hidratado apresenta
01- (UFRRJ 2004) Os sais de cobre são conhecidos por apresentarem coloração azul, inclusive sendo utilizados em misturas destinadas a tratamento de água em piscinas. O sulfato cúprico penta-hidratado apresenta
Química. Resolução das atividades complementares. Q13 Massa molar e mol
 Resolução das atividades complementares 1 Química Q13 Massa molar e mol p. 75 1 (Univali-SC) A urina apresenta 5% de água e 5% de substâncias orgânicas e inorgânicas dissolvidas. Em um litro de urina,
Resolução das atividades complementares 1 Química Q13 Massa molar e mol p. 75 1 (Univali-SC) A urina apresenta 5% de água e 5% de substâncias orgânicas e inorgânicas dissolvidas. Em um litro de urina,
QUÍMICA - 1 o ANO MÓDULO 22 RELAÇÕES NUMÉRICAS FUNDAMENTAIS - PARTE 2
 QUÍMICA - 1 o ANO MÓDULO 22 RELAÇÕES NUMÉRICAS FUNDAMENTAIS - PARTE 2 Fixação 1) (UNESP) O volume de uma massa fixa de gás ideal, a pressão constante, é diretamente proporcional à: a) concentração do gás.
QUÍMICA - 1 o ANO MÓDULO 22 RELAÇÕES NUMÉRICAS FUNDAMENTAIS - PARTE 2 Fixação 1) (UNESP) O volume de uma massa fixa de gás ideal, a pressão constante, é diretamente proporcional à: a) concentração do gás.
Compostos iônicos e moleculares
 LCE0143 Química Geral Compostos iônicos e moleculares Wanessa Melchert Mattos wanemelc@usp.br Moléculas - Menores unidades identificáveis - Moléculas são reuniões de dois ou mais átomos ligados entre si
LCE0143 Química Geral Compostos iônicos e moleculares Wanessa Melchert Mattos wanemelc@usp.br Moléculas - Menores unidades identificáveis - Moléculas são reuniões de dois ou mais átomos ligados entre si
Colégio FAAT Ensino Fundamental e Médio
 Colégio FAAT Ensino Fundamental e Médio Conteúdo: Cálculos químicos Estudo dos gases Recuperação do 4 Bimestre disciplina Química 1ºano Lista de exercícios 1-1,0 mol de glicose (C 6 H 12 O 6 ) corresponde
Colégio FAAT Ensino Fundamental e Médio Conteúdo: Cálculos químicos Estudo dos gases Recuperação do 4 Bimestre disciplina Química 1ºano Lista de exercícios 1-1,0 mol de glicose (C 6 H 12 O 6 ) corresponde
3ªHumanas e Master - Química Prof os João Lins e Alexandre Estevão
 3ªHumanas e Master - Química Prof os João Lins e Alexandre Estevão 1) Um sistema heterogêneo, S, é constituído por uma solução colorida e um sólido branco. O sistema foi submetido ao seguinte esquema de
3ªHumanas e Master - Química Prof os João Lins e Alexandre Estevão 1) Um sistema heterogêneo, S, é constituído por uma solução colorida e um sólido branco. O sistema foi submetido ao seguinte esquema de
QUÍMICA - 1 o ANO MÓDULO 29 ESTEQUIOMETRIA: EXCESSO E LIMITANTE
 QUÍMICA - 1 o ANO MÓDULO 29 ESTEQUIOMETRIA: EXCESSO E LIMITANTE Como pode cair no enem (UFF) O cloreto de alumínio é um reagente muito utilizado em processos industriais que pode ser obtido por meio da
QUÍMICA - 1 o ANO MÓDULO 29 ESTEQUIOMETRIA: EXCESSO E LIMITANTE Como pode cair no enem (UFF) O cloreto de alumínio é um reagente muito utilizado em processos industriais que pode ser obtido por meio da
Interbits SuperPro Web
 Simulado Unicamp Gepê. 1. Quando tocamos em objetos, deixamos várias substâncias neles, uma delas é o cloreto de sódio, expelido pelo suor. Para encontrar impressões digitais, os investigadores borrifam,
Simulado Unicamp Gepê. 1. Quando tocamos em objetos, deixamos várias substâncias neles, uma delas é o cloreto de sódio, expelido pelo suor. Para encontrar impressões digitais, os investigadores borrifam,
LISTA DE EXERCÍCIOS - ESTEQUIOMETRIA
 LISTA DE EXERCÍCIOS - ESTEQUIOMETRIA Prof. Geraldo Alexandre Jr. 1. Três combustíveis automotivos oficialmente usados no Brasil são GNV (CH 4 ), etanol (CH 3 CH 2 OH) e gasolina (C 8 H 18 ). Dentro dos
LISTA DE EXERCÍCIOS - ESTEQUIOMETRIA Prof. Geraldo Alexandre Jr. 1. Três combustíveis automotivos oficialmente usados no Brasil são GNV (CH 4 ), etanol (CH 3 CH 2 OH) e gasolina (C 8 H 18 ). Dentro dos
QUÍMICA - 3 o ANO MÓDULO 24 DILUIÇÃO DE SOLUÇÕES
 QUÍMICA - 3 o ANO MÓDULO 24 DILUIÇÃO DE SOLUÇÕES solvente m c v m c v Como pode cair no enem (UERJ) Uma suspensão de células animais em um meio isotônico adequado apresenta volume igual a 1 L e concentração
QUÍMICA - 3 o ANO MÓDULO 24 DILUIÇÃO DE SOLUÇÕES solvente m c v m c v Como pode cair no enem (UERJ) Uma suspensão de células animais em um meio isotônico adequado apresenta volume igual a 1 L e concentração
O que você deve saber sobre
 O que você deve saber sobre Podemos conhecer as grandezas que regem a quantificação dos fenômenos químicos identificando o comportamento da massa, do número de partículas e do volume de diferentes substâncias.
O que você deve saber sobre Podemos conhecer as grandezas que regem a quantificação dos fenômenos químicos identificando o comportamento da massa, do número de partículas e do volume de diferentes substâncias.
Química Analítica I Tratamento dos dados analíticos Soluções analíticas
 Química Analítica I Tratamento dos dados analíticos Soluções analíticas Profª Simone Noremberg Kunz 2 Mol Medidas em química analítica É a quantidade de uma espécie química que contém 6,02x10 23 partículas
Química Analítica I Tratamento dos dados analíticos Soluções analíticas Profª Simone Noremberg Kunz 2 Mol Medidas em química analítica É a quantidade de uma espécie química que contém 6,02x10 23 partículas
2-) Observe os sistemas
 SOLUBILIDADE Boa atividade!!! Professora Luciane 1-) Um determinado sal tem coeficiente de solubilidade igual a 34g/100g de água, a 20ºC. Tendo-se 450g de água a 20 ºC, qual a quantidade, em gramas, desse
SOLUBILIDADE Boa atividade!!! Professora Luciane 1-) Um determinado sal tem coeficiente de solubilidade igual a 34g/100g de água, a 20ºC. Tendo-se 450g de água a 20 ºC, qual a quantidade, em gramas, desse
TRABALHO DE BIOLOGIA QUÍMICA DA VIDA
 TRABALHO DE BIOLOGIA QUÍMICA DA VIDA Água Sais minerais Vitaminas Carboidratos Lipídios Proteínas Enzimas Ácidos Núcleos Arthur Renan Doebber, Eduardo Grehs Água A água é uma substância química composta
TRABALHO DE BIOLOGIA QUÍMICA DA VIDA Água Sais minerais Vitaminas Carboidratos Lipídios Proteínas Enzimas Ácidos Núcleos Arthur Renan Doebber, Eduardo Grehs Água A água é uma substância química composta
Exercícios de Revisão Ensino Médio Química: Setor A 2ª Série Professor Diego
 Exercícios de Revisão Ensino Médio Química: Setor A ª Série Professor Diego. A figura abaixo representa soluções com 00 g de água a 5 C. a) A solução em A está (insaturada/saturada/supersaturada). b) O
Exercícios de Revisão Ensino Médio Química: Setor A ª Série Professor Diego. A figura abaixo representa soluções com 00 g de água a 5 C. a) A solução em A está (insaturada/saturada/supersaturada). b) O
Assinale o elemento que pode formar um cátion isoeletrônico com o Neônio (Ne) e se ligar ao oxigênio na proporção de 1:1.
 1 PRVA DE QUÍMICA II QUESTÃ 46 Assinale o elemento que pode formar um cátion isoeletrônico com o Neônio (Ne) e se ligar ao oxigênio na proporção de 1:1. a) F b) Na c) Mg d) Al UESTÃ 47 Para se descascarem
1 PRVA DE QUÍMICA II QUESTÃ 46 Assinale o elemento que pode formar um cátion isoeletrônico com o Neônio (Ne) e se ligar ao oxigênio na proporção de 1:1. a) F b) Na c) Mg d) Al UESTÃ 47 Para se descascarem
MASSA ATÔMICA. 1u corresponde a 1, g, que equivale aproximadamente à massa de um próton ou de um nêutron.
 Cálculos Químicos MASSA ATÔMICA Na convenção da IUPAC (União Internacional de Química Pura e Aplicada) realizada em 1961, adotou-se como unidade padrão para massa atômica o equivalente a 1/12 da massa
Cálculos Químicos MASSA ATÔMICA Na convenção da IUPAC (União Internacional de Química Pura e Aplicada) realizada em 1961, adotou-se como unidade padrão para massa atômica o equivalente a 1/12 da massa
10 testes - GABARITO. Estrutura Atômica e Ligação Interatômica
 10 testes - GABARITO Estrutura Atômica e Ligação Interatômica 1) Calcule o número de átomos de Cu em um cilindro de cobre maciço com 1 m de altura e 1 m de diâmetro. densidade do Cu = 8,9 g/cm ; massa
10 testes - GABARITO Estrutura Atômica e Ligação Interatômica 1) Calcule o número de átomos de Cu em um cilindro de cobre maciço com 1 m de altura e 1 m de diâmetro. densidade do Cu = 8,9 g/cm ; massa
RESUMO EXERCÍCIOS DE REVISÃO. n: número de mols (em mol) m: massa (em g) M: massa molar (em g/mol)
 Química Frente I Vitor Terra Lista 1 Contando átomos e moléculas: o Mol RESUMO Unidade de massa atômica (u): definida como 1/12 da massa de um átomo de carbono-12 ( 12 C). Massa atômica é a massa de um
Química Frente I Vitor Terra Lista 1 Contando átomos e moléculas: o Mol RESUMO Unidade de massa atômica (u): definida como 1/12 da massa de um átomo de carbono-12 ( 12 C). Massa atômica é a massa de um
01- (UFRRJ 2001) O hidróxido de lítio (LiOH), usado na produção de sabões de lítio para a
 01- (UFRRJ 2001) O hidróxido de lítio (LiOH), usado na produção de sabões de lítio para a fabricação de graxas lubrificantes a partir de óleos, é obtido pela reação do carbonato de lítio (Li COƒ) com o
01- (UFRRJ 2001) O hidróxido de lítio (LiOH), usado na produção de sabões de lítio para a fabricação de graxas lubrificantes a partir de óleos, é obtido pela reação do carbonato de lítio (Li COƒ) com o
LISTA DE EXERCÍCIOS 1º ANO
 Questão 1 Questão 2 Questão 3 Questão 4 Química GABARITO a) I) Fe 2 O 3 (s)+3h 2 SO 4 (aq) Fe 2 (SO 4 (aq)+3h 2 O II) 2Al(OH (s)+3h 2 SO 4 (aq) Al 2 (SO 4 (aq)+6h 2 O IIICaO(s)+2H 3 PO 4 (aq) Ca 3 (PO
Questão 1 Questão 2 Questão 3 Questão 4 Química GABARITO a) I) Fe 2 O 3 (s)+3h 2 SO 4 (aq) Fe 2 (SO 4 (aq)+3h 2 O II) 2Al(OH (s)+3h 2 SO 4 (aq) Al 2 (SO 4 (aq)+6h 2 O IIICaO(s)+2H 3 PO 4 (aq) Ca 3 (PO
Na obtenção de prata por eletrólise de solução aquosa de nitrato de prata, o metal se forma no: a) cátodo, por redução de íons Ag(+) b) cátodo, por
 Na obtenção de prata por eletrólise de solução aquosa de nitrato de prata, o metal se forma no: a) cátodo, por redução de íons Ag(+) b) cátodo, por oxidação de íons ag(+) c) cátodo, por redução de átomos
Na obtenção de prata por eletrólise de solução aquosa de nitrato de prata, o metal se forma no: a) cátodo, por redução de íons Ag(+) b) cátodo, por oxidação de íons ag(+) c) cátodo, por redução de átomos
INSTITUTO GEREMARIO DANTAS COMPONENTE CURRICULAR: QUÍMICA EXERCÍCIOS DE RECUPERAÇÃO PARCIAL 2016
 INSTITUTO GEREMARIO DANTAS Educação Infantil, Ensino Fundamental e Médio Fone: (21) 21087900 Rio de Janeiro RJ www.igd.com.br Aluno(a): 1º Ano: C11 Nº Professora: Lúcia Nascimento COMPONENTE CURRICULAR:
INSTITUTO GEREMARIO DANTAS Educação Infantil, Ensino Fundamental e Médio Fone: (21) 21087900 Rio de Janeiro RJ www.igd.com.br Aluno(a): 1º Ano: C11 Nº Professora: Lúcia Nascimento COMPONENTE CURRICULAR:
Aula 15 Relações de Massa
 Aula 15 Relações de Massa Na Química, é muito importante, saber antecipadamente as quantidades de reagentes que devemos usar para obter as quantidades de produtos desejadas. Entretanto, essas previsões
Aula 15 Relações de Massa Na Química, é muito importante, saber antecipadamente as quantidades de reagentes que devemos usar para obter as quantidades de produtos desejadas. Entretanto, essas previsões
 Lista de exercícios - Bloco 2 - Aula 25 a 28 - Equilíbrio Químico - Conceitos gerais e cálculo (Kc e Kp) 1. (Unicid - Medicina 2017) Considere os equilíbrios: 1. 2 SO 2 (g) + O 2 (g) 2 SO 3 (g) 25 Kc =
Lista de exercícios - Bloco 2 - Aula 25 a 28 - Equilíbrio Químico - Conceitos gerais e cálculo (Kc e Kp) 1. (Unicid - Medicina 2017) Considere os equilíbrios: 1. 2 SO 2 (g) + O 2 (g) 2 SO 3 (g) 25 Kc =
REVISÃO DE FÉRIAS - QUÍMICA 5
 REVISÃO DE FÉRIAS - QUÍMICA 5 QUÍMICA 5 REVISÃO DE FÉRIAS 1. (Enem 2ª aplicação) Alguns fatores podem alterar a rapidez das reações químicas. A seguir, destacamse três exemplos no contexto da preparação
REVISÃO DE FÉRIAS - QUÍMICA 5 QUÍMICA 5 REVISÃO DE FÉRIAS 1. (Enem 2ª aplicação) Alguns fatores podem alterar a rapidez das reações químicas. A seguir, destacamse três exemplos no contexto da preparação
ESTEQUIOMETRIA (Conceitos básicos) QUÍMICA A 1415 ESTEQUIOMETRIA
 ESTEQUIOMETRIA Estequiometria é a parte da Química que estuda as proporções dos elementos que se combinam ou que reagem. MASSA ATÓMICA (u) É a massa do átomo medida em unidades de massa atómica (u). A
ESTEQUIOMETRIA Estequiometria é a parte da Química que estuda as proporções dos elementos que se combinam ou que reagem. MASSA ATÓMICA (u) É a massa do átomo medida em unidades de massa atómica (u). A
QUÍMICA MÓDULO 20 CÁLCULO ESTEQUIOMÉTRICO. Professor Edson Cruz
 QUÍMICA Professor Edson Cruz MÓDULO 20 CÁLCULO ESTEQUIOMÉTRICO INTRODUÇÃO Agora que já sabemos os pré-requisitos para o entendimento do cálculo estequiométrico, podemos defini-lo como "o método matemático
QUÍMICA Professor Edson Cruz MÓDULO 20 CÁLCULO ESTEQUIOMÉTRICO INTRODUÇÃO Agora que já sabemos os pré-requisitos para o entendimento do cálculo estequiométrico, podemos defini-lo como "o método matemático
QUÍMICA. 1. (FMTM-MG) Uma bisnaga de xilocaína a 2%, de massa total 250g, apresenta quantos gramas de solvente? a) 0,5g. c) 24,5g.
 QUÍMICA Prof. Jorge Luis Lista de exercícios de soluções: Concentrações. 1. (FMTM-MG) Uma bisnaga de xilocaína a 2%, de massa total 250g, apresenta quantos gramas de solvente? a) 0,5g c) 24,5g e) 240g
QUÍMICA Prof. Jorge Luis Lista de exercícios de soluções: Concentrações. 1. (FMTM-MG) Uma bisnaga de xilocaína a 2%, de massa total 250g, apresenta quantos gramas de solvente? a) 0,5g c) 24,5g e) 240g
FUVEST 1984 Primeira fase e Segunda fase
 FUVEST 1984 Primeira fase e Segunda fase Professora Sonia 9. A melhor maneira de separar os três componentes de uma mistura de areia com solução aquosa de sal é: CONHECIMENTOS GERAIS 5. O peso atômico
FUVEST 1984 Primeira fase e Segunda fase Professora Sonia 9. A melhor maneira de separar os três componentes de uma mistura de areia com solução aquosa de sal é: CONHECIMENTOS GERAIS 5. O peso atômico
Pb 2e Pb E 0,13 v. Ag 2e Ag E +0,80 v. Zn 2e Zn E 0,76 v. Al 3e Al E 1,06 v. Mg 2e Mg E 2,4 v. Cu 2e Cu E +0,34 v
 QUÍMICA 1ª QUESTÃO Umas das reações possíveis para obtenção do anidrido sulfúrico é a oxidação do anidrido sulfuroso por um agente oxidante forte em meio aquoso ácido, como segue a reação. Anidrido sulfuroso
QUÍMICA 1ª QUESTÃO Umas das reações possíveis para obtenção do anidrido sulfúrico é a oxidação do anidrido sulfuroso por um agente oxidante forte em meio aquoso ácido, como segue a reação. Anidrido sulfuroso
Disciplina: Química (Turmas T e R); Data: 10/06/16 Aula: Relações de massa Professora Ana RELAÇÕES DE MASSA
 Disciplina: Química (Turmas T e R); Data: 10/06/16 Aula: Relações de massa Professora Ana (anaflaviasuzana@yahoo.com.br) RELAÇÕES DE MASSA A química possibilitou a humanidade uma melhora substancial em
Disciplina: Química (Turmas T e R); Data: 10/06/16 Aula: Relações de massa Professora Ana (anaflaviasuzana@yahoo.com.br) RELAÇÕES DE MASSA A química possibilitou a humanidade uma melhora substancial em
Revisão Específicas. Química Monitores: Luciana Lima e Rafael França 02-08/11/2015. Material de Apoio para Monitoria
 Revisão Específicas 1. As conchas marinhas não se dissolvem apreciavelmente na água do mar, por serem compostas, na sua maioria, de carbonato de cálcio, um sal insolúvel cujo produto de solubilidade é
Revisão Específicas 1. As conchas marinhas não se dissolvem apreciavelmente na água do mar, por serem compostas, na sua maioria, de carbonato de cálcio, um sal insolúvel cujo produto de solubilidade é
SE18 - Química. LQUI1A3 - Introdução à estequiometria. Questão 1
 SE18 - Química LQUI1A3 - Introdução à estequiometria Questão 1 (UFRGS-RS) Os clorofluorcarbonos (CFCs) sofrem decomposição nas altas camadas da atmosfera, originando átomos de cloro, os quais atacam moléculas
SE18 - Química LQUI1A3 - Introdução à estequiometria Questão 1 (UFRGS-RS) Os clorofluorcarbonos (CFCs) sofrem decomposição nas altas camadas da atmosfera, originando átomos de cloro, os quais atacam moléculas
Fundamentos de Química. PROFª LORAINE JACOBS
 Fundamentos de Química PROFª LORAINE JACOBS lorainejacobs@utfpr.edu.br http://paginapessoal.utfpr.edu.br/lorainejacobs Matéria e Energia Matéria e Energia Matéria Essência Tem existência física real Tem
Fundamentos de Química PROFª LORAINE JACOBS lorainejacobs@utfpr.edu.br http://paginapessoal.utfpr.edu.br/lorainejacobs Matéria e Energia Matéria e Energia Matéria Essência Tem existência física real Tem
UNIVERSIDADE DO ESTADO DO RIO DE JANEIRO INSTITUTO DE QUÍMICA PROGRAMA DE PÓS-GRADUAÇÃO EM QUÍMICA PROVA DE SELEÇÃO/2011 DO CURSO DE MESTRADO
 UNIVERSIDADE DO ESTADO DO RIO DE JANEIRO INSTITUTO DE QUÍMICA PROGRAMA DE PÓS-GRADUAÇÃO EM QUÍMICA PROVA DE SELEÇÃO/2011 DO CURSO DE MESTRADO 08/11/2010 PROVA ESCRITA Assinatura do candidato: Área de concentração:
UNIVERSIDADE DO ESTADO DO RIO DE JANEIRO INSTITUTO DE QUÍMICA PROGRAMA DE PÓS-GRADUAÇÃO EM QUÍMICA PROVA DE SELEÇÃO/2011 DO CURSO DE MESTRADO 08/11/2010 PROVA ESCRITA Assinatura do candidato: Área de concentração:
EXERCÍCIOS DE APLICAÇÃO
 EXERCÍCIOS DE APLICAÇÃO 01 (UFSE-SE) 1,8.10 moléculas de uma substância A têm massa igual a 18,0 g. A massa molar de A, em g/mol, vale: (Dados: constante de Avogadro: 6.10 ) a) 18 b) 60 c) 75 d) 90 e)
EXERCÍCIOS DE APLICAÇÃO 01 (UFSE-SE) 1,8.10 moléculas de uma substância A têm massa igual a 18,0 g. A massa molar de A, em g/mol, vale: (Dados: constante de Avogadro: 6.10 ) a) 18 b) 60 c) 75 d) 90 e)
Professor Marcus Ennes. -Estequiometria
 Professor Marcus Ennes -Estequiometria - RELAÇÕES FUNDAMENTAIS RAZÃO E PROPORÇÃO 1) Um formigueiro é composto por 2.000 formigas. Cada formiga consome por dia, 1.500 moléculas de glicose (C 6 H 12 O 6
Professor Marcus Ennes -Estequiometria - RELAÇÕES FUNDAMENTAIS RAZÃO E PROPORÇÃO 1) Um formigueiro é composto por 2.000 formigas. Cada formiga consome por dia, 1.500 moléculas de glicose (C 6 H 12 O 6
ATENÇÃO: O DESENVOLVIMENTO TEÓRICO DAS QUESTÕES É OBRIGATÓRIO
 IX Olimpíada Capixaba de Química 2011 Prova do Grupo I 1 a série do ensino médio Fase 02 Aluno: Idade: Instituição de Ensino: Coordenador da Instituição de Ensino: ATENÇÃO: O DESENVOLVIMENTO TEÓRICO DAS
IX Olimpíada Capixaba de Química 2011 Prova do Grupo I 1 a série do ensino médio Fase 02 Aluno: Idade: Instituição de Ensino: Coordenador da Instituição de Ensino: ATENÇÃO: O DESENVOLVIMENTO TEÓRICO DAS
Gavião Peixoto nº 124 Edifício Manhattan /
 1)Você já sentiu o ardido de pimenta na boca? Pois bem, a substância responsável pela sensação picante na língua é a capsaicina, substância ativa das pimentas. Sua fórmula estrutural está representada
1)Você já sentiu o ardido de pimenta na boca? Pois bem, a substância responsável pela sensação picante na língua é a capsaicina, substância ativa das pimentas. Sua fórmula estrutural está representada
Unimonte, Engenharia Física Aplicada, prof. Marco Simões Comportamento Térmico dos Gases. Exercícios selecionados do Sears & Zemanzki, vol.
 Unimonte, Engenharia Física Aplicada, prof. Marco Simões Comportamento Térmico dos Gases. Exercícios selecionados do Sears & Zemanzki, vol. 2 Nos exercícios abaixo adotar! = 8,315!!"#! = 0,08206!!"#!"#!
Unimonte, Engenharia Física Aplicada, prof. Marco Simões Comportamento Térmico dos Gases. Exercícios selecionados do Sears & Zemanzki, vol. 2 Nos exercícios abaixo adotar! = 8,315!!"#! = 0,08206!!"#!"#!
ESTEQUIOMETRIA. 1. Introdução
 ESTEQUIOMETRIA 1. Introdução A palavra estequiometria vem do grego stoikheion (elemento) e metriā (medida). A estequiometria baseia-se na Lei da Conservação das Massas e na Lei das Proporções Definidas
ESTEQUIOMETRIA 1. Introdução A palavra estequiometria vem do grego stoikheion (elemento) e metriā (medida). A estequiometria baseia-se na Lei da Conservação das Massas e na Lei das Proporções Definidas
Trabalho de Recuperação Final 2017
 Nome Nº Turma 1A1AC Nome do Professor Claudia Figueiredo /12/17 Nome da Disciplina: QUÍMICA Trabalho de Recuperação Final 2017 Valor do trabalho: de zero a dois pontos. Conteúdo: Ap5- Reações de Oxidorredução
Nome Nº Turma 1A1AC Nome do Professor Claudia Figueiredo /12/17 Nome da Disciplina: QUÍMICA Trabalho de Recuperação Final 2017 Valor do trabalho: de zero a dois pontos. Conteúdo: Ap5- Reações de Oxidorredução
QUÍMICA MÓDULO 18 RELAÇÕES NUMÉRICAS. Professor Edson Cruz
 QUÍMICA Professor Edson Cruz MÓDULO 18 RELAÇÕES NUMÉRICAS INTRODUÇÃO Precisamos compreender que houve uma necessidade de se definir uma nova unidade de massa para átomos e moléculas. É importante que você
QUÍMICA Professor Edson Cruz MÓDULO 18 RELAÇÕES NUMÉRICAS INTRODUÇÃO Precisamos compreender que houve uma necessidade de se definir uma nova unidade de massa para átomos e moléculas. É importante que você
PROVA DE QUÍMICA. Adaptada da Tabela Periódica da IUPAC/versão 2007 Acesso: PROVA DE QUÍMICA - Caderno 1
 PROVA DE QUÍMICA Adaptada da Tabela Periódica da IUPAC/versão 2007 Acesso: http://wwwiupacorg/reports/periodic_table/ 18 PROVA DE QUÍMICA - Caderno 1 QUESTÃO 25 1 Na extração do ouro, os garimpeiros costumam
PROVA DE QUÍMICA Adaptada da Tabela Periódica da IUPAC/versão 2007 Acesso: http://wwwiupacorg/reports/periodic_table/ 18 PROVA DE QUÍMICA - Caderno 1 QUESTÃO 25 1 Na extração do ouro, os garimpeiros costumam
Massa Atômica (M.A.) é a massa de um átomo, expressa em u.
 Química Profª Simone AULA 9 QUANTIDADE DE MATÉRIA (MOL) A química é essa ciência que deseja compreender os mistérios da matéria, e nesse estudo serão abordados aspectos quantitativos e qualitativos. Nessa
Química Profª Simone AULA 9 QUANTIDADE DE MATÉRIA (MOL) A química é essa ciência que deseja compreender os mistérios da matéria, e nesse estudo serão abordados aspectos quantitativos e qualitativos. Nessa
INSTITUTO GEREMARIO DANTAS COMPONENTE CURRICULAR: QUÍMICA EXERCÍCIOS EXTRAS 2º TRIMESTRE 2016
 INSTITUTO GEREMARIO DANTAS Educação Infantil, Ensino Fundamental e Médio Fone: (21) 21087900 Rio de Janeiro RJ www.igd.com.br Aluno(a): 1º Ano: C11 Nº Professor: Lúcia Nascimento COMPONENTE CURRICULAR:
INSTITUTO GEREMARIO DANTAS Educação Infantil, Ensino Fundamental e Médio Fone: (21) 21087900 Rio de Janeiro RJ www.igd.com.br Aluno(a): 1º Ano: C11 Nº Professor: Lúcia Nascimento COMPONENTE CURRICULAR:
1. NOÇÕES FUNDAMENTAIS
 Universidade Estadual do Centro-Oeste - UNICENTRO 1. NOÇÕES FUNDAMENTAIS Prof. a M. a Nayara Lais Boschen QUÍMICA 2 MATÉRIA Tudo aquilo que possui massa e ocupa lugar no espaço; Pode ser na forma sólida,
Universidade Estadual do Centro-Oeste - UNICENTRO 1. NOÇÕES FUNDAMENTAIS Prof. a M. a Nayara Lais Boschen QUÍMICA 2 MATÉRIA Tudo aquilo que possui massa e ocupa lugar no espaço; Pode ser na forma sólida,
SOLUÇÕES Folha 1.14 João Roberto Fortes Mazzei
 1) Solução salina normal é uma solução aquosa de cloreto de sódio, usada em medicina porque a sua composição coincide com aquela dos fluídos do organismo. Sabendo-se que foi preparada pela dissolução de
1) Solução salina normal é uma solução aquosa de cloreto de sódio, usada em medicina porque a sua composição coincide com aquela dos fluídos do organismo. Sabendo-se que foi preparada pela dissolução de
Principais funções dos sais minerais:
 A Química da Vida Água Água mineral é a água que tem origem em fontes naturais ou artificiais e que possui componentes químicos adicionados, como sais, compostos de enxofre e gases que já vêm dissolvidas
A Química da Vida Água Água mineral é a água que tem origem em fontes naturais ou artificiais e que possui componentes químicos adicionados, como sais, compostos de enxofre e gases que já vêm dissolvidas
