O gabarito oficial provisório estará disponível no endereço eletrônico a partir das 20 horas do dia 6 de dezembro de 2010.
|
|
|
- Isadora Garrido Correia
- 8 Há anos
- Visualizações:
Transcrição
1
2 O gabarito oficial provisório estará disponível no endereço eletrônico a partir das 20 horas do dia 6 de dezembro de 2010.
3 BIOLOGIA 1 Na tabela, a seguir, estão assinaladas a presença (+) ou a ausência (-) de alguns componentes encontrados em quatro diferentes tipos celulares (A, B, C e D). Componentes Tipos Celulares A B C D envoltório nuclear ribossomos mitocôndrias clorofila retículo endoplasmático Os tipos celulares: A, B, C e D pertencem, respectivamente, a organismos a) procarioto heterótrofo, eucarioto heterótrofo, procarioto autótrofo e eucarioto autótrofo. b) procarioto autótrofo, eucarioto autótrofo, eucarioto heterótrofo e procarioto heterótrofo. c) eucarioto heterótrofo, procarioto heterótrofo, procarioto autótrofo e eucarioto autótrofo. d) eucarioto autótrofo, procarioto autótrofo, eucarioto heterótrofo e procarioto heterótrofo. e) eucarioto heterótrofo, procarioto autótrofo, eucarioto autótrofo e procarioto heterótrofo. 2 O processo de mitose é essencial para o desenvolvimento e o crescimento de todos os organismos eucariotos. (KLUG, Willian et al. Conceitos de Genética. 9. ed. Porto Alegre: Artmed, p. 24.) Com base na figura e nos conhecimentos sobre o ciclo celular, é correto afirmar: a) O período durante o qual ocorre a síntese do DNA é maior que o período em que não ocorre síntese alguma de DNA. b) Ao final de um ciclo celular, a quantidade de material genético, nos núcleos de cada célula-filha, equivale ao dobro da célula parental. c) O tempo gasto para o pareamento cromossômico na placa equatorial equivale ao tempo gasto para síntese de DNA. d) Em mais da metade do tempo da mitose, as cromátides estão duplicadas, separadas longitudinalmente, exceto no centrômero. e) Durante a fase mais longa da mitose, as cromátides-irmãs se separam uma da outra e migram para as extremidades opostas da célula. 1 / 18
4 3 Em 1953, James Watson e Francis Crick elucidaram a estrutura tridimensional da dupla hélice de DNA e postularam que o pareamento específico de bases nitrogenadas sugere um possível mecanismo de cópia para o material genético. Baseado neste postulado, o processo de duplicação do DNA é considerado como sendo semiconservativo porque: 4 a) A dupla-hélice original permanece intacta e uma nova dupla-hélice é formada. b) Os dois filamentos da dupla-hélice original se separam e cada um serve como molde para uma nova fita. c) Ambos os filamentos da dupla-hélice original se fragmentam e servem como moldes para síntese de novos fragmentos. d) Um dos filamentos da dupla-hélice original serve de cópia para as duas fitas de DNA. e) Os filamentos da dupla-hélice original permutam as suas fitas para servirem de cópias de DNA. Em uma população, foi identificado um indivíduo que possui resistência genética a um vírus que provoca uma importante doença. Em um estudo comparativo, verificou-se que esse indivíduo produz uma proteína que confere tal resistência, com a seguinte sequência de aminoácidos: serina-tirosina-cisteína-valina-arginina. A partir da tabela de código genético, a seguir: AGU - serina UAC - tirosina UGC - cisteína GUA - valina AGG - arginina AGC - serina UAU - tirosina UGU - cisteína GUU - valina CGA - arginina 5 e considerando que o RNA mensageiro deste gene contém: 46,7% de uracila; 33,3% de guanina; 20% de adenina e 0% de citosina, assinale a alternativa que apresenta a sequência correta de bases da fita-molde deste gene. a) TCA - ATA - ACA - CAA - TCC b) TCA - ATA - ACG - CAT - TCC c) TCA - ATG - ACA - CAT - TGG d) AGU - UAU - UGU - GUU - AGG e) AGC - UAC - UGC -CAA- CGA Um menino tem o lobo da orelha preso e pertence a uma família na qual o pai, a mãe e a irmã possuem o lobo da orelha solto. Esta diferença não o incomodava até começar a estudar genética e aprender que o lobo da orelha solto é um caráter controlado por um gene com dominância completa. Aprendeu também que os grupos sanguíneos, do sistema ABO, são determinados pelos alelos I A, I B e i. Querendo saber se era ou não filho biológico deste casal, buscou informações acerca dos tipos sanguíneos de cada um da família. Ele verificou que a mãe e a irmã pertencem ao grupo sanguíneo O e o pai, ao grupo AB. Com base no enunciado é correto afirmar que a) a irmã é quem pode ser uma filha biológica, se o casal for heterozigoto para o caráter grupo sanguíneo. b) ambos os irmãos podem ser os filhos biológicos, se o casal for heterozigoto para os dois caracteres. c) o menino é quem pode ser um filho biológico, se o casal for heterozigoto para o caráter lobo da orelha solta. d) a mãe desta família pode ser a mãe biológica de ambos os filhos, se for homozigota para o caráter lobo da orelha solta. e) o pai desta família pode ser o pai biológico de ambos os filhos, se for homozigoto para o caráter grupo sanguíneo. 2 / 18
5 6 A figura a seguir é uma fotomicrografia ao microscópio óptico de estômato de Tradescantia, em vista frontal: Os estômatos são responsáveis pela regulação das trocas gasosas e pela transpiração nos vegetais. A concentração de CO 2 e a temperatura atmosférica são fatores ambientais que influenciam no controle do mecanismo de abertura e fechamento dos estômatos. 7 (Adaptado de: AMABIS, J. M.; MARTHO, G. R. Biologia dos Organismos. São Paulo: Moderna v. 2, p. 232.) Com base na figura, no texto e nos conhecimentos sobre o processo de abertura e fechamento de estômatos, assinale a alternativa que explica corretamente as razões fisiológicas pelas quais a luz influencia neste processo. a) Na ausência de luz, as células-guarda recebem íons Na +, perdem água para o ambiente por osmose, tornam-se murchas e, como consequência, o ostíolo se fecha. b) Na presença de luz, as células-guarda eliminam íons K +, perdem água para o ambiente por osmose, tornam-se flácidas e, como consequência, o ostíolo se fecha. c) Na ausência de luz, as células-guarda eliminam íons Na +, absorvem água por osmose, tornam-se túrgidas e, como consequência, o ostíolo se abre. d) Na presença de luz, as células-guarda recebem íons K +, absorvem água por osmose, tornam-se túrgidas e, como consequência, o ostíolo se abre. e) Na presença de luz, as células-guarda recebem íons Na +, perdem água para o ambiente por osmose, tornam-se flácidas e, como consequência, o ostíolo se abre. Pesquisas recentes consideram que as asas dos insetos evoluíram a partir de apêndices branquiais, estruturas utilizadas como remos por espécies ancestrais aquáticas. Com base no enunciado e de acordo com a perspectiva neodarwinista, considere as afirmativas a seguir. I. Os animais com apêndices branquiais mais desenvolvidos originaram uma descendência mais numerosa. II. As diferenças genéticas acumuladas conduziram ao isolamento reprodutivo da população com apêndices branquiais mais desenvolvidos. III. Em alguns indivíduos da população, ocorreram alterações nos genes responsáveis pelo desenvolvimento dos apêndices branquiais. IV. Ao longo das gerações, foi aumentando a frequência dos alelos responsáveis pelo maior desenvolvimento dos apêndices branquiais. V. A diversidade da população aumentou em relação ao desenvolvimento dos apêndices branquiais. Assinale a alternativa que contém a ordem correta da sequência cronológica dos acontecimentos que explicam a origem das asas dos insetos atuais. a) II, I, V, III e IV. b) III, IV, V, II e I. c) III, V, I, IV e II. d) V, III, IV, II e I. e) V, IV, II, I e III. 3 / 18
6 8 A fauna de vertebrados do fundo de cavernas é representada por peixes, salamandras e morcegos, são animais geralmente despigmentados e, no caso dos peixes, cegos. Sobre a condição de cegueira dos peixes da caverna, atribua verdadeiro (V) ou falso (F) para as afirmativas a seguir, que explicam a razão pela qual encontramos maior incidência de peixes cegos dentro das cavernas do que fora delas, quando comparada com a população de peixes não cegos. 9 ( ) Dentro das cavernas, os peixes não cegos são presas fáceis dos peixes cegos. ( ) Fora das cavernas, os peixes cegos são presas fáceis de predadores. ( ) Fora das cavernas, os peixes não cegos levam vantagem sobre os peixes cegos. ( ) Dentro das cavernas, os peixes cegos levam vantagem sobre os peixes não cegos. Assinale a alternativa que apresenta, de cima para baixo, a sequência correta. a) F, V, V e V. b) F, V, V e F. c) V, F, V e F. d) V, F, F e V. e) V, V, F e F. Considere o experimento sobre o efeito inibidor de hormônio vegetal no desenvolvimento das gemas laterais, apresentado na figura a seguir. Com base na figura e nos conhecimentos sobre fisiologia vegetal, considere as afirmativas a seguir. I. A ausência de hormônio produzido pelo meristema apical do caule exerce inibição sobre as gemas laterais, mantendo-as em estado de dormência. II. As gemas laterais da planta-controle estão inibidas devido ao efeito do hormônio produzido pela gema apical. III. O hormônio aplicado na planta decapitada inibe as gemas laterais e, consequentemente, a formação de ramos laterais. IV. A técnica de poda das gemas apicais tem como objetivo estimular a formação de novos ramos laterais. a) Somente as afirmativas I e II são corretas. b) Somente as afirmativas I e III são corretas. d) Somente as afirmativas I, II e IV são corretas. e) Somente as afirmativas II, III e IV são corretas. 4 / 18
7 10 Uma das medidas mais eficientes de combate à dengue é a eliminação de águas paradas, onde podem proliferar as larvas dos mosquitos Aedes aegypti. Com base no enunciado, pode-se concluir que o Aedes agypti é uma espécie de inseto que tem seu desenvolvimento biológico do tipo: a) holometábolo, com um estágio intermediário denominado de pupa. b) hemimetábolo, com um estágio intermediário denominado de ninfa. c) ametábolo, com um estágio intermediário denominado de lagarta. d) holometábolo, com um estágio intermediário assexuado que se desenvolve no organismo humano. e) hemimetábolo, com um estágio intermediário sexuado que se desenvolve no organismo humano. 11 É comum, quando pessoas entram em lagoas do Pantanal, anelídeos sanguessugas se fixarem na pele para se alimentarem. Para isso, utilizam uma ventosa oral que possui pequenos dentes afiados que raspam a pele, provocando hemorragia. Com relação às sanguessugas, considere as afirmativas a seguir. I. Contêm um par de nefrídio individualizado para cada segmento corporal. II. São celomados com inúmeros segmentos iguais separados internamente por septos transversais membranosos. III. Da mesma forma que as minhocas, as sanguessugas apresentam cerdas para a locomoção. IV. Assim como nas minhocas, os órgãos são irrigados por uma rede contínua de capilares que se estende sob a epiderme. a) Somente as afirmativas I e II são corretas. b) Somente as afirmativas I e III são corretas. d) Somente as afirmativas I, II e IV são corretas. e) Somente as afirmativas II, III e IV são corretas. 12 Com as alterações ambientais provocadas pela espécie humana, tem-se verificado uma redução nas populações de diversos anfíbios anuros no mundo todo. Esse fato, aliado ao pouco conhecimento que se tem da história natural de muitas espécies, torna o problema ainda mais grave. Levando em conta as características biológicas e ecológicas dos anuros, considere as afirmativas a seguir. I. Enquanto estão na forma larval, eles são afetados por águas poluídas porque respiram por meio de pulmões. II. O epitélio pouco queratinizado torna os adultos mais suscetíveis à desidratação quando a cobertura vegetal é reduzida. III. A poluição do ar prejudica os anuros porque eles possuem respiração cutânea mais desenvolvida que a pulmonar. IV. Por serem sensíveis à poluição, os anuros são considerados indicadores biológicos da qualidade ambiental. a) Somente as afirmativas I e II são corretas. b) Somente as afirmativas I e IV são corretas. d) Somente as afirmativas I, II e III são corretas. e) Somente as afirmativas II, III e IV são corretas. 5 / 18
8 13 O grupo dos platelmintos é caracterizado pelo aparecimento, pela primeira vez na escala zoológica, da simetria bilateral. Com base nesse fato, assinale a alternativa que apresenta as características que, durante a evolução destes animais, surgiram associadas ao aparecimento da simetria bilateral. a) Aparecimento do ânus e de células-flama. b) Aparecimento da boca e maior dimensão do corpo. c) Aparecimento da cefalização e movimentação direcional do corpo. d) Aparecimento da mesoderme e da cavidade gastrovascular. e) Aparecimento de digestão intracelular e melhor captura de presas. 14 As doenças parasitárias representam um grande problema de saúde pública. No quadro a seguir, estão relacionadas três doenças parasitárias e suas características. Doença parasitária Agente causador Transmissor A nematoide B doença de Chagas C percevejo D platelminto caramujo Considere as afirmativas a seguir. I. As letras A, B, C e D correspondem, respectivamente, a filariose, mosquito, protozoário, esquistossomose. II. Para prevenir a doença A, é necessário evitar o acúmulo de águas paradas e, para prevenir a doença D, devem-se evitar banhos em lagos e lagoas. III. As letras A, B, C e D correspondem, respectivamente, a amarelão, mosquito, verme, ancilostomíase. IV. Para prevenir a doença de Chagas e combater o transmissor B, são necessárias medidas de saneamento básico. a) Somente as afirmativas I e II são corretas. b) Somente as afirmativas II e IV são corretas. d) Somente as afirmativas I, II e III são corretas. e) Somente as afirmativas I, III e IV são corretas. 15 A figura ao lado representa a estrutura renal de um néfron de mamífero. Os números indicam os processos básicos que ocorrem para a formação da urina. Assinale a alternativa que contém a ordem sequencial dos números correspondentes aos processos indicados. a) 1 - reabsorção passiva de água; 2 - secreção ativa de íons H + e K + ; 3 - reabsorção ativa de sais e glicose; 4 - filtração. b) 1 - filtração; 2 - reabsorção ativa de sais e glicose; 3 - reabsorção passiva de água; 4 - secreção ativa de íons H + e K +. c) 1 - filtração; 2 - reabsorção passiva de água; 3 - secreção ativa de íons H + e K + ; 4 - reabsorção ativa de sais e glicose. d) 1 - reabsorção passiva de água; 2 - reabsorção ativa de sais e glicose; 3 - filtração; 4 - secreção ativa de íons H + e K +. e) 1 - reabsorção ativa de sais e glicose; 2 - filtração; 3 - reabsorção ativa de água; 4 - secreção ativa de íons H + e K +. (Adaptado de: SILVA JÚNIOR, C. da; SASSON, S. Biologia. São Paulo: Saraiva, 2007, p.350.) 6 / 18
9 16 Nos supermercados, encontramos diversos alimentos, enriquecidos com vitaminas e sais minerais. Esses alimentos têm como objetivo a suplementação de nutrientes necessários ao metabolismo e ao desenvolvimento do indivíduo. Com base nessas informações e nos conhecimentos sobre nutrição e saúde, considere as afirmativas a seguir. I. A vitamina A está envolvida na produção de hormônios e associada à exposição solar. II. A falta de vitamina C pode levar aos sintomas de fraqueza e sangramento das gengivas, avitaminose denominada escorbuto. III. O cálcio tem importância para a contração muscular e a coagulação do sangue. IV. O ferro faz parte da molécula de hemoglobina, prevenindo a ocorrência de anemia. a) Somente as afirmativas I e II são corretas. b) Somente as afirmativas I e IV são corretas. d) Somente as afirmativas I, II e III são corretas. e) Somente as afirmativas II, III e IV são corretas. 17 Uma infecção por HIV pode estar presente por vários anos antes da manifestação dos primeiros sintomas, sem que o portador suspeite disso. Esse longo período de latência frequentemente ocasiona a transmissão viral. Curso de uma infecção por HIV. (Adaptado: SADAVA, D. et al. Vida: A ciência da Biologia. 8 ed. Porto Alegre: Artmed, v. 1. p. 422.) Com base na figura e nos conhecimentos sobre AIDS (síndrome da imunodeficiência adquirida), considere as afirmativas a seguir. I. No primeiro ano da infecção por HIV, o sistema imune produz anticorpos contra diversos componentes celulares, incluindo DNA e proteínas nucleares. II. Após o segundo ano, a concentração de células T diminui gradativamente, a concentração de HIV aumenta e a pessoa infectada pode apresentar sintomas como inflamação dos linfonodos e febre. III. A partir do terceiro ano, as células T diminuem e a concentração de HIV aumenta, indicando que o indivíduo se torna mais suscetível a outras infecções que as células T normalmente eliminariam. IV. Após o nono ano, a concentração de HIV se estabiliza e um nível adequado de células T possibilita o desenvolvimento de respostas imunes. a) Somente as afirmativas I e III são corretas. b) Somente as afirmativas I e IV são corretas. c) Somente as afirmativas II e III são corretas. d) Somente as afirmativas I, II e IV são corretas. e) Somente as afirmativas II, III e IV são corretas. 7 / 18
10 18 Pesquisas recentes mostraram que células-tronco retiradas da medula óssea de indivíduos com problemas cardíacos foram capazes de reconstituir o músculo do coração, o que abre perspectivas de tratamento para pessoas com problemas cardíacos. Células-tronco também podem ser utilizadas no tratamento de doenças genéticas, como as doenças neuromusculares degenerativas. A expectativa em torno da utilização das células-tronco decorre do fato de que essas células a) incorporam o genoma do tecido lesionado, desligando os genes deletérios. b) eliminam os genes causadores da doença no tecido lesionado, reproduzindo-se com facilidade. c) alteram a constituição genética do tecido lesionado, pelo alto grau de especialização. d) sofrem diferenciação, tornando-se parte integrante e funcional do tecido lesionado. e) fundem-se com o tecido lesionado, eliminando as possibilidades de rejeição imunológica. 19 O vazamento de petróleo causado pela explosão da plataforma oceânica no Golfo do México, em abril de 2010, provocou um desastre ambiental de grandes proporções. Com relação às possíveis consequências das manchas de petróleo na superfície do oceano, considere as afirmativas a seguir. I. Interferem na passagem de luz, prejudicando a fotossíntese das algas. II. Provocam a proliferação de dinoflagelados, causando o fenômeno da maré vermelha. III. Modificam o ph da água do oceano, liberando gases que ocasionam o aumento do buraco na camada de ozônio. IV. Afetam a difusão do oxigênio da atmosfera para a água do oceano. a) Somente as afirmativas I e II são corretas. b) Somente as afirmativas I e IV são corretas. d) Somente as afirmativas I, II e III são corretas. e) Somente as afirmativas II, III e IV são corretas. 20 A Produtividade Primária Bruta (PPB) é o total de matéria orgânica produzida pelos organismos fotossintéticos de um ecossistema, como, por exemplo, um grande lago. Parte dessa matéria orgânica produzida é gasta na respiração celular (R), e apenas a quantidade de energia que sobra fica armazenada na biomassa, constituindo a Produtividade Primária Líquida (PPL). Assim, temos que: PPL = PPB - R. Inicialmente, mediu-se a quantidade de O 2 dissolvido existente em uma garrafa transparente e outra escura, ambas contendo água de um lago, fechadas e mantidas em ambiente iluminado. Após um período, mediu-se novamente o volume de O 2 dissolvido na água das duas garrafas. Considerando que a quantidade de biomassa (g/cm 3 ) de fitoplâncton é a mesma em ambas as amostras, assinale a alternativa que explica por que é necessário realizar este teste com os dois tipos de garrafas para calcular a PPB do lago. a) A diminuição da quantidade de O 2 dissolvido na garrafa escura indica quanto O 2 é consumido na respiração na garrafa clara, portanto a PPB é o valor de O 2 obtido na garrafa escura somado ao valor encontrado na garrafa clara. b) O aumento da quantidade de O 2 dissolvido na garrafa clara indica quanto O 2 é liberado da fotossíntese e é consumido na respiração na garrafa escura, portanto a PPB é o valor de O 2 obtido na garrafa clara subtraído do valor encontrado na garrafa escura. c) A diminuição da quantidade de O 2 dissolvido na garrafa escura indica quanto O 2 é liberado da fotossíntese na garrafa clara, portanto a PPB é o valor de O 2 obtido na garrafa escura subtraído do valor encontrado na garrafa clara. d) O aumento da quantidade de O 2 dissolvido na garrafa escura indica quanto O 2 é consumido na fotossíntese na garrafa clara, portanto a PPB é o valor do O 2 obtido na garrafa clara somado ao valor encontrado na garrafa escura. e) A diminuição da quantidade de O 2 dissolvido na garrafa clara indica quanto O 2 é consumido na respiração na garrafa escura, portanto a PPB é o valor de O 2 obtido na garrafa escura subtraído ao valor encontrado na garrafa clara. 8 / 18
11 QUÍMICA Leia o texto a seguir e responda às questões de 21 a 23. A chuva ácida é um fenômeno causado pela poluição da atmosfera. Ela pode acarretar problemas para o solo, água, construções e seres vivos. Um dos responsáveis por este fenômeno é o gás SO 3 que reage com a água da chuva originando ácido sulfúrico. O SO 3 não é um poluente produzido diretamente pelas fontes poluidoras, mas é formado quando o SO 2, liberado pela queima de combustíveis fósseis, reage com o oxigênio do ar. Esta reação é representada pela equação mostrada a seguir. 2SO 2 (g) + O 2 (g) 2SO 3 (g) 21 As reações de formação do SO 2 (g) e do SO 3 (g) são exotérmicas, e as variações de entalpias destas reações são 297kJ mol 1 e 396kJ mol 1, respectivamente. Assinale a alternativa que apresenta corretamente a quantidade de energia envolvida na reação entre 1, 0 mol de SO 2 gasoso e oxigênio gasoso, assim como o tipo de processo. a) 99,0 kj, endotérmico b) 99,0 kj, exotérmico c) 198 kj, endotérmico d) 198 kj, exotérmico e) 693 kj, endotérmico 22 Com relação às moléculas citadas no texto, é correto afirmar: a) As soluções formadas pela dissolução das moléculas de SO 2, SO 3 e H 2 SO 4 em água conduzem a corrente elétrica. b) A molécula de SO 2 é apolar, a molécula de SO 3 é polar e a molécula de O 2 é polar. c) A molécula de SO 2 é linear, a molécula de SO 3 é angular e a molécula de H 2 SO 4 é piramidal. d) As moléculas de SO 2, SO 3 e H 2 SO 4 apresentam 30, 38 e 48 elétrons, respectivamente. e) As ligações entre o átomo de enxofre e os átomos de oxigênio nas moléculas de SO 2, SO 3 e H 2 SO 4 são covalentes apolares. 23 Um pesquisador, ao estudar a qualidade do ar de uma região industrial, verificou que, para titular 50mL de uma amostra de água de chuva, necessitou de 20mL de solução de NaOH de concentração 5, mol L 1. Considerando a presença somente do ácido sulfúrico na amostra de água da chuva, a concentração, em mol L 1, deste ácido é: a) 0, b) 0, c) 1, d) 1, e) 1, R A S C U N H O 9 / 18
12 24 Considere as amostras a seguir. Amostra A - 5, 6L de gás flúor nas condições normais de temperatura e pressão. Amostra B - 20g de cobalto. Amostra C - 5, 6L de gás hélio nas condições normais de temperatura e pressão. Assinale a alternativa cujo gráfico representa comparativamente as quantidades de átomos nas amostras A, B e C. a) d) b) e) c) R A S C U N H O 10 / 18
13 Leia o texto a seguir e responda às questões 25 e 26. A produção mundial de amônia é feita praticamente por meio da reação entre os gases N 2 e H 2, pelo processo denominado Haber-Bosch, conforme a reação: 3H 2 (g) + N 2 (g) 2NH 3 (g). Para a produção de NH 3 (g), foram misturados 5,00L de nitrogênio líquido e 5,00L de hidrogênio líquido em um reator catalítico de volume igual a 70,0L, o qual foi aquecido à temperatura de 477 ºC. 25 Supondo que não ocorra reação durante a vaporização, a pressão no interior do reator, quando todo o nitrogênio líquido e todo o hidrogênio líquido foram vaporizados, é igual a: Dados: Densidade: nitrogênio líquido = 0,80g ml 1 e hidrogênio líquido = 0,07g ml 1 Constante dos gases: R = 0,082 atm L mol 1 K 1 a) 186 atm b) 278 atm c) 320 atm d) 450 atm e) 630 atm 26 As concentrações de N 2 (g), H 2 (g) e NH 3 (g) no equilíbrio são 1, 72 mol L 1, 1, 51 mol L 1 e 0, 67 mol L 1, respectivamente. Com base nos conhecimentos sobre equilíbrio químico, considere as afirmativas a seguir. Dado: A constante de equilíbrio (Kc) da reação à temperatura de 25 ºC e pressão de 1,0 atm é igual a 5, I. A constante de equilíbrio da reação, nas condições dadas pelo enunciado, é 0,08. II. Um aumento na pressão do sistema faz com que as moléculas dos gases se aproximem. III. A elevação da pressão aumenta a quantidade relativa de amônia no equilíbrio. IV. À temperatura de 25 ºC e pressão de 1,0 atm, a posição de equilíbrio favorece a decomposição da amônia. a) Somente as afirmativas I e IV são corretas. b) Somente as afirmativas II e III são corretas. d) Somente as afirmativas I, II e III são corretas. e) Somente as afirmativas I, II e IV são corretas. 27 A conversão de energia química em energia elétrica é um fenômeno que ocorre em uma célula galvânica, por exemplo, uma pilha. Quanto ao funcionamento de uma célula galvânica, é correto afirmar: a) A eletricidade é produzida a partir de uma reação química não espontânea. b) Os elétrons fluem de um eletrodo ao outro pela ponte salina. c) Na solução de uma célula galvânica, os ânions movem-se na direção do ânodo e os cátions, na direção do cátodo. d) A reação de oxidação ocorre no cátodo e a reação de redução ocorre no ânodo. e) A força eletromotriz é determinada pela diferença algébrica entre o potencial padrão de oxidação do cátodo e o potencial padrão de oxidação do ânodo. 11 / 18
14 28 No laboratório de uma escola de ensino médio, o professor realizou quatro experimentos, para os quais foi usado o equipamento mostrado na figura a seguir. Dado: Nos quatro experimentos, o tubo B continha uma certa quantidade de água, uma tira de papel tornassol azul e uma tira de papel tornassol vermelho. Experimento 1. No tubo de ensaio A, colocou-se uma certa quantidade de soluções aquosas de cloreto de amônio e de hidróxido de sódio, e este foi tampado. Mergulhou-se a outra extremidade do tubo de vidro no tubo de ensaio B. Experimento 2. No tubo de ensaio A, colocou-se uma certa quantidade de carbonato de cálcio sólido, e este foi tampado. Mergulhou-se a outra extremidade do tubo de vidro no tubo de ensaio B. Em seguida, com o auxílio da chama de um bico de Bunsen, o tubo de ensaio A foi aquecido. Experimento 3. No tubo de ensaio A, colocou-se um pedaço de cobre metálico e uma certa quantidade de ácido nítrico concentrado, e este foi tampado. Mergulhou-se a outra extremidade do tubo de vidro no tubo de ensaio B. Experimento 4. No tubo de ensaio A, colocou-se um pedaço de fio de magnésio, uma certa quantidade de solução diluída de ácido clorídrico, e este foi tampado. Mergulhou-se a outra extremidade do tubo de vidro no tubo de ensaio B. Considerando os produtos das reações dos experimentos 1, 2, 3 e 4, considere as afirmativas a seguir. I. No experimento 1, o papel tornassol vermelho tornou-se azul e o papel tornassol azul não alterou a sua cor. II. No experimento 2, o papel tornassol azul tornou-se vermelho e o papel tornassol vermelho não alterou sua cor. III. No experimento 3, o papel tornassol vermelho tornou-se azul e o papel tornassol azul não alterou sua cor. IV. No experimento 4, os papéis tornassol azul e vermelho mantiveram suas cores. a) Somente as afirmativas I e IV são corretas. b) Somente as afirmativas II e III são corretas. d) Somente as afirmativas I, II e III são corretas. e) Somente as afirmativas I, II e IV são corretas. R A S C U N H O 12 / 18
15 29 Nos lagos tropicais, devido à alta temperatura da água, o metabolismo dos organismos aumenta, fazendo com que o fósforo inorgânico dissolvido seja rapidamente assimilado e incorporado na sua biomassa. Esse é um dos principais motivos pelos quais, nestes lagos, a concentração de fósforo inorgânico é muito baixa. O fósforo inorgânico pode estar presente em diferentes formas iônicas em função do ph do lago. O diagrama a seguir mostra as formas iônicas do fósforo em função do ph. A concentração de íons H 2 PO 4 em uma amostra de água de ph igual a 6,5 é 1, mol L 1. Neste ph, as concentrações em g L 1 de H 3 PO 4, HPO 2 4 e PO 3 4 são, respectivamente: a) zero, 2,5 10 5, zero b) zero, 2,4 10 3, zero c) 2,4 10 3, 2,4 10 3, 2, d) zero, 2,5 10 5, 2, e) zero, 2,4 10 5, zero 30 A primeira aplicação de dióxido de cloro como desinfetante ocorreu em 1944 nos Estados Unidos. O uso deste óxido para o tratamento de água de abastecimento foi possível devido à disponibilidade comercial do clorito de sódio. Em estações de tratamento de água, o dióxido de cloro é produzido a partir de soluções de clorito de sódio, segundo as reações representadas pelas equações químicas a seguir, não totalmente balanceadas. (I) 2NaClO 2 (aq) + Cl 2 (g) ClO 2 (aq) + NaCl(aq) (II) 2NaClO 2 (aq) + HOCl(aq) ClO 2 (aq) + NaCl(aq) + NaOH(aq) (III) 5NaClO 2 (aq) + 4HCl(aq) ClO 2 (aq) + NaCl(aq) + H 2 O(l) Os números de oxidação do cloro no Cl 2, HClO e HCl e os coeficientes estequiométricos do ClO 2 nas equações I, II e III são: a a a aa) a b) b c) c d) d e) e Número de oxidação (Cl) Coeficiente estequiométrico (ClO 2 ) 0 Equações químicas Cl 2 HOCl HCl (I) (II) (III) / 18
16 31 As soluções-tampão desempenham um papel importante em muitos processos químicos e biológicos. Por exemplo, o plasma sanguíneo é uma solução-tampão eficiente em um meio no qual uma variação maior que 0,2 unidade de ph pode ocasionar a morte. Considere as afirmativas a seguir. I. A dissolução do ácido em água para a preparação de uma solução-tampão apresenta constante de ionização igual a 1. II. Um exemplo de solução-tampão é aquela que contém uma base fraca e um sal derivado desta base fraca. III. Adicionando-se quantidades molares semelhantes de ácido acético e de acetato de sódio à água, obtém-se uma solução-tampão. IV. A solução-tampão resiste a variações de ph, quando se adicionam pequenas quantidades de um ácido ou de uma base. a) Somente as afirmativas I e II são corretas. b) Somente as afirmativas I e IV são corretas. d) Somente as afirmativas I, II e III são corretas. e) Somente as afirmativas II, III e IV são corretas. 32 Em 1960, a hipótese de que Napoleão teria morrido envenenado ganhou força devido a uma análise que determinou uma quantidade anormal de arsênio em um fio de cabelo. O arsênio não é tóxico na sua forma elementar, entretanto o óxido de arsênio, As 2 O 3, sim. Nos anos 90, surgiu outra teoria, a de que o envenenamento por arsênio teria ocorrido devido ao papel de parede de cor verde, o qual continha como pigmento o composto hidrogênio arsenito de cobre (II), CuHAsO 3. O clima úmido teria propiciado a formação de mofo no papel de parede e os micro-organismos converteram a substância em trimetil arsênio (CH 3 ) 3 As, altamente volátil. 33 Considerando as substâncias citadas no texto, assinale a alternativa correta. a) O ânion hidrogênio arsenito no hidrogênio arsenito de cobre (II) é trivalente. b) O trimetil arsênio é uma substância orgânica binária. c) A alta volatilidade do trimetil arsênio deve-se às suas fracas interações intermoleculares. d) O óxido arsênico citado no texto reage com a água, formando um composto básico. e) O elemento arsênio apresenta camada de valência 3s 2 3p 3. Um dos problemas que mais afetam a sociedade atual é o consumo de drogas ilícitas. A cocaína é um alcaloide natural extraído das folhas do arbusto Erythroxylon coca. A molécula de cocaína, formada de átomos de carbono, hidrogênio, oxigênio e nitrogênio, é mostrada na figura ao lado. a) Na estrutura da cocaína, estão presentes as funções cetona, aldeído e amida. b) O anel benzênico da cocaína contém seis carbonos secundários. c) A molécula da cocaína apresenta três radicais metilas. d) Os átomos de carbono ligados ao átomo de nitrogênio apresentam hibridação sp 3. e) Os átomos de carbono do anel benzênico apresentam geometria angular. 14 / 18
17 34 A esquizofrenia é uma patologia psiquiátrica caracterizada por perturbações do pensamento, da percepção e do convívio social. A doença de Parkinson é um transtorno neurodegenerativo causado pela perda seletiva de neurônios dopaminérgicos. A dopamina é uma substância que está relacionada com as duas doenças citadas. A fórmula da dopamina é mostrada ao lado. A composição centesimal dos átomos de C, H, O e N na molécula da dopamina são, respectivamente: a) 62,7; 7,3; 20,9 e 9,1 b) 60,5; 9,1; 19,0 e 11,4 c) 43,8; 16,2; 8,0 e 32,0 d) 20,7; 63,0; 8,3 e 8,0 e) 18,5; 60,0; 10,4 e 11,1 35 Resolva as etapas a seguir. Etapa 1- Substituir os hidrogênios dos carbonos insaturados do but-2-eno por radicais isopropila e etila. Etapa 2- Submeter a substância resultante da etapa 1 a uma reação de hidrogenação catalítica. Etapa 3- Submeter a substância resultante da etapa 2 a uma reação de monocloração. Considere as afirmativas a seguir. I. A substância resultante da etapa 1 é o 2,3,4 trimetil hex-3-eno. II. A substância obtida na etapa 2 é um hidrocarboneto de cadeia saturada. III. As substâncias resultantes das etapas 1 e 2 são isômeros de função. IV. Na etapa 3, átomo de cloro substituirá preferencialmente o hidrogênio de carbonos primários. a) Somente as afirmativas I e II são corretas. b) Somente as afirmativas I e IV são corretas. d) Somente as afirmativas I, II e III são corretas. e) Somente as afirmativas II, III e IV são corretas. 36 Os íons sódio e potássio são essenciais à vida. Por exemplo, nós precisamos de pelo menos 1,0 g de íons sódio por dia em nossa dieta. Entretanto, por causa da adição de sal nos alimentos, a ingestão dele, para muitas pessoas, é maior que cinco vezes este valor. Por outro lado, a ingestão excessiva de íons potássio é raramente um problema. De fato, a deficiência de potássio é muito mais comum; assim, é importante incluirmos em nossa dieta alimentos ricos em potássio, tais como banana e café. a) Tanto o sódio quanto o potássio, quando reagem com a água, formam um composto ácido. b) Os íons potássio e sódio têm raios maiores que os átomos de potássio e de sódio, respectivamente. c) O elemento sódio, quando reage com o gás flúor, forma o composto covalente NaF 2. d) O elemento potássio perde seu elétron de valência mais facilmente que o elemento sódio. e) Os metais sódio e potássio são bastante reativos porque apresentam alta eletronegatividade. R A S C U N H O 15 / 18
18 37 O monóxido de carbono é um gás incolor, sem cheiro e muito reativo. Ele reage, por exemplo, com o gás oxigênio formando o dióxido de carbono, de acordo com a equação química a seguir. 2CO (g) + O 2 (g) 2CO 2(g) Experimentalmente observam-se as informações que estão no quadro a seguir. [CO] (mol L 1 ) [O 2 ] (mol L 1 ) Velocidade inicial (mol L 1 min 1 ) 0,04 0,04 7,36 x ,08 0,04 2,94 x ,04 0,08 1,47 x 10 4 Considerando a equação química e os dados do quadro, assinale a alternativa correta. a) Para a lei de velocidade, a expressão para esta reação é v = k[co 2 ] 2. b) Conforme aumenta a concentração do produto, aumenta a velocidade da reação. c) Esta é uma reação de ordem zero com relação ao CO 2 e de segunda ordem quanto à reação global. d) A velocidade de formação do CO 2 nesta reação é independente da concentração de O 2. e) O valor da constante de velocidade para esta reação é 1,15 L 2 mol 2 min Sabe-se que, na fabricação de muitos sorvetes, são utilizados essências artificiais, as quais apresentam o cheiro agradável das frutas. Estes odores devem-se, principalmente, à presença de ésteres. A seguir, estão os nomes de alguns ésteres e a indicação de suas respectivas frutas. Abacaxi butanoato de etila. Framboesa metanoato de isobutila. Pêssego metanoato de etila. Maçã verde etanoato de butila. Damasco butanoato de butila. O sorvete cuja essência foi obtida a partir da reação do ácido metanoico com o 2-metil propanol-1 terá aroma de a) abacaxi. b) damasco. c) framboesa. d) maçã verde. e) pêssego. 39 O eugenol, um composto de fórmula molecular C 10 H 12 O 2, é um ingrediente ativo do cravo-da-índia. O benzeno, um líquido inflamável e incolor, é um composto tóxico. O eugenol tem um ponto de ebulição de 256 ºC e o benzeno, de 80,10 ºC. Sabendo que uma quantidade de eugenol foi dissolvida em 10,0 g de benzeno e que a constante ebuliométrica K e do benzeno é +2,53 (ºC molal 1 ), considere as afirmativas a seguir. I. O ponto de ebulição do benzeno continuará sendo 80,10 ºC, mesmo com a adição de eugenol. II. A quantidade de eugenol necessária para elevar a temperatura em 1,0 ºC é de 0,648 g. III. Se fossem dissolvidas 1,298 g de eugenol em 10,0 g de benzeno, a fração molar de benzeno nesta mistura seria de 0,942. IV. A dissolução do eugenol no benzeno diminuirá a pressão de vapor do benzeno. a) Somente as afirmativas I e II são corretas. b) Somente as afirmativas I e IV são corretas. d) Somente as afirmativas I, II e III são corretas. e) Somente as afirmativas II, III e IV são corretas. 16 / 18
19 40 Analise os pares de fórmulas a seguir. I. H 3 C CH 2 COOH e H 3 C COO CH 3 II. H 3 C CO CH 2 CH 2 CH 3 e H 3 C CO CHCH 3 CH 3 III. H 3 C NH CH 2 CH 2 CH 3 e H 3 C CH 2 NH CH 2 CH 3 IV. H 3 C CHO e H 2 C = CHOH V. e Associe cada par ao seu tipo de isomeria. ( ) A - Isomeria de cadeia ( ) B - Isomeria de função ( ) C - Isomeria de compensação ( ) D - Isomeria geométrica ( ) E - Tautomeria Assinale a alternativa que apresenta a correspondência correta. a) I-A, II-E, III-D, IV-B e V-C b) I-B, II-A, III-C, IV-E e V-D c) I-C, II-B, III-E, IV-D e V-A d) I-D, II-C, III-B, IV-A e V-E e) I-E, II-D, III-A, IV-C e V-B 17 / 18
20 06. BIOLOGIA E QUÍMICA G A B A R I T O Questão Alternativa correta Assinalada 1 E 2 D 3 B 4 A 5 C 6 D 7 C 8 B 9 E 10 A 11 D 12 E 13 C 14 A 15 B 16 E 17 C 18 D 19 B 20 A 21 B 22 A 23 D 24 C 25 B 26 D 27 C 28 E 29 B 30 A 31 E 32 C 33 D 34 A 35 A 36 D 37 E 38 C 39 E 40 B 18 / 18
QUÍMICA QUESTÃO 41 QUESTÃO 42
 Processo Seletivo/UNIFAL- janeiro 2008-1ª Prova Comum TIPO 1 QUÍMICA QUESTÃO 41 Diferentes modelos foram propostos ao longo da história para explicar o mundo invisível da matéria. A respeito desses modelos
Processo Seletivo/UNIFAL- janeiro 2008-1ª Prova Comum TIPO 1 QUÍMICA QUESTÃO 41 Diferentes modelos foram propostos ao longo da história para explicar o mundo invisível da matéria. A respeito desses modelos
B) (até três pontos) Para os pares de espécies apresentados em i, ii e iii, tem-se, respectivamente, Al +, F - e Li.
 Química 1. O raio atômico (ou iônico) é uma propriedade periódica que exerce grande influência na reatividade dos átomos (ou dos íons). A) Explique, em termos de carga nuclear efetiva, a variação apresentada
Química 1. O raio atômico (ou iônico) é uma propriedade periódica que exerce grande influência na reatividade dos átomos (ou dos íons). A) Explique, em termos de carga nuclear efetiva, a variação apresentada
R A S C U N H O. 2SO 2 (g) + O 2 (g) 2SO 3 (g) QUÍMICA
 9 / 19 QUÍMICA Leia o texto a seguir e responda às questões de 21 a 23. A chuva ácida é um fenômeno causado pela poluição da atmosfera. Ela pode acarretar problemas para o solo, água, construções e seres
9 / 19 QUÍMICA Leia o texto a seguir e responda às questões de 21 a 23. A chuva ácida é um fenômeno causado pela poluição da atmosfera. Ela pode acarretar problemas para o solo, água, construções e seres
A) Escreva a equação que representa a semi-reação de redução e seu respectivo potencial padrão.
 QUÍMICA QUESTÃ 01 Aparelhos eletrônicos sem fio, tais como máquinas fotográficas digitais e telefones celulares, utilizam, como fonte de energia, baterias recarregáveis. Um tipo comum de bateria recarregável
QUÍMICA QUESTÃ 01 Aparelhos eletrônicos sem fio, tais como máquinas fotográficas digitais e telefones celulares, utilizam, como fonte de energia, baterias recarregáveis. Um tipo comum de bateria recarregável
Resolução Comentada - Química
 Resolução Comentada - Química UFTM 2013 1 Fase Vestibular UFTM 2013 1 Resolução Prova de Química Tipo 1 Questão 76 A soja é considerada um dos alimentos mais completos em termos de propriedades nutricionais,
Resolução Comentada - Química UFTM 2013 1 Fase Vestibular UFTM 2013 1 Resolução Prova de Química Tipo 1 Questão 76 A soja é considerada um dos alimentos mais completos em termos de propriedades nutricionais,
PROVA DE QUÍMICA - 1998 Segunda Etapa
 PROVA DE QUÍMICA - 1998 Segunda Etapa QUESTÃO 01 Num laboratório químico, havia três frascos que continham, respectivamente, um alcano, um álcool e um alqueno. Foram realizados experimentos que envolviam
PROVA DE QUÍMICA - 1998 Segunda Etapa QUESTÃO 01 Num laboratório químico, havia três frascos que continham, respectivamente, um alcano, um álcool e um alqueno. Foram realizados experimentos que envolviam
Introdução. Muitas reações ocorrem completamente e de forma irreversível como por exemplo a reação da queima de um papel ou palito de fósforo.
 Introdução Muitas reações ocorrem completamente e de forma irreversível como por exemplo a reação da queima de um papel ou palito de fósforo. Existem também sistemas, em que as reações direta e inversa
Introdução Muitas reações ocorrem completamente e de forma irreversível como por exemplo a reação da queima de um papel ou palito de fósforo. Existem também sistemas, em que as reações direta e inversa
UFJF CONCURSO VESTIBULAR 2011-2 GABARITO DA PROVA DISCURSIVA DE QUÍMICA
 UFJF CNCURS VESTIBULAR 2011-2 GABARIT DA PRVA DISCURSIVA DE QUÍMICA Questão 1 Sabe-se que compostos constituídos por elementos do mesmo grupo na tabela periódica possuem algumas propriedades químicas semelhantes.
UFJF CNCURS VESTIBULAR 2011-2 GABARIT DA PRVA DISCURSIVA DE QUÍMICA Questão 1 Sabe-se que compostos constituídos por elementos do mesmo grupo na tabela periódica possuem algumas propriedades químicas semelhantes.
Peso: P = mg. Empuxo: E = ρv g. Lei dos gases: pv = nrt. Frequência: f = 1 T. Lei Coulomb: F = 1 q 1 q 2. Força elétrica: F = qe
 FORMULÁRIO DE FÍSICA Movimento linear: s = s 0 + v 0 t + 1 2 at2 ; v = v 0 + at; v 2 = v 2 0 + 2a s Velocidade média: v = x t Movimento angular: ω m = θ t ; α m = ω ; v = ωr; a = αr t Trajetória descrita
FORMULÁRIO DE FÍSICA Movimento linear: s = s 0 + v 0 t + 1 2 at2 ; v = v 0 + at; v 2 = v 2 0 + 2a s Velocidade média: v = x t Movimento angular: ω m = θ t ; α m = ω ; v = ωr; a = αr t Trajetória descrita
CICLOS BIOGEOQUÍMICOS
 CICLOS BIOGEOQUÍMICOS O fluxo de energia em um ecossistema é unidirecional e necessita de uma constante renovação de energia, que é garantida pelo Sol. Com a matéria inorgânica que participa dos ecossistemas
CICLOS BIOGEOQUÍMICOS O fluxo de energia em um ecossistema é unidirecional e necessita de uma constante renovação de energia, que é garantida pelo Sol. Com a matéria inorgânica que participa dos ecossistemas
Sobre as substâncias representadas pelas estruturas I e II, é INCORRETO afirmar:
 8 GABARITO 1 1 O DIA 2 o PROCESSO SELETIVO/2005 QUÍMICA QUESTÕES DE 16 A 30 16. Devido à sua importância como catalisadores, haletos de boro (especialmente B 3 ) são produzidos na escala de toneladas por
8 GABARITO 1 1 O DIA 2 o PROCESSO SELETIVO/2005 QUÍMICA QUESTÕES DE 16 A 30 16. Devido à sua importância como catalisadores, haletos de boro (especialmente B 3 ) são produzidos na escala de toneladas por
Maxillaria silvana Campacci
 Ecologia Aula 1 Habitat É o lugar que reúne as melhores condições de vida para uma espécie. Temperatura, quantidade de água, intensidade da luz solar e tipo de solo determinam se o habitat é adequado ao
Ecologia Aula 1 Habitat É o lugar que reúne as melhores condições de vida para uma espécie. Temperatura, quantidade de água, intensidade da luz solar e tipo de solo determinam se o habitat é adequado ao
IESA-ESTUDO DIRIGIDO 1º SEMESTRE 8º ANO - MANHÃ E TARDE- DISCIPLINA: CIÊNCIAS PROFESSORAS: CELIDE E IGNÊS. Aluno(a): Turma:
 IESA-ESTUDO DIRIGIDO 1º SEMESTRE 8º ANO - MANHÃ E TARDE- DISCIPLINA: CIÊNCIAS PROFESSORAS: CELIDE E IGNÊS Aluno(a): Turma: Querido (a) aluno (a), Este estudo dirigido foi realizado para que você revise
IESA-ESTUDO DIRIGIDO 1º SEMESTRE 8º ANO - MANHÃ E TARDE- DISCIPLINA: CIÊNCIAS PROFESSORAS: CELIDE E IGNÊS Aluno(a): Turma: Querido (a) aluno (a), Este estudo dirigido foi realizado para que você revise
Peso: P = mg. Empuxo: E = ρv g. Lei dos gases: pv = nrt. Frequência: f = 1 T. Lei Coulomb: F = 1 q 1 q 2. Força elétrica: F = qe
 FORMULÁRIO DE FÍSICA Movimento linear: s = s 0 + v 0 t + 1 2 at2 ; v = v 0 + at; v 2 = v 2 0 + 2a s Velocidade média: v = x t Movimento angular: ω m = θ t ; α m = ω ; v = ωr; a = αr t Trajetória descrita
FORMULÁRIO DE FÍSICA Movimento linear: s = s 0 + v 0 t + 1 2 at2 ; v = v 0 + at; v 2 = v 2 0 + 2a s Velocidade média: v = x t Movimento angular: ω m = θ t ; α m = ω ; v = ωr; a = αr t Trajetória descrita
Peso: P = mg. Empuxo: E = ρv g. Lei dos gases: pv = nrt. Frequência: f = 1 T. Lei Coulomb: F = 1 q 1 q 2. Força elétrica: F = qe
 FORMULÁRIO DE FÍSICA Movimento linear: s = s 0 + v 0 t + 1 2 at2 ; v = v 0 + at; v 2 = v 2 0 + 2a s Velocidade média: v = x t Movimento angular: ω m = θ t ; α m = ω ; v = ωr; a = αr t Trajetória descrita
FORMULÁRIO DE FÍSICA Movimento linear: s = s 0 + v 0 t + 1 2 at2 ; v = v 0 + at; v 2 = v 2 0 + 2a s Velocidade média: v = x t Movimento angular: ω m = θ t ; α m = ω ; v = ωr; a = αr t Trajetória descrita
A A A A A A A A A A A A A A A BIOLOGIA
 BIOLOGI 1 Nos últimos 10.000 anos, o nível de evaporação da água do Mar Morto tem sido maior que o de reposição. Dessa forma, a concentração de sais tem aumentado, já que o sal não evapora. principal fonte
BIOLOGI 1 Nos últimos 10.000 anos, o nível de evaporação da água do Mar Morto tem sido maior que o de reposição. Dessa forma, a concentração de sais tem aumentado, já que o sal não evapora. principal fonte
O gabarito oficial provisório estará disponível no endereço eletrônico a partir das 20 horas do dia 6 de dezembro de 2010.
 O gabarito oficial provisório estará disponível no endereço eletrônico www.cops.uel.br a partir das 20 horas do dia 6 de dezembro de 2010. BIOLOGIA 1 Na tabela, a seguir, estão assinaladas a presença (+)
O gabarito oficial provisório estará disponível no endereço eletrônico www.cops.uel.br a partir das 20 horas do dia 6 de dezembro de 2010. BIOLOGIA 1 Na tabela, a seguir, estão assinaladas a presença (+)
QUÍMICA CELULAR NUTRIÇÃO TIPOS DE NUTRIENTES NUTRIENTES ENERGÉTICOS 4/3/2011 FUNDAMENTOS QUÍMICOS DA VIDA
 NUTRIÇÃO QUÍMICA CELULAR PROFESSOR CLERSON CLERSONC@HOTMAIL.COM CIESC MADRE CLÉLIA CONCEITO CONJUNTO DE PROCESSOS INGESTÃO, DIGESTÃO E ABSORÇÃO SUBSTÂNCIAS ÚTEIS AO ORGANISMO ESPÉCIE HUMANA: DIGESTÃO ONÍVORA
NUTRIÇÃO QUÍMICA CELULAR PROFESSOR CLERSON CLERSONC@HOTMAIL.COM CIESC MADRE CLÉLIA CONCEITO CONJUNTO DE PROCESSOS INGESTÃO, DIGESTÃO E ABSORÇÃO SUBSTÂNCIAS ÚTEIS AO ORGANISMO ESPÉCIE HUMANA: DIGESTÃO ONÍVORA
Lista de Exercícios 4 Indústrias Químicas Resolução pelo Monitor: Rodrigo Papai de Souza
 Lista de Exercícios 4 Indústrias Químicas Resolução pelo Monitor: Rodrigo Papai de Souza 1) a-) Calcular a solubilidade do BaSO 4 em uma solução 0,01 M de Na 2 SO 4 Dissolução do Na 2 SO 4 : Dado: BaSO
Lista de Exercícios 4 Indústrias Químicas Resolução pelo Monitor: Rodrigo Papai de Souza 1) a-) Calcular a solubilidade do BaSO 4 em uma solução 0,01 M de Na 2 SO 4 Dissolução do Na 2 SO 4 : Dado: BaSO
PROCESSO SELETIVO 2006 QUESTÕES OBJETIVAS
 3 PROCESSO SELETIVO 2006 QUESTÕES OBJETIVAS QUÍMICA 01 - O dispositivo de segurança que conhecemos como air-bag utiliza como principal reagente para fornecer o gás N 2 (massa molar igual a 28 g mol -1
3 PROCESSO SELETIVO 2006 QUESTÕES OBJETIVAS QUÍMICA 01 - O dispositivo de segurança que conhecemos como air-bag utiliza como principal reagente para fornecer o gás N 2 (massa molar igual a 28 g mol -1
Água e Solução Tampão
 União de Ensino Superior de Campina Grande Faculdade de Campina Grande FAC-CG Curso de Fisioterapia Água e Solução Tampão Prof. Dra. Narlize Silva Lira Cavalcante Fevereiro /2015 Água A água é a substância
União de Ensino Superior de Campina Grande Faculdade de Campina Grande FAC-CG Curso de Fisioterapia Água e Solução Tampão Prof. Dra. Narlize Silva Lira Cavalcante Fevereiro /2015 Água A água é a substância
EXERCÍCIOS ON LINE DE CIÊNCIAS 8 AN0
 EXERCÍCIOS ON LINE DE CIÊNCIAS 8 AN0 1- Que órgão do sistema nervoso central controla nosso ritmo respiratório? Bulbo 2- Os alvéolos são formados por uma única camada de células muito finas. Explique como
EXERCÍCIOS ON LINE DE CIÊNCIAS 8 AN0 1- Que órgão do sistema nervoso central controla nosso ritmo respiratório? Bulbo 2- Os alvéolos são formados por uma única camada de células muito finas. Explique como
RESOLUÇÃO DA PROVA DE QUÍMICA DA UFRGS 2011
 RESOLUÇÃO DA PROVA DE QUÍMICA DA UFRGS 2011 Questão 26 Como a questão pede a separação do sólido solúvel do líquido, o único processo recomendado é a destilação simples. Lembrando que filtração e decantação
RESOLUÇÃO DA PROVA DE QUÍMICA DA UFRGS 2011 Questão 26 Como a questão pede a separação do sólido solúvel do líquido, o único processo recomendado é a destilação simples. Lembrando que filtração e decantação
Segundo a Portaria do Ministério da Saúde MS n.o 1.469, de 29 de dezembro de 2000, o valor máximo permitido (VMP) da concentração do íon sulfato (SO 2
 11 Segundo a Portaria do Ministério da Saúde MS n.o 1.469, de 29 de dezembro de 2000, o valor máximo permitido (VMP) da concentração do íon sulfato (SO 2 4 ), para que a água esteja em conformidade com
11 Segundo a Portaria do Ministério da Saúde MS n.o 1.469, de 29 de dezembro de 2000, o valor máximo permitido (VMP) da concentração do íon sulfato (SO 2 4 ), para que a água esteja em conformidade com
Projeto Embuá Unidade de Aprendizagem: ENERGIA
 Projeto Embuá Unidade de Aprendizagem: ENERGIA Energia para realizar reações químicas: eletrólise do iodeto de potássio aquoso Existem reações químicas não espontâneas, mas que são realizadas com rapidez
Projeto Embuá Unidade de Aprendizagem: ENERGIA Energia para realizar reações químicas: eletrólise do iodeto de potássio aquoso Existem reações químicas não espontâneas, mas que são realizadas com rapidez
QUESTÃO 01 Analise este gráfico, em que se mostra o resultado de um experimento de decomposição térmica de uma substância orgânica:
 QUESTÃO 01 Analise este gráfico, em que se mostra o resultado de um experimento de decomposição térmica de uma substância orgânica: 1. Considere que, durante esse experimento, a diminuição de massa se
QUESTÃO 01 Analise este gráfico, em que se mostra o resultado de um experimento de decomposição térmica de uma substância orgânica: 1. Considere que, durante esse experimento, a diminuição de massa se
Química - Grupo J - Gabarito
 - Gabarito 1 a QUESTÃO: (2,0 pontos) Avaliador Revisor Informe a que volume deve ser diluído com água um litro de solução de um ácido fraco HA 0.10 M, de constante de ionização extremamente pequena (K
- Gabarito 1 a QUESTÃO: (2,0 pontos) Avaliador Revisor Informe a que volume deve ser diluído com água um litro de solução de um ácido fraco HA 0.10 M, de constante de ionização extremamente pequena (K
UFMG - 2004 3º DIA QUÍMICA BERNOULLI COLÉGIO E PRÉ-VESTIBULAR
 UFMG - 2004 3º DIA QUÍMICA BERNOULLI COLÉGIO E PRÉ-VESTIBULAR Química Questão 01 Os metais alcalinos, ao reagirem com água, produzem soluções dos respectivos hidróxidos e gás hidrogênio. Esta tabela apresenta
UFMG - 2004 3º DIA QUÍMICA BERNOULLI COLÉGIO E PRÉ-VESTIBULAR Química Questão 01 Os metais alcalinos, ao reagirem com água, produzem soluções dos respectivos hidróxidos e gás hidrogênio. Esta tabela apresenta
Química. Resolução das atividades complementares. Q49 Polaridade das moléculas
 Resolução das atividades complementares 4 Química Q49 Polaridade das moléculas p 7 1 Em relação à polaridade das moléculas, responda: a) Quais as condições para que uma molécula seja polar? b) Uma molécula
Resolução das atividades complementares 4 Química Q49 Polaridade das moléculas p 7 1 Em relação à polaridade das moléculas, responda: a) Quais as condições para que uma molécula seja polar? b) Uma molécula
As bactérias operárias
 A U A UL LA As bactérias operárias Na Aula 47 você viu a importância da insulina no nosso corpo e, na Aula 48, aprendeu como as células de nosso organismo produzem insulina e outras proteínas. As pessoas
A U A UL LA As bactérias operárias Na Aula 47 você viu a importância da insulina no nosso corpo e, na Aula 48, aprendeu como as células de nosso organismo produzem insulina e outras proteínas. As pessoas
P2 - PROVA DE QUÍMICA GERAL - 11/10/08
 P2 - PROVA DE QUÍMICA GERAL - 11/10/08 Nome: Gabarito Nº de Matrícula: Turma: Assinatura: Questão Valor Grau Revisão 1 a 2,5 2 a 2,5 3 a 2,5 4 a 2,5 Total 10,0 Constantes: R 8,314 J mol -1 K -1 0,0821
P2 - PROVA DE QUÍMICA GERAL - 11/10/08 Nome: Gabarito Nº de Matrícula: Turma: Assinatura: Questão Valor Grau Revisão 1 a 2,5 2 a 2,5 3 a 2,5 4 a 2,5 Total 10,0 Constantes: R 8,314 J mol -1 K -1 0,0821
MINISTÉRIO DA DEFESA EXÉRCITO BRASILEIRO DECEx DEPA COLÉGIO MILITAR DE BRASÍLIA PLANO DE AULA BIOLOGIA 1º ANO/EM
 MINISTÉRIO DA DEFESA EXÉRCITO BRASILEIRO DECEx DEPA COLÉGIO MILITAR DE BRASÍLIA Prof. Salomão profsalomao@gmail.com PLANO DE AULA BIOLOGIA 1º ANO/EM Sem Mês Início Término CH 1ª FEV 7 11 3 ASSUNTO: ASPECTOS
MINISTÉRIO DA DEFESA EXÉRCITO BRASILEIRO DECEx DEPA COLÉGIO MILITAR DE BRASÍLIA Prof. Salomão profsalomao@gmail.com PLANO DE AULA BIOLOGIA 1º ANO/EM Sem Mês Início Término CH 1ª FEV 7 11 3 ASSUNTO: ASPECTOS
RESOLUÇÃO COMENTADA DA PROVA DA UNESP DE 2014
 RESOLUÇÃO COMENTADA DA PROVA DA UNESP DE 2014 1-Alguns historiadores da Ciência atribuem ao filósofo pré-socrático Empédocles a Teoria dos Quatro Elementos. Segundo essa teoria, a constituição de tudo
RESOLUÇÃO COMENTADA DA PROVA DA UNESP DE 2014 1-Alguns historiadores da Ciência atribuem ao filósofo pré-socrático Empédocles a Teoria dos Quatro Elementos. Segundo essa teoria, a constituição de tudo
a) Qual a configuração eletrônica do cátion do alumínio isoeletrônico ao gás nobre neônio?
 Questão 1: O Brasil é o campeão mundial da reciclagem de alumínio, colaborando com a preservação do meio ambiente. Por outro lado, a obtenção industrial do alumínio sempre foi um processo caro, consumindo
Questão 1: O Brasil é o campeão mundial da reciclagem de alumínio, colaborando com a preservação do meio ambiente. Por outro lado, a obtenção industrial do alumínio sempre foi um processo caro, consumindo
COMENTÁRIO DA PROVA DE BIOLOGIA
 COMENTÁRIO DA PROVA DE BIOLOGIA A prova de Biologia da UFPR apresentou uma boa distribuição de conteúdos ao longo das nove questões. O grau de dificuldade variou entre questões médias e fáceis, o que está
COMENTÁRIO DA PROVA DE BIOLOGIA A prova de Biologia da UFPR apresentou uma boa distribuição de conteúdos ao longo das nove questões. O grau de dificuldade variou entre questões médias e fáceis, o que está
química 2 Questão 37 Questão 38 Questão 39 alternativa C na alternativa B. Sabendo-se que a amônia (NH 3)
 química 2 Questão 37 Questão 38 abendo-se que a amônia (N 3) é constituída por moléculas polares e apresenta boa solubilidade em água. o diclorometano (2 2) não possui isômeros. ua molécula apresenta polaridade,
química 2 Questão 37 Questão 38 abendo-se que a amônia (N 3) é constituída por moléculas polares e apresenta boa solubilidade em água. o diclorometano (2 2) não possui isômeros. ua molécula apresenta polaridade,
Resolução: 0,86ºC. x = 0,5 mol etanol/kg acetona. 0,5 mol 1000 g de acetona. 200 g de acetona. y = 0,1 mol de etanol. 1 mol de etanol (C 2 H 6 O) 46 g
 (ACAFE) Foi dissolvida uma determinada massa de etanol puro em 200 g de acetona acarretando em um aumento de 0,86 C na temperatura de ebulição da acetona. Dados: H: 1 g/mol, C: 12 g/mol, O: 16 g/mol. Constante
(ACAFE) Foi dissolvida uma determinada massa de etanol puro em 200 g de acetona acarretando em um aumento de 0,86 C na temperatura de ebulição da acetona. Dados: H: 1 g/mol, C: 12 g/mol, O: 16 g/mol. Constante
O processo fisiológico que está representado no gráfico é
 Questão 01) Analise o gráfico a seguir. Disponível em: . Acesso em: 22 set. 2014. O processo fisiológico que está representado no gráfico é a) o efeito do aumento
Questão 01) Analise o gráfico a seguir. Disponível em: . Acesso em: 22 set. 2014. O processo fisiológico que está representado no gráfico é a) o efeito do aumento
QUÍMICA. Questão 31. Questão 32
 QUÍMICA Questão 3 Em 9,9 g de um sal de cálcio encontra-se 0,5 mol desse elemento. Qual a massa molar do ânion trivalente que forma esse sal? Dado: Ca 40 g/mol. (A) 39 g/mol. (B) 278 g/mol. (C) 63,3 g/mol.
QUÍMICA Questão 3 Em 9,9 g de um sal de cálcio encontra-se 0,5 mol desse elemento. Qual a massa molar do ânion trivalente que forma esse sal? Dado: Ca 40 g/mol. (A) 39 g/mol. (B) 278 g/mol. (C) 63,3 g/mol.
Hoje estudaremos a bioquímica dos ácidos nucléicos. Acompanhe!
 Aula: 2 Temática: Ácidos Nucléicos Hoje estudaremos a bioquímica dos ácidos nucléicos. Acompanhe! Introdução: Os ácidos nucléicos são as moléculas com a função de armazenamento e expressão da informação
Aula: 2 Temática: Ácidos Nucléicos Hoje estudaremos a bioquímica dos ácidos nucléicos. Acompanhe! Introdução: Os ácidos nucléicos são as moléculas com a função de armazenamento e expressão da informação
ELETRODO OU SEMIPILHA:
 ELETROQUÍMICA A eletroquímica estuda a corrente elétrica fornecida por reações espontâneas de oxirredução (pilhas) e as reações não espontâneas que ocorrem quando submetidas a uma corrente elétrica (eletrólise).
ELETROQUÍMICA A eletroquímica estuda a corrente elétrica fornecida por reações espontâneas de oxirredução (pilhas) e as reações não espontâneas que ocorrem quando submetidas a uma corrente elétrica (eletrólise).
01) (ACAFE) O grupo de átomos que é encontrado na forma monoatômica pelo fato de serem estáveis é:
 01) (ACAFE) O grupo de átomos que é encontrado na forma monoatômica pelo fato de serem estáveis é: a) Halogênios b) Calcogênios c) Metais Alcalinos Terrosos d) Metais Alcalinos e) Gases Nobres 02) (UFF-RJ)
01) (ACAFE) O grupo de átomos que é encontrado na forma monoatômica pelo fato de serem estáveis é: a) Halogênios b) Calcogênios c) Metais Alcalinos Terrosos d) Metais Alcalinos e) Gases Nobres 02) (UFF-RJ)
Volumetria ácido-base (continuação) Prof a Alessandra Smaniotto QMC 5325 - Química Analítica - Farmácia Turmas 02102A e 02102B
 Volumetria ácido-base (continuação) Prof a Alessandra Smaniotto QMC 5325 - Química Analítica - Farmácia Turmas 02102A e 02102B Curvas de titulação ² A curva de titulação é a representação gráfica de como
Volumetria ácido-base (continuação) Prof a Alessandra Smaniotto QMC 5325 - Química Analítica - Farmácia Turmas 02102A e 02102B Curvas de titulação ² A curva de titulação é a representação gráfica de como
COLÉGIO SANTA TERESINHA R. Madre Beatriz 135 centro Tel. (33) 3341-1244 www.colegiosantateresinha.com.br
 PLANEJAMENTO DE AÇÕES DA 2 ª ETAPA 2015 PERÍODO DA ETAPA: 01/09/2015 á 04/12/2015 TURMA: 9º Ano EF II DISCIPLINA: CIÊNCIAS / QUÍMICA 1- S QUE SERÃO TRABALHADOS DURANTE A ETAPA : Interações elétricas e
PLANEJAMENTO DE AÇÕES DA 2 ª ETAPA 2015 PERÍODO DA ETAPA: 01/09/2015 á 04/12/2015 TURMA: 9º Ano EF II DISCIPLINA: CIÊNCIAS / QUÍMICA 1- S QUE SERÃO TRABALHADOS DURANTE A ETAPA : Interações elétricas e
Ensino Médio Unidade Parque Atheneu. Professor (a): Me. DIOGO LOPES Aluno (a): Série: 3ª Data: / / 2015. LISTA DE QUÍMICA I
 Ensino Médio Unidade Parque Atheneu Professor (a): Me. DIOGO LOPES Aluno (a): Série: 3ª Data: / / 2015. LISTA DE QUÍMICA I OBS: Sua lista semanal deverá ser respondida em folha de papel almaço, copiando
Ensino Médio Unidade Parque Atheneu Professor (a): Me. DIOGO LOPES Aluno (a): Série: 3ª Data: / / 2015. LISTA DE QUÍMICA I OBS: Sua lista semanal deverá ser respondida em folha de papel almaço, copiando
CAPÍTULO 02 A TEIA ALIMENTAR
 CAPÍTULO 02 A TEIA ALIMENTAR Cadeia alimentar: é uma seqüência de seres vivos relacionando-se dentro de um ecossistema, onde um ser serve de alimento para outro ser. Exemplo: Capim capivara onça bactéria
CAPÍTULO 02 A TEIA ALIMENTAR Cadeia alimentar: é uma seqüência de seres vivos relacionando-se dentro de um ecossistema, onde um ser serve de alimento para outro ser. Exemplo: Capim capivara onça bactéria
química FUVEST ETAPA Resposta QUESTÃO 1 QUESTÃO 2 c) Determine o volume adicionado da solução
 Química QUESTÃO 1 Um recipiente contém 100 ml de uma solução aquosa de H SO 4 de concentração 0,1 mol/l. Duas placas de platina são inseridas na solução e conectadas a um LED (diodo emissor de luz) e a
Química QUESTÃO 1 Um recipiente contém 100 ml de uma solução aquosa de H SO 4 de concentração 0,1 mol/l. Duas placas de platina são inseridas na solução e conectadas a um LED (diodo emissor de luz) e a
QUÍMICA COMENTÁRIO DA PROVA DE QUÍMICA
 COMENTÁRIO DA PROVA DE QUÍMICA Prova boa, com questões claras e nível superior ao do ano passado. Nota-se, no entanto, a falta de uma revisão criteriosa, feita por algum professor da área, que não tenha
COMENTÁRIO DA PROVA DE QUÍMICA Prova boa, com questões claras e nível superior ao do ano passado. Nota-se, no entanto, a falta de uma revisão criteriosa, feita por algum professor da área, que não tenha
PlanetaBio Resolução de Vestibulares UNICAMP 2011 1ª fase www.planetabio.com TEXTO PARA AS QUESTÕES 1 E 2
 TEXTO PARA AS QUESTÕES 1 E 2 O vazamento de petróleo no Golfo do México, em abril de 2010, foi considerado o pior da história dos EUA. O vazamento causou o aparecimento de uma extensa mancha de óleo na
TEXTO PARA AS QUESTÕES 1 E 2 O vazamento de petróleo no Golfo do México, em abril de 2010, foi considerado o pior da história dos EUA. O vazamento causou o aparecimento de uma extensa mancha de óleo na
3º trimestre- LISTA DE EXERCICIOS - Biologia - CESINHA Ensino Médio 1º ano classe: Prof. Cesinha Nome: nº
 . 3º trimestre- LISTA DE EXERCICIOS - Biologia - CESINHA Ensino Médio 1º ano classe: Prof. Cesinha Nome: nº Valor: 10 Nota:. 1. (Uel 2015) Leia o texto a seguir. Quando se fala em divisão celular, não
. 3º trimestre- LISTA DE EXERCICIOS - Biologia - CESINHA Ensino Médio 1º ano classe: Prof. Cesinha Nome: nº Valor: 10 Nota:. 1. (Uel 2015) Leia o texto a seguir. Quando se fala em divisão celular, não
Questão 1. Questão 3. Questão 2 1ª PARTE: QUESTÕES OBJETIVAS. alternativa E. alternativa B. A, B e C pertenceriam, respectivamente, a organismos
 1ª PARTE: QUESTÕES OBJETIVAS Questão 1 O exame de um epitélio e do tecido nervoso de um mesmo animal revelou que suas células apresentam diferentes características. Isso ocorre porque a) as moléculas de
1ª PARTE: QUESTÕES OBJETIVAS Questão 1 O exame de um epitélio e do tecido nervoso de um mesmo animal revelou que suas células apresentam diferentes características. Isso ocorre porque a) as moléculas de
Questão 1 Questão 2. Questão 3. Resposta. Resposta
 Questão 1 Questão 2 O esquema abaixo representa as principais relações alimentares entre espécies que vivem num lago de uma região equatorial. a) O câncer é uma doença genética, mas na grande maioria dos
Questão 1 Questão 2 O esquema abaixo representa as principais relações alimentares entre espécies que vivem num lago de uma região equatorial. a) O câncer é uma doença genética, mas na grande maioria dos
TC Revisão 2 Ano Termoquímica e Cinética Prof. Alexandre Lima
 TC Revisão 2 Ano Termoquímica e Cinética Prof. Alexandre Lima 1. Em diversos países, o aproveitamento do lixo doméstico é quase 100%. Do lixo levado para as usinas de compostagem, após a reciclagem, obtém-se
TC Revisão 2 Ano Termoquímica e Cinética Prof. Alexandre Lima 1. Em diversos países, o aproveitamento do lixo doméstico é quase 100%. Do lixo levado para as usinas de compostagem, após a reciclagem, obtém-se
> ESTUDO DO RNA. (C) O ácido nucléico I é DNA e o II, RNA. (D) O ácido nucléico I é RNA e o II, DNA. (E) I é exclusivo dos seres procariontes.
 Biologia > Citologia > Sintese Protéica > Alunos Prof. Zell (biologia) (C) O ácido nucléico I é DNA e o II, RNA. (D) O ácido nucléico I é RNA e o II, DNA. (E) I é exclusivo dos seres procariontes. > ESTUDO
Biologia > Citologia > Sintese Protéica > Alunos Prof. Zell (biologia) (C) O ácido nucléico I é DNA e o II, RNA. (D) O ácido nucléico I é RNA e o II, DNA. (E) I é exclusivo dos seres procariontes. > ESTUDO
A) a existência do oceano líquido é uma hipótese possível, pois um sal solúvel só forma uma mistura homogênea com a água, quando ela está líquida.
 TEXTO PARA A QUESTÃO 1. Sonda espacial detecta sal de cozinha em lua de Saturno A análise da composição química do anel mais externo de Saturno revelou a presença de 98% de água, 1% de cloreto de sódio,
TEXTO PARA A QUESTÃO 1. Sonda espacial detecta sal de cozinha em lua de Saturno A análise da composição química do anel mais externo de Saturno revelou a presença de 98% de água, 1% de cloreto de sódio,
 Reações Químicas Reações Químicas DG O QUE É UMA REAÇÃO QUÍMICA? É processo de mudanças químicas, onde ocorre a conversão de uma substância, ou mais, em outras substâncias. A + B REAGENTES C +
Reações Químicas Reações Químicas DG O QUE É UMA REAÇÃO QUÍMICA? É processo de mudanças químicas, onde ocorre a conversão de uma substância, ou mais, em outras substâncias. A + B REAGENTES C +
Biomassa de Banana Verde Integral- BBVI
 Biomassa de Banana Verde Integral- BBVI INFORMAÇÕES NUTRICIONAIS Porção de 100g (1/2 copo) Quantidade por porção g %VD(*) Valor Energético (kcal) 64 3,20 Carboidratos 14,20 4,73 Proteínas 1,30 1,73 Gorduras
Biomassa de Banana Verde Integral- BBVI INFORMAÇÕES NUTRICIONAIS Porção de 100g (1/2 copo) Quantidade por porção g %VD(*) Valor Energético (kcal) 64 3,20 Carboidratos 14,20 4,73 Proteínas 1,30 1,73 Gorduras
DURAÇÃO DA PROVA: 03 HORAS
 INSTRUÇÕES: PRCESS SELETIV 2013/2 - CPS PRVA DISCURSIVA DE QUÍMICA CURS DE GRADUAÇÃ EM MEDICINA 1. Só abra a prova quando autorizado. 2. Veja se este caderno contém 5 (cinco) questões discursivas. Caso
INSTRUÇÕES: PRCESS SELETIV 2013/2 - CPS PRVA DISCURSIVA DE QUÍMICA CURS DE GRADUAÇÃ EM MEDICINA 1. Só abra a prova quando autorizado. 2. Veja se este caderno contém 5 (cinco) questões discursivas. Caso
Apostila de Química Geral
 Cursinho Vitoriano UNESP - Universidade Estadual Paulista "Júlio de Mesquita Filho" Câmpus de São José do Rio Preto Apostila de Química Geral Período noturno Ligações químicas interatômicas Vanessa R.
Cursinho Vitoriano UNESP - Universidade Estadual Paulista "Júlio de Mesquita Filho" Câmpus de São José do Rio Preto Apostila de Química Geral Período noturno Ligações químicas interatômicas Vanessa R.
REVISÃO QUÍMICA. Profº JURANDIR QUÍMICA
 REVISÃO QUÍMICA Profº JURANDIR QUÍMICA DADOS 01. (ENEM 2004) Em setembro de 1998, cerca de 10.000 toneladas de ácido sulfúrico (H 2 SO 4 ) foram derramadas pelo navio Bahamas no litoral do Rio Grande
REVISÃO QUÍMICA Profº JURANDIR QUÍMICA DADOS 01. (ENEM 2004) Em setembro de 1998, cerca de 10.000 toneladas de ácido sulfúrico (H 2 SO 4 ) foram derramadas pelo navio Bahamas no litoral do Rio Grande
MEIOS DE CULTURA DESENVOLVIMENTO OU PRODUÇÃO DE MEIOS DE CULTURA. Necessidade Bactérias Leveduras
 MEIOS DE CULTURA Associação equilibrada de agentes químicos (nutrientes, ph, etc.) e físicos (temperatura, viscosidade, atmosfera, etc) que permitem o cultivo de microorganismos fora de seu habitat natural.
MEIOS DE CULTURA Associação equilibrada de agentes químicos (nutrientes, ph, etc.) e físicos (temperatura, viscosidade, atmosfera, etc) que permitem o cultivo de microorganismos fora de seu habitat natural.
Resolução da Prova de Química Vestibular Verão UERGS/2003 Prof. Emiliano Chemello
 Fácil Resolução da Prova de Química Vestibular Verão UERGS/2003 Prof. Emiliano Chemello Médio www.quimica.net/emiliano emiliano@quimica.net Difícil Níveis de dificuldade das Questões 01. Em um frasco,
Fácil Resolução da Prova de Química Vestibular Verão UERGS/2003 Prof. Emiliano Chemello Médio www.quimica.net/emiliano emiliano@quimica.net Difícil Níveis de dificuldade das Questões 01. Em um frasco,
ESTEQUIOMETRIA. Prof. João Neto
 ESTEQUIOMETRIA Prof. João Neto 1 Lei de Lavoisier Leis Ponderais Lei de Dalton Lei de Proust 2 Fórmula molecular Fórmula mínima Tipos de Fórmulas Fórmula eletrônica ou de Lewis Fórmula Centesimal Fórmula
ESTEQUIOMETRIA Prof. João Neto 1 Lei de Lavoisier Leis Ponderais Lei de Dalton Lei de Proust 2 Fórmula molecular Fórmula mínima Tipos de Fórmulas Fórmula eletrônica ou de Lewis Fórmula Centesimal Fórmula
Regulação dos níveis iônicos do sangue (Na +, K +, Ca 2+, Cl -, HPO 4. , K +, Mg 2+, etc...)
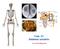 Regulação dos níveis iônicos do sangue (Na +, K +, Ca 2+, Cl -, HPO 4 2-, K +, Mg 2+, etc...) Regulação do equilíbrio hidrossalino e da pressão arterial; Regulação do ph sanguíneo (H +, HCO 3- ); Síntese
Regulação dos níveis iônicos do sangue (Na +, K +, Ca 2+, Cl -, HPO 4 2-, K +, Mg 2+, etc...) Regulação do equilíbrio hidrossalino e da pressão arterial; Regulação do ph sanguíneo (H +, HCO 3- ); Síntese
LIGAÇÃO COVALENTE APOLAR ELEMENTOS COM MESMA ELETRONEGATIVIDADE
 LIGAÇÃO COVALENTE APOLAR ELEMENTOS COM MESMA ELETRONEGATIVIDADE LIGAÇÃO COVALENTE POLAR ELEMENTOS COM ELETRONEGATIVIDADES DIFERENTES MOLÉCULA APOLAR VETORES SE ANULAM ///// µ R = 0 MOLÉCULA APOLAR VETORES
LIGAÇÃO COVALENTE APOLAR ELEMENTOS COM MESMA ELETRONEGATIVIDADE LIGAÇÃO COVALENTE POLAR ELEMENTOS COM ELETRONEGATIVIDADES DIFERENTES MOLÉCULA APOLAR VETORES SE ANULAM ///// µ R = 0 MOLÉCULA APOLAR VETORES
ESCOLA ESTADUAL DR JOSÉ MARQUES DE OLIVEIRA PLANO INDIVIDUAL DE ESTUDO PARA ATENDIMENTO DA PROGRESSÃO PARCIAL 1º SEMESTRE -2013 RESOLUÇÃO SEE Nº 2
 ESCOLA ESTADUAL DR JOSÉ MARQUES DE OLIVEIRA PLANO INDIVIDUAL DE ESTUDO PARA ATENDIMENTO DA PROGRESSÃO PARCIAL 1º SEMESTRE -2013 RESOLUÇÃO SEE Nº 2.197, DE 26 DE OUTUBRO DE 2012 ANO 2013 PROFESSOR (a) Jaqueline
ESCOLA ESTADUAL DR JOSÉ MARQUES DE OLIVEIRA PLANO INDIVIDUAL DE ESTUDO PARA ATENDIMENTO DA PROGRESSÃO PARCIAL 1º SEMESTRE -2013 RESOLUÇÃO SEE Nº 2.197, DE 26 DE OUTUBRO DE 2012 ANO 2013 PROFESSOR (a) Jaqueline
O DNA é formado por pedaços capazes de serem convertidos em algumas características. Esses pedaços são
 Atividade extra Fascículo 2 Biologia Unidade 4 Questão 1 O DNA é formado por pedaços capazes de serem convertidos em algumas características. Esses pedaços são chamados de genes. Assinale abaixo quais
Atividade extra Fascículo 2 Biologia Unidade 4 Questão 1 O DNA é formado por pedaços capazes de serem convertidos em algumas características. Esses pedaços são chamados de genes. Assinale abaixo quais
De onde vêm as lágrimas?
 De onde vêm as lágrimas? É toda substância que, em solução aquosa, sofre dissociação, liberado pelo menos um cátion diferente de H + e um ânion diferente de OH -. a) Presença de oxigênio b) Sal não oxigenado
De onde vêm as lágrimas? É toda substância que, em solução aquosa, sofre dissociação, liberado pelo menos um cátion diferente de H + e um ânion diferente de OH -. a) Presença de oxigênio b) Sal não oxigenado
Prova de Química e Biologia
 Provas Especialmente Adequadas Destinadas a Avaliar a Capacidade para a Frequência dos Cursos Superiores do IPVC dos Maiores de 23 Anos Prova de Química e Biologia Prova modelo Prova Específica de Química
Provas Especialmente Adequadas Destinadas a Avaliar a Capacidade para a Frequência dos Cursos Superiores do IPVC dos Maiores de 23 Anos Prova de Química e Biologia Prova modelo Prova Específica de Química
As questões de 31 a 34 referem-se ao texto abaixo.
 QUÍMICA As questões de 31 a 34 referem-se ao texto abaixo. Em diversos países, o aproveitamento do lixo doméstico é quase 100%. Do lixo levado para as usinas de compostagem, após a reciclagem, obtém-se
QUÍMICA As questões de 31 a 34 referem-se ao texto abaixo. Em diversos países, o aproveitamento do lixo doméstico é quase 100%. Do lixo levado para as usinas de compostagem, após a reciclagem, obtém-se
PROF. KELTON WADSON OLIMPÍADA 8º SÉRIE ASSUNTO: TRANSFORMAÇÕES DE ESTADOS DA MATÉRIA.
 PROF. KELTON WADSON OLIMPÍADA 8º SÉRIE ASSUNTO: TRANSFORMAÇÕES DE ESTADOS DA MATÉRIA. 1)Considere os seguintes dados obtidos sobre propriedades de amostras de alguns materiais. Com respeito a estes materiais,
PROF. KELTON WADSON OLIMPÍADA 8º SÉRIE ASSUNTO: TRANSFORMAÇÕES DE ESTADOS DA MATÉRIA. 1)Considere os seguintes dados obtidos sobre propriedades de amostras de alguns materiais. Com respeito a estes materiais,
www.professormazzei.com ISOMERIA Folha 01 João Roberto Fortes Mazzei
 01. Dentre as alternativas a seguir, é incorreto afirmar que: a) etanol e etóxi-etano apresentam, respectivamente, isomeria funcional e de compensação. b) 2-buteno e propino apresentam, respectivamente,
01. Dentre as alternativas a seguir, é incorreto afirmar que: a) etanol e etóxi-etano apresentam, respectivamente, isomeria funcional e de compensação. b) 2-buteno e propino apresentam, respectivamente,
DATA: 17/11/2015. 2. (ENEM) Discutindo sobre a intensificação do efeito estufa, Francisco Mendonça afirmava:
 EXERCÍCIOS REVISÃO QUÍMICA AMBIENTAL (EFEITO ESTUFA, DESTRUIÇÃO DA CAMADA DE OZÔNIO E CHUVA ÁCIDA) e EQUILÍBRIO QUÍMICO DATA: 17/11/2015 PROF. ANA 1. Na década de 70, alguns cientistas descobriram quais
EXERCÍCIOS REVISÃO QUÍMICA AMBIENTAL (EFEITO ESTUFA, DESTRUIÇÃO DA CAMADA DE OZÔNIO E CHUVA ÁCIDA) e EQUILÍBRIO QUÍMICO DATA: 17/11/2015 PROF. ANA 1. Na década de 70, alguns cientistas descobriram quais
Prova de Recuperação Bimestral de Ciências Nome Completo: Data: / /2010
 COLÉGIO MARIA IMACULADA QI 05 ch. 72 LAGO SUL BRASÍLIA DF E-MAIL: cmidf@cmidf.com.br FONE: 248 4768 SITE: www.cmidf.com.br VALOR:10 pontos. NOTA: 9ºano 2º PERÍODO Prova de Recuperação Bimestral de Ciências
COLÉGIO MARIA IMACULADA QI 05 ch. 72 LAGO SUL BRASÍLIA DF E-MAIL: cmidf@cmidf.com.br FONE: 248 4768 SITE: www.cmidf.com.br VALOR:10 pontos. NOTA: 9ºano 2º PERÍODO Prova de Recuperação Bimestral de Ciências
Ecologia. 1) Níveis de organização da vida
 Introdução A ciência que estuda como os seres vivos se relacionam entre si e com o ambiente em que vivem e quais as conseqüências dessas relações é a Ecologia (oikos = casa e, por extensão, ambiente; logos
Introdução A ciência que estuda como os seres vivos se relacionam entre si e com o ambiente em que vivem e quais as conseqüências dessas relações é a Ecologia (oikos = casa e, por extensão, ambiente; logos
Sistema circulatório. Componentes: - Vasos sanguíneos. - Sangue (elementos figurados e plasma) - Coração
 Fisiologia Humana Sistema circulatório Componentes: - Sangue (elementos figurados e plasma) - Vasos sanguíneos - Coração Vasos sanguíneos Artérias Vasos com paredes espessas e elásticas por onde circula
Fisiologia Humana Sistema circulatório Componentes: - Sangue (elementos figurados e plasma) - Vasos sanguíneos - Coração Vasos sanguíneos Artérias Vasos com paredes espessas e elásticas por onde circula
O interesse da Química é analisar as...
 O interesse da Química é analisar as... PROPRIEDADES CONSTITUINTES SUBSTÂNCIAS E MATERIAIS TRANSFORMAÇÕES ESTADOS FÍSICOS DOS MATERIAIS Os materiais podem se apresentar na natureza em 3 estados físicos
O interesse da Química é analisar as... PROPRIEDADES CONSTITUINTES SUBSTÂNCIAS E MATERIAIS TRANSFORMAÇÕES ESTADOS FÍSICOS DOS MATERIAIS Os materiais podem se apresentar na natureza em 3 estados físicos
EXAME GERAL EM QUÍMICA EDITAL N 118/2009. Seleção para o 1º Semestre de 2010 07 de Dezembro de 2009 CANDIDATO: Assinatura: INSTRUÇÕES
 UNIVERSIDADE ESTADUAL DO SUDOESTE DA BAHIA PROGRAMA DE PÓS-GRADUAÇÃO EM QUÍMICA R. José Moreira Sobrinho, s/n, CEP: 45506-191 Jequié-BA Tel / FAX: 73 3528-9630 e-mail: mestrado.quimica@uesb.br Reservado
UNIVERSIDADE ESTADUAL DO SUDOESTE DA BAHIA PROGRAMA DE PÓS-GRADUAÇÃO EM QUÍMICA R. José Moreira Sobrinho, s/n, CEP: 45506-191 Jequié-BA Tel / FAX: 73 3528-9630 e-mail: mestrado.quimica@uesb.br Reservado
Matéria e Energia no Ecossistema
 Matéria e Energia no Ecossistema Qualquer unidade que inclua a totalidade dos organismos (comunidade) de uma área determinada, interagindo com o ambiente físico, formando uma corrente de energia que conduza
Matéria e Energia no Ecossistema Qualquer unidade que inclua a totalidade dos organismos (comunidade) de uma área determinada, interagindo com o ambiente físico, formando uma corrente de energia que conduza
Gabarito Química - Grupo A. 1 a QUESTÃO: (1,0 ponto) Avaliador Revisor
 VESTIB LAR Gabarito Química - Grupo A 1 a QUESTÃO: (1,0 ponto) Avaliador Revisor Muitos álcoois, como o butanol (C 4 H 10 O), têm importância comercial como solventes e matériasprimas na produção industrial
VESTIB LAR Gabarito Química - Grupo A 1 a QUESTÃO: (1,0 ponto) Avaliador Revisor Muitos álcoois, como o butanol (C 4 H 10 O), têm importância comercial como solventes e matériasprimas na produção industrial
CALORIMETRIA, MUDANÇA DE FASE E TROCA DE CALOR Lista de Exercícios com Gabarito e Soluções Comentadas
 COLÉGIO PEDRO II PRÓ-REITORIA DE PÓS-GRADUAÇÃO, PESQUISA, EXTENSÃO E CULTURA PROGRAMA DE RESIDÊNCIA DOCENTE RESIDENTE DOCENTE: Marcia Cristina de Souza Meneguite Lopes MATRÍCULA: P4112515 INSCRIÇÃO: PRD.FIS.0006/15
COLÉGIO PEDRO II PRÓ-REITORIA DE PÓS-GRADUAÇÃO, PESQUISA, EXTENSÃO E CULTURA PROGRAMA DE RESIDÊNCIA DOCENTE RESIDENTE DOCENTE: Marcia Cristina de Souza Meneguite Lopes MATRÍCULA: P4112515 INSCRIÇÃO: PRD.FIS.0006/15
PlanetaBio Resolução de Vestibulares UFRJ 2007 www.planetabio.com
 1-O gráfico a seguir mostra como variou o percentual de cepas produtoras de penicilinase da bactéria Neisseria gonorrhoeae obtidas de indivíduos com gonorréia no período de 1980 a 1990. A penicilinase
1-O gráfico a seguir mostra como variou o percentual de cepas produtoras de penicilinase da bactéria Neisseria gonorrhoeae obtidas de indivíduos com gonorréia no período de 1980 a 1990. A penicilinase
5ª SÉRIE/6º ANO - ENSINO FUNDAMENTAL UM MUNDO MELHOR PARA TODOS
 5ª SÉRIE/6º ANO - ENSINO FUNDAMENTAL UM MUNDO MELHOR PARA TODOS Auno(a) N 0 6º Ano Turma: Data: / / 2013 Disciplina: Ciências UNIDADE I Professora Martha Pitanga ATIVIDADE 01 CIÊNCIAS REVISÃO GERAL De
5ª SÉRIE/6º ANO - ENSINO FUNDAMENTAL UM MUNDO MELHOR PARA TODOS Auno(a) N 0 6º Ano Turma: Data: / / 2013 Disciplina: Ciências UNIDADE I Professora Martha Pitanga ATIVIDADE 01 CIÊNCIAS REVISÃO GERAL De
SÉRIE: 2º ano EM Exercícios de recuperação final DATA / / DISCIPLINA: QUÍMICA PROFESSOR: FLÁVIO QUESTÕES DE MÚLTIPLA ESCOLHA
 SÉRIE: 2º ano EM Exercícios de recuperação final DATA / / DISCIPLINA: QUÍMICA PROFESSOR: FLÁVIO QUESTÕES DE MÚLTIPLA ESCOLHA QUESTÃO 01 Em uma determinada transformação foi constatado que poderia ser representada
SÉRIE: 2º ano EM Exercícios de recuperação final DATA / / DISCIPLINA: QUÍMICA PROFESSOR: FLÁVIO QUESTÕES DE MÚLTIPLA ESCOLHA QUESTÃO 01 Em uma determinada transformação foi constatado que poderia ser representada
O QUE É SER VIVO? Matéria bruta. Ser vivo vida o que existe. ou Ser in animado ativo prefixo de negação o que existe
 Seres Vivos O QUE É SER VIVO? Ser vivo vida o que existe Matéria bruta ou Ser in animado ativo prefixo de negação o que existe O que é vida? Em 1959 Norman Horowitz afirmou que a vida caracteriza-se por
Seres Vivos O QUE É SER VIVO? Ser vivo vida o que existe Matéria bruta ou Ser in animado ativo prefixo de negação o que existe O que é vida? Em 1959 Norman Horowitz afirmou que a vida caracteriza-se por
EXAME DE BIOLOGIA Prova de Acesso - Maiores 23 Anos (21 de Abril de 2009)
 INSTITUTO POLITÉCNICO DE BEJA EXAME DE BIOLOGIA Prova de Acesso - Maiores 23 Anos (21 de Abril de 2009) Nome do Candidato Classificação Leia as seguintes informações com atenção. 1. O exame é constituído
INSTITUTO POLITÉCNICO DE BEJA EXAME DE BIOLOGIA Prova de Acesso - Maiores 23 Anos (21 de Abril de 2009) Nome do Candidato Classificação Leia as seguintes informações com atenção. 1. O exame é constituído
CADERNO DE EXERCÍCIOS 2D
 CADERNO DE EXERCÍCIOS 2D Ensino Fundamental Ciências da Natureza II Habilidade da Questão Conteúdo Matriz da EJA/FB 01 Fisiologia Vegetal (Transporte e absorção de H34, H40, H41, H63 substâncias); Fotossíntese
CADERNO DE EXERCÍCIOS 2D Ensino Fundamental Ciências da Natureza II Habilidade da Questão Conteúdo Matriz da EJA/FB 01 Fisiologia Vegetal (Transporte e absorção de H34, H40, H41, H63 substâncias); Fotossíntese
Pág. 1. COMISSÃO PERMANENTE DE SELEÇÃO - COPESE PRÓ-REITORIA DE GRADUAÇÃO - PROGRAD CONCURSO VESTIBULAR 2009 2ª Fase PROVA DE QUÍMICA
 Questão 1: As bebidas alcoólicas contêm etanol e podem ser obtidas pela destilação do álcool (ex. whiskey e vodka) ou pela fermentação de uma variedade de produtos como frutas e outros vegetais (ex. vinho
Questão 1: As bebidas alcoólicas contêm etanol e podem ser obtidas pela destilação do álcool (ex. whiskey e vodka) ou pela fermentação de uma variedade de produtos como frutas e outros vegetais (ex. vinho
UFJF CONCURSO VESTIBULAR 2012-2 GABARITO DA PROVA DE BIOLOGIA
 Questão 1 Sobre as mitocôndrias, responda: a) Através da análise de DNA, demonstrou-se que muitos genes da bactéria Rickettsia prowazekii, que causa um tipo de febre, são parecidos com os genes das mitocôndrias.
Questão 1 Sobre as mitocôndrias, responda: a) Através da análise de DNA, demonstrou-se que muitos genes da bactéria Rickettsia prowazekii, que causa um tipo de febre, são parecidos com os genes das mitocôndrias.
ELETROQUÍMICA (Parte II)
 ELETROQUÍMICA (Parte II) I ELETRÓLISE A eletrólise é um processo de oxirredução não espontâneo, em que a passagem da corrente elétrica em uma solução eletrolítica (solução com íons), produz reações químicas.
ELETROQUÍMICA (Parte II) I ELETRÓLISE A eletrólise é um processo de oxirredução não espontâneo, em que a passagem da corrente elétrica em uma solução eletrolítica (solução com íons), produz reações químicas.
QIE0001 Química Inorgânica Experimental Prof. Fernando R. Xavier. Prática 09 Síntese do cloreto de pentaaminoclorocobalto(iii)
 UNIVERSIDADE DO ESTADO DE SANTA CATARINA CENTRO DE CIÊNCIAS TECNOLÓGICAS CCT DEPARTAMENTO DE QUÍMICA DQMC QIE0001 Química Inorgânica Experimental Prof. Fernando R. Xavier Prática 09 Síntese do cloreto
UNIVERSIDADE DO ESTADO DE SANTA CATARINA CENTRO DE CIÊNCIAS TECNOLÓGICAS CCT DEPARTAMENTO DE QUÍMICA DQMC QIE0001 Química Inorgânica Experimental Prof. Fernando R. Xavier Prática 09 Síntese do cloreto
FISIOLOGIA RENAL EXERCÍCIOS DE APRENDIZAGEM
 EXERCÍCIOS DE APRENDIZAGEM FISIOLOGIA RENAL 01. A sudorese (produção de suor) é um processo fisiológico que ajuda a baixar a temperatura do corpo quando está muito calor ou quando realizamos uma atividade
EXERCÍCIOS DE APRENDIZAGEM FISIOLOGIA RENAL 01. A sudorese (produção de suor) é um processo fisiológico que ajuda a baixar a temperatura do corpo quando está muito calor ou quando realizamos uma atividade
G r u p o s B e C. 1 a Questão: (2,0 pontos)
 1 a Questão: (2,0 pontos) Um aluno em sua casa, estudando eletromicrografias de diferentes células, recortou o núcleo de duas células para posterior montagem em seu colégio. O núcleo de uma destas células
1 a Questão: (2,0 pontos) Um aluno em sua casa, estudando eletromicrografias de diferentes células, recortou o núcleo de duas células para posterior montagem em seu colégio. O núcleo de uma destas células
EQUILÍBRIO QUÍMICO 1
 EQUILÍBRIO QUÍMICO 1 1- Introdução Uma reação química é composta de duas partes separadas por uma flecha, a qual indica o sentido da reação. As espécies químicas denominadas como reagentes ficam à esquerda
EQUILÍBRIO QUÍMICO 1 1- Introdução Uma reação química é composta de duas partes separadas por uma flecha, a qual indica o sentido da reação. As espécies químicas denominadas como reagentes ficam à esquerda
: fórmula mínima M = (1. 12 + 4. 1) g/mol M = 16g/mol. b) A equação química do processo é: (g) + 2O 2. (g) CO 2. (g) + 2H 2
 20 A Bolívia é um grande produtor de gás natural (metano) e celebrou com o Brasil um acordo para a utilização deste importante recurso energético. Para seu transporte até os centros consumidores, há um
20 A Bolívia é um grande produtor de gás natural (metano) e celebrou com o Brasil um acordo para a utilização deste importante recurso energético. Para seu transporte até os centros consumidores, há um
Associação Catarinense das Fundações Educacionais ACAFE PARECER RECURSO DISCIPLINA QUÍMICA
 33) Assinale a alternativa correta, na qual todas as substâncias são compostas e líquidas à temperatura ambiente. A O 3, O 2 ; CH 3 CH 2 OH B H 2 ; CO 2 ; CH 3 OH C H 2 O; NH 3 ; CO D H 2 O; CH 3 CH 2
33) Assinale a alternativa correta, na qual todas as substâncias são compostas e líquidas à temperatura ambiente. A O 3, O 2 ; CH 3 CH 2 OH B H 2 ; CO 2 ; CH 3 OH C H 2 O; NH 3 ; CO D H 2 O; CH 3 CH 2
QUESTÕES DE CARACTERIZAÇÃO E ANÁLISE AMBIENTAL. O 2(g) O 2(aq)
 QUESTÕES DE CARACTERIZAÇÃO E ANÁLISE AMBIENTAL Questão 01 O agente oxidante mais importante em águas naturais é, sem a menor dúvida, o oxigênio molecular dissolvido, O 2. O equilíbrio entre o oxigênio
QUESTÕES DE CARACTERIZAÇÃO E ANÁLISE AMBIENTAL Questão 01 O agente oxidante mais importante em águas naturais é, sem a menor dúvida, o oxigênio molecular dissolvido, O 2. O equilíbrio entre o oxigênio
Química. Resolução das atividades complementares. Q42 Ligação metálica
 Resolução das atividades complementares 3 Química Q42 Ligação metálica p. 59 1 (Cefet-PR) Analise as afirmações a seguir: I. O metal X é leve, sofre pouca corrosão e é bastante utilizado na construção
Resolução das atividades complementares 3 Química Q42 Ligação metálica p. 59 1 (Cefet-PR) Analise as afirmações a seguir: I. O metal X é leve, sofre pouca corrosão e é bastante utilizado na construção
Química D Extensivo V. 3
 Química D Extensivo V. 3 Exercícios 01) Alternativa correta: A 5 4 3 2 1 CH 3 CH 2 CH CH CH 2 OH CH 3 CH 3 metil metil 02) Alternativa correta: D 8 7 6 5 4 3 2 1 CH 3 C = CH CH 2 CH 2 CH CH 2 CH 2 OH CH
Química D Extensivo V. 3 Exercícios 01) Alternativa correta: A 5 4 3 2 1 CH 3 CH 2 CH CH CH 2 OH CH 3 CH 3 metil metil 02) Alternativa correta: D 8 7 6 5 4 3 2 1 CH 3 C = CH CH 2 CH 2 CH CH 2 CH 2 OH CH
VI OLIMPÍADA BAIANA DE QUÍMICA 2011
 VI OLIMPÍADA BAIANA DE QUÍMICA 2011 RESPONDA AS QUESTÕES DE 1 a 30, MARCANDO UMA DAS ALTERNATIVAS DE ACORDO COM O QUE SE PEDE QUESTÃO 1 Peso 2 A dissolução do cloreto de amônio, NH 4 Cl(s), em água ocorre
VI OLIMPÍADA BAIANA DE QUÍMICA 2011 RESPONDA AS QUESTÕES DE 1 a 30, MARCANDO UMA DAS ALTERNATIVAS DE ACORDO COM O QUE SE PEDE QUESTÃO 1 Peso 2 A dissolução do cloreto de amônio, NH 4 Cl(s), em água ocorre
