TERMODINÂMICA NO EQUILÍBRIO QUÍMICO 1
|
|
|
- Felipe Dinis Maranhão
- 7 Há anos
- Visualizações:
Transcrição
1 TERMODINÂMICA NO EQUILÍBRIO QUÍMICO 1 1. Conceitos fundamentais A ciência da termodinâmica se originou do reconhecimento de que a transformação de calor e trabalho poderia ser prevista através de umas poucas relações. Enquanto que inicialmente o interesse da termodinâmica se concentrou na melhoria da eficiência das máquinas, hoje em dia a termodinâmica é uma parte integrante do estudo das interações químicas. Através dos conceitos da termodinâmica pode ser previsto se uma reação química pode ou não ocorrer e também pode ser determinado a sua composição no equilíbrio, em ambos os casos segundo uma condição prévia. Deve ser salientado que previsões baseadas em tempos não podem ser feitas e, portanto, cinética química das reações ou o conhecimento do equilíbrio cinético não podem ser avaliados. Nas investigações termodinâmicas considera-se sistema (parte que estamos interessados a investigar) como sendo a parte física do ambiente que é separada por uma borda ou contorno. Sistemas podem ser classificados como isolados quando eles não podem efetuar troca de energia ou matéria com seu ambiente, fechado quando energia porém não matéria pode ser exportada para o ambiente, e aberto quando ambos energia e matéria podem ser trocadas com seu ambiente. Assim sendo sistemas ambientais geralmente são abertos, porém deve ser observado que a aplicação restrita de termodinâmica química pode ser confundida nestes sistemas devido as interações biológicas as quais podem fazer com que a termodinâmica se torne mais complexa. 1 Arquimedes Lavorenti. Professor Associado do Depto. de Ciências Exatas, ESALQ/USP, Caixa Postal 9, Piracicaba SP. alavoren@carpa.ciagri.usp.br Publicação Destinada ao Ensino de Ciências - Química - 28/3/2002 1
2 As propriedades dos sistemas são ditas como sendo extensivas se elas dependem da quantidade de matéria do sistema (isto é, volume, massa), e intensivas quando elas não dependem (isto é, densidade, concentração, temperatura, pressão). O estado do sistema (aquela série de circunstâncias nas quais todas as propriedades do sistema possuem valores fixos e reprodutíveis) pode ser definido por um número limitado de propriedades conhecidas como funções de estado ou variáveis de estado. Um processo se refere a qualquer troca nas propriedades de um sistema. Processos são designados como reversíveis (ideal) ou irreversíveis (não ideal). Para um processo reversível, toda a série de mudanças que fazem parte do processo pode ser revertida de tal forma que a condição original pode ser restabelecida. Este processo pode ser executado apenas por etapas infinitesimais de tal modo que cada etapa é caracterizada por um estado de balanço (isto é, equilíbrio). Um processo reversível precisa que todas as fontes de dissipação de energia (isto é, fricção, resistência elétrica) sejam eliminadas. Na realidade isto é impossível, e então todos os processo atuais são irreversíveis em alguma extensão. Termodinâmica investiga as mudanças nas propriedades de um sistema se movimentando de um estado inicial para um estado final. 2. Leis A primeira lei da termodinâmica trata do conceito da conservação de energia e pode ser expressa de vários modos: A energia total do universo (ou de qualquer sistema isolado) é constante Energia não pode ser criada nem destruída apenas transferida de uma para outra A primeira lei da termodinâmica pode ser descrita matematicamente como: U = q + W (1) onde: = indica a variação de alguma função de um estado inicial para um outro estado final; 2
3 U = energia interna é o total de energia (de todas as formas possíveis) de um sistema; q = energia que é transferida como calor para um sistema; W = trabalho realizado em um sistema. Assim, a energia interna de um sistema pode aumentar quando calor é aplicado ou trabalho é realizado no sistema. Termos subsequentes podem ser adicionados a esta equação para demonstrar outros tipos de trabalho, tais como elétrico ou magnético. Um processo adiabático é aquele no qual durante a sua ocorrência o calor não é adicionado ou removido do sistema (isto é, q = 0). Se uma quantidade de trabalho W de pressãovolume é realizada adiabáticamente no sistema, a variação na energia interna é dada por: U = W (2) Por outro lado, se uma quantidade de calor q é transferida para um sistema a volume constante (W = -P V = 0, e trabalho mecânico não é realizado), a mudança na energia interna é dada por: U = q V (3) onde, o subscrito V representa que a variável de estado é mantida constante. A maioria dos processos experimentais e que ocorrem no ambiente é realizado à pressão constante (P) em vez de volume constante (V). Assim, apenas o trabalho volume é utilizado e as expressões: W = -P V (4) U = q + W (1) podem ser combinadas para dar: U = q P - P V (5) 3
4 Se considerarmos mudanças no sistema de um estado inicial para um estado final (designados como subscritos i e f, respectivamente) à pressão constante terá: U f U i = q P P(V f V i ) (6) E o calor absorvido pelo sistema é, portanto: q P = (U f + PV f ) (U i + PV i ) (7) Uma nova função de estado pode ser definida pela equação: De tal modo que H = U + PV (8) H = (U f + PV f ) (U i + PV i ) = q P (9) A função de estado H é denominada de entalpia. Da expressão (9) podemos ver que a mudança na entalpia para um processo é igual ao calor absorvido pelo sistema se apenas o volume trabalho é realizado e a pressão é mantida constante. A função de estado H é algumas vezes chamada de quantidade de calor, porém o uso deste termo pode ser mal interpretado nos processos onde a pressão não é constante. Calor tanto pode ser absorvido como liberado de um sistema durante o transcorrer de uma reação química. A quantidade de entalpia que se modifica durante a reação é denominada de calor da reação. O calor da reação é dependente da temperatura e, portanto a temperatura deve ser especificada, normalmente designada por meio de um subscrito. A fim de comparar mudanças na entalpia para diferentes reações, os dados devem ser normalizados com respeito à temperatura. A temperatura padrão que é mais freqüentemente utilizada é 25 o C (298 K). 4
5 Assim sendo o calor da reação é expressa como H o 298 e o superscrito o, refere aos constituintes envolvidos na reação em seus estados padrões. O estado padrão de referência é 25 o C e 1 atm de pressão. O estado padrão de um elemento ou composto é o estado físico e na forma mais estável na qual ele existe sob estas condições descritas. Quando calor é liberado a reação é dita como sendo exotérmica e H é negativo. Um exemplo típico poderia ser a combustão ou oxidação do monóxido de carbono: CO (g) + ½ O 2(g) CO 2(g) H o 298 = -283,0 kj mol -1 Inversamente, quando calor é absorvido o processo é endotérmico e H é positivo. Este é o caso da dissociação da água: H 2 O (l) H + (aq) + OH - (aq) H o 298 = 55,5 kj mol -1 De modo semelhante, entalpia pode aumentar ou diminuir quando um soluto é dissolvido em um solvente. O calor da solução resultante pode ser endotérmico quando calor é absorvido: NaCl em água: H o 298 = 3,98 kj mol -1 ou exotérmico quando calor é liberado: NH 3 em água: H o 298 = -30,5 kj mol -1 A segunda lei da termodinâmica se relaciona com a possibilidade de um processo químico ou físico ocorrer espontaneamente ou não. Por exemplo, quando dois cilindros de gás contendo ar em diferentes pressões são conectados, a pressão se iguala nos dois cilindros. De modo semelhante quando um objeto quente 5
6 entra em contato com um objeto frio, calor é transferido do quente para o frio fazendo com que a temperatura se iguale entre os dois. A existência de diferenças de pressão, composição e temperatura dentro de um sistema não são impedidas pela primeira lei da termodinâmica; de qualquer modo, os processos destacados acima estão sujeitos a ocorrer por suas próprias vontades. De modo oposto, os processos inversos seriam considerados não naturais ou não espontâneos. A manifestação da segunda lei da termodinâmica diz que qualquer sistema deixado por si próprio alcançará o seu estado final, isto é obtém o equilíbrio. Enquanto a primeira lei da termodinâmica diz que a energia do universo é constante, a segunda lei diz que: A entropia do universo está aumentando constantemente A entropia de um sistema é uma medida do grau de desordem que existe no sistema. A entropia também é uma função de estado. A entropia, S, pode ser definida pela equação: ds = dq/dt (10) ou S = q/ T (11) onde dq é a troca de calor associada com um processo reversível. A convenção de sinal é tal que, à medida que o sistema se torna mais ao acaso ou disperso, o aumento da entropia é positivo. A variação de entropia pode ser ocasionada tanto pela mudança na temperatura como no número de entidades do sistema. Quanto maior o número de entidades em um sistema, maior a desordem exibida pelo sistema. Portanto, a variação de entropia é positiva para reações nas quais o número de produtos é maior do que o de reagentes. Uma importante manifestação disto é o chamado efeito quelato, no 6
7 qual vários sítios de uma única molécula podem colaborativamente ligar-se com um íon metálico, deslocando, portanto as moléculas coordenadas de água. De modo semelhante ao que foi feito para a entalpia, o estado padrão de 1 atm e 25 o C é usado geralmente para a tabulação da entropia padrão (S o 298) para uma substância. A variação de entropia durante uma reação pode ser calculada pela diferença entre a entropia dos produtos e dos reagentes. Para um caso geral: n 1 X 1 + n 2 X 2 n 3 X 3 + n 4 X 4 A variação de entropia é dada como: S o = n i S o produtos i - n j S o reagentes j Ex: H 2(g) + ½ O 2(g) H 2 O (l) S o 298 = S o H2O(l) S o H 2(g) - 1/2S o O 2(g) = 69,9-103,6 - ½(205) = - 163,2 J mol -1 K -1 como: A terceira lei da termodinâmica também pertence à entropia e pode ser expressa a entropia de sólidos cristalinos perfeitos na temperatura absoluta ( 0 K) é zero Se um processo é favorecido ou não energéticamente, pode ser previsto através da primeira e segunda lei da termodinâmica. Duas funções de estado têm sido definidas as quais combinam estes conceitos. Para sistemas isotérmicos de composição constante e a volume constante a energia de Helmholtz (energia livre de Helmholtz), A, é dada como: A = U - TS (12) Para sistemas isotérmicos de composição constante e a pressão constante (uma condição mais comum encontrada no ambiente) a energia de Gibbs (energia livre de Gibbs), G, é definida como: 7
8 G = H - TS (13) Nestas condições a variação da energia de Gibbs para um processo é, portanto: G = H - T S (14) De modo semelhante a entalia e entropia, um estado padrão para a energia livre também pode ser estabelecido o qual é designado como 1 atm de pressão e 298 K, resultando: G o 298 = H o T S o 298 (15) E o critério de espontaneidade de uma reação química é dado por G < 0 (16) o qual é a conclusão termodinâmica mais importante para a química, ou seja, reações químicas são espontâneas quando caminham em direção ao decréscimo de suas energias livres de Gibbs. Reações químicas nas quais G é negativo são energéticamente favorecidas. Sistemas tenderão a se aproximar de um nível mínimo de energia e, portanto, maior será o decréscimo na energia de Gibbs. Deve ser enfatizado, de qualquer modo, que a cinética das reações químicas desempenha um papel importante. Embora uma reação possa ser prevista como sendo espontânea do ponto de vista termodinâmico, ela pode ocorrer em uma velocidade (taxa) suficientemente baixa a tal ponto que não seja perceptível. A variação na energia livre de Gibbs para uma reação química depende das variações tanto da entalpia como da entropia. Portanto, fatores que tendem a favorecer um processo em particular com a diminuição na entalpia (exotérmica) e um aumento na entropia, resultam em um G negativo. Geralmente o termo entalpia é dominante e, portanto ele influência tanto o sinal como a magnitude de G. Como mencionado acima, sistemas tendem a atingir um nível mínimo de energia. Processos nos quais as variações na energia livres de Gibbs são positivas não ocorrerão 8
9 espontaneamente. Inversamente, processos que permitem com que a energia livre de Gibbs diminua ocorrerão espontaneamente e podem ser ditas que são favorecidas do ponto de vista termodinâmico. Uma série de reações competitiva pode ser comparada com respeito ao G. A reação com o G mais negativo será mais favorecida do ponto de vista termodinâmico. Como observado anteriormente, pode haver limitações cinéticas envolvidas de tal modo que o processo ocorre a uma velocidade (taxa) tão baixa que não possa ser observado. De qualquer modo, pode-se esperar que a reação com a maior diminuição na energia de Gibbs será a que tem mais probabilidade de ocorrer. As discussões das energias de Helmholtz e de Gibbs estabeleceram um sistema de composição constante. Isto implica que a composição de um sistema deve exercer certa influência. Claramente, a energia interna de um sistema será afetada pela quantidade do material presente. De fato, U aumenta a medida que a quantidade de material aumenta. Mantendo aspectos químicos práticos, a quantidade de material presente é medida em termos de mols e designados como n 1, n 2, n 3,... n i., onde, o subscrito define o componente. A composição deve ser especificada, uma vez que diferentes componentes irão contribuir variando a quantidade de energia interna do sistema. Tudo contém energia interna. Portanto, se a quantidade de um material em um sistema está aumentando, por exemplo, pela adição de mais sal a uma solução salina, a energia interna do sistema aumenta. O aumento também será afetado pela substância que é adicionada uma vez que a energia livre por mol (conhecida como potencial químico, µ) é uma propriedade da substância. Portanto, a variação da energia livre de Gibbs resultante da adição de 1 mol de açúcar é diferente daquela devido a adição de 1 mol de sal. Cada função termodinâmica depende não apenas de P, V e T como citadas anteriormente más também dos vários n i s presentes. Assim sendo, a equação da energia livre de Gibbs deve ser estendida para incluir o efeito destes componentes; resultando na equação fundamental da termodinâmica química: 9
10 G = H - T S + i µ i dn i (17) onde µ é o potencial químico, definido por Gibbs como sendo: µ = ( δg/δn i ) T,P,nj (18) Esta é uma definição matemática indicando que à temperatura, pressão e composição constantes (outra que não o componente i), o potencial químico é igual a variação da energia livre de Gibbs devida a variação na quantidade do componente i presente. Assim, a energia livre de Gibbs é uma propriedade extensiva e o potencial químico uma propriedade intensiva. O potencial químico também pode ser expresso em termos de atividade: µ = µ o i + RT lnγ i c i (19) onde µ o i é o potencial químico no estado padrão do componente i. O estado padrão normalmente é denominado como sendo o sistema que existe quando i tem atividade unitária a 1 atm de pressão e 25 o C. 3. Condições de equilíbrio químico O equilíbrio químico é uma das aplicações mais importantes da termodinâmica. Quando se diz que o sistema está em estado de equilíbrio, isto quer dizer que o sistema está em estado de descanso, e processos dinâmicos ocorrem continuamente, isto é, para qualquer processo as velocidades no sentido direto e inverso são semelhantes, as quais asseguram que a composição total do sistema não se altera. Vários critérios podem ser estabelecidos para descrever um sistema em equilíbrio. A primeira e segunda lei da termodinâmica indica que um sistema tende a caminhar para um estado de mínima energia e máxima entropia. Estas condições devem ser, portanto satisfeitas para um sistema atingir o equilíbrio. 10
11 Um processo espontâneo ocasiona uma variação líquida positiva na entropia de um sistema. Observa-se que um sistema em equilíbrio não pode ser submetido a variações espontâneas. Portanto, a variação de entropia para qualquer processo em equilíbrio deve ser zero: ds = 0 (20) Do mesmo modo, pode ser mostrado que a variação da energia livre de Gibbs deve ser zero para qualquer processo em equilíbrio, em um sistema de composição constante sob condições isotérmicas e isobáricas: dg = 0 (21) Em um sistema fechado em equilíbrio sob condições de pressão e temperatura constantes, o potencial químico do composto i é o mesmo em todas as fases na qual i existe: µ α i = µ β i (22) onde α e β são diferentes fases do componente i. Uma fase é uma parte de um sistema onde ele é homogêneo com respeito as propriedades químicas e físicas intensivas e é separado de outras partes do sistema por bordas. Uma reação química geral pode ser representada da seguinte forma: aa + bb cc + dd (23) A interpretação desta reação é a seguinte: se a mols de substância A reagem com b mols de substância B, podem ser formados c mols de substância C e d mols de substância D. Observa-se que nesta reação química não há nenhuma referência às concentrações ou quantidades presentes dos componentes envolvidos na reação. Da mesma forma, pode-se imaginar qualquer número finito de reagentes ou produtos. Para qualquer reação química existe um ponto de equilíbrio no qual não há tendência da reação prosseguir ou regredir. Embora o ponto de equilíbrio da maioria das reações químicas 11
12 esteja muito deslocado para o lado direito ou para o lado esquerdo da reação, o ponto verdadeiro de equilíbrio pode ser calculado. da ação das massas: Uma constante de equilíbrio, K, pode ser obtida para a equação geral, aplicando a lei [C] c [D] d K = ) [A] a [B] b Constantes termodinâmicas de equilíbrio também podem ser obtidas. A energia livre de Gibbs para um componente i pode ser expresso em termos de atividade usando a equação: G i = G o i + RT ln a i (25) são: Portanto, as energias livres de Gibbs para os constituintes da reação geral dada acima ag A = ag o A + art ln a A (26) bg B = bg o B + brt ln a B (27) cg C = cg o C + crt ln a C (28) dg D = dg o D + drt ln a D (29) A variação da energia de Gibbs para esta reação é: G = cg C + dg D - ag A - bg B (30) ac c ad d G = cg o C + dg o D - ag o A - bg o B + RT ln (31) aa a ab b A energia livre padrão de Gibbs para a reação é definida como: 12
13 G o = cg o C + dg o D - ag o A - bg o B (32) Para um sistema em equilíbrio, G = 0, resulta em: ac c ad d - G o = RT ln (33) aa a ab b como G o é constante para uma dada temperatura e pressão, esta expressão se torna: G o = - RT ln K (34) onde a constante de equilíbrio, K, é dada como: ac c ad d K = (35) aa a ab b Com a finalidade de calcular constantes de equilíbrio através de valores tabulados de termodinâmica, a seguinte equação pode ser utilizada: - G o log K = (36) 2,303 RT 13
Universidade Federal do Ceará Centro de Ciências Departamento de Bioquímica e Biologia Molecular Disciplina de Biofísica.
 Universidade Federal do Ceará Centro de Ciências Departamento de Bioquímica e Biologia Molecular Disciplina de Biofísica Termodinâmica 1. Introdução 2. Conceitos Importantes em Termodinâmica 3. Leis da
Universidade Federal do Ceará Centro de Ciências Departamento de Bioquímica e Biologia Molecular Disciplina de Biofísica Termodinâmica 1. Introdução 2. Conceitos Importantes em Termodinâmica 3. Leis da
TERMODINÂMICA TERMOQUÍMICA
 TERMODINÂMICA TERMOQUÍMICA Termodinâmica é a ciência que estuda as transformações de energia nas quais as variações de temperatura são importantes. A maioria das transformações químicas resulta em alterações
TERMODINÂMICA TERMOQUÍMICA Termodinâmica é a ciência que estuda as transformações de energia nas quais as variações de temperatura são importantes. A maioria das transformações químicas resulta em alterações
Termodinâmica. Termodinâmica é o estudo das mudanças de energia que acompanham os processos físicos e químicos. QUÍMICA GERAL Fundamentos
 Termodinâmica é o estudo das mudanças de energia que acompanham os processos físicos e químicos 1 Calor e Trabalho Calor e trabalho são formas relacionadas de energia Calor pode ser convertido em trabalho
Termodinâmica é o estudo das mudanças de energia que acompanham os processos físicos e químicos 1 Calor e Trabalho Calor e trabalho são formas relacionadas de energia Calor pode ser convertido em trabalho
Capítulo 18 Entropia, Energia de Gibbs e Equilíbrio
 Capítulo 18 Entropia, Energia de Gibbs e Equilíbrio As Três Leis da Termodinâmica Processos Espontâneos Entropia A Segunda Lei da Termodinâmica Energia de Gibbs Energia de Gibbs e Equilíbrio Químico Termodinâmica
Capítulo 18 Entropia, Energia de Gibbs e Equilíbrio As Três Leis da Termodinâmica Processos Espontâneos Entropia A Segunda Lei da Termodinâmica Energia de Gibbs Energia de Gibbs e Equilíbrio Químico Termodinâmica
TERMODINÂMICA TERMOQUÍMICA
 TERMODINÂMICA TERMOQUÍMICA Termodinâmica é a ciência que estuda as transformações de energia nas quais as variações de temperatura são importantes. A maioria das transformações químicas resulta em alterações
TERMODINÂMICA TERMOQUÍMICA Termodinâmica é a ciência que estuda as transformações de energia nas quais as variações de temperatura são importantes. A maioria das transformações químicas resulta em alterações
Entropia e energia livre de Gibbs. Prof. Leandro Zatta
 Entropia e energia livre de Gibbs Prof. Leandro Zatta 1 Segunda e a terceira leis Ideias importantes Sentido Natural Desordem Medido por Energia livre de Gibbs 2 Chave para compreensão da ocorrência ou
Entropia e energia livre de Gibbs Prof. Leandro Zatta 1 Segunda e a terceira leis Ideias importantes Sentido Natural Desordem Medido por Energia livre de Gibbs 2 Chave para compreensão da ocorrência ou
Diagramas de Energia
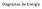 Diagramas de Energia 1.1- Análise Gráfica Reação exotérmica Reação endotérmica (a) Energia de ativação (Ea) para a reação inversa (b) Energia de ativação (Ea) para a reação direta (c) ΔH 1.2- Entropia
Diagramas de Energia 1.1- Análise Gráfica Reação exotérmica Reação endotérmica (a) Energia de ativação (Ea) para a reação inversa (b) Energia de ativação (Ea) para a reação direta (c) ΔH 1.2- Entropia
TERMODINÂMICA TERMOQUÍMICA
 Termodinâmica é a ciência que estuda as transformações de energia nas quais as variações de temperatura são importantes. A maioria das transformações químicas resulta em alterações nas temperaturas e,
Termodinâmica é a ciência que estuda as transformações de energia nas quais as variações de temperatura são importantes. A maioria das transformações químicas resulta em alterações nas temperaturas e,
Fisica do Corpo Humano ( ) Prof. Adriano Mesquita Alencar Dep. Física Geral Instituto de Física da USP B01. Temperatura Aula 5 e 1/2 da 6
 Fisica do Corpo Humano (4300325) Prof. Adriano Mesquita Alencar Dep. Física Geral Instituto de Física da USP B01 Temperatura Aula 5 e 1/2 da 6 1. Existem em torno de uma centena de átomos 2. Cada átomo
Fisica do Corpo Humano (4300325) Prof. Adriano Mesquita Alencar Dep. Física Geral Instituto de Física da USP B01 Temperatura Aula 5 e 1/2 da 6 1. Existem em torno de uma centena de átomos 2. Cada átomo
Entropia. Energia de Gibbs e Equilíbrio
 Entropia Energia de Gibbs e Equilíbrio Mestrado integrado em Engenharia Biológica Disciplina Química II, 2º semestre 2009/10 Professsora Ana Margarida Martins TRANSFORMAÇÕES ESPONTÂNEAS Uma reacção diz-se
Entropia Energia de Gibbs e Equilíbrio Mestrado integrado em Engenharia Biológica Disciplina Química II, 2º semestre 2009/10 Professsora Ana Margarida Martins TRANSFORMAÇÕES ESPONTÂNEAS Uma reacção diz-se
A Primeira Lei da Termodinâmica. Energia. U = variação na energia de um sistema U = U final -U inicial
 Química Aplicada à Engenharia Civil Termodinâmica Química Continuação Profa. Geisamanda Pedrini Brandão Athayde Revisão Calor Sistema ganha calor Æ q > 0 Æ Processo Endotérmico Sistema perde calor Æ q
Química Aplicada à Engenharia Civil Termodinâmica Química Continuação Profa. Geisamanda Pedrini Brandão Athayde Revisão Calor Sistema ganha calor Æ q > 0 Æ Processo Endotérmico Sistema perde calor Æ q
BCL 0307 Transformações Químicas
 BCL 0307 Transformações Químicas Prof. Dr. André Sarto Polo Bloco B S. 1014 ou L202 andre.polo@ufabc.edu.br Aula 06 http://pesquisa.ufabc.edu.br/pologroup/transformacoes_quimicas.html Ciclo termodinâmico
BCL 0307 Transformações Químicas Prof. Dr. André Sarto Polo Bloco B S. 1014 ou L202 andre.polo@ufabc.edu.br Aula 06 http://pesquisa.ufabc.edu.br/pologroup/transformacoes_quimicas.html Ciclo termodinâmico
SISTEMAS DE COMPOSIÇÃO VARIÁVEL EQUILÍBRIO QUÍMICO
 ESCOLA DE ENGENHARIA DE LORENA EEL/USP TERMODINÂMICA QUÍMICA PROF. ANTONIO CARLOS DA SILVA SISTEMAS DE COMPOSIÇÃO VARIÁVEL EQUILÍBRIO QUÍMICO 1. EQUAÇÃO FUNDAMENTAL DA ENERGIA DE GIBBS Para uma substância
ESCOLA DE ENGENHARIA DE LORENA EEL/USP TERMODINÂMICA QUÍMICA PROF. ANTONIO CARLOS DA SILVA SISTEMAS DE COMPOSIÇÃO VARIÁVEL EQUILÍBRIO QUÍMICO 1. EQUAÇÃO FUNDAMENTAL DA ENERGIA DE GIBBS Para uma substância
Equilíbrio Químico. Estágio da reação química em que não existe mais tendência a mudar a composição da mistura de uma reação
 Equilíbrio Químico 1 Equilíbrio Químico Estágio da reação química em que não existe mais tendência a mudar a composição da mistura de uma reação Equilíbrio dinâmico: as reações direta e inversa ocorrem
Equilíbrio Químico 1 Equilíbrio Químico Estágio da reação química em que não existe mais tendência a mudar a composição da mistura de uma reação Equilíbrio dinâmico: as reações direta e inversa ocorrem
Termoquímica. Iniciação à Química II. Prof. Edson Nossol
 Termoquímica Iniciação à Química II Prof. Edson Nossol Uberlândia, 20/10/2017 Energia de ligação (dissociação): energia necessária para romper a ligação H (entalpia de ligação): variação de calor que acompanha
Termoquímica Iniciação à Química II Prof. Edson Nossol Uberlândia, 20/10/2017 Energia de ligação (dissociação): energia necessária para romper a ligação H (entalpia de ligação): variação de calor que acompanha
QB70C:// Química (Turmas S71/S72) Termodinâmica. Prof. Dr. Eduard Westphal ( Capítulo 8 Atkins (5ª ed.
 QB70C:// Química (Turmas S71/S72) Termodinâmica Prof. Dr. Eduard Westphal (http://paginapessoal.utfpr.edu.br/eduardw) Capítulo 8 Atkins (5ª ed.) Entalpia Em um sistema rígido (onde não exista outra forma
QB70C:// Química (Turmas S71/S72) Termodinâmica Prof. Dr. Eduard Westphal (http://paginapessoal.utfpr.edu.br/eduardw) Capítulo 8 Atkins (5ª ed.) Entalpia Em um sistema rígido (onde não exista outra forma
Primeira Lei da Termodinâmica
 Físico-Química I Profa. Dra. Carla Dalmolin Primeira Lei da Termodinâmica Definição de energia, calor e trabalho Trabalho de expansão Trocas térmicas Entalpia Termodinâmica Estudo das transformações de
Físico-Química I Profa. Dra. Carla Dalmolin Primeira Lei da Termodinâmica Definição de energia, calor e trabalho Trabalho de expansão Trocas térmicas Entalpia Termodinâmica Estudo das transformações de
Termodinâmica em Bioquímica
 Instituto de Química de São Carlos IQSC Universidade de São Paulo Termodinâmica em Bioquímica Disciplina: Bioquímica I Docente: Profa. Dra. Fernanda Canduri Sugestão de leitura: Cap. 1 do Lehninger A vida
Instituto de Química de São Carlos IQSC Universidade de São Paulo Termodinâmica em Bioquímica Disciplina: Bioquímica I Docente: Profa. Dra. Fernanda Canduri Sugestão de leitura: Cap. 1 do Lehninger A vida
Termodinâmica II. Tecnologia e Processos
 Termodinâmica II Tecnologia e Processos Geral Estudadas nos gases Propriedades termodinâmicas A temperatura (T) A pressão (P) O volume (V) A densidade ( ) = m / V O calor específico a volume constante
Termodinâmica II Tecnologia e Processos Geral Estudadas nos gases Propriedades termodinâmicas A temperatura (T) A pressão (P) O volume (V) A densidade ( ) = m / V O calor específico a volume constante
TERMODINÂMICA QUÍMICA
 TERMODINÂMICA QUÍMICA Processos Espontâneos 1ª Lei da termodinâmica: Energia de um sistema é conservada ΔE = variação da energia interna q = calor absorvido pelo sistema w = trabalho realizado pela vizinhança
TERMODINÂMICA QUÍMICA Processos Espontâneos 1ª Lei da termodinâmica: Energia de um sistema é conservada ΔE = variação da energia interna q = calor absorvido pelo sistema w = trabalho realizado pela vizinhança
FUNÇÕES DE ESTADO TERMODINÂMICAS: ENTALPIA E ENERGIA LIVRE Parte 2
 FUNÇÕES DE ESTADO TERMODINÂMICAS: ENTALPIA E ENERGIA LIVRE Parte 2 [texto baseado nas seções 3.5, 3.6 e 3.9 de Physical Chemistry, P. Atkins e J. de Paula, Freeman 2006] As energias livres de Helmholtz
FUNÇÕES DE ESTADO TERMODINÂMICAS: ENTALPIA E ENERGIA LIVRE Parte 2 [texto baseado nas seções 3.5, 3.6 e 3.9 de Physical Chemistry, P. Atkins e J. de Paula, Freeman 2006] As energias livres de Helmholtz
UNIVERSIDADE FEDERAL DO RIO DE JANEIRO UFRJ INSTITUTO DE QUÍMICA IQG127. Termodinâmica
 UNIVERSIDADE FEDERAL DO RIO DE JANEIRO UFRJ INSTITUTO DE QUÍMICA IQG127 Termodinâmica Prof. Antonio Guerra Departamento de Química Geral e Inorgânica - DQI Energia e Trabalho Energia A capacidade de realizar
UNIVERSIDADE FEDERAL DO RIO DE JANEIRO UFRJ INSTITUTO DE QUÍMICA IQG127 Termodinâmica Prof. Antonio Guerra Departamento de Química Geral e Inorgânica - DQI Energia e Trabalho Energia A capacidade de realizar
Termodinâmica Química
 Termodinâmica Química Prof. Alex Fabiano C. Campos, Dr Naturezas de Energias Energia cinética é a energia do movimento (translacional, vibracional e rotacional). Energia potencial é a energia que um objeto
Termodinâmica Química Prof. Alex Fabiano C. Campos, Dr Naturezas de Energias Energia cinética é a energia do movimento (translacional, vibracional e rotacional). Energia potencial é a energia que um objeto
ELETROQUÍMICA. Prof a. Dr a. Carla Dalmolin
 ELETROQUÍMICA Prof a. Dr a. Carla Dalmolin CONCEITOS BÁSICOS Eletroquímica Fenômenos químicos associados à transferência de cargas elétricas Duas semi-reações de transferência de carga em direções opostas
ELETROQUÍMICA Prof a. Dr a. Carla Dalmolin CONCEITOS BÁSICOS Eletroquímica Fenômenos químicos associados à transferência de cargas elétricas Duas semi-reações de transferência de carga em direções opostas
Energia de Gibbs. T e P ctes. = ΔS sistema - ΔH sistema / T 0 = 0 reversível > 0 espontâneo Multiplica por ( -T )
 Energia de Gibbs ΔS total = ΔS sistema + ΔS viz T e P ctes = ΔS sistema + ΔH viz / T = ΔS sistema - ΔH sistema / T 0 = 0 reversível > 0 espontâneo Multiplica por ( -T ) -TΔS total = ΔH sistema - TΔS sistema
Energia de Gibbs ΔS total = ΔS sistema + ΔS viz T e P ctes = ΔS sistema + ΔH viz / T = ΔS sistema - ΔH sistema / T 0 = 0 reversível > 0 espontâneo Multiplica por ( -T ) -TΔS total = ΔH sistema - TΔS sistema
Universidade Federal do ABC. Disciplina: Transformações Químicas. Equilíbrio Químico. Hueder Paulo M. de Oliveira. Santo André - SP 2018.
 Universidade Federal do ABC Disciplina: Transformações Químicas Equilíbrio Químico Hueder Paulo M. de Oliveira Santo André - SP 2018.1 EQUILÍBRIO QUÍMICO Transformação Química: É o processo de mudança
Universidade Federal do ABC Disciplina: Transformações Químicas Equilíbrio Químico Hueder Paulo M. de Oliveira Santo André - SP 2018.1 EQUILÍBRIO QUÍMICO Transformação Química: É o processo de mudança
Físico-Química I. Profa. Dra. Carla Dalmolin. Misturas Simples. Termodinâmica das Misturas Propriedades das Soluções Atividade
 Físico-Química I Profa. Dra. Carla Dalmolin Misturas Simples Termodinâmica das Misturas Propriedades das Soluções Atividade Misturas Simples Misturas de substâncias que não reagem Modelo simples para posteriormente
Físico-Química I Profa. Dra. Carla Dalmolin Misturas Simples Termodinâmica das Misturas Propriedades das Soluções Atividade Misturas Simples Misturas de substâncias que não reagem Modelo simples para posteriormente
PROFª. KAÍZA CAVALCANTI
 Processos Químicos Quando ocorre uma alteração qualitativa do sistema, dos tipos de substâncias presentes ou de suas proporções. Processos Físicos Quando ocorre uma alteração qualitativa do sistema, dos
Processos Químicos Quando ocorre uma alteração qualitativa do sistema, dos tipos de substâncias presentes ou de suas proporções. Processos Físicos Quando ocorre uma alteração qualitativa do sistema, dos
Propriedades termodinâmicas e a temperatura
 Propriedades termodinâmicas e a temperatura Miguel Almeida 1 Introdução Algo que se percebe no estudo da termodinâmica é que todas as propriedades dependem da temperatura em que o sistema analisado se
Propriedades termodinâmicas e a temperatura Miguel Almeida 1 Introdução Algo que se percebe no estudo da termodinâmica é que todas as propriedades dependem da temperatura em que o sistema analisado se
Termodinâmica 26. Alexandre Diehl. Departamento de Física - UFPel
 Termodinâmica 26 Alexandre Diehl Departamento de Física - UFPel Sistema termodinâmico mecanicamente isolado O sistema A está em contato térmico (parede diatérmica) com um reservatório r. Sistema A tem
Termodinâmica 26 Alexandre Diehl Departamento de Física - UFPel Sistema termodinâmico mecanicamente isolado O sistema A está em contato térmico (parede diatérmica) com um reservatório r. Sistema A tem
FCAV/ UNESP NOÇÕES DE TERMODINÂMICA
 FCAV/ UNESP NOÇÕES DE TERMODINÂMICA Profa. Dra. Luciana Maria Saran 1 1.TERMODINÂMICA Compreende o estudo da energia e suas transformações. Em grego, thérme-; calor, dy namis, energia. Termoquímica: área
FCAV/ UNESP NOÇÕES DE TERMODINÂMICA Profa. Dra. Luciana Maria Saran 1 1.TERMODINÂMICA Compreende o estudo da energia e suas transformações. Em grego, thérme-; calor, dy namis, energia. Termoquímica: área
Equilíbrio Químico. Capítulo 14
 Capítulo 14 Equilíbrio Químico Conceito de Equilíbrio e de Constante de Equilíbrio Expressões para a Constante de Equilíbrio Relação entre Cinética Química e Equilíbrio Químico Que Informação nos Dá a
Capítulo 14 Equilíbrio Químico Conceito de Equilíbrio e de Constante de Equilíbrio Expressões para a Constante de Equilíbrio Relação entre Cinética Química e Equilíbrio Químico Que Informação nos Dá a
MÓDULOS 37 E 38 QUÍMICA. Termodinâmica I e II. Ciências da Natureza, Matemática e suas Tecnologias. 1. Trabalho de expansão à pressão constante
 Ciências da Natureza, Matemática e suas Tecnologias QUÍMICA MÓDULOS 37 E 38 Termodinâmica I e II 1. Trabalho de expansão à pressão constante Vamos considerar um gás aprisionado em um cilindro com pistão
Ciências da Natureza, Matemática e suas Tecnologias QUÍMICA MÓDULOS 37 E 38 Termodinâmica I e II 1. Trabalho de expansão à pressão constante Vamos considerar um gás aprisionado em um cilindro com pistão
Um dos grandes problemas mundiais é constante necessidade de geração de energia.
 Termoquímica 1 2 Introdução Um dos grandes problemas mundiais é constante necessidade de geração de energia. A Termoquímica possibilita uma solução viável (econômica e ecológica) para esta crescente demanda.
Termoquímica 1 2 Introdução Um dos grandes problemas mundiais é constante necessidade de geração de energia. A Termoquímica possibilita uma solução viável (econômica e ecológica) para esta crescente demanda.
Química Aplicada EQUILÍBRIO QUÍMICO
 Química Aplicada EQUILÍBRIO QUÍMICO Equilíbrio Químico Todas as reações tendem alcançar o equilíbrio químico Quando as velocidades das reações direta e inversa forem iguais e as concentrações dos reagentes
Química Aplicada EQUILÍBRIO QUÍMICO Equilíbrio Químico Todas as reações tendem alcançar o equilíbrio químico Quando as velocidades das reações direta e inversa forem iguais e as concentrações dos reagentes
Termodinâmica de Sistemas Biológicos
 Aula de Bioquímica I Tema: Termodinâmica de Sistemas Biológicos Prof. Dr. Júlio César Borges Depto. de Química e Física Molecular DQFM Instituto de Química de São Carlos IQSC Universidade de São Paulo
Aula de Bioquímica I Tema: Termodinâmica de Sistemas Biológicos Prof. Dr. Júlio César Borges Depto. de Química e Física Molecular DQFM Instituto de Química de São Carlos IQSC Universidade de São Paulo
Capítulo by Pearson Education
 QUÍMICA A Ciência Central 9ª Edição Termodinâmica química David P. White Processos espontâneos A termodinâmica está relacionada com a pergunta: uma reação pode ocorrer? A primeira lei de termodinâmica:
QUÍMICA A Ciência Central 9ª Edição Termodinâmica química David P. White Processos espontâneos A termodinâmica está relacionada com a pergunta: uma reação pode ocorrer? A primeira lei de termodinâmica:
EQUILÍBRIO QUÍMICO MOLECULAR
 EQUILÍBRIO QUÍMICO MOLECULAR Profº Enéas Torricelli 1 Equilíbrio químico é uma reação reversível na qual a velocidade da reação direta é igual à da reação inversa e, conseqüentemente, as concentrações
EQUILÍBRIO QUÍMICO MOLECULAR Profº Enéas Torricelli 1 Equilíbrio químico é uma reação reversível na qual a velocidade da reação direta é igual à da reação inversa e, conseqüentemente, as concentrações
ENSINO MÉDIO QUÍMICA
 ENSINO MÉDIO QUÍMICA TERMOQUÍMICA TERMOQUÍMICA Termoquímica é a parte da química que estuda o calor associado a uma reação química. A unidade usada para medir a energia liberada ou absorvida por um sistema
ENSINO MÉDIO QUÍMICA TERMOQUÍMICA TERMOQUÍMICA Termoquímica é a parte da química que estuda o calor associado a uma reação química. A unidade usada para medir a energia liberada ou absorvida por um sistema
Fisica do Calor ( ) Prof. Adriano Mesquita Alencar Dep. Física Geral Instituto de Física da USP B03. Primeira Lei da Termodinâmica
 Fisica do Calor (4300159) Prof. Adriano Mesquita Alencar Dep. Física Geral Instituto de Física da USP B03 Primeira Lei da Termodinâmica Data Programa do curso August 9 August 12 August 16 August 19 August
Fisica do Calor (4300159) Prof. Adriano Mesquita Alencar Dep. Física Geral Instituto de Física da USP B03 Primeira Lei da Termodinâmica Data Programa do curso August 9 August 12 August 16 August 19 August
TERMODINÂMICA (Parte 1)
 TERMODINÂMICA (Parte 1) Estudo das transformações da energia. Baseia-se em duas leis: 1ª Lei: acompanha as variações de energia e permite o cálculo da quantidade de calor produzida numa reação. 2ª Lei:
TERMODINÂMICA (Parte 1) Estudo das transformações da energia. Baseia-se em duas leis: 1ª Lei: acompanha as variações de energia e permite o cálculo da quantidade de calor produzida numa reação. 2ª Lei:
EQUILÍBRIO QUÍMICO. Profa. Marcia M. Meier QUÍMICA GERAL II
 EQUILÍBRIO QUÍMICO Profa. Marcia M. Meier QUÍMICA GERAL II EQUILÍBRIO QUÍMICO Galo meteorológico, muda de cor em função da umidade do ambiente. EQUILÍBRIO QUÍMICO Quando queimamos um palito de fósforo,
EQUILÍBRIO QUÍMICO Profa. Marcia M. Meier QUÍMICA GERAL II EQUILÍBRIO QUÍMICO Galo meteorológico, muda de cor em função da umidade do ambiente. EQUILÍBRIO QUÍMICO Quando queimamos um palito de fósforo,
corresponde a força que se aplica ao corpo, para provocar um deslocamento. ( = F x Δe)
 Energia: é a capacidade de realizar trabalho Trabalho ( ): corresponde a força que se aplica ao corpo, para provocar um deslocamento. ( = F x Δe) Os sistemas não possuem calor ou trabalho. Essas modalidades
Energia: é a capacidade de realizar trabalho Trabalho ( ): corresponde a força que se aplica ao corpo, para provocar um deslocamento. ( = F x Δe) Os sistemas não possuem calor ou trabalho. Essas modalidades
BCL 0307 Transformações Químicas
 BCL 0307 Transformações Químicas Prof. Dr. André Sarto Polo Bloco B S. 1014 ou L202 andre.polo@ufabc.edu.br Aula 10 http://pesquisa.ufabc.edu.br/pologroup/transformacoes_quimicas.html Para saber a concentração
BCL 0307 Transformações Químicas Prof. Dr. André Sarto Polo Bloco B S. 1014 ou L202 andre.polo@ufabc.edu.br Aula 10 http://pesquisa.ufabc.edu.br/pologroup/transformacoes_quimicas.html Para saber a concentração
Profª Eleonora Slide de aula. Revisão: Termodinâmica e Bioenergética
 Revisão: Termodinâmica e Bioenergética Revisão:Termodinâmica As leis da termodinâmica governam o comportamento de s bioquímicos As leis da termodinâmica são princípios gerais aplicados a todos os processos
Revisão: Termodinâmica e Bioenergética Revisão:Termodinâmica As leis da termodinâmica governam o comportamento de s bioquímicos As leis da termodinâmica são princípios gerais aplicados a todos os processos
Primeira e Segunda Leis da Termodinâmica
 Primeira e Segunda Leis da Termodinâmica Estudam mudanças no estado ou condição de uma substância quando alterações na energia interna são importantes. Tipos de resultados da termodinâmica: 1 a lei relações
Primeira e Segunda Leis da Termodinâmica Estudam mudanças no estado ou condição de uma substância quando alterações na energia interna são importantes. Tipos de resultados da termodinâmica: 1 a lei relações
Segunda e Terceira Lei da Termodinâmica Entropia Energia Livre de Gibbs
 Química Geral e Inorgânica QGI0001 Eng a. de Produção e Sistemas Prof a. Dr a. Carla Dalmolin Segunda e Terceira Lei da Termodinâmica Entropia Energia Livre de Gibbs Primeira Lei da Termodinâmica U = q
Química Geral e Inorgânica QGI0001 Eng a. de Produção e Sistemas Prof a. Dr a. Carla Dalmolin Segunda e Terceira Lei da Termodinâmica Entropia Energia Livre de Gibbs Primeira Lei da Termodinâmica U = q
Segunda Lei da Termodinâmica
 Físico-Química I Profa. Dra. Carla Dalmolin Segunda Lei da Termodinâmica Espontaneidade das reações químicas Entropia Terceira Lei da Termodinâmica Primeira Lei da Termodinâmica Estabelece que as transformações
Físico-Química I Profa. Dra. Carla Dalmolin Segunda Lei da Termodinâmica Espontaneidade das reações químicas Entropia Terceira Lei da Termodinâmica Primeira Lei da Termodinâmica Estabelece que as transformações
Prof. Dr. Jeverson Teodoro Arantes Junior Engenharia de Materiais
 EN2815 Termodinâmica Estatística de Materiais Prof. Dr. Jeverson Teodoro Arantes Junior Engenharia de Materiais Para um N (número de partículas) fixo, uma equação de estado genérica, para vários gases,
EN2815 Termodinâmica Estatística de Materiais Prof. Dr. Jeverson Teodoro Arantes Junior Engenharia de Materiais Para um N (número de partículas) fixo, uma equação de estado genérica, para vários gases,
Equilíbrio é um estado em que não há mudanças observáveis, com passar do tempo.
 Equilíbrio Químico Equilíbrio é um estado em que não há mudanças observáveis, com passar do tempo. Equilíbrio químico é alcançado quando: as taxas das reações direta e inversa são iguais e não são iguais
Equilíbrio Químico Equilíbrio é um estado em que não há mudanças observáveis, com passar do tempo. Equilíbrio químico é alcançado quando: as taxas das reações direta e inversa são iguais e não são iguais
QUÍMICA GERAL Termodinâmica: 2a e 3a Leis
 QUÍMICA GERAL Termodinâmica: 2a e 3a Leis Prof. Dr. Anselmo E. de Oliveira Instituto de Química, UFG anselmo.quimica.ufg.br anselmo.disciplinas@gmail.com 14 de Setembro de 2018 Agronomia Entropia 1 Entropia
QUÍMICA GERAL Termodinâmica: 2a e 3a Leis Prof. Dr. Anselmo E. de Oliveira Instituto de Química, UFG anselmo.quimica.ufg.br anselmo.disciplinas@gmail.com 14 de Setembro de 2018 Agronomia Entropia 1 Entropia
Equilíbrio Químico. Prof. Alex Fabiano C. Campos. Processos Reversíveis e Irreversíveis
 Equilíbrio Químico Prof. Alex Fabiano C. Campos Processos Reversíveis e Irreversíveis Algumas reações são irreversíveis, ou seja, uma vez obtidos os produtos não há previsão espontânea de regeneração dos
Equilíbrio Químico Prof. Alex Fabiano C. Campos Processos Reversíveis e Irreversíveis Algumas reações são irreversíveis, ou seja, uma vez obtidos os produtos não há previsão espontânea de regeneração dos
Profª. Drª. Ana Cláudia Kasseboehmer Monitor: Israel Rosalino
 Universidade de São Paulo Instituto de Química de São Carlos Departamento de Físico-Química Laboratório de Investigações em Ensino de Ciências Naturais Profª. Drª. Ana Cláudia Kasseboehmer claudiaka@iqsc.usp.br
Universidade de São Paulo Instituto de Química de São Carlos Departamento de Físico-Química Laboratório de Investigações em Ensino de Ciências Naturais Profª. Drª. Ana Cláudia Kasseboehmer claudiaka@iqsc.usp.br
Equilíbrio Químico 01/02/2013
 01/02/2013 EQUILÍBRIO QUÍMICO Plano de Aula Objetivos Compreender a natureza e as características dos equilíbrios químicos; Compreender o significado da constante de equilíbrio, K; Compreender a utilização
01/02/2013 EQUILÍBRIO QUÍMICO Plano de Aula Objetivos Compreender a natureza e as características dos equilíbrios químicos; Compreender o significado da constante de equilíbrio, K; Compreender a utilização
Aula 04: Revisão de Conceitos Fundamentais da Termodinâmica dos Materiais
 Disciplina : - MFI Professores: Guilherme Ourique Verran - Dr. Eng. Metalúrgica Aula 04: Revisão de Conceitos Fundamentais da Termodinâmica dos Materiais Conceitos: sistema, fases, componentes, constituintes,
Disciplina : - MFI Professores: Guilherme Ourique Verran - Dr. Eng. Metalúrgica Aula 04: Revisão de Conceitos Fundamentais da Termodinâmica dos Materiais Conceitos: sistema, fases, componentes, constituintes,
N 2 O 4(g) 2NO 2(g) incolor castanho
 Equilíbrios Químicos Conceito de equilíbrio químico Primeira experiência N 2 O 4(g) 2NO 2(g) incolor castanho Análise microscópica N 2 O 4(g) 2NO 2(g) incolor castanho Pela reação: 1 mol de N 2 O 4 2 mols
Equilíbrios Químicos Conceito de equilíbrio químico Primeira experiência N 2 O 4(g) 2NO 2(g) incolor castanho Análise microscópica N 2 O 4(g) 2NO 2(g) incolor castanho Pela reação: 1 mol de N 2 O 4 2 mols
MÓDULOS 37 E 38 QUÍMICA. Termodinâmica I e II. Ciências da Natureza, Matemática e suas Tecnologias. 1. Trabalho de expansão à pressão constante
 Ciências da Natureza, Matemática e suas Tecnologias QUÍMICA MÓDULOS 37 E 38 Termodinâmica I e II 1. Trabalho de expansão à pressão constante Vamos considerar um gás aprisionado em um cilindro com pistão
Ciências da Natureza, Matemática e suas Tecnologias QUÍMICA MÓDULOS 37 E 38 Termodinâmica I e II 1. Trabalho de expansão à pressão constante Vamos considerar um gás aprisionado em um cilindro com pistão
Apresentar as aplicações conjuntas do primeiro e do segundo princípio; apresentar as equações fundamentais da termodinâmica.
 ENERGIA LIVRE E POTENCIAL QUÍMICO Metas Apresentar as aplicações conjuntas do primeiro e do segundo princípio; apresentar as equações fundamentais da termodinâmica. Objetivos Ao final desta aula, o aluno
ENERGIA LIVRE E POTENCIAL QUÍMICO Metas Apresentar as aplicações conjuntas do primeiro e do segundo princípio; apresentar as equações fundamentais da termodinâmica. Objetivos Ao final desta aula, o aluno
Físico-Química I. Profa. Dra. Carla Dalmolin. Misturas Simples. Físico-Química, cap. 5: Transformações Físicas de Substâncias Puras
 Físico-Química I Profa. Dra. Carla Dalmolin Misturas Simples Físico-Química, cap. 5: Transformações Físicas de Substâncias Puras Misturas Simples Misturas de substâncias que não reagem Modelo simples para
Físico-Química I Profa. Dra. Carla Dalmolin Misturas Simples Físico-Química, cap. 5: Transformações Físicas de Substâncias Puras Misturas Simples Misturas de substâncias que não reagem Modelo simples para
Aula EQUILÍBRIO QUÍMICO METAS
 EQUILÍBRIO QUÍMICO METAS Apresentar o conceito de equilíbrio químico; apresentar a constante de equilibrio; apresentar o princípio de lê Châtelier; apresentar atividade e coeficiente de atividade. OBJETIVOS
EQUILÍBRIO QUÍMICO METAS Apresentar o conceito de equilíbrio químico; apresentar a constante de equilibrio; apresentar o princípio de lê Châtelier; apresentar atividade e coeficiente de atividade. OBJETIVOS
Princípios de equilíbrio químico
 Princípios de equilíbrio químico https://pt.wikipedia.org/wiki/fenolftale%c3%adna Processos irreversíveis: ΔG = ΔH TΔS < 0 2a Lei da TD: ΔS universo = ΔS sistema ΔS vizinhança > 0 Macroscopicamente
Princípios de equilíbrio químico https://pt.wikipedia.org/wiki/fenolftale%c3%adna Processos irreversíveis: ΔG = ΔH TΔS < 0 2a Lei da TD: ΔS universo = ΔS sistema ΔS vizinhança > 0 Macroscopicamente
Primeira Lei da Termodinâmica
 Físico-Química I Profa. Dra. Carla Dalmolin Primeira Lei da Termodinâmica Definição de energia, calor e trabalho Trocas térmicas Entalpia e termoquímica Termodinâmica Estudo das transformações de energia
Físico-Química I Profa. Dra. Carla Dalmolin Primeira Lei da Termodinâmica Definição de energia, calor e trabalho Trocas térmicas Entalpia e termoquímica Termodinâmica Estudo das transformações de energia
N 2 O 4 (g) 2 NO 2 (g) [ ] Para T=298 K. tempo
![N 2 O 4 (g) 2 NO 2 (g) [ ] Para T=298 K. tempo N 2 O 4 (g) 2 NO 2 (g) [ ] Para T=298 K. tempo](/thumbs/71/65187689.jpg) Equilíbrio Químico N 2 O 4 (g) 2 NO 2 (g) [ ] [ N O ] 2 4 2 NO 2 cte = 4.63x10 3 Concentração Concentração tempo Para T=298 K Concentração 2 SO 2 (g) + O 2 (g) 2 SO 3 (g) 2 [ SO ] [SO 2 ] / mol dm -3 [O
Equilíbrio Químico N 2 O 4 (g) 2 NO 2 (g) [ ] [ N O ] 2 4 2 NO 2 cte = 4.63x10 3 Concentração Concentração tempo Para T=298 K Concentração 2 SO 2 (g) + O 2 (g) 2 SO 3 (g) 2 [ SO ] [SO 2 ] / mol dm -3 [O
CAPÍTULO 6 Princípios de mínimo nas representações de Legendre
 UFABC - BC0205 Princípios de Termodinâmica - Curso 2015.2 Prof. Germán Lugones Composition, Piet Mondrian (1916) CAPÍTULO 6 Princípios de mínimo nas representações de Legendre o A transformação de Legendre
UFABC - BC0205 Princípios de Termodinâmica - Curso 2015.2 Prof. Germán Lugones Composition, Piet Mondrian (1916) CAPÍTULO 6 Princípios de mínimo nas representações de Legendre o A transformação de Legendre
Aula 02 : EM-524. Capítulo 2 : Definições e Conceitos Termodinâmicos
 Aula 02 : EM-524 Capítulo 2 : Definições e Conceitos Termodinâmicos 1. Termodinâmica Clássica; 2. Sistema Termodinâmico; 3. Propriedades Termodinâmicas; 4. As propriedades termodinâmicas pressão, volume
Aula 02 : EM-524 Capítulo 2 : Definições e Conceitos Termodinâmicos 1. Termodinâmica Clássica; 2. Sistema Termodinâmico; 3. Propriedades Termodinâmicas; 4. As propriedades termodinâmicas pressão, volume
SIMULADO de QUÍMICA 2 os anos 2008 TODOS COLÉGIOS
 SIMULADO de QUÍMICA 2 os anos 2008 TODOS COLÉGIOS ) Foram misturados 400 mililitros de solução 0,25 molar de ácido sulfúrico com 600 mililitros,5 molar do mesmo ácido. A molaridade da solução final é:
SIMULADO de QUÍMICA 2 os anos 2008 TODOS COLÉGIOS ) Foram misturados 400 mililitros de solução 0,25 molar de ácido sulfúrico com 600 mililitros,5 molar do mesmo ácido. A molaridade da solução final é:
O processo de dissolução
 SOLUBILIDADE Sabemos que um soluto altera as propriedades do solvente. Solução sólida: silício dopado com fósforo eletrônica. indústria Sal sobre o gelo abaixa o ponto e congelamento se a temperatura é
SOLUBILIDADE Sabemos que um soluto altera as propriedades do solvente. Solução sólida: silício dopado com fósforo eletrônica. indústria Sal sobre o gelo abaixa o ponto e congelamento se a temperatura é
PAGQuímica 2011/1 Exercícios de Equilíbrio Químico
 PAGQuímica 2011/1 Exercícios de Equilíbrio Químico 1. Para o equilíbrio gasoso entre NO e O 2 formando NO 2 (2 NO (g) + O 2 (g) 2 NO 2 (g)), a constante de equilíbrio é Kc = 6,45 x 10 5. a) em que concentração
PAGQuímica 2011/1 Exercícios de Equilíbrio Químico 1. Para o equilíbrio gasoso entre NO e O 2 formando NO 2 (2 NO (g) + O 2 (g) 2 NO 2 (g)), a constante de equilíbrio é Kc = 6,45 x 10 5. a) em que concentração
TERMODINÂMICA. Radiação Solar. Anjo Albuquerque
 TERMODINÂMICA Radiação Solar 1 Anjo Albuquerque TERMODINÂMICA Termodinâmica - é a área da Física que nos permite compreender o mundo que nos rodeia, desde a escala dos átomos até à escala do universo.
TERMODINÂMICA Radiação Solar 1 Anjo Albuquerque TERMODINÂMICA Termodinâmica - é a área da Física que nos permite compreender o mundo que nos rodeia, desde a escala dos átomos até à escala do universo.
Vapor d água e seus efeitos termodinâmicos. Energia livre de Gibbs e Helmholtz Equação de Clausius Clapeyron
 Vapor d água e seus efeitos termodinâmicos Energia livre de Gibbs e Helmholtz Equação de Clausius Clapeyron Funções Termodinâmicas e condições de equilíbrio Em estados de equilíbrio todas as transformações
Vapor d água e seus efeitos termodinâmicos Energia livre de Gibbs e Helmholtz Equação de Clausius Clapeyron Funções Termodinâmicas e condições de equilíbrio Em estados de equilíbrio todas as transformações
INSTITUTO FEDERAL DE EDUCAÇÃO, CIÊNCIA E TECNOLOGIA DO RIO GRANDE DO NORTE IFRN Campus Mossoró. Equilíbrio Químico. Albino O.
 INSTITUTO FEDERAL DE EDUCAÇÃO, CIÊNCIA E TECNOLOGIA DO RIO GRANDE DO NORTE IFRN Campus Mossoró Equilíbrio Químico Albino O. Nunes SUMÁRIO OBJETIVOS; INTRODUÇÃO; DEFINIÇÃO; CONCEITOS BÁSICOS DE EQUILÍBRIO;
INSTITUTO FEDERAL DE EDUCAÇÃO, CIÊNCIA E TECNOLOGIA DO RIO GRANDE DO NORTE IFRN Campus Mossoró Equilíbrio Químico Albino O. Nunes SUMÁRIO OBJETIVOS; INTRODUÇÃO; DEFINIÇÃO; CONCEITOS BÁSICOS DE EQUILÍBRIO;
Professor Dr. Evandro Rodrigo Dário Curso: Engenharia Mecânica Disciplina: Termodinâmica. Processos reversíveis e Irreversíveis
 Processos reversíveis e Irreversíveis Um processo reversível é definido como um processo que pode ser invertida sem deixar nenhum vestígio no ambiente. Ou seja, tanto o sistema e o ambiente são devolvidos
Processos reversíveis e Irreversíveis Um processo reversível é definido como um processo que pode ser invertida sem deixar nenhum vestígio no ambiente. Ou seja, tanto o sistema e o ambiente são devolvidos
SMM0562 Termodinâmica dos Materiais. Aula 4 Equilíbrio em Sistemas Termodinâmicos
 SMM0562 Termodinâmica dos Materiais Aula 4 Equilíbrio em Sistemas Termodinâmicos Prof. Eduardo Bellini Ferreira Departamento de Engenharia de Materiais EESC/USP Noção de equilíbrio Um sistema entra em
SMM0562 Termodinâmica dos Materiais Aula 4 Equilíbrio em Sistemas Termodinâmicos Prof. Eduardo Bellini Ferreira Departamento de Engenharia de Materiais EESC/USP Noção de equilíbrio Um sistema entra em
P2 - PROVA DE QUÍMICA GERAL - 27/10/12
 P2 - PROVA DE QUÍMICA GERAL - 27/10/12 Nome: Nº de Matrícula: GABARITO Turma: Assinatura: Questão Valor Grau Revisão 1 a 2,5 2 a 2,5 3 a 2,5 4 a 2,5 Total 10,0 Dados: T (K) = T ( C) + 273,15 R = 8,314
P2 - PROVA DE QUÍMICA GERAL - 27/10/12 Nome: Nº de Matrícula: GABARITO Turma: Assinatura: Questão Valor Grau Revisão 1 a 2,5 2 a 2,5 3 a 2,5 4 a 2,5 Total 10,0 Dados: T (K) = T ( C) + 273,15 R = 8,314
Universidade Estadual do Sudoeste da Bahia
 Universidade Estadual do Sudoeste da Bahia Departamento de Estudos Básicos e Instrumentais 4 Termodinâmica Física II Ferreira 1 ÍNDICE 1. Conceitos Fundamentais; 2. Sistemas Termodinâmicos; 3. Leis da
Universidade Estadual do Sudoeste da Bahia Departamento de Estudos Básicos e Instrumentais 4 Termodinâmica Física II Ferreira 1 ÍNDICE 1. Conceitos Fundamentais; 2. Sistemas Termodinâmicos; 3. Leis da
Primeira Lei da Termodinâmica Trabalho, Calor e Energia Entalpia
 Química Geral e Inorgânica QGI0001 Eng a. de Produção e Sistemas Prof a. Dr a. Carla Dalmolin Primeira Lei da Termodinâmica Trabalho, Calor e Energia Entalpia Sistemas Em termodinâmica, o universo é formado
Química Geral e Inorgânica QGI0001 Eng a. de Produção e Sistemas Prof a. Dr a. Carla Dalmolin Primeira Lei da Termodinâmica Trabalho, Calor e Energia Entalpia Sistemas Em termodinâmica, o universo é formado
P4 - PROVA DE QUÍMICA GERAL - 28/11/09
 P4 - PROVA DE QUÍMICA GERAL - 8/11/09 Nome: GABARITO Nº de Matrícula: Turma: Assinatura: Questão Valor Grau Revisão Dados gerais: 1 a,5 a,5 3 a,5 4 a,5 Total 10,0 G o = H o - T S o G = - n F E o RT E =
P4 - PROVA DE QUÍMICA GERAL - 8/11/09 Nome: GABARITO Nº de Matrícula: Turma: Assinatura: Questão Valor Grau Revisão Dados gerais: 1 a,5 a,5 3 a,5 4 a,5 Total 10,0 G o = H o - T S o G = - n F E o RT E =
Termoquímica. Trabalho, calor e energia interna. Leis da Termodinâmica. Entalpia. Lei de Hess. Entropia. Energia livre
 Termoquímica IV Trabalho, calor e energia interna Leis da Termodinâmica Entalpia Lei de Hess Entropia Energia livre Trabalho, calor e energia interna Cada reação química obedece a duas leis fundamentais:
Termoquímica IV Trabalho, calor e energia interna Leis da Termodinâmica Entalpia Lei de Hess Entropia Energia livre Trabalho, calor e energia interna Cada reação química obedece a duas leis fundamentais:
EQUILÍBRIOS: QUÍMICO E IÔNICO Profº Jaison Mattei
 EQUILÍBRIOS: QUÍMICO E IÔNICO Profº Jaison Mattei Reações completas ou irreversíveis São reações nas quais os reagentes são totalmente convertidos em produtos, não havendo sobra de reagente, ao final da
EQUILÍBRIOS: QUÍMICO E IÔNICO Profº Jaison Mattei Reações completas ou irreversíveis São reações nas quais os reagentes são totalmente convertidos em produtos, não havendo sobra de reagente, ao final da
Capítulo 1 Vapor d água e seus efeitos termodinâmicos. Energia livre de Gibbs e Helmholtz Equação de Clausius Clapeyron
 Capítulo 1 Vapor d água e seus efeitos termodinâmicos Energia livre de Gibbs e Helmholtz Equação de Clausius Clapeyron Funções Termodinâmicas e condições de equilíbrio Em estados de equilíbrio (P,T e são
Capítulo 1 Vapor d água e seus efeitos termodinâmicos Energia livre de Gibbs e Helmholtz Equação de Clausius Clapeyron Funções Termodinâmicas e condições de equilíbrio Em estados de equilíbrio (P,T e são
Física estatística. Termodinâmica: potenciais termodinâmicos e a 3 a lei MEFT, IST
 Física estatística Termodinâmica: potenciais termodinâmicos e a 3 a lei MEFT, IST Fourth Law of Thermodynamics: If the probability of success is not almost one, then it is damn near zero. David Ellis A
Física estatística Termodinâmica: potenciais termodinâmicos e a 3 a lei MEFT, IST Fourth Law of Thermodynamics: If the probability of success is not almost one, then it is damn near zero. David Ellis A
PAG Química Equilíbrio Químico 1. Para o equilíbrio gasoso entre NO e O 2 formando NO 2 (2 NO (g) + O 2 (g) 2 NO 2 (g)), a constante de equilíbrio é
 1. Para o equilíbrio gasoso entre NO e O 2 formando NO 2 (2 NO (g) + O 2 (g) 2 NO 2 (g)), a constante de equilíbrio é Kc = 6,45 x 10 5. a) em que concentração de O 2 as concentrações de NO 2 e de NO são
1. Para o equilíbrio gasoso entre NO e O 2 formando NO 2 (2 NO (g) + O 2 (g) 2 NO 2 (g)), a constante de equilíbrio é Kc = 6,45 x 10 5. a) em que concentração de O 2 as concentrações de NO 2 e de NO são
Capítulo 3 A Segunda Lei da Termodinâmica
 Capítulo 3 A Segunda Lei da Termodinâmica 3.1 Enunciados da Lei 3.2 Máquinas Térmicas 3.3 Escalas de Temperaturas Termodinâmicas 3.4 Entropia 3.5 Variações da Entropia de um Gás Ideal 3.6 A Terceira Lei
Capítulo 3 A Segunda Lei da Termodinâmica 3.1 Enunciados da Lei 3.2 Máquinas Térmicas 3.3 Escalas de Temperaturas Termodinâmicas 3.4 Entropia 3.5 Variações da Entropia de um Gás Ideal 3.6 A Terceira Lei
FÍSICO-QUÍMICA Prof. Jackson Alves
 FÍSICO-QUÍMICA Prof. Jackson Alves TERMOQUÍMICA Parte II Entalpia e H Processos exotérmicos e endotérmicos Equações Alotropia Entalpia (H) e Variação de entalpia ( H) Entalpia: É a energia total em um
FÍSICO-QUÍMICA Prof. Jackson Alves TERMOQUÍMICA Parte II Entalpia e H Processos exotérmicos e endotérmicos Equações Alotropia Entalpia (H) e Variação de entalpia ( H) Entalpia: É a energia total em um
P2 - PROVA DE QUÍMICA GERAL - 12/05/12
 P2 - PROVA DE QUÍMICA GERAL - 12/05/12 Nome: GABARITO Nº de Matrícula: Turma: Assinatura: Questão Valor Grau Revisão 1 a 2,5 2 a 2,5 3 a 2,5 4 a 2,5 Total 10,0 Dados: T (K) = T ( C) + 273,15 R = 8,314
P2 - PROVA DE QUÍMICA GERAL - 12/05/12 Nome: GABARITO Nº de Matrícula: Turma: Assinatura: Questão Valor Grau Revisão 1 a 2,5 2 a 2,5 3 a 2,5 4 a 2,5 Total 10,0 Dados: T (K) = T ( C) + 273,15 R = 8,314
Quí. Quí. Monitor: Gabriel Pereira
 Quí. Professor: Allan Rodrigues Monitor: Gabriel Pereira Exercícios sobre Equilíbrio Químico EXERCÍCIOS 1. Para a produção de energia, os mamíferos oxidam compostos de carbono nos tecidos, produzindo dióxido
Quí. Professor: Allan Rodrigues Monitor: Gabriel Pereira Exercícios sobre Equilíbrio Químico EXERCÍCIOS 1. Para a produção de energia, os mamíferos oxidam compostos de carbono nos tecidos, produzindo dióxido
Capítulo 1 Vapor d água e seus efeitos termodinâmicos. Energia livre de Gibbs e Helmholtz Equação de Clausius Clapeyron
 Capítulo 1 Vapor d água e seus efeitos termodinâmicos Energia livre de Gibbs e Helmholtz Equação de Clausius Clapeyron Funções Termodinâmicas e condições de equilíbrio Em estados de equilíbrio (P,T e são
Capítulo 1 Vapor d água e seus efeitos termodinâmicos Energia livre de Gibbs e Helmholtz Equação de Clausius Clapeyron Funções Termodinâmicas e condições de equilíbrio Em estados de equilíbrio (P,T e são
Aula 4 A 2ª Lei da Termodinâmica
 Universidade Federal do ABC P O S M E C Aula 4 A 2ª Lei da Termodinâmica MEC202 As Leis da Termodinâmica As leis da termodinâmica são postulados básicos aplicáveis a qualquer sistema que envolva a transferência
Universidade Federal do ABC P O S M E C Aula 4 A 2ª Lei da Termodinâmica MEC202 As Leis da Termodinâmica As leis da termodinâmica são postulados básicos aplicáveis a qualquer sistema que envolva a transferência
Halliday Fundamentos de Física Volume 2
 Halliday Fundamentos de Física Volume 2 www.grupogen.com.br http://gen-io.grupogen.com.br O GEN Grupo Editorial Nacional reúne as editoras Guanabara Koogan, Santos, Roca, AC Farmacêutica, LTC, Forense,
Halliday Fundamentos de Física Volume 2 www.grupogen.com.br http://gen-io.grupogen.com.br O GEN Grupo Editorial Nacional reúne as editoras Guanabara Koogan, Santos, Roca, AC Farmacêutica, LTC, Forense,
Aula 8 Entropia e espontaneidade
 Universidade Tecnológica Federal do Paraná Departamento Acadêmico de Química e Biologia Aula 8 Entropia e espontaneidade Dr. Tiago P. Camargo Reações químicas e espontaneidade Ocorrer ou não ocorrer...
Universidade Tecnológica Federal do Paraná Departamento Acadêmico de Química e Biologia Aula 8 Entropia e espontaneidade Dr. Tiago P. Camargo Reações químicas e espontaneidade Ocorrer ou não ocorrer...
BCL 0307 Transformações Químicas
 BCL 0307 Transformações Químicas Prof. Dr. André Sarto Polo Bloco B S. 1014 ou L202 andre.polo@ufabc.edu.br Aula 05 http://pesquisa.ufabc.edu.br/pologroup/transformacoes_quimicas.html Qual a importância
BCL 0307 Transformações Químicas Prof. Dr. André Sarto Polo Bloco B S. 1014 ou L202 andre.polo@ufabc.edu.br Aula 05 http://pesquisa.ufabc.edu.br/pologroup/transformacoes_quimicas.html Qual a importância
CURSO DE CIÊNCIAS BIOLÓGICAS. DISCIPLINA: Química Geral. Assunto: Equilíbrio Químico Docente: Prof a. Dr a. Luciana M. Saran
 CURSO DE CIÊNCIAS BIOLÓGICAS DISCIPLINA: Química Geral Assunto: Equilíbrio Químico Docente: Prof a. Dr a. Luciana M. Saran 1 1. Introdução Existem dois tipos de reações: a) aquelas em que, após determinado
CURSO DE CIÊNCIAS BIOLÓGICAS DISCIPLINA: Química Geral Assunto: Equilíbrio Químico Docente: Prof a. Dr a. Luciana M. Saran 1 1. Introdução Existem dois tipos de reações: a) aquelas em que, após determinado
Termodinâmica de Sistemas Biológicos
 Aula de Bioquímica I Tema: Termodinâmica de Sistemas Biológicos Prof. Dr. Júlio César Borges Depto. de Química e Física Molecular DQFM Instituto de Química de São Carlos IQSC Universidade de São Paulo
Aula de Bioquímica I Tema: Termodinâmica de Sistemas Biológicos Prof. Dr. Júlio César Borges Depto. de Química e Física Molecular DQFM Instituto de Química de São Carlos IQSC Universidade de São Paulo
11ª LISTA - EXERCÍCIOS DE PROVAS Energia Livre
 Pg. 1/5 1ª. Questão Considere o processo de sublimação (eq. 1) e a reação de dissociação (eq. 2) do iodo e responda o que se pede. Sublimação do iodo: I 2 (s) I 2 (g) eq. 1 Reação de dissociação do iodo:
Pg. 1/5 1ª. Questão Considere o processo de sublimação (eq. 1) e a reação de dissociação (eq. 2) do iodo e responda o que se pede. Sublimação do iodo: I 2 (s) I 2 (g) eq. 1 Reação de dissociação do iodo:
Termodinâmica. Universidade Federal de Ouro Preto Instituto de Ciências Exatas e Biológicas Departamento de Química
 Universidade Federal de Ouro Preto Instituto de Ciências Exatas e Biológicas Departamento de Química ermodinâmica Professora: Melissa Soares Caetano Disciplina QUI 702 Segundo Princípio da ermodinâmica
Universidade Federal de Ouro Preto Instituto de Ciências Exatas e Biológicas Departamento de Química ermodinâmica Professora: Melissa Soares Caetano Disciplina QUI 702 Segundo Princípio da ermodinâmica
11/Mar/2016 Aula 7 Entropia Variação da entropia em processos reversíveis Entropia e os gases ideais
 11/Mar/016 Aula 7 Entropia ariação da entropia em processos reversíveis Entropia e os gases ideais Entropia no ciclo de Carnot e em qualquer ciclo reversível ariação da entropia em processos irreversíveis
11/Mar/016 Aula 7 Entropia ariação da entropia em processos reversíveis Entropia e os gases ideais Entropia no ciclo de Carnot e em qualquer ciclo reversível ariação da entropia em processos irreversíveis
FUNÇÕES DE ESTADO TERMODINÂMICAS: ENTALPIA E ENERGIA LIVRE Parte 1
 FUNÇÕES DE ESTADO TERMODINÂMICAS: ENTALPIA E ENERGIA LIVRE Parte 1 [texto baseado nas seções 2.5 (a e b) e 2.7 de Physical Chemistry, P. Atkins e J. de Paula, Freeman 2006] Funções de estado termodinâmico
FUNÇÕES DE ESTADO TERMODINÂMICAS: ENTALPIA E ENERGIA LIVRE Parte 1 [texto baseado nas seções 2.5 (a e b) e 2.7 de Physical Chemistry, P. Atkins e J. de Paula, Freeman 2006] Funções de estado termodinâmico
1. TERMODINÂMICA. PQI3110 Aula 2 Augusto Neiva
 APOSTILA PQI3110 Aula 2 Augusto Neiva 1. TERMODINÂMICA 1.1 INTRODUÇÃO 1.1.1 Balanço de Massa 1.1.2 Quociente de Pressões 1.1.3 Grau de avanço correspondente ao equilíbrio 1.2 PROPRIEDADES DE ESTADO 1.3
APOSTILA PQI3110 Aula 2 Augusto Neiva 1. TERMODINÂMICA 1.1 INTRODUÇÃO 1.1.1 Balanço de Massa 1.1.2 Quociente de Pressões 1.1.3 Grau de avanço correspondente ao equilíbrio 1.2 PROPRIEDADES DE ESTADO 1.3
QUÍMICA 3 - APOSTILA 4. Prof. Msc João Neto
 QUÍMICA - APOSTILA Prof. Msc João Neto A (g) B (g) C (g) D (g) Em um sistema fechado, o equilíbrio é atingido quando: as propriedades macroscópicas ficam inalteradas; no estado final, coexistem reagentes
QUÍMICA - APOSTILA Prof. Msc João Neto A (g) B (g) C (g) D (g) Em um sistema fechado, o equilíbrio é atingido quando: as propriedades macroscópicas ficam inalteradas; no estado final, coexistem reagentes
