Destilação é uma operação unitária cujo objectivo é separar ou fraccionar, por vaporização, uma mistura de líquidos voláteis e miscíveis, nos seus com
|
|
|
- Yasmin Brás de Figueiredo
- 7 Há anos
- Visualizações:
Transcrição
1
2 Destilação é uma operação unitária cujo objectivo é separar ou fraccionar, por vaporização, uma mistura de líquidos voláteis e miscíveis, nos seus componentes
3 A separação é possível aproveitando as diferenças entre a pressão de vapor dos diferentes componentes da mistura A destilação é uma das operações unitárias mais importantes na indústria química, na indústria petrolífera e também na indústria alimentar
4 Diagrama de fases
5
6 Equilíbrio Líquido Vapor A(l) F A(g)
7 Lei de Dalton "Numa mistura gasosa, a pressão de cada componente é independente da pressão dos demais, a pressão total ( P) é igual à soma das pressões parciais dos componentes" Lei de Raoult Numa solução ideal, a pressão parcial de cada componente da solução é igual à pressão de vapor do componente puro multiplicada pela sua fração molar Lei de Henry P i = x i H A solubilidade de um gás num líquido é directamente proporcional à pressão parcial do gás em equilíbrio com a solução (T=const)
8 Volatilidade Relativa A volatilidade pode ser utilizada para relacionar as composições, em equilíbrio, das fases líquidas e gasosas A volatilidade de um componente pode ser definida como a razão entre a pressão parcial do componente na fase gasosa e a fracção molar na fase líquida:
9 Equilíbrio Líquido Vapor A (l) + B(l) F A(g) + B(g)
10 Pressão de vapor Pressão de vapor vapor de A puro fracção molar
11 Pressão de vapor Pressão de vapor vapor de B puro vapor de A puro fracção molar
12 Pressão de vapor Pressão de vapor vapor de B puro pressão de vapor total da mistura vapor de A puro fracção molar
13 Ponto de Ebulição PE de A puro PE de B puro fracção molar
14 Pressão de vapor B puro pressão de vapor total A puro fracção molar Ponto de Ebulição Ponto de Ebulição PE de A puro PE de B puro fracção molar
15 Ponto de Ebulição O líquido entra em ebulição a esta temperatura Ponto de Ebulição PE de A puro PE de B puro fracção molar composição da mistura
16 Ponto de Ebulição dando origem a um vapor com esta composição O líquido entra em ebulição a esta temperatura Ponto de Ebulição PE de A puro PE de B puro fracção molar composição do vapor sobre o líquido em ebulição composição da mistura
17 Ponto de Ebulição composição do vapor Ponto de Ebulição PE de A puro composição do líquido PE de B puro fracção molar
18
19 Curva dos pontos de condensação Mistura binária ideal (a+b) Aquecimento de líquido (composição do líquido = x a1 ) Curva dos pontos de ebulição 1 - t = t 1 estado líquido 2 - t = t 1 início ebulição (fase vapor - y a1 ; fase líquida - x a1 ) 3 - t = t 2 (vapor - y a2 ; líquido - x a2 ) 4 - t = t 3 (só vapor - y a3 = x a1 ) 5 - t = t vapor sobreaquecido
20 Mistura binária não ideal com um mínimo (metanol clorofórmio) azeótropo
21 Mistura binária não ideal com um máximo (água ácido fórmico) azeótropo
22 Destilação simples Cálculo analítico Considere-se um líquido que contém um soluto a, volátil, que se vai destilar. À medida que a volatiliza, o líquido fica mais pobre em a (destilação diferencial) A composição das fases L e V varia com o tempo (processo não estacionário) m massa do soluto a no destilado dm massa de a no elemento de volume dv do destilado dv elemento de volume do destilado v volume de destilado
23 Destilação simples K a razão entre as concentrações de a no destilado e no resíduo M massa inicial de a na solução a ser destilada v L volume da solução inicial a destilar E fracção extraída de a (m/m) (v volume de destilado; m massa de soluto a no destilado)
24 K a razão entre as concentrações de a no destilado e no resíduo M massa inicial de a na solução a ser destilada v L volume da solução inicial a destilar E fracção extraída de a (m/m) (v volume de destilado; m massa de soluto a no destilado)
25 Se K a se mantém aproximadamente constante e se v << v L (E=m/M) 1-E
26 Se K a se mantém aproximadamente constante e se v não é desprezável
27 Se K a variar e se v não é desprezável
28 Em resumo: 1. Ka constante e v do destilado desprezável v = - v L /K a ln (1-E) 2. Ka constante e v do destilado não é desprezável ln [(v L -v)/v L ] = (1/K a ) ln (1-E) 3. Ka não é constante e v do destilado não é desprezável v 0 K a /(v L -v)dv] = - ln (1-E)
29 Equipamento para destilação simples Condensador Balão Cabeça de destilação Núcleos de ebulição
30 Equipamento para Destilação simples Balões Balão de Claisen
31 Equipamento para Destilação simples Cabeças de destilação Cabeças de Claisen
32 Equipamento para Destilação simples Tipos de condensadores Liebig Graham Allihn Friedrichs Dimroth
33 Equipamento para Destilação simples Tipos de condensadores J. B. Hill, S. W. Ferris, Laboratory Fractionating Columns, Ind. Eng. Chem., 1927, 19 (3), pp
34 Equipamento para Destilação simples Alongas de recolha de destilado
35 Vídeos sobre Destilação
36 Destilação Instantânea Destilação Súbita Destilação Flash A destilação súbita ou instantânea é uma operação contínua de um andar de equilíbrio onde uma mistura líquida de dois ou mais componentes é parcialmente vaporizada através da passagem por uma válvula de expansão. É o processo de destilação em contínuo mais simples, ocorrendo num único andar com a formação de uma fase vapor em equilíbrio com um líquido a partir da corrente de alimentação
37 Destilação Instantânea A destilação súbita não é muito eficiente. Se as volatilidades relativas não forem muito distintas a separação é fraca. Este método é normalmente usado, na indústria, como um processo Este método é normalmente usado, na indústria, como um processo prévio de separação
38 Destilação Instantânea F caudal molar da fase da corrente de alimentação V - caudal molar da fase vapor L - caudal molar da fase líquida Q H Quantidade de calor fornecida pelo permutador de calor Q Calor trocado pela câmara flash z F fração molar do componente mais volátil x, y - fração molar do componente mais volátil, no líquido e no vapor, respetivamente h - entalpia
39 Destilação Instantânea Balanço de massa Balanço de energia sendo: Na maior parte dos casos Q =0 (processo adiabático)
40 Destilação Instantânea Balanço de massa: Representando por f a fração da alimentação vaporizada: Reta operatória (y em função de x): Declive = -(1-f)/f Ordenada na origem = z F /f
41 Destilação Instantânea No caso do balanço energético: Em condições adiabáticas: Exprimindo em função de f (f = V/F):
42 Destilação Instantânea (f = V/F) Reta operatória (y em função de x): Declive = -(1-f)/f Ordenada na origem = z F /f - Fração vaporizada f declive - Composição da alimentação ordenada na origem - Ou: quando z f = x então x = y = z f (equação)
43 Destilação Instantânea
44 Destilação Instantânea (Diagrama Entalpia Composição) A entalpia de uma mistura de dois componentes A e B pode ser calculada pela equação:
45 Destilação Instantânea
46 Destilação Instantânea
47 Destilação Instantânea Dados: z f = 0,5; V/F = 0,6 = f Equação da reta operatória: y = 0,83 0,67 x Resposta: x = 0,39; y = 0,58
48 Destilação Instantânea PROBLEMA
49 Resposta (alínea a) 10 kmol/hr 0,5 Não: 4 incógnitas (x, y, F, V, L, zf) 3 equações
50 Resposta (alínea b) 0,98 10 kmol/hr 0,5 = 0,98 3 incógnitas (x, y, F, V, L, zf) 3 equações: Resultado: L = 6,1 kmol/h; V = 3,9 kmol/h
51 Destilação Instantânea (misturas multicomponentes)
52 Destilação Instantânea (misturas multicomponentes) (mistura binária) Em vez de 2 componentes, temos i componentes, com i 3: As relações de equilíbrio são:
53 Destilação Instantânea (misturas multicomponentes) F = V + L L = F - V z i F = x i (F-V) + k i x i V Sabendo K i e V/F, pode-se calcular x i e y i.
54 Destilação Instantânea (misturas multicomponentes) Se K i ou V/F não for conhecido: C = 1,0 i=1 C = 1,0 i=1 Como há C componentes, as equações não são de resolução fácil (polinómios)
55 Destilação Instantânea (misturas multicomponentes) Método iterativo de Rachford - Rice C = 0 i=1 Z i (K i - 1)
56 Destilação Instantânea (misturas multicomponentes) Problema - Limites superior e inferior da temperatura na câmara de flash: 94 ºC e 112 ºC (t em ºC
57 a) Temperatura no interior da câmara de flash Admitindo como válidas as leis de Dalton e Raoult para esta mistura, as razões de equilíbrio Ki são obtidas de: K 1 = 2,92; K 2 = 1,02; K 3 = 0,458; Uma vez que 60% da alimentação são vaporizados (V/F=0,6): C =1,0 i=1
58 b) As composições do vapor e do líquido produzidos
59 c) A temperatura da corrente de alimentação (diapositivo 41): x (t 106) x (t 106) =
60 PROBLEMA 3.1 K B K T
61 Destilação por Andares A eficiência de uma separação por destilação aumenta se forem conseguidos múltiplos contactos entre a fase líquida e a fase vapor. Os múltiplos contactos entre as fases permitem o enriquecimento progressivo da fase vapor no componente mais volátil. Este procedimento tem a designação de rectificação ou destilação contínua em andares de equilíbrio Nesta operação a separação é efectuada numa sucessão de andares de equilíbrio, nos quais ambas as fases entram em contacto, misturam-se, transferem energia e massa e saem, teoricamente, em equilíbrio
62 Destilação por Andares Os andares de equilíbrio devem garantir o contacto íntimo entre as fases, proporcionar uma grande interface entre elas, de modo a permitir uma transferência de massa eficiente. O tempo de residência da mistura líquido-vapor em cada andar deve ser o adequado para garantir que o equilíbrio seja atingido. Equipamento é constituído por um reservatório cilindrico sob pressão controlada (superior ou inferior à pressão atmosférica) designada por coluna de destilação.
63 Destilação por Andares Na coluna de destilação circulam duas correntes em contracorrente: - Corrente ascendente de vapor; - Corrente descendente de líquido. O contacto entre as duas fases faz-se por dispersão do vapor no líquido ou do líquido no vapor. Podem ser consideradas 2 partes na coluna de destilação (acima e abaixo da alimentação): - Secção de Retificação - Secção de Esgotamento No fundo da coluna parte do líquido é vaporizada e reenviada para a coluna. No cimo da coluna o vapor é condensado e parte é reenviada para a coluna.
64 Destilação por Andares Existem vários tipos de colunas. As mais utilizadas em aplicações industriais são: - Colunas de pratos (contacto por andares) - Colunas de enchimento (contacto contínuo)
65 Destilação por Andares Colunas de pratos (contacto por andares) Esquema de operação de um prato perfurado numa coluna de separação líquido-vapor
66 Destilação por Andares Colunas de enchimento (contacto contínuo) Enchimentos aleatórios Coluna de enchimento típica de um processo de absorção. Na destilação as colunas são mais complexas, porque têm vários distribuidores de líquido (e até de gás), separadores gás-líquido, etc. Enchimentos estruturados
67 Destilação por Andares Material de enchimento Enchimentos aleatórios
68 Destilação por Andares Colunas de enchimentoversus Colunas de andares As colunas de enchimento: - têm uma maior área interfacial de contacto líquido-vapor - apresentam uma melhor eficiência de separação para a mesma altura de coluna - são mais curtas dos que as de andares
69 Destilação por Andares Distribuidores de líquido
70 Destilação por Andares O projecto de uma coluna de destilação envolve a resolução de várias equações: -Balanços de massa (global e do componente mais volátil); -Balanços de energia (balanços entálpicos). É necessário fazer algumas aproximações, como a de que se estabelece o equilíbrio líquido-vapor em cada andar
71 Destilação por Andares O projecto da coluna envolve, tipicamente, os seguintes passos:
72 Destilação por Andares Utilizando métodos gráficos e numéricos é possível calcular aproximadamente o número de andares de equilíbrio ou a composição do vapor e do líquido à saída da coluna Dos métodos existentes, o de uso mais vulgarizado é o método gráfico de McCabe-Thiele usado nos cálculos da separação de misturas binárias
73 Destilação por Andares Lewis verificou que em muitos sistemas (p. ex. em misturas de hidrocarbonetos) as entalpias de vaporização são aproximadamente constantes, pelo que é razoável admitir que os caudais de vapor e de líquido em cada secção são também constantes. L 1 = L 2 =...=L j =...= L V 1 = V 2 =...=V j =...= V L f = L f+1 =...=L N-1 =...= L V f = V f+1 =...=V N-1 =...= V
74 Destilação por Andares Sendo os caudais molares em cada secção constantes, as equações dos balanços mássicos da alimentação, secções de rectificação e esgotamento são equações de rectas Com base nestes resultados McCabe-Thiele desenvolveram um método gráfico construído com base nos seguintes pressupostos: - A coluna é adiabática - Desprezam-se as variações de calor devido ao aquecimento e arrefecimento das correntes (cp T), o que implica que a diferença de temperatura entre ebulidor e condensador deverá ser < 50ºC - A entalpia de mistura das correntes é desprezável; h vap dentro da coluna é constante
75 Destilação por Andares Para substâncias com pontos de ebulição próximos (e com entalpias de ebulição também próximas) a regra de Trouton estabelece que: h vap vap (J/mol)= 85 T eb eb Como consequência da igualdade das entalpias de vaporização dentro da coluna, o número de moles de líquido que se evapora é igual ao número de moles de vapor que se condensa (o calor necessário para evaporar o líquido provém do calor que se liberta na condensação do vapor)
76 Destilação por Andares Secção de retificação Tendo em conta que a numeração dos pratos começa por cima e as composições de líquido e vapor que saem do prato estão em equilíbrio: y n+1 +1V= V=x n L + Dx D y n+1 +1=x n L + D x D V V Em que: V = L R + D L R - fração de líquido reintroduzido na coluna (refluxo); D - destilado
77 Destilação por Andares Secção de retificação: num andar qualquer, n, as correntes de líquido e de vapor (com composição x n e y n+1 ) são correntes de passagem que podem ser relacionadas pelo balanço mássico ou pela linha operatória y n+1 +1V= V=x n L + Dx D y n+1 +1=x n L + D x D V V y = L V D V x + x D (para qualquer andar na secção de retificação)
78 Destilação por Andares Secção de esgotamento: x n e y n são correntes de saída do andar n y m+1 +1V V + V + Wx w =x m L _ y = _ L x - x w V W V _ (para qualquer andar na secção de esgotamento)
79 Destilação por Andares Secção de esgotamento O último ponto da linha operatória de esgotamento é o correspondente ao último prato, isto é ao líquido que deixa o andar N-1, com a composição x N-1, e ao vapor proveniente do ebulidor y W y x - x w = L V W V _
80 Destilação por Andares Corrente de alimentação A relação entre os caudais das secções de retificação e de esgotamento depende do caudal e do estado térmico da corrente de alimentação, que determina a sua entalpia. É necessário,por isso, fazer um balanço molar e um balanço entálpico ao prato de alimentação:
81 Destilação por Andares Definindo uma grandeza adimensional q como a razão entre o aumento de caudal molar do líquido no prato de alimentação por mole da corrente de alimentação (representa a condição térmica da alimentação): - F + -V - V V - V q = = 1 + F -L L = F + -V - V - V - V F Ou ainda:
82 Destilação por Andares A partir de: Podem exprimir-se os caudais das secções de rectificação e de esgotamento em função de q: Podem, ainda, relacionar-se as entalpias da alimentação, secção de esgotamento e de rectificação: h V, h L e h F são as entalpias do vapor saturado(para y=z F ), do líquido saturado (para x=z F ) e da alimentação.
83 Destilação por Andares y = L V D V x + x D Reta operatória (retificação) _ y = _ L x - x w V W V _ Reta operatória (esgotamento) Combinando as equações anteriores e tendo em conta o balanço mássico do componente mais volátil chegamos à equação da recta operatória da alimentação: Reta operatória de alimentação
84 Destilação por Andares Explicação gráfica do significado de q
85 Destilação por Andares Valores possíveis de q e a sua relação com os caudais de líquido e de vapor no interior da coluna de destilação
86 Destilação por Andares (Resumo) Rectas operatórias: y = L V D V x + x D Secção de retificação _ y = _ L x - x w V W V _ Secção de esgotamento Alimentação
87 Destilação por Andares (Resumo) Efeito das condições térmicas da alimentação no declive da linha q
88 Destilação por Andares
89 Destilação por Andares Resolução:
90 Destilação por Andares
91 Destilação por Andares
92 Destilação por Andares Declive = q / (q-1) = 1,5
93 Destilação por Andares
94 Destilação por Andares
95 Destilação por Andares diapositivo seguinte fração mássica
96 Destilação por Andares
97 Destilação por Andares
98 Destilação por Andares
99 Destilação por Andares Cálculo do nº de andares de equilíbrio O número de andares teóricos é igual ao número de pratos + 1 (porque as colunas têm o ebulidor que não constitui um prato da coluna mas onde ocorre um equilíbrio entre líquido e vapor)
100 Destilação por Andares O cálculo do nº de andares de equilíbrio pelo método gráfico de McCabe-Thiele inicia-se pela marcação num diagrama x-y das retas operatórias de retificação e alimentação (ou esgotamento): Retificação declive y = (L/V)x + (D/V)x d x = y = x d ponto da reta Alimentação - q = (L L)/F declive y = [q/(q-1)]x -z F /(q-1) x = y = z F ponto da reta Esgotamento declive _ y = (L/V)x - (D/V)x w x = y = x w ponto da reta
101 Destilação por Andares Se, por exemplo, se tiverem traçado as retas operatórias de retificação e de esgotamento, a de alimentação pode ser obtida unindo o ponto encontro dessas duas retas com o ponto x=y=z F. y = (L/V)x + (D/V)x d x = y = x d y = [q/(q-1)]x -z F /(q-1) x = y = z F y = (L/V)x - (D/V)x w x = y = x w
102 Destilação por Andares Nº de andares para obter um destilado com a composição x D : 1 ponto x = y = x D (reta de retificação) e ponto x = y = x w (reta de esgotamento) 2 declives das retas (retificação = L/V; esgotamento = L/V) 2 união do ponto de interseção das duas retas com x = y= z F (reta de alimentação) 3 marcação dos degraus a partir de cima (equilíbrio/linha operatória) - - Construção de McCabe-Thiele O nº de degraus ou de triângulos traçados é o nº de andares teóricos, isto é, o nº de pratos de destilação + 1 (o do ebulidor, que é o último andar)
103 Destilação por Andares Coluna de destilação com refluxo total: F = D = 0 (R = ) (não há qualquer entrada ou saída e N = N mínimo mínimo ) R = L R /D = razão de refluxo Dado que L=V e L=V as duas retas operatórias (retificação e esgotamento) tem um declive igual a 1 (y=x) e, portanto, coincidem com a linha y=x.
104 Destilação por Andares Coluna de destilação com refluxo mínimo (R = mínimo) (valor máximo possível de destilado D e N = ) R = L R /D = mínimo razão de refluxo Condições operacionais: R op 1,2 x R min
105 Destilação por Andares Resumo dos passos de construção gráfica McCabe-Thiele: 1-traçar a linha de equilíbrio y-x e a linha auxiliar a 45º (y=x) 2-marcar as composições conhecidas (em geral: x D, z F e x W ) 3-traçar a linha q [declive = q/(q-1) e ponto x=y=z F ] 4-determinar R min L/V = R/(R+1) [L/V = declive da reta de retificação que une à linha de equilíbrio] 5-determinar R op (em geral: R op = 1,2 x R mín ) 6-traçar a recta operatória de rectificação R/(R+1) 7-traçar a recta operatória de esgotamento (unir x=x w com a interseção das outras 2 retas) 8-traçar o número de andares de equilíbrio (número de degraus)
106 Destilação por Andares
107 Destilação por Andares
108 Destilação por Andares Localização da corrente de alimentação No caso de colunas já existentes, a corrente de alimentação pode não entrar na localização ótima (mais abaixo ou mais acima), o que pode alterar a sua eficiência (nº de andares) Localização ótima 1 andar acima 1 andar abaixo
109 Destilação por Andares Balanço energético à coluna A quantidade de calor (Q c,5) libertada no condensador, admitindo que há condensação total e se forma líquido saturado, é igual a: Q C = V x h vap Sabendo Q C, é possível calcular o valor do calor a fornecer ao ebulidor parcial, Q B, através de um balanço energético à coluna: Fh F + Q B = Dh D + Wh W + Q C
110 Recursos na internet sobre destilação
111 ep/slide.php?chapter=/chemsep/distil lation/&last=34&slide=20
112 PROBLEMAS FINAIS 1. Uma coluna de destilação opera a 1 atm e recebe kg/h de uma solução aquosa com 8,6% (em massa) de álcool. Pretende-se que as composições do destilado e do resíduo sejam, respetivamente, 95,4% e 0,1% em álcool. Calcule: a) Sistema de 2 equações a 2 incógnitas (D e W): 0,086 x = 0,954 x D + 0,001 x W (balanço material ao etanol) = D + W (balanço material à coluna). Resultado: D = 446 kg/h; ; W = 4554kg/h etanol 95,4% b) Massa de álcool na alimentação = 0,086 x kg = 430 kg Massa de álcool no resíduo = 0,001 x kg = 4,55 kg Resultado: % álcool perdido = 4,55 /430 x 100 = 1,1% kg/h etanol 8,6 % etanol 0,1%
113 PROBLEMAS FINAIS 2.
114 PROBLEMAS FINAIS 2. Resolução idêntica à anterior (sistema de 2 equações) Usando CF, o componente mais volátil: 200 x 0,55 = D x 0,95 + W x 0,03 D + W = 200 kmol/h Resultado: D = 113 kmol/h; W = 87 kmol/h CF 95% n CF (entrada) = 200 kmol/h x 0,55 = 110 kmol/h n CF (destilado) = 113 kmol/h x 0,95 = 107,4 kmol/h Fração de recuperação (CF) = 107,4/110= 0, kmol/h (CF-55%; AA-45%) n AA (entrada) = 200 kmol/h x 0,45 = 90 kmol/h n AA (resíduo) = 87 kmol/h x 0,97 = 84,4 kmol/h Fração de recuperação (AA) = 84,4/90 = 0,938 AA 97%
115 PROBLEMAS FINAIS 2. CF 95% 200 kmol/h (CF-55%; AA-45%) Balanços materiais: calculado em a) R = 1 L R = D = 113 kg/h; logo: L = 113 kmol/h Como F é 50%V e 50%L L = L = 213 kmol/h Como V = L R + D V = = 226 kmol/h Como V = V V = = 126 kmol/h AA 97%
116 PROBLEMAS FINAIS 2. ( ) No ebulidor são vaporizados 126 kmol/h (valor de V). É preciso calcular a composição deste vapor. A partir de α: 6,15 = (y CF /x CF )/(y AA /x AA ) e y CF + y AA = 1. Temos 2 equações e 2 incógnitas, uma vez x CF e x AA são conhecidos. Então: 6,15 = (y CF /0,03)/(y AA /0,97) y CF = 0,235; y AA = 0,765. CF AA kmol/h (CF-55%; AA-45%) CF 95% Sabendo a composição do vapor, podemos calcular Q B : Q B = x [0,235x29,24 + 0,765x23,68] = 3,15x10 6 kj/h Mas como 1 kw = 1 kj/s = 3600 kj/h Q B = 875 kw (gastos) AA 97% No condensador são condensados 226 kmol/h (valor de V): Q C = x[0,95x29,24 + 0,05x23,68] = 6,55x10 6 kj/h Q C = 1819 kw (produzidos)
117 PROBLEMAS FINAIS 3. Uma câmara de destilação instantânea opera a kpa e separa uma mistura etanol água. A alimentação tem 60 % de água. a) Se a razão V/F for de 2/3 calcule a composição do líquido e do vapor. b) Caso pretenda a produção de 100 kmol/h de vapor qual deverá ser a alimentação a usar. c) Se duplicar o valor da alimentação, calculado na alínea anterior, qual a composição do líquido e do vapor nestas novas condições.
118 PROBLEMAS FINAIS 3. Uma câmara de destilação instantânea opera a kpa e separa uma mistura etanol água. A alimentação tem 60 % de água. a) Se a razão V/F for de 2/3 calcule a composição do líquido e do vapor. Composição do vapor (y) e do líquido (x) (intercepção da linha operatória com a linha de equilíbrio líquido-vapor): x = 0,17; y = 0,51
119 PROBLEMAS FINAIS 3. Uma câmara de destilação instantânea opera a kpa e separa uma mistura etanol água. A alimentação tem 60 % de água. b) Caso pretenda a produção de 100 kmol/h de vapor qual deverá ser a alimentação a usar. V=2/3F F = 3/2V =3/2x100=150 kmol/h c) Se duplicar o valor da alimentação, calculado na alínea anterior, qual a composição do líquido e do vapor nestas novas condições. Não há efeito sobre a composição. x = 0,17; y = 0,51
120 PROBLEMAS FINAIS 4. Diagrama de composição da fase gasosa em função da composição da fase líquida para a mistura dissulfureto decarbono/tetracloretodecarbonoa1atm.
121 PROBLEMAS FINAIS 4. a) Estabeleça a equação da reta operatória de retificação. Igualando as equações das 2 retas, obtemos o ponto de interseção: -x + 1 = 0, ,833x x = 0,46 e y = 0,54. Portanto, a reta de esgotamento pode ser obtida ligando os pontos (0,05; 0,05) e (0,46; 0,54).
122 PROBLEMAS FINAIS 4. c) Calcule o número de pratos de equilíbrio necessários. Por análise do gráfico, depois de construídos os andares (a construção é efectuada do topo para o fundo) podemos verificar que existem 8 andares teóricos que correspondem a sete pratos ou andares na coluna de destilação mais 1 ebulidor parcial (topo). (0,95; 0,95) (0,46; 0,54) 4. d) Determine a localização ótima do prato da alimentação. A alimentação deve ser efectuada no 4º andar da coluna de destilação (5º andar teórico). (0,05; 0,05) Diagrama de composição da fase gasosa em função da composição da fase líquida para a mistura dissulfureto decarbono/tetracloretodecarbonoa1atm.
123 PROBLEMAS FINAIS 4. e) Determine os caudais do líquido e do vapor na secção de esgotamento Como se viu, o declive da reta de retificação, L/V, é igual a 0,833. O declive da reta de esgotamento, L/V, pode calcular-se a partir de 2 pontos da reta: L/V = (0,54 0,05) / (0,46 0,05) = 1,2. Então: 1,2 = (L+L F )/(V-V F ) = (L+0,5F)/(V-0,5F) = (L+50)/(V-50). Ou seja: 1,2 = (0,833V+50)/(V-50) V = 297 mol/h Sabendo V, facilmente se calculam os outros caudais: L = 0,833V = 247 mol/h L = L + 50 = 297 mol/h V = V 50 = 247 mol/h
124 PROBLEMAS FINAIS 5. Pretende-se projetar uma coluna de destilação contínua para separar kg por hora de uma mistura líquida metanol/água, em que a fração molar de metanol é de 40%. O objetivo é obter um destilado com uma fração molar de metanol de 97% e um resíduo com uma fração molar de água de 98%. Sabendo que a razão de refluxo molar é igual a 3 e conhecendo a curva de equilíbrio líquido/vapor de misturas de metanol/água (figura anexa), calcular: (i) O fluxo de destilado, D (ii) O número de pratos ideais e a localização do prato de alimentação Curva de equilíbrio Líquido (x) / Vapor (y) CH 3 OH
125 PROBLEMAS FINAIS (i) Fluxo de destilado, D M(CH 3 OH) M(H 2 O) Massa molecular média da alimentação = 0.4 x x 18 = 23.6 Fluxo molar da alimentação = 10000/23.6 = kmol/hr Balanços materiais: F = D + W F z F = D x D + W x W = D + W x 0.4 = 0.97 D W 97% CH 3 OH = 0.97 D ( D) kmol/h (60% H 2 O; 40% CH 3 OH) D = / 0,95 = kmol/hr 98% H 2 O
126 PROBLEMAS FINAIS (ii) Número de pratos ideais e localização do prato de alimentação Reta de alimentação: q-1 = 0 reta vertical (a amarelo) Reta de retificação: yv = xl + x D D (balanço material) y = (L/V)x + (D/V)x D Mas como: R = L/D L = RD V = L+D = D (1+R) CH 3 OH y = [R/(1+R)]x + [(1/(1+R)]x D y = (3/4)x + (1/4)x D y = 0,75x + 0,24 (reta a azul claro) Número de pratos teóricos = 7 Alimentação no 5º prato teórico
DESTILAÇÃO FRACIONADA OPERAÇÕES UNITÁRIAS 2. Profa. Roberta S. Leone
 DESTILAÇÃO FRACIONADA OPERAÇÕES UNITÁRIAS 2 INTRODUÇÃO O equipamento que promove a transferência de massa e calor entre correntes líquidas e de vapor saturadas é a conhecida Coluna de Destilação Fraccionada
DESTILAÇÃO FRACIONADA OPERAÇÕES UNITÁRIAS 2 INTRODUÇÃO O equipamento que promove a transferência de massa e calor entre correntes líquidas e de vapor saturadas é a conhecida Coluna de Destilação Fraccionada
Faculdade de Engenharia Química (FEQUI) Operações Unitárias 2 2ª Lista de Exercícios (parte A) Profº Carlos Henrique Ataíde (julho de 2013)
 Faculdade de Engenharia Química (FEQUI) Operações Unitárias 2 2ª Lista de Exercícios (parte A) Profº Carlos Henrique Ataíde (julho de 2013) 1) Concurso Petrobras: Engenheiro de Processamento Junior (questão
Faculdade de Engenharia Química (FEQUI) Operações Unitárias 2 2ª Lista de Exercícios (parte A) Profº Carlos Henrique Ataíde (julho de 2013) 1) Concurso Petrobras: Engenheiro de Processamento Junior (questão
Curso de Engenharia Química. Prof. Rodolfo Rodrigues Lista 2 de Destilação Binária por Estágios
 Curso de Engenharia Química Operações Unitárias II 216/2 Prof. Rodolfo Rodrigues Lista 2 de Destilação Binária por Estágios Exercício 1* (Wankat, 212, Exemplo 4-2) Calcule o coeficiente angular da linha
Curso de Engenharia Química Operações Unitárias II 216/2 Prof. Rodolfo Rodrigues Lista 2 de Destilação Binária por Estágios Exercício 1* (Wankat, 212, Exemplo 4-2) Calcule o coeficiente angular da linha
Destilação Binária por Estágios
 Destilação Binária por Estágios Prof. Universidade Federal do Pampa BA310 Curso de Engenharia Química Campus Bagé 16 de agosto de 2016 Destilação Binária por Estágios 1 / 33 Introdução Destilação Binária
Destilação Binária por Estágios Prof. Universidade Federal do Pampa BA310 Curso de Engenharia Química Campus Bagé 16 de agosto de 2016 Destilação Binária por Estágios 1 / 33 Introdução Destilação Binária
Destilação Binária por Estágios
 Destilação Binária por Estágios Prof. Universidade Federal do Pampa BA310 Curso de Engenharia Química Campus Bagé 21 de agosto de 2018 Destilação Binária por Estágios 1 / 40 Introdução Destilação Binária
Destilação Binária por Estágios Prof. Universidade Federal do Pampa BA310 Curso de Engenharia Química Campus Bagé 21 de agosto de 2018 Destilação Binária por Estágios 1 / 40 Introdução Destilação Binária
ESCOLA DE ENGENHARIA DE LORENA - USP DEPARTAMENTO DE ENGENHARIA QUÍMICA DESTILAÇÃO DIFERENCIAL PROF. DR. FÉLIX MONTEIRO PEREIRA
 ESCOLA DE ENGENHARIA DE LORENA - USP DEPARTAMENTO DE ENGENHARIA QUÍMICA DESTILAÇÃO DIFERENCIAL PROF. DR. FÉLIX MONTEIRO PEREIRA INTRODUÇÃO ETAPAS DE UM PROCESSO QUÍMICO INDUSTRIAL DIAGRAMA OPERAÇÕES UNITÁRIAS
ESCOLA DE ENGENHARIA DE LORENA - USP DEPARTAMENTO DE ENGENHARIA QUÍMICA DESTILAÇÃO DIFERENCIAL PROF. DR. FÉLIX MONTEIRO PEREIRA INTRODUÇÃO ETAPAS DE UM PROCESSO QUÍMICO INDUSTRIAL DIAGRAMA OPERAÇÕES UNITÁRIAS
UNIVERSIDADE DE SÃO PAULO ENGENHARIA QUÍMICA LOQ 4017 OPERAÇÕES UNITÁRIAS EXPERIMENTAL II
 UNIVERSIDADE DE SÃO PAULO ENGENHARIA QUÍMICA LOQ 4017 OPERAÇÕES UNITÁRIAS EXPERIMENTAL II Profa. Lívia Chaguri E-mail: lchaguri@usp.br DESTILAÇÃO 1 Semestre de 2015 Introdução Destilação: método utilizado
UNIVERSIDADE DE SÃO PAULO ENGENHARIA QUÍMICA LOQ 4017 OPERAÇÕES UNITÁRIAS EXPERIMENTAL II Profa. Lívia Chaguri E-mail: lchaguri@usp.br DESTILAÇÃO 1 Semestre de 2015 Introdução Destilação: método utilizado
3.ª ED., IST PRESS (2017) ÍNDICE
 ENGENHARIA DE PROCESSOS DE SEPARAÇÃO 3.ª ED., IST PRESS (2017) ÍNDICE PREFÁCO LISTA DE SÍMBOLOS 1 ENGENHARIA DE PROCESSOS DE SEPARAÇÃO1 1.1 Processos de Separação 1.2 Mecanismos de Separação 1.2.1 Separação
ENGENHARIA DE PROCESSOS DE SEPARAÇÃO 3.ª ED., IST PRESS (2017) ÍNDICE PREFÁCO LISTA DE SÍMBOLOS 1 ENGENHARIA DE PROCESSOS DE SEPARAÇÃO1 1.1 Processos de Separação 1.2 Mecanismos de Separação 1.2.1 Separação
564 E V A P O R A Ç Ã O
 564 E V A P O R A Ç Ã O FIGURA 10-5: Esquema de cálculo de um evaporador de multiefeitos (caso de um evaporador triplo, em que i 1, 2, 3). V i e L i são, respectivamente, os caudais de vapor provenientes
564 E V A P O R A Ç Ã O FIGURA 10-5: Esquema de cálculo de um evaporador de multiefeitos (caso de um evaporador triplo, em que i 1, 2, 3). V i e L i são, respectivamente, os caudais de vapor provenientes
Capítulo 7 Processos Envolvendo Equilíbrio Líquido Vapor
 Capítulo 7 Processos Envolvendo Equilíbrio Líquido Vapor Numa mistura de duas fases, líquida e vapor, em equilíbrio, um componente de uma das fases está em equilíbrio com o mesmo componente na outra fase.
Capítulo 7 Processos Envolvendo Equilíbrio Líquido Vapor Numa mistura de duas fases, líquida e vapor, em equilíbrio, um componente de uma das fases está em equilíbrio com o mesmo componente na outra fase.
Curso de Engenharia Química. Prof. Rodolfo Rodrigues
 Curso de Engenharia Química Operações Unitárias II 26/2 Prof. Rodolfo Rodrigues Lista 5: Absorção e Regeneração Exercício * (Geankoplis, 23, Exemplo.3-2) Deseja-se absorver 9% da acetona de uma corrente
Curso de Engenharia Química Operações Unitárias II 26/2 Prof. Rodolfo Rodrigues Lista 5: Absorção e Regeneração Exercício * (Geankoplis, 23, Exemplo.3-2) Deseja-se absorver 9% da acetona de uma corrente
Diagrama de Fases de Misturas
 Físico-Química I Profa. Dra. Carla Dalmolin Diagrama de Fases de Misturas Diagramas de pressão de vapor Diagramas de Temperatura x Composição Equilíbrios líquido líquido Equilíbrios sólido líquido Diagrama
Físico-Química I Profa. Dra. Carla Dalmolin Diagrama de Fases de Misturas Diagramas de pressão de vapor Diagramas de Temperatura x Composição Equilíbrios líquido líquido Equilíbrios sólido líquido Diagrama
Físico-Química I. Profa. Dra. Carla Dalmolin. Diagrama de Fases. Físico-Química, cap. 5: Transformações Físicas de Substâncias Puras
 Físico-Química I Profa. Dra. Carla Dalmolin Diagrama de Fases Físico-Química, cap. 5: Transformações Físicas de Substâncias Puras Sistemas Binários O equilíbrio de fases de sistemas com dois componentes
Físico-Química I Profa. Dra. Carla Dalmolin Diagrama de Fases Físico-Química, cap. 5: Transformações Físicas de Substâncias Puras Sistemas Binários O equilíbrio de fases de sistemas com dois componentes
MÉTODO DE MCCABE-THIELE REVERSO PARA SIMULAÇÃO DE UNIDADE DE DESTILAÇÃO MULTICOMPONENTE
 MÉTODO DE MCCABE-THIELE REVERSO PARA SIMULAÇÃO DE UNIDADE DE DESTILAÇÃO MULTICOMPONENTE Julita Savant Carvalho, 2 Luiz Fernando de Moura Discente do curso de Engenharia Química da UFSCar 2 Professor do
MÉTODO DE MCCABE-THIELE REVERSO PARA SIMULAÇÃO DE UNIDADE DE DESTILAÇÃO MULTICOMPONENTE Julita Savant Carvalho, 2 Luiz Fernando de Moura Discente do curso de Engenharia Química da UFSCar 2 Professor do
Destilação Fracionada e Misturas Azeotrópicas
 1. Introdução Destilação Fracionada e Misturas Azeotrópicas O ponto de ebulição normal de uma mistura binária líquida é a temperatura na qual a pressão de vapor total da mistura é igual a 1 atm. Ou seja,
1. Introdução Destilação Fracionada e Misturas Azeotrópicas O ponto de ebulição normal de uma mistura binária líquida é a temperatura na qual a pressão de vapor total da mistura é igual a 1 atm. Ou seja,
Operações Unitárias Parte II
 Operações Unitárias Parte II Apresentação Aula anterior: - Grandezas físicas; - Balanço de massa; - Balanço de energia; - Conversão; - Reciclo; - Rendimento; - Fração convertida; - Umidade relativa; -
Operações Unitárias Parte II Apresentação Aula anterior: - Grandezas físicas; - Balanço de massa; - Balanço de energia; - Conversão; - Reciclo; - Rendimento; - Fração convertida; - Umidade relativa; -
DESTILAÇÃO Lei de Raoult
 DESTILAÇÃO Operação que consiste na separação de líquidos de suas eventuais misturas, por passagem de vapor e posterior condensação com retorno ao estado líquido, com auxílio de calor e/ou por redução
DESTILAÇÃO Operação que consiste na separação de líquidos de suas eventuais misturas, por passagem de vapor e posterior condensação com retorno ao estado líquido, com auxílio de calor e/ou por redução
Destilação Binária em Batelada
 Destilação Binária em Batelada Prof. Universidade Federal do Pampa BA310 Curso de Engenharia Química Campus Bagé 30 de agosto de 2016 Destilação Binária em Batelada 1 / 16 Destilação Batelada 1 Destilação
Destilação Binária em Batelada Prof. Universidade Federal do Pampa BA310 Curso de Engenharia Química Campus Bagé 30 de agosto de 2016 Destilação Binária em Batelada 1 / 16 Destilação Batelada 1 Destilação
Capítulo 6 Processos Envolvendo Vapores
 Capítulo 6 Processos Envolvendo Vapores Pressão de vapor Define-se vapor como um componente no estado gasoso que se encontra a pressão e temperatura inferiores às do ponto crítico. Assim, um vapor pode
Capítulo 6 Processos Envolvendo Vapores Pressão de vapor Define-se vapor como um componente no estado gasoso que se encontra a pressão e temperatura inferiores às do ponto crítico. Assim, um vapor pode
OPERAÇÕES UNITÁRIAS EXPERIMENTAL II
 OPERAÇÕES UNITÁRIAS EXPERIMENTAL II Prof. MSc.. Sérgio S R. Montoro 1º semestre de 2013 OPERAÇÕES UNITÁRIAS EXPERIMENTAL II DESTILAÇÃO 1º semestre de 2012 DESTILAÇÃO Operação baseada na separação de misturas
OPERAÇÕES UNITÁRIAS EXPERIMENTAL II Prof. MSc.. Sérgio S R. Montoro 1º semestre de 2013 OPERAÇÕES UNITÁRIAS EXPERIMENTAL II DESTILAÇÃO 1º semestre de 2012 DESTILAÇÃO Operação baseada na separação de misturas
Destilação Fracionada e Misturas Azeotrópicas
 1. Introdução Destilação Fracionada e Misturas Azeotrópicas O ponto de ebulição normal de uma mistura binária líquida é a temperatura na qual a pressão de vapor total da mistura é igual a 1 atm. Ou seja,
1. Introdução Destilação Fracionada e Misturas Azeotrópicas O ponto de ebulição normal de uma mistura binária líquida é a temperatura na qual a pressão de vapor total da mistura é igual a 1 atm. Ou seja,
Faculdade de Engenharia Química (FEQUI) Operações Unitárias 2 2ª Lista de Exercícios (parte B) Profº Carlos Henrique Ataíde (agosto de 2013)
 Faculdade de Engenharia Química (FEQUI) Operações Unitárias 2 2ª Lista de Exercícios (parte B) Profº Carlos Henrique Ataíde (agosto de 2013) 1) Concurso Petrobras Engenheiro(a) de Processamento Junior
Faculdade de Engenharia Química (FEQUI) Operações Unitárias 2 2ª Lista de Exercícios (parte B) Profº Carlos Henrique Ataíde (agosto de 2013) 1) Concurso Petrobras Engenheiro(a) de Processamento Junior
DESTILAÇÃO. Prof.: Dr. Joel Gustavo Teleken
 DESTILAÇÃO Prof.: Dr. Joel Gustavo Teleken Definição A destilação é o método de separação baseado no equilíbrio líquido-vapor de misturas. Quando temos duas ou mais substâncias formando uma mistura líquida,
DESTILAÇÃO Prof.: Dr. Joel Gustavo Teleken Definição A destilação é o método de separação baseado no equilíbrio líquido-vapor de misturas. Quando temos duas ou mais substâncias formando uma mistura líquida,
SISTEMAS DE DOIS COMPONENTES: EQUILÍBRIO LÍQUIDO-VAPOR. LÍQUIDOS MISCÍVEIS
 SISTEMS DE DOIS COMPONENTES: EQUILÍRIO LÍQUIDO-VPOR. LÍQUIDOS MISCÍVEIS Prof. Harley P. Martins Filho plicação da regra das fases F = 2 + 2 P = 4 P máxima variância (uma fase): F = 3 Fixando o valor de
SISTEMS DE DOIS COMPONENTES: EQUILÍRIO LÍQUIDO-VPOR. LÍQUIDOS MISCÍVEIS Prof. Harley P. Martins Filho plicação da regra das fases F = 2 + 2 P = 4 P máxima variância (uma fase): F = 3 Fixando o valor de
Curso de Engenharia Química. Prof. Rodolfo Rodrigues
 Curso de Engenharia Química Operações Unitárias II 26/2 Prof. Rodolfo Rodrigues Lista : Destilação Flash Exercício * (McCabe, Smith & Harriot, 993, Exemplo 8.) Uma mistura equimolar de benzeno e tolueno
Curso de Engenharia Química Operações Unitárias II 26/2 Prof. Rodolfo Rodrigues Lista : Destilação Flash Exercício * (McCabe, Smith & Harriot, 993, Exemplo 8.) Uma mistura equimolar de benzeno e tolueno
Calcule o valor mínimo de M para permitir o degelo (e recongelação) do bloco à medida que é atravessado pela barra.
 Termodinâmica Aplicada (PF: comunicar eventuais erros para pmmiranda@fc.ul.pt) Exercícios 7. Uma barra metálica rectangular fina, com 0 cm de comprimento e mm de largura, está assente num bloco de gelo
Termodinâmica Aplicada (PF: comunicar eventuais erros para pmmiranda@fc.ul.pt) Exercícios 7. Uma barra metálica rectangular fina, com 0 cm de comprimento e mm de largura, está assente num bloco de gelo
EXPERIÊNCIA 02 DESTILAÇÃO
 EXPERIÊNCIA 02 DESTILAÇÃO 1- INTRODUÇÃO Destilação é uma técnica utilizada, geralmente, para remover um solvente, purificar um líquido ou para separar os componentes de uma mistura de líquidos, ou ainda
EXPERIÊNCIA 02 DESTILAÇÃO 1- INTRODUÇÃO Destilação é uma técnica utilizada, geralmente, para remover um solvente, purificar um líquido ou para separar os componentes de uma mistura de líquidos, ou ainda
SOLUÇÕES - SOLUÇÃO IDEAL E AS PROPRIEDADES COLIGATIVAS
 ESCOLA DE ENGENHARIA DE LORENA EEL/USP TERMODINÂMICA QUÍMICA PROF. ANTONIO CARLOS DA SILVA SOLUÇÕES - SOLUÇÃO IDEAL E AS PROPRIEDADES COLIGATIVAS 1. TIPOS DE SOLUÇÕES Solução é uma mistura homogênea de
ESCOLA DE ENGENHARIA DE LORENA EEL/USP TERMODINÂMICA QUÍMICA PROF. ANTONIO CARLOS DA SILVA SOLUÇÕES - SOLUÇÃO IDEAL E AS PROPRIEDADES COLIGATIVAS 1. TIPOS DE SOLUÇÕES Solução é uma mistura homogênea de
MODELAGEM E SIMULAÇÃO DO SISTEMA ACETONA- METANOL PARA OBTENÇÃO DE METANOL EM COLUNAS DE DESTILAÇÃO
 MODELAGEM E SIMULAÇÃO DO SISTEMA ACETONA- METANOL PARA OBTENÇÃO DE METANOL EM COLUNAS DE DESTILAÇÃO SILVA J. O (1); MARCELINO T. O. A. C (1); SILVA M. C (2) e RAMOS B. W (4) Universidade Federal de Campina
MODELAGEM E SIMULAÇÃO DO SISTEMA ACETONA- METANOL PARA OBTENÇÃO DE METANOL EM COLUNAS DE DESTILAÇÃO SILVA J. O (1); MARCELINO T. O. A. C (1); SILVA M. C (2) e RAMOS B. W (4) Universidade Federal de Campina
SOLUÇÕES MAIS DE UM COMPONENTE VOLÁTIL A SOLUÇÃO DILUÍDA IDEAL
 ESCOLA DE ENGENHARIA DE LORENA EEL/USP TERMODINÂMICA QUÍMICA PROF. ANTONIO CARLOS DA SILVA SOLUÇÕES MAIS DE UM COMPONENTE VOLÁTIL A SOLUÇÃO DILUÍDA IDEAL 1. CARACTERÍSTICAS GERAIS DA SOLUÇÃO IDEAL Para
ESCOLA DE ENGENHARIA DE LORENA EEL/USP TERMODINÂMICA QUÍMICA PROF. ANTONIO CARLOS DA SILVA SOLUÇÕES MAIS DE UM COMPONENTE VOLÁTIL A SOLUÇÃO DILUÍDA IDEAL 1. CARACTERÍSTICAS GERAIS DA SOLUÇÃO IDEAL Para
Curso de Engenharia Química. Prof. Rodolfo Rodrigues. Formulário para a Prova 1 11/10/2016
 Curso de Engenharia Química Operações Unitárias II 206/2 Prof. Rodolfo Rodrigues Formulário para a Prova /0/206 Destilação Flash ˆ Volatilidade relativa: F, z Flash V, y α AB = K A K B = y A/x A y B /x
Curso de Engenharia Química Operações Unitárias II 206/2 Prof. Rodolfo Rodrigues Formulário para a Prova /0/206 Destilação Flash ˆ Volatilidade relativa: F, z Flash V, y α AB = K A K B = y A/x A y B /x
Roteiro das Práticas 1 a 3
 Roteiro das Práticas 1 a 3 Destilação e Absorção/Umidificação Prof. Universidade Federal do Pampa Curso de Engenharia Química Campus Bagé 10 de agosto de 2017 Destilação e Absorção 1 / 13 Operações por
Roteiro das Práticas 1 a 3 Destilação e Absorção/Umidificação Prof. Universidade Federal do Pampa Curso de Engenharia Química Campus Bagé 10 de agosto de 2017 Destilação e Absorção 1 / 13 Operações por
Exercício. Questão 48 Engenheiro de Processamento Petrobras 02/2010
 Operações Unitárias Apresentação Grandezas Físicas Questão 48 Engenheiro de Processamento Petrobras 02/2010 O número de cavitação (Ca) é um número adimensional empregado na investigação da cavitação em
Operações Unitárias Apresentação Grandezas Físicas Questão 48 Engenheiro de Processamento Petrobras 02/2010 O número de cavitação (Ca) é um número adimensional empregado na investigação da cavitação em
DESTILAÇÃO EM PROCESSO CONTÍNUO DE MISTURA ÁGUA-ÁCIDO ACÉTICO
 DESTILAÇÃO EM PROCESSO CONTÍNUO DE MISTURA ÁGUA-ÁCIDO ACÉTICO A. C. G. S. COSTA 1, B. S. GONÇALVES 1, G. S. COSTA 1, N. C. CRUZ 1, R. C. CAMPOS 1 e M. S. BATISTA 2 1 Universidade Federal de São João del-rei,
DESTILAÇÃO EM PROCESSO CONTÍNUO DE MISTURA ÁGUA-ÁCIDO ACÉTICO A. C. G. S. COSTA 1, B. S. GONÇALVES 1, G. S. COSTA 1, N. C. CRUZ 1, R. C. CAMPOS 1 e M. S. BATISTA 2 1 Universidade Federal de São João del-rei,
Faculdade de Engenharia Química (FEQUI) Operações Unitárias 2 4ª Lista de Exercícios (parte B Extração Líquido-Líquido)
 Faculdade de Engenharia Química (FEQUI) Operações Unitárias 2 4ª Lista de Exercícios (parte B Extração Líquido-Líquido) Profº Carlos Henrique Ataíde (novembro de 2013) 1ª) Concurso Petrobras Químico (a)
Faculdade de Engenharia Química (FEQUI) Operações Unitárias 2 4ª Lista de Exercícios (parte B Extração Líquido-Líquido) Profº Carlos Henrique Ataíde (novembro de 2013) 1ª) Concurso Petrobras Químico (a)
Físico-Química I. Profa. Dra. Carla Dalmolin. Misturas Simples. Termodinâmica das Misturas Propriedades das Soluções Atividade
 Físico-Química I Profa. Dra. Carla Dalmolin Misturas Simples Termodinâmica das Misturas Propriedades das Soluções Atividade Misturas Simples Misturas de substâncias que não reagem Modelo simples para posteriormente
Físico-Química I Profa. Dra. Carla Dalmolin Misturas Simples Termodinâmica das Misturas Propriedades das Soluções Atividade Misturas Simples Misturas de substâncias que não reagem Modelo simples para posteriormente
Extração e Purificação do Limoneno Parte II
 Extração e Purificação do Limoneno Parte II Alan Cesar Pilon Andrey Pinheiro Técnicas para extração e purificação do Limoneno Extração com Solvente Destilação por arraste de vapor Destilação Fracionada
Extração e Purificação do Limoneno Parte II Alan Cesar Pilon Andrey Pinheiro Técnicas para extração e purificação do Limoneno Extração com Solvente Destilação por arraste de vapor Destilação Fracionada
OPERAÇÕES UNITÁRIAS II AULA 9: EVAPORAÇÃO EM SIMPLES EFEITO. Profa. Dra. Milena Martelli Tosi
 OPERAÇÕES UNITÁRIAS II AULA 9: EVAPORAÇÃO EM SIMPLES EFEITO Profa. Dra. Milena Martelli Tosi EVAPORAÇÃO EM SIMPLES EFEITO Características da evaporação e do líquido a ser evaporado Principais tipos de
OPERAÇÕES UNITÁRIAS II AULA 9: EVAPORAÇÃO EM SIMPLES EFEITO Profa. Dra. Milena Martelli Tosi EVAPORAÇÃO EM SIMPLES EFEITO Características da evaporação e do líquido a ser evaporado Principais tipos de
Prefácio. Lista de Símbolos. Modelo do Gás Perfeito 2 Mistura de Gases Perfeitos. Lei de Dalton 4 Problemas 6
 Índice Geral Prefácio xv Lista de Símbolos xvii 1 Modelo do Gás Perfeito 1 Modelo do Gás Perfeito 2 Mistura de Gases Perfeitos. Lei de Dalton 4 Problemas 6 2 Princípio da Conservação da Energia. A 1.ª
Índice Geral Prefácio xv Lista de Símbolos xvii 1 Modelo do Gás Perfeito 1 Modelo do Gás Perfeito 2 Mistura de Gases Perfeitos. Lei de Dalton 4 Problemas 6 2 Princípio da Conservação da Energia. A 1.ª
Seminário de química orgânica Experimental I Destilação fracionada do limoneno. Edvan Ferreira de Oliveira Letícia Naomi Higa
 Seminário de química orgânica Experimental I Destilação fracionada do limoneno Edvan Ferreira de Oliveira Letícia Naomi Higa *Introdução *Destilação *Explicação da destilação fracionada *Coluna de fracionamento
Seminário de química orgânica Experimental I Destilação fracionada do limoneno Edvan Ferreira de Oliveira Letícia Naomi Higa *Introdução *Destilação *Explicação da destilação fracionada *Coluna de fracionamento
calculadora científica
 Lista de Exercícios Obs.:.. a maioria desses exercícios (além dos apresentados nos slides ) estão sendo resolvidos durante as aulas. Caso, não tenha comparecido em alguma aula, verifique com os colegas
Lista de Exercícios Obs.:.. a maioria desses exercícios (além dos apresentados nos slides ) estão sendo resolvidos durante as aulas. Caso, não tenha comparecido em alguma aula, verifique com os colegas
4.2. Separação dos componentes de misturas homogéneas
 4.2. Separação dos componentes de misturas homogéneas Separação dos componentes de misturas homogéneas Os componentes das misturas homogéneas podem ser separados por processos físicos de separação. Usam-se
4.2. Separação dos componentes de misturas homogéneas Separação dos componentes de misturas homogéneas Os componentes das misturas homogéneas podem ser separados por processos físicos de separação. Usam-se
Físico-Química I. Profa. Dra. Carla Dalmolin. Misturas Simples. Físico-Química, cap. 5: Transformações Físicas de Substâncias Puras
 Físico-Química I Profa. Dra. Carla Dalmolin Misturas Simples Físico-Química, cap. 5: Transformações Físicas de Substâncias Puras Misturas Simples Misturas de substâncias que não reagem Modelo simples para
Físico-Química I Profa. Dra. Carla Dalmolin Misturas Simples Físico-Química, cap. 5: Transformações Físicas de Substâncias Puras Misturas Simples Misturas de substâncias que não reagem Modelo simples para
Combustível adicional se necessário 10
 Esta colecção contem enunciados de problemas utilizados na avaliação da disciplina Termotecnia da licenciatura de Eng. Electrotécnica entre e 000. Nos enunciados existem por vezes mais dados do que os
Esta colecção contem enunciados de problemas utilizados na avaliação da disciplina Termotecnia da licenciatura de Eng. Electrotécnica entre e 000. Nos enunciados existem por vezes mais dados do que os
TERMODINÂMICA APLICADA CAPÍTULO 2
 TERMODINÂMICA APLICADA CAPÍTULO 2 PROPRIEDADES DAS SUBSTÂNCIAS PURAS SUMÁRIO Neste capítulo o conceito de substância pura é introduzido e as várias fases, bem como as propriedades físicas dos processos
TERMODINÂMICA APLICADA CAPÍTULO 2 PROPRIEDADES DAS SUBSTÂNCIAS PURAS SUMÁRIO Neste capítulo o conceito de substância pura é introduzido e as várias fases, bem como as propriedades físicas dos processos
(8) Isolamento e Purificação do Limoneno II
 UNIVERSIDADE ESTADUAL PAULISTA Instituto de Química ARARAQUARA / SP (8) Isolamento e Purificação do Limoneno II Discentes: Grupo XIX Andrezza Fernandes Chagas Júlia Pinto Piccoli Profº. Dr. José Eduardo
UNIVERSIDADE ESTADUAL PAULISTA Instituto de Química ARARAQUARA / SP (8) Isolamento e Purificação do Limoneno II Discentes: Grupo XIX Andrezza Fernandes Chagas Júlia Pinto Piccoli Profº. Dr. José Eduardo
5ª LISTA - EXERCÍCIOS DE PROVAS Lei de Raoult
 Pg. 1/6 1 a Questão Metanol, CH 4 O, e etanol, C 2 H 6 O, são dois álcoois voláteis a 25 C. Ambos podem ser usados como solvente ou combustível e muitas vezes a mistura dos dois é empregada em processos
Pg. 1/6 1 a Questão Metanol, CH 4 O, e etanol, C 2 H 6 O, são dois álcoois voláteis a 25 C. Ambos podem ser usados como solvente ou combustível e muitas vezes a mistura dos dois é empregada em processos
Destilação Binária em Batelada
 Destilação Binária em Batelada Prof. Universidade Federal do Pampa BA310 Curso de Engenharia Química Campus Bagé 29 de agosto de 2017 Destilação Binária em Batelada 1 / 24 Destilação Batelada São de 2
Destilação Binária em Batelada Prof. Universidade Federal do Pampa BA310 Curso de Engenharia Química Campus Bagé 29 de agosto de 2017 Destilação Binária em Batelada 1 / 24 Destilação Batelada São de 2
PME 3344 Exercícios - Ciclos
 PME 3344 Exercícios - Ciclos 13) Exercícios sobre ciclos 1 v. 2.0 Exercício 01 Água é utilizada como fluido de trabalho em um ciclo Rankine no qual vapor superaquecido entra na turbina a 8 MPa e 480 C.
PME 3344 Exercícios - Ciclos 13) Exercícios sobre ciclos 1 v. 2.0 Exercício 01 Água é utilizada como fluido de trabalho em um ciclo Rankine no qual vapor superaquecido entra na turbina a 8 MPa e 480 C.
LISTA DE EXERCÍCIOS 4. Equilíbrio de Misturas Líquidas Binárias com o Vapor
 DEPARTAMENTO DE FÍSICO-QUÍMICA DISCIPLINA QUI 03310 FÍSICO-QUÍMICA II-B INTRODUÇÃO LISTA DE EXERCÍCIOS 4 Equilíbrio de Misturas Líquidas Binárias com o Vapor Na presente unidade, será examinado o comportamento
DEPARTAMENTO DE FÍSICO-QUÍMICA DISCIPLINA QUI 03310 FÍSICO-QUÍMICA II-B INTRODUÇÃO LISTA DE EXERCÍCIOS 4 Equilíbrio de Misturas Líquidas Binárias com o Vapor Na presente unidade, será examinado o comportamento
1 Termodinâmica: Modelos e Leis 1. 2 Princípio da Conservação da Energia: A 1.ª Lei da Termodinâmica 13
 Prefácio Lista de Símbolos xiii xvii 1 Termodinâmica: Modelos e Leis 1 1.1 Introdução 1 1.2 Modelo do Gás Perfeito 3 1.3 Mistura de Gases Perfeitos: Lei de Dalton 6 1.4 Leis da Termodinâmica 7 1.5 Expansão
Prefácio Lista de Símbolos xiii xvii 1 Termodinâmica: Modelos e Leis 1 1.1 Introdução 1 1.2 Modelo do Gás Perfeito 3 1.3 Mistura de Gases Perfeitos: Lei de Dalton 6 1.4 Leis da Termodinâmica 7 1.5 Expansão
Química. APL 2.1 Destilação fracionada de uma mistura de três compostos
 Química APL 2.1 Destilação fracionada de uma mistura de três compostos Luísa Neves, 12ºCT 9 de março de 2015 Índice Introdução...2 Material e Reagentes...3 Procedimento..4 Perigos específicos e conselhos
Química APL 2.1 Destilação fracionada de uma mistura de três compostos Luísa Neves, 12ºCT 9 de março de 2015 Índice Introdução...2 Material e Reagentes...3 Procedimento..4 Perigos específicos e conselhos
Parte II. Meneah Renata Talita
 Extração e Purificação do Limoneno Parte II Meneah Renata Talita Objetivo da prática Isolar e Purificar o Limoneno a partir de uma fase orgânica contendo n-hexano, limoneno, traços de substâncias voláteis
Extração e Purificação do Limoneno Parte II Meneah Renata Talita Objetivo da prática Isolar e Purificar o Limoneno a partir de uma fase orgânica contendo n-hexano, limoneno, traços de substâncias voláteis
Curso de Farmácia. Operações Unitárias em Indústria Prof.a: Msd Érica Muniz 6 /7 Período DESTILAÇÃO Parte 2
 Curso de Farmácia Operações Unitárias em Indústria Prof.a: Msd Érica Muniz 6 /7 Período DESTILAÇÃO Parte 2 1 Destilação Fracionada As operações até agora descritas propiciam pouco enriquecimento do vapor
Curso de Farmácia Operações Unitárias em Indústria Prof.a: Msd Érica Muniz 6 /7 Período DESTILAÇÃO Parte 2 1 Destilação Fracionada As operações até agora descritas propiciam pouco enriquecimento do vapor
FUNCIONAMENTO DE UMA COLUNA DE DESTILAÇÃO
 FUNCIONAMENTO DE UMA COLUNA DE DESTILAÇÃO DESTILAÇÃO MULTI-ESTÁGIOS Obtém a concentração desejada porém em quantidades reduzidas MULTI-ESTÁGIOS FRACIONADA fonte de resfriamento fonte de aquecimento O vapor
FUNCIONAMENTO DE UMA COLUNA DE DESTILAÇÃO DESTILAÇÃO MULTI-ESTÁGIOS Obtém a concentração desejada porém em quantidades reduzidas MULTI-ESTÁGIOS FRACIONADA fonte de resfriamento fonte de aquecimento O vapor
DRAFT. Operações Unitárias CONCURSO PETROBRAS. Questões Resolvidas ENGENHEIRO(A) DE PROCESSAMENTO JÚNIOR
 CONCURSO PETROBRAS ENGENHEIRO(A) DE PROCESSAMENTO JÚNIOR ENGENHEIRO(A) JÚNIOR - ÁREA: PROCESSAMENTO QUÍMICO(A) DE PETRÓLEO JÚNIOR Operações Unitárias Questões Resolvidas QUESTÕES RETIRADAS DE PROVAS DA
CONCURSO PETROBRAS ENGENHEIRO(A) DE PROCESSAMENTO JÚNIOR ENGENHEIRO(A) JÚNIOR - ÁREA: PROCESSAMENTO QUÍMICO(A) DE PETRÓLEO JÚNIOR Operações Unitárias Questões Resolvidas QUESTÕES RETIRADAS DE PROVAS DA
Absorção & Regeneração
 Absorção & Regeneração Prof. Universidade Federal do Pampa BA310 Curso de Engenharia Química Campus Bagé 06 de setembro de 2016 Absorção & Regeneração 1 / 28 Introdução Absorção & Regeneração 2 / 28 Introdução
Absorção & Regeneração Prof. Universidade Federal do Pampa BA310 Curso de Engenharia Química Campus Bagé 06 de setembro de 2016 Absorção & Regeneração 1 / 28 Introdução Absorção & Regeneração 2 / 28 Introdução
PROJETO/ANÁLISE DE COLUNAS DE DESTILAÇÃO BINÁRIA ASSISTIDOS POR COMPUTADOR FASE 1: MÉTODO McCABE-THIELE
 VI Congresso Brasileiro de Engenharia Química em Iniciação Científica 1/7 PROJETO/ANÁLISE DE COLUNAS DE DESTILAÇÃO BINÁRIA ASSISTIDOS POR COMPUTADOR FASE 1: MÉTODO McCABE-THIELE Souza, L. C. 1, Lossávaro,
VI Congresso Brasileiro de Engenharia Química em Iniciação Científica 1/7 PROJETO/ANÁLISE DE COLUNAS DE DESTILAÇÃO BINÁRIA ASSISTIDOS POR COMPUTADOR FASE 1: MÉTODO McCABE-THIELE Souza, L. C. 1, Lossávaro,
PQI 3103 LISTA DE EXERCÍCIOS II 2018 BALANÇOS MATERIAIS SISTEMAS EM REGIME PERMANENTE SEM REAÇÕES QUÍMICAS
 Pág. 1/6 PQI 3103 LISTA DE EXERCÍCIOS II 2018 BALANÇOS MATERIAIS SISTEMAS EM REGIME PERMANENTE SEM REAÇÕES QUÍMICAS Exercícios para apoio ao estudo não é necessário entregar a solução da lista Observação:
Pág. 1/6 PQI 3103 LISTA DE EXERCÍCIOS II 2018 BALANÇOS MATERIAIS SISTEMAS EM REGIME PERMANENTE SEM REAÇÕES QUÍMICAS Exercícios para apoio ao estudo não é necessário entregar a solução da lista Observação:
DESTILAÇÃO DE UMA MISTURA BINÁRIA AZEOTRÓPICA
 Instituto Superior de Engenharia de Coimbra DESTILAÇÃO DE UMA MISTURA BINÁRIA AZEOTRÓPICA M.N. Coelho Pinheiro, B.P.M. Duarte, M.J. Moura, L.M.T. Santos 1 TRABALHO: Destilação de uma mistura binária azeotrópica
Instituto Superior de Engenharia de Coimbra DESTILAÇÃO DE UMA MISTURA BINÁRIA AZEOTRÓPICA M.N. Coelho Pinheiro, B.P.M. Duarte, M.J. Moura, L.M.T. Santos 1 TRABALHO: Destilação de uma mistura binária azeotrópica
Extração e Purificação do Limoneno Parte II
 Extração e Purificação do Limoneno Parte II Alan Cesar Pilon Andrey Pinheiro Técnicas para extração e purificação do Limoneno Extração com Solvente Destilação por arraste de vapor Destilação Fracionada
Extração e Purificação do Limoneno Parte II Alan Cesar Pilon Andrey Pinheiro Técnicas para extração e purificação do Limoneno Extração com Solvente Destilação por arraste de vapor Destilação Fracionada
UTFPR Termodinâmica 1 Avaliando Propriedades Termodinâmicas
 UTFPR Termodinâmica 1 Avaliando Propriedades Termodinâmicas Princípios de Termodinâmica para Engenharia Capítulo 3 Parte 2 Tabelas de Saturação As Tabelas A-2 e A-3 listam os valores de propriedades para
UTFPR Termodinâmica 1 Avaliando Propriedades Termodinâmicas Princípios de Termodinâmica para Engenharia Capítulo 3 Parte 2 Tabelas de Saturação As Tabelas A-2 e A-3 listam os valores de propriedades para
P1 - PROVA DE QUÍMICA GERAL 09/04/11
 P1 - PROVA DE QUÍMICA GERAL 09/04/11 Nome: Nº de Matrícula: GABARITO Turma: Assinatura: Questão Valor Grau Revisão 1 a 2,5 2 a 2,5 3 a 2,5 4 a 2,5 Total 10,0 Dados R = 0,0821 atm L mol -1 K -1 T (K) =
P1 - PROVA DE QUÍMICA GERAL 09/04/11 Nome: Nº de Matrícula: GABARITO Turma: Assinatura: Questão Valor Grau Revisão 1 a 2,5 2 a 2,5 3 a 2,5 4 a 2,5 Total 10,0 Dados R = 0,0821 atm L mol -1 K -1 T (K) =
Nome: Nº Sala. Hipóteses: o ar é gás perfeito ( R
 Termodinâmica I Ano Lectivo 2011/12 1º Ciclo-2ºAno/2º semestre (LEAmb LEAN MEAer MEMec) Exame, 26 / Junho/ 2012 P1 Nome: Nº Sala Problema 1 (5v) A figura representa um tanque rígido e adiabático com uma
Termodinâmica I Ano Lectivo 2011/12 1º Ciclo-2ºAno/2º semestre (LEAmb LEAN MEAer MEMec) Exame, 26 / Junho/ 2012 P1 Nome: Nº Sala Problema 1 (5v) A figura representa um tanque rígido e adiabático com uma
MÁQUINAS TÉRMICAS
 UNIVERSIDADE DE AVEIRO DEPARTAMENTO DE ENGENHARIA MECÂNICA EXERCÍCIOS DAS AULAS PRÁTICAS MÁQUINAS TÉRMICAS 2010-2011 DOCENTES RESPONSÁVEIS DEM Fernando Neto DEM João Oliveira DISCIPLINA Código 40544 Ano
UNIVERSIDADE DE AVEIRO DEPARTAMENTO DE ENGENHARIA MECÂNICA EXERCÍCIOS DAS AULAS PRÁTICAS MÁQUINAS TÉRMICAS 2010-2011 DOCENTES RESPONSÁVEIS DEM Fernando Neto DEM João Oliveira DISCIPLINA Código 40544 Ano
QUÍMICA. Soluções e Substâncias Inorgânicas. Propriedades Coligativas: Tonoscopia, Ebulioscopia, Crioscopia e Pressão Osmótica - Parte 2
 QUÍMICA Soluções e Substâncias Inorgânicas Propriedades Coligativas: Tonoscopia, Ebulioscopia, Crioscopia e Pressão Osmótica - Parte 2 Prof ª. Giselle Blois As PROPRIEDADES COLIGATIVAS são propriedades
QUÍMICA Soluções e Substâncias Inorgânicas Propriedades Coligativas: Tonoscopia, Ebulioscopia, Crioscopia e Pressão Osmótica - Parte 2 Prof ª. Giselle Blois As PROPRIEDADES COLIGATIVAS são propriedades
Energética Industrial
 Universidade do Minho Departamento de Engenharia Mecânica Energética Industrial Problemas propostos José Carlos Fernandes Teixeira 1) 1.5 kg de gelo à temperatura de 260 K, funde-se, à pressão de 1 bar,
Universidade do Minho Departamento de Engenharia Mecânica Energética Industrial Problemas propostos José Carlos Fernandes Teixeira 1) 1.5 kg de gelo à temperatura de 260 K, funde-se, à pressão de 1 bar,
TRANSPORTE DE MASSA. Alda Simões CEQ / MEF / 2015
 Livro de apoio: Christie Geankoplis, Transport Processes and Unit Operations, 3rd ed, 1993, Prentice Hall, cap 6 TRANSPORTE DE MASSA CEQ / MEF / 2015 Alda Simões Transporte molecular de massa Lei de Fick
Livro de apoio: Christie Geankoplis, Transport Processes and Unit Operations, 3rd ed, 1993, Prentice Hall, cap 6 TRANSPORTE DE MASSA CEQ / MEF / 2015 Alda Simões Transporte molecular de massa Lei de Fick
REDUÇÃO DO CONSUMO ENERGÉTICO DO PROCESSO DE DESTILAÇÃO
 REDUÇÃO DO CONSUMO ENERGÉTICO DO PROCESSO DE DESTILAÇÃO R. M. L. OLIVEIRA 1, C. V. ARAÚJO 2 e R. P. BRITO 3 1 Universidade Federal de Campina Grande, Departamento de Engenharia Química. 2 Universidade
REDUÇÃO DO CONSUMO ENERGÉTICO DO PROCESSO DE DESTILAÇÃO R. M. L. OLIVEIRA 1, C. V. ARAÚJO 2 e R. P. BRITO 3 1 Universidade Federal de Campina Grande, Departamento de Engenharia Química. 2 Universidade
TERMODINÂMICA PROPRIEDADES DAS SUBSTÂNCIAS PURAS
 TERMODINÂMICA PROPRIEDADES DAS SUBSTÂNCIAS PURAS Profa. Danielle Cardoso www.profadanielle.com.br danielle@profadanielle.com.br Substância Pura É um a substância que possui a mesma composição química em
TERMODINÂMICA PROPRIEDADES DAS SUBSTÂNCIAS PURAS Profa. Danielle Cardoso www.profadanielle.com.br danielle@profadanielle.com.br Substância Pura É um a substância que possui a mesma composição química em
EQUILÍBRIO LÍQUIDO-VAPOR. Fase vapor p,y i Fase líquida. x i
 Solução ideal: EQUILÍBRIO LÍQUIDO-VAPOR Fase vapor p,y i Fase líquida Consideremos uma solução: -Composta de várias substâncias voláteis; -A solução líquida e o vapor estão em equilíbrio; -A pressão total
Solução ideal: EQUILÍBRIO LÍQUIDO-VAPOR Fase vapor p,y i Fase líquida Consideremos uma solução: -Composta de várias substâncias voláteis; -A solução líquida e o vapor estão em equilíbrio; -A pressão total
Lei de Charles e Gay-Lussac V T. Pressão baixa. Pressão alta
 GASES Lei de Boyle V 1/P Lei de Charles e Gay-Lussac V T Pressão baixa Pressão alta Lei de Avogadro V n Equação dos gases perfeitos Lei de Boyle V 1/P Lei de Charles e Gay-Lussac Lei de Avogadro V T V
GASES Lei de Boyle V 1/P Lei de Charles e Gay-Lussac V T Pressão baixa Pressão alta Lei de Avogadro V n Equação dos gases perfeitos Lei de Boyle V 1/P Lei de Charles e Gay-Lussac Lei de Avogadro V T V
L. G. Oliveira, S. P. Nascimento, T. D. Romão, J. A. Cavalcante, N. A. Costa
 APLICATIVO EXCEL/VBA PARA ESTIMATIVAS DE COEFICIENTES DE ATIVIDADES A DILUIÇÃO INFINITA ATRAVÉS DO MODELO MOSCED E VERIFICAÇÃO DE AZEOTROPIA DE MISTURAS BINÁRIAS L. G. Oliveira, S. P. Nascimento, T. D.
APLICATIVO EXCEL/VBA PARA ESTIMATIVAS DE COEFICIENTES DE ATIVIDADES A DILUIÇÃO INFINITA ATRAVÉS DO MODELO MOSCED E VERIFICAÇÃO DE AZEOTROPIA DE MISTURAS BINÁRIAS L. G. Oliveira, S. P. Nascimento, T. D.
Capítulo 9 Processos Envolvendo Balanços Energéticos com Transição de Fase
 Capítulo 9 Processos Envolvendo Balanços Energéticos com Transição de Fase Durante uma transição de fase a temperatura e a pressão mantêm-se constantes, apesar do calor trocado pelo sistema ser diferente
Capítulo 9 Processos Envolvendo Balanços Energéticos com Transição de Fase Durante uma transição de fase a temperatura e a pressão mantêm-se constantes, apesar do calor trocado pelo sistema ser diferente
Aquecimento de um sistema
 Aquecimento de um sistema Aquecimento de diferentes quantidades de água Quando se fornece, num dado intervalo de tempo, a mesma quantidade de energia a dois sistemas, A e B, que diferem apenas na sua massa.
Aquecimento de um sistema Aquecimento de diferentes quantidades de água Quando se fornece, num dado intervalo de tempo, a mesma quantidade de energia a dois sistemas, A e B, que diferem apenas na sua massa.
X Congresso Brasileiro de Engenharia Química Iniciação Científica
 Blucher Chemical Engineering Proceedings Dezembro de 204, Volume, Número X Congresso Brasileiro de Engenharia Química Iniciação Científica Influência da pesquisa em Engenharia Química no desenvolvimento
Blucher Chemical Engineering Proceedings Dezembro de 204, Volume, Número X Congresso Brasileiro de Engenharia Química Iniciação Científica Influência da pesquisa em Engenharia Química no desenvolvimento
Termodinâmica e Estrutura da Matéria (MEFT)
 Termodinâmica e Estrutura da Matéria (MEFT) 2014-2015 Vasco Guerra Carlos Augusto Santos Silva carlos.santos.silva@tecnico.ulisboa.pt Versão 1.0 24-1-2014 1. Um inventor diz que desenvolveu uma máquina
Termodinâmica e Estrutura da Matéria (MEFT) 2014-2015 Vasco Guerra Carlos Augusto Santos Silva carlos.santos.silva@tecnico.ulisboa.pt Versão 1.0 24-1-2014 1. Um inventor diz que desenvolveu uma máquina
Problema 1 (5V)- resposta correcta=1v; resposta incorrecta= v; sem resposta =0v
 P1 Problema 1 (5V)- resposta correcta=1v; resposta incorrecta= - 0.25v; sem resposta =0v Para aumentar o rendimento de um ciclo de potência reversível, que opera entre duas fontes de energia com temperatura
P1 Problema 1 (5V)- resposta correcta=1v; resposta incorrecta= - 0.25v; sem resposta =0v Para aumentar o rendimento de um ciclo de potência reversível, que opera entre duas fontes de energia com temperatura
INTRODUÇÃO À QUÍMICA FÍSICA
 FACULDADE DE CIÊNCIAS E TECNOLOGIA DEPARTAMENTO DE QUÍMICA, BIOQUÍMICA E FARMÁCIA Orientação tutorial INTRODUÇÃO À QUÍMICA FÍSICA 1º Ano Q/BQ/CF/F/MIEB/BT Ano Lectivo: 2008 / 2009 (5º Módulo) 2009 IQF
FACULDADE DE CIÊNCIAS E TECNOLOGIA DEPARTAMENTO DE QUÍMICA, BIOQUÍMICA E FARMÁCIA Orientação tutorial INTRODUÇÃO À QUÍMICA FÍSICA 1º Ano Q/BQ/CF/F/MIEB/BT Ano Lectivo: 2008 / 2009 (5º Módulo) 2009 IQF
PME 3344 Termodinâmica Aplicada
 PME 3344 Termodinâmica Aplicada Aula de exercícios 01 1 v. 1.3 Exercício 01 Considere o conjunto mostrado na figura. O pistão pode mover-se sem atrito entre os dois conjuntos de batentes. Quando o pistão
PME 3344 Termodinâmica Aplicada Aula de exercícios 01 1 v. 1.3 Exercício 01 Considere o conjunto mostrado na figura. O pistão pode mover-se sem atrito entre os dois conjuntos de batentes. Quando o pistão
DL 242/2001, de 31 de Agosto Conceitos técnicos e legais. Francisco Póvoas Técnico superior - CCDRC
 DL 242/2001, de 31 de Agosto Conceitos técnicos e legais Francisco Póvoas Técnico superior - CCDRC 1 Tópicos da apresentação Definições de: Solvente; Composto orgânico = Compostos de carbono Compostos
DL 242/2001, de 31 de Agosto Conceitos técnicos e legais Francisco Póvoas Técnico superior - CCDRC 1 Tópicos da apresentação Definições de: Solvente; Composto orgânico = Compostos de carbono Compostos
6. Propriedades dos gases e líquidos. Mudanças de fase.
 6. Propriedades dos gases e líquidos. Mudanças de fase. Gases Num gás a densidade é baixa e portanto as moléculas estão em média muito afastadas umas das outras. As suas interacções são muito fracas, porque
6. Propriedades dos gases e líquidos. Mudanças de fase. Gases Num gás a densidade é baixa e portanto as moléculas estão em média muito afastadas umas das outras. As suas interacções são muito fracas, porque
1ª Lei da Termodinâmica lei da conservação de energia
 1ª Lei da Termodinâmica lei da conservação de energia É de bastante interesse em análises termodinâmicas conhecer o balanço energético dos sistemas, principalmente durante trocas de estado A 1ª Lei da
1ª Lei da Termodinâmica lei da conservação de energia É de bastante interesse em análises termodinâmicas conhecer o balanço energético dos sistemas, principalmente durante trocas de estado A 1ª Lei da
Cap. 4: Análise de Volume de Controle
 Cap. 4: Análise de Volume de Controle AR Ar+Comb. www.mecanicavirtual.org/carburador2.htm Cap. 4: Análise de Volume de Controle Entrada, e Saída, s Conservação da Massa em um Sistema dm dt sist = 0 Conservação
Cap. 4: Análise de Volume de Controle AR Ar+Comb. www.mecanicavirtual.org/carburador2.htm Cap. 4: Análise de Volume de Controle Entrada, e Saída, s Conservação da Massa em um Sistema dm dt sist = 0 Conservação
Disciplina : Máquinas Térmicas e de Fluxo. Aula 2 Propriedades Termodinâmicas
 Disciplina : Máquinas Térmicas e de Fluxo Aula 2 Propriedades Termodinâmicas Prof. Evandro Rodrigo Dário, Dr. Eng. Líquido comprimido Considere-se um dispositivo de cilindropistão contendo água na fase
Disciplina : Máquinas Térmicas e de Fluxo Aula 2 Propriedades Termodinâmicas Prof. Evandro Rodrigo Dário, Dr. Eng. Líquido comprimido Considere-se um dispositivo de cilindropistão contendo água na fase
Prof. Dr. José Eduardo de Oliveira Adriana Teixeira Machado Marcela Dias da Silva Matheus Gibbin Zanzini
 Prof. Dr. José Eduardo de Oliveira Adriana Teixeira Machado Marcela Dias da Silva Matheus Gibbin Zanzini Filtração Fonte de aquecimento Destilação Correção do ponto de ebulição OBJETIVO: Remover impurezas
Prof. Dr. José Eduardo de Oliveira Adriana Teixeira Machado Marcela Dias da Silva Matheus Gibbin Zanzini Filtração Fonte de aquecimento Destilação Correção do ponto de ebulição OBJETIVO: Remover impurezas
Destilação fracionada. Destilação por arraste à vapor. Extração
 ISOLAMENTO DE COMPOSTOS ORGÂNICOS VOLÁTEIS DE FONTES NATURAIS OBJETIVO isolar e purificar o limoneno do óleo de laranja TÉCNICAS UTILIZADAS Destilação fracionada Extração Limoneno CH3 H2C CH3 1-metil-4
ISOLAMENTO DE COMPOSTOS ORGÂNICOS VOLÁTEIS DE FONTES NATURAIS OBJETIVO isolar e purificar o limoneno do óleo de laranja TÉCNICAS UTILIZADAS Destilação fracionada Extração Limoneno CH3 H2C CH3 1-metil-4
Equilíbrio Físico. Equilíbrio físico estado no qual duas ou mais fases de uma substância coexistem sem uma tendência a mudança.
 Equilíbrio Físico Equilíbrio físico estado no qual duas ou mais fases de uma substância coexistem sem uma tendência a mudança. FASES E TRANSIÇÕES DE FASES SOLUBILIDADE PROPRIEDADES COLIGATIVAS MISTURAS
Equilíbrio Físico Equilíbrio físico estado no qual duas ou mais fases de uma substância coexistem sem uma tendência a mudança. FASES E TRANSIÇÕES DE FASES SOLUBILIDADE PROPRIEDADES COLIGATIVAS MISTURAS
b) Qual o menor fluxo de calor que deve ser retirado ao tanque de água para que todo o sistema funcione e retire 1kW à casa.
 Termodinâmica I 1º Exame 13 de Janeiro de 2005 (Duração da Prova : 180 min) Problema 1 (6 valores) Pretende-se manter a temperatura de uma casa em 20ºC, quando o ar exterior está a 32ºC, com uma máquina
Termodinâmica I 1º Exame 13 de Janeiro de 2005 (Duração da Prova : 180 min) Problema 1 (6 valores) Pretende-se manter a temperatura de uma casa em 20ºC, quando o ar exterior está a 32ºC, com uma máquina
UNIVERSIDADE ZAMBEZE. Fundamentos de Combustão Aula 2-Prática Prof. Jorge Nhambiu
 UNIVERSIDADE ZAMBEZE Fundamentos de Combustão Aula 2-Prática Aula 2. Tópicos Termodinâmica da combustão: Revisão dos conceitos da primeira lei; Propriedades das misturas; Estequiometria da combustão; Energia
UNIVERSIDADE ZAMBEZE Fundamentos de Combustão Aula 2-Prática Aula 2. Tópicos Termodinâmica da combustão: Revisão dos conceitos da primeira lei; Propriedades das misturas; Estequiometria da combustão; Energia
Refrigeração e Ar Condicionado
 Refrigeração e Ar Condicionado Psicrometria Filipe Fernandes de Paula filipe.paula@engenharia.ufjf.br Departamento de Engenharia de Produção e Mecânica Faculdade de Engenharia Universidade Federal de Juiz
Refrigeração e Ar Condicionado Psicrometria Filipe Fernandes de Paula filipe.paula@engenharia.ufjf.br Departamento de Engenharia de Produção e Mecânica Faculdade de Engenharia Universidade Federal de Juiz
Metal, Não Metal e Metaloide
 Metal, Não Metal e Metaloide 1 Metal, Não Metal e Metaloide Metal: conduz eletricidade, tem brilho, é maleável e dúctil Ex: cobre Não metal: não... Ex: Enxofre Metaloide: aparência e algumas propriedades
Metal, Não Metal e Metaloide 1 Metal, Não Metal e Metaloide Metal: conduz eletricidade, tem brilho, é maleável e dúctil Ex: cobre Não metal: não... Ex: Enxofre Metaloide: aparência e algumas propriedades
Segunda Lei da Termodinâmica
 Físico-Química I Profa. Dra. Carla Dalmolin Segunda Lei da Termodinâmica Espontaneidade das reações químicas Entropia Terceira Lei da Termodinâmica Primeira Lei da Termodinâmica Estabelece que as transformações
Físico-Química I Profa. Dra. Carla Dalmolin Segunda Lei da Termodinâmica Espontaneidade das reações químicas Entropia Terceira Lei da Termodinâmica Primeira Lei da Termodinâmica Estabelece que as transformações
PQI 3211 LISTA DE EXERCÍCIOS BALANÇOS MATERIAIS COM REAÇÕES QUÍMICAS
 PQI 3211 LISTA DE EXERCÍCIOS BALANÇOS MATERIAIS COM REAÇÕES QUÍMICAS Para problemas com múltiplas unidades de processamento, realize a análise do número de graus de liberdade para cada unidade, para o
PQI 3211 LISTA DE EXERCÍCIOS BALANÇOS MATERIAIS COM REAÇÕES QUÍMICAS Para problemas com múltiplas unidades de processamento, realize a análise do número de graus de liberdade para cada unidade, para o
PROPRIEDADES COLIGATIVAS. Tonoscopia Pg. 320
 PROPRIEDADES COLIGATIVAS Tonoscopia Pg. 320 O que é estudado em propriedades coligativas? É estudado a alteração de algumas propriedades devido à adição de um soluto não volátil a um solvente. As variações
PROPRIEDADES COLIGATIVAS Tonoscopia Pg. 320 O que é estudado em propriedades coligativas? É estudado a alteração de algumas propriedades devido à adição de um soluto não volátil a um solvente. As variações
Extração Líquido-Líquido
 Extração Líquido-Líquido Prof. Universidade Federal do Pampa BA310 Curso de Engenharia Química Campus Bagé 18 de outubro de 2016 Extração Líquido-Líquido 1 / 43 Introdução Extração Líquido-Líquido 2 /
Extração Líquido-Líquido Prof. Universidade Federal do Pampa BA310 Curso de Engenharia Química Campus Bagé 18 de outubro de 2016 Extração Líquido-Líquido 1 / 43 Introdução Extração Líquido-Líquido 2 /
P2 - PROVA DE QUÍMICA GERAL - 09/05/08
 2 - ROVA DE QUÍMICA GERAL - 09/05/08 Nome: GABARITO Nº de Matrícula: Turma: Assinatura: Quão Valor Grau Revisão 1 a 2,5 2 a 2,5 3 a 2,5 4 a 2,5 Total 10,0 Constantes: R 8,314 J mol -1 K -1 0,0821 atm L
2 - ROVA DE QUÍMICA GERAL - 09/05/08 Nome: GABARITO Nº de Matrícula: Turma: Assinatura: Quão Valor Grau Revisão 1 a 2,5 2 a 2,5 3 a 2,5 4 a 2,5 Total 10,0 Constantes: R 8,314 J mol -1 K -1 0,0821 atm L
Umidificaçãoe Desumidificação. Prof. Dr. Félix Monteiro Pereira
 Umidificaçãoe Desumidificação Prof. Dr. Félix Monteiro Pereira Introdução Umidificação e Desumidificação: Operações Unitárias que envolvem transferência simultânea de calor e massa. Estão envolvidos dois
Umidificaçãoe Desumidificação Prof. Dr. Félix Monteiro Pereira Introdução Umidificação e Desumidificação: Operações Unitárias que envolvem transferência simultânea de calor e massa. Estão envolvidos dois
Físico-Química II Termodinâmica de Soluções
 Físico-Química II Termodinâmica de Soluções Este material está disponível no endereço: https://sites.google.com/site/otavioquimica/ Programa da Disciplina: Conteúdo CONTEÚDO Transformações Físicas (Substâncias
Físico-Química II Termodinâmica de Soluções Este material está disponível no endereço: https://sites.google.com/site/otavioquimica/ Programa da Disciplina: Conteúdo CONTEÚDO Transformações Físicas (Substâncias
EXTRAÇÃO DO ÓLEO DE LARANJA A PARTIR DAS CASCAS DE LARANJA DESTILAÇÃO POR ARRASTAMENTO DE VAPOR
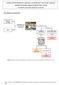 EXTRAÇÃO DO ÓLEO DE LARANJA A PARTIR DAS CASCAS DE LARANJA DESTILAÇÃO POR ARRASTAMENTO DE VAPOR Procedimento experimental adaptado de J. H. Beatty 1 Procedimento experimental Figura 1. Esquema resumo do
EXTRAÇÃO DO ÓLEO DE LARANJA A PARTIR DAS CASCAS DE LARANJA DESTILAÇÃO POR ARRASTAMENTO DE VAPOR Procedimento experimental adaptado de J. H. Beatty 1 Procedimento experimental Figura 1. Esquema resumo do
