Biofísica I Turma de Biologia FFCLRP USP Prof. Antônio Roque Difusão
|
|
|
- Milena Brunelli Macedo
- 7 Há anos
- Visualizações:
Transcrição
1 A difusão pode ser definida como o processo pelo qual uma população de partículas é transportada de regiões de alta concentração para regiões de baixa concentração de maneira a diminuir o gradiente de concentraçãoo de partículas no meio. Introdução Histórica As primeiras medidas sistemáticas de um processo de difusão foram feitas pelo químico escocês Thomas Graham ( ), que estudou difusão de gases e líquidos entre 1828 e Por exemplo, para estudar a difusão de substâncias na água, Graham encheu dois reservatórios com diferentes concentrações de ácidos ou sais em água, permitiu que os conteúdos dos dois reservatórios se comunicassem por vários dias, e então analisou os seus conteúdos. Graham observou que a quantidade de soluto transportada decrescia em função do tempo e que a quantidade de soluto que se difundia durante um período fixo de tempo de um recipiente cheio para um recipiente vazio era proporcional à quantidade de soluto inicialmente presente. 1
2 Em 1855, o médico e fisiologista alemão Adolf Fick ( ), então professor associado de anatomia e fisiologia da Universidade de Zurique, propôs leis fenomenológicas para a difusão de um soluto em um solvente (que atualmente levam o seu nome). Vale a pena reproduzir um trecho dos escritos de Fick: Há alguns anos atrás, Graham publicou uma vasta investigação sobre a difusão de sais em água, na qual ele especificamente comparou a difusibiliade de diferentes sais. Me parece, no entanto, lamentável que em tal investigação tão valiosa e abrangente o desenvolvimento de uma lei fundamental para a operação da difusão em um único elemento de espaço tenha sido desprezado, e eu tenho trabalhado no sentido de suprir esta omissão. Foi bastante natural supor que essa lei para a difusão de um sal no seu solvente deva ser idêntica àquela que descreve a difusão de calor em um meio condutor, com base na qual Fourier fundou sua celebrada teoria do calor, e que é a mesma que Ohm aplicou com extraordinário sucesso à difusão de eletricidade em um condutor. De acordo com essa lei, a transferência de sal e água durante uma unidade de tempo entre dois elementos de espaço preenchidos com soluções do mesmo sal em concentrações diferentes deve ser, caetaris paribus, diretamente proporcional à diferença de concentração e inversamente proporcional à distância entre os dois elementos. 2
3 Portanto, Fick nada mais fez do que propor um modelo para difusão de um soluto em um solvente análogo aos modelos de Fourier para a condução de calor e de Ohm para a condução de eletricidade (mostrando que um tipo de processo pode ser comum a vários sistemas físicos). Definições das variáveis envolvidas A menos que se diga algo em contrário, vamos desenvolver a teoria aqui para movimentos em 1 dimensão. Concentração c(x,t): concentração de partículas no ponto x no instante t, em unidades de mol/cm 3. Esta é a concentração molar, ou molaridade. A concentração pode ser definida da seguinte maneira: imagine um pequeno elemento de volume ΔV contendo um número de partículas ΔN. O número de moles de partículas no elemento de volume é ΔN/N A, onde N A é o número de Avogadro (6,022 x ). O número de moles por elemento de volume é ΔN/(N A ΔV). A concentração molar é definida como o limite do número de moles por unidade de volume quando o elemento de volume tende a zero. 3
4 Devido à natureza atômica (isto é, não contínua) da matéria, existe um problema com esta definição: matematicamente, o elemento de volume pode ser feito tão pequeno (menor até que o tamanho de uma partícula) que a probabilidade de se encontrar uma partícula dentro do elemento de volume também se torna muito pequena. Porém, há uma maneira física de imaginar este processo de limite para compatibilizá-lo com as leis macroscópicas para a difusão nele baseadas: os elementos de volume devem ter dimensões pequenas em comparação com a distância dentro da qual a concentração de partículas varia apreciavelmente, mas suficientemente grandes para conter um grande número de partículas. As unidades em que se costuma medir a concentração de um soluto em uma solução são as seguintes: Molaridade = Moles de soluto Litros de solução = c Molalidade = Moles de soluto Kilogramas de solvente = m Fração molar = Moles de soluto Moles de solução 4
5 Massa percentual = Kilogramas de soluto Kilogramas de solução x 100 Exercício: obter a fórmula para conversão de m em c para um kilograma de solvente (água). A fórmula é: c = ρm ( 10 3 mm +1), onde M é o peso molecular do soluto em g/mol. Note que, como a densidade da água é aproximadamente 1 g/cm 3, a molaridade e a molalidade são numericamente próximas para baixas concentrações de soluto; porém, para grandes concentrações de soluto as diferenças começam a ficar grandes. Fluxo O fluxo de partículas φ (x,t) é número líquido de moles de partículas cruzando uma área unitária perpendicular ao eixo x, localizada em x, por unidade de tempo, no instante t. As unidades de φ são mol/(cm 2.s). 5
6 Em três dimensões, o fluxo é definido como o número líquido de moles de partículas que cruza uma superfície de área unitária em uma unidade de tempo. Portanto, o fluxo é um vetor (isto é, ele tem componentes nas direções x, y e z). Em uma dimensão, o fluxo reduz-se a um escalar. A lei de Fick Considere uma situação como a da figura abaixo. Dois reservatórios contendo soluções neutras nas quais está presente um soluto S (indicado por bolinhas vermelhas) estão separados por uma membrana permeável apenas a S. Suponha que a concentração de soluto seja constante em cada reservatório, mas que, no início, ela seja maior no reservatório da esquerda do que no da direita. Por causa da diferença de concentração de soluto, este se difunde pela membrana semipermeável ao longo do tempo até que as concentrações de S nos dois reservatórios se igualem. 6
7 Em analogia com o fluxo de calor entre dois corpos a temperaturas diferentes, Fick propôs que o fluxo por difusão φ(x,t) do soluto S é proporcional ao gradiente de concentração entre os dois lados da membrana, φ(x,t) = D Δc( x,t) Δx, (1) onde D ( 0) é chamado de coeficiente de difusão e vamos representar o gradiente da concentração aqui por Δc/Δx. O gradiente de uma grandeza que varia espacialmente, como a temperatura e a concentração, por exemplo, indica a direção do espaço em que essa grandeza sofre maior variação. 7
8 Por exemplo, imagine que você está caminhando por um terreno usando uma mapa que dê as curvas de nível do terreno. As curvas de nível são linhas imaginárias que unem pontos do terreno sempre com a mesma altura. Imagine que as curvas de nível sejam as da figura abaixo. O gradiente de altura é um vetor que, em cada ponto, aponta para a região onde a altura é máxima e o faz cortando ortogonalmente as curvas de nível. A figura abaixo mostra o gradiente para alguns pontos do terreno. 8
9 Em uma dimensão, como é o caso considerado aqui, a grandeza só pode variar para um lado ou para o outro. Portanto, o gradiente aponta para o lado em que a grandeza cresce (ver figura mais abaixo). A equação (1) é chamada de lei de Fick. Quais são as unidades do coeficiente de difusão D? A análise dimensional nos revela isso: [ D] = [ quantidade de partículas] [ área] [ tempo] [ volume] [ comprimento ] [ quantidade de partículas] = [ área] [ tempo]. Portanto, as unidades de D são independentes das unidades usadas para medir quantidade de partículas (moles ou número de partículas), desde que sejam usadas unidades consistentes tanto para a concentração como para o fluxo. Neste curso, a menos que se diga algo em contrário, D será dado em cm 2 /s. O valor numérico de D depende das características tanto das partículas como do meio no qual ocorre a difusão. Em geral, o valor de D é determinado experimentalmente ao invés de por primeiros princípios. 9
10 No entanto, existem modelos microscópicos para difusão que permitem uma interpretação de D a partir de grandezas físicas fundamentais. Como D 0, o sinal negativo na lei de Fick indica que o fluxo se dá de uma região de alta concentração para uma de baixa concentração. A figura a seguir mostra um exemplo de variação espacial (unidimensional) da concentração de um soluto em um determinado instante de tempo. O valor da concentração está indicado pelo tom de cinza, do mais forte (maior concentração) ao mais fraco (menor concentração). Os gráficos a seguir mostram a varição da concentração (parte de acima) e do fluxo (parte de baixo) em função da variável espacial x para o caso acima. Certifique-se de que você entende o que esses gráficos querem dizer. 10
11 Duas características da Lei de Fick devem ser notadas: Primeiro, ela é uma lei linear: por maior que a diferença de concentração entre os dois lados da membrana se torne, o fluxo permanece proporcional ao gradiente, ou seja, não existe um processo de saturação. Segundo, a lei implica uma independência de fluxos: o fluxo do soluto S é independente do fluxo de outros solutos X e Y, ou seja, não existe acoplamento entre os fluxos. 11
12 Descrição Microscópica da Introdução Em 1827, o botânico escocês Robert Brown ( ) observou com um microscópio simples o movimento errático de pequenas partículas no interior de grãos de pólen. Inicialmente, ele pensou que esse movimento estaria associado à vitalidade dos grãos de pólen, mas observações posteriores com partículas inorgânicas em suspensão revelaram que elas também exibiam este comportamento, desde que as suas dimensões fossem suficientemente pequenas. Este tipo de movimento foi chamado de movimento browniano e a sua explicação quantitativa foi feita por Albert Einstein ( ) em 1905 (um dos annus mirabilis da história da física). O movimento browniano de uma partícula em suspensão resulta do fato de que ela está continuamente sendo bombardeada pelas moléculas que compõem o meio, as quais estão em constante agitação térmica. Em outras palavras, o movimento browniano é um fenômeno observável durante um tempo de observação macroscópico relacionado ao movimento de agitação térmica das moléculas do meio (invisíveis ao microscópio) e ao efeito desse movimento, 12
13 devido a colisões, sobre uma partícula presente no meio (visível ao microscópio). Portanto, o movimento browniano é uma espécie de janela para observar (indiretamente, através dos seus efeitos) o movimento molecular invisível ao microscópio. A figura abaixo representa uma trajetória browniana típica entre dois pontos A e B durante um tempo de observação macroscópico. É interessante notar que a teoria de Einstein para o movimento browniano forneceu um enorme suporte para a então embrionária teoria atômica da matéria. Por todo o século XIX e até a primeira década do século XX, a hipótese de que a matéria é formada por átomos, que pode ser datada da Grécia antiga, com Leucipo (primeira metade do século V a.c.) e Demócrito (ca. 460 a.c. ca. 370 a,c.), foi muito criticada por 13
14 importantes cientistas, como, por exemplo, o físico austríaco Ernst Mach ( ) e o químico alemão Wilhelm Ostwald ( ). O principal argumento desses cientistas contra a teoria atômica era o de que não havia evidência experimental em favor da existência de átomos e moléculas. A teoria de Einstein para o movimento browniano, baseada na hipótese de que esse movimento é devido à agitação térmica das moléculas do meio, foi validada experimentalmente em 1909 pelo físico francês Jean Perrin ( ) e, a partir de então, a natureza molecular da matéria deixou de ser puramente uma hipótese e passou a ser a base para nossa compreensão da estrutura da matéria. A base microscópica da lei de Fick Einstein percebeu que o movimento errático de uma partícula em um meio composto por moléculas colidindo com ela é mais bem descrito em termos probabilísticos. O modelo probabilístico mais simples que permite um entendimento das leis macroscópicas da difusão em termos do movimento browniano de partículas é o modelo do passeio aleatório em uma dimensão. 14
15 No modelo do passeio aleatório unidimensional, consideramos uma partícula com movimentos restritos apenas ao eixo x. Ela parte da origem em t = 0 e, a cada τ segundos, move-se de acordo com a seguinte lei probabilística: ela pode dar um passo de tamanho l para a direita com probabilidade ½ ou um passo para a esquerda, também de tamanho l, com probabilidade ½. A lei de Fick pode ser deduzida a partir desse modelo simples. Para tal, vamos considerar um elemento de volume como o da figura abaixo, com comprimento igual a 2l e seção reta de área A. Vamos procurar deduzir uma expressão para o número líquido de partículas que cruza a superfície pintada de área A localizada em x num intervalo de tempo τ. 15
16 Como, por hipótese, as partículas se movem de acordo com as leis do passeio aleatório unidimensional, nenhuma partícula que estiver fora do elemento de volume da figura irá cruzar a área central A em um intervalo de tempo τ. Portanto, só precisamos nos preocupar com as partículas que estiverem no interior do volume no início do intervalo de tempo. Das partículas que estiverem à esquerda da área A no início desse intervalo, em média, metade irá cruzá-la passando para a direita. Da mesma forma, em média, metade das partículas que estiverem à direita da área A irá cruzá-la para a esquerda. Quantas partículas estão à esquerda da área A? Usando c( x l 2, t) (o valor da concentração no ponto médio do lado esquerdo) para representar a concentração de partículas no lado esquerdo do elemento de volume no instante t, o número de partículas do lado esquerdo é dado por c( x l 2, t) Al. Metade desse número é, então, ( ( x l 2, t) Al) /2. c Da mesma forma, metade das partículas no lado direito é dada por ( c ( x + l 2, t) Al) /2. Seja φ + o fluxo de partículas cruzando a área A da esquerda para a direita durante o período τ e φ o fluxo de partículas cruzando a área A da direita para a esquerda no mesmo período. Então: 16
17 φ + = 1 2 c x l / 2,t ( ) Al Aτ e φ = (1) Portanto, o fluxo líquido cruzando a área A vale: 1 2 c x + l / 2,t ( ) Al φ = φ + φ = l ( 2τ c ( x l / 2,t ) c( x + l / 2,t) ). (2) Aτ. A ordem de grandeza do tamanho do passo l dado por uma partícula a cada intervalo de tempo τ deve ser bem menor do que as dimensões macroscópicas dentro das quais se observa o movimento browniano. Ou seja, l << x. A taxa de variação de c em relação a x pode ser escrita como ou Δc(x, t) Δx Δc(x, t) Δx ( ) c( x,t) = c x + Δx,t Δx ( ) c( x Δx,t) = c x,t Δx ( ) c( x,t) = c x + l / 2,t l / 2 ( ) c( x l / 2,t) = c x,t l / 2 Rearrangando as duas equações acima, pode-se escrever c( x + l / 2,t) = c(x)+ Δc(x,t) Δx l 2 e c( x l / 2,t) = c(x) Δc(x,t) Δx l 2. 17
18 Substituindo estas duas expressões em (2): φ = l )# + % c(x,t) l 2τ * $ 2 Δc(x, t) Δx & # ( % c(x,t)+ l ' $ 2 Δc(x, t) Δx &, (. '. - Desenvolvendo a equação acima chega-se a φ = l 2 Δc(x, t). (3) 2τ Δx Esta equação é equivalente à lei de Fick em uma dimensão (equação 1). O fluxo unidimensional de partículas é proporcional ao negativo do gradiente da concentração de partículas. Esta dedução nos mostra que, mesmo que as partículas individuais não tenham um sentido preferencial de movimento (elas podem ir tanto para a direita como para a esquerda), a existência de um excesso de partículas de um lado em relação ao outro (o gradiente de c) leva naturalmente ao aparecimento da difusão observada macroscopicamente. Note que se houver exatamente o mesmo número de partículas de ambos os lados do volume o fluxo líquido será zero (veja a equação 2). 18
19 Comparando a equação (3) com a equação (1), vemos que o coeficiente de difusão (uma variável macroscópica) está relacionado às variáveis microscópicas que descrevem o movimento aleatório das partículas por 2 l D =. (4) 2τ A variável l pode ser interpretada como o livre caminho médio das partículas (o valor médio das distâncias percorridadas pelas partículas entre duas colisões com as moléculas do meio) e a variável τ pode ser interpretada como o tempo médio entre duas colisões. 19
Descrição Microscópica da Difusão. Introdução
 Descrição Microscópica da Difusão 5910187 Biofísica II FFCLRP USP Prof. Antônio Roque Aula Introdução Em 187, o botânico escocês Robert Brown (1773-1858) observou com um microscópio simples o movimento
Descrição Microscópica da Difusão 5910187 Biofísica II FFCLRP USP Prof. Antônio Roque Aula Introdução Em 187, o botânico escocês Robert Brown (1773-1858) observou com um microscópio simples o movimento
Difusão. Introdução Histórica
 Estas notas de aula estão fortemente baseadas no livro de T. F. Weiss (2 vols.) indicado na bibliografia. Difusão A difusão pode ser definida como o processo pelo qual uma população de partículas é transportada
Estas notas de aula estão fortemente baseadas no livro de T. F. Weiss (2 vols.) indicado na bibliografia. Difusão A difusão pode ser definida como o processo pelo qual uma população de partículas é transportada
Primeira Lista de Exercícios de Biofísica II. c n
 Primeira Lista de Exercícios de Biofísica II 1. Considere uma célula composta por um corpo celular ao qual está preso um longo e fino processo tubular (por exemplo, o axônio de um neurônio ou o flagelo
Primeira Lista de Exercícios de Biofísica II 1. Considere uma célula composta por um corpo celular ao qual está preso um longo e fino processo tubular (por exemplo, o axônio de um neurônio ou o flagelo
Transporte Iônico e o Potencial de Membrana
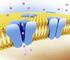 Transporte Iônico e o Potencial de Membrana Até o momento, consideramos apenas o transporte de solutos neutros (sem carga elétrica) através da membrana celular. A partir de agora, vamos passar a estudar
Transporte Iônico e o Potencial de Membrana Até o momento, consideramos apenas o transporte de solutos neutros (sem carga elétrica) através da membrana celular. A partir de agora, vamos passar a estudar
Teoria Cinética dos Gases
 CENTRO DE CIÊNCIAS E TECNOLOGIA AGROALIMENTAR UNIDADE ACADÊMICA DE TECNOLOGIA DE ALIMENTOS DISCIPLINA: FÍSICA II Teoria Cinética dos Gases Prof. Bruno Farias Introdução Termodinâmica é o estudo das transformações
CENTRO DE CIÊNCIAS E TECNOLOGIA AGROALIMENTAR UNIDADE ACADÊMICA DE TECNOLOGIA DE ALIMENTOS DISCIPLINA: FÍSICA II Teoria Cinética dos Gases Prof. Bruno Farias Introdução Termodinâmica é o estudo das transformações
Difusão em sólidos. Introdução e História da Difusão. Prof. Rodrigo Perito Cardoso
 Universidade Federal do Paraná Setor de Tecnologia Departamento de Engenharia Mecânica Difusão em sólidos Introdução e História da Difusão Prof. Rodrigo Perito Cardoso Definição Difusão é o transporte
Universidade Federal do Paraná Setor de Tecnologia Departamento de Engenharia Mecânica Difusão em sólidos Introdução e História da Difusão Prof. Rodrigo Perito Cardoso Definição Difusão é o transporte
Termometria. Ao entrarmos em contato com um corpo, através do nosso tato, temos uma sensação subjetiva de seu estado térmico (quente, morno, frio).
 Termometria Ao entrarmos em contato com um corpo, através do nosso tato, temos uma sensação subjetiva de seu estado térmico (quente, morno, frio). a água morna parecerá quente para a mão direita e fria
Termometria Ao entrarmos em contato com um corpo, através do nosso tato, temos uma sensação subjetiva de seu estado térmico (quente, morno, frio). a água morna parecerá quente para a mão direita e fria
Difusão em sólidos. Teoria do Contínuo da Difusão. Prof. Rodrigo Perito Cardoso
 Universidade Federal do Paraná Setor de Tecnologia Departamento de Engenharia Mecânica Difusão em sólidos Teoria do Contínuo da Difusão Prof. Rodrigo Perito Cardoso Leis de Fick Representam uma abordagem
Universidade Federal do Paraná Setor de Tecnologia Departamento de Engenharia Mecânica Difusão em sólidos Teoria do Contínuo da Difusão Prof. Rodrigo Perito Cardoso Leis de Fick Representam uma abordagem
Física II FEP 112 ( ) 1º Semestre de Instituto de Física - Universidade de São Paulo. Professor: Valdir Guimarães
 Física II FEP 11 (4300110) 1º Semestre de 01 Instituto de Física - Universidade de São Paulo Professor: Valdir Guimarães E-mail: valdir.guimaraes@usp.br Fone: 3091-7104(05) Aula 1 Temperatura e Teoria
Física II FEP 11 (4300110) 1º Semestre de 01 Instituto de Física - Universidade de São Paulo Professor: Valdir Guimarães E-mail: valdir.guimaraes@usp.br Fone: 3091-7104(05) Aula 1 Temperatura e Teoria
BIOMEMBRANAS. M Filomena Botelho
 BIOMEMBRANAS M Filomena Botelho Transporte de massa Transporte de moléculas neutras Transporte de iões Noções de bioelectricidade Biomembranas Transporte de massa Transporte de massa ou transferência de
BIOMEMBRANAS M Filomena Botelho Transporte de massa Transporte de moléculas neutras Transporte de iões Noções de bioelectricidade Biomembranas Transporte de massa Transporte de massa ou transferência de
A teoria Cinética dos Gases
 CENTRO DE CIÊNCIAS E TECNOLOGIA AGROALIMENTAR UNIDADE ACADÊMICA DE TECNOLOGIA DE ALIMENTOS DISCIPLINA: FÍSICA II A teoria Cinética dos Gases Prof. Bruno Farias Gases Um gás é formado de átomos (isolados
CENTRO DE CIÊNCIAS E TECNOLOGIA AGROALIMENTAR UNIDADE ACADÊMICA DE TECNOLOGIA DE ALIMENTOS DISCIPLINA: FÍSICA II A teoria Cinética dos Gases Prof. Bruno Farias Gases Um gás é formado de átomos (isolados
Capítulo 11 - Teoria Cinética dos Gases. O número de Avogrado é número de moléculas contido em 1 mol de qualquer substãncia
 Capítulo 11 - Teoria Cinética dos Gases Em 1811, o italiano Amedeo Avogrado enunciou 2 hipóteses: 1) As moléculas de um gás podem ser compostas por mais de um único átomo. 2) Nas mesmas condições de temperatura
Capítulo 11 - Teoria Cinética dos Gases Em 1811, o italiano Amedeo Avogrado enunciou 2 hipóteses: 1) As moléculas de um gás podem ser compostas por mais de um único átomo. 2) Nas mesmas condições de temperatura
Einstein, o atomismo SILVIO R. A. SALINAS. e a teoria do movimento browniano
 Einstein, o atomismo SILVIO R. A. SALINAS e a teoria do movimento browniano SILVIO R. A. SALINAS é professor do Departamento de Física Geral do Instituto de Física da USP. Oano miraculoso de Einstein é
Einstein, o atomismo SILVIO R. A. SALINAS e a teoria do movimento browniano SILVIO R. A. SALINAS é professor do Departamento de Física Geral do Instituto de Física da USP. Oano miraculoso de Einstein é
BIOFÍSICA. Objectivos
 BOFÍSCA M Filomena Botelho Objectivos Compreender e explicar a difusão livre Apreender a noção de constante de difusão livre Compreender o que é a densidade de corrente Compreender o regime estacionário
BOFÍSCA M Filomena Botelho Objectivos Compreender e explicar a difusão livre Apreender a noção de constante de difusão livre Compreender o que é a densidade de corrente Compreender o regime estacionário
Cap 03: Dilatação térmica de sólidos e líquidos
 Cap 03: Dilatação térmica de sólidos e líquidos A mudança nas dimensões dos corpos, quando sofrem variações de temperatura, é um fenômeno que pode ser facilmente observado em situações do cotidiano. Quando
Cap 03: Dilatação térmica de sólidos e líquidos A mudança nas dimensões dos corpos, quando sofrem variações de temperatura, é um fenômeno que pode ser facilmente observado em situações do cotidiano. Quando
Capítulo II. Fenómenos de Transporte
 Capítulo II Fenómenos de Transporte Fenómenos de transporte: aspectos gerais Movimento molecular De que depende o movimento aleatório das moléculas? TEMPERATURA Física Aplicada 2013/14 MICF FFUP 2 Fenómenos
Capítulo II Fenómenos de Transporte Fenómenos de transporte: aspectos gerais Movimento molecular De que depende o movimento aleatório das moléculas? TEMPERATURA Física Aplicada 2013/14 MICF FFUP 2 Fenómenos
CURSO: ENGENHARIA CIVIL FÍSICA GERAL E EXPERIMENTAL II 2º Período Prof.a: Érica Muniz UNIDADE 2. Propriedades Moleculares dos Gases
 CURSO: ENGENHARIA CIVIL FÍSICA GERAL E EXPERIMENTAL II 2º Período Prof.a: Érica Muniz UNIDADE 2 Propriedades Moleculares dos Gases Estado Gasoso Dentre os três estados de agregação, apenas o estado gasosos
CURSO: ENGENHARIA CIVIL FÍSICA GERAL E EXPERIMENTAL II 2º Período Prof.a: Érica Muniz UNIDADE 2 Propriedades Moleculares dos Gases Estado Gasoso Dentre os três estados de agregação, apenas o estado gasosos
Cap. 5 - Corrente, Resistência e Força Eletromotriz
 Universidade Federal do Rio de Janeiro Instituto de Física Física III 2014/2 Cap. 5 - Corrente, Resistência e Força Eletromotriz Prof. Elvis Soares Nesse capítulo, estudaremos a definição de corrente,
Universidade Federal do Rio de Janeiro Instituto de Física Física III 2014/2 Cap. 5 - Corrente, Resistência e Força Eletromotriz Prof. Elvis Soares Nesse capítulo, estudaremos a definição de corrente,
QUÍMICA Tipos de soluções Edson Mesquita
 QUÍMICA Tipos de soluções Edson Mesquita 1 Soluções Uma solução é uma mistura homogênea de substâncias puras (átomos, moléculas ou íons) na qual não há precipitação. Substância pura: substância com composição
QUÍMICA Tipos de soluções Edson Mesquita 1 Soluções Uma solução é uma mistura homogênea de substâncias puras (átomos, moléculas ou íons) na qual não há precipitação. Substância pura: substância com composição
BIK0102: ESTRUTURA DA MATÉRIA. Crédito: Sprace GASES. Professor Hugo B. Suffredini Site:
 BIK0102: ESTRUTURA DA MATÉRIA Crédito: Sprace GASES Professor Hugo B. Suffredini hugo.suffredini@ufabc.edu.br Site: www.suffredini.com.br Pressão Atmosférica A pressão é a força atuando em um objeto por
BIK0102: ESTRUTURA DA MATÉRIA Crédito: Sprace GASES Professor Hugo B. Suffredini hugo.suffredini@ufabc.edu.br Site: www.suffredini.com.br Pressão Atmosférica A pressão é a força atuando em um objeto por
Física Moderna I Aula 06. Marcelo G Munhoz Edifício HEPIC, sala 212, ramal
 Física Moderna I Aula 06 Marcelo G Munhoz Edifício HEPIC, sala 212, ramal 916940 munhoz@if.usp.br 1 Esquema da Disciplina 2 O que existe no mundo físico? Matéria Radiação eletromagnética 3 Dualidade onda-partícula
Física Moderna I Aula 06 Marcelo G Munhoz Edifício HEPIC, sala 212, ramal 916940 munhoz@if.usp.br 1 Esquema da Disciplina 2 O que existe no mundo físico? Matéria Radiação eletromagnética 3 Dualidade onda-partícula
Métodos de Física Teórica II Prof. Henrique Boschi IF - UFRJ. 1º. semestre de 2010 Aula 4 Ref. Butkov, cap. 8, seção 8.4
 Métodos de Física Teórica II Prof. Henrique Boschi IF - UFRJ 1º. semestre de 2010 Aula 4 Ref. Butkov, cap. 8, seção 8.4 Equação da Difusão Um problema importante para vários ramos da Física é saber como
Métodos de Física Teórica II Prof. Henrique Boschi IF - UFRJ 1º. semestre de 2010 Aula 4 Ref. Butkov, cap. 8, seção 8.4 Equação da Difusão Um problema importante para vários ramos da Física é saber como
Conceitos Básicos sobre gases
 Conceitos Básicos sobre gases ara este estudo não vamos fazer distinção entre gás e vapor, desta forma neste capítulo, o estado gasoso (gás ou vapor) será sempre referido como gás... ressão dos gases Suponha
Conceitos Básicos sobre gases ara este estudo não vamos fazer distinção entre gás e vapor, desta forma neste capítulo, o estado gasoso (gás ou vapor) será sempre referido como gás... ressão dos gases Suponha
QUÍMICA MÓDULO 18 RELAÇÕES NUMÉRICAS. Professor Edson Cruz
 QUÍMICA Professor Edson Cruz MÓDULO 18 RELAÇÕES NUMÉRICAS INTRODUÇÃO Precisamos compreender que houve uma necessidade de se definir uma nova unidade de massa para átomos e moléculas. É importante que você
QUÍMICA Professor Edson Cruz MÓDULO 18 RELAÇÕES NUMÉRICAS INTRODUÇÃO Precisamos compreender que houve uma necessidade de se definir uma nova unidade de massa para átomos e moléculas. É importante que você
Difusão: Osmose Tônus Aplicação: Diálise T É C N I C A S B Á S I C A S D E L A B O R A T Ó R I O B I O M E D I C I N A U F R J M A I O
 Difusão: Osmose Tônus Aplicação: Diálise T É C N I C A S B Á S I C A S D E L A B O R A T Ó R I O B I O M E D I C I N A U F R J M A I O 2 0 1 0 Difusão Movimento de componentes de uma mistura qualquer,
Difusão: Osmose Tônus Aplicação: Diálise T É C N I C A S B Á S I C A S D E L A B O R A T Ó R I O B I O M E D I C I N A U F R J M A I O 2 0 1 0 Difusão Movimento de componentes de uma mistura qualquer,
AULA 8 Teoria Cinética dos Gases II
 UFABC - BC0205 Prof. Germán Lugones AULA 8 Teoria Cinética dos Gases II James Clerk Maxwell 1831-1879 A Distribuição de Velocidades Moleculares A velocidade média quadrática V rms nos fornece uma ideia
UFABC - BC0205 Prof. Germán Lugones AULA 8 Teoria Cinética dos Gases II James Clerk Maxwell 1831-1879 A Distribuição de Velocidades Moleculares A velocidade média quadrática V rms nos fornece uma ideia
4. Propriedades dos gases experimentos e modelo microscópico simples para a temperatura
 PV T = nr, onde R é um número (a constante dos gases). Repare que esta é uma lei universal para qualquer gás em pressão e temperatura próxima da atmosférica: não aparece nenhuma dependência de características
PV T = nr, onde R é um número (a constante dos gases). Repare que esta é uma lei universal para qualquer gás em pressão e temperatura próxima da atmosférica: não aparece nenhuma dependência de características
FENÔMENOS DE TRANSPORTES AULA 12 E 13 INTRODUÇÃO À CONVECÇÃO E CONDUÇÃO
 FENÔMENOS DE TRANSPORTES AULA 12 E 13 INTRODUÇÃO À CONVECÇÃO E CONDUÇÃO PROF.: KAIO DUTRA Convecção Térmica O modo de transferência de calor por convecção é composto por dois mecanismos. Além da transferência
FENÔMENOS DE TRANSPORTES AULA 12 E 13 INTRODUÇÃO À CONVECÇÃO E CONDUÇÃO PROF.: KAIO DUTRA Convecção Térmica O modo de transferência de calor por convecção é composto por dois mecanismos. Além da transferência
Classificação Solução Colóide Suspensão Exemplo: açúcar na água, sal de cozinha na água, álcool hidratado.
 Química - Unidade 5 de 12: GOVERNO DO ESTADO DE MATO GROSSO DO SUL Conteúdo 10: Dispersões (definição,classificação, e características) Habilidade e competência: Identificar a diferença entre dispersões,
Química - Unidade 5 de 12: GOVERNO DO ESTADO DE MATO GROSSO DO SUL Conteúdo 10: Dispersões (definição,classificação, e características) Habilidade e competência: Identificar a diferença entre dispersões,
Estudo Físico-Químico dos Gases
 Estudo Físico-Químico dos Gases Prof. Alex Fabiano C. Campos Gás e Vapor Diagrama de Fase Gás Vapor Gás: fluido elástico que não pode ser condensado apenas por aumento de pressão, pois requer ainda um
Estudo Físico-Químico dos Gases Prof. Alex Fabiano C. Campos Gás e Vapor Diagrama de Fase Gás Vapor Gás: fluido elástico que não pode ser condensado apenas por aumento de pressão, pois requer ainda um
MODELO PROBABILÍSTICO DE AGREGADO PARA DENSIDADE DE MISTURAS AQUOSAS ORGÂNICAS
 MODELO PROBABILÍSTICO DE AGREGADO PARA DENSIDADE DE MISTURAS AQUOSAS ORGÂNICAS Aluno: César Felipe Salomão Blanco Orientador: Maria Matos Colaborador: L.C. Scavarda do Carmo Resumo Neste trabalho foi desenvolvido
MODELO PROBABILÍSTICO DE AGREGADO PARA DENSIDADE DE MISTURAS AQUOSAS ORGÂNICAS Aluno: César Felipe Salomão Blanco Orientador: Maria Matos Colaborador: L.C. Scavarda do Carmo Resumo Neste trabalho foi desenvolvido
CINÉTICA QUÍMICA. Obs.: a variação da quantidade deverá ser sempre um valor positivo, então ela deverá ser em módulo. 1.
 CINÉTICA QUÍMICA 1. Introdução O Conhecimento e o estudo da velocidade das reações, além de ser muito importante em termos industriais, também está relacionado ao nosso dia-adia, verificamos que há algumas
CINÉTICA QUÍMICA 1. Introdução O Conhecimento e o estudo da velocidade das reações, além de ser muito importante em termos industriais, também está relacionado ao nosso dia-adia, verificamos que há algumas
UFABC Fenômenos Térmicos Prof. Germán Lugones. Aula 5: Livre caminho médio, distribuição de Maxwell-Boltzmann
 UFABC Fenômenos Térmicos Prof. Germán Lugones Aula 5: Livre caminho médio, distribuição de Maxwell-Boltzmann Caminho Livre Médio A Figura mostra a trajetória de uma molécula típica quando ela se move através
UFABC Fenômenos Térmicos Prof. Germán Lugones Aula 5: Livre caminho médio, distribuição de Maxwell-Boltzmann Caminho Livre Médio A Figura mostra a trajetória de uma molécula típica quando ela se move através
Física II Teoria Cinética dos Gases
 Física II Teoria Cinética dos Gases João Francisco Fuzile Rodrigues Garcia -- 8549323 Maiara Fernanda Moreno -- 8549344 Otávio Massola Sumi -- 8549452 Ex. 18.63 Explique, em termos do movimento molecular,
Física II Teoria Cinética dos Gases João Francisco Fuzile Rodrigues Garcia -- 8549323 Maiara Fernanda Moreno -- 8549344 Otávio Massola Sumi -- 8549452 Ex. 18.63 Explique, em termos do movimento molecular,
Cap 03: Dilatação térmica de sólidos e líquidos
 Cap 03: Dilatação térmica de sólidos e líquidos A mudança nas dimensões dos corpos, quando sofrem variações de temperatura, é um fenômeno que pode ser facilmente observado em situações do cotidiano. Quando
Cap 03: Dilatação térmica de sólidos e líquidos A mudança nas dimensões dos corpos, quando sofrem variações de temperatura, é um fenômeno que pode ser facilmente observado em situações do cotidiano. Quando
GASES. https://www.youtube.com/watch?v=wtmmvs3uiv0. David P. White. QUÍMICA: A Ciência Central 9ª Edição Capítulo by Pearson Education
 GASES PV nrt https://www.youtube.com/watch?v=wtmmvs3uiv0 David P. White QUÍMICA: A Ciência Central 9ª Edição volume, pressão e temperatura Um gás consiste em átomos (individualmente ou ligados formando
GASES PV nrt https://www.youtube.com/watch?v=wtmmvs3uiv0 David P. White QUÍMICA: A Ciência Central 9ª Edição volume, pressão e temperatura Um gás consiste em átomos (individualmente ou ligados formando
Universidade Federal do Pampa UNIPAMPA. Teoria Cinética do Gases
 Universidade Federal do Pampa UNIPAMPA Teoria Cinética do Gases Introdução A descrição de um gás por inteiro (descrição macroscópica) pode ser feito estabelecendo as grandezas macroscópicas que caracterizam
Universidade Federal do Pampa UNIPAMPA Teoria Cinética do Gases Introdução A descrição de um gás por inteiro (descrição macroscópica) pode ser feito estabelecendo as grandezas macroscópicas que caracterizam
Dilatação dos sólidos e dos líquidos
 Dilatação dos sólidos e dos líquidos Dilatação dos sólidos e dos líquidos Dilatação dos sólidos e dos líquidos Dilatação dos sólidos e dos líquidos Dilatação dos sólidos e dos líquidos Dilatação dos sólidos
Dilatação dos sólidos e dos líquidos Dilatação dos sólidos e dos líquidos Dilatação dos sólidos e dos líquidos Dilatação dos sólidos e dos líquidos Dilatação dos sólidos e dos líquidos Dilatação dos sólidos
Operadores Diferenciais Aplicações Rebello 2014
 Operadores Diferenciais Aplicações Rebello 2014 Os operadores diferenciais representam um conjunto de ferramentas indispensáveis na engenharia não só na parte de avaliar e classificar um campo vetorial
Operadores Diferenciais Aplicações Rebello 2014 Os operadores diferenciais representam um conjunto de ferramentas indispensáveis na engenharia não só na parte de avaliar e classificar um campo vetorial
Estudo Físico-Químico dos Gases
 19/08/009 Estudo Físico-Químico dos Gases Prof. Alex Fabiano C. Campos Gás e Vapor Diagrama de Fase Gás Vapor Gás: fluido elástico que não pode ser condensado apenas por aumento de pressão, pois requer
19/08/009 Estudo Físico-Químico dos Gases Prof. Alex Fabiano C. Campos Gás e Vapor Diagrama de Fase Gás Vapor Gás: fluido elástico que não pode ser condensado apenas por aumento de pressão, pois requer
Princípios de Eletricidade Magnetismo
 Princípios de Eletricidade Magnetismo Corrente Elétrica e Circuitos de Corrente Contínua Professor: Cristiano Faria Corrente e Movimento de Cargas Elétricas Embora uma corrente seja um movimento de partícula
Princípios de Eletricidade Magnetismo Corrente Elétrica e Circuitos de Corrente Contínua Professor: Cristiano Faria Corrente e Movimento de Cargas Elétricas Embora uma corrente seja um movimento de partícula
Aula 13 - Capítulo 38 Fótons e Ondas de Matéria
 Aula 13 - Capítulo 38 Fótons e Ondas de Matéria Física 4 Ref. Halliday Volume4 Sumário Elétrons e Ondas de Matéria A Equação de Schrödinger Determinação da Densidade de Probabilidade 2 Elétrons e Ondas
Aula 13 - Capítulo 38 Fótons e Ondas de Matéria Física 4 Ref. Halliday Volume4 Sumário Elétrons e Ondas de Matéria A Equação de Schrödinger Determinação da Densidade de Probabilidade 2 Elétrons e Ondas
Cap. 25. Capacitância. Copyright 2014 John Wiley & Sons, Inc. All rights reserved.
 Cap. 25 Capacitância Copyright 25-1 Capacitância Um capacitor é constituído por dois condutores isolados (as placas), que podem receber cargas +q e q. A capacitância C é definida pela equação onde V é
Cap. 25 Capacitância Copyright 25-1 Capacitância Um capacitor é constituído por dois condutores isolados (as placas), que podem receber cargas +q e q. A capacitância C é definida pela equação onde V é
Gás Ideal (1) PMT2305 Físico-Química para Metalurgia e Materiais I César Yuji Narita e Neusa Alonso-Falleiros 2012
 Gás Ideal (1) Para um gás, uma equação de estado é uma relação entre pressão (P), volume (V), temperatura (T) e composição ou número de mols (n). O primeiro passo para a determinação de uma equação de
Gás Ideal (1) Para um gás, uma equação de estado é uma relação entre pressão (P), volume (V), temperatura (T) e composição ou número de mols (n). O primeiro passo para a determinação de uma equação de
UNIDADE 6 - VIBRAÇÕES ATÔMICAS E DIFUSÃO NO ESTADO SÓLIDO
 UNIDADE 6 - VIBRAÇÕES ATÔMICAS E DIFUSÃO NO ESTADO SÓLIDO 6.1. TAXA DE UM PROCESSO Um grande número de processos que tem a temperatura como força motriz são regidos pela Equação de Arrhenius Q / RT (6.1)
UNIDADE 6 - VIBRAÇÕES ATÔMICAS E DIFUSÃO NO ESTADO SÓLIDO 6.1. TAXA DE UM PROCESSO Um grande número de processos que tem a temperatura como força motriz são regidos pela Equação de Arrhenius Q / RT (6.1)
SUMÁRIO FÍSICA TEMPERATURA E CALOR 3 CELSIUS E FAHRENHEIT 5 KELVIN E CELSIUS 6 EXERCÍCIOS DE COMBATE 8 GABARITO 13
 SUMÁRIO TEMPERATURA E CALOR 3 CELSIUS E FAHRENHEIT 5 KELVIN E CELSIUS 6 EXERCÍCIOS DE COMBATE 8 GABARITO 13 2 TEMPERATURA E CALOR Vamos iniciar nossos estudos com a diferenciação dessas duas grandezas
SUMÁRIO TEMPERATURA E CALOR 3 CELSIUS E FAHRENHEIT 5 KELVIN E CELSIUS 6 EXERCÍCIOS DE COMBATE 8 GABARITO 13 2 TEMPERATURA E CALOR Vamos iniciar nossos estudos com a diferenciação dessas duas grandezas
RELAÇÕES DE MASSA E MOL
 RELAÇÃO DE MASSA E MOL A relação entre massa e quantidade Em uma gota de água de 0,05 ml há 1,67 sextilhão (1,67 x 10 21 ) de moléculas de água. A relação entre massa e quantidade A unidade de massa atômica
RELAÇÃO DE MASSA E MOL A relação entre massa e quantidade Em uma gota de água de 0,05 ml há 1,67 sextilhão (1,67 x 10 21 ) de moléculas de água. A relação entre massa e quantidade A unidade de massa atômica
Física Geral II. Aula 1 - Teoria cinética dos gases. D. Valin 1. Universidade do Estado de Mato Grosso. Sinop-MT, April 25, 2017
 Física Geral II Aula 1 - Teoria cinética dos gases D. Valin 1 1 Faculdade de Ciências Exatas - FACET Universidade do Estado de Mato Grosso Sinop-MT, April 25, 2017 D. Valin (Universidade do Estado de Mato
Física Geral II Aula 1 - Teoria cinética dos gases D. Valin 1 1 Faculdade de Ciências Exatas - FACET Universidade do Estado de Mato Grosso Sinop-MT, April 25, 2017 D. Valin (Universidade do Estado de Mato
1 - Fricção: Formas de Eletrização
 1 - Fricção: Formas de Eletrização Formas de Eletrização 2 - Indução: 1 - Fricção: Polarização Resumo Propriedade das Cargas 1. Existem dois tipos de cargas que são positivas (prótons) e negativas (elétrons)
1 - Fricção: Formas de Eletrização Formas de Eletrização 2 - Indução: 1 - Fricção: Polarização Resumo Propriedade das Cargas 1. Existem dois tipos de cargas que são positivas (prótons) e negativas (elétrons)
= 6, mol de moléculas de um gás possui aproximadamente 6, moléculas deste gás, ou seja, seiscentos e dois sextilhões de moléculas;
 TEORIA CINÉTICA DOS GASES PROF. LEANDRO NECKEL NÚMERO DE AVOGADRO Mol é a quantidade de substância de um sistema que contém tantas entidades elementares quanto são os átomos contidos em 0,012 quilograma
TEORIA CINÉTICA DOS GASES PROF. LEANDRO NECKEL NÚMERO DE AVOGADRO Mol é a quantidade de substância de um sistema que contém tantas entidades elementares quanto são os átomos contidos em 0,012 quilograma
Cap. 41 -Condução de eletricidade em sólidos
 Cap. 41 -Condução de eletricidade em sólidos Propriedades elétricas dos sólidos; Níveis de energia em um sólido cristalino: Átomo; Molécula; Sólido. Estrutura eletrônica e condução: Isolantes (T = 0);
Cap. 41 -Condução de eletricidade em sólidos Propriedades elétricas dos sólidos; Níveis de energia em um sólido cristalino: Átomo; Molécula; Sólido. Estrutura eletrônica e condução: Isolantes (T = 0);
CENTRO DE CIÊNCIAS E TECNOLOGIA AGROALIMENTAR UNIDADE ACADÊMICA DE TECNOLOGIA DE ALIMENTOS DISCIPLINA: FÍSICA I ROTAÇÃO. Prof.
 CENTRO DE CIÊNCIAS E TECNOLOGIA AGROALIMENTAR UNIDADE ACADÊMICA DE TECNOLOGIA DE ALIMENTOS DISCIPLINA: FÍSICA I ROTAÇÃO Prof. Bruno Farias Introdução Neste capítulo vamos aprender: Como descrever a rotação
CENTRO DE CIÊNCIAS E TECNOLOGIA AGROALIMENTAR UNIDADE ACADÊMICA DE TECNOLOGIA DE ALIMENTOS DISCIPLINA: FÍSICA I ROTAÇÃO Prof. Bruno Farias Introdução Neste capítulo vamos aprender: Como descrever a rotação
Termodinâmica II - FMT 259
 Termodinâmica II - FMT 259 Diurno e Noturno, primeiro semestre de 2009 Lista 3 GABARITO (revisado em 22/04/0). Se as moléculas contidas em,0 g de água fossem distribuídas uniformemente sobre a superfície
Termodinâmica II - FMT 259 Diurno e Noturno, primeiro semestre de 2009 Lista 3 GABARITO (revisado em 22/04/0). Se as moléculas contidas em,0 g de água fossem distribuídas uniformemente sobre a superfície
REVISÃO: CONDUTIVIDADE ELÉTRICA DE SOLUÇÕES AQUOSAS AULA 1 EXPRESSÕES DE CONCENTRAÇÃO PROF. ANA
 REVISÃO: CONDUTIVIDADE ELÉTRICA DE SOLUÇÕES AQUOSAS AULA 1 EXPRESSÕES DE CONCENTRAÇÃO DATA: 21/08/2015 PROF. ANA 1) SOLUÇÕES Soluções são misturas homogêneas de duas ou mais substâncias. - numa solução,
REVISÃO: CONDUTIVIDADE ELÉTRICA DE SOLUÇÕES AQUOSAS AULA 1 EXPRESSÕES DE CONCENTRAÇÃO DATA: 21/08/2015 PROF. ANA 1) SOLUÇÕES Soluções são misturas homogêneas de duas ou mais substâncias. - numa solução,
Universidade Tecnológica Federal do Paraná Departamento Acadêmico de Química e Biologia. Aula Interlúdio molecular
 Universidade Tecnológica Federal do Paraná Departamento Acadêmico de Química e Biologia Aula Interlúdio molecular Energia Interna somatório de energias (cinética + potencial) Energia cinética relacionada
Universidade Tecnológica Federal do Paraná Departamento Acadêmico de Química e Biologia Aula Interlúdio molecular Energia Interna somatório de energias (cinética + potencial) Energia cinética relacionada
Propriedades Coligativas
 Propriedades Coligativas Propriedades Coligativas São propriedades que se somam pela presença de um ou mais solutos e dependem única e exclusivamente do número de partículas (moléculas ou íons) que estão
Propriedades Coligativas Propriedades Coligativas São propriedades que se somam pela presença de um ou mais solutos e dependem única e exclusivamente do número de partículas (moléculas ou íons) que estão
Elementos de Circuitos Elétricos
 Elementos de Circuitos Elétricos Corrente e Lei de Ohm Consideremos um condutor cilíndrico de seção reta de área S. Quando uma corrente flui pelo condutor, cargas se movem e existe um campo elétrico. A
Elementos de Circuitos Elétricos Corrente e Lei de Ohm Consideremos um condutor cilíndrico de seção reta de área S. Quando uma corrente flui pelo condutor, cargas se movem e existe um campo elétrico. A
Termodinâmica. Lucy V. C. Assali
 Termodinâmica Calor Física II 2016 - IO Calor Final do século XVIII: duas hipóteses alternativas 1) Fluido indestrutível (calórico) que preencheria os poros dos corpos, escoando-se de um corpo mais quente
Termodinâmica Calor Física II 2016 - IO Calor Final do século XVIII: duas hipóteses alternativas 1) Fluido indestrutível (calórico) que preencheria os poros dos corpos, escoando-se de um corpo mais quente
Descrição Macroscópica de um Gás ideal
 Descrição Macroscópica de um Gás ideal O gás não tem volume fixo ou uma pressão fixa O volume do gás é o volume do recipiente A pressão do gás depende do tamanho do recipiente A equação de estado relaciona
Descrição Macroscópica de um Gás ideal O gás não tem volume fixo ou uma pressão fixa O volume do gás é o volume do recipiente A pressão do gás depende do tamanho do recipiente A equação de estado relaciona
FÍSICA TÉRMICA. Prof. Neemias Alves de Lima Instituto de Pesquisa em Ciência dos Materiais Universidade Federal do Vale do São Francisco 1
 FÍSICA TÉRMICA Prof. Neemias Alves de Lima Instituto de Pesquisa em Ciência dos Materiais Universidade Federal do Vale do São Francisco 1 Domínio da Física Térmica Como pode água aprisionada ser ejetada
FÍSICA TÉRMICA Prof. Neemias Alves de Lima Instituto de Pesquisa em Ciência dos Materiais Universidade Federal do Vale do São Francisco 1 Domínio da Física Térmica Como pode água aprisionada ser ejetada
FUNÇÕES DE ESTADO TERMODINÂMICAS: ENTALPIA E ENERGIA LIVRE Parte 2
 FUNÇÕES DE ESTADO TERMODINÂMICAS: ENTALPIA E ENERGIA LIVRE Parte 2 [texto baseado nas seções 3.5, 3.6 e 3.9 de Physical Chemistry, P. Atkins e J. de Paula, Freeman 2006] As energias livres de Helmholtz
FUNÇÕES DE ESTADO TERMODINÂMICAS: ENTALPIA E ENERGIA LIVRE Parte 2 [texto baseado nas seções 3.5, 3.6 e 3.9 de Physical Chemistry, P. Atkins e J. de Paula, Freeman 2006] As energias livres de Helmholtz
ENERGIA INTERNA, CALOR, TEMPERATURA...
 ENERGIA INTERNA, CALOR, TEMPERATURA... ENERGIA INTERNA As moléculas 1 de um corpo estão em constante agitação. Essa agitação pode ser maior ou menor dependendo tanto da temperatura quanto do estado físico
ENERGIA INTERNA, CALOR, TEMPERATURA... ENERGIA INTERNA As moléculas 1 de um corpo estão em constante agitação. Essa agitação pode ser maior ou menor dependendo tanto da temperatura quanto do estado físico
O modelo cinético molecular para gases e a difusão: o passeio aleatório
 O modelo cinético molecular para gases e a difusão: o passeio aleatório O modelo mecânico para a pressão que consideramos ignora as interações entre moléculas, uma molécula não vê a outra há choques apenas
O modelo cinético molecular para gases e a difusão: o passeio aleatório O modelo mecânico para a pressão que consideramos ignora as interações entre moléculas, uma molécula não vê a outra há choques apenas
1. (Uerj 2015) Em uma pista de competição, quatro carrinhos elétricos, numerados de I a IV, são movimentados de acordo com o gráfico v t a seguir.
 1. (Uerj 015) Em uma pista de competição, quatro carrinhos elétricos, numerados de I a IV, são movimentados de acordo com o gráfico v t a seguir. O carrinho que percorreu a maior distância em 4 segundos
1. (Uerj 015) Em uma pista de competição, quatro carrinhos elétricos, numerados de I a IV, são movimentados de acordo com o gráfico v t a seguir. O carrinho que percorreu a maior distância em 4 segundos
Relações de massa. Situando-se ao assunto...
 Situando-se ao assunto... Relações de massa Prof. : Drielle Caroline Conceito de mol A unidade fundamental do pensamento químico é o átomo ou a molécula; por isso, não surpreende que seja da maior importância
Situando-se ao assunto... Relações de massa Prof. : Drielle Caroline Conceito de mol A unidade fundamental do pensamento químico é o átomo ou a molécula; por isso, não surpreende que seja da maior importância
OPERAÇÕES UNITÁRIAS II AULA 1: REVISÃO TRANSFERÊNCIA DE CALOR. Profa. Dra. Milena Martelli Tosi
 OPERAÇÕES UNITÁRIAS II AULA 1: REVISÃO TRANSFERÊNCIA DE CALOR Profa. Dra. Milena Martelli Tosi A IMPORTÂNCIA DA TRANSFERÊNCIA DE CALOR NA INDÚSTRIA DE ALIMENTOS Introdução Revisão: Mecanismos de transferência
OPERAÇÕES UNITÁRIAS II AULA 1: REVISÃO TRANSFERÊNCIA DE CALOR Profa. Dra. Milena Martelli Tosi A IMPORTÂNCIA DA TRANSFERÊNCIA DE CALOR NA INDÚSTRIA DE ALIMENTOS Introdução Revisão: Mecanismos de transferência
Estudo Físico-Químico dos Gases
 Estudo Físico-Químico dos Gases Prof. Alex Fabiano C. Campos Fases de Agregação da Matéria Sublimação (sólido em gás ou gás em sólido) Gás Evaporação (líquido em gás) Condensação (gás em líquido) Sólido
Estudo Físico-Químico dos Gases Prof. Alex Fabiano C. Campos Fases de Agregação da Matéria Sublimação (sólido em gás ou gás em sólido) Gás Evaporação (líquido em gás) Condensação (gás em líquido) Sólido
ELEMENTOS DE TERMODINÂMICA
 ELEMENTOS DE TERMODINÂMICA TERMODINÂMICA ESCALAS DE TEMPERATURA Estuda as relações entre grandezas como a temperatura, a pressão, o volume, o calor e a energia interna Reparar na necessidade de definir
ELEMENTOS DE TERMODINÂMICA TERMODINÂMICA ESCALAS DE TEMPERATURA Estuda as relações entre grandezas como a temperatura, a pressão, o volume, o calor e a energia interna Reparar na necessidade de definir
Professor: Fábio Silva SOLUÇÕES
 Professor: Fábio Silva SOLUÇÕES Solvente: Substância que apresenta o mesmo estado de agregação da solução; Substância encontrada em maior quantidade. SOLUÇÃO É uma mistura homogênea de dois ou mais componentes.
Professor: Fábio Silva SOLUÇÕES Solvente: Substância que apresenta o mesmo estado de agregação da solução; Substância encontrada em maior quantidade. SOLUÇÃO É uma mistura homogênea de dois ou mais componentes.
Aula II Lei de Ohm, ddp, corrente elétrica e força eletromotriz. Prof. Paulo Vitor de Morais
 Aula II Lei de Ohm, ddp, corrente elétrica e força eletromotriz Prof. Paulo Vitor de Morais E-mail: paulovitordmorais91@gmail.com 1 Potencial elétrico Energia potencial elétrica Quando temos uma força
Aula II Lei de Ohm, ddp, corrente elétrica e força eletromotriz Prof. Paulo Vitor de Morais E-mail: paulovitordmorais91@gmail.com 1 Potencial elétrico Energia potencial elétrica Quando temos uma força
Soluções. 1 Introdução. Ludmila Ferreira
 Soluções Ludmila Ferreira 1 Introdução Para iniciarmos o estudo das soluções é importante que saibamos o que é uma solução, para que depois possamos estudar seus componentes e classificá-las. Uma solução
Soluções Ludmila Ferreira 1 Introdução Para iniciarmos o estudo das soluções é importante que saibamos o que é uma solução, para que depois possamos estudar seus componentes e classificá-las. Uma solução
Física e Química A 715 (versão 1)
 Exame (Resolução proposta por colaboradores da Divisão de Educação da Sociedade Portuguesa de Física) Física e Química A 715 (versão 1) 0 de Junho de 008 1. 1.1. Átomos de ferro A espécie redutora é o
Exame (Resolução proposta por colaboradores da Divisão de Educação da Sociedade Portuguesa de Física) Física e Química A 715 (versão 1) 0 de Junho de 008 1. 1.1. Átomos de ferro A espécie redutora é o
Volume Parcial Molar
 Volume Parcial Molar 1. Introdução O volume molar é definido como o volume ocupado por 1 mol de uma substância pura. Por exemplo, o volume molar da água pura é 18 cm 3 /mol, conforme mostrado no cálculo
Volume Parcial Molar 1. Introdução O volume molar é definido como o volume ocupado por 1 mol de uma substância pura. Por exemplo, o volume molar da água pura é 18 cm 3 /mol, conforme mostrado no cálculo
18 1ª LEI DA TERMODINÂMICA
 FÍSICA Professor Ricardo Fagundes MÓDULO 18 1ª LEI DA TERMODINÂMICA 1ª LEI DA TERMODINÂMICA Energia interna (U): a energia interna de um gás é a soma das energias cinéticas das partículas que o compõe
FÍSICA Professor Ricardo Fagundes MÓDULO 18 1ª LEI DA TERMODINÂMICA 1ª LEI DA TERMODINÂMICA Energia interna (U): a energia interna de um gás é a soma das energias cinéticas das partículas que o compõe
Fenômenos de Transporte
 Fenômenos de Transporte Introdução a Fenômenos de Transporte Prof. Dr. Felipe Corrêa Introdução a Fenômenos de Transporte Fenômenos de Transporte Refere-se ao estudo sistemático e unificado da transferência
Fenômenos de Transporte Introdução a Fenômenos de Transporte Prof. Dr. Felipe Corrêa Introdução a Fenômenos de Transporte Fenômenos de Transporte Refere-se ao estudo sistemático e unificado da transferência
FÍSICA E QUÍMICA A 10º ANO
 DEPARTAMENTO DE MATEMÁTICA E CIÊNCIAS EXPERIMENTAIS Planificação Anual FÍSICA E QUÍMICA A 10º ANO 2017 / 2018 1º Período - QUÍMICA Apresentação e divulgação de critérios 2 1. ELEMENTOS QUÍMICOS E SUA ORGANIZAÇÃO
DEPARTAMENTO DE MATEMÁTICA E CIÊNCIAS EXPERIMENTAIS Planificação Anual FÍSICA E QUÍMICA A 10º ANO 2017 / 2018 1º Período - QUÍMICA Apresentação e divulgação de critérios 2 1. ELEMENTOS QUÍMICOS E SUA ORGANIZAÇÃO
AULA 05: Isso significa que 1 átomo de hidrogênio pesa 1/12 da massa do carbono-12.
 SETOR 2306 Turma de Maio/Manhã Aulas 05 e 06 Resolução dos eercícios de sala AULA 05: EXERCÍCIO 1) (discutido em sala) Hidrogênio (MA = 1,0 u). Isso significa que 1 átomo de hidrogênio pesa 1/12 da massa
SETOR 2306 Turma de Maio/Manhã Aulas 05 e 06 Resolução dos eercícios de sala AULA 05: EXERCÍCIO 1) (discutido em sala) Hidrogênio (MA = 1,0 u). Isso significa que 1 átomo de hidrogênio pesa 1/12 da massa
Aula: 28 Temática: Efeito da Temperatura na Velocidade de Reação
 Aula: 28 Temática: Efeito da Temperatura na Velocidade de Reação Em grande parte das reações, as constantes de velocidade aumentam com o aumento da temperatura. Vamos analisar esta dependência. A teoria
Aula: 28 Temática: Efeito da Temperatura na Velocidade de Reação Em grande parte das reações, as constantes de velocidade aumentam com o aumento da temperatura. Vamos analisar esta dependência. A teoria
Avenida Lourival Alfredo, 176, Poeira, Marechal Deodoro, Alagoas, Brasil,
 1 ESTUDO DOS GASES 1 INTRODUÇÃO Vários processos que ocorrem na natureza e nos organismos vivos são fenômenos pertinentes aos gases, como, por exemplo: o metabolismo nos animais exige a presença de oxigênio,
1 ESTUDO DOS GASES 1 INTRODUÇÃO Vários processos que ocorrem na natureza e nos organismos vivos são fenômenos pertinentes aos gases, como, por exemplo: o metabolismo nos animais exige a presença de oxigênio,
TERMODINÂMICA E TEORIA CINÉTICA
 UNIVERSIDADE DA MADEIRA 1. OBJECTIVOS TERMODINÂMICA E TEORIA CINÉTICA T8. Mecanismos de transmissão do calor Estudo do fenómeno de condução térmica. Determinação da condutividade térmica do vidro. Verificar
UNIVERSIDADE DA MADEIRA 1. OBJECTIVOS TERMODINÂMICA E TEORIA CINÉTICA T8. Mecanismos de transmissão do calor Estudo do fenómeno de condução térmica. Determinação da condutividade térmica do vidro. Verificar
Capítulo 4 Séries de Fourier
 Capítulo 4 Séries de Fourier Dizemos que representamos uma função real ela se expressa na série em série de Fourier quando os coeficientes são chamados de coeficientes de Fourier. Claro, a série de Fourier
Capítulo 4 Séries de Fourier Dizemos que representamos uma função real ela se expressa na série em série de Fourier quando os coeficientes são chamados de coeficientes de Fourier. Claro, a série de Fourier
CENTRO DE CIÊNCIAS E TECNOLOGIA AGROALIMENTAR UNIDADE ACADÊMICA DE TECNOLOGIA DE ALIMENTOS DISCIPLINA: FÍSICA I ROTAÇÃO. Prof.
 CENTRO DE CIÊNCIAS E TECNOLOGIA AGROALIMENTAR UNIDADE ACADÊMICA DE TECNOLOGIA DE ALIMENTOS DISCIPLINA: FÍSICA I ROTAÇÃO Prof. Bruno Farias Introdução Neste capítulo vamos aprender: Como descrever a rotação
CENTRO DE CIÊNCIAS E TECNOLOGIA AGROALIMENTAR UNIDADE ACADÊMICA DE TECNOLOGIA DE ALIMENTOS DISCIPLINA: FÍSICA I ROTAÇÃO Prof. Bruno Farias Introdução Neste capítulo vamos aprender: Como descrever a rotação
Campus de Ilha Solteira. Disciplina: Fenômenos de Transporte
 Campus de Ilha Solteira CONCEITOS BÁSICOS B E VISCOSIDADE Disciplina: Fenômenos de Transporte Professor: Dr. Tsunao Matsumoto INTRODUÇÃO A matéria de Fenômenos de Transporte busca as explicações de como
Campus de Ilha Solteira CONCEITOS BÁSICOS B E VISCOSIDADE Disciplina: Fenômenos de Transporte Professor: Dr. Tsunao Matsumoto INTRODUÇÃO A matéria de Fenômenos de Transporte busca as explicações de como
Equação Geral da Condução
 Equação Geral da Condução Para um sistema unidimensional demonstrouse: q x = k A T x x Para um sistema multidimensional o fluxo de calor é vetorial: q,, =q x,, i q y,, j q z,, k = k T i k T j k T k =k
Equação Geral da Condução Para um sistema unidimensional demonstrouse: q x = k A T x x Para um sistema multidimensional o fluxo de calor é vetorial: q,, =q x,, i q y,, j q z,, k = k T i k T j k T k =k
Termodinâmica e Estrutura da Matéria
 Termodinâmica e Estrutura da Matéria Conceitos básicos J. Seixas Sistema Índice da lição e Sistema Porque falamos de sistema? Para descrever um fenómeno físico precisamos de especificar do que estamos
Termodinâmica e Estrutura da Matéria Conceitos básicos J. Seixas Sistema Índice da lição e Sistema Porque falamos de sistema? Para descrever um fenómeno físico precisamos de especificar do que estamos
ESTUDOS EXATOS DA CONDUÇÃO TÉRMICA NA CADEIA HARMÔNICA UNIDIMENSIONAL
 ESTUDOS EXATOS DA CONDUÇÃO TÉRMICA NA CADEIA HARMÔNICA UNIDIMENSIONAL Aluno: Diogo Gaia Orientador: Welles Antônio Martinez Morgado Introdução O problema da condução térmica baseada em dinâmicas microscópicas,
ESTUDOS EXATOS DA CONDUÇÃO TÉRMICA NA CADEIA HARMÔNICA UNIDIMENSIONAL Aluno: Diogo Gaia Orientador: Welles Antônio Martinez Morgado Introdução O problema da condução térmica baseada em dinâmicas microscópicas,
CENTRO DE MASSA E MOMENTO LINEAR
 CENTRO DE CIÊNCIAS E TECNOLOGIA AGROALIMENTAR UNIDADE ACADÊMICA DE TECNOLOGIA DE ALIMENTOS DISCIPLINA: FÍSICA I CENTRO DE MASSA E MOMENTO LINEAR Prof. Bruno Farias Introdução Neste módulo vamos discutir
CENTRO DE CIÊNCIAS E TECNOLOGIA AGROALIMENTAR UNIDADE ACADÊMICA DE TECNOLOGIA DE ALIMENTOS DISCIPLINA: FÍSICA I CENTRO DE MASSA E MOMENTO LINEAR Prof. Bruno Farias Introdução Neste módulo vamos discutir
Ondas. Lucy V. C. Assali. Física II IO
 Ondas Física II 2016 - IO O que é uma onda? Qualquer sinal que é transmitido de um ponto a outro de um meio, com velocidade definida, sem que haja transporte direto de matéria. distúrbio se propaga leva
Ondas Física II 2016 - IO O que é uma onda? Qualquer sinal que é transmitido de um ponto a outro de um meio, com velocidade definida, sem que haja transporte direto de matéria. distúrbio se propaga leva
Metal, Não Metal e Metaloide
 Metal, Não Metal e Metaloide 1 Metal, Não Metal e Metaloide Metal: conduz eletricidade, tem brilho, é maleável e dúctil Ex: cobre Não metal: não... Ex: Enxofre Metaloide: aparência e algumas propriedades
Metal, Não Metal e Metaloide 1 Metal, Não Metal e Metaloide Metal: conduz eletricidade, tem brilho, é maleável e dúctil Ex: cobre Não metal: não... Ex: Enxofre Metaloide: aparência e algumas propriedades
Relações Mássicas em Reacções Químicas
 Capítulo 3 Relações Mássicas em Reacções Químicas Massa Atómica N.º de Avogadro e Massa Molar Massa Molecular Espectrómetro de Massa Composição Percentual dos Compostos Determinação Experimental de Fórmulas
Capítulo 3 Relações Mássicas em Reacções Químicas Massa Atómica N.º de Avogadro e Massa Molar Massa Molecular Espectrómetro de Massa Composição Percentual dos Compostos Determinação Experimental de Fórmulas
Aluno (a): Para as questões de Ciências Exatas têm que ser apresentados os respectivos cálculos.
 Educa teu filho no caminho que deve andar, e quando grande não se desviará dele Prov.22.6 Bateria de Exercícios Data: 03/06/2016 Turma: 1º Ano Área II Aluno (a): Prezado aluno caso prefira responder na
Educa teu filho no caminho que deve andar, e quando grande não se desviará dele Prov.22.6 Bateria de Exercícios Data: 03/06/2016 Turma: 1º Ano Área II Aluno (a): Prezado aluno caso prefira responder na
Mecânica I (FIS-14) Prof. Dr. Ronaldo Rodrigues Pelá Sala 2602A-1 Ramal 5785
 Mecânica I (FIS-14) Prof. Dr. Ronaldo Rodrigues Pelá Sala 2602A-1 Ramal 5785 rrpela@ita.br www.ief.ita.br/~rrpela Journal Club Teoria do funcional da densidade A energia do estado fundamental é um funcional
Mecânica I (FIS-14) Prof. Dr. Ronaldo Rodrigues Pelá Sala 2602A-1 Ramal 5785 rrpela@ita.br www.ief.ita.br/~rrpela Journal Club Teoria do funcional da densidade A energia do estado fundamental é um funcional
Universidade Federal do Rio de Janeiro Instituto de Física Lista 1 Física 2. prof. Daniela Szilard 23 de maio de 2016
 Universidade Federal do Rio de Janeiro Instituto de Física Lista 1 Física 2 prof. Daniela Szilard 23 de maio de 2016 1. Julgue os itens: verdadeiro ou falso. ( ) A lei de Stevin é válida para qualquer
Universidade Federal do Rio de Janeiro Instituto de Física Lista 1 Física 2 prof. Daniela Szilard 23 de maio de 2016 1. Julgue os itens: verdadeiro ou falso. ( ) A lei de Stevin é válida para qualquer
CTM P OBS: Esta prova contém 7 páginas e 6 questões. Verifique antes de começar. VOCÊ DEVE ESCOLHER APENAS 5 QUESTÕES PARA RESOLVER.
 Nome: Assinatura: CTM P1 2014.2 Matrícula: Turma: OBS: Esta prova contém 7 páginas e 6 questões. Verifique antes de começar. VOCÊ DEVE ESCOLHER APENAS 5 QUESTÕES PARA RESOLVER. VOCÊ DEVE RISCAR NA TABELA
Nome: Assinatura: CTM P1 2014.2 Matrícula: Turma: OBS: Esta prova contém 7 páginas e 6 questões. Verifique antes de começar. VOCÊ DEVE ESCOLHER APENAS 5 QUESTÕES PARA RESOLVER. VOCÊ DEVE RISCAR NA TABELA
ESTEQUIOMETRIA. 1. Introdução
 ESTEQUIOMETRIA 1. Introdução A palavra estequiometria vem do grego stoikheion (elemento) e metriā (medida). A estequiometria baseia-se na Lei da Conservação das Massas e na Lei das Proporções Definidas
ESTEQUIOMETRIA 1. Introdução A palavra estequiometria vem do grego stoikheion (elemento) e metriā (medida). A estequiometria baseia-se na Lei da Conservação das Massas e na Lei das Proporções Definidas
3 Introdução à Transferência de Massa. 7a. Aula
 3 Introdução à Transferência de Massa 7a. Aula Transporte Molecular Transporte de Energia (condução) Transporte de Massa (difusão) Exemplo: vidro de perfume aberto numa sala com ar parado Transporte Molecular
3 Introdução à Transferência de Massa 7a. Aula Transporte Molecular Transporte de Energia (condução) Transporte de Massa (difusão) Exemplo: vidro de perfume aberto numa sala com ar parado Transporte Molecular
EP34D Fenômenos de Transporte
 EP34D Fenômenos de Transporte Prof. Dr. André Damiani Rocha arocha@utfpr.edu.br Introdução à Transferência de Calor 2 Introdução à Transferência de Calor O que é Transferência de Calor? Transferência de
EP34D Fenômenos de Transporte Prof. Dr. André Damiani Rocha arocha@utfpr.edu.br Introdução à Transferência de Calor 2 Introdução à Transferência de Calor O que é Transferência de Calor? Transferência de
E-books PCNA. Vol. 1 QUÍMICA ELEMENTAR CAPÍTULO 4 ESTEQUIOMETRIA
 E-books PCNA Vol. 1 QUÍMICA ELEMENTAR CAPÍTULO 4 ESTEQUIOMETRIA 1 QUÍMICA ELEMENTAR CAPÍTULO 4 SUMÁRIO Apresentação -------------------------------------------- 2 Capítulo 4 ------------------------------------------------
E-books PCNA Vol. 1 QUÍMICA ELEMENTAR CAPÍTULO 4 ESTEQUIOMETRIA 1 QUÍMICA ELEMENTAR CAPÍTULO 4 SUMÁRIO Apresentação -------------------------------------------- 2 Capítulo 4 ------------------------------------------------
