- Molécula polar, devido à elevada electronegatividade do átomo de oxigénio e à própria estrutura da molécula.
|
|
|
- Laís Natal Palma
- 7 Há anos
- Visualizações:
Transcrição
1 Água A água é a substância mais abundante dos organismos vivos, correspondendo a 70% ou mais da sua composição. Os primeiros organismos vivos surgiram certamente no meio aquoso, e o curso da evolução foi moldado pelas propriedades do meio aquoso em que a vida teve origem. As forças atractivas entre moléculas, e a sua ligeira tendência para sofrer ionização são essenciais para a estrutura e função das biomoléculas. A molécula de H 2 O e os seus produtos de ionização, H + e OH -, influenciam profundamente a estrutura, autoorganização e propriedades de todos os componentes celulares, incluindo proteínas, ácidos nucleícos e lípidos. As forças não-covalentes responsáveis pela intensidade e especificidade das interacções entre biomoléculas são condicionadas pela capacidade de formação de ligações de hidrogénio entre a água e os seus solutos.
2 1. A geometria da molécula de água Segundo o modelo de repulsão electrónica da camada de valência (VSEPR) a água apresenta uma geometria tetraédrica não perfeita, ou seja, uma estrutura angular: O = 1s 2 2s 2 2px 2 2py 1 2pz 1 H= 1s 1 H 2 O - 2 pares de electrões ligantes + 2 pares de electrões não ligantes. Como a repulsão entre pares não ligantes é maior do que a repulsão entre pares ligantes, iremos ter uma estrutura tetraédrica distorcida, com uma ângulo de 104.5º entre os átomos de H, em vez de 109.5º. - Constituída por 2 ligações covalentes entre os átomos de oxigénio e hidrogénio - Molécula polar, devido à elevada electronegatividade do átomo de oxigénio e à própria estrutura da molécula. -Forma pontes de hidrogénio entre o átomo de oxigénio de uma molécula e um átomo de hidrogénio de outra molécula.
3 As ligações de hidrogénio tornam a água um solvente invulgar A água apresenta propriedades físicas bastante diferentes da maioria dos líquidos, que podem ser explicadas pela existência de forças atractivas entre as suas moléculas. Estas forças resultam da diferente electronegatividade do oxigénio e hidrogénio, que provocam uma distribuição assimétrica de carga na molécula de água. ~23 kj/mol 1-20 ps
4 Estrutura do gelo Estrutura do gelo. Cada molécula de água estabelece ligações de hidrogénio com 4 moléculas circundantes. O colapso deste retículo tetraédrico explica a diminuição de volume associado à fusão do gelo.
5 A água forma ligações de hidrogénio com uma variedade de grupos químicos A formação de ligações de hidrogénio está dependente da existência de um átomo electronegativo que funciona como aceitador do hidrogénio, e de um átomo dador a que o hidrogénio se encontra covalentemente ligado. Muitos grupos químicos satisfazem estas condições C X X C geralmente não se observam
6 Solução aquosa de substâncias carregadas A água forma ligações de hidrogénio que competem com as interacções entre as partículas da substância carregada e possibilitam a sua dissolução. A dissolução de sais em água é acompanhada de um aumento de entropia ( S<0) e de uma variação de entalpia muito pequena ( H 0), pelo que sendo o processo favorável. G = H - T S < 0,
7 Blindagem das interacções electrostáticas A força de atracção effectiva entre 2 iões na água é dada por : F= q 1 q 2 / ε r 2 em que r é a distância entre os iões, q 1 e q 2 as suas cargas e ε a constante dieléctrica do meio, que para a água é 78.5.
8 A dissolução de substâncias apolares em água é um processo desfavorável Os compostos não-polares forçam as moléculas de água a assumir conformações energeticamente desfavoráveis na interface soluto-solvente. A rotura das ligações de hidrogénio da água não é compensada por formação de ligações soluto-água ( H>0), e a criação de estruturas de água ordenada na interface provoca uma diminuição de entropia ( S<0), pelo que temos G = H - T S > 0 Estrutura ordenada da água em torno de um solute não polar. As moléculas de água organizam-se de modo a maximizar o número de ligações de hidrogénio. Estrutura de um clatrato. Os clatratos são complexos cristalinos de água e um solvente não-polar. Os clatratos são considerados bons modelos para a estrutura da água líquida em torno de um solvent não-polar. (n-c 4 H 9 ) 3 S + F - 23 H 2 O
9 Moléculas anfipáticas Substâncias cujas moléculas contêm simultâneamente regiões hidrofílicas e hidrofóbicas são denominadas anfipáticas. Como consequência do efeito hidrofóbico, as moléculas anfipáticas tendem a export as superfícies polares à agua, e a tentar esconder as superfícies polares, o que produz a formação de estruturas ordenadas denominadas micelas. micela
10 Classificação dos compostos de acordo com a sua capacidade de interagir com a água: - Hidrofílicos: Compostos que se dissolvem facilmente em água (gostam de água), tais como sais e moléculas polares. - Hidrofóbicos: Compostos não polares tais como os lípidos e as ceras, são insolúveis em água. - Anfipáticos: Compostos que contêm simultaneamente regiões hidrofílicas e hidrofóbicas (Ex: Detergentes).
11 Formação de micelas em solução aquosa
12 Existe uma grande variedade de moléculas biológicas anfipáticas: proteínas, lípidos de membrane, pigmentos, vitaminas, etc possuem regiões polares e regiões apolares na sua superfície.
13 Importância bioquímica e estrutural do efeito hidrofóbico A organização estrutura das membranas biológicas é consequência do efeito hidrofóbico a que estão sujeitos os fosfolípidos anfipáticos da membrana. O efeito hidrofóbico é essencial para a estabilização da estrutura nativa das proteínas Em muitos processos de reconhecimento molecular (interacções proteína-ligando), o efeito hidrofóbico é uma componente essencial para a estabilização do complexo formado.
14 Forças de van der Waals Quando dois átomos neutros estão próximos, as flutuações de carga e o efeito de polarização são suficientes para criar uma força atractiva fraca entre eles. Apesar das interacções de van der Waals serem muito fracas (~ 3-4 kj/mol), um elevado número de contactos intra- e interatómicos pode tornar o seu papel extremamente significativo, como acontece nas biomacromoléculas.
15 Interacções interatómicas fracas são cruciais para a estrutura das biomoléculas Embora os quatro tipos de forças presentes na tabela anterior sejam individualmente muito mais fracos do que as ligações covalentes, o efeito somado de um elevado número destas interacções com uma proteína ou um ácido nucleico poderá ser bastante significativo.
16 Macromoléculas como as proteínas, o ADN e o ARN contêm tantos sítios para potenciais ligações por pontes de hidrogénio, iónicas, Van der Waals ou interacções hidrofóbicas, que o efeito cumulativo das muitas forças de ligação fracas é enorme. Para as macromoléculas, a estrutura mais estável (nativa) é normalmente aquela em que a possibilidade de estabelecimento ligações fracas é maximizada. O enrolamento de um polipéptido ou de uma cadeia polinucleotídica e a sua estrutura tridimensional são determinados por este princípio. Influência do soluto nas propriedades coligativas das soluções aquosas Os solutos alteram as propriedades coligativas dos solventes em que estão dissolvidos (Pressão de vapor, ponto de ebulição, ponto de fusão e pressão osmótica), dado a concentração do solvente em soluções ser mais baixa do que no solvente puro. Este efeito depende somente do número de partículas de soluto numa dada quantidade de solvente.
17 Osmose Movimento da água (solvente) através de uma membrana semipermiável, causado pela diferença de pressão osmótica (diferença de osmolaridade). Este factor é de extrema importância na vida da maior parte das células. Soluções isotónicas Soluções de igual osmolaridade. Solução hipertónica Solução que têm uma maior osmolaridade do que aquela com que é comparada. Solução hipotónica - Solução que têm uma menor osmolaridade do que aquela com que é comparada. Na célula
18 Lise osmótica na célula três mecanismos de prevenção: 1. Bactérias e plantas: A membrana plasmática está rodeada por uma parede celular não-expansível com rigidez e força suficientes para resistir à pressão osmótica. 2. Alguns protozoários de água doce: Vivem num meio altamente hipotónico, pelo que possuem um organelo que bombeia a água para fora da célula. 3. Animais multicelulares: O plasma sanguíneo e fluído extracelular dos tecidos são mantidos a uma osmolaridade próxima da do citosol. A elevada concentração de albumina e outras proteínas no plasma sanguíneo contribui para a sua osmolaridade. As células bombeiam também activamente iões como o Na + para o fluido extracelular dos tecidos de forma a balançar a osmolaridade.
19 As moléculas de H 2 O podem ter um papel estrutural Estrutura da hemoglobina Estrutura da hemoglobina com as moléculas de água ligadas Moléculas de água que se encontram fortemente ligadas na superfície ou no interior de uma macromolécula ocupam posições definidades e perdem as propriedades próprios da água líquida. Moléculas de água sequestradas no interior de uma proteína (citocromo f) podem servir como canal para conduzir protões de um local para outro.
20
21 A ionização da água Embora muitas propriedades da água possam ser explicados em termos de uma molécula neutra (mas polar), existe uma pequena fracção de moléculas de água que se encontram ionizada: H 2 O H + + OH K eq = [H + ] [OH ] / [H 2 O] Como a concentração da água pura é constante e igual a mol/l, podemos escrever K eq = [H + ] [OH ] / M K eq = K w = [H + ] [OH ] em que K w é o produto iónico da água, que numa solução aquosa depende apenas da temperatura: K w = 1.0x10-14 M, T = 25 o C Quando [H + ] = [OH ] tem-se: K w = [H + ] [OH ] = [H + ] 2 [H + ] = [OH ] = 10-7 M Nesta situação diz-se que a solução está neutra.
22 A escala de ph ph = log [H + ] A escala de ph foi inventada por Sorensen em 1906, devido à necessidade de controlar rigorosamente a concentração hidrogeniónica nos ensaios bioquímicos.
23 Constantes de dissociação de ácidos fracos Muitos ácidos orgânicos não se dissociam completamente quando dissolvidos no meio aquoso. Considerando a ionização de um ácido fraco: HA ❷ H + + A a sua constante de dissociação, K A, é dada por: K A = [H + ] [A ] / [HA] a ácidos mais fortes correspondem valore de K A mais elevados, mas define-se a grandeza pk, pk A = log K A De tal forma que ácidos mais fortes terão pk a mais baixos.
24 Curvas de titulação de ácidos fracos A concentração de ácido numa determinada solução pode ser determinada adicionando uma base forte (NaOH, por exemplo) em quantidade suficiente para neutralizar completamente o ácido da solução. A variação do ph da solução em função da concentração de base é conhecida como curva de titulação. Curva de titulação do ácido acético
25 Os ácidos fracos podem funcionar como tampões
26 Regulação do ph no organismo Quase todos os processo biológicos são dependentes da concentração de H +, observando-se grandes variações de velocidade de reacção para pequeníssimas alterações do ph do meio. Mesmo quando o H + não está directamente envolvido na reacção, a variação da sua concentração pode ter um efeito profundo na estrutura e função das biomoléculas. Os enzimas que catalisam reacções biológicas contêm muitos grupos ionizáveis com pka s característicos, cujo carga varia com o ph. Os grupos fosfato dos nucleotídos funcionam como ácidos fracos, sendo a sua ionização sensível ao ph do meio. A constância do ph é assegurada pela existência de tampões biológicos, que são misturas de ácidos fracos e das suas bases conjugadas. Influência do ph na actividade enzimática
27 Constantes de dissociação de alguns tampões
28 A equação de Henderson-Hasselbalch A forma das curvas de titulação dos ácidos fracos é descrita pela equação de Henderson-Hasselbalch, que estabelece uma relação simples entre pk a, ph do meio e concentração dos membros do par ácidobase conjugado: dissociação do ácido: resolvendo em ordem a [H + ] Tomando o log negativo de ambos os membros: Substituindo com a definição de ph e pk a : Quando [HA]=[A-], temos:
29 Tampões biológicos No nosso organismo existem alguns tampões especialmente importantes. O tampão fosfato: H 2 PO4 H + + HPO 4 Este tampão tem a sua máxima eficiência a ph=6.86, sendo eficiente dentro do intervalo de ph da maioria dos fluídos biológicos e compartimentos citoplasmáticos (ph ) O ph do plasma sanguíneo é parcialmente controlado pelo tampão bicarbonato: H 2 CO3 H + + HCO 3 K 1 = [H + ] [HCO 3 ] / [H 2 CO 3 ] Para além deste equilíbrio é preciso considerar que o ácido carbónico se forma a partir de CO2 dissolvido na água, num processo reversível: CO 2 (d) + H 2 O H 2 CO 3 (s) K 2 = [H 2 CO 3 ] / [CO 2 (d)] [H 2 O] A concentração de CO 2 dissolvido resulta do equilíbrio com CO 2 na fase gasosa: [CO 2 (g)] = presssão parcial CO 2 (g) CO 2 (d) K 3 = [CO 2 (d)] / [CO 2 (g)] Assim, o ph do tampão bicarbonato depende, em última análise, das concentrações de bicarbonato na fase aquosa e pressão parcial de dióxido de carbono na fase gasosa.
30 Tampões biológicos A histidina, um dos aminoácidos das proteínas, tem um pk a ~6.0, logo pode funcionar como tampão a ph fisiológico Mecanismo do tampão bicarbonato
31 Ex: C 6 H 12 O 6 + 6O 2 6CO 2 + 6H 2 O A água metabólica formada a partir de alimento sólido e combustíveis armazenados é o necessário para que alguns animais sobrevivam em habitats muito secos (canguru, ratos e camelos).
A molécula de água A ÁGUA 2
 A água A maior parte da superfície do planeta terra está coberto com água. A água é também a substância mais abundante dos sistemas vivos, perfazendo cerca de 70% ou mais do peso dos mesmos. A água influência
A água A maior parte da superfície do planeta terra está coberto com água. A água é também a substância mais abundante dos sistemas vivos, perfazendo cerca de 70% ou mais do peso dos mesmos. A água influência
Aula de Bioquímica I. Tema: Água. Prof. Dr. Júlio César Borges
 Aula de Bioquímica I Tema: Água Prof. Dr. Júlio César Borges Depto. de Química e Física Molecular DQFM Instituto de Química de São Carlos IQSC Universidade de São Paulo USP E-mail: borgesjc@iqsc.usp.br
Aula de Bioquímica I Tema: Água Prof. Dr. Júlio César Borges Depto. de Química e Física Molecular DQFM Instituto de Química de São Carlos IQSC Universidade de São Paulo USP E-mail: borgesjc@iqsc.usp.br
Cerca de 99% dos átomos no corpo humano são de H, O, C e N. Oxigenio 63% Hidrogenio 25.2% Carbono 9.5% Azoto 1.4%
 Cerca de 99% dos átomos no corpo humano são de H, O, C e N Oxigenio 63% Hidrogenio 25.2% Carbono 9.5% Azoto 1.4% Tipos de ligação covalente mais comuns em biomoleculas As reacções bioquímicas utilizam
Cerca de 99% dos átomos no corpo humano são de H, O, C e N Oxigenio 63% Hidrogenio 25.2% Carbono 9.5% Azoto 1.4% Tipos de ligação covalente mais comuns em biomoleculas As reacções bioquímicas utilizam
ÁGUA, SOLUBILIDADE E PH
 Universidade Federal do Rio de Janeiro Centro de Ciências da Saúde Instituto de Bioquímica Médica Curso: Enfermagem e Obstetrícia ÁGUA, SOLUBILIDADE E PH ÁGUA: UM COMPONENTE E SOLVENTE UNIVERSAL A ÁGUA
Universidade Federal do Rio de Janeiro Centro de Ciências da Saúde Instituto de Bioquímica Médica Curso: Enfermagem e Obstetrícia ÁGUA, SOLUBILIDADE E PH ÁGUA: UM COMPONENTE E SOLVENTE UNIVERSAL A ÁGUA
INTRODUÇÃO. As reacções bioquímicas requerem, muitas vezes, energia. A fonte mais vulgar de energia química é a adenosina trifosfato (ATP).
 INTRODUÇÃO Célula é a unidade básica dos organismos - tem a área limitada por uma membrana Todas as células são compostas por moléculas pequenas, macromoléculas e organelos. 70% da célula é Água Há quatro
INTRODUÇÃO Célula é a unidade básica dos organismos - tem a área limitada por uma membrana Todas as células são compostas por moléculas pequenas, macromoléculas e organelos. 70% da célula é Água Há quatro
INTRODUÇÃO. As reacções bioquímicas requerem, muitas vezes, energia. A fonte mais vulgar de energia química é a adenosina trifosfato (ATP).
 INTRODUÇÃO Célula é a unidade básica dos organismos - tem a área limitada por uma membrana Todas as células são compostas por moléculas pequenas, macromoléculas e organelos. 70% da célula é Água Há quatro
INTRODUÇÃO Célula é a unidade básica dos organismos - tem a área limitada por uma membrana Todas as células são compostas por moléculas pequenas, macromoléculas e organelos. 70% da célula é Água Há quatro
Introdução à Bioquímica
 Introdução à Bioquímica Água Dra. Fernanda Canduri Laboratório de Sistemas BioMoleculares. Departamento de Física. UNESP São José do Rio Preto. SP. A água é fundamental para os seres vivos, atua como solvente
Introdução à Bioquímica Água Dra. Fernanda Canduri Laboratório de Sistemas BioMoleculares. Departamento de Física. UNESP São José do Rio Preto. SP. A água é fundamental para os seres vivos, atua como solvente
Interacções em moléculas biológicas
 Interacções em moléculas biológicas Interacções intramoleculares Ligações covalentes (manutenção da estrutura covalente das moléculas Interacções não-covalentes (conformções, folding, estrutura secundária)
Interacções em moléculas biológicas Interacções intramoleculares Ligações covalentes (manutenção da estrutura covalente das moléculas Interacções não-covalentes (conformções, folding, estrutura secundária)
ÁGUA. Planeta Terra ou planeta Água? 71% da supergcie é de água. Composição dos seres vivos:
 ÁGUA Planeta Terra ou planeta Água? 71% da supergcie é de água Composição dos seres vivos: 1% de sais minerais 1% de carboidratos 2 a 3% de lipídios 10 a 15% de proteínas 1% de cidos nucléicos 75 a 85%
ÁGUA Planeta Terra ou planeta Água? 71% da supergcie é de água Composição dos seres vivos: 1% de sais minerais 1% de carboidratos 2 a 3% de lipídios 10 a 15% de proteínas 1% de cidos nucléicos 75 a 85%
Disciplina de BIOQUÍMICA do Ciclo Básico de MEDICINA Universidade dos Açores 1º Ano ENSINO PRÁTICO 4ª AULA PRÁTICA
 Disciplina de BIOQUÍMICA do Ciclo Básico de MEDICINA Universidade dos Açores 1º Ano ENSINO PRÁTICO 4ª AULA PRÁTICA CONCEITO DE SOLUÇÕES TAMPÃO, ph E pk 1. Conceito de soluções tampão (ph e pk) 2. Principais
Disciplina de BIOQUÍMICA do Ciclo Básico de MEDICINA Universidade dos Açores 1º Ano ENSINO PRÁTICO 4ª AULA PRÁTICA CONCEITO DE SOLUÇÕES TAMPÃO, ph E pk 1. Conceito de soluções tampão (ph e pk) 2. Principais
Hidrofobicidade. processo foi sucintamente descrita por G.S.Hartley em 1939:
 Hidrofobicidade A excelentes qualidades da água como solvente de uma grande variedade de substâncias podem ser explicadas pela polaridade da molécula de água e pela facilidade de formação ligações de hidrogénio
Hidrofobicidade A excelentes qualidades da água como solvente de uma grande variedade de substâncias podem ser explicadas pela polaridade da molécula de água e pela facilidade de formação ligações de hidrogénio
Água, ph e tampão. Profa. Alana Cecília
 Água, ph e tampão Profa. Alana Cecília Água: Estrutura e Propriedades Físico-químicas A água é o principal componente da maioria das células; Permeia todas as porções de todas as células; Importância em
Água, ph e tampão Profa. Alana Cecília Água: Estrutura e Propriedades Físico-químicas A água é o principal componente da maioria das células; Permeia todas as porções de todas as células; Importância em
BIOQUÍMICA PARA ODONTO
 BIOQUÍMICA PARA ODONTO Aula 1: ph, pk a e Sistemas tampão Aminoácidos Autoria: Luiza Higa Programa de Biologia Estrutural Instituto de Bioquímica Médica Universidade Federal do Rio de Janeiro Reprodução
BIOQUÍMICA PARA ODONTO Aula 1: ph, pk a e Sistemas tampão Aminoácidos Autoria: Luiza Higa Programa de Biologia Estrutural Instituto de Bioquímica Médica Universidade Federal do Rio de Janeiro Reprodução
Todos os seres vivos são constituídos por células unidade estrutural.
 Prof. Ana Rita Rainho Biomoléculas Todos os seres vivos são constituídos por células unidade estrutural. Para além da unidade estrutural também existe uma unidade bioquímica todos os seres vivos são constituídos
Prof. Ana Rita Rainho Biomoléculas Todos os seres vivos são constituídos por células unidade estrutural. Para além da unidade estrutural também existe uma unidade bioquímica todos os seres vivos são constituídos
INSTITUTO FEDERAL DO NORTE DE MINAS GERAIS KAMILA MARCIANO DE SOUZA SOLUÇÃO TAMPÃO ARINOS MINAS GERAIS
 INSTITUTO FEDERAL DO NORTE DE MINAS GERAIS KAMILA MARCIANO DE SOUZA SOLUÇÃO TAMPÃO ARINOS MINAS GERAIS 2016 INSTITUTO FEDERAL DO NORTE DE MINAS GERAIS KAMILA MARCIANO DE SOUZA SOLUÇÃO TAMPÃO PROFESSOR:
INSTITUTO FEDERAL DO NORTE DE MINAS GERAIS KAMILA MARCIANO DE SOUZA SOLUÇÃO TAMPÃO ARINOS MINAS GERAIS 2016 INSTITUTO FEDERAL DO NORTE DE MINAS GERAIS KAMILA MARCIANO DE SOUZA SOLUÇÃO TAMPÃO PROFESSOR:
08/08/2017. Objetivos da aula
 Objetivos da aula Desenvolver a capacidade de preparar uma solução em diferentes unidades de expressão de concentração. Compreender o mecanismo de dissolução de uma substância e os fatores que afetam a
Objetivos da aula Desenvolver a capacidade de preparar uma solução em diferentes unidades de expressão de concentração. Compreender o mecanismo de dissolução de uma substância e os fatores que afetam a
UNIFESO - Engenharia Ambiental Prof. Edson Rodrigo Fernandes dos Santos. ÁGUA, ph E TAMPÕES
 UNIFES - Engenharia Ambiental Prof. Edson Rodrigo Fernandes dos Santos ÁGUA, p E TAMPÕES ÁGUA É uma substância essencial para o organismo. Todas as reações bioquímicas ocorrem em meio aquoso. É uma substância
UNIFES - Engenharia Ambiental Prof. Edson Rodrigo Fernandes dos Santos ÁGUA, p E TAMPÕES ÁGUA É uma substância essencial para o organismo. Todas as reações bioquímicas ocorrem em meio aquoso. É uma substância
Disciplina Fisiologia veterinária I (VET 302)
 Disciplina Fisiologia veterinária I (VET 302) Prof. Bruna Waddington de Freitas Médica Veterinária bruna.freitas@ufv.br 1 Bibliografia Básica REECE, W. O. Dukes Fisiologia dos Animais Domésticos. 12 a
Disciplina Fisiologia veterinária I (VET 302) Prof. Bruna Waddington de Freitas Médica Veterinária bruna.freitas@ufv.br 1 Bibliografia Básica REECE, W. O. Dukes Fisiologia dos Animais Domésticos. 12 a
UNIVERSIDADE FEDERAL DE CAMPINA GRANDE CENTRO DE TECNOLOGIA AGROALIMENTAR CURSO DE GRADUAÇÃO EM AGRONOMIA DISCIPLINA: BIOQUÍMICA GERAL PROFESSOR:
 Aula 4: água UNIVERSIDADE FEDERAL DE CAMPINA GRANDE CENTRO DE TECNOLOGIA AGROALIMENTAR CURSO DE GRADUAÇÃO EM AGRONOMIA DISCIPLINA: BIOQUÍMICA GERAL PROFESSOR: Adriana Silva Lima Água A água é a substância
Aula 4: água UNIVERSIDADE FEDERAL DE CAMPINA GRANDE CENTRO DE TECNOLOGIA AGROALIMENTAR CURSO DE GRADUAÇÃO EM AGRONOMIA DISCIPLINA: BIOQUÍMICA GERAL PROFESSOR: Adriana Silva Lima Água A água é a substância
Química Aplicada e Bioquímica,
 Química Analítica Cristina Costa Química Aplicada e Bioquímica, 2006-2007 2007 Introdução A Água 2 A maior parte das reacções químicas que vamos estudar ocorrem em solução aquosa. 3 4 Estrutura da água
Química Analítica Cristina Costa Química Aplicada e Bioquímica, 2006-2007 2007 Introdução A Água 2 A maior parte das reacções químicas que vamos estudar ocorrem em solução aquosa. 3 4 Estrutura da água
Ácidos, bases e sistemas tampão
 Ácidos, bases e sistemas tampão Ionização da água A água pura tem uma baixa concentração de iões hidrónio (H 3 O + ) e uma igual concentração de iões hidróxido (OH - ) Os ácidos são dadores de protões
Ácidos, bases e sistemas tampão Ionização da água A água pura tem uma baixa concentração de iões hidrónio (H 3 O + ) e uma igual concentração de iões hidróxido (OH - ) Os ácidos são dadores de protões
Ligação Iónica. é também superior (993 ºC 800 ºC)
 Ligação Iónica A ligação iónica resulta da atracção electroestática entre iões de carga oposta. A força atractiva é compensada pela repulsão quando os átomos estão muito próximos e as duas núvens electrónicas
Ligação Iónica A ligação iónica resulta da atracção electroestática entre iões de carga oposta. A força atractiva é compensada pela repulsão quando os átomos estão muito próximos e as duas núvens electrónicas
Biomoléculas e processos Passivos/Ativos na célula
 Biomoléculas e processos Passivos/Ativos na célula ICB Dep. Mofologia Disciplina: Biologia Celular Bases moleculares e Macromoleculares Substâncias Inorgânicas/Orgânicas Processos Celulares Passivos/Ativos
Biomoléculas e processos Passivos/Ativos na célula ICB Dep. Mofologia Disciplina: Biologia Celular Bases moleculares e Macromoleculares Substâncias Inorgânicas/Orgânicas Processos Celulares Passivos/Ativos
Origem grego (protos) primeira, mais importante
 PROTEÍNAS Origem grego (protos) primeira, mais importante A palavra proteína que eu proponho vem derivada de proteos, porque ela parece ser a substância primitiva ou principal da nutrição animal, as plantas
PROTEÍNAS Origem grego (protos) primeira, mais importante A palavra proteína que eu proponho vem derivada de proteos, porque ela parece ser a substância primitiva ou principal da nutrição animal, as plantas
ph SISTEMAS TAMPÕES Faculdade de Medicina PUC-Campinas Profa. Dra. Celene Fernandes Bernardes
 ph SISTEMAS TAMPÕES Faculdade de Medicina PUC-Campinas Profa. Dra. Celene Fernandes Bernardes ph = potencial hidrogeniônico ph = -log [H + ] Sorenson 1909 A escala de ph é logarítma; portanto, quando duas
ph SISTEMAS TAMPÕES Faculdade de Medicina PUC-Campinas Profa. Dra. Celene Fernandes Bernardes ph = potencial hidrogeniônico ph = -log [H + ] Sorenson 1909 A escala de ph é logarítma; portanto, quando duas
Aula: 03 Temática: Componentes Inorgânicos das Células Parte I
 Aula: 03 Temática: Componentes Inorgânicos das Células Parte I As substâncias inorgânicas existem na natureza, independentemente dos seres vivos, mas algumas delas podem ser encontradas nas células. Acompanhe!
Aula: 03 Temática: Componentes Inorgânicos das Células Parte I As substâncias inorgânicas existem na natureza, independentemente dos seres vivos, mas algumas delas podem ser encontradas nas células. Acompanhe!
Macromolécula mais abundante nas células
 PROTEÍNAS Origem grego (protos) primeira, mais importante A palavra proteína que eu proponho vem derivada de proteos, porque ela parece ser a substância primitiva ou principal da nutrição animal, as plantas
PROTEÍNAS Origem grego (protos) primeira, mais importante A palavra proteína que eu proponho vem derivada de proteos, porque ela parece ser a substância primitiva ou principal da nutrição animal, as plantas
Biomoléculas e processos Passivos/Ativos na célula
 Biomoléculas e processos Passivos/Ativos na célula ICB Dep. Mofologia Disciplina: Biologia Celular Prof: Dr. Cleverson Agner Ramos Bases moleculares e Macromoleculares Substâncias Inorgânicas/Orgânicas
Biomoléculas e processos Passivos/Ativos na célula ICB Dep. Mofologia Disciplina: Biologia Celular Prof: Dr. Cleverson Agner Ramos Bases moleculares e Macromoleculares Substâncias Inorgânicas/Orgânicas
Átomos, moléculas, ligações químicas e água
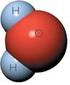 Átomos, moléculas, ligações químicas e água Elementos mais abundantes da crosta terrestre: O 47% Si 28% Al 7,9% Fe 4,5% Ca 3,5% Os elementos químicos da Vida Elementos essenciais Elementos vestigiais Lantanídeos
Átomos, moléculas, ligações químicas e água Elementos mais abundantes da crosta terrestre: O 47% Si 28% Al 7,9% Fe 4,5% Ca 3,5% Os elementos químicos da Vida Elementos essenciais Elementos vestigiais Lantanídeos
Bioquímica: Componentes orgânicos e inorgânicos necessários à vida. Leandro Pereira Canuto
 Bioquímica: orgânicos e inorgânicos necessários à vida Leandro Pereira Canuto Toda matéria viva: C H O N P S inorgânicos orgânicos Água Sais Minerais inorgânicos orgânicos Carboidratos Proteínas Lipídios
Bioquímica: orgânicos e inorgânicos necessários à vida Leandro Pereira Canuto Toda matéria viva: C H O N P S inorgânicos orgânicos Água Sais Minerais inorgânicos orgânicos Carboidratos Proteínas Lipídios
Aminoácidos, Péptidos e Proteínas
 Aminoácidos, Péptidos e Proteínas Proteínas: -São as macromoléculas biológicas mais abundantes, presentes em todas as células. - Ocorrem numa variedade enorme numa mesma célula. - Exibem uma enorme diversidade
Aminoácidos, Péptidos e Proteínas Proteínas: -São as macromoléculas biológicas mais abundantes, presentes em todas as células. - Ocorrem numa variedade enorme numa mesma célula. - Exibem uma enorme diversidade
13/08/2018. Escala de ph. Escala de ph. Crescimento básico. Crescimento ácido. Neutro. básico
 Escala de ph Crescimento básico Neutro Crescimento ácido Escala de ph básico 1 Sistema tampão Um par conjugado ácido-base tende a resistir a alteração de ph, quando pequenas quantidades de ácido ou base
Escala de ph Crescimento básico Neutro Crescimento ácido Escala de ph básico 1 Sistema tampão Um par conjugado ácido-base tende a resistir a alteração de ph, quando pequenas quantidades de ácido ou base
Homeostase do ph. Ácidos e Bases. HA H + + A - HCl H + + Cl - H 2 CO 3 H + + HCO H + + NH 3. Escala de ph
 Frederico Gueiros Filho Formação: Bacharelado em Biologia - UERJ Mestrado em Genética - UFRJ Doutorado - Harvard Medical School - EUA Pós-doutorado - Harvard, Depto. MCB - EUA Interesse de pesquisa: Mecanismo
Frederico Gueiros Filho Formação: Bacharelado em Biologia - UERJ Mestrado em Genética - UFRJ Doutorado - Harvard Medical School - EUA Pós-doutorado - Harvard, Depto. MCB - EUA Interesse de pesquisa: Mecanismo
Composição Química das Células: Água e Sais Minerais
 Composição Química das Células: Água e Sais Minerais Uma das evidências da evolução biológica e da ancestralidade comum dos seres vivos é que todas as formas de vida possuem composição química semelhante.
Composição Química das Células: Água e Sais Minerais Uma das evidências da evolução biológica e da ancestralidade comum dos seres vivos é que todas as formas de vida possuem composição química semelhante.
QUI219 QUÍMICA ANALÍTICA (Farmácia) Prof. Mauricio X. Coutrim
 QUI219 QUÍMICA ANALÍTICA (Farmácia) Prof. Mauricio X. Coutrim (mcoutrim@iceb.ufop.br) SOLUÇÕES AQUOSAS Equilíbrios químicos A água e os eletrólitos (solutos que forma íons quando dissolvidos em água):
QUI219 QUÍMICA ANALÍTICA (Farmácia) Prof. Mauricio X. Coutrim (mcoutrim@iceb.ufop.br) SOLUÇÕES AQUOSAS Equilíbrios químicos A água e os eletrólitos (solutos que forma íons quando dissolvidos em água):
Aspectos Bioquímicos da Água
 Pontifícia Universidade Católica de Goiás Departamento de Biologia Aspectos Bioquímicos da Água Prof. Macks Wendhell Gonçalves, Msc mackswendhell@gmail.com A concentração de água varia entre os organismos
Pontifícia Universidade Católica de Goiás Departamento de Biologia Aspectos Bioquímicos da Água Prof. Macks Wendhell Gonçalves, Msc mackswendhell@gmail.com A concentração de água varia entre os organismos
Número atômico de A = número atômico de B = 18
 61 e QUÍMICA O elemento químico B possui 20 nêutrons, é isótopo do elemento químico A, que possui 18 prótons, e isóbaro do elemento químico C, que tem 16 nêutrons Com base nessas informações, pode-se afirmar
61 e QUÍMICA O elemento químico B possui 20 nêutrons, é isótopo do elemento químico A, que possui 18 prótons, e isóbaro do elemento químico C, que tem 16 nêutrons Com base nessas informações, pode-se afirmar
QBQ 0204 Bioquímica. Carlos Hotta e Glaucia Souza. Introdução à disciplina 11/03/17
 QBQ 0204 Bioquímica Introdução à disciplina Carlos Hotta e Glaucia Souza 11/03/17 Organização do curso Os tópicos serão tratados em aulas expositivas e resolução de exercícios. Material disponível em http://carloshotta.com.br/qbq0304
QBQ 0204 Bioquímica Introdução à disciplina Carlos Hotta e Glaucia Souza 11/03/17 Organização do curso Os tópicos serão tratados em aulas expositivas e resolução de exercícios. Material disponível em http://carloshotta.com.br/qbq0304
UFSC. Resposta: = 40. Comentário
 Resposta: 08 + 32 = 40 01. Incorreta. O butano não possui isomeria óptica, pois não possui carbono assimétrico. 02. Incorreta. Ao serem liberados para a atmosfera os gases sofrem expansão de volume. 04.
Resposta: 08 + 32 = 40 01. Incorreta. O butano não possui isomeria óptica, pois não possui carbono assimétrico. 02. Incorreta. Ao serem liberados para a atmosfera os gases sofrem expansão de volume. 04.
Biologia e Geologia 10º ano. Natércia Charruadas 2011
 Biologia e Geologia 10º ano Natércia Charruadas 2011 Todos os seres vivos, logo todas as células, são constituídos por moléculas orgânicas de grandes dimensões macromoléculas. Estas são formadas por um
Biologia e Geologia 10º ano Natércia Charruadas 2011 Todos os seres vivos, logo todas as células, são constituídos por moléculas orgânicas de grandes dimensões macromoléculas. Estas são formadas por um
Constituintes básicos de uma célula - Biomoléculas. Biomoléculas
 Biomoléculas Todas as moléculas que fazem parte da constituição dos seres vivos são designadas biomoléculas. Formam-se a partir da união de bioelementos. Biomoléculas Os bioelementos combinam-se entre
Biomoléculas Todas as moléculas que fazem parte da constituição dos seres vivos são designadas biomoléculas. Formam-se a partir da união de bioelementos. Biomoléculas Os bioelementos combinam-se entre
2.3.1Mineralização das águas e processos de dissolução
 2.3.1Mineralização das águas e processos de dissolução As águas naturais são na verdade soluções aquosas, não contêm apenas água, mas também substâncias dissolvidas. A facilidade de dissolução das substâncias
2.3.1Mineralização das águas e processos de dissolução As águas naturais são na verdade soluções aquosas, não contêm apenas água, mas também substâncias dissolvidas. A facilidade de dissolução das substâncias
Membranas Biológicas
 UNIVERSIDADE DO ESTADO DE SANTA CATARINA CENTRO DE CIÊNCIAS TECNOLÓGICAS DEPARTAMENTO DE QUÍMICA DQMC BIOQUÍMICA BIO0001 Membranas Biológicas Prof Karine P. Naidek Outubro/2016 Membranas Biológicas Membranas
UNIVERSIDADE DO ESTADO DE SANTA CATARINA CENTRO DE CIÊNCIAS TECNOLÓGICAS DEPARTAMENTO DE QUÍMICA DQMC BIOQUÍMICA BIO0001 Membranas Biológicas Prof Karine P. Naidek Outubro/2016 Membranas Biológicas Membranas
Água A água é uma substância química cujas moléculas são formadas por dois átomos de hidrogênio e um de oxigênio (H2O). É abundante no planeta Terra,
 A Química da Vida Água A água é uma substância química cujas moléculas são formadas por dois átomos de hidrogênio e um de oxigênio (H2O). É abundante no planeta Terra, onde cobre grande parte de sua superfície
A Química da Vida Água A água é uma substância química cujas moléculas são formadas por dois átomos de hidrogênio e um de oxigênio (H2O). É abundante no planeta Terra, onde cobre grande parte de sua superfície
ph arterial entre 7,35 e 7,45 [H+] ~ 40 nanomoles/l (10-9) CO2 (Ácido volátil) O CO 2 não se acumula no organismo, é eliminado pelos pulmões
![ph arterial entre 7,35 e 7,45 [H+] ~ 40 nanomoles/l (10-9) CO2 (Ácido volátil) O CO 2 não se acumula no organismo, é eliminado pelos pulmões ph arterial entre 7,35 e 7,45 [H+] ~ 40 nanomoles/l (10-9) CO2 (Ácido volátil) O CO 2 não se acumula no organismo, é eliminado pelos pulmões](/thumbs/60/44575873.jpg) Regulação do ph dos líquidos Regulação do ph dos líquidos ph = log[ ] LEC =, ±, (, mm) ph , Alcalose Ojetivo: Manutenção do ph sistêmico na faixa de normalidade. ph arterial entre, e, [H]
Regulação do ph dos líquidos Regulação do ph dos líquidos ph = log[ ] LEC =, ±, (, mm) ph , Alcalose Ojetivo: Manutenção do ph sistêmico na faixa de normalidade. ph arterial entre, e, [H]
ph do sangue arterial = 7.4
 Regulação do Equilíbrio Ácido Base ph do sangue arterial = 7.4 < 6.9 ou > 7.7 = MORTE 1 Importância do ph nos processos biológicos Protonação ou desprotonação de radicais proteicos Variação da carga total
Regulação do Equilíbrio Ácido Base ph do sangue arterial = 7.4 < 6.9 ou > 7.7 = MORTE 1 Importância do ph nos processos biológicos Protonação ou desprotonação de radicais proteicos Variação da carga total
Disciplina Biologia Celular. Profª Cristina Lacerda Soares Petrarolha Silva Curso de Agronomia FISMA / FEA
 Disciplina Biologia Celular Profª Cristina Lacerda Soares Petrarolha Silva Curso de Agronomia FISMA / FEA Aula 4: Bases Macromoleculares da Constituição Celular Bio Cel Profª Cristina Introdução Células
Disciplina Biologia Celular Profª Cristina Lacerda Soares Petrarolha Silva Curso de Agronomia FISMA / FEA Aula 4: Bases Macromoleculares da Constituição Celular Bio Cel Profª Cristina Introdução Células
Trabalho realizado por: Ariana Gonçalves nº Ricardo Figueiredo nº
 Trabalho realizado por: Ariana Gonçalves nº. 57301 Ricardo Figueiredo nº. 57284 Composição: Lípidos (anfipáticos); Proteínas; Glícidos: Sob a forma de glicolípidos e glicoproteínas. (em proporções variáveis)
Trabalho realizado por: Ariana Gonçalves nº. 57301 Ricardo Figueiredo nº. 57284 Composição: Lípidos (anfipáticos); Proteínas; Glícidos: Sob a forma de glicolípidos e glicoproteínas. (em proporções variáveis)
Avaliação da Capacidade para Frequência do Ensino Superior de Candidatos Maiores de 23 anos
 Avaliação da Capacidade para Frequência do Ensino Superior de Candidatos Maiores de 23 anos 2016 QUÍMICA Conteúdos Programáticos MATERIAIS - Origem - Constituição e composição dos materiais: - Constituição
Avaliação da Capacidade para Frequência do Ensino Superior de Candidatos Maiores de 23 anos 2016 QUÍMICA Conteúdos Programáticos MATERIAIS - Origem - Constituição e composição dos materiais: - Constituição
Escola Secundária Anselmo de Andrade 5º Teste de Biologie e Geologia de 10 ano. Nome- Nº T Data-
 Escola Secundária Anselmo de Andrade 5º Teste de Biologie e Geologia de 10 ano Nome- Nº T Data- O mundo vivo é caracterizado por uma enorme diversidade. Pluricelular Unicelular Heterotrófico organismos
Escola Secundária Anselmo de Andrade 5º Teste de Biologie e Geologia de 10 ano Nome- Nº T Data- O mundo vivo é caracterizado por uma enorme diversidade. Pluricelular Unicelular Heterotrófico organismos
Metais no Organismo Humano
 Metais no Organismo Humano Relativamente à necessidade biológica podem classificar-se Metais Essenciais: Metais Tóxicos: sódio, potássio, cálcio, magnésio, ferro, crómio, zinco, cobalto, manganês e níquel.
Metais no Organismo Humano Relativamente à necessidade biológica podem classificar-se Metais Essenciais: Metais Tóxicos: sódio, potássio, cálcio, magnésio, ferro, crómio, zinco, cobalto, manganês e níquel.
Proposta de resolução do Exame Nacional de Química do 12º ano Prova 142, 1ª chamada, 30 de Junho de 2003 Versão 1
 Proposta de resolução do Exame Nacional de Química do 12º ano Prova 142, 1ª chamada, 0 de Junho de 200 Versão 1 Grupo 1 1. A afirmação verdadeira é a (E). Estes dois elementos pertencem ao mesmo grupo
Proposta de resolução do Exame Nacional de Química do 12º ano Prova 142, 1ª chamada, 0 de Junho de 200 Versão 1 Grupo 1 1. A afirmação verdadeira é a (E). Estes dois elementos pertencem ao mesmo grupo
Membrana Plasmática Estrutura e Função
 Universidade Federal do Amazonas ICB Dep. Morfologia Disciplina: Biologia Celular Aulas Teóricas Membrana Plasmática Estrutura e Função Prof: Dr. Cleverson Agner Ramos Membrana Plasmática A bicamada de
Universidade Federal do Amazonas ICB Dep. Morfologia Disciplina: Biologia Celular Aulas Teóricas Membrana Plasmática Estrutura e Função Prof: Dr. Cleverson Agner Ramos Membrana Plasmática A bicamada de
Biomoléculas. * Este esquema não está a incluir as Vitaminas que são classificadas no grupo de moléculas orgânicas. Biomoléculas
 Biomoléculas Biomoléculas Inorgânicas Orgânicas Água Sais Minerais Glícidos Lípidos Prótidos Ácidos Nucléicos * Este esquema não está a incluir as Vitaminas que são classificadas no grupo de moléculas
Biomoléculas Biomoléculas Inorgânicas Orgânicas Água Sais Minerais Glícidos Lípidos Prótidos Ácidos Nucléicos * Este esquema não está a incluir as Vitaminas que são classificadas no grupo de moléculas
FORÇAS INTERMOLECULARES
 FORÇAS INTERMOLECULARES São as forças que mantêm os sólidos e líquidos unidos. A ligação covalente que mantém uma molécula unida é uma força intramolecular. A atração entre moléculas é uma força intermolecular.
FORÇAS INTERMOLECULARES São as forças que mantêm os sólidos e líquidos unidos. A ligação covalente que mantém uma molécula unida é uma força intramolecular. A atração entre moléculas é uma força intermolecular.
Biologia Molecular ÁGUA
 Biologia Molecular ÁGUA Direitos autorais reservados. INTRODUÇÃO A vida depende de reações químicas que ocorrem dentro das células reações bioquímicas do metabolismo. Constituição da matéria viva: água,
Biologia Molecular ÁGUA Direitos autorais reservados. INTRODUÇÃO A vida depende de reações químicas que ocorrem dentro das células reações bioquímicas do metabolismo. Constituição da matéria viva: água,
LIPOFILIA LIPOFILIA COEFICIENTE DE PARTIÇÃO.
 LIPOFILIA A lipofilia de um composto é comumente estimada usando Log P a partir da partição de um sistema octanol/água aandrico@ifsc.usp.br A lipofilia é uma das propriedades mais importantes relacionadas
LIPOFILIA A lipofilia de um composto é comumente estimada usando Log P a partir da partição de um sistema octanol/água aandrico@ifsc.usp.br A lipofilia é uma das propriedades mais importantes relacionadas
Vitaminas As vitaminas são nutrientes essenciais para nos.o organismo humano necessita destas vitaminas em pequenas quantidades para desempenhar
 A Química da vida A água A água é a mais abundante de todas as substâncias da célula, representando cerca de 80% da sua massa; funciona como solvente para grande parte das outras substâncias presentes
A Química da vida A água A água é a mais abundante de todas as substâncias da célula, representando cerca de 80% da sua massa; funciona como solvente para grande parte das outras substâncias presentes
MÓDULO 1 ESTRUTURA DE BIOMOLÉCULAS. Bianca Zingales IQ-USP
 MÓDULO 1 ESTRUTURA DE BIOMOLÉCULAS Bianca Zingales IQ-USP Biomoléculas As biomoléculas são compostos químicos presentes nas células de todos os seres vivos. São em geral moléculas orgânicas, compostas
MÓDULO 1 ESTRUTURA DE BIOMOLÉCULAS Bianca Zingales IQ-USP Biomoléculas As biomoléculas são compostos químicos presentes nas células de todos os seres vivos. São em geral moléculas orgânicas, compostas
Princípios fisico-químicos laboratoriais. Aula 08 Profº Ricardo Dalla Zanna
 Princípios fisico-químicos laboratoriais Aula 08 Profº Ricardo Dalla Zanna Conteúdo Programático Unidade 3 Química orgânica o Seção 3.1 Ligação e estrutura molecular o Seção 3.2 Funções orgânicas - Hidrocarbonetos
Princípios fisico-químicos laboratoriais Aula 08 Profº Ricardo Dalla Zanna Conteúdo Programático Unidade 3 Química orgânica o Seção 3.1 Ligação e estrutura molecular o Seção 3.2 Funções orgânicas - Hidrocarbonetos
INTRODUÇÃO Á BIOQUÍMICA
 INTRODUÇÃO Á BIOQUÍMICA BIOQUÍMICA ENFERMAGEM FIO Faculdades Integradas de Ourinhos. Prof. Esp. Roberto Venerando Fundação Educacional Miguel Mofarrej. FIO robertovenerando@fio.edu.br 1 - Introdução à
INTRODUÇÃO Á BIOQUÍMICA BIOQUÍMICA ENFERMAGEM FIO Faculdades Integradas de Ourinhos. Prof. Esp. Roberto Venerando Fundação Educacional Miguel Mofarrej. FIO robertovenerando@fio.edu.br 1 - Introdução à
Capítulo 12. Tipos de Soluções. Unidades de Concentração Efeito da Temperatura na Solubilidade Efeito da Pressão na Solubilidade de Gases
 Capítulo 12 Propriedades Físicas das Soluções Tipos de Soluções Perspectiva Molecular do Processo de Dissolução Unidades de Concentração Efeito da Temperatura na Solubilidade Efeito da Pressão na Solubilidade
Capítulo 12 Propriedades Físicas das Soluções Tipos de Soluções Perspectiva Molecular do Processo de Dissolução Unidades de Concentração Efeito da Temperatura na Solubilidade Efeito da Pressão na Solubilidade
b
 a 1 2 3 4 5 8 6 7 b c d e 1 2 C B A Todos os seres vivos e as suas células são constituídos por moléculas orgânicas de grandes dimensões, as MACROMOLÉCULAS. O H As biomoléculas desempenham várias funções:
a 1 2 3 4 5 8 6 7 b c d e 1 2 C B A Todos os seres vivos e as suas células são constituídos por moléculas orgânicas de grandes dimensões, as MACROMOLÉCULAS. O H As biomoléculas desempenham várias funções:
SOLUÇÃO PRATIQUE EM CASA - QUÍMICA
 SOLUÇÃO PC. Percebe-se pela geometria apresentada, que: 3 2 () A hibridização de é sp d. 2 2 6 2 6 2 0 6 2 0 6 Xe (Z 54) : s 2s 2p 3s 3p 4s 3d 4p 5s 4d 5p Xe (camada de valência): SOLUÇÃO PRATIQUE EM CASA
SOLUÇÃO PC. Percebe-se pela geometria apresentada, que: 3 2 () A hibridização de é sp d. 2 2 6 2 6 2 0 6 2 0 6 Xe (Z 54) : s 2s 2p 3s 3p 4s 3d 4p 5s 4d 5p Xe (camada de valência): SOLUÇÃO PRATIQUE EM CASA
BIOLOGIA. Moléculas, células e tecidos. Estrutura e fisiologia da Membrana Plasmática - Parte 2. Professor: Alex Santos
 BIOLOGIA Moléculas, células e tecidos Estrutura e fisiologia da Membrana Plasmática - Parte 2 Professor: Alex Santos Tópicos em abordagem: Parte 2 Transporte e especializações de membrana V Transporte
BIOLOGIA Moléculas, células e tecidos Estrutura e fisiologia da Membrana Plasmática - Parte 2 Professor: Alex Santos Tópicos em abordagem: Parte 2 Transporte e especializações de membrana V Transporte
Propriedades Físicas e Químicas dos Compostos Orgânicos
 Aumenta Propriedades das Moléculas Orgânicas Propriedades Físicas e Químicas dos Compostos Orgânicos A partir das ligações químicas que unem os átomos de suas moléculas, e das forças que agem entre elas
Aumenta Propriedades das Moléculas Orgânicas Propriedades Físicas e Químicas dos Compostos Orgânicos A partir das ligações químicas que unem os átomos de suas moléculas, e das forças que agem entre elas
OBTENÇÃO DE MATÉRIA PELOS SERES HETEROTRÓFICOS: - Estrutura da membrana celular - Mecanismos de transporte membranar
 OBTENÇÃO DE MATÉRIA PELOS SERES HETEROTRÓFICOS: - Estrutura da membrana celular - Mecanismos de transporte membranar Natércia Charruadas Biologia e Geologia 10º ano SistemaGzar conhecimentos Metabolismo
OBTENÇÃO DE MATÉRIA PELOS SERES HETEROTRÓFICOS: - Estrutura da membrana celular - Mecanismos de transporte membranar Natércia Charruadas Biologia e Geologia 10º ano SistemaGzar conhecimentos Metabolismo
TRANSPORTE ATRAVÉS DA MEMBRANA
 TRANSPORTE ATRAVÉS DA MEMBRANA LÍQUIDOS INTRA E EXTRA CELULARES MEMBRANA CELULAR: manutenção das # / seletividade das proteínas transportadoras para íons ou moléculas; SELETIVIDADE E ABERTURAS DAS COMPORTAS
TRANSPORTE ATRAVÉS DA MEMBRANA LÍQUIDOS INTRA E EXTRA CELULARES MEMBRANA CELULAR: manutenção das # / seletividade das proteínas transportadoras para íons ou moléculas; SELETIVIDADE E ABERTURAS DAS COMPORTAS
BCL 0307 Transformações Químicas
 BCL 0307 Transformações Químicas Prof. Dr. André Sarto Polo Bloco B S. 1014 ou L202 andre.polo@ufabc.edu.br Aula 02 Determinar a polaridade de cada ligação e da molécula como um todo CCl 4 HCCl 3 C 2 H
BCL 0307 Transformações Químicas Prof. Dr. André Sarto Polo Bloco B S. 1014 ou L202 andre.polo@ufabc.edu.br Aula 02 Determinar a polaridade de cada ligação e da molécula como um todo CCl 4 HCCl 3 C 2 H
ARTIGO SOBRE OS PERSONAGENS MARCANTES DA HISTÓRIA DA FISIOLOGIA
 ARTIGO SOBRE OS PERSONAGENS MARCANTES DA HISTÓRIA DA FISIOLOGIA Adaptação Ponto de vista evolutivo Exemplos: gado Zebu X gado europeu Aclimatação Alteração fisiológica, bioquímica ou anatômica a partir
ARTIGO SOBRE OS PERSONAGENS MARCANTES DA HISTÓRIA DA FISIOLOGIA Adaptação Ponto de vista evolutivo Exemplos: gado Zebu X gado europeu Aclimatação Alteração fisiológica, bioquímica ou anatômica a partir
Para compreender o conceito de reacção de precipitação é necessário considerar as noções básicas de dissolução e de solubilidade de sais em água.
 ESTUDO DA SOLUBILIDADE DO ACETATO DE PRATA INTRODUÇÃO Para compreender o conceito de reacção de precipitação é necessário considerar as noções básicas de dissolução e de solubilidade de sais em água. O
ESTUDO DA SOLUBILIDADE DO ACETATO DE PRATA INTRODUÇÃO Para compreender o conceito de reacção de precipitação é necessário considerar as noções básicas de dissolução e de solubilidade de sais em água. O
Reações ácido base 1
 1 Reações ácido base Evolução Histórica A palavra ácido (acidus, em latim) significa azedo (sabor azedo) A palavra alcalino (do termo árabe al Kali) significa cinza de plantas (sabor amargo e escorregadias
1 Reações ácido base Evolução Histórica A palavra ácido (acidus, em latim) significa azedo (sabor azedo) A palavra alcalino (do termo árabe al Kali) significa cinza de plantas (sabor amargo e escorregadias
A IMPORTÂNCIA DA ÁGUA
 A ÁGUA A IMPORTÂNCIA DA ÁGUA A água é a substância mais abundante nos sistemas vivos, prefazendo 70% ou mais do peso da maioria dos organismos. Os primeiros organismos vivos iniciaram a sua vida num ambiente
A ÁGUA A IMPORTÂNCIA DA ÁGUA A água é a substância mais abundante nos sistemas vivos, prefazendo 70% ou mais do peso da maioria dos organismos. Os primeiros organismos vivos iniciaram a sua vida num ambiente
Água A superfície da Terra é constituída de três quartos de água, cerca de 70%, a maior parte está concentrada nos oceanos e mares, cerca de 97,5%, o
 A química da Vida Água A superfície da Terra é constituída de três quartos de água, cerca de 70%, a maior parte está concentrada nos oceanos e mares, cerca de 97,5%, o restante 2,5% está concentrado em
A química da Vida Água A superfície da Terra é constituída de três quartos de água, cerca de 70%, a maior parte está concentrada nos oceanos e mares, cerca de 97,5%, o restante 2,5% está concentrado em
FISIOLOGIA GERAL INTRODUÇÃO
 FISIOLOGIA GERAL INTRODUÇÃO FISIOLOGIA Fisiologia (do grego physis = natureza, função ou funcionamento; e logos =estudo) A fisiologia: - estuda as funções mecânicas, físicas e bioquímicas nos seres vivos.
FISIOLOGIA GERAL INTRODUÇÃO FISIOLOGIA Fisiologia (do grego physis = natureza, função ou funcionamento; e logos =estudo) A fisiologia: - estuda as funções mecânicas, físicas e bioquímicas nos seres vivos.
Lipídeos e Membranas Biológicas
 Disciplina de Bioquímica Estrutural Curso de Ciências Biológicas Lipídeos e Membranas Biológicas Prof. Marcos Túlio de Oliveira mtoliveira@fcav.unesp.br Faculdade de Ciências Agrárias e Veterinárias de
Disciplina de Bioquímica Estrutural Curso de Ciências Biológicas Lipídeos e Membranas Biológicas Prof. Marcos Túlio de Oliveira mtoliveira@fcav.unesp.br Faculdade de Ciências Agrárias e Veterinárias de
QB70C:// Química (Turmas S71/S72) Ligação Química
 QB70C:// Química (Turmas S71/S72) Ligação Química Prof. Dr. Eduard Westphal (http://paginapessoal.utfpr.edu.br/eduardw) Formação das Ligações O modelo RPECV, baseado principalmente nas estruturas de Lewis,
QB70C:// Química (Turmas S71/S72) Ligação Química Prof. Dr. Eduard Westphal (http://paginapessoal.utfpr.edu.br/eduardw) Formação das Ligações O modelo RPECV, baseado principalmente nas estruturas de Lewis,
Vamos iniciar o estudo da unidade fundamental que constitui todos os organismos vivos: a célula.
 Aula 01 Composição química de uma célula O que é uma célula? Vamos iniciar o estudo da unidade fundamental que constitui todos os organismos vivos: a célula. Toda célula possui a capacidade de crescer,
Aula 01 Composição química de uma célula O que é uma célula? Vamos iniciar o estudo da unidade fundamental que constitui todos os organismos vivos: a célula. Toda célula possui a capacidade de crescer,
Química 2º Ano. Professora Cristina Lorenski Ferreira
 Química 2º Ano Professora Cristina Lorenski Ferreira 2016 1 GEOMETRIA MOLECULAR POLARIDADE DAS MOLÉCULAS INTERAÇÕES INTERMOLECULARES PROFESSORA CRISTINA LORENSKI FERREIRA 2 ALGUNS QUESTIONAMENTOS Como
Química 2º Ano Professora Cristina Lorenski Ferreira 2016 1 GEOMETRIA MOLECULAR POLARIDADE DAS MOLÉCULAS INTERAÇÕES INTERMOLECULARES PROFESSORA CRISTINA LORENSKI FERREIRA 2 ALGUNS QUESTIONAMENTOS Como
CIÊNCIAS DA NATUREZA - QUÍMICA Prof. Adriana Strelow 1º Ano
 CIÊNCIAS DA NATUREZA - QUÍMICA Prof. Adriana Strelow 1º Ano - 2016 Geometria molecular : Forma como os átomos estão espacialmente dispostos em uma molécula. A geometria de uma molécula depende do número
CIÊNCIAS DA NATUREZA - QUÍMICA Prof. Adriana Strelow 1º Ano - 2016 Geometria molecular : Forma como os átomos estão espacialmente dispostos em uma molécula. A geometria de uma molécula depende do número
Ligações Interatômicas: IÔNICA = metal + não-metal COVALENTE = não-metais METÁLICA = metais
 Ligações Químicas Ligações Interatômicas: IÔNICA = metal + não-metal COVALENTE = não-metais METÁLICA = metais Ligação iônica Transferência de elétrons de um átomo para outro Íons de cargas opostas Forças
Ligações Químicas Ligações Interatômicas: IÔNICA = metal + não-metal COVALENTE = não-metais METÁLICA = metais Ligação iônica Transferência de elétrons de um átomo para outro Íons de cargas opostas Forças
Propriedades dos compostos moleculares
 Aula 10 Propriedades dos compostos moleculares Forças intermoleculares Van der Waals: Keesom, Debye, London Ligações de hidrogénio Propriedades Temperaturas de fusão e de ebulição Miscibilidade Viscosidade
Aula 10 Propriedades dos compostos moleculares Forças intermoleculares Van der Waals: Keesom, Debye, London Ligações de hidrogénio Propriedades Temperaturas de fusão e de ebulição Miscibilidade Viscosidade
Ciência que estuda a química da vida
 Ciência que estuda a química da vida Mostra como o conjunto de moléculas inanimadas que constituem os seres vivos interagem para manter e perpetuar a vida seguindo as leis da química e da física e conferindo
Ciência que estuda a química da vida Mostra como o conjunto de moléculas inanimadas que constituem os seres vivos interagem para manter e perpetuar a vida seguindo as leis da química e da física e conferindo
Ciência que estuda a química da vida
 Ciência que estuda a química da vida Mostra como o conjunto de moléculas inanimadas que constituem os seres vivos interagem para manter e perpetuar a vida seguindo as leis da química e da física e conferindo
Ciência que estuda a química da vida Mostra como o conjunto de moléculas inanimadas que constituem os seres vivos interagem para manter e perpetuar a vida seguindo as leis da química e da física e conferindo
10º ANO MÓDULO 2 (dois) F i c h a d e p r e p a r a ç ã o p a r a o t e s t e d o d i a 31 d e M a r ç o GRUPO I
 E S C O L A S E C U N D Á R I A A N T Ó N I O S É R G I O 10º ANO MÓDULO 2 (dois) F i c h a d e p r e p a r a ç ã o p a r a o t e s t e d o d i a 31 d e M a r ç o 2 7-03- 201 4 GRUPO I 1 1 Os seres vivos
E S C O L A S E C U N D Á R I A A N T Ó N I O S É R G I O 10º ANO MÓDULO 2 (dois) F i c h a d e p r e p a r a ç ã o p a r a o t e s t e d o d i a 31 d e M a r ç o 2 7-03- 201 4 GRUPO I 1 1 Os seres vivos
OLIMPÍADA MINEIRA DE QUÍMICA 2013 GABARITO OFICIAL. Modalidade A - Tabela de Respostas das Questões 1 a 20. a X X X X X X. b X X X X X X X.
 OLIMPÍADA MINEIRA DE QUÍMICA 2013 GABARITO OFICIAL Modalidade A - Tabela de Respostas das Questões 1 a 20 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 a X X X X X X b X X X X X X X c X X X d X X
OLIMPÍADA MINEIRA DE QUÍMICA 2013 GABARITO OFICIAL Modalidade A - Tabela de Respostas das Questões 1 a 20 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 a X X X X X X b X X X X X X X c X X X d X X
FISIOLOGIA DAS MEMBRANAS. Composição da membrana plasmática. Transporte através da membrana.
 FISIOLOGIA DAS MEMBRANAS Composição da membrana plasmática. Transporte através da membrana. FUNÇÕES DA MEMBRANA PLASMÁTICA Isolamento físico Regulação de trocas Comunicação celular Suporte estrutural Modelo
FISIOLOGIA DAS MEMBRANAS Composição da membrana plasmática. Transporte através da membrana. FUNÇÕES DA MEMBRANA PLASMÁTICA Isolamento físico Regulação de trocas Comunicação celular Suporte estrutural Modelo
MUDANÇA DE ESTADO ROMPIMENTO DE FORÇAS INTERMOLECULARES
 MUDANÇA DE ESTADO ROMPIMENTO DE FORÇAS INTERMOLECULARES DEFORMAÇÃO DA NUVEM ELETRÔNICA EFEITO COLISÃO = CHOQUE ///// EFEITO INDUÇÃO = VARIAÇÃO ELÉTRICA DIPOLO INDUZIDO FORÇAS DE LONDON ///// DIPOLO INSTANTÂNEO
MUDANÇA DE ESTADO ROMPIMENTO DE FORÇAS INTERMOLECULARES DEFORMAÇÃO DA NUVEM ELETRÔNICA EFEITO COLISÃO = CHOQUE ///// EFEITO INDUÇÃO = VARIAÇÃO ELÉTRICA DIPOLO INDUZIDO FORÇAS DE LONDON ///// DIPOLO INSTANTÂNEO
4. Ácidos e Bases em Química Orgânica
 4. Ácidos e Bases em Química Orgânica Leitura Recomendada: Organic Chemistry, J. Clayden, N. Greeves, S. Warren, P. Wothers, Oxford, Oxford, 2001, cap. 8. Compreender aspectos de acidez e basicidade é
4. Ácidos e Bases em Química Orgânica Leitura Recomendada: Organic Chemistry, J. Clayden, N. Greeves, S. Warren, P. Wothers, Oxford, Oxford, 2001, cap. 8. Compreender aspectos de acidez e basicidade é
Química Fascículo 02 Elisabeth Pontes Araújo Elizabeth Loureiro Zink José Ricardo Lemes de Almeida
 Química Fascículo 02 Elisabeth Pontes Araújo Elizabeth Loureiro Zink José Ricardo Lemes de Almeida Índice Ligação Covalente...1 Ligação Iônica...3 Teoria de Lewis...5 Ligações Intermoleculares...6 Exercícios...7
Química Fascículo 02 Elisabeth Pontes Araújo Elizabeth Loureiro Zink José Ricardo Lemes de Almeida Índice Ligação Covalente...1 Ligação Iônica...3 Teoria de Lewis...5 Ligações Intermoleculares...6 Exercícios...7
O plasma sanguíneo contém uma reserva ("pool") total de carbonato (essencialmente HCO 3-
 Exercícios 1. Segel, Biochemical Calculations, Capítulo 1, Problema 1-19. O Ka do ácido fraco HA é 1,6 x 10-6. Calcular: a) O grau de ionização do ácido para uma solução 10-3 M. b) O ph 2. Segel, Biochemical
Exercícios 1. Segel, Biochemical Calculations, Capítulo 1, Problema 1-19. O Ka do ácido fraco HA é 1,6 x 10-6. Calcular: a) O grau de ionização do ácido para uma solução 10-3 M. b) O ph 2. Segel, Biochemical
Sumário. 1 Introdução: matéria e medidas 1. 2 Átomos, moléculas e íons Estequiometria: cálculos com fórmulas e equações químicas 67
 Prefácio 1 Introdução: matéria e medidas 1 1.1 O estudo da química 1 1.2 Classificações da matéria 3 1.3 Propriedades da matéria 8 1.4 Unidades de medida 12 1.5 Incerteza na medida 18 1.6 Análise dimensional
Prefácio 1 Introdução: matéria e medidas 1 1.1 O estudo da química 1 1.2 Classificações da matéria 3 1.3 Propriedades da matéria 8 1.4 Unidades de medida 12 1.5 Incerteza na medida 18 1.6 Análise dimensional
tampão Prof a Alessandra Smaniotto QMC Química Analítica Curso de Graduação em Farmácia Turmas 02102A e 02102B
 Cap 3: Equilíbrio Químico Soluções tampão Prof a Alessandra Smaniotto QMC 5325 - Química Analítica Curso de Graduação em Farmácia Turmas 02102A e 02102B Água:excepcional habilidade em dissolver grande
Cap 3: Equilíbrio Químico Soluções tampão Prof a Alessandra Smaniotto QMC 5325 - Química Analítica Curso de Graduação em Farmácia Turmas 02102A e 02102B Água:excepcional habilidade em dissolver grande
Química Bio-inorgânica - 1 o semestre 2018 Prof. André Ferraz
 Química Bio-inorgânica - 1 o semestre 2018 Prof. André Ferraz Cronograma 2018 >> ver edisciplinas.usp.br Aspectos formais Avaliação: 4 Provas escritas: (2 para compor P1 e 2 para compor P2) Nota final
Química Bio-inorgânica - 1 o semestre 2018 Prof. André Ferraz Cronograma 2018 >> ver edisciplinas.usp.br Aspectos formais Avaliação: 4 Provas escritas: (2 para compor P1 e 2 para compor P2) Nota final
5º Teste Sumativo (60 minutos)
 ESCOLA SECUNDÁRIA DE CASQUILHOS BARREIRO 5º Teste Sumativo (60 minutos) DISCIPLINA DE BIOLOGIA E GEOLOGIA 10º Ano - Turma A TEMA : Componente de Biologia Diversidade na biosfera e obtenção de matéria pelos
ESCOLA SECUNDÁRIA DE CASQUILHOS BARREIRO 5º Teste Sumativo (60 minutos) DISCIPLINA DE BIOLOGIA E GEOLOGIA 10º Ano - Turma A TEMA : Componente de Biologia Diversidade na biosfera e obtenção de matéria pelos
Química I Exame de 2ª Época, 7/2/2012 Resolução 1. a)
 Química I Exame de 2ª Época, 7/2/2012 Resolução 1. a) b) A intensidade de corrente que passa no circuito (dada pelo nº de electrões que passa por unidade de tempo) depende da intensidade da radiação incidente.
Química I Exame de 2ª Época, 7/2/2012 Resolução 1. a) b) A intensidade de corrente que passa no circuito (dada pelo nº de electrões que passa por unidade de tempo) depende da intensidade da radiação incidente.
QUI109 QUÍMICA GERAL (Ciências Biológicas) 8ª aula /
 QUI109 QUÍMICA GERAL (Ciências Biológicas) 8ª aula / 2016-2 Prof. Mauricio X. Coutrim (disponível em: http://professor.ufop.br/mcoutrim) A LIGAÇÃO COVALENTE É BASEADA NO COMPARTILHAMENTO DE ELÉTRONS Ex.
QUI109 QUÍMICA GERAL (Ciências Biológicas) 8ª aula / 2016-2 Prof. Mauricio X. Coutrim (disponível em: http://professor.ufop.br/mcoutrim) A LIGAÇÃO COVALENTE É BASEADA NO COMPARTILHAMENTO DE ELÉTRONS Ex.
PROTEÍNAS. A palavra proteína derivada de proteos, (grego = primeira ou a mais importante)
 PROTEÍNAS A palavra proteína derivada de proteos, (grego = primeira ou a mais importante) Macromolécula mais abundante nas células Produto final da informação genética (DNA-RNA-Proteína) Diversidade funcional
PROTEÍNAS A palavra proteína derivada de proteos, (grego = primeira ou a mais importante) Macromolécula mais abundante nas células Produto final da informação genética (DNA-RNA-Proteína) Diversidade funcional
QB70C:// Química (Turmas S71/S72) Ácidos e Bases. Prof. Dr. Eduard Westphal (http://paginapessoal.utfpr.edu.br/eduardw) Capítulo 11 Atkins (5ed.
 QB70C:// Química (Turmas S71/S72) Ácidos e Bases Prof. Dr. Eduard Westphal (http://paginapessoal.utfpr.edu.br/eduardw) Capítulo 11 Atkins (5ed.) Pai, o que é chuva ácida? NaO idróxido de magnésio Mg(O)
QB70C:// Química (Turmas S71/S72) Ácidos e Bases Prof. Dr. Eduard Westphal (http://paginapessoal.utfpr.edu.br/eduardw) Capítulo 11 Atkins (5ed.) Pai, o que é chuva ácida? NaO idróxido de magnésio Mg(O)
