ESCOLA ESTADUAL TÉCNICA SÃO JOÃO BATISTA TÉCNICO EM QUÍMICA
|
|
|
- Carmem Marques Neiva
- 7 Há anos
- Visualizações:
Transcrição
1 ESCOLA ESTADUAL TÉCNICA SÃO JOÃO BATISTA TÉCNICO EM QUÍMICA PRÁTICAS DE QUÍMICA ORGÂNICA APLICADA Montenegro, 2010
2 1.POLARIDADE DENSIDADE SOLUBILIDADE -Em um tubo de ensaio com tampa, colocar os seguintes reagentes na ordem abaixo: 1.º ) 5mL de tetracloreto de carbono 2.º ) 5mL de solução aquosa de Sulfato de Cobre 5% 3.º ) 5mL de tolueno 4.º ) 1 grão de iodo -Observar e registrar sistema obtido através de desenho. -Aguardar 5 minutos, proceder a inversão do tubo e recolocá-lo na posição inicial. -Observar e registrar novamente o número de fases obtidas. Questões: a) Escreva as fórmulas das 5 substâncias envolvidas no experimento. b) Qual o número de fases no sistema antes da agitação? Justifique. c) Ocorreu alguma mudança de cor após a introdução do iodo no sistema? Justifique d) O que ocorreu após a inversão do tubo? Justifique
3 2.ALCANOS Material: - Tubos de ensaio - Tubo de desprendimento com ponta afilada; - Cápsula de porcelana. Reagentes: - Cal Sodada desidratada ( mistura sólida de 2 partes de NaOH e 1 parte de CaO) - Acetato de Sódio Anidro - KMnO 4 1% - Éter de petróleo - Na 2 CO 3 0,5% - H 2 SO 4 1: 3 - Raspas de vela 2.1 Obtenção e queima do metano - Usando gral e pistilo, misturar 3g de acetato de sódio com 2g de cal sodada; - Colocar a mistura sólida em um tubo de desprendimento com ponta afilada; - Aquecer o tubo diretamente no bico de bunsen (usar a capela); - Inflamar o gás que sai na ponta afilada. 2.2 Reatividade dos Alcanos a) Colocar em dois tubos de ensaio 2mL de éter de petróleo. Ao primeiro, adicionar 1mL de KMnO 4 e 1mL de Na 2 CO 3 Ao segundo adicionar 1mL de KMnO4 e 1mL de H2SO4 Agitar e anotar as observações em cada tubo b) Colocar 1 ml de éter de petróleo em uma cápsula de porcelana, inflamar (usar capela), observar aspecto e cor da chama; c) Repetir os testes anteriores com as raspas de vela Questões a) Equacionar e fundamentar as reações que ocorreram nos experimentos propostos; b) Caso não tenham ocorrido, justificar.
4 3.ALCENOS Material - Balão de destilação com saída lateral; - Pérolas de vidro ou cacos de porcelana; - Condensador de tubo reto; - Manta elétrica; - Termômetro; - Funil ou pêra de separação pequena; - Tubos de ensaio - Cápsula de porcelana Reagentes - ciclohexanol - H 2 SO 4 conc. - Na 2 CO 3 10% - KMnO 4 1% 3.1 Síntese do Ciclohexeno - ciclohexeno - Colocar em um balão de destilação, 25mL de ciclohexanol e adicionar lentamente (gota a gota), sob agitação constante, 3mL de H2SO4 conc. sob resfriamento (usar banho de gelo); - Colocar 3 a 4 pérolas de vidro ou cacos de porcelana no balão e fixá-lo na manta elétrica; - Fixar o termômetro com rolha, de modo que o bulbo fique na altura da saída do balão - Conectar a saída lateral do balão ao condensador e colocar uma proveta na extremidade para recolher o destilado; - Aquecer o conteúdo do balão até que os vapores atinjam a temperatura de 95ºC, estágio em que se incia o desprendimento de vapores brancos; - Transferir o destilado para o funil de separação; - Adicionar 10mL de água deionizada e agitar brandamente. Desprezar a camada inferior. - Adicionar 18mL de Na 2 CO 3, agitar e desprezar a camada inferior; - Passar o destilado para outro balão de destilação e destilar novamente; - Recolher o produto que destila entre 80ºC e 85ºC. - Fazer os testes de reconhecimento e os cálculos de rendimento percentual (será necessário usar a densidade do ciclohexanol e do ciclohexeno). 3.2 Propriedades Químicas dos Alcenos a) Colocar em um tubo de ensaio 10 gotas de ciclohexeno; Adicionar 10 gotas de KMnO 4 e observar b) Colocar em uma cápsula de porcelana 10 gotas de ciclohexeno; Inflamar o hidrocarboneto e observar aspecto e cor da chama (realizar o ensaio na capela); a) Equacionar as reações realizadas nos experimentos e fundamentar as observações; b) Comparar as propriedades químicas (oxidação e combustibilidade entre alcanos e alcenos.
5 4. ALCINOS Material - Tubos de ensaio - Tubo de desprendimento com ponta afilada; Reagentes - Carbureto da cálcio - KMnO 4 1% - Na 2 CO 3 0,5% 4.1 Obtenção e Queima do Acetileno - Colocar cerca de 4g de carbureto em um tubo de ensaio seco; - Levar o tubo até a capela. De forma rápida acrescentar aproximadamente 3mL de água e imediatamente colocar a rolha com o tubo de desprendimento; - Inflamar o gás liberado e observar aspecto e cor da chama. 4.2 Propriedades químicas dos alcinos - Reperir o experimento anterior sem promover a ignição do gás; - Borbulhar o gás em outro tubo contendo 2mL de KMnO 4 e 1mL de Na 2 CO 3. Questão Equacionar e fundamentar as reações químicas envolvidas nos experimentos
6 5. ÁLCOOIS Material - Tubos de ensaio e estante - Pinça metálica pequena - Cronômetro Reagentes - metanol, etanol, n-propanol, isopropanol, n-butanol e glicerina - Ácido acético p.a. - Ácido sulfúrico p.a. - Ácido Salicílico - K 2 Cr 2 O 7 0,5% - Gelo 5.1 Esterificação a) Numerar 3 tubos de ensaio e adicionar: Tubo 1: 3mL etanol Tubo 2: 3mL n-propanol ou isopropanol Tubo 3: 3mL n-butanol Adicionar em cada tubo 3mL de ácido acético e 0,5mL de ácido sulfúrico; Aquecer a mistura em banho-maria até a ebulição (cuidado com os álcoois voláteis) Verter cada tubo sobre 20mL de água gelada (usar bequer de 50 ou 100mL); Identificar o aroma de cada produto, comparando-o com o aroma de flores, frutas, produtos medicinais, etc. b) Colocar, em um tubo de ensaio, 3mL de metanol; Adicionar 0,5g de ácido salicílico e 1mL de ácido sulfúrico; Verter o conteúdo sobre 20mL de água gelada e identificar o aroma do produto. 5.2 Oxidação - Colocar em um tubo de ensaio 3mL de K 2 Cr 2 O 7 0,5%; - Adicionar 4 gotas de ácido sulfúrico concentrado e 3mL de etanol; - Aquecer a mistura em banho-maria e verter sobre 20mL de água gelada; - Anotar as mudanças de coloração e o aroma. Questões: Equacionar as reações químicas ocorridas nos experimentos, o nome dos produtos formados e pesquisar na bibliografia os fundamentos necessários:
7 6. AROMÁTICOS Materiais - Tubos de ensaio - Tubos de desprendimento com ponta afilada - Tubos de ensaio com tampa Reagentes - Ácido Benzóico p.a. - Tolueno - Óxido de Cálcio - Xilol - Álcool etílico - Ciclohexano - H 2 SO 4 conc - KMnO 4 0,5% - Gelo - Na 2 CO 3 0,5% - Benzeno - H 2 SO 4 1: Obtenção do Benzeno - Colocar em um tubo de ensaio, uma ponta de espátula de ácido benzóico; - Adicionar duas pontas de espátula de óxido de cálcio; - Adaptar um tubo de desprendimento com ponta afilada e aquecer o tubo no bico de bunsen (realizar esse 6.2 Esterificação - Colocar, em um tubo de ensaio, cerca de 30mg de ácido benzóico; - Adicionar 2mL de álcool etílico e 2mL de H 2 SO 4 conc; - Agitar e colocar em banho-maria por 3 minutos; - Verter o produto sobre 20mL de água gelada; - Identificar o odor característico. 6.3 Oxidação a) Numerar 4 tubos de ensaio com tampa rosqueada e colocar 1mL dos seguintes solventes: Tubo 1: Benzeno Tubo 2: Tolueno Tubo 3: Xilol Tubo 4: Ciclohexano - Acrescentar a cada tubo, 1mL de KMnO 4 0,5% e 1mL Na 2 CO 3 0,5% - Observar e anotar b) Repetir o experimento substituindo o carbonato de sódio pelo H 2 SO 4 1: 3 Caso não ocorra oxidação em algum dos tubos, colocá-lo em banho-maria por 3 minutos. Questões: - Houve diferença (resistência) na oxidação dos solventes frente ao permanganato? Justifique. - Equacione as reações de oxidação ocorridas e dê o nome dos produtos formados.
8 7.SÍNTESE E PURIFICAÇÀO DO AAS - Pesar 3g de ácido salicílico seco em bequer e adicionar 5mL de anidrido acético; - Adicionar 5 gotas de H 2 SO 4 concentrado (ou ácido fosfórico 85%). - Agitar a mistura para assegurar mistura completa. - Aquecer a reação em banho-maria (por volta de 50 a 60ºC), mantendo agitação durente 15 minutos; - Deixar a mistura esfriar naturalmente; - Adicionar 50mL de água gelada e esperar a formação dos cristais; - Filtrar a vácuo, usando funil de büchner com disco de papel de filtro comum; - Secar em estufa a 50ºC e guardar para a aula seguinte. Purificação: - Transferir o sólido obtido para um bequer e adicionar de 5 a 10mL de etanol; - Aquecer a mistura em banho-maria (50 a 60ºC) até completa dissolução; - Após esfriar, adicionar água lentamente (até começar a turvar) e deixar o sistema em repouso durante alguns minutos. Se a formação dos cristais não ocorrer, resfriar com um banho de gelo (5 a 10ºC). - Filtrar a vácuo, usando funil de büchner com disco de papel de filtro comum; - Secar em estufa e pesar o sólido obtido. Questões: a) Equacionar a reação de síntese do AAS e calcular o rendimento % alcançado; b) Se possível, determinar o ponto de fusão do produto e comparar com tabelado; c) Testar a ausência de ácido salicílico residual colocando alguns mg do material em um tubo de ensaio contendo solução alcoólica de FeCl3 (positivo = cor violeta)
9 8.Determinação da Porcentagem de Óleo em Amostras (Soxhlet) Aparelhagem: - 1 balão de 250mL com boca esmerilhada, 1 extrator soxhlet e 1 condensador para extrator. Técnica: - moer a amostra até granulometria de aproximadamente 1mm (moinho ou gral) - pesar 10g e colocar num cartucho de papel e vedado no fundo com algodão. - Adaptar o extrator soxhlet ao balão previamente tarado, montando o conjunto sobre a manta de aquecimento e fixando-os à haste metálica. - Colocar um volume de solvente (hexano ou éter de petróleo) no extrator, o suficiente para alcançar o refluxo (sifão lateral). - Colocar o cartucho no intermediário, adaptar o condensador na parte superior do extrator e manter em refluxo (aquecimento) por cinco horas. - Retire o extrator antes do refluxo e evapore o resto do solvente que ficou no balão (utilizar aquecimento leve para não carbonizar o óleo) - Coloque o balão na estufa a 105ºC por duas horas, esfriar em dessecador e pesar.
10 9.Determinação do Índice de Iodo: (massa de iodo consumido por 100g de amostra) Método de Hubl Material: - vidro relógio de 5cm de diâmetro; - dois frascos de 300mL com rolha esmerilhada; - proveta de 100mL; - proveta de 10mL; - Bureta de 25mL. Reagentes: - Clorofórmio p.a. - Solução de KI 15% (recente); - Solução de tiossulfato de sódio 0,1N - Solução de amido 0,5% - Solução de Hulb Solução A: solução alcoólica de iodo 5% (usar álcool etílico 95ºGL) Solução B: solução alcoólica de cloreto de mercúrio II a 6% (álcool 96ºGL) Misture volumes iguais das duas soluções 12 horas antes de usar. Filtre se necessário. Obs.: esta solução não deve ser usada após 24 horas de preparação. Técnica: - Pese 0,25g da amostra em um vidro relógio e transfira com o auxílio de 10mL de clorofórmio para um frasco de 300mL com rolha esmerilhada. - Adicione com uma bureta 25mL de solução iodo (Hubl) - Deixe em repouso durante 2 horas, ao abrigo da luz, agitando ocasionalmente. - Adicione 10mL de solução recente de KI a 15% e 100mL de H2O. - Titule o excesso de iodo com solução de tiossulfato de sódio 0,1N. Quando o titulado estiver amarelo claro, adicione 1mL de solução de amido a 0,5% como indicador. - Continuar a titulação até o desaparecimento da cor azul. Prova em Branco: - Adicione 10mL de CHCl3 em um frasco de 300mL com rolha esmerilhada e 25mL de solução de Hubl. - Deixe em repouso ao abrigo da luz durante 2 horas
11 - Adicione 10mL de solução recente de KI a 15% e 100mL de H2O. - Titule o conteúdo do frasco com tiossulfato de sódio 0,1N, usando solução de amido como indicador, até o desaparecimento da cor azul. Interpretação Química O Índice de Iodo indica o grau de insaturação do óleo ou gordura, pois o iodo se adiciona às duplas. Quanto maior o grau de insaturação, maior a quantidade de iodo adicionada e maior o índice de iodo. Cálculos: A diferença entre os números de ml de solução de tiossulfato de sódio gastos nas duas titulações é equivalente à quantidade de iodo adicionado ao óleo. 1mL de Na2S2O3 1N = 1mEqg Iodo
12 Rancificação: os glicerídeos quando expostos ao ar, por ação de microorganismos sofrem diversas reações complexas envolvendo hidrólise, oxidação (nas ligas duplas) e, às vezes,fermentação. Destas reações são liberados ácidos, aldeídos, cetonas e peróxidos. A decomposição dos glicerídeos pela ação da lipase é acelerada por aquecimento, luz e a rancidez é quase sempre acompanhada pela formação de ácido graxo livre. Para se avaliar o estado de conservação de um glicerídeo faze-se o uso do Índice de Acidez (IA). 10.Determinação do Índice de Acidez (IA) Índice de Acidez é o n.º de miligramas de KOH necessário para neutralizar os ácidos gordurosos livres (AGL) contidos em 1g de amostra. Material: - erlenmeyer de 125mL - Bureta de 25mL - Pipeta de 25mL Reagentes: - Solução de éter etílico-álcool etílico 95ºGL neutralizado (2:1) - Solução alcoólica de fenolftaleína 1% (álcool etílico neutralizado). - Solução padrão de NaOH 0,1N Técnica: - Pesar 2g de amostra em um erlenmeyer de 125mL
13 - Adicionar 25mL de éter etílico - álcool etílico (2:1) e 2 gotas de fenolftaleína Cálculos: a.) Índice de Aridez O índice de Acidez (IA) será expresso em mg de KOHpor Ig de amostra 1A = V. f. 5,61 P b) Solução Normal: c o n. de 111L de solução de NaOH ou KOH normal necessário para neutralizar os ácidos gordurosos livres (AGL) contidos em loog de amostra. V. f. 10 P A acidez em solução normal será expressa em ml de solução de NaOH normal por loogda amostra. c) Em Ácido Oleico: é o n. em gramas de AGL, expresso em ácido oleico, existente em loog de amostra g ácido oleico = V. f ,0282 loog amostra P A acidez em ácido oleico será expressa em gramas de ácido oleico ( G7H33COOH ) por loog de amostra. V = volume de NaOH 0, IN gasto tia titulação f = fator da solução de NaOH (),1N P = massa da amostra em gramas - Agitar até completa dissolução da amostra - Titular com solução padrão de NaOH 0,1 N até coloração rósea persistente. Óleos gordurosos contém: Ésteres - Ácidos livres Material insaponificável ( umidade, impurezas, voláteis ) Ao adicionar NaOH diluído ao óleo ou gordura, este reage com os ácidos graxos livres.
14 Saponificação: os glicerídeos, em presença de bases fortes concentradas, produzem glicerina e sais de ácidos graxos (sabões). Somente são solúveis os sabões de metais alcalinos e NH 4 +. Os demais são insolúveis e não produzem espuma. Sabões de sódio são duros e de potássio são moles. Quando provenientes de ácidos graxos insaturados, são mais moles que os de ácidos graxos saturados. Os sabões são usados como detergentes, inibidores de corrosão, lubrificantes e emulsionantes. Para se determinar a quantidade de base forte para fabricar sabão faz-se uso do Índice de Saponificação (IS). 11.Determinação do Índice de Saponificação Índice de Saponificação é o n.º de mg de KOH necessários para saponificar 1g de amostra. É inversamente proporcional ao peso molecular dos ácidos graxos dos glicerídeos presentes. Material: - balão fundo chato de 250mL ou erlenmeyer de 250mL com boca esmerilhada - pipeta volumétrica de 25mL - condensador de refluxo com rolha esmerilhada - manta elétrica de aquecimento Reagentes: - Solução alcoólica de KOH 1N (usar álcool etílico 95ºGL) - Solução padrão de HCl 0,5N - Solução de fenolftaleína 1%
15 Técnica: - medir massa exata de amostra entre 2,0 a 2,5g em erlenmeyer ou balão de fundo chato de 250mL. - Acrescentar exatos 25mL de solução de KOH 1N - Adaptar um condensador de refluxo e ferver em manta elétrica durante 30 minutos. - Retirar do refluxo, adicionar 0,5mL de fenolftaleína e titular a quente com solução padrão de HCl 0,5N até o desaparecimento da coloração rósea. (Volume B) - Fazer Prova em Branco em paralelo. (Volume A) Cálculos: A diferença entre os números de tnl gastos nas duas titulações é equivalente à quantidade de KOH gasto na saponificação da amostra. A = ml de HCl gasto na PB B = ml de HCl gasto na amostra f = fator do HCl 0,5N IS = V. f. 28,5 P = massa da amostra em gramas P V = A - B Obs.: na determinação do IA usa-se base diluída, a qual reage com os ácidos livres. Na determinação do IS usa-se base concentrada sob aquecimento. a qual reage com os ácidos livres e com os ésteres (óleos). Destas duas análises, pode-se deduzir o índice de Ester (IE): I E = IS - IA
QUÍMICA FARMACÊUTICA
 INSTITUTO DE CIÊNCIAS DA SAÚDE CURSO DE FARMÁCIA ROTEIRO PARA S PRÁTICAS DISCIPLINA: QUÍMICA FARMACÊUTICA Título da Aula: Determinação do coeficiente de partição óleo-água (P) do ácido benzóico 1 Demonstrar
INSTITUTO DE CIÊNCIAS DA SAÚDE CURSO DE FARMÁCIA ROTEIRO PARA S PRÁTICAS DISCIPLINA: QUÍMICA FARMACÊUTICA Título da Aula: Determinação do coeficiente de partição óleo-água (P) do ácido benzóico 1 Demonstrar
Controle de Qualidade de Óleos e Gorduras Vegetais
 Universidade Federal de Pelotas Departamento de Ciência e Tecnologia Agroindustrial Tecnologia de óleos vegetais e biocombustíveis Controle de Qualidade de Óleos e Gorduras Vegetais Profa Giniani Dors
Universidade Federal de Pelotas Departamento de Ciência e Tecnologia Agroindustrial Tecnologia de óleos vegetais e biocombustíveis Controle de Qualidade de Óleos e Gorduras Vegetais Profa Giniani Dors
XXVI - CERA DE ABELHA
 XXVI - CERA DE ABELHA 1. CARACTERÍSTICAS E PREPARO DA AMOSTRA Comercialmente a cera de abelha poderá ser encontrada como bruta, prébeneficiada e beneficiada. A amostra deve ser representativa do lote,
XXVI - CERA DE ABELHA 1. CARACTERÍSTICAS E PREPARO DA AMOSTRA Comercialmente a cera de abelha poderá ser encontrada como bruta, prébeneficiada e beneficiada. A amostra deve ser representativa do lote,
SUBSTÂNCIAS E MISTURAS
 Universidade de São Paulo Instituto de Química de São Carlos Departamento de Físico-Química SUBSTÂNCIAS E MISTURAS Prof. Dr. Edson Antonio Ticianelli edsont@iqsc.usp.br Monitor: Dr. Wanderson Oliveira
Universidade de São Paulo Instituto de Química de São Carlos Departamento de Físico-Química SUBSTÂNCIAS E MISTURAS Prof. Dr. Edson Antonio Ticianelli edsont@iqsc.usp.br Monitor: Dr. Wanderson Oliveira
CURSO PRÁTICO QUI 328 e 128 SÍNTESE DE COMPOSTOS ORGÂNICOS
 CURSO PRÁTICO QUI 328 e 128 SÍNTESE DE COMPOSTOS ORGÂNICOS Síntese I ( p-red) Nitrobenzeno Anilina Acetanilida p-nitro Acetanilida p-nitro Anilina p-red 1- OBTENÇÃO DA ANILINA -Estanho -Àcido clorídrico
CURSO PRÁTICO QUI 328 e 128 SÍNTESE DE COMPOSTOS ORGÂNICOS Síntese I ( p-red) Nitrobenzeno Anilina Acetanilida p-nitro Acetanilida p-nitro Anilina p-red 1- OBTENÇÃO DA ANILINA -Estanho -Àcido clorídrico
CURSO PRÁTICO QUI 328 e 128 SÍNTESE DE COMPOSTOS ORGÂNICOS. Síntese II (Alaranjado II) Benzeno Nitrobenzeno Anilina Ácido Sulfanilico Alaranjado II
 CURSO PRÁTICO QUI 328 e 128 SÍNTESE DE COMPOSTOS ORGÂNICOS Síntese II (Alaranjado II) Benzeno Nitrobenzeno Anilina Ácido Sulfanilico Alaranjado II 1- OBTENÇÃO DO NITROBENZENO Reagentes: -Ácido nítrico
CURSO PRÁTICO QUI 328 e 128 SÍNTESE DE COMPOSTOS ORGÂNICOS Síntese II (Alaranjado II) Benzeno Nitrobenzeno Anilina Ácido Sulfanilico Alaranjado II 1- OBTENÇÃO DO NITROBENZENO Reagentes: -Ácido nítrico
AULA PRÁTICA N 15: DETERMINAÇÃO DE PERÓXIDO DE HIDROGÊNIO NA ÁGUA OXIGENADA Volumetria de oxirredução permanganimetria volumetria direta
 3 AULA PRÁTICA N 15: DETERMINAÇÃO DE PERÓXIDO DE HIDROGÊNIO NA ÁGUA OXIGENADA Volumetria de oxirredução permanganimetria volumetria direta REAGENTES: Solução de permanganato de potássio 0,02 mol L -1,
3 AULA PRÁTICA N 15: DETERMINAÇÃO DE PERÓXIDO DE HIDROGÊNIO NA ÁGUA OXIGENADA Volumetria de oxirredução permanganimetria volumetria direta REAGENTES: Solução de permanganato de potássio 0,02 mol L -1,
RESINA FENÓLICA PARA FUNDIÇÃO - DETERMINAÇÃO DO TEOR DE FENOL LIVRE
 SUMÁRIO Método de Ensaio Folha : 1 de 5 1_ Objetivo 2_ Princípio do método 3_ Definição 4_ Aparelhagem / reagentes 5_ Execução do ensaio 6_ Resultados 7_ Anexo A 1_ OBJETIVO 1.1_ Esta recomendação prescreve
SUMÁRIO Método de Ensaio Folha : 1 de 5 1_ Objetivo 2_ Princípio do método 3_ Definição 4_ Aparelhagem / reagentes 5_ Execução do ensaio 6_ Resultados 7_ Anexo A 1_ OBJETIVO 1.1_ Esta recomendação prescreve
1 Extração Líquido-Líquido
 Ministério da Educação Universidade Tecnológica Federal do Paraná Campus de Curitiba Departamento de Química _ Extração Líquido-Líquido Disciplina: Práticas de Química Orgânica Materiais e Reagentes Mesa
Ministério da Educação Universidade Tecnológica Federal do Paraná Campus de Curitiba Departamento de Química _ Extração Líquido-Líquido Disciplina: Práticas de Química Orgânica Materiais e Reagentes Mesa
MATERIAIS BÁSICOS DO LABORATÓRIO DE QUÍMICA. Tópicos de Química Experimental. Débora Alvim/ Willian Miguel
 MATERIAIS BÁSICOS DO LABORATÓRIO DE QUÍMICA Tópicos de Química Experimental Débora Alvim/ Willian Miguel BÉQUER OU BECHER É de uso geral em laboratório: Serve para fazer reações entre soluções Dissolver
MATERIAIS BÁSICOS DO LABORATÓRIO DE QUÍMICA Tópicos de Química Experimental Débora Alvim/ Willian Miguel BÉQUER OU BECHER É de uso geral em laboratório: Serve para fazer reações entre soluções Dissolver
MATERIAIS PARA FUNDIÇÃO - DETERMINAÇÃO DO ÓXIDO DE FERRO
 Folha : 1 de 5 SUMÁRIO 1_ Objetivo 2_ Princípio do método 3_ Definição 4_ Aparelhagem / reagentes 5_ Execução do ensaio 6_ Padronização da solução de dicromato de potássio 0,05 N 7_ Resultados 1_ OBJETIVO
Folha : 1 de 5 SUMÁRIO 1_ Objetivo 2_ Princípio do método 3_ Definição 4_ Aparelhagem / reagentes 5_ Execução do ensaio 6_ Padronização da solução de dicromato de potássio 0,05 N 7_ Resultados 1_ OBJETIVO
AULA PRÁTICA GRADUAÇÃO CARACTERIZAÇÃO E QUALIDADE DE ÓLEOS E GORDURAS. Material insaponificável Método Ca 6b-53 (AOCS, 2003)
 LAN 0155 Óleos, gorduras, grãos e derivados - Caracterização e qualidade de óleos e gorduras p.1 AULA PRÁTICA GRADUAÇÃO CARACTERIZAÇÃO E QUALIDADE DE ÓLEOS E GORDURAS Material insaponificável Método Ca
LAN 0155 Óleos, gorduras, grãos e derivados - Caracterização e qualidade de óleos e gorduras p.1 AULA PRÁTICA GRADUAÇÃO CARACTERIZAÇÃO E QUALIDADE DE ÓLEOS E GORDURAS Material insaponificável Método Ca
RESINA FENÓLICA PARA FUNDIÇÃO DETERMINAÇÃO DE NITROGÊNIO TOTAL DA RESINA E DO CATALISADOR
 Método de Ensaio Folha : 1 de 6 SUMÁRIO 1_ Objetivo 2_ Princípio do método 3_ Definição 4_ Aparelhagem / reagentes 5_ Execução do ensaio 6_ Resultados 7_ Anexos A e B 1_ OBJETIVO 1.1_ Esta recomendação
Método de Ensaio Folha : 1 de 6 SUMÁRIO 1_ Objetivo 2_ Princípio do método 3_ Definição 4_ Aparelhagem / reagentes 5_ Execução do ensaio 6_ Resultados 7_ Anexos A e B 1_ OBJETIVO 1.1_ Esta recomendação
EXPERIÊNCIA 04 EXTRAÇÃO COM SOLVENTES REATIVOS
 EXPERIÊNCIA 04 EXTRAÇÃO COM SOLVENTES REATIVOS 1 - INTRODUÇÃO O processo de extração com solventes é um método simples, empregado na separação e isolamento de substâncias componentes de uma mistura, ou
EXPERIÊNCIA 04 EXTRAÇÃO COM SOLVENTES REATIVOS 1 - INTRODUÇÃO O processo de extração com solventes é um método simples, empregado na separação e isolamento de substâncias componentes de uma mistura, ou
Antraquinonas livres. Ligação C-O
 Instituto de Ciências da Saúde CURSO: FARMÁCIA DISCIPLINA: FARMACOGNOSIA APLICADA TITULO DA AULA: IDENTIFICAÇÃO QUÍMICA DE ANTRAQUINONAS AULA 1 OBJETIVO: Identificar a presença de compostos antraquinônicos
Instituto de Ciências da Saúde CURSO: FARMÁCIA DISCIPLINA: FARMACOGNOSIA APLICADA TITULO DA AULA: IDENTIFICAÇÃO QUÍMICA DE ANTRAQUINONAS AULA 1 OBJETIVO: Identificar a presença de compostos antraquinônicos
APÊNDICE A - Calibração do Forno de Redução
 APÊNDICE A - Calibração do Forno de Redução A calibração do forno de redução Combustol para o conhecimento da temperatura real em seu centro, foi realizada com base num indicador digital de temperatura,
APÊNDICE A - Calibração do Forno de Redução A calibração do forno de redução Combustol para o conhecimento da temperatura real em seu centro, foi realizada com base num indicador digital de temperatura,
APARELHAGEM DE LABORATÓRIO 1. BICO DE BÜNSEN
 APARELHAGEM DE LABORATÓRIO 1. BICO DE BÜNSEN Aparelho ligado ao gás, utilizado para aquecimento de materiais não inflamáveis. Possui em sua base um regulador de entrada de ar para controlar o tipo de chama:
APARELHAGEM DE LABORATÓRIO 1. BICO DE BÜNSEN Aparelho ligado ao gás, utilizado para aquecimento de materiais não inflamáveis. Possui em sua base um regulador de entrada de ar para controlar o tipo de chama:
Preparação do cloreto de t-butila. Carina de Freitas Vellosa Daiane Cristina Romanini
 Preparação do cloreto de t-butila Carina de Freitas Vellosa Daiane Cristina Romanini Técnicas e Materiais Utilizados Funil de separação: serve para extrair duas soluções imiscíveis. A fase orgânica pode
Preparação do cloreto de t-butila Carina de Freitas Vellosa Daiane Cristina Romanini Técnicas e Materiais Utilizados Funil de separação: serve para extrair duas soluções imiscíveis. A fase orgânica pode
REALIZAÇÃO EXPERIMENTAL - MICROESCALA (adaptada de Pike et al, Microscale Inorganic Chemistry, exp.16, p )
 REALIZAÇÃO EXPERIMENTAL - MICROESCALA (adaptada de Pike et al, Microscale Inorganic Chemistry, exp.16, p204-207) PARTE B: PREPARAÇÃO QUANTITATIVA DO TETRATIONATO DE SÓDIO A MICROESCALA Reagentes Tiossulfato
REALIZAÇÃO EXPERIMENTAL - MICROESCALA (adaptada de Pike et al, Microscale Inorganic Chemistry, exp.16, p204-207) PARTE B: PREPARAÇÃO QUANTITATIVA DO TETRATIONATO DE SÓDIO A MICROESCALA Reagentes Tiossulfato
MT DEPARTAMENTO NACIONAL DE ESTRADAS DE RODAGEM
 Método de Ensaio Página 1 de 6 RESUMO Este documento, que é uma norma técnica, fixa o procedimento a ser usado na determinação do de material termoplástico para demarcação viária. Prescreve a aparelhagem,
Método de Ensaio Página 1 de 6 RESUMO Este documento, que é uma norma técnica, fixa o procedimento a ser usado na determinação do de material termoplástico para demarcação viária. Prescreve a aparelhagem,
Universidade Federal de Sergipe Departamento de Química Química Analítica Experimental Prof. Marcelo da Rosa Alexandre Alunos:
 Alunos: DETERMINAÇÃO DA ACIDEZ TOTAL EM BEBIDAS 1. Padronizar a solução de NaOH 0,1 mol.l -1 com biftalato de potássio (P.M. KHC8H4O4 = 204). Lembre-se de calcular a massa de biftalato de potássio para
Alunos: DETERMINAÇÃO DA ACIDEZ TOTAL EM BEBIDAS 1. Padronizar a solução de NaOH 0,1 mol.l -1 com biftalato de potássio (P.M. KHC8H4O4 = 204). Lembre-se de calcular a massa de biftalato de potássio para
SÍNTESE DO 1-BROMOBUTANO Procedimento experimental a macroescala (adaptado de Williamson, Minard & Masters 1 )
 SÍNTESE DO 1-BROMOBUTANO Procedimento experimental a macroescala (adaptado de Williamson, Minard & Masters 1 ) Introdução O 1-bromobutano é um halogeneto alquílico primário (alquilo primário) e, por isso,
SÍNTESE DO 1-BROMOBUTANO Procedimento experimental a macroescala (adaptado de Williamson, Minard & Masters 1 ) Introdução O 1-bromobutano é um halogeneto alquílico primário (alquilo primário) e, por isso,
SÍNTESE DO 1-BROMOBUTANO Procedimento experimental a microescala (adaptado de Williamson, Minard & Masters 1 )
 SÍNTESE DO 1-BROMOBUTANO Procedimento experimental a microescala (adaptado de Williamson, Minard & Masters 1 ) Introdução O 1-bromobutano é um halogeneto alquílico primário (alquilo primário) e, por isso,
SÍNTESE DO 1-BROMOBUTANO Procedimento experimental a microescala (adaptado de Williamson, Minard & Masters 1 ) Introdução O 1-bromobutano é um halogeneto alquílico primário (alquilo primário) e, por isso,
3016 Oxidação do ácido ricinoléico a ácido azeláico (a partir de óleo de rícino) com KMnO 4
 6 Oxidação do ácido ricinoléico a ácido azeláico (a partir de óleo de rícino) com KMnO 4 CH -(CH ) OH (CH ) -COOH KMnO 4 /KOH HOOC-(CH ) -COOH C H 4 O (.) KMnO 4 KOH (.) (6.) C H 6 O 4 (.) Classificação
6 Oxidação do ácido ricinoléico a ácido azeláico (a partir de óleo de rícino) com KMnO 4 CH -(CH ) OH (CH ) -COOH KMnO 4 /KOH HOOC-(CH ) -COOH C H 4 O (.) KMnO 4 KOH (.) (6.) C H 6 O 4 (.) Classificação
MATERIAIS PARA FUNDIÇÃO - DETERMINAÇÃO DO FATOR DA SOLUÇÃO DE AZUL DE METILENO POR TITULAÇÃO COM SOLUÇÃO DE CLORETO TITANOSO (TiCl 3 )
 Padronização Folha : 1 de 6 SUMÁRIO 1_ Objetivo 2_ Princípio do método 3_ Aparelhagem 4_ Procedimento 1_ OBJETIVO 1.1_ Esta recomendação prescreve o método de fatoração da solução de azul de metileno utilizada
Padronização Folha : 1 de 6 SUMÁRIO 1_ Objetivo 2_ Princípio do método 3_ Aparelhagem 4_ Procedimento 1_ OBJETIVO 1.1_ Esta recomendação prescreve o método de fatoração da solução de azul de metileno utilizada
Prática 02. Síntese do Cloreto de tert-butila. HCl
 Prática 02 Síntese do Cloreto de tert-butila CH3OH HCl CH3Cl Objetivos Didáticos: 1) Desenvolver os conceitos de reações de substituição nucleofílica. 2) Discutir o mecanismo, mostrando a diferença entre
Prática 02 Síntese do Cloreto de tert-butila CH3OH HCl CH3Cl Objetivos Didáticos: 1) Desenvolver os conceitos de reações de substituição nucleofílica. 2) Discutir o mecanismo, mostrando a diferença entre
EXTRAÇÃO COM SOLVENTES (transp. 1)
 EXTRAÇÃO COM SOLVENTES (transp. 1) Usado para separar e isolar determinadas substâncias encontradas em misturas complexas. As substâncias em geral são solúveis em água. Ao se adicionar um solvente não
EXTRAÇÃO COM SOLVENTES (transp. 1) Usado para separar e isolar determinadas substâncias encontradas em misturas complexas. As substâncias em geral são solúveis em água. Ao se adicionar um solvente não
A. Recuperação de n-hexano e de diclorometano a partir de resíduo constituído de mistura de n-hexano e diclorometano
 A. Recuperação de n-hexano e de diclorometano a partir de resíduo constituído de mistura de n-hexano e diclorometano Objetivo: Recuperar diclorometano e n-hexano de misturas de n-hexano/diclorometano.
A. Recuperação de n-hexano e de diclorometano a partir de resíduo constituído de mistura de n-hexano e diclorometano Objetivo: Recuperar diclorometano e n-hexano de misturas de n-hexano/diclorometano.
AULA PRÁTICA Nº / Abril / 2016 Profª Solange Brazaca DETERMINAÇÃO DE NITROGÊNIO
 AULA PRÁTICA Nº - 07 28 / Abril / 2016 Profª Solange Brazaca DETERMINAÇÃO DE NITROGÊNIO FUNDAMENTO: A determinação do nitrogênio total (NT) proposta por Kjeldahl em 1883, ainda é muito usada por ser uma
AULA PRÁTICA Nº - 07 28 / Abril / 2016 Profª Solange Brazaca DETERMINAÇÃO DE NITROGÊNIO FUNDAMENTO: A determinação do nitrogênio total (NT) proposta por Kjeldahl em 1883, ainda é muito usada por ser uma
PRÁTICA N o. 01 SOLUBILIDADE DE COMPOSTOS ORGÂNICOS
 PRÁTICA N o. 01 SOLUBILIDADE DE COMPOSTOS ORGÂNICOS OBJETIVOS: Esta prática tem como objetivo a determinação da solubilidade de compostos orgânicos através de um estudo sequencial com solventes situando
PRÁTICA N o. 01 SOLUBILIDADE DE COMPOSTOS ORGÂNICOS OBJETIVOS: Esta prática tem como objetivo a determinação da solubilidade de compostos orgânicos através de um estudo sequencial com solventes situando
Síntese do Biodiesel a partir de óleo vegetal Procedimento experimental (adaptado de 1 )
 Síntese do Biodiesel a partir de óleo vegetal Procedimento experimental (adaptado de 1 ) O biodiesel é atualmente um combustível em fase de desenvolvimento no nosso país, estando algumas fábricas já em
Síntese do Biodiesel a partir de óleo vegetal Procedimento experimental (adaptado de 1 ) O biodiesel é atualmente um combustível em fase de desenvolvimento no nosso país, estando algumas fábricas já em
Prof. Dr. José Eduardo de Oliveira Adriana Teixeira Machado Marcela Dias da Silva Matheus Gibbin Zanzini
 Prof. Dr. José Eduardo de Oliveira Adriana Teixeira Machado Marcela Dias da Silva Matheus Gibbin Zanzini Filtração Fonte de aquecimento Destilação Correção do ponto de ebulição OBJETIVO: Remover impurezas
Prof. Dr. José Eduardo de Oliveira Adriana Teixeira Machado Marcela Dias da Silva Matheus Gibbin Zanzini Filtração Fonte de aquecimento Destilação Correção do ponto de ebulição OBJETIVO: Remover impurezas
MATERIAL SUPLEMENTAR ANÁLISES FISICO-QUÍMICAS DO ÓLEO DE COCO. = índice de acidez
 MATERIAL SUPLEMENTAR ANÁLISES FISICO-QUÍMICAS DO ÓLEO DE COCO Índice de acidez Pesaram-se 2 g do óleo em um erlenmeyer de 125 ml. Em seguida, adicionaram-se 25 ml de uma mistura de éter-álcool etílico
MATERIAL SUPLEMENTAR ANÁLISES FISICO-QUÍMICAS DO ÓLEO DE COCO Índice de acidez Pesaram-se 2 g do óleo em um erlenmeyer de 125 ml. Em seguida, adicionaram-se 25 ml de uma mistura de éter-álcool etílico
EXPERIMENTO 3 SUBSTÂNCIAS E MISTURAS OBJETIVOS INTRODUÇÃO
 EXPERIMENTO 3 SUBSTÂNCIAS E MISTURAS OBJETIVOS Observar a diferença entre uma substância e uma mistura de substâncias; Aprender algumas formas de separação e purificação de misturas; Determinar a pureza
EXPERIMENTO 3 SUBSTÂNCIAS E MISTURAS OBJETIVOS Observar a diferença entre uma substância e uma mistura de substâncias; Aprender algumas formas de separação e purificação de misturas; Determinar a pureza
BC-1302 QUÍMICA DOS ELEMENTOS
 PRÁTICA 5: Oxigênio e Enxofre Objetivos Preparar o gás oxigênio, por método laboratorial e estudar algumas de suas propriedades. Estudar o enxofre nas suas variações alotrópicas e algumas de suas reações.
PRÁTICA 5: Oxigênio e Enxofre Objetivos Preparar o gás oxigênio, por método laboratorial e estudar algumas de suas propriedades. Estudar o enxofre nas suas variações alotrópicas e algumas de suas reações.
EXPERIMENTOS DE QUIMICA ORGANICA I(QUI 127, QUI 186 E QUI 214) EXPERIMENTO 7 TÉCNICAS DE EXTRAÇÃO
 EXPERIMENTO 7 TÉCNICAS DE EXTRAÇÃO 1.1. Fundamentação teórica A extração é um processo de separação de compostos que consiste em transferir uma substância da fase na qual essa se encontra (dissolvida ou
EXPERIMENTO 7 TÉCNICAS DE EXTRAÇÃO 1.1. Fundamentação teórica A extração é um processo de separação de compostos que consiste em transferir uma substância da fase na qual essa se encontra (dissolvida ou
Aula prática 1: Materiais de laboratório, exatidão e precisão. 1. Material de laboratório
 Aula prática 1: Materiais de laboratório, exatidão e precisão 1. Material de laboratório 1.1.Material de vidro o Tubo de ensaio utilizado para efetuar reações químicas em pequena escala. o Béquer recipiente
Aula prática 1: Materiais de laboratório, exatidão e precisão 1. Material de laboratório 1.1.Material de vidro o Tubo de ensaio utilizado para efetuar reações químicas em pequena escala. o Béquer recipiente
Controle de Qualidade de Óleos e Gorduras Vegetais
 Universidade Federal de Pelotas Departamento de Ciência e Tecnologia Agroindustrial Tecnologia de óleos vegetais e biocombustíveis Controle de Qualidade de Óleos e Gorduras Vegetais Profa Giniani Dors
Universidade Federal de Pelotas Departamento de Ciência e Tecnologia Agroindustrial Tecnologia de óleos vegetais e biocombustíveis Controle de Qualidade de Óleos e Gorduras Vegetais Profa Giniani Dors
QUÍMICA INORGÂNICA EXPERIMENTAL I 2017 Experimento 6 Preparação e Propriedades de óxidos de Enxofre e formas alotrópicas de Enxofre
 1 QUÍMICA INORGÂNICA EXPERIMENTAL I 2017 Experimento 6 Preparação e Propriedades de óxidos de Enxofre e formas alotrópicas de Enxofre 1. Objetivos: Obter o dióxido de enxofre e estudar algumas de suas
1 QUÍMICA INORGÂNICA EXPERIMENTAL I 2017 Experimento 6 Preparação e Propriedades de óxidos de Enxofre e formas alotrópicas de Enxofre 1. Objetivos: Obter o dióxido de enxofre e estudar algumas de suas
purificação de solventes
 purificação de solventes éter dietílico, tetraidrofurano, diclorometano, hexanos, etanol, acetona,acetato de etila e tolueno objetivos: grau de pureza adequado ao uso é diferente de recuperação de solventes
purificação de solventes éter dietílico, tetraidrofurano, diclorometano, hexanos, etanol, acetona,acetato de etila e tolueno objetivos: grau de pureza adequado ao uso é diferente de recuperação de solventes
1º trimestre Sala de Estudo Química Data: 26/02/18 Ensino Médio 2º ano classe: A_B Profª Danusa Nome: nº. Conteúdo: Vidrarias de laboratório
 1º trimestre Sala de Estudo Química Data: 26/02/18 Ensino Médio 2º ano classe: A_B Profª Danusa Nome: nº Conteúdo: Vidrarias de laboratório Legenda: 1 Tubos de ensaio: Usado em reações químicas, principalmente
1º trimestre Sala de Estudo Química Data: 26/02/18 Ensino Médio 2º ano classe: A_B Profª Danusa Nome: nº Conteúdo: Vidrarias de laboratório Legenda: 1 Tubos de ensaio: Usado em reações químicas, principalmente
AULA PRÁTICA Nº / Abril / 2016 Profª Solange Brazaca DETERMINAÇÃO DE LIPÍDEOS
 LABORATÓRIO DE ANÁLISE DE ALIMENTOS E NUTRIÇÃO AULA PRÁTICA Nº - 05 31 / Abril / 2016 Profª Solange Brazaca DETERMINAÇÃO DE LIPÍDEOS FUNDAMENTO: Os lipídios constituem uma classe grande de compostos que
LABORATÓRIO DE ANÁLISE DE ALIMENTOS E NUTRIÇÃO AULA PRÁTICA Nº - 05 31 / Abril / 2016 Profª Solange Brazaca DETERMINAÇÃO DE LIPÍDEOS FUNDAMENTO: Os lipídios constituem uma classe grande de compostos que
Química Orgânica Experimental I BAC CRITÉRIOS PARA CORREÇÃO DOS PRÉ-RELATÓRIOS E RELATÓRIOS
 Química Orgânica Experimental I BAC - 2009 CRITÉRIOS PARA CORREÇÃO DOS PRÉ-RELATÓRIOS E RELATÓRIOS Além do aqui solicitado para os Pré-Relatórios, devem ser apresentados os itens correspondentes a cada
Química Orgânica Experimental I BAC - 2009 CRITÉRIOS PARA CORREÇÃO DOS PRÉ-RELATÓRIOS E RELATÓRIOS Além do aqui solicitado para os Pré-Relatórios, devem ser apresentados os itens correspondentes a cada
EXPERIÊNCIA 4 SÍNTESE E PURIFICAÇÃO DO ÁCIDO ACETILSALICÍLICO (AAS)
 EXPERIÊNCIA 4 SÍNTESE E PURIFICAÇÃ D ÁCID ACETILSALICÍLIC (AAS) 1 - INTRDUÇÃ Ácido Acetilsalicílico (AAS), também conhecido como Aspirina, é um dos remédios mais populares mundialmente produzidas e consumidas
EXPERIÊNCIA 4 SÍNTESE E PURIFICAÇÃ D ÁCID ACETILSALICÍLIC (AAS) 1 - INTRDUÇÃ Ácido Acetilsalicílico (AAS), também conhecido como Aspirina, é um dos remédios mais populares mundialmente produzidas e consumidas
PREPARAÇÃO E PURIFICAÇÃO DO ACETATO DE ISOPENTILA. Daniela Gonçalves Dias Jeniffer Biin Huoy Lin Renato Oyadomari Abe
 PREPARAÇÃO E PURIFICAÇÃO DO ACETATO DE ISOPENTILA Daniela Gonçalves Dias Jeniffer Biin Huoy Lin Renato Oyadomari Abe Reação de Esterificação Os ácidos carboxílicos reagem com álcoois produzindo ésteres
PREPARAÇÃO E PURIFICAÇÃO DO ACETATO DE ISOPENTILA Daniela Gonçalves Dias Jeniffer Biin Huoy Lin Renato Oyadomari Abe Reação de Esterificação Os ácidos carboxílicos reagem com álcoois produzindo ésteres
EXPERIÊNCIA 05 PREPARAÇÃO DE UM AROMATIZANTE ARTIFICIAL: ACETATO DE ISOAMILA
 EXPERIÊNCIA 05 PREPARAÇÃO DE UM AROMATIZANTE ARTIFICIAL: ACETATO DE ISOAMILA 1- INTRODUÇÃO Ésteres são compostos amplamente distribuídos na natureza. Os ésteres simples tendem a ter um odor agradável,
EXPERIÊNCIA 05 PREPARAÇÃO DE UM AROMATIZANTE ARTIFICIAL: ACETATO DE ISOAMILA 1- INTRODUÇÃO Ésteres são compostos amplamente distribuídos na natureza. Os ésteres simples tendem a ter um odor agradável,
QUÍMICA GERAL EXPERIMENTAL CURSO Engenharia de Produção e Engenharia Ambiental PERÍODO: BIMESTRE Primeiro PROFESSOR Priscila de Freitas Siqueira
 DISCIPLINA QUÍMICA GERAL EXPERIMENTAL CURSO Engenharia de Produção e Engenharia Ambiental PERÍODO: BIMESTRE Primeiro PROFESSOR Priscila de Freitas Siqueira DATA 1 Instruções gerais para as aulas práticas
DISCIPLINA QUÍMICA GERAL EXPERIMENTAL CURSO Engenharia de Produção e Engenharia Ambiental PERÍODO: BIMESTRE Primeiro PROFESSOR Priscila de Freitas Siqueira DATA 1 Instruções gerais para as aulas práticas
Prática de Laboratório 1
 Prática de Laboratório 1 12 pontos Preparação do ácido 2-iodobenzóico [Tempo aprox: 1 hr] Essa prática de laboratório envolve a preparação do acido 2-iodobenzóico a partir do acido 2-aminobenzóico. O procedimento
Prática de Laboratório 1 12 pontos Preparação do ácido 2-iodobenzóico [Tempo aprox: 1 hr] Essa prática de laboratório envolve a preparação do acido 2-iodobenzóico a partir do acido 2-aminobenzóico. O procedimento
Complemento das Aulas 13 e 14: Os principais equipamentos presentes em um laboratório
 MATERIAL EXTRA 2 BIMESTRE ENSINO MÉDIO Prof.: Cotrim 1ª Série Data: 18/04/2017 Complemento das Aulas 13 e 14: Os principais equipamentos presentes em um laboratório A execução de experimentos, em um laboratório
MATERIAL EXTRA 2 BIMESTRE ENSINO MÉDIO Prof.: Cotrim 1ª Série Data: 18/04/2017 Complemento das Aulas 13 e 14: Os principais equipamentos presentes em um laboratório A execução de experimentos, em um laboratório
Parte II. Meneah Renata Talita
 Extração e Purificação do Limoneno Parte II Meneah Renata Talita Objetivo da prática Isolar e Purificar o Limoneno a partir de uma fase orgânica contendo n-hexano, limoneno, traços de substâncias voláteis
Extração e Purificação do Limoneno Parte II Meneah Renata Talita Objetivo da prática Isolar e Purificar o Limoneno a partir de uma fase orgânica contendo n-hexano, limoneno, traços de substâncias voláteis
SOLUBILIDADE DE SÓLIDOS EM LÍQUIDOS
 EXPERIMENTO 4 SOLUBILIDADE DE SÓLIDOS EM LÍQUIDOS OBJETIVOS Observar soluções insaturadas, saturadas e supersaturadas; Construir a curva de solubilidade de um sal inorgânico. INTRODUÇÃO Os depósitos naturais
EXPERIMENTO 4 SOLUBILIDADE DE SÓLIDOS EM LÍQUIDOS OBJETIVOS Observar soluções insaturadas, saturadas e supersaturadas; Construir a curva de solubilidade de um sal inorgânico. INTRODUÇÃO Os depósitos naturais
Prática de QOA em duas etapas:
 CENTRO FEDERAL DE EDUCAÇÃO TECNOLÓGICA DE MINAS GERAIS CAMPUS TIMÓTEO Prática de QOA em duas etapas: 1) Ciclohexeno a partir de ciclohexanol via eliminação Grau de dificuldade: baixo Duração: 50 minutos
CENTRO FEDERAL DE EDUCAÇÃO TECNOLÓGICA DE MINAS GERAIS CAMPUS TIMÓTEO Prática de QOA em duas etapas: 1) Ciclohexeno a partir de ciclohexanol via eliminação Grau de dificuldade: baixo Duração: 50 minutos
EXPERIÊNCIA 07 OXIDAÇÃO DO CICLOEXANOL: SÍNTESE DA CICLOEXANONA
 EXPERIÊNCIA 07 XIDAÇÃ D CICLEXANL: SÍNTESE DA CICLEXANNA 1- INTRDUÇÃ produto formado a partir da oxidação de álcoois depende do agente oxidante empregado e da natureza do álcool de partida (álcool primário,
EXPERIÊNCIA 07 XIDAÇÃ D CICLEXANL: SÍNTESE DA CICLEXANNA 1- INTRDUÇÃ produto formado a partir da oxidação de álcoois depende do agente oxidante empregado e da natureza do álcool de partida (álcool primário,
PÓ DE CARVÃO MINERAL PARA FUNDIÇÃO - DETERMINAÇÃO DO TEOR DE ENXOFRE TOTAL PELO PROCESSO DE ESCHKA (GRAVIMETRIA)
 SUMÁRIO Método de Ensaio Folha : 1 de 6 1_ Objetivo 2_ Documentos a consultar 3_ Princípio do método 4_ Definição 5_ Aparelhagem/reagentes 6_ Preparação das soluções 7_ Execução do ensaio 8_ Segurança
SUMÁRIO Método de Ensaio Folha : 1 de 6 1_ Objetivo 2_ Documentos a consultar 3_ Princípio do método 4_ Definição 5_ Aparelhagem/reagentes 6_ Preparação das soluções 7_ Execução do ensaio 8_ Segurança
EXPERIÊNCIA 2 - SOLUBILIDADE
 CENTRO DE CIÊNCIAS TECNOLÓGICAS - CCT Departamento de Ciências Básicas e Sociais - DCBS Disciplina Química Experimental QEX Prof. Sivaldo Leite Correia EXPERIÊNCIA 2 - SOLUBILIDADE 1. CONCEITOS FUNDAMENTAIS
CENTRO DE CIÊNCIAS TECNOLÓGICAS - CCT Departamento de Ciências Básicas e Sociais - DCBS Disciplina Química Experimental QEX Prof. Sivaldo Leite Correia EXPERIÊNCIA 2 - SOLUBILIDADE 1. CONCEITOS FUNDAMENTAIS
Associação Brasileira de Química XI Maratona Cearense de Química a Fase 1 o Ano 22/08/08. Experiência 1
 Associação Brasileira de Química XI Maratona Cearense de Química 2008 2 a Fase 1 o Ano Experiência 1 8 tubos de ensaio. Solução de Ba(OH) 2. Pipeta graduada. 4 conjuntos de mangueiras e rolhas. 1 estante
Associação Brasileira de Química XI Maratona Cearense de Química 2008 2 a Fase 1 o Ano Experiência 1 8 tubos de ensaio. Solução de Ba(OH) 2. Pipeta graduada. 4 conjuntos de mangueiras e rolhas. 1 estante
Determinação de amido em farinha de mandioca, produtos amiláceos e outros
 Página 1 de 5 1 Escopo Este método determina o teor de amido em farinha de mandioca, produtos amiláceos e outros, cujo parâmetro está relacionado à qualidade do produto segundo a Instrução Normativa nº
Página 1 de 5 1 Escopo Este método determina o teor de amido em farinha de mandioca, produtos amiláceos e outros, cujo parâmetro está relacionado à qualidade do produto segundo a Instrução Normativa nº
Tabela I - Ésteres encontrados em alguns aromas
 1º Ciclo Enologia Química rgânica I TRABALH PRÁTIC Nº2 SÍNTESE DE ÉSTERES CM ARMA INTRDUÇÃ s ésteres são compostos extremamente comuns. Por exemplo, os óleos vegetais, como o azeite, são misturas de diversos
1º Ciclo Enologia Química rgânica I TRABALH PRÁTIC Nº2 SÍNTESE DE ÉSTERES CM ARMA INTRDUÇÃ s ésteres são compostos extremamente comuns. Por exemplo, os óleos vegetais, como o azeite, são misturas de diversos
MF-0428.R-1 - MÉTODO DE DETERMINAÇÃO DE FENÓIS (AMINO ANTIPIRINA)
 MF-0428.R-1 - MÉTODO DE DETERMINAÇÃO DE FENÓIS (AMINO ANTIPIRINA) Notas: Aprovado pela Deliberação CECA nº 0045, de 01 de fevereiro de 1979. Publicado no DOERJ de 25 de abril de 1979. 1. OBJETIVO O objetivo
MF-0428.R-1 - MÉTODO DE DETERMINAÇÃO DE FENÓIS (AMINO ANTIPIRINA) Notas: Aprovado pela Deliberação CECA nº 0045, de 01 de fevereiro de 1979. Publicado no DOERJ de 25 de abril de 1979. 1. OBJETIVO O objetivo
Prática 06 Síntese do Ácido Acetilsalicílico (AAS) O COOH + INTRODUÇÃO
 Prática 06 Síntese do Ácido Acetilsalicílico (AAS) H CH H 2 S 4 CH H bjetivos Didáticos: 1) Desenvolver os conceitos de reações de esterificação. 2) Discutir o mecanismo. INTDUÇÃ s ésteres mais simples
Prática 06 Síntese do Ácido Acetilsalicílico (AAS) H CH H 2 S 4 CH H bjetivos Didáticos: 1) Desenvolver os conceitos de reações de esterificação. 2) Discutir o mecanismo. INTDUÇÃ s ésteres mais simples
XVI Maratona Cearense de Química º Ano. Experiência 1
 - 2013 8º Ano Experiência 1 Material: 1. Erlenmeyer 500mL com tampa 2. Cinco béqueres de 150 ml 3. 100 ml de mel (Karo) 4. 100 ml de glicerina 5. 100 ml de água com corante 6. 100 ml de óleo de cozinha
- 2013 8º Ano Experiência 1 Material: 1. Erlenmeyer 500mL com tampa 2. Cinco béqueres de 150 ml 3. 100 ml de mel (Karo) 4. 100 ml de glicerina 5. 100 ml de água com corante 6. 100 ml de óleo de cozinha
Experimento 03: Cinética Química
 Experimento 03: Cinética Química 1 OBJETIVO - Verificar alguns fatores que influenciam na velocidade das reações químicas: temperatura, superfície de contato e efeito do catalisador. 2 INTRODUÇÃO A cinética
Experimento 03: Cinética Química 1 OBJETIVO - Verificar alguns fatores que influenciam na velocidade das reações químicas: temperatura, superfície de contato e efeito do catalisador. 2 INTRODUÇÃO A cinética
Seminário de Química Orgânica Experimental I. Silene Alessandra Santos Melo Douglas Fernando Antonio Outubro 2002
 Seminário de Química Orgânica Experimental I Silene Alessandra Santos Melo Douglas Fernando Antonio Outubro 2002 Recristalização da Acetanilida Introdução Cristalização Precipitação Recristalização Cristalização
Seminário de Química Orgânica Experimental I Silene Alessandra Santos Melo Douglas Fernando Antonio Outubro 2002 Recristalização da Acetanilida Introdução Cristalização Precipitação Recristalização Cristalização
EQUIPAMENTO BÁSICO DE LABORATÓRIO
 1 EQUIPAMENTO BÁSICO DE LABORATÓRIO MATERIAL DE VIDRO: TUBO DE ENSAIO Utilizado principalmente para efetuar reações químicas em pequena escala. 2 BÉQUER ou BÉCKER Recipiente com ou sem graduação, utilizado
1 EQUIPAMENTO BÁSICO DE LABORATÓRIO MATERIAL DE VIDRO: TUBO DE ENSAIO Utilizado principalmente para efetuar reações químicas em pequena escala. 2 BÉQUER ou BÉCKER Recipiente com ou sem graduação, utilizado
Estudo das reações. Pércio Augusto Mardini Farias. Este documento tem nível de compartilhamento de acordo com a licença 3.0 do Creative Commons.
 Pércio Augusto Mardini Farias Este documento tem nível de compartilhamento de acordo com a licença 3.0 do Creative Commons. http://creativecommons.org.br http://creativecommons.org/licenses/by-sa/3.0/br/legalcode
Pércio Augusto Mardini Farias Este documento tem nível de compartilhamento de acordo com a licença 3.0 do Creative Commons. http://creativecommons.org.br http://creativecommons.org/licenses/by-sa/3.0/br/legalcode
Disciplina: Práticas de Química Orgânica. Materiais e Reagentes
 Ministério da Educação Universidade Tecnológica Federal do Paraná Campus de Curitiba Gerência de Ensino e Pesquisa Departamento Acadêmico de Química e Biologia Prática n o 08 _ Síntese e purificação da
Ministério da Educação Universidade Tecnológica Federal do Paraná Campus de Curitiba Gerência de Ensino e Pesquisa Departamento Acadêmico de Química e Biologia Prática n o 08 _ Síntese e purificação da
Ana Elisa Comanini Ana Karla Agner Felipe Gollino
 Ana Elisa Comanini Ana Karla Agner Felipe Gollino 2º ano Bacharelado 2008 Filtração Remover impurezas sólidas de um líquido ou de uma solução Coletar um produto sólido de uma solução na qual ele tenha
Ana Elisa Comanini Ana Karla Agner Felipe Gollino 2º ano Bacharelado 2008 Filtração Remover impurezas sólidas de um líquido ou de uma solução Coletar um produto sólido de uma solução na qual ele tenha
EXPERIÊNCIA 5 SOLUBILIDADE
 EXPERIÊNCIA 5 SOLUBILIDADE 1. OBJETIVOS No final desta experiência, espera-se que o aluno seja capaz de: Identificar algumas variáveis que afetam a solubilidade. Utilizar técnicas simples de extração,
EXPERIÊNCIA 5 SOLUBILIDADE 1. OBJETIVOS No final desta experiência, espera-se que o aluno seja capaz de: Identificar algumas variáveis que afetam a solubilidade. Utilizar técnicas simples de extração,
Síntese e Caracterização do
 Síntese e Caracterização do trans-[cocl2(en)2]cl.2h2o Objetivos Ilustrar a preparação de isômeros geométricos do diclorobis(etilenodiamina)cobalto(iii) e verificar experimentalmente algumas de suas propriedades
Síntese e Caracterização do trans-[cocl2(en)2]cl.2h2o Objetivos Ilustrar a preparação de isômeros geométricos do diclorobis(etilenodiamina)cobalto(iii) e verificar experimentalmente algumas de suas propriedades
ALTERAÇÕES FÍSICO-QUÍMICAS EM ÓLEOS SUBMETIDOS AO PROCESSO DE FRITURA NO REFEITÓRIO DO IFSUDESTEMG-CAMPUS BARBACENA
 ALTERAÇÕES FÍSICO-QUÍMICAS EM ÓLEOS SUBMETIDOS AO PROCESSO DE FRITURA NO REFEITÓRIO DO IFSUDESTEMG-CAMPUS BARBACENA Amanda Aparecida de Lima Bergami 1, Daniel Rodrigues Lima 2, Ianka Cristina Ernesto 3,
ALTERAÇÕES FÍSICO-QUÍMICAS EM ÓLEOS SUBMETIDOS AO PROCESSO DE FRITURA NO REFEITÓRIO DO IFSUDESTEMG-CAMPUS BARBACENA Amanda Aparecida de Lima Bergami 1, Daniel Rodrigues Lima 2, Ianka Cristina Ernesto 3,
MF-612.R-3 - MÉTODO DE DETERMINAÇÃO DE NITRATOS EM SUSPENSÃO NO AR POR COLORIMETRIA
 MF-612.R-3 - MÉTODO DE DETERMINAÇÃO DE NITRATOS EM SUSPENSÃO NO AR POR COLORIMETRIA 1. OBJETIVO Definir o método de determinação de nitratos em suspensão no ar, por colorimetria, utilizando 2,4 dimetilfenol
MF-612.R-3 - MÉTODO DE DETERMINAÇÃO DE NITRATOS EM SUSPENSÃO NO AR POR COLORIMETRIA 1. OBJETIVO Definir o método de determinação de nitratos em suspensão no ar, por colorimetria, utilizando 2,4 dimetilfenol
PRÁTICA 05 - DETERMINAÇÃO DE CLORO ATIVO EM ÁGUA SANITÁRIA E DETERMINAÇÃO IODOMÉTRICA DE ÁCIDO ASCÓRBICO
 PRÁTICA 05 - DETERMINAÇÃO DE CLORO ATIVO EM ÁGUA SANITÁRIA E DETERMINAÇÃO IODOMÉTRICA DE ÁCIDO ASCÓRBICO Aula 15 METAS Familiarizar com as técnicas de preparo e padronização de solução de tiossulfato de
PRÁTICA 05 - DETERMINAÇÃO DE CLORO ATIVO EM ÁGUA SANITÁRIA E DETERMINAÇÃO IODOMÉTRICA DE ÁCIDO ASCÓRBICO Aula 15 METAS Familiarizar com as técnicas de preparo e padronização de solução de tiossulfato de
IQ-UFG. Curso Experimental de Química Geral e Inorgânica. Prof. Dr. Anselmo
 IQ-UFG Curso Experimental de Química Geral e Inorgânica Aula 02 Reconhecimento de Vidrarias e Introdução às Técnicas de Laboratório Prof. Dr. Anselmo Vidrarias e equipamentos usuais em laboratórios de
IQ-UFG Curso Experimental de Química Geral e Inorgânica Aula 02 Reconhecimento de Vidrarias e Introdução às Técnicas de Laboratório Prof. Dr. Anselmo Vidrarias e equipamentos usuais em laboratórios de
Experiência 02 - SOLUBILIDADE SOLUBILIDADE
 1. Objetivos SOLUBILIDADE No final dessa experiência, o aluno deverá ser capaz de: - Identificar algumas variáveis que afetam a solubilidade. - Utilizar técnicas simples de separação de misturas. 2. Introdução
1. Objetivos SOLUBILIDADE No final dessa experiência, o aluno deverá ser capaz de: - Identificar algumas variáveis que afetam a solubilidade. - Utilizar técnicas simples de separação de misturas. 2. Introdução
VOLUMETRIA DE NEUTRALIZAÇÃO.
 13 Técnica 1. VOLUMETRIA DE NEUTRALIZAÇÃO. PADRONIZAÇÃO DA SOLUÇÃO APROXIMADAMENTE 0,1 M DE HCl COM SOLUÇÃO PADRÃO 0,05 M DE Na 2 CO 3. Colocar no erlenmeyer exatamente 10 ml de solução padrão 0,05 M de
13 Técnica 1. VOLUMETRIA DE NEUTRALIZAÇÃO. PADRONIZAÇÃO DA SOLUÇÃO APROXIMADAMENTE 0,1 M DE HCl COM SOLUÇÃO PADRÃO 0,05 M DE Na 2 CO 3. Colocar no erlenmeyer exatamente 10 ml de solução padrão 0,05 M de
1004 Nitração do N-óxido de piridina para N-óxido de 4- nitropiridina
 1004 Nitração do N-óxido de piridina para N-óxido de 4- nitropiridina O N HNO 3 /H 2 SO 4 O N NO 2 C 5 H 5 NO (95,1) (63,0) (98,1) C 5 H 4 N 2 O 3 (140,1) Classificação Tipos de reações e classes de substâncias
1004 Nitração do N-óxido de piridina para N-óxido de 4- nitropiridina O N HNO 3 /H 2 SO 4 O N NO 2 C 5 H 5 NO (95,1) (63,0) (98,1) C 5 H 4 N 2 O 3 (140,1) Classificação Tipos de reações e classes de substâncias
Química Orgânica Experimental
 Química Orgânica Experimental Destilação Simples para Purificação do Cloreto de Terc-butila e do Acetato de Isopentila Discentes: Ana Carolina Boni Eliana Alves Arxer Fernanda Maciel Barbosa Gubbiotti
Química Orgânica Experimental Destilação Simples para Purificação do Cloreto de Terc-butila e do Acetato de Isopentila Discentes: Ana Carolina Boni Eliana Alves Arxer Fernanda Maciel Barbosa Gubbiotti
MF-420.R-3 - MÉTODO DE DETERMINAÇÃO DE AMÔNIA (MÉTODO DO INDOFENOL).
 MF-420.R-3 - MÉTODO DE DETERMINAÇÃO DE AMÔNIA (MÉTODO DO INDOFENOL). Notas: Aprovada pela Deliberação CECA nº 686, de 25 de julho de 1985. Publicada no DOERJ de 14 de julho de 1985. 1. OBJETIVO O objetivo
MF-420.R-3 - MÉTODO DE DETERMINAÇÃO DE AMÔNIA (MÉTODO DO INDOFENOL). Notas: Aprovada pela Deliberação CECA nº 686, de 25 de julho de 1985. Publicada no DOERJ de 14 de julho de 1985. 1. OBJETIVO O objetivo
Unidade V - Determinação de umidade e sólidos totais
 Unidade V - Determinação de umidade e sólidos totais O método empregado depende do objetivo. O que estou necessitando? Rapidez? Precisão? Exatidão? Medir em tempo real? Umidade: métodos Quantitativos Métodos
Unidade V - Determinação de umidade e sólidos totais O método empregado depende do objetivo. O que estou necessitando? Rapidez? Precisão? Exatidão? Medir em tempo real? Umidade: métodos Quantitativos Métodos
Acilação Síntese da Acetanilida
 Química Orgânica Experimental Acilação Síntese da Acetanilida Introdução O termo genérico acilação cobre todas as reações que resultam na introdução de um grupo acila em um composto orgânico. No caso específico
Química Orgânica Experimental Acilação Síntese da Acetanilida Introdução O termo genérico acilação cobre todas as reações que resultam na introdução de um grupo acila em um composto orgânico. No caso específico
Preparação e padronização de soluções
 INSTITUTO POLITÉCNICO DE TOMAR ESCOLA SUPERIOR DE TECNOLOGIA Departamento de Engenharia Química e do Ambiente QUÍMICA I (1º Ano 1º Semestre) Trabalho Prático nº 2 Preparação e padronização de soluções
INSTITUTO POLITÉCNICO DE TOMAR ESCOLA SUPERIOR DE TECNOLOGIA Departamento de Engenharia Química e do Ambiente QUÍMICA I (1º Ano 1º Semestre) Trabalho Prático nº 2 Preparação e padronização de soluções
Redações Anteriores. Art. 3º Esta Instrução Normativa entra em vigor na data de sua publicação.
 MINISTÉRIO DA AGRICULTURA, PECUÁRIA E ABASTECIMENTO GABINETE DO MINISTRO INSTRUÇÃO NORMATIVA Nº 8, DE 11 DE MARÇO DE 2009 O MINISTRO DE ESTADO DA AGRICULTURA, PECUÁRIA E ABASTECIMENTO, no uso da atribuição
MINISTÉRIO DA AGRICULTURA, PECUÁRIA E ABASTECIMENTO GABINETE DO MINISTRO INSTRUÇÃO NORMATIVA Nº 8, DE 11 DE MARÇO DE 2009 O MINISTRO DE ESTADO DA AGRICULTURA, PECUÁRIA E ABASTECIMENTO, no uso da atribuição
Preparação do Acetato de Isopentila. Leonardo Lataro Paim Rodrigo Putvinskis
 Preparação do Acetato de Isopentila Leonardo Lataro Paim Rodrigo Putvinskis Objetivo: Preparação e isolamento do acetato de isopentila (reação de esterificação) O Acetato de Isopentila é um éster conhecido
Preparação do Acetato de Isopentila Leonardo Lataro Paim Rodrigo Putvinskis Objetivo: Preparação e isolamento do acetato de isopentila (reação de esterificação) O Acetato de Isopentila é um éster conhecido
3003 Síntese de 2-cloro-ciclohexanol a partir de ciclohexeno
 3003 Síntese de 2-cloro-ciclohexanol a partir de ciclohexeno _ + SO 2 NCl Na OH H 2 SO 4 + x 3 H 2 O + Cl CH 3 SO 2 NH 2 CH 3 C 6 H 10 (82.2) C 7 H 13 ClNNaO 5 S (281.7) (98.1) C 6 H 11 ClO (134.6) C 7
3003 Síntese de 2-cloro-ciclohexanol a partir de ciclohexeno _ + SO 2 NCl Na OH H 2 SO 4 + x 3 H 2 O + Cl CH 3 SO 2 NH 2 CH 3 C 6 H 10 (82.2) C 7 H 13 ClNNaO 5 S (281.7) (98.1) C 6 H 11 ClO (134.6) C 7
EXAME PRÁTICO QUÍMICA ORGÂNICA QUÍMICA VERDE
 EXAME PRÁTICO QUÍMICA ORGÂNICA QUÍMICA VERDE O objetivo da Química verde é desenvolver procedimentos químicos que não provoquem a poluição do meio ambiente, utilizando as matérias primas de uma forma eficiente
EXAME PRÁTICO QUÍMICA ORGÂNICA QUÍMICA VERDE O objetivo da Química verde é desenvolver procedimentos químicos que não provoquem a poluição do meio ambiente, utilizando as matérias primas de uma forma eficiente
EXTRAÇÃO DO ÓLEO DE LARANJA A PARTIR DAS CASCAS DE LARANJA DESTILAÇÃO POR ARRASTAMENTO DE VAPOR
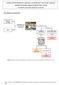 EXTRAÇÃO DO ÓLEO DE LARANJA A PARTIR DAS CASCAS DE LARANJA DESTILAÇÃO POR ARRASTAMENTO DE VAPOR Procedimento experimental adaptado de J. H. Beatty 1 Procedimento experimental Figura 1. Esquema resumo do
EXTRAÇÃO DO ÓLEO DE LARANJA A PARTIR DAS CASCAS DE LARANJA DESTILAÇÃO POR ARRASTAMENTO DE VAPOR Procedimento experimental adaptado de J. H. Beatty 1 Procedimento experimental Figura 1. Esquema resumo do
Recristalização da Acetanilida
 Recristalização da Acetanilida Reação de formação da acetanilida O NH 2 + CH 3 CH 3 C C O O O NaAc/HAc H N C CH 3 + CH 3 C O O H Anilina Anidrido Acético Acetanilida Acido acético H + CH 3 COO - CH 3 COOH
Recristalização da Acetanilida Reação de formação da acetanilida O NH 2 + CH 3 CH 3 C C O O O NaAc/HAc H N C CH 3 + CH 3 C O O H Anilina Anidrido Acético Acetanilida Acido acético H + CH 3 COO - CH 3 COOH
Figura 1. Variação da solubilidade dos compostos em função da temperatura. fonte: 2010, 2008, 2005, 2002 por P. W. Atkins e L. L. Jones.
 Experiência 4. SOLUBILIDADE 1. Objetivos No final desta experiência, espera-se que o aluno seja capaz de: - Identificar algumas variáveis que afetam a solubilidade. - Utilizar técnicas simples de extração,
Experiência 4. SOLUBILIDADE 1. Objetivos No final desta experiência, espera-se que o aluno seja capaz de: - Identificar algumas variáveis que afetam a solubilidade. - Utilizar técnicas simples de extração,
Recristalização da Acetanilida
 Recristalização da Acetanilida Grupo 2 Maísa Sanchez Gomes Mariana Cutigi Recristalização Método para purificar sólidos ou para separar compostos que são solúveis à quente e insolúveis, ou pouco solúveis,
Recristalização da Acetanilida Grupo 2 Maísa Sanchez Gomes Mariana Cutigi Recristalização Método para purificar sólidos ou para separar compostos que são solúveis à quente e insolúveis, ou pouco solúveis,
XXV - MEL. Esta classificação é em fotômetro ou espectrofotômetro a 560nm, em célula de 1cm, usando como branco a glicerina pura.
 XXV - MEL 1. CARACTERÍSTICAS ORGANOLÉPTICAS 1.1. Aspecto: Líquido denso, viscoso, translúcido ou cristalino. 1.2. Classificação segundo a coloração Coloração Escala de Pfund Faixa de coloração Branco d
XXV - MEL 1. CARACTERÍSTICAS ORGANOLÉPTICAS 1.1. Aspecto: Líquido denso, viscoso, translúcido ou cristalino. 1.2. Classificação segundo a coloração Coloração Escala de Pfund Faixa de coloração Branco d
Associação Brasileira de Química XIV Maratona Cearense de Química a Fase 1 o Ano 31/08/11. Experiência
 Associação Brasileira de Química XIV Maratona Cearense de Química 2011 2 a Fase 1 o Ano 31/08/11 Experiência Material e Reagentes: 1. Dois béqueres de 250 ml. 2. Espátula. 3. Água destilada. 4. Borato
Associação Brasileira de Química XIV Maratona Cearense de Química 2011 2 a Fase 1 o Ano 31/08/11 Experiência Material e Reagentes: 1. Dois béqueres de 250 ml. 2. Espátula. 3. Água destilada. 4. Borato
ANALISE DE RENDIMENTO DO CATALISADOR HETEROGÊNEO ÓXIDO DE ALUMÍNIO (Al2O3) NA PRODUÇÃO DE BIODIESEL DE SOJA (glycine max)
 ANALISE DE RENDIMENTO DO CATALISADOR HETEROGÊNEO ÓXIDO DE ALUMÍNIO (Al2O3) NA PRODUÇÃO DE BIODIESEL DE SOJA (glycine max) Rayanne Samara de Sousa Reinaldo(1); Maria Rosimar de Sousa(2); Leonardo Alcântara
ANALISE DE RENDIMENTO DO CATALISADOR HETEROGÊNEO ÓXIDO DE ALUMÍNIO (Al2O3) NA PRODUÇÃO DE BIODIESEL DE SOJA (glycine max) Rayanne Samara de Sousa Reinaldo(1); Maria Rosimar de Sousa(2); Leonardo Alcântara
Aprender a preparar soluções aquosas, realizar diluições e determinar suas concentrações.
 EXPERIMENTO 2 Preparação e Padronização de Soluções OBJETIVOS Rever os conceitos de concentração de soluções. Aprender a preparar soluções aquosas, realizar diluições e determinar suas concentrações. Exercitar
EXPERIMENTO 2 Preparação e Padronização de Soluções OBJETIVOS Rever os conceitos de concentração de soluções. Aprender a preparar soluções aquosas, realizar diluições e determinar suas concentrações. Exercitar
EXPERIMENTO 12 SÍNTESE E CARACTERIZAÇÃO DA ASPIRINA OBJETIVOS INTRODUÇÃO
 EXPERIMENTO 12 SÍNTESE E CARACTERIZAÇÃO DA ASPIRINA OBJETIVOS Sintetizar e purificar um composto orgânico de importância farmacológica; Caracterizar este composto medindo seu ponto de fusão; Determinar
EXPERIMENTO 12 SÍNTESE E CARACTERIZAÇÃO DA ASPIRINA OBJETIVOS Sintetizar e purificar um composto orgânico de importância farmacológica; Caracterizar este composto medindo seu ponto de fusão; Determinar
Química. APL 2.5 Síntese de biodiesel a partir de óleo alimentar
 Química APL 2.5 Síntese de biodiesel a partir de óleo alimentar Luísa Neves, 12ºCT de abril de 2015 Índice Introdução...2 Material e Reagentes...3 Procedimento..4 Perigos específicos e conselhos de segurança
Química APL 2.5 Síntese de biodiesel a partir de óleo alimentar Luísa Neves, 12ºCT de abril de 2015 Índice Introdução...2 Material e Reagentes...3 Procedimento..4 Perigos específicos e conselhos de segurança
MINISTÉRIO DA EDUCAÇÃO UNIVERSIDADE FEDERAL DO PARANÁ Departamento de Farmácia Laboratório de Farmacognosia
 MINISTÉRI DA EDUCAÇÃ UNIVERSIDADE FEDERAL D PARANÁ Departamento de Farmácia Laboratório de Farmacognosia ANÁLISE D MEL mel natural é um produto açucarado fornecido pela abelha Apis mellifera L., APIDAE.
MINISTÉRI DA EDUCAÇÃ UNIVERSIDADE FEDERAL D PARANÁ Departamento de Farmácia Laboratório de Farmacognosia ANÁLISE D MEL mel natural é um produto açucarado fornecido pela abelha Apis mellifera L., APIDAE.
Prática 4: Reações envolvendo trocas de calor
 Prática 4: Reações envolvendo trocas de calor Pretende-se com essa atividade dar ao aluno a oportunidade de fazer experiências que possibilitem calcular calores de reação e aplicação da Lei de Hess. Etapa
Prática 4: Reações envolvendo trocas de calor Pretende-se com essa atividade dar ao aluno a oportunidade de fazer experiências que possibilitem calcular calores de reação e aplicação da Lei de Hess. Etapa
4023 Síntese do éster etílico do ácido 2-cicclopentanona carboxílico a partir do éster dietílico do ácido adípico
 NP 4023 Síntese do éster etílico do ácido 2-cicclopentanona carboxílico a partir do éster dietílico do ácido adípico NaEt C 10 H 18 4 Na C 2 H 6 C 8 H 12 3 (202,2) (23,0) (46,1) (156,2) Classificação Tipos
NP 4023 Síntese do éster etílico do ácido 2-cicclopentanona carboxílico a partir do éster dietílico do ácido adípico NaEt C 10 H 18 4 Na C 2 H 6 C 8 H 12 3 (202,2) (23,0) (46,1) (156,2) Classificação Tipos
