UNIVERSIDADE FEDERAL DO RIO GRANDE DO NORTE CENTRO DE BIOCIÊNCIAS PROGRAMA DE PÓS-GRADUAÇÃO EM BIOQUÍMICA GEOVANNA MARIA DE MEDEIROS MOURA
|
|
|
- Manuella Benke
- 3 Há anos
- Visualizações:
Transcrição
1 UNIVERSIDADE FEDERAL DO RIO GRANDE DO NORTE CENTRO DE BIOCIÊNCIAS PROGRAMA DE PÓS-GRADUAÇÃO EM BIOQUÍMICA GEOVANNA MARIA DE MEDEIROS MOURA UMA NOVA LECTINA LACTOSE-ESPECÍFICA ISOLADA DO FUNGO Langermannia bicolor COM PROPRIEDADES ANTIBIOFILME NATAL
2 GEOVANNA MARIA DE MEDEIROS MOURA Uma nova lectina lactose-específica isolada do fungo Langermannia bicolor com propriedades antibiofilme Dissertação apresentada ao Programa de Pós-Graduação em Bioquímica da Universidade Federal do Rio Grande do Norte como requisito parcial para a obtenção do título de Mestre em Bioquímica. Orientador: Prof. Dr. Elizeu Antunes dos Santos. NATAL
3 Universidade Federal do Rio Grande do Norte - UFRN Sistema de Bibliotecas - SISBI Catalogação de Publicação na Fonte. UFRN - Biblioteca Setorial Prof. Leopoldo Nelson Centro de Biociências - CB Moura, Geovanna Maria de Medeiros. Uma nova lectina lactose-específica isolada do fungo Langermannia bicolor com propriedades antibiofilme / Geovanna Maria de Medeiros Moura. - Natal, f.: il. Dissertação (Mestrado) - Universidade Federal do Rio Grande do Norte. Centro de Biociências. Programa de Pós-Graduação em Bioquímica. Orientador: Prof. Dr. Elizeu Antunes dos Santos. 1. Cogumelo - Dissertação. 2. Proteínas - Dissertação. 3. Domínio Reconhecedor de Carboidratos - Dissertação. 4. Aglutinação - Dissertação. 5. Biofilme - Dissertação. 6. Bactérias - Dissertação. I. Santos, Elizeu Antunes dos. II. Universidade Federal do Rio Grande do Norte. III. Título. Elaborado por KATIA REJANE DA SILVA - CRB-15/351 3
4 4
5 Dedico este trabalho Aos meus pais Maria Luciene de Medeiros Moura e George Adriano Bezerra Moura, palavras não são capazes de expressar tamanho o orgulho e gratidão que sinto por vocês. Todos os dias eu luto para ser uma filha melhor para vocês e poder devolver ao longo dessa vida todo esse carinho e amor. Todas as páginas dessa dissertação são pra vocês. Amo vocês além do tempo, do espaço e da vida. 5
6 AGRADECIMENTOS À Universidade Federal do Rio Grande do Norte através do Departamento de Bioquímica e o Programa de Pós-Graduação em Bioquímica que permitiram a realização desse trabalho; À agência de fomento à pesquisa no Brasil: Coordenação de Aperfeiçoamento de Pessoal de Nível Superior (CAPES) responsável por meu sustento pessoal durante esses dois anos; Ao meu orientador Prof. Dr. Elizeu Antunes dos Santos por ser uma fonte inesgotável de inspiração. Exemplo de pessoa e educador que propiciou a realização desse projeto. Obrigada pela paciência, por confiar em mim e pelo constante aprendizado; Às professoras Drª Adriana Uchôa, Drª Monique Alves e Drª Luciana Rabêlo pela disponibilidade e valiosos ensinamentos dentro e fora da qualificação. Foi imensamente gratificante ter mulheres tão inspiradoras e poderosas contribuindo para o enriquecimento deste trabalho; Aos professores da banca de defesa: Dr. Elizeu Antunes (Presidente), Dr. Hugo Rocha (Interno), Dr. Ermeton Duarte (Externo ao Programa) e Drª Paula Ivani (Externa à Instituição). Só tenho elogios e gratidão por todas sugestões extremamente pertinentes; Aos meus colegas do mestrado : Aquiles Sales, Cynthia Haynara, Johny Wysllas, Lucas Alighieri, Luiz Henrique Costa e Thais Teixeira. Desejo todo $uce$$o profissional e na vida de cada um de vocês. Foi uma honra ter passado essa jornada com vocês. Muito obrigada; À todos os funcionários do Departamento de Bioquímica da UFRN, do pessoal da limpeza a secretária meu muito obrigada! Ao Prof. Dr. Hugo Rocha sempre solícito e divertido! Obrigada por permitir meu acesso ao BIOPOL e tornar possível a execução deste trabalho, sem a sua ajuda nada disso seria possível! À todos integrantes da mansão BIOPOL pelos momentos de descontração e de conhecimento, é muito bom tê-los como vizinhos de laboratório e poder compartilhar meu dia-a-dia com vocês, meu muito obrigada por tudo! Ao Laboratório de Química e Função de Proteínas Bioativas (LQFPB) em sua totalidade e em tudo que representa pra mim. Todos os doutores, mestres e alunos de iniciação cientifica que me deram ensinamentos valiosos acadêmicos e extra-acadêmicos; Ao Prof. Me. Antônio Moreira por ter acreditado no meu potencial e me convidado para ser sua aluna de Iniciação Científica e de Monografia. Essa dissertação é resultado do que construímos junto na pesquisa com fungos. 6
7 Obrigada pelo excelente convívio, todos ensinamentos e conselhos (profissionais e pessoais); À professora Drª Paula Ivani (IFRN Macau), nossa parceria foi uma surpresa muito boa na minha vida acadêmica. Obrigada por confiar na minha pesquisa e tornar possíveis as cromatografias nos sistemas de FPLC E HPLC, além de me ensinar todos os segredos cromatográficos até tarde da noite; Ao Prof. Dr. Iuri Baseia, e seus alunos Freitas e Miguel, do Laboratório de Fungos do Centro de Biociências pela parceria, trilhas e coletas que tornaram possível a minha pesquisa ao longo desse anos, meu muito obrigada esse trabalho é todo nosso! A Prof. Drª Elizabeth Santos colaboradora do laboratório de imunoparasitologia (LIMPA) no Centro de Ciências da Saúde (CCS). Beth, você foi um presente na minha vida, é uma alegria saber que existem pessoas como você na ciência. Obrigada por fazer possível essa dissertação e também por ser esse exemplo de pessoa e profissional! Ao Me. Bruno Oliveira de Veras (UFPE) pela constante ajuda e tornar possível o impossível haha. Obrigada pelo auxílio na elaboração e planejamento dos meus artigos e experimentos, sou muito grata por tudo! Às meninas Juliane Ribeiro, Gabriella Campos, Stephanie Silva e aos meninos Guilherme Cavalcanti e Leonardo Amaral por representarem a nova geração LQFPB e por me propiciarem a oportunidade de aprender à ensinar tudo aquilo que aprendi dentro laboratório. Obrigada pessoal, é uma honra propagar esses conhecimentos à vocês e participar de nossas reuniões semanais. Ao biomédico Vladimir Sabino que além de ter se tornado um parceiro na ciência virou um amigo de memes! Vlad, você é incrível e vem muito sucesso por aí! Obrigada por sempre ser tão prestativo e atencioso! Aos meus alunos de iniciação científica: Juliane Ribeiro e Guilherme Cavalcante, definitivamente dois anjos na minha vida! Esforçados, inteligentes, honestos, além de tudo bem-humorados e de bom coração. Faltam adjetivos Ju e Gui, é um prazer coorientar vocês e poder contribuir de alguma forma para desenvolvimento de vocês. Todo $uce$$o do mundo, meus queridos! Aos meus colegas de vida e de bancada Joelton Igor Oliveira, Rayana Mazille e Maria Tatiana Oliveira. Vocês foram imprescindíveis para a minha trajetória até aqui. Obrigada pelo apoio e por me ensinarem tanta coisa que vão além dos experimentos, mostrando que responsabilidade e dedicação não tem nada a ver com soberba e autoafirmação. Obrigada hoje e sempre, amo vocês; A minha amiga Heloísa Lara Muniz pela amizade, risadas, e constante apoio e paciência para os meus dramas. Você não faz ideia de como sou grata a nossa amizade. Desejar toda a felicidade do mundo ainda seria pouco para você. Obrigada por tudo, te amo demais! 7
8 Aos meus amigos da graduação de Ciências Biológicas turma , do colégio das neves e ciências aplicadas, não citarei todos pois tenho medo de esquecer alguém! Vocês são bastante importantes para mim; À todos os professores que passaram na minha vida do Chapeuzinho Vermelho, passando pelos colégios das Neves e Ciências Aplicadas, na Graduação em Ciências Biológicas Bacharelado até os docentes do Programa de Pós-Graduação em Bioquímica. Meu muito obrigada por tonarem tudo isso possível; Aos meus amados sobrinhos: Théo Pietro (5 anos), Thayla Maria (1 ano e 9 meses) e Valentinna (8 meses). Doí meu coração não poder vê-los crescer com a frequência que gostaria. Titia está trabalhando e se aperfeiçoando pra no futuro mimar muito vocês na Disney! Aos meus irmãos queridos Geórgia Adriana e Francisco Juvenal (Netinho) o tempo passou tão rápido, na minha cabeça ainda estamos todos assistindo o DVD do Shrek 3 pela 38º vez no apartamento da praia do meio ou jogando Donkey Kong no computador com internet discada com a TV ligada na MTV Brasil. Obrigada meus irmãos por me protegerem e me propiciar uma infância tão boa. Amo vocês! À poodle mais ciumenta e companheira de 15 anos de vida (tive mais tempo de vida ao seu lado do que sozinha). Minininha nunca pensei que sua ausência iria ser assim. Te amo pra sempre minha cachorrinha; In memoriam aos meus amados avós paternos (Francisco Juvenal e Terezinha Bezerra) e tias Maria Isabel e Maria de Fátima. Carrego vocês no meu coração sempre! Aos meus avós maternos Maria Eliza e José Medeiros, vocês são o verdadeiro significado de amor e companheirismo, é um orgulho indescritível o que sinto por vocês! À toda família Medeiros e Moura pelo apoio e amor; Ao meu companheiro Bernardo Amorim. Nesse ano tão importante no nosso relacionamento eu não posso deixar de agradecer por tudo que passamos. Você que acompanhou de perto todas as frustrações e desânimos. Obrigada por nunca me deixar desistir e sempre acreditar no meu potencial mesmo quando eu não acreditei; À toda família Carvalho e Amorim por me tratar com tanto carinho e respeito, obrigada por sempre torcerem por mim! À todos que contribuíram direta ou indiretamente para a confecção desta dissertação meu muito obrigada! 8
9 I was taught that the way of progress is neither swift nor easy. Marie Curie 9
10 Uma nova lectina lactose-específica isolada do fungo Langermannia bicolor com propriedades antibiofilme Formado por uma complexa matriz de biopolímeros, a estrutura do biofilme bacteriano atua como uma estratégia de resistência frente a condições de estresses ambientais, incluindo por exemplo a imunidade do hospedeiro e ação de antibióticos. Esse problema tem intensificado a busca por moléculas com ação antibiofilme, como aquelas capazes de interferir na estrutura da matriz do biofilme e, assim, permitir a ação de fármacos antimicrobiano. Nesse cenário se destacam as lectinas, proteínas de origem não imune, capazes de se ligarem especificamente a carboidratos do biofilme. O objetivo deste trabalho foi isolar e caracterizar a lectina do basidiomiceto Langermannia bicolor (LLB) bem como avaliar o seu potencial aglutinante e antibiofilme bacteriano. A LLB foi isolada após uma separação por cromatografia de troca catiônica e gel filtração, e se mostrou específica para lactose e dependente de Ca +2, a alta estabilidade em uma ampla faixa de valores de ph e temperatura. A lectina não interferiu na viabilidade de hemácias humanas e linhagens de fibroblastos murinos (3T3). Apesar de LLB não apresentar atividade antibacteriana, a lectina foi capaz de aglutinar (interação dependente de seu domínio reconhecedor) e reduzir significativamente a biomassa de biofilme total, atuando na prevenção da formação do biofilme e no biofilme pré-formado de Staphylococcus aureus e Pseudomonas aeruginosa. Dessa forma, esses dados sugerem LLB como um futuro candidato de protótipo antibiofilme, no entanto mais estudos devem ser realizados para elucidar o mecanismo de ação, bem como sua possível combinação com antibióticos convencionais como estratégia terapêutica afim de reduzir o desenvolvimento da resistência bacteriana. Palavras-chave: Cogumelo; Proteínas; Domínio Reconhecedor de Carboidratos; Aglutinação; Biofilme; Bactérias. 10
11 A new lactose-binding lectin isolated from the fungus Langermannia bicolor with antibiofilm properties Constituted by a complex matrix of biopolymers, the structure of the bacterial biofilm acts as a strategy of resistance to environmental stress conditions, including for example host immunity and antibiotic action. This problem has intensified the search for molecules with antibiofilm action, such as those capable of interfering with the matrix structure of the biofilm and thus allowing the action of antibiotic drugs. In this context, the lectins, proteins of non-immune origin capable of binding specifically to biofilm carbohydrates, stand out. The aims of this work are isolate and characterize the lectin from the basidiomycete Langermannia bicolor (LLB) and evaluate its binding potential to bacteria and antibiofilm activity. LLB was isolated after separation with cation-exchange chromatography and gel filtration, showing specificity calcium-dependent to bind lactose, as well as high stability at different ph and temperatures values. LLB did not affect the human red blood cells and murine fibroblast strains (3T3) viability. Although LLB had no antibacterial activity, it was able to agglutinate (interaction dependent on its recognizing domain) and significantly reduce total biofilm biomass preventing early biofilm formation and preformed biofilm in Staphylococcus aureus and Pseudomonas aeruginosa. Moreover, these data suggest LLB as a future candidate for prototype antibiofilm, however further studies should be conducted to elucidate the mechanism of action as well as its possible combination with conventional antibiotics as a therapeutic strategy to reduce the development of bacterial resistance. Keywords: Mushroom; Proteins; Carbohydrate-Recognizing Domain; Agglutination; Biofilm; Bacteria. 11
12 LISTA DE FIGURAS Figura 1 - Biofilme multibacteriano...16 Figura 2 - Infecções por biofilmes bacterianos em superfícies abióticas e bióticas...18 Figura 3 - Lectinas com ação antibacteriana...23 Figura 4 - Lectinas capazes de aglutinar bactérias...27 Figura 5 - Lectinas que interagem com EPS desestabilizando o Biofilme...32 Figura 6 - Lectinas inibindo a adesão bacteriana na superfície...34 Figura 7 - Lectina do fungo Aleuria aurantia (código PDB 1UIC)...38 Figura 8 - Classificação taxônomica do fungo Langermannia bicolor...43 Figura 9 - Esquema de Extração e Fracionamento do fungo Langermannia bicolor...46 Figura 10 - Fluxograma das etapas de isolamento da lectina do fungo Langermannia bicolor...49 Figura 11 - Perfil cromatográfico da fração F1,0 em coluna CM Sepharose Fast Flow...59 Figura 12 - Cromatografia de exclusão molecular com Superdex 200 em sistema FPLC AKTA...61 Figura 13 - SDS-PAGE e PAGE de LLB...64 Figura 14 - Perfil cromatográfico de LLB em 280 nm em coluna de exclusão molecular HPLC...64 Figura 15 - Caracterização frente a presença de íons, diferentes temperaturas e ph...67 Figura 16 - Ensaio de aglutinação de bactérias gram-positiva e gram-negativa por LLB...70 Figura 17 - Quantificação total da biomassa do biofilme por cristal violeta em contato com LLB...72 Figura 18 - Avaliação do efeito hemolítico de diferentes concentrações de LLB...76 Figura 19 - Efeito de LLB sobre a viabilidade da linhagem celular 3T
13 LISTA DE TABELAS Tabela 1 - Lectinas capazes de aglutinar bactérias...24 Tabela 2 - Lectinas com atividade antibiofilme e seus respectivos mecanismos de ação...28 Tabela 3 - Dosagem proteica e recuperação do extrato bruto e frações acetônicas Tabela 4 - Unidades de hemaglutinação do extrato (E.B.) e frações de Langermannia bicolor...58 Tabela 5 - Avaliação das etapas de isolamento de LLB...62 Tabela 6 - Concentração Mínima de Carboidrato capaz de inibir a hemaglutinação de LLB
14 LISTA DAS PRINCIPAIS ABREVIATURAS E SIGLAS ADEL: lectina dos ovos da Aplysia dactylomela; ALL: lectina da esponja Aplysina lactuca; ANOVA: análise de variância; ATCC: do inglês american type culture collection; BCA: ácido bicinconínico, do inglês bicinchoninic acid; CCL: lectina da esponja Chondrilla caribensis; CDR: Domínio reconhecedor de carboidratos, do inglês carbohydraterecognition domain; CLSI: do inglês Clinical and Laboratory Standards Institute; CMHG: Caldo Mueller Hilton suplementado com glicose; CNPq: Conselho Nacional de Desenvolvimento Científico e Tecnológico; CM: Carboximetil; DEAE: Dietilaminoetil; DMEN: do inglês dulbecco s modified eagle s médium; DMSO: Dimetilsufóxido; DP: Desvio padrão; EDTA: ácido etilenodiamino tetra-acético, do inglês ethylenediamine tetraacetic acid; ELISA: Ensaio de imunoabsorção enzimática, do inglês enzyme-linked immunosorbent assay; ELLSA: Ensaio de imunoabsorção lectínica, do inglês lectin-linked immunosorbent assay; EPS: Substâncias poliméricas extracelular, do inglês extracellular polymeric substances; FITC: Isotiocianato de fluoresceína, do inglês Fluorescein isothiocyanate; FLBA: do inglês fluorescence lectin-binding analysis; FLBC: do inglês fluorescence lectin bar coding; FPLC: Cromatografia líquida rápida, do inglês fast protein liquid chromatography; HPLC: Cromatografia líquida de alta performance, do inglês high performance liquid chromatography; LLB: Lectina de Langermannia bicolor; 14
15 MIC: Concentração inibitória mínima, do inglês minimum inhibitory concentration; MTT: Brometo de 3-(4,5-dimetil-2-tiazolil)-2,5-difenil-tetrazólio; MWCO: Peso molecular retido, do inglês Molecular weight cut-off; NR: Não-retido da cromatografia de troca catiônica; PAGE: Eletroforese em gel de poliacrilamida, do inglês Polyacrylamide gel electrophoresis; PBS: Tampão fosfato-salino, do inglês phosphate buffered saline; PDB: Banco de dados de proteínas, do inglês protein data bank; RMN: Ressonância magnética nuclear; RPM: Rotações por minuto; RPMI: do inglês Roswell Park Memorial Institute; SDS: dodecil sulfato de sódio, do inglês sodium dodecyl sulfate; TBS: Tampão Tris HCl salino; UH: Unidade de Hemaglutinação; UFC: Unidades formadoras de colônia; UFRN: Universidade Federal do Rio Grande do Norte; WGA: lectina comercial de Triticum vulgaris; 15
16 SUMÁRIO 1. INTRODUÇÃO Fundamentação Teórica Biofilme Bacteriano Lectinas Atividade Antibacteriana Aglutinação de Bactérias Ação Antibiofilme Inibição da Aderência Bacteriana Aplicações Biotecnológicas em Bactérias e Biofilmes Lectinas de Fungos Basiodiomicetos OBJETIVOS Objetivo Geral Objetivos Específicos MATERIAIS E MÉTODOS Equipamentos Reagentes Materiais Biológicos Fungo Eritrócitos Bactérias Linhagens Celulares Métodos Isolamento da Lectina Caracterização da Lectina Ensaios Biológicos Análises Estatísticas RESULTADOS E DISCUSSÃO Isolamento da Lectina (LLB) Caracterização da Lectina Atividade Antibacteriana e Aglutinação de Bactérias Ação Antibiofilme de LLB Citotoxicidade CONCLUSÃO REFERÊNCIAS
17 1. INTRODUÇÃO Os tratamentos de infecções bacterianas por uso de antimicrobianos estão se tornando cada vez menos efetivos devido ao aumento da resistência microbiana frente a esses fármacos (TARASZKIEWICZ et al., 2013). Parte desse aumento ocorre devido à formação de uma comunidade microbiana séssil, conhecida como biofilme, que confere resistência aos tratamentos com antimicrobianos cerca de vezes maior do que a forma livre da mesma bactéria (LI; LEE, 2017). O biofilme é uma estratégia de resistência associada com 80% das infecções microbianas crônicas (BRACKMAN; COENYE, 2015; JAMAL et al., 2017; LI; LEE, 2017). O cenário atual consiste na ausência de fármacos direcionados especificadamente para as bactérias presentes no biofilme e poucas opções terapêuticas estão disponíveis na prática clínica (BJARNSHOLT; CIOFU; GIVSKOV, 2013; VUOTTO; DONELLI, 2019). Motivados por essa questão, na última década, pesquisadores investiram em novas estratégias para solucionar infecções por biofilme, principalmente através da procura por agentes antibiofilme (RABIN et al., 2015). Na busca por novos compostos que impeçam a formação de biofilme de bactérias patogênicas, alguns trabalhos com extratos e óleos essenciais de plantas, polissacarídeos, peptídeos e proteases estão se destacando na ciência (FIRMINO et al., 2018; GRECKA et al., 2019; LU et al., 2019; TRENTIN et al., 2011). Entre essas, as lectinas têm mostrado serem promissoras para inibição de biofilmes patogênicos (PROCÓPIO et al., 2017a). Por serem proteínas de origem ubíqua na natureza, com capacidade de se ligar reversivelmente a carboidratos, as lectinas podem interagir com a parede celular de bactérias e com seus glicanos extracelulares, o que pode aprimorar o estudo de possíveis estratégias de biomarcação e inibição de biofilme através de sua especificidade (MBAE; UMESHA; MANUKUMAR, 2018). Lectinas com atividade antibiofilme possuem habilidades como alterar a viabilidade celular bacteriana, interagir com constituintes presentes na matriz exopolimérica do biofilme, interromper a polimerização e inibir sinais do sistema 17
18 quórum-sensing (QS) (FERREIRA et al., 2018). Esses mecanismos de ação não estão relacionados necessariamente a uma atividade antibacteriana. Algumas lectinas, mesmo não possuindo ação bactericida direta, podem combater a formação e/ou inibir o biofilme previamente formado (SANTOS SILVA et al., 2019). 1.1 Fundamentação Teórica Biofilme Bacteriano Os biofilmes estão presentes em todas as superfícies conhecidas e 90% dos microorganismos do mundo sobrevivem dispostos em biofilme (PETROVA; SAUER, 2012), presentes principalmente em ciclos biogeoquímicos do solo, água, sedimentos e superfícies ambientais (FLEMMING et al., 2016). Biofilme é uma complexa organização microbiana na qual uma comunidade bacteriana está incorporada a uma matriz produzida pelas próprias bactérias contendo substâncias poliméricas extracelulares (EPS) como polissacarídeos, DNA e proteínas (Figure 1) (KUMAR et al., 2017). Figura 1 - Biofilme Multibacteriano. Esquema do biofilme maduro em superfície abiótica, representando populações de diferentes bactérias e a substância polimérica extracelular (EPS), constituída de carboidratos, proteínas e DNA extracelular. Fonte: Imagem elaborada pela própria autora. 18
19 Os estágios do desenvolvimento do biofilme se iniciam pelo processo de fixação das células em uma superfície biótica ou abiótica (PAHARIK; HORSWILL, 2016). Esses microrganismos começam a viver em um "microcolônia" possuindo diferentes espécies de bactérias. Ser uma estrutura multibacteriana pode ter importantes vantagens ecológicas: por possuir mais de uma espécie de bactéria o processo de fixação em superfície é favorecido, além de proporcionar maior resistência ao biofilme (BATTIN et al., 2016). A formação desse consórcio bacteriano, se inicia como biofilme nascente (com poucas células aderidas) e ao longo do tempo - através de sua estruturação - passa a ser um biofilme maduro. Em sua forma madura, pode ocorrer dispersão permitindo a colonização de novos ambientes (LIU et al., 2016). Seu estágio maduro permite resistência aos tratamentos antimicrobianos e à imunidade do hospedeiro. Isso os torna capazes de tolerar intensos estresses exógenos em ambientes naturais, industriais e clínicos (MOURA; CASSANDRA; BARROSO, 2017). Nos mais diferentes setores da indústria, incluindo a alimentícia, o biofilme está relacionado a altos prejuízos devido a processos como a biocorrosão e contaminação de materiais (PAHARIK; HORSWILL, 2016). Mas são as infecções humanas de caráter crônico e nosocomiais provocadas por biofilme que mais estimulam o atual cenário na procura de moléculas antibiofilme (RABIN et al., 2015). Além de estarem relacionados a vários tipos de infecções humanas, como a urinária, endocardite, fibrose cística e placa dentária (LEBEAUX et al., 2013), os biofilmes também podem colonizar uma ampla variedade de dispositivos médicos, como cateteres e próteses (VUOTTO; DONELLI, 2019) (Figura 2). A suscetibilidade humana à colonização bacteriana nesses casos ocorre devido à redução da eficácia do sistema de defesa imunológica na interface tecidoimplante, o que prejudica a recuperação e cicatrização do tecido (ARCIOLA; CAMPOCCIA; MONTANARO, 2018). 19
20 Figura 2 Infecções por biofilmes bacterianos em superfícies abióticas e bióticas. Em azul e ao lado esquerdo da figura alguns exemplos de infecções por biofilme em dispositivos médicos. As caixas de texto vermelhas e ao lado direito da figura temos exemplos de infecções por biofilme em tecidos biológicos humanos. Figura adaptada de Lebeaux et al e desenvolvida com arcabouços fornecidos pelo SMART (SMART - servier medical ART) e Google Imagens. Apenas nos Estados Unidos, o custo anual de cuidados médicos relacionados à infecções varia de 25 a 45 bilhões de dólares. Esses gastos exorbitantes são reflexo do tratamento dessas doenças, nas quais medicamentos convencionais, como antibióticos, são insatisfatórios na erradicação de infecções bacterianas mediadas por biofilme (NEETHIRAJAN; CLOND; VOGT, 2014). Cerca de 25,6% dessas infecções são provenientes de implantes médicos (ARCIOLA; CAMPOCCIA; MONTANARO, 2018). Biofilmes em dispositivos médicos para serem erradicados geralmente requerem remoção cirúrgica e longa antibioticoterapia; e se o biofilme não for tratado adequadamente, pode resultar em infecções recalcitrantes com alto impacto clínico (SHIH, 2019; TONG et al., 2015). As espécies Staphylococcus aureus e Staphylococcus epidermidis são exemplos de bactérias cuja colonização desencadeia infecção em implantes e cateteres (intra e extravasculares) associados a mucosas (BAIDAMSHINA et al., 2017). Ambas espécies apresentam altas taxas de resistência a antibióticos (LI; WEBSTER, 2018). As terapias convencionais com antibióticos para erradicação do biofilme são ineficientes, pois são necessárias altas concentrações desses 20
21 medicamentos para que sejam efetivos, aumentando assim a toxicidade e os efeitos colaterais na saúde humana (PETROVA; SAUER, 2012). Os mecanismos de ação de antibióticos no biofilme diferem dos mecanismos já elucidados na forma livre bacteriana (SHARMA; MISBA; KHAN, 2019). As propriedades de resistência a antibióticos no biofilme são classificadas como emergentes e não são previsíveis a partir do estudo de células bacterianas planctônicas (FLEMMING et al., 2016). Por ser frequentemente um agregado polimicrobiano, o biofilme possui uma alta densidade bacteriana (> 10⁷ UFC/ ml), dificultando o tratamento com antibióticos, uma vez que existe uma relação entre alta densidade e uma maior concentração inibitória mínima para vários antibióticos (PLETZER; MANSOUR; HANCOCK, 2018; UDEKWU et al., 2009). Parte da resistência do biofilme ocorre devido à sua matriz de substâncias poliméricas extracelulares (EPS), consistindo principalmente de polissacarídeos, proteínas, lipídios e ácidos nucleicos. Contribuindo principalmente para a dinâmica do biofilme de agregação, adesão e coesão das células bacterianas, além de fonte de nutrientes e água, a matriz confere uma barreira de proteção a agentes externos (FLEMMING; WINGENDER, 2010). A organização espacial e a estabilidade da matriz geram gradientes complexos de nutrientes, promovendo uma diversidade de habitats, além da retenção e difusão de oxigênio (GIAOURIS et al., 2015). A alta heterogeneidade biológica e físico-química do biofilme promove sua estruturação em diferentes gradientes, onde as camadas superiores e externas são compostas por bactérias de crescimento mais rápido, enquanto as internas apresentam crescimento mais lento. Dentro do biofilme, a lenta taxa de crescimento de bactérias está relacionada a uma maior tolerância a alguns antibióticos (EVEN et al., 2017). Todas as informações recentes sobre o biofilme são geradas graças ao uso de técnicas como imagens ópticas de biofilme com resolução de célula única, no qual é possível avaliar o interior do biofilme, bem como analisar toda a sua estrutura 3D. Foi possível elucidar as transições arquitetônicas durante o crescimento do biofilme em que ocorre a multiplicação de bactérias e a secreção de EPS (DRESCHER et al., 2016). 21
22 Metodologias como essas contribuem para o estudo de novos compostos que possam interromper a interação entre o microrganismo e a matriz extracelular promovendo a desestabilização do biofilme - tornando o microorganismo frágil e suscetível à ação do sistema imunológico do hospedeiro ou mesmo possibilitando a eficácia dos antibióticos (LI; LEE, 2017). Dessa forma, um grande obstáculo no combate à formação de biofilme é que alguns são benéficos para a fisiologia humana, como aqueles com bactérias comensais na pele e no intestino. Assim, é necessário que os tratamentos antibiofilme sejam muito específicos para as bactérias patogênicas (NEETHIRAJAN; CLOND; VOGT, 2014). Visando essa especificidade, dentre as biomoléculas utilizadas no combate a bactérias e biofilmes estão as proteínas conhecidas como lectinas Lectinas A palavra lectina é derivada do latim legere que significa para escolher ou selecionar e foi introduzida inicialmente em 1954 pelos cientistas Boyd e Shapleigh (GHAZARIAN; IDONI; OPPENHEIMER, 2011). As lectinas são proteínas caracterizadas pela presença de, pelo menos, um domínio não catalítico de reconhecimento de carboidratos (CDR, do inglês carbohydraterecognition domain). Por meio de forças intermoleculares como ligações de hidrogênio, interações hidrofóbicas e eletrostáticas, as lectinas interagem com glicanos simples e / ou complexos com afinidade e especificidade, sem alteração na estrutura covalente do açúcar (HAMID et al., 2013; VAN HOLLE et al., 2017). Ubíquas na natureza, com alta diversidade e especificidade para diferentes carboidratos, o estudo desse tipo de proteína abrange os mais diferentes organismos e potencializa a busca de novas atividades biológicas (FERNÁNDEZ-ALONSO et al., 2012). A classificação das lectinas pode ser baseada em suas estruturas globais, como é o caso das denominadas: merolectinas, hololectinas, quimerolectinas e superlectinas. E também podendo ser categorizadas em diferentes famílias com base em suas especificidades, como é o caso das famílias: lectinas de leguminosas, proteínas inativadoras de ribossomos do tipo II, lectinas de 22
23 monocotiledôneas ligadoras de manose e entre outras famílias (HAMID et al., 2013; SANTOS SILVA et al., 2019). O maior número de lectinas caracterizadas são as encontradas em plantas, mas também existem as descritas em animais, insetos, vírus, fungos e bactérias (DANG; DAMME, 2015). Uma ampla variedade de processos biológicos estão atreladas às lectinas desses organismos, podendo atuar na defesa frente a patógenos e predadores, reconhecimento e adesão celular, interações célula-célula e célula-matriz, entre outras ações (DE SCHUTTER; VAN DAMME, 2015). Além disso, propriedades biológicas heterológas associadas a ações antivirais, antiparasitárias, anti-inflamatórias, antitumorais e antimicrobianas são amplamente estudadas e atribuídas a lectinas das mais diversas fontes (MAZALOVSKA; KOUOKAM, 2018). A atividade antibacteriana, por exemplo, é uma ação que está associada ao sistema de defesa do organismo; em que o papel crucial da lectina é o reconhecimento específico de carboidratos presentes na superfície celular do microrganismo (CHEN et al., 2018). A interação de lectinas com carboidratos de superfície bacteriana pode prejudicar o crescimento e o desenvolvimento, bem como a mobilidade, bloqueando os locais de ligação das bactérias às células hospedeiras. Essa interação pode alterar a estrutura da bactéria e a permeabilidade de sua membrana (GAIDAMASH; STADEN, 2002) Atividade Antibacteriana Na literatura são relatadas lectinas com potencial antibacteriano purificadas dos mais diferentes organismos, como por exemplo: peixes (ARASU et al., 2017; LIU et al., 2019; MACIEL CARVALHO et al., 2012; OLAYEMI; ADENIKE; DAVID AYIN, 2015), plantas (HASAN; OZEKI; KABIR, 2014; KARNCHANATAT, 2012; PROCÓPIO et al., 2017a; SAHA et al., 2014; SILVA et al., 2019), fungos (CHANDRASEKARAN et al., 2016; CHITTARAGI et al., 2013; ERJAVEC et al., 2016; SINGH; KAUR; SINGH, 2014), bactérias (ABDULLAH; IDRIS; SAPARON, 2017; PETROVA et al., 2016), esponjas (CARNEIRO et al., 23
24 2017a, 2019; FENTON et al., 2013; HASAN; OZEKI, 2019; HUNG et al., 2018; MARQUES et al., 2018), bivalves (SHEN et al., 2018), humanos (MUKHERJEE et al., 2014), caranguejos (FANG et al., 2016; ISWARYA; ANJUGAM; VASEEHARAN, 2017; JAYANTHI et al., 2017), caramujos (DOMENECH; GARCÍA, 2017), insetos (VELAYUTHAM et al., 2017), dentre outros documentados. Desta forma, vários estudos sobre as propriedades antibacterianas das lectinas foram publicados nos últimos anos. Foram relatados na literatura como resultado da interação de lectinas e superfície bacteriana: ação antibacteriana, uma vez que promovem inibição do crescimento, bloqueio da mobilidade bacteriana, dano à integridade celular e alterações na adesão celular microbiana e na permeabilidade da membrana (COELHO et al., 2018b; DIAS et al., 2015; PROCÓPIO et al., 2017b). Apesar das elucidações estruturais e bioquímicas dessas lectinas, alguns pontos de sua atividade antibacteriana ainda não são claros, tornando a aplicação para a síntese de novos medicamentos pouco explorada (ABDULLAH; IDRIS; SAPARON, 2017). Uma possível explicação dada pelos pesquisadores para tal atividade seria a interação de lectinas com a parede celular bacteriana e / ou glicanos extracelulares (CÂNDIDO et al., 2011; DANG; DAMME, 2015; KARNCHANATAT, 2012). Uma ampla diversidade de carboidratos bacterianos da superfície celular já é conhecida e amplamente estudada, como os lipopolissacarídeos encontrados em bactérias Gram-negativas e peptidoglicanos, que contêm ligações β(1-4) entre resíduos de ácido N- acetilmurâmico alternados com N-acetilglucosamina, tanto em Gram-negativas como em Gram-positivas (LANNOO; VAN DAMME, 2014). As ligações de hidrogênio e interações hidrofóbicas entre lectinas e componentes da parede celular foram documentadas através da análise da atividade antibacteriana de lectinas em bactérias Gram-positivas e Gramnegativas (PAIVA et al., 2010). Prova disso, por exemplo, é o efeito bacteriostático da lectina da esponja Halichondria okadai através de sua interação com lipopolissacarídeos e peptideoglicanos (HASAN; OZEKI, 2019). 24
25 O efeito bactericida promovido por lectinas podem causar a formação de poros na membrana bacteriana, conhecida como um dos mecanismos antibacterianos que permitem a ruptura da barreira de impermeabilização da membrana e, consequentemente, a morte da bactéria (Figura 3) (SILVA et al., 2019). Essa ação já está bem documentada para as lectinas dependentes do íon cálcio de humanos, conhecidas como lectinas do tipo C (MUKHERJEE et al., 2014). Figura 3 Lectinas com ação antibacteriana. Representação de uma ação antibacteriana promovida pelas lectinas, alterando neste caso a permeabilidade celular levando à morte da bactéria. Fonte: Imagem elaborada pela própria autora. Outro exemplo é a lectina purificada da semente de Moringa oleifera, que exibiu atividade antibacteriana para Serratia marcescens através da perda da integridade da membrana bacteriana e forte ligação a proteínas intracelulares de maneira dose dependente (MOURA et al., 2017). Uma outra lectina, da planta Alpinia purpurata (Apul), inibiu crescimento de S. aureus e prejudicou sua viabilidade celular por danos na divisão celular, já com S. aureus resistente à oxacilina, Apul afetou a viabilidade celular através de alterações estruturais e vazamento de proteínas (FERREIRA et al., 2018). 25
26 Já a lectina purificada das sementes de Apuleia leiocarpa, ao reconhecer um receptor específico da membrana bacteriana, foi capaz de induzir alterações estruturais capazes de comprometer o metabolismo da bactéria e justificar sua ação antibacteriana (CARVALHO et al., 2015). O bloqueio da entrada de nutrientes na célula bacteriana, causada pela lectina derivada da hemolinfa do caranguejo Portunus pelagicus, é outro exemplo de mecanismo que interfere na manutenção do status metabólico das bactérias (JAYANTHI et al., 2017). Outra estratégia de uso de lectinas envolve a sua interação de forma cruzada com os carboidratos presentes na superfície da bactéria agregando-as Aglutinação de Bactérias Graças à presença de mais de um domínio reconhecedor de carboidratos (CDR) nas lectinas, é possível ocorrer interações cruzadas entre bactérias, aglutinando-as, de forma a imobilizar essas células (COSTA et al., 2010). A aglutinação tornou-se um processo fundamental para a evolução de lectinas nos mecanismos de defesa de plantas e animais. Prevenindo o movimento e a dispersão de patógenos, a aglutinação leva à ação de mecanismos antibacterianos sinérgicos que podem atingir o maior número possível de bactérias (MELO et al., 2014; MOURA et al., 2015; VELAYUTHAM et al., 2017). Alguns exemplos de lectinas de diferentes fontes com capacidade de aglutinar distintas espécies de bactérias são demonstrados na tabela 1. Tabela 1 Lectinas capazes de aglutinar bactérias. Animal Fonte Especificidade Espécie de bactéria Referência Aplysina fulva Mucina Escherichia coli (CARNEIRO (esponja marinha) (Glicoproteína) Staphylococcus aureus et al., 2019) Glucose Etroplus Vibrio /N-Acetil- (RUBEENA suratensis parahaemolyticus Glucosamina/ et al., 2019) (peixe) Aeromonas hydrophila Manose Oplegnathus punctatus (peixe) Manose Escherichia coli Staphylococcus aureus Bacillus subtilis Aeromonas hydrophila Vibrio anguillarum Edwardsiella tarda (LIU et al., 2019) 26
27 Animal Chondrilla caribensis (esponja marinha) Fasciospongia cavernosa (esponja marinha) Oreochromis niloticus (peixe) Sinonovacula constricta (bivalve) Aplysina lactuca (esponja marinha) Aplysia dactylomela (lebre-do-mar) Mytilus californianus (mexilhão) Oryctes rhinoceros (besouro) Spodoptera exígua (traça) Eriocheir sinensis (caranguejo) Clarias gariepinus (bagre) Lactose /Lactulose Mucina/Fetuína (Glicoproteínas) Galactose /N-Acetil- Galactosamina Manose /Fucose Galactose Lactose /Lactulose Mucina (Glicoproteína) Ácido Galacturônico / N-Acetil- Galactosamina/ Metil- Galactopiranosíde o Galactose /N-Acetil- Galactosamina Galactose /Lactose Mucina /Tiroglobulina (Glicoproteínas) N-Acetil- Galactosamina Manose /Galactose Galactose Staphylococcus aureus Staphylococcus epidermidis Escherichia coli Bacillus subtilis Pseudomonas aeruginosa Staphylococcus aureus Streptococcus agalactiae Aeromonas hydrophila Escherichia coli Vibrio parahaemolyticus Vibrio harvey Vibrio anguillarum Micrococcus luteus Staphylococcus aureus Escherichia coli Staphylococcus aureus Lactobacillus plantarum Escherichia coli Bacillus subtilis Bacillus pumilus Escherichia coli Pseudomonas aeruginosa Bacillus cereus Staphylococcus aureus Aeromonas hydrophila Alcaligenes faecalis Klebsiella edwardsii Vibrio metschnikovii (MARQUES et al., 2018) (SADANAN DAN; RAUF, 2018) (MU et al., 2018) (SHEN et al., 2018) (CARNEIRO et al., 2017a) (CARNEIRO et al., 2017b) (GARCÍA- MALDONA DO; CANO- SÁNCHEZ; HERNÁND EZ- SANTOYO, 2017) (VELAYUT HAM et al., 2017) (GASMI; FERRÉ; HERRERO, 2017) (FANG et al., 2016) (OLAYEMI; ADENIKE; DAVID AYIN, 2015) 27
28 Holothuria grisea (pepino-do-mar) Galactose /Lactose/ Metil- Galactopiranosíde o/ N-Acetil- Galactosamina Escherichia coli (MELO et al., 2014) Animal Litopenaeus vannamei (camarão) Mucina (Glicoproteína) N- Acetil- Glucosamina /N-Acetil- Galactosamina/Ác ido N-Acetil- Neuramínico Vibrio auguillarum Edwardsiella tarda (SUN et al., 2008) Plantas Momordica charantia (melão São Caetano) Kaempferia rotunda (Cananga-do- Japão) Myracrodruon urundeuva (aroeira) Eugenia uniflora (pitangueira) Canavalia ensiformis (feijãode-porco) Mucina/Fetuína (Glicoproteínas) Galactose Metil- Manopiranosídeo/ Manose /Metil- Glucopiranosídeo N-Acetil- Glucosamina Caseína/Fetuína (Glicoproteinas) Manose /Glucose Staphylococcus aureus Listeria monocytogenes Escherichia coli Salmonella enteritidis Bacillus subtilis Shigella sonnei Klebsiella sp. Salmonella typhi Staphylococcus aureus Staphylococcus aureus Streptococcus sp. Klebsiella sp. Pseudomonas aeruginosa Fucose Tetragonolobus Helicobacter pylori purpureus N- Acetil- (aspargo ervilha) Glucosamina/N- Acetil-Ácido Triticum vulgaris Neuramínico (trigo) Fonte: autoria própria, com base nas referências citadas. (KABIR et al., 2015) (KABIR et al., 2011) (SÁ et al., 2009) (OLIVEIRA et al., 2008) (KHIN et al., 2000) A aglutinação das bactérias reduz o número desses microorganismos que podem aderir à superfície biótica e/ou abiótica, apoiando estudos nos quais ocorre a inibição da formação de biofilme, em vez da redução do crescimento bacteriano (Figura 4) (VASCONCELOS et al., 2014). 28
29 Figura 4 Lectinas capazes de aglutinar bactérias. A aglutinação de bactérias pelas lectinas ocorre principalmente devido ao domínio de reconhecimento de carboidratos (CDR) presente nas lectinas, permitindo a interação cruzada com os carboidratos da superfície bacteriana. Fonte: imagem elaborada pela própria autora. Um exemplo mostrado na tabela de lectinas aglutinantes de bacterias com atividade antibiofilme, é da lectina isolada de ovos de Aplysia dactylomela, a lectina galactofílica denominada ADEL foi eficiente na inibição do biofilme pela formação de agregados bacterianos, o que diminuiu o número de possíveis células aderentes e não apresentou efeito bacteriostático (CARNEIRO et al., 2017b) Ação Antibiofilme Com base no reconhecimento de carboidratos bacterianos pelas lectinas, é possível avaliar a ação dessas proteínas na inibição da formação e desenvolvimento de biofilmes bacterianos. Nas análises in vitro, através do monitoramento colorimétrico por espectrofotômetro usando cristal violeta em microplacas, é possível quantificar a formação de biofilme (COELHO et al., 2018a). 29
30 Estudos com lectinas como possíveis ferramentas antibiofilme estão evoluindo e a elucidação de seus mecanismos de ação estão progredindo com o avanço das pesquisas. Como no caso da lectina purificada do veneno de Bothrops jararacussu que foi capaz de inibir o biofilme de S. aureus e S. epidermidis e um dos mecanismos propostos pelos autores seriam possíveis interações entre carboidratos bacterianos e domínio CDR da lectina (KLEIN; FABRES-KLEIN; OLIVEIRA, 2015). No entanto, em um artigo mais recente, Klein et al. demonstram que a atividade antibiofilme desta lectina chamada BJcuL não depende de seu domínio de reconhecimento de carboidratos como tinha sido proposto em 2015 mas que a lectina foi capaz de modular a expressão de genes de S. aureus envolvidos na formação de biofilme (KLEIN et al., 2019). Outros exemplos de lectinas antibiofilme e seus mecanismos de ação até o momento estão descritos na Tabela 2. Tabela 2 Lectinas com atividade antibiofilme e seus respectivos mecanismos de ação. Animal Fonte Aplysina fulva (esponja marinha) Bothrops jararacussu (jararacuçu) Etroplus suratensis (peixe) Metapenaeus monóceros (camarão) Fasciospongia cavernosa (esponja marinha) Especificidade Mucina (Glicoproteína) Galactose Glucose/N-Acetil- Glucosamina /Manose Arabinose/Dextro se/raminose/n- Acetil- Glucosamina/ Fucose/Manose Galactose/N- Acetil- Galactosamina Mecanismo Proposto Alterando a expressão gênica ou interrompendo moléculas QS; Redução na expressão de genes envolvidos na formação de biofilme; Perturbando a estrutura do biofilme; Prejudicando a arquitetura do biofilme; Agregação bacteriana diminuindo o número de células aderentes; Espécie Escherichia coli Staphylococcus aureus Staphylococcus epidermidis Staphylococcus aureus Staphylococcus epidermidis Vibrio parahaemolytic us Aeromonas hydrophila Aeromonas hydrophila Staphylococcus aureus Vibrio parahaemolytic us Enterococcus faecalis Klesbsiella pneumoniae Escherichia coli Pseudomonas aeruginosa Referência (CARNEIRO et al., 2019) (KLEIN et al., 2019) (RUBEENA et al., 2019) (PREETHA M et al., 2019) (SADANAN DAN; RAUF, 2018) 30
31 Animal Chondrilla caribensis (esponja marinha) Aplysina lactuca (esponja marinha) Aplysia dactylomela (lebre-do-mar) Portunus pelagicus (caranguejo) Punica granatum (romãzeira) Lactose/Lactulose Mucina/Fetuína (Glicoproteínas) Lactose/Lactulose Mucina (Glicoproteína) Ácido Galacturônico / N-Acetil- Galactosamina/ Metil- Galactopiranosíde o Manose NI NI Diminuição do número de bactérias aderentes por agregação bacteriana; Diminuição de células aderentes através da agregação bacteriana; Deteriorando a matriz EPS do biofilme; Envolvida com ligações com a parede celular e/ou glicoconjugados da membrana bacteriana; Staphylococcus aureus Staphylococcus epidermidis Escherichia coli Staphylococcus aureus Escherichia coli Staphylococcus aureus Citrobacter amalonatius Proteus vulgaris Pseudomonas aeruginosa Vibrio parahaemolytic us Staphylococcus aureus Marques et al. (MARQUES et al., 2018) Carneiro et al. (CARNEIRO et al., 2017a) (CARNEIRO et al., 2017b) (JAYANTHI et al., 2017) (MICHELLE et al., 2019) Alpinia purpurata (alpínia) Fetuína/ Ovoalbumina (Glicoproteínas) NI Staphylococcus aureus (FERREIRA et al., 2018) Plantas Calliandra surinamensis (arbusto) Moringa oleífera (acácia branca) Manose/Glucose Fetuina/ Ovoalbumina/ Albumina (Glicoproteínas) Frutose NI Limitando o número e crescimento de bactérias capazes de formar biofilme; Staphylococcus saprophyticcus Staphylococcus aureus Serratia marcescens Bacillus sp. (PROCÓPIO et al., 2017a) (MOURA et al., 2017) Litchi chinensis (lichieira) Glucose/Manose NI Pseudomonas aeruginosa (BOSE et al., 2016) Bryothamnion seaforthii (alga) Bauhinia bauhinioides (unha-de-gato) Cratylia floribunda (cipó prata) NI NI NI Formação de agregados que causam o decréscimo no número de células aderentes; Staphylococcus aureus Klebsiella oxytoca (VASCONC ELOS et al., 2014) 31
32 Plantas Bactéria Solanum tuberosum (batata) Bauhinia variegate (casco-de-vacalilás) Canavalia marítima (feijão-da-praia) Canavalia boliviana (feijão) Canavalia marítima (feijão-da-praia) Canavalia ensiformis (feijão-deporco) Canavalia ensiformis (feijão-deporco) Trigonella foenumgraecum (feno-grego) Triticum aestivum (trigo) Arachis hypogaea (amendoim) Cajanus cajan (ervilha-depombo) Phaseolus vulgaris (feijão comum) Pisum sativum (ervilha) Acinetobacter baumannii (bactéria Gramnegativa) Quitotriose Galactose Maltose/Trealose Glucose Maltose/Trealose Manose/Glucose Manose/Glucose Manose/Glucose N-Acetil- Glucosamine Galactose/ N- Acetil- Glucosamina Manose/Glucose N-Acetil- Glucosamina Manose/Glucose NI Interação com moléculas da matriz impedindo a polimerização; Inibição da adesão inicial da bactéria; Redução na expressão gênica de genes envolvidos na regulação da adesão e formação de biofilme; Formação de agregados bacterianos diminuindo o número de células aderentes; Alteram o arranjo de adesão das bactérias; Alterando a expressão gênica ou interropendo moléculas de QS responsáveis pela manutenção do biofilme; Pseudomonas aeruginosa Streptococcus mutans Streptococcus sanguis Streptococcus sobrinus Streptococcus mutans Streptococcus mutans Streptococcus mutans Enterococcus faecalis Klebsiella pneumoniae Pseudomonas aeuroginosa NI Não Informado; Fonte: autoria própria, com base nas referências citadas. QS Quorum-Sensing (HASAN; OZEKI; KABIR, 2014) Klafke et al. (KLAFKE; BORSUK; GONC, 2013) Cavalcante et al. (CAVALCA NTE et al., 2011, 2013) (CAVALCA NTE et al., 2011) (ISLAM et al., 2009) (ABDULLA H; IDRIS; SAPARON, 2017) 32
33 Uma das dificuldades apontadas pelos pesquisadores para eliminar o biofilme é que as moléculas antibacterianas são incapazes de penetrar no biofilme de forma que acabam presas na matriz extracelular (PROCÓPIO et al., 2017a). Com base nisso, alguns trabalhos enfatizam lectinas que não possuem atividade antibacteriana mas que têm ação antibiofilme (BOSE et al., 2016; CARNEIRO et al., 2017b, 2017a, 2019; KLAFKE; BORSUK; GONC, 2013; MARQUES et al., 2018; PROCÓPIO et al., 2017a). Por outro lado, algumas lectinas com atividade antibacteriana também demonstraram ação antibiofilme, uma vez que aquelas que promovem danos à parede celular e à membrana bacteriana por interação com glicanos superficiais podem ser responsáveis por prejudicar o desenvolvimento do biofilme (ABDULLAH; IDRIS; SAPARON, 2017; FANG et al., 2016; FERREIRA et al., 2018; MICHELLE et al., 2019; MOURA et al., 2017; SADANANDAN; RAUF, 2018). Além disso, outros mecanismos podem estar associados à inibição do biofilme, como o impedimento estérico causado pelas lectinas bloqueando as interações entre polissacarídeos de bactérias com a superfície biótica / abiótica ou com outras bactérias (ISLAM et al., 2009; JIN; LEE; HONG, 2018). A interação com os constituintes da matriz pode prejudicar a polimerização e o desenvolvimento do biofilme (Figura 5), como ocorreu com a lectina StL-20, capaz de inibir o biofilme de P. aeruginosa (HASAN; OZEKI; KABIR, 2014). 33
34 Figura 5 - Lectinas que interagem com o EPS desestabilizando o Biofilme. A interação com a matriz exopolimérica do biofilme é um dos mecanismos da atividade antibiofilme das lectinas e, portanto, pode dificultar a polimerização e a estabilidade da comunidade bacteriana. Fonte: imagem elaborada pela própria autora. Mudanças na arquitetura do biofilme pela ação das lectinas em biofilmes pré-formados contribuem para a fragilização de sua estrutura. Semelhante ao que ocorreu com a lectina Trigonella foenumgraecum, capaz de interferir no EPS de S. mutans - envolvido em cárie dentária - cujo suposto mecanismo de ação, proposto pelos autores, seria sua interação com moléculas da superfície bacteriana responsáveis pela manutenção e integridade estrutural do biofilme (ISLAM et al., 2009). Outras ações como alterações na expressão gênica também estão relacionadas às ações das lectinas. A ConM, lectina de Canavalia maritima, por exemplo, contribuiu para redução da expressão de genes codificantes de enzimas associadas à adesão superficial, bem como prejudicou a formação e desenvolvimento do biofilme de Streptococcus mutans (CAVALCANTE et al., 2013). Dentre as diferentes fontes bibliográficas de lectinas com ação antibiofilme, destaca-se um trabalho sobre a inibição do biofilme pela lectina da bactéria Acinetobacter baumannii. Este foi o primeiro e único estudo encontrado em que uma lectina bacteriana inibiu a formação de biofilme de bactérias intimamente relacionadas, presumindo que sua ação ocorra através da 34
35 expressão gênica alternada ou comprometendo o sinal molecular responsável pelo síntese do biofilme. As lectinas que atuam como inibidores do biofilme também podem realizar ações semelhantes a uma molécula surfactante, podendo modificar características físicas de superfícies abióticas e bacterianas (ABDULLAH; IDRIS; SAPARON, 2017). Inibir a adesão das bactérias como essa citada permite um efeito de prevenção da consolidação do biofilme, uma vez que, a adesão bacteriana é a primeira etapa para sua formação Inibição da Aderência Bacteriana Para a adesão celular, são necessárias interações moleculares, que podem ser específicas, como reconhecimento químico-estrutural; ou inespecíficas, como ligações de hidrogênio, interações hidrofóbicas e eletrostáticas, entre outras (EVEN et al., 2017). A adesão bacteriana possui dois estágios: o primeiro é a fixação primária inespecífica e reversível, e o segundo estágio é a adesão irreversível e específica (ARCIOLA; CAMPOCCIA; MONTANARO, 2018). A terapia antiadesiva bloqueia a ligação de bactérias à superfície da célula hospedeira ou dispositivo médico, e este é um mecanismo importante para prevenir e tratar doenças infecciosas bacterianas (ASADI et al., 2019). O uso de lectinas purificadas para prevenir a formação de biofilme tem sido utilizado como estratégia antiadesiva em superfícies bióticas e / ou abióticas, impedindo a adesão de bactérias e, consequentemente, o desenvolvimento do biofilme (Figura 5) (CAVALCANTE et al., 2013; VASCONCELOS et al., 2014). Um exemplo encontrado foi a lectina da Moringa oleifera, que foi imobilizada em uma superfície de vidro sendo capaz de impedir a formação de biofilme das bactérias de S. marcescens e impedindo a adesão em Bacillus sp. (MOURA et al., 2017) (Figura 6). 35
36 Figura 6 - Lectinas inibindo a Adesão Bacteriana na superfície. O bloqueio dos locais de ligação entre a bactéria e a superfície abiótica e/ou biótica é uma estratégia para reduzir a adesão bacteriana e consequentemente a formação de biofilme. Fonte: imagem elaborada pela própria autora. A ConA (lectina de Canavalia ensiformis), por exemplo, dificultou a fixação das bactérias testadas ao bloquear sua interação com a superfície e / ou com outras bactérias, justificando sua atividade antiaderente e antibiofilme (JIN; LEE; HONG, 2018). A ação antiaderência das lectinas também é explorada como uma ferramenta biotecnológica. O autor Klafke e colaboradores em seu estudo mostram uma lectina de Bauhinia variegata como futura proposta biotecnológica para inibir a adesão do biofilme oral de espécies de Streptococcus que estão associadas ao desenvolvimento de cárie dentária (KLAFKE; BORSUK; GONC, 2013) Aplicações Biotecnológicas em Bactérias e Biofilmes O padrão de expressão de carboidratos presente nas superfícies dos vários tipos de células pode ser investigado com o uso de lectinas, contribuindo para o avanço das tecnologias de bioreconhecimento e biomarcação celular (HENDRICKSON; ZHERDEV, 2018). Essas técnicas potencializam as aplicações biotecnológicas das lectinas através de, por exemplo, terapias de 36
37 doenças, sistemas de administração de medicamentos, histoquímica e biossensores (COELHO et al., 2017). Apesar da pluralidade de glicanos expressos por diferentes bactérias, existem açúcares específicos presentes nas células procarióticas que são usados como alvos de diagnóstico e medicamentos (TRA; DUBE, 2014). Rastreando as interações entre lectinas e carboidratos bacterianos através da técnica de espectroscopia de ressonância magnética nuclear (RMN) é possível analisar as propriedades estruturais e eventos biológicos associados (FERNÁNDEZ-ALONSO et al., 2012). Essa interação entre lectinas e glicanos bacterianos não implica necessariamente em uma ação antibacteriana. O uso de lectinas como "decodificador de glicanos" tornou-se uma ferramenta útil no aprimoramento das técnicas de biomarcadores (HU; TATENO; HIRABAYASHI, 2015). A análise dos carboidratos presentes nos biofilmes está bem documentada na literatura científica, como o uso da lectina comercial do trigo Triticum vulgaris conjugada com fosfatase. Com isso foi possível determinar de forma qualitativa colorimétrica os resíduos de N-acetilglucosamina que são responsáveis pela adesão intercelular do biofilme de S. epidermis (HENDRICKSON; ZHERDEV, 2018). Devido ao desempenho não destrutivo dos glicoconjugados in situ, técnicas usando lectinas, como a FLBC (do inglês Fluorescence Lectin Bar Coding) e a FLBA (do inglês Fluorescence Lectin-Binding Analysis), estão sendo cada vez mais refinadas e direcionadas para a caracterização de biofilme (GAGLIANO et al., 2018; KRISTENSEN et al., 2017). De maneira quantitativa, estudos anteriores já utilizaram uma técnica adaptada do ELISA, chamada ELLSA, que utiliza lectinas conjugadas com agentes colorimétricos para detectar e definir o EPS de linhagens bacterianas que produzem biofilmes, como P. aeruginosa, Stenotrophomonas maltophila, Staphylococcus sciuri, Bacillus antharacis, entre outros (GRAHAM et al., 1984; LERICHE; SIBILLE; CARPENTIER, 2000; STRATHMANN; WINGENDER; FLEMMING, 2002). O uso da especificidade das lectinas para a biomarcação levou à identificação, por exemplo, dos componentes da matriz de biofilme de bactérias 37
38 redutoras de sulfato - uma das principais causas de corrosão - ajudando a elaborar métodos eficazes de inibição de biofilme (POOSARLA et al., 2017). Outro exemplo recente é a lectina do arbusto Griffonia simplicifolia, que interage especificamente com glicogênio e, conjugada com FITC, foi usada para identificar o biofilme EPS de Pasteurella multocida (PETRUZZI et al., 2018). Além disso, as lectinas com atividade antibiofilme podem ser usadas para revestir superfícies médicas para evitar a formação de biofilme no dispositivo. Estudos com a lectina de Moringa oleifera, aderida em uma superfície de vidro, mostram diminuição da adesão de Bacillus sp. Bem como a combinação da lectina com íons de prata sobre um cateter no qual inibiu a adesão celular de P. aeruginosa no estudo de Gu et al. (COELHO et al., 2018b; GU; BELAY; MITCHELL, 2001; MOURA et al., 2015). Essa especificidade auxilia no desenvolvimento do sistema conhecido como drug delivery, auxiliando o direcionamento dos fármacos para tratamentos de infecções bacterianas (NORDSTRÖM; MALMSTEN, 2017). O uso dessas proteínas pode estar relacionado à liberação de agentes antimicrobianos, como ocorre com nanopartículas poliméricas conjugadas a lectinas de superfície, com especificidade para manose ou fucose, tornando-as capazes de aderir seletivamente à superfície do Helicobacter pylori e aumentar a liberação de antibióticos - presentes nas nanopartículas nas células bacterianas (COELHO et al., 2018b). A propriedade das lectinas de interagir com glicanos de maneira específica é útil para identificar espécies bacterianas pela diferença de aglutinação em microplacas. Como no experimento em que 23 tipos de lectinas foram usadas e foi demonstrado que a interação lectina-bacteria pode ser usada como uma possível ferramenta para identificar as espécies de Mycobacterium (ATHAMNA et al., 2006). Outro exemplo é a lectina isolada de Aplysia spp. capaz de aglutinar isolados de E. coli de origem fecal, indicando sua presença (GILBOA-GARBER; SUDAKEVITZ, 2001). Com foco na identificação, técnicas que utilizam diferentes lectinas em microarranjos podem auxiliar no reconhecimento dos glicanos que fazem parte da composição bacteriana, como ocorreu com E. coli (HSU; PILOBELLO; 38
39 MAHAL, 2006). As lectinas recombinantes, por exemplo, já são utilizadas como ferramentas no estudo glicômico e biomarcação (OLIVEIRA; TEIXEIRA; DOMINGUES, 2013). Como, por exemplo, a lectina recombinante do cogumelo Psathyrella velutina (rpvl), utilizada para biomarcação de proteínas glicosiladas com N-acetilglucosamina. Lectinas recombinantes representam um menor custo e resultados mais reproduzíveis (MACHON et al., 2016). Dentro de todo o cenário de aplicações, proposto ao longo desse trabalho, existe um grupo de lectinas com potencial antibiofilme ainda pouco explorada sem nenhum estudo que são as lectinas de origem fúngica Lectinas de Fungos Basiodiomicetos Por muitos anos, os fungos foram fontes de compostos com propriedades medicinais na cultura asiática, o que sempre desperta o interesse dos pesquisadores na intensa procura por novos fármacos e/ou aplicações biotecnológicas (HYDE et al., 2019; VALVERDE; HERNÁNDEZ-PÉREZ; PAREDES-LÓPEZ, 2015). A diversidade, extensão e conservação de fungos vêm recebendo a atenção da ciência, principalmente, nas duas últimas décadas mais do que qualquer em outro período da história (HAWKSWORTH; GARDENS; HAWKSWORTH, 2014). Vários compostos provenientes/extraídos de fungos são utilizados para fins medicinais incluindo efeitos antibacterianos, antifúngicos, antivirais, antitumorais, antiparasitários, antioxidantes e muitos outros. Existem no total mais de 126 aplicações medicinais relacionadas a componentes fúngicos, principalmente aqueles extraídos de cogumelos, encontrados em pesquisas científicas (CARMEN, 2017; SIVANANDHAN et al., 2017; WASSER, 2014). Com base em métodos moleculares é estimada uma riqueza de diversidade em 5,1 milhões de espécies, desses, somente cerca de 98 mil espécies fúngicas são conhecidas pela ciência, o que equivale a apenas 1,9% do total (HIBBETT et al., 2007). A demanda atual dos pesquisadores na busca por novas fontes de biomoléculas reflete no crescente interesse por organismos como os fungos, principalmente daqueles poucos explorados (BLACKWELL, 2011). 39
40 Somente nos últimos 15 anos, um grande número de lectinas de fungos foi isolado e caracterizado, revelando potenciais biológicos na aplicabilidade dessas proteínas, como atividade de biomarcação, antitumorais e imunomodulatórias (HASSAN et al., 2015). Aproximadamente 80 lectinas descritas na literatura (KOBAYASHI; KAWAGISHI, 2016), muitas dessas são purificadas de corpos de frutificação de fungos pertencentes ao filo Basidiomycota (BLEULER-MARTÍNEZ et al., 2011). Uma das funções das lectinas nos corpos de frutificação está atrelada ao seu crescimento e morfogênese, reconhecimento molecular do hospedeiro, adesão e defesa por exemplo (VARROT; BASHEER; IMBERTY, 2013). As lectinas isoladas de fungos Basidiomicetos têm despertado o interesse dos pesquisadores, tanto por representarem um novo repertório de especificidades, como o alto potencial biomédico e biotecnológico (RIBEIRO et al., 2017). Dentre as lectinas isoladas de representantes do filo Basidiomycota, 61% pertencem a organismos da ordem Agaricales (SINGH; BHARI; KAUR, 2010). Na figura 7 temos um exemplo de lectina fúngica da Aleuria aurantia pertencente a ordem Agaricales com seus domínios de reconhecimento a fucose. Figura 7 Lectina do fungo Aleuria aurantia (código PDB 1UIC). Estrutura da lectina fucose-específica do fungo da ordem Agaricales Aleuria aurantia. 40
41 Ações dessas proteínas, como atividade de biomarcação, antivirais, antitumorais e imunomodulatórias já foram documentadas (LIU et al., 2018; MA et al., 2018; NOVAES; NOVAES; TAVEIRA, 2007; SINGH; BHARI; KAUR, 2010; WANG et al., 2019; ZHANG et al., 2019), como também toxicidade a patógenos como vermes, insetos e vírus (VARROT; BASHEER; IMBERTY, 2013). Como por exemplo a lectina que interage com manose do cogumelo Laccaria bicolor está associada a defesa do fungo frente os patógenos bacterianos (SINGH et al., 2015). Em relação às atividades heterólogas antibacterianas, alguns trabalhos como a lectina da Sparassis latifolia - fungo basidiomiceto com aplicação medicinal - teve efeito tóxico para E. coli, S. aureus e P. aeruginosa (CHANDRASEKARAN et al., 2016). Outro exemplo é da lectina do cogumelo Gymnopilus spectabilis que foi capaz de inibir o crescimento de S. aureus (ALBORÉS et al., 2014a). Sobre uma possível atividade especificamente antibiofilme de lectinas fúngicas, até o momento nenhum estudo foi encontrado. Porém, alguns estudos com atividade contra biofilmes bacterianos já foram encontrados em extratos e compostos secundários de corpos de frutificação de fungos basidiomicetos (HYDE et al., 2019; LIMA; GRIS; KARNIKOWSKI, 2016). A busca por novas fontes de lectinas se faz necessário a fim de aprimorar esses estudos. Pertencente à ordem Agaricales, o gênero Langermannia possui espécimes caracterizadas por possuir basidiomas grandes com cerca de 100 cm de diâmetro de forma globosa e séssil. Encontrado na América Central e do Sul e também na Afríca, no ano de 2012 foi descrita pela primeira vez em solo brasileiro, por Cortez et al., no Estado do Rio Grande do Sul (CORTEZ; BASEIA; DA SILVEIRA, 2012). Já em 2013 teve seu primeiro registo na região do Nordeste, mais especificamente nos Estados do Rio Grande do Norte e Piauí (SILVA, 2013). Enriquecer o arsenal de lectinas fúngicas e explorar suas atividades, favorece não somente novos estudos antibiofilme mas, sim, um novo repertório bioquímico com possíveis aplicações medicinais e/ou biotecnológicas. Nisso, a exploração de fontes fungícas inéditas para ciência potencializa a descoberta de 41
42 novas biomoléculas, como as lectinas, em que possam ser sondadas frente à atuação heterológa com diferentes especificidades e mecanismos de ação beneficiando a pesquisa científica. 42
43 2. OBJETIVOS 2.1 Objetivo Geral Isolar e caracterizar uma lectina do fungo Langermannia bicolor e avaliar o seu efeito sobre biofilmes bacterianos. 2.2 Objetivos Específicos Isolar a lectina do fungo Langermannia bicolor; Caracterizar a lectina frente à sua especificidade a carboidratos, dependência de cátions bivalentes, e estabilidade em diferentes valores de temperatura e ph; Examinar a atividade antibacteriana e o efeito aglutinante de bactérias da lectina em espécies Gram-positiva e Gram-negativa; Investigar a ação da lectina na prevenção e formação de biofilmes bacterianos; Analisar o efeito citotóxico da lectina em eritrócitos humanos (hemólise) e em fibroblastos murinos (3T3). 43
44 3. MATERIAIS E MÉTODOS 3.1 Equipamentos Além dos equipamentos usuais do laboratório foram utilizados: - Agitador magnético (Tecnal TE081) - Banho Maria (Tecnal Te056) - Balança analítica eletrônica BEL Engineering - Balança eletrônica (Tecnal B-tec 2200) - Concentrador de Soluções (Eppendorf 5301) - Centrífuga (Hettich Centrifugen Mikro 200R) - Centrífuga Refrigerada (Eppendorf 5804R) - Espectrofotômetro Pharmacia Biotec (Ultrospec 2100pro) - Estufa Microbiológica (SPLABOR SP200) - FPLC AKTA purifier (GE Healthcare BioSciences Corp.) - HPLC (GE Healthcare BioSciences Corp.) - Incubadora de CO2 com desinfecção UV (Laboven L212) - Leitor de microplaca (Epoch - BioTek) - Liofilizador (Liotop L202) - Microcentrífuga para hematócrito (Modelo spin 1000) - Microscópio Nikon Eclipse Ti-U - Peagâmetro Analyser (ph 300) 3.2 Reagentes Todos os reagentes empregados para a confecção dessa dissertação foram de grau analítico e adquiridos comercialmente. As recomendações do fabricante, de cada reagente, e as normas de biossegurança laboratoriais foram respeitadas. 44
45 3.3 Materiais Biológicos Fungo Basidiomas de Langermannia bicolor foram coletados no Parque Estadual Dunas do Natal, Rio Grande do Norte (5 50'31 "S, 35 11'39" W). Os espécimes foram cedidos pelo Professor Iuri Goulart Baseia, responsável pelo laboratório de Biologia de Fungos (LBF) da UFRN, identificados de acordo com os métodos taxonômicos tradicionais (SILVA, 2013), mantidos na Coleção de Fungos da UFRN e posteriormente doados para essas análises bioquímicas (Figura 8). Os comprovantes do material estudado foram depositados na Coleção de Fungos da UFRN: UFRN 3213 (Langermannia bicolor). Figura 8 Classificação taxonômica do fungo Langermannia bicolor. Fonte: Foto de I. G. Baseia (SILVA, 2013). Langermannia bicolor é um fungo basidiomiceto pertencente à ordem Agaricales Eritrócitos As bolsas de concentrado de eritrócitos humanos dos diferentes grupos sanguíneos do sistema ABO foram obtidos através de doações do HEMOCENTRO RN. As bolsas fornecidas encontravam-se fora do prazo de validade para transfusões mas em condições viáveis para os ensaios (integridade celular). 45
46 3.3.3 Bactérias As linhagens das espécies Pseudomonas aeruginosa ATCC e Staphylococcus aureus ATCC (cepas padrões da American Type Culture Collection) foram cedidas pelo laboratório de microbiologia da faculdade de farmácia / centro de ciências da saúde (CCS - UFRN). As atividades in vitro antibacterianas (disco difusão e concentração inibitória mínima) e antibiofilme foram realizadas em fluxo laminar com suspensão bacteriana das espécies Pseudomonas aeruginosa e Staphylococcus aureus, pelo método de diluição segundo BALOUIRI; SADIKI; IBNSOUDA, (2016), com modificações Linhagens Celulares A linhagem celular imortalizada de fibroblastos de camundongos (ATCC CL-173 ) foi obtida através da American Type Culture Collection (ATCC, Rockville, MD, USA) e disponibilizada, assim como a infraestrutura para cultivo celular, pelo Laboratório de Biotecnologia de Polímeros Naturais BIOPOL (DBQ-UFRN). A linhagem celular cresceu em meio DMEM (Dulbecco s Modified Eagle s Medium), suplementado com 10% de soro fetal bovino com adição de estreptomicina (5000 mg/ml) e penicilina (5000 UI). As células foram incubadas a 37 C, em atmosfera úmida de 5% de CO₂. 3.4 Métodos A realização desse trabalho pode ser dividida em três etapas: isolamento da lectina presente no fungo Langermannia bicolor; caracterização da sua atividade aglutinante quanto à sua especificidade a carboidratos e em diferentes temperaturas, phs e cátions bivalentes; e realização de testes biológicos. 46
47 3.4.1 Isolamento da Lectina Extração e Fracionamento Proteico com Acetona O material seco do fungo Langermannia bicolor foi triturado até adquirir aspecto de farinha e foi, então, solubilizado em água destilada na proporção 1:10 (m/v), em banho de gelo. Essa solução permaneceu em agitação por 4 horas e, em seguida, foi centrifugado a 8000 x g por 30 minutos à 4 C para a separação do sedimento da fração solúvel. Após a centrifugação o sedimentado foi descartado, e o sobrenadante obtido foi designado como Extrato Bruto (E.B.). Visando a separação proteica por diferenças de solubilidades foi feito a etapa de fracionamento sequencial por precipitação utilizando diferentes volumes de acetona nas proporções de 1:0,5, 1:1 e 1:2 (volume de extrato: volume de acetona). O primeiro fracionamento 1:0,5 (v/v) foi adicionado, com auxílio da bureta, acetona em um volume correspondente a metade do volume total de extrato bruto de Langermannia bicolor. Em constante agitação a solução - após a adição da acetona - foi mantida em banho de gelo durante 12 h e centrifugada nas mesmas condições já citadas. Como resultado da centrifugação o precipitado foi solubilizado em água, e denominado F0,5, e o sobrenadante foi submetido a segunda etapa de fracionamento. Dessa vez utilizando o mesmo volume de acetona para volume de extrato bruto 1:1 (v/v), o sobrenadante da etapa anterior foi mantido em banho de gelo e agitação e adicionado a acetona. Em seguida os mesmos procedimentos para F0,5 foram realizados sendo a resultante da sua centrifugação o precipitado denominado F1,0 e o sobrenadante separado para a última etapa de fracionamento. Usando agora o dobro de volume de acetona para extrato bruto 1:2 (v/v) o sobrenadante da etapa anterior foi separado e submetido às mesmas condições citadas anteriormente para F0,5 e F1,0. Depois da centrifugação o sobrenadante foi descartado e o precipitado foi coletado e denominado F2,0. Os precipitados de todos fracionamentos foram solubilizados em água destilada depois da retirada da acetona, para esse passo os precipitados foram deixados na capela de exaustão de gases para a volatilização completa da acetona. Após isso, foram solubilizadas em água na 47
48 menor volume possível - armazenados à 4 C e denominadas de F0,5, F1,0 e F2,0 (Figura 9). Para o monitoramento da possível lectina foi realizado o ensaio de hemaglutinação e dosagem proteica foram realizados com o extrato bruto e as frações e ao longo de todas as etapas do isolamento da lectina. Figura 9 - Esquema de extração e fracionamento do fungo Langermannia bicolor. Em extração aquosa na proporção 1:10 (m/v) foi feito a precipitação proteica utilizando acetona nas proporções de 1:0,5, 1:1 e 1:2 (v/v). Após os precipitados resultantes da centrifugação - serem solubilizados em água foram denominadas de F0,5, F1,0 e F2, Ensaio de Hemaglutinação Alíquotas de 1 ml de sangue humano heparinizado foram lavadas com 9 ml de solução salina (NaCl 0,9%) através de sucessivas centrifugações a 924 x g durante 5 minutos e temperatura ambiente foi separado o concentrado de eritrócitos isento de soro e material hemolisado. Os eritrócitos foram também tratados com proteases (papaína e tripsina) com o intuito de potencializar a variabilidade de sítios glicídicos. Para o ensaio de hemaglutinação a concentração dos eritrócitos não-tratados e tratados enzimaticamente foram ajustadas pela técnica de micro-hematócrito à 4% (SANTOS, 2015). 48
49 Os testes de hemaglutinação foram realizados por meio de diluição seriada das amostras testes em placas de 96 poços de fundo em V. No primeiro poço foram adicionados 25 µl da amostra e do segundo poço em diante foi realizado diluição seriada em NaCl 0,9%, e posteriormente 25 µl da suspensão de eritrócitos à 4%, tratados enzimaticamente e não-tratados foram adicionados a cada poço. Após isso, a microplaca foi incubada por 1 hora, à temperatura ambiente. O grau de aglutinação foi observado visualmente e o título expresso em unidades de hemaglutinação (U.H.), que foi definido como inverso da maior diluição da amostra que tenha apresentado nítida aglutinação (MOREIRA; PERRONE, 1977). A relação entre a unidade de hemaglutinação e concentração de proteína utilizada no ensaio é calculada através da atividade específica (UH/mg). Como controle positivo foi utilizada a lectina comercial de trigo (WGA, do inglês wheat germ lectin) e controle negativo solução salina (NaCl 0,9%) Dosagem de Proteínas A determinação da concentração de proteínas das amostras foi realizada utilizando o kit de quantificação por ácido bicinconínico (BCA) (Sigma ). O método se baseia na redução do íon cobre por proteínas em meio alcalino (Smith et al., 1985). O experimento foi executado conforme instruções do fabricante e a leitura foi feita no comprimento de onda 562 nm em leitor de microplaca (Epoch - BioTek). Outro método de dosagem utilizada apenas para o extrato bruto do fungo Langermannia bicolor foi o método de BradFord (BRADFORD, 1976) adaptado para microplacas e leitura feita a 595 nm. A albumina sérica bovina foi usada como padrão proteico para as duas dosagens Cromatografia de Troca Iônica CM Sepharose Fast Flow As frações obtidas do fracionamento com acetona foram submetidas a ensaio de hmaglutinação e dosagem proteica. A fração F1,0 apresentou melhores resultados e então foi escolhida para a primeira etapa cromatográfica. 49
50 Foi utilizada uma coluna cromatográfica com resina de carga negativa de CarboxiMetil (CM) Sepharose Fast Flow (Sigma ) equilibrada com tampão acetato de sódio 50 mm (ph 4,3). Em um fluxo de 1 ml/min foram coletados 1 ml de cada fração. O monitoramento da presença de proteínas foi feito pela absorbância nos comprimentos de onda de 280 nm e 214 nm em cubeta de quartzo no espectrofotômetro Pharmacia Biotec (Ultrospec 2100 pro). Diluída em tampão de equilíbrio na concentração de 4 mg/ml a fração F1,0 foi aplicada na coluna. O não retido da coluna foi coletado utilizando o tampão de equilíbrio como eluente. As proteínas retidas na coluna através da força iônica foram eluídas com faixas crescentes de concentrações de NaCl 0,2, 0,4, 0,6, 0,8 e 1 Molar. As frações proteicas eluídas que obtiveram maior leitura foram separadas, dialisadas em membrana de celulose regenerada kd MWCO contra água, liofilizadas e submetidas a ensaios de hemaglutinação, eletroforese e aos próximos passos cromatográficos para isolamento da lectina Cromatografia de Exclusão Molecular em Sistema de FPLC- AKTA Purifier A segunda etapa cromatográfica foi uma gel filtração utilizando o sistema FPLC - AKTA (do inglês, fast protein liquid chromatography) com coluna Superdex 200. Essa resina possui um limite de exclusão molecular entre kda, com um limite máximo de exclusão de 100 Da. O tampão de equilíbrio da coluna foi fosfato de sódio 50 mm com NaCl 150 mm (ph 7,5). Em um fluxo de 0,15 ml/min., cada fração foi coletada com volume de 0,5 ml e monitorada através da absorbância em 280 e 215 nm. 2 mg do liofilizado da fração 0,2 M da troca catiônica CM - Sepharose foram solubilizados em 100 µl do tampão de equilíbrio e injetados no sistema. Na figura 10 é apresentada a ordem dos passos para isolamento da lectina do fungo Langermannia bicolor (LLB) após sua extração e fracionamento no qual a F1,0 foi escolhida. 50
51 Figura 10 Fluxograma das etapas de isolamento da lectina do fungo Langermannia bicolor. F1,0 é fração resultante da precipitação por acetona do extrato bruto na proporção 1:1 (v/v); CM Sepharose é a cromatografia de troca catiônica; NR não-retido; 0,2, 0,4 e 1 M são as eluições com suas respectivas concentrações de NaCl; Superdex 200 é a cromatografia de exclusão molecular; Frações derivadas da cromatografia 1-30, e 34-55; Lectina da Langermannia bicolor (LLB) Cromatografia de Exclusão Molecular em Sistema HPLC Para avaliar o perfil e homogeneidade da lectina, as principais frações da cromatografia de exclusão molecular Superdex 200 foram reunidas, dialisadas e concentradas. Com 100 µg de proteína denominada de LLB (lectina de Langermannia bicolor) aplicadas no sistema de cromatografia líquida de alta performance HPLC (do inglês, high performance liquid cromatography) utilizando coluna hidrofílica SRT-C SEC-1000, 5 µm, 7.8 x 300 mm. Essa coluna é possuiu um limite de exclusão molecular de kda. O tampão fosfato salino PBS (do inglês, phosphate buffered saline) 150 mm (ph 7,2) foi o tampão de equilíbrio da coluna. O perfil cromatográfico foi analisado em fluxo de 1 ml/min. e o acompanhamento das absorbâncias de cada fração foram feitas no comprimento de onda de 280 nm. 51
52 Eletroforese em Gel de Poliacrilamida na presença de SDS (SDS- PAGE) e ausência (PAGE) Com o objetivo de avaliar o seu perfil proteico as amostras foram submetidas à eletroforese em gel de poliacrilamida de dimensões de 10 x 14 cm², com espaçadores de 1 mm - a 12% em presença de SDS, de acordo com a metodologia descrita por LAEMMLI, (1970). A eletroforese em condições nãodesnaturantes foi realizada nas mesmas dimensões e concentração do gel nativo PAGE (MAURER, 1971). Os géis foram corados em solução de Coomasie Blue R 250 a 1%, metanol 40% e ácido acético 10% em água destilada e reveladas com nitrato de prata (CHEVALLET; LUCHE; RABILLOUD, 2006) Caracterização da Lectina Ensaio de Inibição da Hemaglutinação por Carboidratos Os ensaios de inibição da hemaglutinação foram realizados da mesma forma como descrito no item 3.1.4, no entanto, após a diluição seriada da amostra foram adicionados 25 µl do carboidrato inibidor da hemaglutinação na concentração de 100 mm em cada poço e incubados a temperatura ambiente por 1h. Posteriormente foi feita a adição da suspensão de eritrócitos a 4%. Os carboidratos utilizados para inibição da hemaglutinação foram: D-Glucose, D-Galactose, D-Frutose, L-Fucose, D-Manose, D-Arabinose, D- Xilose, D-Glucosamina, N-Acetil-D-Glucosamina, D-Galactosamina, D-Ribose, Lactose, Melibiose, Maltose, Sacarose Efeito da Temperatura sobre a atividade da Lectina O efeito residual da temperatura sobre a atividade da lectina foi investigada usando alíquotas da solução de lectina (1 mg/ml) incubadas nas temperaturas de -4, 20, 30, 40, 50, 60, 70, 80, 90 e 100 C, por trinta e sessenta 52
53 minutos para cada temperatura. Após esse processo, as amostras já em temperatura ambiente foram analisadas através do ensaio de hemaglutinação. A relação entre as atividades antes e após os tratamentos com temperaturas é dado pela atividade hemaglutinante relativa em que 100% refere-se a atividade antes dos tratamentos Efeito do ph sobre a atividade da Lectina A investigação do efeito residual de diferentes phs sobre a atividade da lectina foi realizada com alíquotas da lectina (1 mg/ml) dialisadas a 4 C durante 24 horas, contra diferentes tampões: Glicina 50 mm, ph 2, 3 e 11; Acetato de Sódio 50 mm, ph 5; e Tris-HCl 50 mm ph 7,5, 8 e 9. Após essas diálises, outra foi realizada contra água destilada a 4 C, durante 24 horas. Ensaios de hemaglutinação foram realizados para cada alíquota submetida a diferentes phs. Os dados foram expressos em porcentagem de atividade hemaglutinante relativa, como explicado anteriormente Determinação da Dependência de íons Bivalentes Para a determinação da dependência da atividade hemaglutinante de íons bivalentes, alíquota da lectina isolada (1 mg/ml) foi dialisada em solução contendo Tris-HCl 50 mm com EDTA 20 mm, ph 7,5 à 4 C por 24 horas. O EDTA é um agente quelante de íons. Após esse período, foi realizado uma nova diálise no tampão Tris-HCl 50 mm, ph 7,5 (sem EDTA). Depois, a amostra foi concentrada, suspendida em 1 ml de salina e utilizada no ensaio de hemaglutinação na presença dos íons bivalentes Ca +2, Mg +2 e Mn +2, separadamente na concentração de 100 mm. Os resultados foram apresentados em porcentagem de atividade hemaglutinante relativa à lectina sem nenhum tratamento. 53
54 3.4.3 Ensaios Biológicos Ensaio microbiológico por difusão em ágar Discos de papel de 4 mm de diâmetro foram autoclavados e 10 µl da lectina na concentração de 1 mg/ml foram adicionados. Para o controle positivo foi utilizada Tobramicina (10 µg/ml) e o controle negativo foi apenas um disco 10 µl de água destilada. Os discos foram colocados diametralmente opostos em placa de Petri com meio ágar Mueller Hinton em que foi semeado as suspenções bacterianas de P. aeruginosa e S. aureus padronizadas na escala de 0,5 MacFarland (CLSI, 2016). A placa foi incubada a 37 ºC durante 24 horas e posteriormente foi analisado a zona de inibição de crescimento bacteriano ao redor do disco Concentração Inibitória Mínima A Concentração Inibitória Mínima (CIM) foi determinada utilizando o ensaio de microdiluição (CLSI, 2016). A viabilidade das bactérias na presença da lectina foi analisada através do ensaio colorimétrico utilizando resazurina (0,001% p/v em agua destilada). A resazurina é utilizada como indicador de viabilidade bacteriana, semelhante ao mecanismo do MTT, a resazurina é reduzida a resorufina quando há atividade metabólica mitocondrial. Utilizando microplacas de 96 poços, 100 µl da lectina diluída em meio líquido Mueller Hinton (MH) na concentração final de 1 mg/ml foi adicionada no primeiro poço e do segundo á diante foi realizado diluição seriada. Após essa etapa foram inoculados 2 µl das suspenções bacterianas padronizadas na escala de 0,5 MacFarland (CLSI, 2016). As placas foram incubadas a 37 C, por 24 horas, e então 20 µl de resazurina foi adicionada e incubada por 1 hora (COSTA et al., 2016; HUSSAIN, 2011). A leitura da placa ocorreu em espectrofotômetro no comprimento de onda de 575 nm em leitor de microplaca (Epoch - BioTek). 54
55 Efeito na Aglutinação Bacteriana De acordo com a metodologia IMAMICHI; YOKOYAMA, (2010) com modificações, P. aeruginosa e S. aureus cultivados em meio Mueller Hinton à 37 C, por 24 horas. Em seguida, as bactérias foram centrifugadas a 2000 x g por 10 minutos e o sedimento bacteriano foi lavado com tampão fosfato PBS ph 7,2. Essa etapa de centrifugação e lavagem foram repetidas 3 vezes. As células bacterianas foram fixadas quando o sedimento da última lavagem e centrifugação foi suspendidos em 1 ml do mesmo tampão PBS ph 7,2 com 4% de formaldeído e incubados por 16 horas a 4 ºC. Após esse tempo, as bactérias foram lavadas e centrifugadas uma vez com o tampão PBS (sem formaldeído) e suspendidos com 1 ml do mesmo tampão. As bactérias fixadas foram diluídas e microplacas e suas leituras foram feitas em leitor de microplacas no comprimento de onda de 600 nm. A diluição utilizada foi a em que se obteve uma densidade ótica equivalente a 0,5 na escala MacFarland (equivalente a 10 8 UFC/mL). Com uma microplaca de 24 poços o ensaio de aglutinação bacteriana foi realizado utilizando 50 µl de suspenção bacteriana, com concentrações ajustada, para ambas espécies gram-postiva e gram-negativa. Em seguida, 50 µl da lectina isolada na concentração final de 1 mg/ml também foi adicionada aos poços. Em outro conjunto, a mesma lectina foi testada após incubação durante 30 minutos com o seu carboidrato ligante a 100 mm (após o experimento do tópico 3.2.1), e depois adicionado o mesmo volume de suspensão bacteriana. Após o período de 2 h, os resultados foram observado sob um microscópio de luz invertida no aumento de 200x modelo Nikon Eclipse Ti-U. Total Avaliação do efeito Antibiofilme por Quantificação de Biomassa A metodologia empregada é baseada na descrita por KLEIN et al. (2015), da qual a formação de biofilme é avaliada em microplacas de 96 poços de fundo plano. Foi feito uma suspensão das bactérias na concentração de 0,5 55
56 MacFarland em meio Mueller Hinton suplementado com 1% de glicose (CMHG) tanto para S. aureus como P. aeruginosa. O ensaio antibiofilme foi realizado em duas versões: atividade preventiva (concomitante) e sobre o biofilme préformado (biofilme estruturado em 4 horas). No primeiro ensaio de efeito preventivo, foram adicionadas 100 µl da suspenção bacteriana aos poços seguida da adição de 100 µl da lectina isolada diluída em meio MH nas concentrações 0,1, 1, 10, 100 e 1000 µg/ml. A placa foi incubada a 35 ± 2 C durante 24 horas. Já no segundo ensaio utilizando biofilme pré-formado, 100 µl das suspenções bacterianas foram aplicadas na microplaca e incubados a 35 ± 2 C durante 4 horas. Depois desse tempo, as bactérias presentes no sobrenadante dos poços foram descartadas seguidas por uma lavagem com tampão PBS (ph 7,2) no volume de 200 µl. Após a lavagem foi adicionado 100 µl da lectina isolada diluída em meio MH nas concentrações citadas anteriormente seguidas de encubação a 35 ± 2 C durante 24 horas Após o último tempo de encubação dos dois testes foram realizadas os procedimentos de lavagens sequenciais e coloração da biomassa total do biofilme. As placas foram lavadas uma vez com 200 µl de tampão PBS, seguida de uma lavagem com 200 µl de álcool metílico PA durante 15 minutos com a tampa da microplaca fechada e mais 15 minutos após ser descartado com a tampa aberta para evaporar todo álcool. A próxima etapa é a coloração da biomassa total através da adição de 100 µl de cristal violeta a 0,1% (m/v) durante 30 minutos. Após esse tempo, foram feitas sucessivas lavagens com 200 µl de tampão PBS. Como última etapa foi utilizado 200 µl de álcool etílico PA na microplaca que ficou sob agitação durante 3 minutos e 80 x g. Em uma nova placa de microtitulação foram transferidas alíquotas de 100 µl do cristal violeta dissolvida em etanol. O controle negativo para biofilme foram os poços não-tratados utilizando apenas 100 µl de CMHG. A absorbância da placa foi avaliada em leitor de microplaca (Epoch - BioTek) no comprimento de onda de 595 nm. 56
57 Hemólise Em tubos de ensaio, 100 µl de uma suspensão de hemácias a 1% foram incubadas com 100 µl da lectina nas concentrações de 0,1, 1, 10, 100 e 1000 µg/ml por 1 hora à temperatura ambiente. Constituindo a referência de 100% de hemólise foi usado 100 µl da suspensão de hemácias e 100 µl de Triton X % (v/v). A suspensão de hemácias a 1% e 100 µl de NaCl 0,9% foi usada como referência para 0% de hemólise. Após a incubação, os tubos foram centrifugados a 8000 x g por 3 minutos e alíquotas de 100 µl dos sobrenadantes foram transferidos para placas de microtitulação de 96 poços, analisados a 405 nm em leitor de microplaca (Epoch - BioTek) Ensaio de Citotoxicidade a Fibroblastos O efeito citotóxico da lectina foi testado através do experimento de redução do brometo de 3-(4,5-dimetil-2-tiazolil)-2, 5-difenil-tetrazólio, conhecido como MTT. Esse reagente atua como indicador da viabilidade celular através de sua redução em formazam por intermédio da atividade mitocondrial das células viáveis. As células de fibroblastos murinos (3T3) foram diluídas em meio RPMI e adicionadas em microplaca (96 poços) de fundo reto na concentração de 5 x 10 3 células/poço. Após incubação por 24 horas, a 37 C, em atmosfera úmida de 5% de CO₂, foram adicionados 100 µl da lectina (nas concentrações de 0,1, 1, 10 e 100 µg/ml) e mantido em incubação durante 24 e 48 horas. Posteriormente, foram adicionados 100 µl de MTT diluído em meio RPMI 1640 (1 mg/ml) para avaliar o efeito da lectina sobre as células. Depois de 4 horas o sobrenadante foi removido, e então adicionado 100 µl de DMSO. A solução foi homogeneizada até que os cristais de formazan fossem completamente dissolvidos. A leitura da absorbância, diretamente proporcional à quantidade de células viáveis, foi feita em leitor de microplaca (Epoch - BioTek) no comprimento de onda de 570 nm. 57
58 3.4.4 Análises Estatísticas Os dados obtidos são resultados de pelo menos três experimentos independentes apresentados com média ± DP (Desvio Padrão). As diferenças entre os grupos com o grupo controle foram avaliados através do teste ANOVA pelo teste de Tukey utilizando o software GraphPad Prism 5.0, com diferença significativa dada apenas para um valor de p inferior a 0,05. 58
59 4. RESULTADOS E DISCUSSÃO 4.1 Isolamento da Lectina (LLB) As etapas de isolamento da lectina do fungo Langermannia bicolor se iniciam com a extração dos corpos de frutificação em solução aquosa seguida de seu fracionamento com acetona, sendo as frações denominadas F0,5, F1,0 e F2,0, de acordo com a proporção de acetona (ver Métodos). Tanto o extrato bruto como as frações foram submetidas a ensaios de dosagem proteica, para determinação do seus rendimentos. O extrato bruto teve um altíssimo valor total de proteína, já a fração F1,0 (19,28 mg/ml) se destacou, apresentando uma concentração de proteína 4 vezes maior que F0,5 (4,57 mg/ml) e aproximadamente 3 vezes o valor de F2,0 (6,83 mg/ml). Em relação à porcentagem de recuperação das proteínas presentes no extrato, todos os valores das frações foram bastante baixos (Tabela 3). Tabela 3. Dosagem proteica e recuperação do extrato bruto e frações acetônicas. FRAÇÃO VOLUME DA FRAÇÃO (ml) PROTEÍNA (mg) TOTAL DE PROTEÍNA (mg/ml) RECUPERACÃO (%) E.B , , F0,5 12,5 0,36 4,57 0,03 F1,0 8 2,41 19,28 0,13 F2,0 6 1,14 6,83 0,05 Uma possível explicação para o alto valor proteico encontrado no extrato bruto de Langermannia bicolor está na subestimação na dosagem pelo método de dosagem proteica utilizado (BCA). Esse método consiste na redução do íon cobre de Cu +2 Cu + em meio básico. Porém, um possível interferente nessa dosagem são os compostos fenólicos que são capazes de reduzir o íon cobre (IWASAKI et al., 2011). E os extratos fúngicos possuem altas dosagens de compostos fenólicos na sua composição (BACH et al., 2019; SÁNCHEZ, 2017), como o extrato do fungo 59
60 Calvatia gigantea, da mesma família de Langermannia bicolor (K; KIVR; HARMANDAR, 2016). Uma forma de amenizar essa superestimação seria calcular um fator de correção na concentração proteica de Extrato Bruto utilizando outra metodologia de dosagem de proteínas, como Bradford. A dosagem por Bradford foi admitida nesse trabalho como a concentração real de extrato bruto por ter menor interferência nos demais compostos presentes no extrato. O fator de correção das diferenças entre as concentrações por Bradford, admitindo como concentração real, e a por BCA, como concentração teórica, é de 0,43. Utilizando o fator de correção a concentração real de EB é de 19,41 mg/ml. Com isso os novos valores de recuperação ainda são baixos, porém, podem ser avaliados de forma a diminuir valores de sobrestimação das condições reais. Nesse caso F1,0 continua em destaque com 0,31%, seguida da fração F2,0 (0,11%) e, por fim, a menor recuperação em F0,5 (0,07%). Dessa forma, nos experimentos seguintes em que são necessários utilizar a dosagem proteica do extrato bruto do fungo foi aplicado o fator de correção de 0,43. A etapa seguinte consiste em determinar as unidades de hemaglutinação do extrato e frações utilizando diferentes grupo sanguíneo (ABO) tratados e nãotratados com proteases (Tabela 4). Tabela 4. Unidades de Hemaglutinação do Extrato (E.B.) e Frações de Langermannia bicolor. E.B. F0,5 F1,0 F2,0 Eritrócitos Não-Tratado Tratado Enzimaticamente Tripsina Papaína Humano A Humano B Humano O Humano A Humano B Humano O Humano A Humano B Humano O Humano A Humano B Humano O
61 A B S U H Tanto EB como F1,0 e F2 possuíram atividade hemaglutinante em todos os tratamento sanguíneos. A fração F0,5 teve atividade somente com os sangues tratados enzimaticamente com proteases (Tripsina e Papaína), A maior atividade hemaglutinante encontrada foi com sangue A tratado enzimaticamente com papaína no extrato bruto ( UH) seguida da fração F1,0 com UH também com o mesmo tipo de sangue. Dentre as frações a fração 1,0 obteve maiores títulos de hemaglutinação e maior atividade específica relação atividade hemaglutinante e quantidade de proteína utilizada no ensaio para o sangue A tratado com papaína (217,55 x 10³ UH/mg) quando comparada às frações F0,5 (2,282 x 10³ UH/mg) e F2,0 (1,439 x 10³ UH/mg). A F1,0 apresentou valores de atividade específica elevados e melhor rendimento de extração, por essa razão, foi escolhida para as próximas etapas de isolamento da lectina em cromatografia de troca catiônica em CM Sepharose Fast Flow. Apenas os tubos derivados das eluições do NR e 0,2 e 0,4 M apresentaram atividade hemaglutinante como mostrado na figura 11, com destaque ao eluído com 0,2 molar de NaCl que teve intensa atividade hemaglutinante atingindo uma atividade específica de 512 x 10³ UH/mg. 1.8 N R 0.2 M n m n m M U H M Figura 11 Perfil cromatográfico da fração F1,0 em coluna CM Sepharose Fast Flow. NR é a fração Não-Retida, coletada com tampão Acetato de Sódio 50 mm ph 4,3. 0,2, 0,4 e 1 M tratamse das eluições utilizando concentrações de 0,2, 0,4 e 1 molar de NaCl, respectivamente. Linha preta: Leitura em 280 nm; Linha cinza: Leitura em 214 nm; Unidade Hemaglutinante da fração 61
62 O cromatograma mostrou uma absorbância mais expressiva no comprimento de onda de 214 nm, quando comparado ao 280 nm. Essa informação contribuiu para mudança do método de dosagem proteico utilizado para o método de redução de cobre (BCA) (SMITH et al., 1985), uma vez que a quantificação por Bradford (BRADFORD, 1976) estava subestimando o valor proteico das frações. Lembrando, como já foi explicado, que para o extrato bruto foi aplicado o fator de correção com base na dosagem real utilizada por metodologia de Bradford (devido à interferência dos compostos fenólicos, presentes no extrato, na metodologia de BCA). Já para as frações proteicas, rastreamento e isolamento da lectina proposta foram feitas com BCA sem fatores de correção. Isso porque a lectina desse estudo tem leituras maiores no comprimento de onda 214 nm, e menos intensas no comprimento de 280 nm, possivelmente representando a baixa incidência de aminoácidos aromáticos presentes na estrutura proteína (MARQUES et al., 2018). Leituras no comprimento de nm estão associadas ao alto coeficiente de extinção molar das ligações peptídicas e aminoácidos como: prolina e metionina; contribuindo para a estimação proteica da amostra ao longo das etapas de isolamento. (KUIPERS; GRUPPEN, 2007). De forma semelhante, a lectina da planta Phthirusa pyrifolia também foi monitorada nos dois comprimentos de onda durante suas cromatografias (CM - Sepharose e gel filtração Superdex 100) possuindo picos expressivos na faixa de nm (COSTA et al., 2010). O uso de cromatografia de troca iônica já é documentado para a purificação de lectinas de fungos Agaricales, sendo bastante comum o uso da cromatografia de troca aniônica (DEAE Sepharose ou SP - Sepharose ) seguida de uma cromatografia catiônica (CM Sepharose ou Q - Sepharose ). Alguns exemplos de lectinas puras, originadas de Agaricales, que foram obtidas por essa metodologia são: Agaricus bitorquis (ZHANG et al., 2019), Inocybe umbrinella (ZHAO; WANG; NG, 2009), Schizophyllum commune (HAN et al., 2005), Pleurotus citrinopileatus (LI et al., 2008), Pholiota adiposa (ZHANG et al., 2009), Armillaria luteo-virens (FENG et al., 2006). Como etapa seguinte, todos estes trabalhos citam cromatografia de gel filtração em sistema FPLC (Superdex 75 ou Sephadex G100), totalizando 3 etapas cromatográficas. 62
63 Semelhante à troca iônica feita neste trabalho, as lectinas dos fungos Sparassis latifolia (CHANDRASEKARAN et al., 2016), Lentinus edodes (TSIVILEVA; NIKITINA; LOSHCHININA, 2008) e Lentinus squarrosulus (SINGH et al., 2013) tiveram a escolha da melhor fração por precipitação, seguida de uma cromatografia iônica e posterior gel filtração. Após dialisar e concentrar 2 mg de proteínas provenientes da cromatografia de troca iônica por eluição com 0,2 M foi realizada a segunda etapa cromatográfica desse estudo. Realizou-se a cromatografia de exclusão molecular com coluna Superdex 200 em sistema de FPLC AKTA utilizando tampão fosfato de sódio 50 mm e NaCl 150 mm (ph 7,2) como tampão de equilíbrio (Figura 12). Figura 12 Cromatografia de exclusão molecular com Superdex 200 em sistema FPLC AKTA. Fosfato de sódio 50 mm e NaCl 150 mm ph 7,5 foi o tampão de equilíbrio. Fluxo de 0,15 ml/min. Em rosa e azul são os perfis de leitura nos comprimentos de onda 215 e 280 nm, respectivamente. O perfil cromatográfico acima mostra que, apesar da base larga do gráfico, ocorre um pico de alta leitura em 215 nm e uma menos intensa na faixa de 280 nm. As frações coletadas no tubos 31, 32 e 33 obtiveram maior leitura e assim, foram reunidas, dialisadas e o concentradas. O material concentrado em questão foi denominado de lectina Langermannia bicolor (LLB) para os testes seguintes. Na 63
64 tabela 5 encontramos os valores de dosagem de proteína e de atividade hemaglutinante que denotam a progressão das etapas de isolamento de LLB. Observando os dados contidos na tabela 5, podemos analisar a quantidade de proteínas e a porcentagem de proteína que foram recuperadas nas etapas de progressão de isolamento (F1,0, 0,2 M e LLB) partindo das proteínas presentes no extrato bruto (100%). Também é possível avaliar a unidade de hemaglutinação e atividade específica de cada uma das frações. O número de vezes em que a lectina foi enriquecida é calculada comparando as atividades especificas de cada fração com a atividade específica inicial proveniente do extrato bruto (enriquecida 1 vez). Tabela 5 Avaliação das etapas de isolamento de LLB. FRAÇÃO VOLUME DA FRAÇÃO (ml) PROTEINA (mg/ml) TOTAL DE PROTEINA (mg) RECUPERAÇÃO (%) UNIDADE DE HEMAGLUTINAÇÃO (x 10³ UH) TOTAL ATIVIDADE HEMAGLUTINANTE (x 10³ UH) ATIVIDADE ESPECÍFICA (x 10³ UH/ mg) ENRIQUECIDA (n º de vezes) E.B ,41* 6.211, , ,64 108,04 1 F1,0 8 2,41 19,28 0,31 524, ,30 217,55 2,01 0,2 M 2 0,26 0,512 0,01 131,07 262, ,00 4,74 LLB 1 0,11 0,102 0,002 65,536 65, ,51 5,95 * Diferentemente das demais frações a dosagem do extrato bruto (E.B.) foi feita utilizando o fator de correção de 0,43. A recuperação de LLB (quantidade de proteína) foi de 0,002%, bastante baixa, porém as atividades específicas das etapas de isolamento foram crescentes com LLB atingindo a máxima atividade específica de 642,51 (x 10 3 UH/mg). O número de vezes em que LLB foi enriquecida partindo do seu extrato bruto aquoso foi de 5,95 vezes. Apesar da baixa recuperação de LLB é possível utilizar do seu estudo para o desenvolvimento de protótipos ou seu uso através de técnicas de recombinações de lectinas fúngicas, como a lectina recombinante do cogumelo Psathyrella velutina utilizada para biomarcação de proteínas glicosiladas com N-acetilglucosamina. Lectinas recombinantes representam um menor custo e resultados mais reproduzíveis (MACHON et al., 2016). Outros exemplos de lectinas recombinantes de cogumelos como: Agrocybe aegerita com ativide antiviral (CHANG et al., 2019; MA et al., 2018) e Aleuria aurantia, com atividade de biomarcação de células 64
65 cancerígenas hepáticas (NORTON et al., 2016) e como imunoadjuvante (MA et al., 2018). Com 5 passos de purificação, a lectina do cogumelo Agaricus bitorquis foi enriquecida 16 vezes, porém apresentou atividade específica 53 vezes menor que LLB ( UH/mg) (ZHANG et al., 2019). Enriquecida 22 vezes a lectina do cogumelo do gênero do cogumelo comestível shitake Lentinus squarrosulus, tem sua atividade específica em 342 UH/mg cerca de menor que LLB (SINGH et al., 2013). Já a lectina fúngica de Cerrena unicolor com 4 passos de purificação como LLB, possuiu uma atividade específica de 100 x 10³ UH/mg (DAVITASHVILI et al., 2015). No intuito de acompanhar os passos de isolamento e análise do perfil proteico, as frações foram submetidas a eletroforese em condições desnaturantes, conhecida como SDS-PAGE (Figura 13a). No gel em condições desnaturantes e tratamento das amostras com agente redutor, é possível observamos um enriquecimento de LLB ao longos dos passos de isolamento, com uma banda majoritária entre as bandas dos marcadores de 200 e 116 kda. Em gel nativo LLB foi visualizada o predomínio de uma banda (Figura 13b). Para análise do perfil e da homogeneidade de LLB foi feita uma cromatografia de exclusão molecular em sistema HPLC (Figura 14). 65
66 Figura 13 SDS-PAGE e PAGE de LLB. (a) SDS-PAGE com β-mercaptoetanol do Extrato Bruto (E.B.) fração acetônica (F1,0), fração 0,2 M da cromatografia de troca catiônica e LLB dos picos 31, 32 e 33 da gel filtração S200. Marcadores de peso molecular: Miosina (200 kda); β-galactosidase (116 kda); Fosforilase B (97 kda); Albumina (66 kda); Glutamato desidrogenase (55 kda); Ovoalbumina (45 kda); Gliceraldeido-3-fosfato desidrogenase (36 kda); Anidrase carbônica (29 kda) e Tripsinogênio (24 kda). (b) PAGE de LLB sem agente redutor. 800 DAD-CH1 280 nm Lectina Fungo Geovana GeoLectinUFRN mau mau Minutes Figura 14 - Perfil cromatográfico de LLB em 280 nm em coluna de exclusão molecular HPLC. O tampão fosfato salino PBS Ph 7,2 foi o tampão de equilíbrio. Fluxo de 1 ml/min. Em azul está o perfil de leitura no comprimento de onda de 280 nm. 66
67 As massas moleculares de lectinas fúngicas variam de 10 a 190 kda (HASSAN et al., 2015). Pertencente à mesma classe de Langermannia bicolor, a lectina hexamérica purificada de Ganoderma capense possui um peso molecular de 114 kda (SINGH; BHARI; KAUR, 2010). Duas lectinas encontradas no fungo Cerrena unicolor possuíam pesos moleculares de 160 kda e 105 kda (DAVITASHVILI et al., 2015). Contendo 6 subunidades, a lectina do fungo Lactarius lignyotus também se destaca pelo alto peso molecular, com 98 kda (SINGH et al., 2015). Além do peso molecular, foram investigados alguns parâmetros bioquímicos que pudessem interferir na atividade lectínica. A caracterização da atividade aglutinante de LLB frente ao seu carboidrato ligante, dependência de cátions e sua performance em diferentes temperaturas e phs foram avaliadas. 4.2 Caracterização da Lectina Um dos principais passos iniciais para caracterização lectiníca está na elucidação de seu carboidrato ligante. O ensaio é realizado através da inibição da atividade hemaglutinante da lectina na presença de carboidratos distintos (monossacarídeos e dissacarídeos) em concentrações crescentes de 100 mm. Na tabela 6 se encontra a lista de carboidratos testados e a concentração mínima de carboidrato para inibir 100% da atividade hemaglutinante. O único carboidrato testado que apresentou completa inibição da atividade hemaglutinante de LLB foi o dissacarídeo lactose com a concentração mínima de 6,25 mm. A lactose é um dissacarídeo formado por glicose e galactose, contudo LLB não foi inibida por esses monossacarídeos separadamente, sugerindo que possivelmente o domínio reconhecedor de carboidratos de LLB requer os dois resíduos de monossacarídeos unidos glicosidicamente, para que a lectina se ligue. Mas não qualquer tipo de ligação glicosídica entre esses dois carboidratos, especificadamente a ligação β-1 4 encontrada na lactose, uma vez que o dissacarídeo melibiose apresenta os mesmos resíduos em ligação β-1 6, e o mesmo não promoveu inibição na hemaglutinação gerada na presença de LLB. A mesma concentração de lactose (6,25 mm) foi necessária para inibir a hemaglutinação da lectina do cogumelo Omphalotus nidiformis (ROUF et al., 2011). 67
68 A mesma especificidade ocorre com a lectina antiproliferativa do cogumelo Schizophyllum commune sem inibição dos monossacarídeos separados, inibida apenas com lactose e N-acetil-D-galactosamina (CHUMKHUNTHOD et al., 2006; HAN et al., 2005). Outras lectinas de basidiomicetos também possuem especificidade para lactose como: Agrocybe cylindracea, Auricularia polytricha, Ganoderma lucidum, Punctularia atropurpurascens, Laetiporus sulphureus, Boletus edulis, entre outros (ALBORÉS et al., 2014b; SINGH et al., 2015; VARROT; BASHEER; IMBERTY, 2013). Isso pode ser um indicio da importância desse domínio de reconhecimento a lactose para os fungos, visto a ampla presença em diferentes gêneros. Tabela 6 Concentração Mínima de Carboidrato capaz de inibir a hemaglutinação de LLB. Carboidratos mm D-Glucose NI D-Galactose NI D-Frutose NI L-Fucose NI D-Manose NI D-Arabinose NI D-Xilose NI D-Glucosamina NI N-Acetil-D-Glucosamina NI D-Galactosamina NI D-Ribose NI Lactose 6,25 Melibiose NI Maltose NI Sacarose NI NI Inibição da hemaglutinação não foi observada nas concentrações testadas. Outra etapa importante para a caracterização é a avaliação da dependência de LLB por cátions bivalentes para que exerça sua função. Dialisando previamente a lectina com uma solução EDTA agente quelante capaz de complexar e inativar íons. Posteriormente foi realizado a incubação de LLB com os íons dissociados das soluções de CaCl2, MnCl2 e MgCl2. LLB após o tratamento com EDTA não apresentou nenhum efeito hemaglutinante quando comparada à LLB sem nenhum tratamento. O mesmo ocorreu quando a LLB após tratamento com EDTA entrou em 68
69 contato com os íons de Mg +2 e Mn +2. Mas na presença do Ca +2 o percentual da atividade hemaglutinante relativa foi recuperada representando 100% de sua atividade hemaglutinante anterior aos tratamentos (Figura 15a). Algumas lectinas da ordem Agaricales são dependentes do íon cálcio (Ca +2 ) para exerceram sua atividade como as dos cogumelos: Marasmius oreades e Psathyrella velutina (CIOCI et al., 2006; GRAHN et al., 2009). Foi possível investigar a influência da temperatura e do ph sobre a LLB ao testar sua ação hemaglutinante após sua exposição a diferentes valores de temperatura (Figura 15b) e ph (Figura 15c). Quando exposta a diferentes temperaturas, LLB se manteve estável atingindo 100% de sua atividade inicial até 60 ºC. A partir de 70 ºC até 100 ºC LLB teve sua ação aglutinante prejudicada em 25%. Lectinas já caracterizadas de outros fungos possuem atividade aglutinante até ºC. Maiores temperaturas comprometem sua conformação nativa, não apresentando ação hemaglutinante (JIANG et al., 2012; SINGH et al., 2010, 2013; ZHAO; WANG; NG, 2009). Figura 15 Caracterização frente a presença de íons, diferentes temperaturas e ph. Percentual da atividade hemaglutinante relativa de LLB após tratamento com Tris-HCl 50 mm com EDTA 20 mm e com soluções contendo cátions bivalentes (100 mm) (a); em diferentes temperaturas durante 30 minutos (b) e phs (c). Depois da incubação por 30 minutos a 100 C, ao voltar à temperatura ambiente LLB foi capaz de manter 75% de sua atividade. No entanto, no tempo de exposição de 1 hora a 100 ºC LLB só manteve 12,5% da aglutinação. Semelhante a esses dados, temos a lectina termoestável do fungo Ganoderma capense, até 1 hora 69
70 manteve sua interação a 100 ºC, porém, incubada por mais tempo em altas temperaturas foi perdendo significativamente sua atividade (NGAI; NG, 2004). A atividade de LLB também se mostrou estável aos diferentes phs avaliados, afetada apenas em ph 2 na qual teve 25% de sua atividade reduzida. Nos demais valores de ph LLB manteve sua atividade hemaglutinante, tendo seu ph ótimo 7,5 com um título acima de sua atividade antes dos tratamentos. De forma semelhante, a hemaglutinina proteica de Inocybe umbrinella, quando em contato com diferentes concentrações de soluções ácidas e básicas, permaneceu com o mesmo percentual de atividade hemaglutinante (ZHAO; WANG; NG, 2009). Lectinas agaricales com menores intervalos de estabilidade são encontradas, como as de Hericium erinaceum, entre os phs 5 e 10,5 e da Agrocybe aegerita entre ph 6 e 11 (JIANG et al., 2012; KAWAGISHI et al., 1994). Outro exemplo é a lectina da Lentinus squarrosulus que não possuiu atividade em ph 1,5 mas manteve 50% de sua atividade total entre ph 3-6,5 e ph 8 9,5 (SINGH et al., 2013). Dada a descrição dos principais aspectos que possam afetar o desempenho da lectina LLB, incluindo interações e fatores físico-químicos como temperatura e ph, é preciso atribuir uma atividade biológica a essa lectina isolada para que possamos usufruir desses conhecimentos aqui apresentados. 4.3 Atividade Antibacteriana e Aglutinação de Bactérias Os ensaios foram iniciados com metodologias de avaliação da possível atividade bactericida de LLB em bactérias Gram-positiva (S. aureus) e Gramnegativa (P. aeruginosa). LLB não promoveu inibição do crescimento bacteriano e, portanto não foi observado halo de inibição de crescimento bacteriano na técnica de disco de difusão em ambas bactérias testadas. Também não apresentou mínima concentração de inibição bacteriana tanto para S. aureus como para P. aeruginosa. As espécies P. aeruginosa e S. aureus foram escolhidas para esse trabalho porque são responsáveis pela maioria das infecções nosocomiais e são exemplos de patógenos persistentes capazes de formar biofilme (ALGBURI et al., 2017). A formação desse agregado bacteriano estruturado, conhecido como biofilme, 70
71 promove o desencadeamento de infecções crônicas atuando com uma estratégia extraordinária de impedir a ação de antimicrobianos e do sistema imune do hospedeiro (PALMIOLI et al., 2019). O biofilme de S. aureus está relacionado principalmente aos dispositivos médicos, tornando a erradicação da infecção sem a remoção cirúrgica do dispositivo quase impossível (PAHARIK; HORSWILL, 2016; TONG et al., 2015). P. aeruginosa é responsável por % da infecções hospitalares em todo o mundo (ZHAO et al., 2018) podendo desencadear fibrose cística, colonização de cateteres, lentes de contato e próteses (SHARMA; MISBA; KHAN, 2019). Uma estratégia antibiofilme bem sucedida - segundo alguns pesquisadores seria a ação de fármacos que não fossem bactericidas, a fim de evitar o rápido aparecimento de mutantes de escape, dessa forma, biomoléculas não tóxicas a bactérias seriam viáveis uma vez que, não aplicariam nenhuma pressão seletiva no biofilme multibacteriano (CARNEIRO et al., 2019; KLEIN; FABRES-KLEIN; OLIVEIRA, 2015; PAPA et al., 2013). Esse tipo de abordagem tornaria o patógeno menos virulento, facilitando assim o tratamento da infecção podendo viabilizar a atuação de antibióticos e do sistema imune nas infecções por biofilmes bacterianos (TATEDA et al., 2007). Dentro do potencial biotecnológico, a pesquisa de lectinas com atividade antibiofilme é estimulada pela intensa busca por moléculas naturais capazes de funcionar de maneira não-tóxica e biocompatível, e com capacidade de interagir com bactérias e seus componentes, dentro do microssistema no qual o biofilme está inserido (GLINEL et al., 2012). Para investigar uma possível atividade antibiofilme de LLB foi feito inicialmente um ensaio de aglutinação de bactérias com S. aureus e P. aeruginosa (Figura 16). 71
72 Figura 16 Ensaio de aglutinação de bactérias gram-positiva e gram-negativa por LLB. (a) S. aureus incubada com tampão TBS; (b) S. aureus incubada com LLB (1 mg/ml); (c) S. aureus incubada com LLB e lactose; (d) P. aeruginosa incubada com tampão TBS; (e) P. aeruginosa incubada com LLB (1 mg/ml); (f) P. aeruginosa incubada com LLB e lactose. As setas indicam aglutinação bacteriana. Imagens tiradas em microscópio de luz invertida na aumento de 200x (modelo Nikon Eclipse Ti-U). Na concentração de 1 mg/ml, foi possível observar alguns pontos de aglutinação nas bactérias tratadas (identificados pelas setas na fig. 16). Já nos experimentos utilizando LLB mais e o seu carboidrato específico (lactose) não houve aglutinação bacteriana de S. aureus e P. Aeruginosa, revelando que a aglutinação é dependente do seu domínio de reconhecimento a lactose. A aglutinação por lectinas endógenas é um artificio bastante utilizado por organismos pluricelulares como estratégia de defesa frente a patógenos bacterianos, por isso a rica diversidade de lectinas (fungos, peixes, borboletas, insetos, plantas e etc) com atividade agregadora de bactérias (GASMI; FERRÉ; HERRERO, 2017; KABIR et al., 2015; MU et al., 2018; POHLEVEN; KOS; SABOTIC, 2016; VELAYUTHAM et al., 2017). Dentre as diferentes fontes, um grupo de lectinas com atividade aglutinante e antibiofilme se destacam pelo maior número de pesquisas as lectinas de esponja. Utilizando a mesma concentração 1 mg/ml, as lectinas ligantes de lactose de esponjas marinhas como: Chondrilla caribensis (CCL) e Aplysina lactuca (ALL) não 72
73 apresentaram atividade antibacteriana mas foram capazes de aglutinar as bactérias E. coli e S. aureus (CARNEIRO et al., 2017a; MARQUES et al., 2018). Também com especificidade à lactose e na mesma concentração que LLB, a lectina purificada dos ovos da Aplysia dactylomela (ADEL), conhecida como lebre do mar, só possuiu atividade aglutinante para gram-positiva S. aureus e não para E. coli (CARNEIRO et al., 2017b). A relação entre a agregação bacteriana e efeito antibiofilme bacteriano está na interação cruzada de lectinas com os glicanos de superfície e/ou parede celular das bactérias de forma a aglutiná-las. Essa agregação gera um menor número de células disponíveis para aderirem à superfície biótica e/ou abiótica prejudicando a formação do biofilme. Muitos trabalhos com atividade antibiofilme de lectinas atrelaram essa ação à aglutinação de bactérias promovida por essas proteínas (CARNEIRO et al., 2017b; CAVALCANTE et al., 2011; MARQUES et al., 2018; SADANANDAN; RAUF, 2018; VASCONCELOS et al., 2014). 4.4 Ação Antibiofilme de LLB Dessa forma analisou-se o efeito de LLB sobre a formação e erradicação do biofilme pré-formado (em 4 horas). Inicialmente, ao ser administrada as concentrações 0, e 1000 µg/ml em conjunto com as suspensões bacterianas pretendeu-se investigar o potencial preventivo de LLB a geração do biofilme de S. aureus (Figura 17a) e P. aeruginosa (Figura 17b). Todas as concentrações testadas promoveram inibição na formação do biofilme com diferença estatística com o grupo não tratado (Figura 17a e b). Em S. aureus dentre as concentrações testadas a melhor concentração para prevenir a formação do biofilme é 100 µg/ml com 99,8% de redução da biomassa total. As concentrações de 10, 100 e 1000 µg/ml não tiveram diferenças estatísticas entre si. Com 78% a concentração 10 vezes menor (10 µg/ml) também foi capaz de inibir o biofilme (Figura 17a). Na concentração cinco vezes maior que a de LLB, com 500 µg/ml da lectina da esponja Aplysina fulva ocorreu 80% de inibição do biofilme de S. aureus sem afetar a viabilidade das bactérias (CARNEIRO et al., 2019). Ainda no mesmo gênero, 73
74 a aglutinação de bactérias pela lectina da esponja marinha Aplysina fulva também inibiu a formação de biofilme sem alterar a viabilidade das bactérias (CARNEIRO et al., 2019). Figura 17 Quantificação total da biomassa do biofilme por cristal violeta em contato com LLB. Atividade de LLB na prevenção da formação do biofilme em S. aureus (a) e P. aeruginosa (b) e no biofilme precoce (4h) em S. aureus (c) e P. aeruginosa (d). *p < 0,005 em relação ao controle positivo. Atividade antibiofilme com redução de 70% da biomassa de S. aureus foi encontrada na lectina da planta Punica granatum utilizando o dobro da concentração de LLB (200 µg/ml,), e o mecanismo de ação proposto pelos autores envolvia a interferência na expressão gênica e interação com a parede celular e/ou membrana de glicoconjugados (SILVA et al., 2016). Com 50 µg/ml a lectina de planta ApuL prejudicou a formação do biofilme de S. aureus em 45% da sua biomassa total (FERREIRA et al., 2018). Já a lectina comercial Triticum vulgaris (WGA) nas concentrações de 100 µg/ml preveniu a formação do biofilme de S. aureus em 85%, mas não foi capaz de atuar no biofilme pré-formado (KLEIN et al., 2019). 74
75 Para a bactéria gram-negativa P. aeruginosa 83% da biomassa total de biofilme foi inibida na concentração mais alta de 1000 µg/ml com diferença estatística para todas as demais concentrações. As concentrações de 0, e 100 µg/ml apesarem de terem diferença estatísticas com o não-tratado, mantiveram a inibição da formação do biofilme em cerca de 70% (Figura 17b). Para inibir porcentagens próximas à de inibição de S. aureus foi necessária uma concentração 10 vezes maior de LLB para P. aeruginosa. Uma possível explicação para uma menor concentração de LLB para S. aureus, é que, por ser uma bactéria gram-positiva, sua superfície é constituída por diversos carboidratos, peptideoglicanos, polissacarídeos capsulares e os ácidos teicoicos que podem atuar como sítios de ligação para LLB. O que em gram-negativas compreende apenas a uma fina camada de peptideoglicano coberto por uma membrana externa como em P. aeruginosa, limitando o número de possíveis sítios de ligações e exigindo maior concentração de LLB (WEIDENMAIER; PESCHEL, 2008). A lectina de esponja, dessa vez da Fasciospongia cavernosa, com afinidade para galactose, foi capaz de aglutinar S. aureus e P. aeruginosa e também inibiu o desenvolvimento do biofilme de Pseudomonas aeruginosa em aproximadamente 90% de inibição na concentração de 800 µg/ml (SADANANDAN; RAUF, 2018). Semelhantemente, a lectina da batata Solanum tuberosum não foi citotóxica para Pseudomonas mas ao ser administrada concomitantemente com a bactéria diminuiu de 5-20% a formação do biofilme (a concentração utilizada não foi informada) (HASAN; OZEKI; KABIR, 2014). Sem também divulgar a concentração testada, nas mesmas condições do teste preventivo, a lectina da bactéria Acinetobacter baumannii inibiu em 57% a formação do biofilme de P. aeruginosa (ABDULLAH; IDRIS; SAPARON, 2017). LLB se mostrou capaz de prejudicar a formação do biofilme de S. aureus e P. aeruginosa. É possível que LLB interaja com os glicanos complexos presentes na superfície dessas bactérias, visto que as lectinas podem reconhecer preferencialmente carboidratos complexos (GHAZARIAN; IDONI; OPPENHEIMER, 2011). Dessa forma, o efeito de LLB na redução do biofilme dessas bactérias pode ser explicada através da redução do número de bactérias aderentes através de sua ação aglutinante sendo capaz de bloquear a fixação e a adesão das bactérias na superfície (KLAFKE; BORSUK; GONC, 2013). Ao realizar esse ensaio in vitro, ao 75
76 encubar simultaneamente LLB e as bactérias, é viável que ocorra a formação de agregados bacterianos que não aderiram a superfície e que ao realizar as lavagens com tampão PBS foram descartados (JIN; LEE; HONG, 2018). Existem alguns trabalhos que também associaram a ação antibiofilme de suas lectinas purificadas à aglutinação das bactérias: Bryothamnion seaforthii (alga vermelha), Bauhinia bauhinioides (planta), Cratylia floribunda (planta), Canavalia boliviana (planta), Canavalia marítima (planta), Canavalia ensiformis (planta) (Etroplus suratensis (peixe), Chondrilla caribensis (esponja), Fasciospongia cavernosa (esponja), Aplysina lactuca (esponja), Aplysina fulva (esponja) e Aplysia dactylomela (lebre-do-mar). O segundo ensaio antibiofilme foi realizado através da administração de LLB, nas mesmas concentrações testadas anteriormente, após a formação de um biofilme precoce durante o período de 4 horas afim de pesquisar um possível mecanismo de erradicação do biofilme pré-formado. Na figura 17 estão os resultados com biofilme precoce de S. aureus (Figura 17c) e P. aeruginosa (Figura17d). A concentração de 0,1 µg/ml não teve diferença estatística do grupo nãotratado, as demais concentrações testadas tiveram diferenças estatísticas do controle. E novamente, não ocorreu diferença significativa entre as concentrações de 10, 100 e 1000 µg/ml LLB foi capaz de prejudicar o biofilme pré-formado de S. aureus chegando a 84% de inibição na concentração máxima de 1 mg/ml No biofilme formado depois de 24 horas, a lectina do veneno da Bothrops jararacussu na concentração 100 µg/ml afetou 85% da biomassa do biofilme de S. aureus através da inibição da expressão de genes responsáveis pela estruturação do biofilme. Essa lectina não foi capaz de inibir a formação do biofilme (ação preventiva) como LLB, atuando apenas na desestruturação do biofilme maduro (KLEIN et al., 2019). Já em P. aeruginosa a ação de LLB não foi tão expressiva quanto o resultado com S. aureus. Os grupos tratados tiveram diferença significativa quando comparado ao não-tratado, porém entre as concentrações de tratamento (0,1, 1, 10, 100 e 1000 µg/ml) não houve diferença estatística. Os tratamentos obtiveram uma porcentagem de inibição média de cerca de 25%. 76
77 A lectina do caranguejo Portunus pelagicus também de alto peso molecular como LLB (155 kda) teve capacidade de deteriorar a matriz polimérica do biofilme maduro (depois de 24 horas) de P. aeruginosa, na concentração de 25 µg/ml, inibindo a biomassa do biofilme em 40%. O mecanismo de ação proposto pelos autores seria a deterioração da matriz de substância extracelular polimérica (EPS) (JAYANTHI et al., 2017). Além de inibir a formação do biofilme, LLB também possuiu atividade sobre o biofilme pré-formado, ao ser aplicada após a formação em 4 horas do pré-biofilme. Esse tipo de mecanismo pode estar atrelado também à aglutinação bacteriana, mas principalmente na interferência com componentes da matriz extracelular polimérica, afetando a estrutura e polimerização do biofilme como ocorreu com a lectina da batata Solanum tuberosum que ao interagir com moléculas do EPS do biofilme prejudicou sua estruturação (HASAN; OZEKI; KABIR, 2014). Permitir a ação conjunta entre lectinas com atividade antibiofilme e antibióticos, ou mesmo compostos antibacterianos, pode potencializar os efeitos desses medicamentos. Uma combinação sinérgica estimula o uso de concentrações mais baixas de antibióticos, reduzindo os efeitos colaterais em humanos e a seleção de cepas resistentes a antibióticos, contribuindo para a redução do desenvolvimento da resistência bacteriana. Também amplia o espectro de ação do antibiótico, o que favorece a desestabilização dos biofilmes, uma vez que a diversidade de células em diferentes estados metabólicos e condições ambientais requerem diferentes mecanismos de ação (GRASSI et al., 2017). Porém, antes de qualquer aplicabilidade médica/farmacológica é necessário saber se LLB não é tóxica para o humano que irá se beneficiar de sua ação antibiofilme seja no revestimento de dispositivos médicos ou como fármaco. Com isso, foi testado o efeito de LLB em células: hemácias e fibroblastos murinos. 77
78 4.5 Citotoxicidade A toxicidade de concentrações de LLB (0,1, 1, 10, 100 e 1000 µg/ml LLB foi analisada utilizando hemácias humanas e diferentes). Células tratadas com Triton X- 100 a 1% foram correspondentes ao controle positivo para hemólise dado o alto efeito hemolítico desse agente surfactante aniônico. Já o controle negativo empregado ao tratamento foi salina NaCl 0,9 % (Figura 18). Figura 18 Avaliação do efeito hemolítico de diferentes concentrações de LLB. Hemácias tratadas com 1 % de Trinton X 100 e tratadas com salina 0,9 % são controle positivo e negativo de hemólise, respectivamente; *p < 0,005 em relação ao controle positivo. Em todas as concentrações testadas de LLB, incluindo a mais alta (1 mg/ml), não foi observada toxicidade para as células vermelhas sanguíneas diferentemente da lectina do cogumelo Laetiporus sulphureus que possui alta atividade hemolítica associada a hemaglutinação (TATENO; GOLDSTEIN, 2003). Na última década estudos com as hemolisinas fúngicas têm-se destacado, principalmente devido à sua diversidade proteica e seu papel desempenhado no crescimento e regulação dos corpos de frutificação (NAYAK; GREEN; BEEZHOLD, 2016). Também foi realizado o ensaio de viabilidade celular utilizando células fibroblásticas normais de camundongos (3T3) pelo ensaio de redução de MTT a formazam durante 24 (Figura 19a) e 48 horas (Figura 19b). 78
79 Figura 19 Efeito de LLB sobre a viabilidade da linhagem celular 3T3. A avaliação da citotoxicidade LLB sobre a linhagem fibroblástica de camundongo 3T3 foi feita pelo ensaio de redução do MTT em 24 (a) e 48 horas (b). No tempo de 24 horas LLB manteve a viabilidade celular sem diferenças estatísticas do grupo não tratado com LLB, exceto a concentração de 100 µg/ml que teve diferença estatística do grupo controle de viabilidade. Porém, com tempo de 48 horas essa diferença estatística não é mais significativa. Dessa forma, LLB não foi capaz de alterar a viabilidade celular de fibroblastos de camundongo. A lectina Langermannia bicolor (LLB) não apresentou toxicidade às células testadas. Os fibroblastos foram capazes de proliferar e as hemácias não sofreram hemólise quando estiveram em contato com LLB. Um efeito antiploriferativo em células 3T3 e células tumorais da linhagem HeLa foi encontrado na lectina (140 µg/ml) do fungo Xerocomus chrysenteron (HASSAN et al., 2015; MARTY-DETRAVES et al., 2004). Em contrapartida, a quimerolectina dependente de cálcio - já citada neste trabalho - Marasmius oreades (MOA) possui em seu domínio catalítico a região chave para sua toxicidade frente à linhagens 3T3. Além de inibir a síntese proteica da célula, MOA possuiu um efeito citotóxico devido a sua ação enzimática (de natureza proteolítica) (CORDARA et al., 2014). A aplicabilidade médica de uma biomolécula que não causa prejuízos aos tecidos do hospedeiro se potencializa, principalmente no design de novos fármacos e/ou dispositivos antibiofilmes por exemplo (NEETHIRAJAN; CLOND; VOGT, 2014). O isolamento de LLB é um estudo inédito na literatura científica, principalmente porque o material biológico é extremamente inexplorado do ponto de 79
Biofilmes Bacterianos
 Biofilmes Bacterianos Biofilmes Bactérias isoladas x Bactérias em associação Biofilmes: Comunidades de bactérias aderidas a superfícies sólidasou semi-sólidas, envoltas por uma matriz de polímeros extracelulares
Biofilmes Bacterianos Biofilmes Bactérias isoladas x Bactérias em associação Biofilmes: Comunidades de bactérias aderidas a superfícies sólidasou semi-sólidas, envoltas por uma matriz de polímeros extracelulares
Fighting bacteria using selective drugs for membranes
 Universidade de Lisboa Faculdade de Ciências Departamento de Química e Bioquímica Fighting bacteria using selective drugs for membranes Versão Pública Susana Filipa Almeida Dias Dissertação Mestrado em
Universidade de Lisboa Faculdade de Ciências Departamento de Química e Bioquímica Fighting bacteria using selective drugs for membranes Versão Pública Susana Filipa Almeida Dias Dissertação Mestrado em
Purificação parcial, Caracterização e Imobilização de lectina de sementes de Brosimum gaudichaudii.
 Purificação parcial, Caracterização e Imobilização de lectina de sementes de Brosimum gaudichaudii. MACHADO, Paula Marce Fernandes 1 ; FERNANDES, Kátia Flávia 2 1 2 Laboratório de Química de Proteínas
Purificação parcial, Caracterização e Imobilização de lectina de sementes de Brosimum gaudichaudii. MACHADO, Paula Marce Fernandes 1 ; FERNANDES, Kátia Flávia 2 1 2 Laboratório de Química de Proteínas
Bases ecológicas da resistência bacteriana às drogas
 Bases ecológicas da resistência bacteriana às drogas Drogas antimicrobianas: mecanismo de ação Um aspecto do controle do crescimento dos microrganismos envolve a utilização de fármacos no tratamento de
Bases ecológicas da resistência bacteriana às drogas Drogas antimicrobianas: mecanismo de ação Um aspecto do controle do crescimento dos microrganismos envolve a utilização de fármacos no tratamento de
- A energia é armazenada em suas ligações químicas e liberadas na digestão
 1 IV Bioquímica de biomoléculas 1 Carboidratos ou Glicídeos - São as biomoléculas mais abundantes - São uma classe de moléculas orgânicas que possuem em sua estrutura carbono (C), hidrogênio () e oxigênio
1 IV Bioquímica de biomoléculas 1 Carboidratos ou Glicídeos - São as biomoléculas mais abundantes - São uma classe de moléculas orgânicas que possuem em sua estrutura carbono (C), hidrogênio () e oxigênio
Microbiota Normal do Corpo Humano
 Microbiota Normal do Corpo Humano Microbiota Microbiota Microflora Flora indígena São termos usados para denominar os microrganismos que habitam o corpo humano e interagem de forma benéfica. Flora normal
Microbiota Normal do Corpo Humano Microbiota Microbiota Microflora Flora indígena São termos usados para denominar os microrganismos que habitam o corpo humano e interagem de forma benéfica. Flora normal
1.4 Metodologias analíticas para isolamento e identificação de micro-organismos em alimentos
 Áreas para Submissão de Resumos (1) Microbiologia de Alimentos Trabalhos relacionados com micro-organismos associados aos alimentos: crescimento, identificação, biossíntese, controle, interação com o hospedeiro,
Áreas para Submissão de Resumos (1) Microbiologia de Alimentos Trabalhos relacionados com micro-organismos associados aos alimentos: crescimento, identificação, biossíntese, controle, interação com o hospedeiro,
Morfologia e estruturas bacterianas. Prof. Dr. Marcio Vinicius Bertacine Dias Laboratório de Biologia Estrutural Aplicada sala 166 ICB-II
 Morfologia e estruturas bacterianas Prof. Dr. Marcio Vinicius Bertacine Dias Laboratório de Biologia Estrutural Aplicada sala 166 ICB-II -O que são as bactérias? -Por que devemos estudar as bactérias?
Morfologia e estruturas bacterianas Prof. Dr. Marcio Vinicius Bertacine Dias Laboratório de Biologia Estrutural Aplicada sala 166 ICB-II -O que são as bactérias? -Por que devemos estudar as bactérias?
Henrique Guimarães Fernandes Médico Veterinário - Departamento de Nutrição da Vaccinar
 ACIDIFICANTES Henrique Guimarães Fernandes Médico Veterinário - Departamento de Nutrição da Vaccinar INTRODUÇÃO Os ácidos orgânicos englobam aqueles ácidos cuja estrutura química se baseiam no carbono.
ACIDIFICANTES Henrique Guimarães Fernandes Médico Veterinário - Departamento de Nutrição da Vaccinar INTRODUÇÃO Os ácidos orgânicos englobam aqueles ácidos cuja estrutura química se baseiam no carbono.
Métodos de Purificação de Proteínas Nativas
 Métodos de Purificação de Proteínas Nativas Disciplina: Métodos de Análise e Purificação de Proteínas Prof. Dr. Marcos Túlio de Oliveira Créditos a Ms. Flávia Campos Freitas Vieira e Prof. Pisauro. Métodos
Métodos de Purificação de Proteínas Nativas Disciplina: Métodos de Análise e Purificação de Proteínas Prof. Dr. Marcos Túlio de Oliveira Créditos a Ms. Flávia Campos Freitas Vieira e Prof. Pisauro. Métodos
Antimicrobianos: Resistência Bacteriana. Prof. Marcio Dias
 Antimicrobianos: Resistência Bacteriana Prof. Marcio Dias Resistência Capacidade adquirida de resistir aos efeitos de um agente quimioterápico, normalmente que um organismo é sensível. Como eles adquiriram:
Antimicrobianos: Resistência Bacteriana Prof. Marcio Dias Resistência Capacidade adquirida de resistir aos efeitos de um agente quimioterápico, normalmente que um organismo é sensível. Como eles adquiriram:
UNIVERSIDADE FEDERAL DE JUIZ DE FORA DEPARTAMENTO DE PARASITOLOGIA, MICROBIOLOGIA E IMUNOLOGIA. Antibioticos e resistência bacteriana a drogas
 UNIVERSIDADE FEDERAL DE JUIZ DE FORA DEPARTAMENTO DE PARASITOLOGIA, MICROBIOLOGIA E IMUNOLOGIA Antibioticos e resistência bacteriana a drogas Controle de população microbiana in vivo Controle do crescimento
UNIVERSIDADE FEDERAL DE JUIZ DE FORA DEPARTAMENTO DE PARASITOLOGIA, MICROBIOLOGIA E IMUNOLOGIA Antibioticos e resistência bacteriana a drogas Controle de população microbiana in vivo Controle do crescimento
Seminários 2013 Resíduos Hospitalares. ActivapTM e Polygiene Tecnologias Inovadoras na prevenção de infeções António Santos
 Seminários 2013 Resíduos Hospitalares ActivapTM e Polygiene Tecnologias Inovadoras na prevenção de infeções António Santos 1 1 CANNON HYGIENE DESINFEÇÃO DE RESÍDUOS RISCO DE INFEÇÃO 1 Os resíduos sanitários
Seminários 2013 Resíduos Hospitalares ActivapTM e Polygiene Tecnologias Inovadoras na prevenção de infeções António Santos 1 1 CANNON HYGIENE DESINFEÇÃO DE RESÍDUOS RISCO DE INFEÇÃO 1 Os resíduos sanitários
UNIVERSIDADE FEDERAL DE PERNAMBUCO CENTRO DE CIÊNCIAS BIOLÓGICAS DEPARTAMENTO DE BIOQUÍMICA MESTRADO EM BIOQUÍMICA
 UNIVERSIDADE FEDERAL DE PERNAMBUCO CENTRO DE CIÊNCIAS BIOLÓGICAS DEPARTAMENTO DE BIOQUÍMICA MESTRADO EM BIOQUÍMICA ISOLAMENTO, CARACTERIZAÇÃO PARCIAL E IMOBILIZAÇÃO EM SEPHAROSE CL-4B DA LECTINA DE ENTRECASCA
UNIVERSIDADE FEDERAL DE PERNAMBUCO CENTRO DE CIÊNCIAS BIOLÓGICAS DEPARTAMENTO DE BIOQUÍMICA MESTRADO EM BIOQUÍMICA ISOLAMENTO, CARACTERIZAÇÃO PARCIAL E IMOBILIZAÇÃO EM SEPHAROSE CL-4B DA LECTINA DE ENTRECASCA
Isolamento, Seleção e Cultivo de Bactérias Produtoras de Enzimas para Aplicação na Produção mais Limpa de Couros
 Universidade Federal do Rio Grande do Sul Programa de Pós-Graduação em Engenharia Química Departamento de Engenharia Química Laboratório de Estudos em Couro e Meio Ambiente Isolamento, Seleção e Cultivo
Universidade Federal do Rio Grande do Sul Programa de Pós-Graduação em Engenharia Química Departamento de Engenharia Química Laboratório de Estudos em Couro e Meio Ambiente Isolamento, Seleção e Cultivo
UNIVERSIDADE DO SAGRADO CORAÇÃO
 UNIVERSIDADE DO SAGRADO CORAÇÃO RAFAELA PIGNATTI DE FREITAS ATIVIDADE ANTIBIOFILME E PROPRIEDADES FÍSICAS DE CIMENTOS ENDODÔNTICOS ASSOCIADOS À AMOXICILINA, PÓ TRI- ANTIBIÓTICO E DICLOFENACO SÓDICO BAURU
UNIVERSIDADE DO SAGRADO CORAÇÃO RAFAELA PIGNATTI DE FREITAS ATIVIDADE ANTIBIOFILME E PROPRIEDADES FÍSICAS DE CIMENTOS ENDODÔNTICOS ASSOCIADOS À AMOXICILINA, PÓ TRI- ANTIBIÓTICO E DICLOFENACO SÓDICO BAURU
Quimioterápicos Arsenobenzóis Sulfas
 ANTIBIÓTICOS 1 INTRODUÇÃO: História: Penicillium notatum Antibiose S. aureus Ser Vivo x Ser Vivo Antibiótico Fungo x Bactéria Quimioterápicos Antibiótico Sir Alexander Fleming 1909 Arsenobenzóis 1935 -
ANTIBIÓTICOS 1 INTRODUÇÃO: História: Penicillium notatum Antibiose S. aureus Ser Vivo x Ser Vivo Antibiótico Fungo x Bactéria Quimioterápicos Antibiótico Sir Alexander Fleming 1909 Arsenobenzóis 1935 -
RELATÓRIO S0BRE A PESQUISA DAS ACTIVIDADES ANTI-BACTERIAIS E ANTI- FÚNGICAS DA PREPARAÇÃO "Herba Sept Strong"
 Instituto de Pesquisas Biológica "Sinisa Stankovic" Universidade em Belgrado Bul. despota Stefana 142 Diretor; 011-2078-399 Tel: 011-2078-300 Fax: 011-2078-433 www.ibiss.bg.ac.rs No. 01-318_ INSTITUTE
Instituto de Pesquisas Biológica "Sinisa Stankovic" Universidade em Belgrado Bul. despota Stefana 142 Diretor; 011-2078-399 Tel: 011-2078-300 Fax: 011-2078-433 www.ibiss.bg.ac.rs No. 01-318_ INSTITUTE
06/10/2017. Microbiologia da água
 06/10/2017 Microbiologia da água Água Água potável 2,5 bilhões de pessoas não têm acesso ao saneamento básico países em desenvolvimento. 1,5 milhões de crianças morrem por ano, tendo como causa as diarréias.
06/10/2017 Microbiologia da água Água Água potável 2,5 bilhões de pessoas não têm acesso ao saneamento básico países em desenvolvimento. 1,5 milhões de crianças morrem por ano, tendo como causa as diarréias.
BIOLOGIA. Moléculas, células e tecidos. Estrutura e fisiologia da Membrana Plasmática - Parte 1. Professor: Alex Santos
 BIOLOGIA Moléculas, células e tecidos Estrutura e fisiologia da Membrana Plasmática - Parte 1 Professor: Alex Santos Tópicos em abordagem: Estrutura e fisiologia da Membrana Plasmática - Parte 1 Parte
BIOLOGIA Moléculas, células e tecidos Estrutura e fisiologia da Membrana Plasmática - Parte 1 Professor: Alex Santos Tópicos em abordagem: Estrutura e fisiologia da Membrana Plasmática - Parte 1 Parte
Palavras chave: peptídeo; estrutura 3D; SDS micelas
 Estudo estrutural por RMN de 1 H de peptídeos bioativos isolados da secreção cutânea de Hypsiobas albopunctatus e Leptodactylus labyrinthicus Eliane Santana FERNANDES *1, Luciano Morais LIÃO 1, Aline Lima
Estudo estrutural por RMN de 1 H de peptídeos bioativos isolados da secreção cutânea de Hypsiobas albopunctatus e Leptodactylus labyrinthicus Eliane Santana FERNANDES *1, Luciano Morais LIÃO 1, Aline Lima
Métodos de Purificação de Proteínas Nativas
 Disciplina de Mét. Purif. e Anál. Proteínas Curso de Ciências Biológicas Métodos de Purificação de Proteínas Nativas Prof. Marcos Túlio de Oliveira mtoliveira@fcav.unesp.br Faculdade de Ciências Agrárias
Disciplina de Mét. Purif. e Anál. Proteínas Curso de Ciências Biológicas Métodos de Purificação de Proteínas Nativas Prof. Marcos Túlio de Oliveira mtoliveira@fcav.unesp.br Faculdade de Ciências Agrárias
TÍTULO: A UTILIZAÇÃO DO COBRE COMO ANTIMICROBIANO EM HOSPITAIS E LOCAIS PÚBLICOS DE GRANDE CIRCULAÇÃO
 TÍTULO: A UTILIZAÇÃO DO COBRE COMO ANTIMICROBIANO EM HOSPITAIS E LOCAIS PÚBLICOS DE GRANDE CIRCULAÇÃO CATEGORIA: CONCLUÍDO ÁREA: CIÊNCIAS EXATAS E DA TERRA SUBÁREA: QUÍMICA INSTITUIÇÃO: UNIVERSIDADE CAMILO
TÍTULO: A UTILIZAÇÃO DO COBRE COMO ANTIMICROBIANO EM HOSPITAIS E LOCAIS PÚBLICOS DE GRANDE CIRCULAÇÃO CATEGORIA: CONCLUÍDO ÁREA: CIÊNCIAS EXATAS E DA TERRA SUBÁREA: QUÍMICA INSTITUIÇÃO: UNIVERSIDADE CAMILO
Microbiologia ambiental 30/09/201 4
 Microbiologia ambiental 30/09/201 4 Microbiologia da água 30/09/ 2014 Água Microbiologia da água Águas naturais Rios Estuários Oceanos Água potável Água potável 2,5 bilhões de pessoas não têm acesso ao
Microbiologia ambiental 30/09/201 4 Microbiologia da água 30/09/ 2014 Água Microbiologia da água Águas naturais Rios Estuários Oceanos Água potável Água potável 2,5 bilhões de pessoas não têm acesso ao
PATOGENICIDADE BACTERIANA
 PATOGENICIDADE BACTERIANA Fatores de de Virulência Instituto Federal de Educação, Ciência e Tecnologia do Pará Instituto Federal de Educação, Ciência e Tecnologia do Pará Curso de Licenciatura Plena em
PATOGENICIDADE BACTERIANA Fatores de de Virulência Instituto Federal de Educação, Ciência e Tecnologia do Pará Instituto Federal de Educação, Ciência e Tecnologia do Pará Curso de Licenciatura Plena em
SOLUÇÕES INOVADORAS NA DETECÇÃO E ELIMINAÇÃO DE BIOFILMES
 SOLUÇÕES INOVADORAS NA DETECÇÃO E ELIMINAÇÃO DE BIOFILMES SOLUÇÕES INOVADORAS NA DETECÇÃO E ELIMINAÇÃO DE BIOFILMES A solução definitiva para um problema complexo A segurança na indústria alimentar e farmacêutica
SOLUÇÕES INOVADORAS NA DETECÇÃO E ELIMINAÇÃO DE BIOFILMES SOLUÇÕES INOVADORAS NA DETECÇÃO E ELIMINAÇÃO DE BIOFILMES A solução definitiva para um problema complexo A segurança na indústria alimentar e farmacêutica
Objectivo: Separar uma proteína das restantes no extracto celular. Estratégia: Existem inúmeras técnicas de purificação disponíveis.
 Objectivo: Separar uma proteína das restantes no extracto celular Estratégia: Existem inúmeras técnicas de purificação disponíveis. O procedimento exacto e a ordem dos métodos a aplicar dependem do tipo
Objectivo: Separar uma proteína das restantes no extracto celular Estratégia: Existem inúmeras técnicas de purificação disponíveis. O procedimento exacto e a ordem dos métodos a aplicar dependem do tipo
Injúria microbiana. Talita Schneid Tejada. Pelotas, outubro de 2008
 Injúria microbiana Talita Schneid Tejada Pelotas, outubro de 2008 Artigo base: Uma revisão sobre injúria microbiana alimentar e métodos de recuperação V.C.H. Wu Food Microbiology 25 (2008) 735-744 Objetivo
Injúria microbiana Talita Schneid Tejada Pelotas, outubro de 2008 Artigo base: Uma revisão sobre injúria microbiana alimentar e métodos de recuperação V.C.H. Wu Food Microbiology 25 (2008) 735-744 Objetivo
ÍNDICE. Agradecimentos Abreviaturas Índice de Figuras Índice de Tabelas Índice de Gráficos e Esquemas
 ÍNDICE Agradecimentos Abreviaturas de Figuras de Tabelas de Gráficos e Esquemas Sumário Abstract pág. xxi xxv xxvii xxxi xxxiii xxxv xxxvii CAPÍTULO I- INTRODUÇÃO I.1 Família Leguminosae 3 1.1- Interesse
ÍNDICE Agradecimentos Abreviaturas de Figuras de Tabelas de Gráficos e Esquemas Sumário Abstract pág. xxi xxv xxvii xxxi xxxiii xxxv xxxvii CAPÍTULO I- INTRODUÇÃO I.1 Família Leguminosae 3 1.1- Interesse
02/07/2010. Importância. Pesquisas. Agente Antimicrobiano. Biofilmes. Agentes Quimioterápicos (Antimicróbicos) Antibióticos. Saúde.
 Importância Saúde Economia Pesquisas Novos compostos Resustência Biofilmes Importância na terapêutica antimicrobiana Agente Antimicrobiano Composto químico que mata ou inibe o crescimento de microrganismos,
Importância Saúde Economia Pesquisas Novos compostos Resustência Biofilmes Importância na terapêutica antimicrobiana Agente Antimicrobiano Composto químico que mata ou inibe o crescimento de microrganismos,
MARINE C THIOPEPTIDE. Teste de Eficácia:
 MARINE C THIOPEPTIDE Ciclopeptídeo Antiacne Descrição MARINE C THIOPEPTIDE é um ciclopeptídeo de ação tópica para tratamento da acne. Composto quimicamente natural, produzido por um actinomiceto marinho
MARINE C THIOPEPTIDE Ciclopeptídeo Antiacne Descrição MARINE C THIOPEPTIDE é um ciclopeptídeo de ação tópica para tratamento da acne. Composto quimicamente natural, produzido por um actinomiceto marinho
Projeto de iniciação cientifica. Peptídeos antimicrobianos como ferramenta biotecnológica. Isabela Suriani Caetano. Orientador: Érica Soares Martins
 Projeto de iniciação cientifica Peptídeos antimicrobianos como ferramenta biotecnológica Isabela Suriani Caetano Orientador: Érica Soares Martins Brasília, maio de 2013 1 Índice 1. Resumo 3 2. Introdução
Projeto de iniciação cientifica Peptídeos antimicrobianos como ferramenta biotecnológica Isabela Suriani Caetano Orientador: Érica Soares Martins Brasília, maio de 2013 1 Índice 1. Resumo 3 2. Introdução
USO RACIONAL DOS ANTIBIÓTICOS. Prof. Dra. Susana Moreno
 USO RACIONAL DOS ANTIBIÓTICOS Prof. Dra. Susana Moreno 1 Antibióticos Uma das mais importantes descobertas da medicina moderna Salva milhões de vidas ANTIBIÓTICOS BETA-LACTÂMICOS 3 Antibióticos Beta Lactâmicos
USO RACIONAL DOS ANTIBIÓTICOS Prof. Dra. Susana Moreno 1 Antibióticos Uma das mais importantes descobertas da medicina moderna Salva milhões de vidas ANTIBIÓTICOS BETA-LACTÂMICOS 3 Antibióticos Beta Lactâmicos
Bases do diagnóstico bacteriológico
 Bases do diagnóstico bacteriológico Prof. Cláudio Galuppo Diniz Diagnóstico clínico Sinais (mensuráveis) e sintomas (subjetivos) Origem Etiologia Natureza Diagnóstico laboratorial Identificação agentes
Bases do diagnóstico bacteriológico Prof. Cláudio Galuppo Diniz Diagnóstico clínico Sinais (mensuráveis) e sintomas (subjetivos) Origem Etiologia Natureza Diagnóstico laboratorial Identificação agentes
SUSCETIBILIDADE E RESISTÊNCIA AOS ANTIFÚNGICOS
 SUSCETIBILIDADE E RESISTÊNCIA AOS ANTIFÚNGICOS ANTIFÚNGICOS Entende-se por antifúngico ou antimicótico a toda a substância que tem a capacidade de evitar o crescimento de alguns tipos de fungos ou inclusive
SUSCETIBILIDADE E RESISTÊNCIA AOS ANTIFÚNGICOS ANTIFÚNGICOS Entende-se por antifúngico ou antimicótico a toda a substância que tem a capacidade de evitar o crescimento de alguns tipos de fungos ou inclusive
24/11/2015. Biologia de Microrganismos - 2º Semestre de Prof. Cláudio 1. O mundo microbiano. Profa. Alessandra B. F. Machado
 UNIVERSIDADE FEDERAL DE JUIZ DE FORA DEPARTAMENTO DE PARASITOLOGIA, MICROBIOLOGIA E IMUNOLOGIA Relação bactéria-hospedeiro Profa. Alessandra B. F. Machado O mundo microbiano Os microrganismos são ubíquos.
UNIVERSIDADE FEDERAL DE JUIZ DE FORA DEPARTAMENTO DE PARASITOLOGIA, MICROBIOLOGIA E IMUNOLOGIA Relação bactéria-hospedeiro Profa. Alessandra B. F. Machado O mundo microbiano Os microrganismos são ubíquos.
Fonte de energia Estrutura celular Sinais. Função biológica. Monossacarídeos Oligossacarídeos Polissacarídeos. Classificação
 Função biológica Fonte de energia Estrutura celular Sinais Classificação Monossacarídeos Oligossacarídeos Polissacarídeos Monossacarídeos Aldose ou cetose 3 a 7 carbonos Isomeria D e L Solução aquosa Forma
Função biológica Fonte de energia Estrutura celular Sinais Classificação Monossacarídeos Oligossacarídeos Polissacarídeos Monossacarídeos Aldose ou cetose 3 a 7 carbonos Isomeria D e L Solução aquosa Forma
Na aula de hoje continuaremos a estudar as funções bioquímicas das proteínas. Boa aula!
 Aula: 20 Temática: Funções bioquímicas das proteínas parte II Na aula de hoje continuaremos a estudar as funções bioquímicas das proteínas. Boa aula! 1) Mediadores e reguladores metabólicos (continuação):
Aula: 20 Temática: Funções bioquímicas das proteínas parte II Na aula de hoje continuaremos a estudar as funções bioquímicas das proteínas. Boa aula! 1) Mediadores e reguladores metabólicos (continuação):
Resposta inicial que, em muitos casos, impede a infecção do hospedeiro podendo eliminar os micróbios
 Resposta inicial que, em muitos casos, impede a infecção do hospedeiro podendo eliminar os micróbios Células da imunidade inata (macrófagos e neutrófilos) chegam rapidamente e em grande número no foco
Resposta inicial que, em muitos casos, impede a infecção do hospedeiro podendo eliminar os micróbios Células da imunidade inata (macrófagos e neutrófilos) chegam rapidamente e em grande número no foco
Antígenos Recombinantes e suas aplicações em Imunologia
 UNIVERSIDADE ESTADUAL PAULISTA - UNESP FACULDADE DE CIÊNCIAS AGRÁRIAS E VETERINÁRIAS FCAV CAMPUS DE JABOTICABAL Antígenos Recombinantes e suas aplicações em Imunologia Bióloga Mariana Monezi Borzi Doutoranda
UNIVERSIDADE ESTADUAL PAULISTA - UNESP FACULDADE DE CIÊNCIAS AGRÁRIAS E VETERINÁRIAS FCAV CAMPUS DE JABOTICABAL Antígenos Recombinantes e suas aplicações em Imunologia Bióloga Mariana Monezi Borzi Doutoranda
Tela 1. Imagem. Esboço da tela. texto
 Título da animação: No tempo certo Autoras: Maria Aparecida da Silva Prado e Silvana Texto: A descoberta casual da penicilina por Alexander Fleming no final da década de 20 marca o início da era moderna
Título da animação: No tempo certo Autoras: Maria Aparecida da Silva Prado e Silvana Texto: A descoberta casual da penicilina por Alexander Fleming no final da década de 20 marca o início da era moderna
Controle da população microbiana
 Controle da população microbiana Microbiologia Prof a. Vânia Controle da população microbiana Destruir, inibir ou remover microrganismos Agentes físicos Agentes químicos Microrganismos em n os aceitáveis
Controle da população microbiana Microbiologia Prof a. Vânia Controle da população microbiana Destruir, inibir ou remover microrganismos Agentes físicos Agentes químicos Microrganismos em n os aceitáveis
Maria Eugênia Silveira da Rosa 1 ; Sheila Mello da Silveira 2 INTRODUÇÃO
 FRACIONAMENTO DOS EXTRATOS HIDROALCOÓLICOS DE Campomanesia eugenioides (GUABIROBA) E Parapiptadenia rigida (ANGICO VERMELHO) E DETERMINAÇÃO DA ATIVIDADE ANTIMICROBIANA Maria Eugênia Silveira da Rosa 1
FRACIONAMENTO DOS EXTRATOS HIDROALCOÓLICOS DE Campomanesia eugenioides (GUABIROBA) E Parapiptadenia rigida (ANGICO VERMELHO) E DETERMINAÇÃO DA ATIVIDADE ANTIMICROBIANA Maria Eugênia Silveira da Rosa 1
BIOFILMES BACTERIANOS FORMAÇÃO E CONTROLE DA ADESÃO
 BIOFILMES BACTERIANOS FORMAÇÃO E CONTROLE DA ADESÃO O Biofilme Microbiano é formado por colônias de microrganismos. Sua massa celular é suficiente para que sejam agregados nutrientes, resíduos e outros
BIOFILMES BACTERIANOS FORMAÇÃO E CONTROLE DA ADESÃO O Biofilme Microbiano é formado por colônias de microrganismos. Sua massa celular é suficiente para que sejam agregados nutrientes, resíduos e outros
CULTIVO, NUTRIÇÃO E MEIOS DE CULTURA UTILIZADOS NO CRESCIMENTO DE MICRORGANISMOS
 CULTIVO, NUTRIÇÃO E MEIOS DE CULTURA UTILIZADOS NO CRESCIMENTO DE MICRORGANISMOS CULTIVO: CONDIÇÕES FÍSICAS PARA O CRESCIMENTO MICROBIANO CULTIVO: CONDIÇÕES FÍSICAS PARA O CRESCIMENTO MICROBIANO CULTIVO:
CULTIVO, NUTRIÇÃO E MEIOS DE CULTURA UTILIZADOS NO CRESCIMENTO DE MICRORGANISMOS CULTIVO: CONDIÇÕES FÍSICAS PARA O CRESCIMENTO MICROBIANO CULTIVO: CONDIÇÕES FÍSICAS PARA O CRESCIMENTO MICROBIANO CULTIVO:
mundo inteiro com uma variedade de aplicações como clonagem, genotipagem e sequenciamento.
 mundo inteiro com uma variedade de aplicações como clonagem, genotipagem e sequenciamento. necessária para que você possa alcançar o melhor desempenho nesta técnica. AGAROSE A agarose é um polissacarídeo
mundo inteiro com uma variedade de aplicações como clonagem, genotipagem e sequenciamento. necessária para que você possa alcançar o melhor desempenho nesta técnica. AGAROSE A agarose é um polissacarídeo
Monossacarídeos. Solução aquosa. Cadeia carbonica 3 a 7 C Grupamento carbonila (Aldose ou cetose) e hidroxilas Isomeria D e L (2 n )
 Monossacarídeos Cadeia carbonica 3 a 7 C Grupamento carbonila (Aldose ou cetose) e hidroxilas Isomeria D e L (2 n ) Solução aquosa Forma cíclica - Anômeros α e β Forma linear ou aberta - redutor Reação
Monossacarídeos Cadeia carbonica 3 a 7 C Grupamento carbonila (Aldose ou cetose) e hidroxilas Isomeria D e L (2 n ) Solução aquosa Forma cíclica - Anômeros α e β Forma linear ou aberta - redutor Reação
EXTRAÇÃO, SEPARAÇÃO E PURIFICAÇÃO ENZIMÁTICA
 EXTRAÇÃO, SEPARAÇÃO E PURIFICAÇÃO ENZIMÁTICA EQB4383 _ Enzimologia Industrial Etapas de Extração, Separação e Purificação Enzimáticas remoção de material insolúvel separação dos produtos purificação e
EXTRAÇÃO, SEPARAÇÃO E PURIFICAÇÃO ENZIMÁTICA EQB4383 _ Enzimologia Industrial Etapas de Extração, Separação e Purificação Enzimáticas remoção de material insolúvel separação dos produtos purificação e
Replicação. Transcrição. Antígenos Recombinantes e suas aplicações em Imunologia 22/03/2016
 UNIVERSIDADE ESTADUAL PAULISTA - UNESP FACULDADE DE CIÊNCIAS AGRÁRIAS E VETERINÁRIAS FCAV CAMPUS DE JABOTICABAL Antígenos Recombinantes e suas aplicações em Imunologia Bióloga Mariana Monezi Borzi Mestre
UNIVERSIDADE ESTADUAL PAULISTA - UNESP FACULDADE DE CIÊNCIAS AGRÁRIAS E VETERINÁRIAS FCAV CAMPUS DE JABOTICABAL Antígenos Recombinantes e suas aplicações em Imunologia Bióloga Mariana Monezi Borzi Mestre
FISIOLOGIA E TRANSPORTE ATRAVÉS DA MEMBRANA CELULAR
 FISIOLOGIA E TRANSPORTE ATRAVÉS DA MEMBRANA CELULAR AULA 2 DISCIPLINA: FISIOLOGIA I PROFESSOR RESPONSÁVEL: FLÁVIA SANTOS Membrana Celular ou Membrana Plasmática Função 2 Membrana Celular ou Membrana Plasmática
FISIOLOGIA E TRANSPORTE ATRAVÉS DA MEMBRANA CELULAR AULA 2 DISCIPLINA: FISIOLOGIA I PROFESSOR RESPONSÁVEL: FLÁVIA SANTOS Membrana Celular ou Membrana Plasmática Função 2 Membrana Celular ou Membrana Plasmática
USO RACIONAL DE ANTIBIÓTICOS
 USO RACIONAL DE ANTIBIÓTICOS USO IRRACIONAL DE ANTIBIÓTICOS infecções virais ( sarampo, catapora e 90% das infecções do trato respiratório superior ) tratamento de estados febris de origem desconhecida,
USO RACIONAL DE ANTIBIÓTICOS USO IRRACIONAL DE ANTIBIÓTICOS infecções virais ( sarampo, catapora e 90% das infecções do trato respiratório superior ) tratamento de estados febris de origem desconhecida,
PURIFICAÇÃO E CARACTERIZAÇÃO DE PROTEINASE EXTRACELULAR PRODUZIDA POR Candida krusei AP176.
 ALMIR ASSIS BRAGA PURIFICAÇÃO E CARACTERIZAÇÃO DE PROTEINASE EXTRACELULAR PRODUZIDA POR Candida krusei AP176. Tese apresentada ao Departamento de Microbiologia do Instituto de Ciências Biológicas da Universidade
ALMIR ASSIS BRAGA PURIFICAÇÃO E CARACTERIZAÇÃO DE PROTEINASE EXTRACELULAR PRODUZIDA POR Candida krusei AP176. Tese apresentada ao Departamento de Microbiologia do Instituto de Ciências Biológicas da Universidade
As bases bioquímicas da vida
 As bases bioquímicas da vida Água, Sais Minerais, Carboidratos, Lipídios, Proteínas e Vitaminas 1º Ano Profª Priscila F Binatto Constituintes Bioquímicos da Célula Água e Minerais Carboidratos Lipídios
As bases bioquímicas da vida Água, Sais Minerais, Carboidratos, Lipídios, Proteínas e Vitaminas 1º Ano Profª Priscila F Binatto Constituintes Bioquímicos da Célula Água e Minerais Carboidratos Lipídios
CARACTERÍSTICAS GERAIS DAS BACTÉRIAS (Citologia) PRINCIPAIS DIFERENÇAS ENTRE CÉLULAS EUCARIÓTICAS E PROCARIÓTICAS
 1 PRINCIPAIS DIFERENÇAS ENTRE CÉLULAS EUCARIÓTICAS E PROCARIÓTICAS 2 ESTRUTURAS DAS CÉLULAS PROCARIÓTICAS: FUNDAMENTAIS Parede Celular Membrana Celular Ribossoma Genoma Fundamentais a Viabilidade da Célula
1 PRINCIPAIS DIFERENÇAS ENTRE CÉLULAS EUCARIÓTICAS E PROCARIÓTICAS 2 ESTRUTURAS DAS CÉLULAS PROCARIÓTICAS: FUNDAMENTAIS Parede Celular Membrana Celular Ribossoma Genoma Fundamentais a Viabilidade da Célula
Biofilmes: estrutura, formação, ecologia
 Formação de Biofilme de Pseudomonas aeruginosa Biofilmes: estrutura Biofilmes: estrutura, formação, ecologia Biofilmes: formação: coagregação Os principais componentes estruturais de biofilmes são: Microrganismos
Formação de Biofilme de Pseudomonas aeruginosa Biofilmes: estrutura Biofilmes: estrutura, formação, ecologia Biofilmes: formação: coagregação Os principais componentes estruturais de biofilmes são: Microrganismos
ATIVIDADE SANIFICANTE DO ÓLEO ESSENCIAL DE CYMBOPOGON FLEXUOSOS CONTRA BIOFILMES SIMPLES FORMADOS POR PSEUDOMONAS AERUGINOSA
 ATIVIDADE SANIFICANTE DO ÓLEO ESSENCIAL DE CYMBOPOGON FLEXUOSOS CONTRA BIOFILMES SIMPLES FORMADOS POR PSEUDOMONAS AERUGINOSA PENNO, Taciara do Amaral 1 ; SHUCH, Vanessa 1 ; GRIS, Claudia Regina 1 ; SILVEIRA,
ATIVIDADE SANIFICANTE DO ÓLEO ESSENCIAL DE CYMBOPOGON FLEXUOSOS CONTRA BIOFILMES SIMPLES FORMADOS POR PSEUDOMONAS AERUGINOSA PENNO, Taciara do Amaral 1 ; SHUCH, Vanessa 1 ; GRIS, Claudia Regina 1 ; SILVEIRA,
BASES MACROMOLECULARES CELULAR
 BASES MACROMOLECULARES CELULAR BIOQUÍMICA- FARMÁCIA FIO Faculdades Integradas de Ourinhos Prof. Esp. Roberto Venerando Fundação Educacional Miguel Mofarrej. FIO robertovenerando@fio.edu.br BASES MACROMOLECULARES
BASES MACROMOLECULARES CELULAR BIOQUÍMICA- FARMÁCIA FIO Faculdades Integradas de Ourinhos Prof. Esp. Roberto Venerando Fundação Educacional Miguel Mofarrej. FIO robertovenerando@fio.edu.br BASES MACROMOLECULARES
Antígenos Recombinantes e suas aplicações em Imunologia
 UNIVERSIDADE ESTADUAL PAULISTA - UNESP FACULDADE DE CIÊNCIAS AGRÁRIAS E VETERINÁRIAS FCAV CAMPUS DE JABOTICABAL Antígenos Recombinantes e suas aplicações em Imunologia Bióloga Mariana Monezi Borzi Doutoranda
UNIVERSIDADE ESTADUAL PAULISTA - UNESP FACULDADE DE CIÊNCIAS AGRÁRIAS E VETERINÁRIAS FCAV CAMPUS DE JABOTICABAL Antígenos Recombinantes e suas aplicações em Imunologia Bióloga Mariana Monezi Borzi Doutoranda
Projeto. Relatório de atividade Março Dezembro de 2012
 Projeto (Southern oceans educational and development) Relatório de atividade Março Dezembro de 2012 Por: Genyess R. A. S. Vieira Florianópolis, 2013 O ano 2012 foi o segundo ano do mestrado na Universidade
Projeto (Southern oceans educational and development) Relatório de atividade Março Dezembro de 2012 Por: Genyess R. A. S. Vieira Florianópolis, 2013 O ano 2012 foi o segundo ano do mestrado na Universidade
Fisiologia celular I. Fisiologia Prof. Msc Brunno Macedo
 celular I celular I Objetivo Conhecer os aspectos relacionados a manutenção da homeostasia e sinalização celular Conteúdo Ambiente interno da célula Os meios de comunicação e sinalização As bases moleculares
celular I celular I Objetivo Conhecer os aspectos relacionados a manutenção da homeostasia e sinalização celular Conteúdo Ambiente interno da célula Os meios de comunicação e sinalização As bases moleculares
RELATÓRIO CUMULATIVO DA SUSCETIBILIDADE DOS AGENTES DE INFEÇÃO URINÁRIA AOS ANTIMICROBIANOS
 RELATÓRIO CUMULATIVO DA SUSCETIBILIDADE DOS AGENTES DE INFEÇÃO URINÁRIA AOS ANTIMICROBIANOS ALGARVE RELATÓRIO CUMULATIVO DE SUSCETIBILIDADE AOS ANTIMICROBIANOS DOS AGENTES DE INFEÇÃO URINÁRIA NO ALGARVE
RELATÓRIO CUMULATIVO DA SUSCETIBILIDADE DOS AGENTES DE INFEÇÃO URINÁRIA AOS ANTIMICROBIANOS ALGARVE RELATÓRIO CUMULATIVO DE SUSCETIBILIDADE AOS ANTIMICROBIANOS DOS AGENTES DE INFEÇÃO URINÁRIA NO ALGARVE
Plano de Aulas. Biologia. Módulo 4 A célula e os componentes da matéria viva
 Plano de Aulas Biologia Módulo 4 A célula e os componentes da matéria viva Resolução dos exercícios propostos Retomada dos conceitos 12 CAPÍTULO 1 1 b Graças ao microscópio óptico descobriu-se que os seres
Plano de Aulas Biologia Módulo 4 A célula e os componentes da matéria viva Resolução dos exercícios propostos Retomada dos conceitos 12 CAPÍTULO 1 1 b Graças ao microscópio óptico descobriu-se que os seres
Fortalecimento das barreiras essenciais. Ingredientes funcionais. Salvaguarda da população
 A arte da proteção Defesa 1 2 2 Fortalecimento das barreiras essenciais Lorica oferece suporte às defesas primárias do camarão contra as ameaças ambientais. Essa dieta também age melhorando a estrutura
A arte da proteção Defesa 1 2 2 Fortalecimento das barreiras essenciais Lorica oferece suporte às defesas primárias do camarão contra as ameaças ambientais. Essa dieta também age melhorando a estrutura
Antimicrobianos: Resistência Bacteriana. Prof. Marcio Dias
 Antimicrobianos: Resistência Bacteriana Prof. Marcio Dias Resistência Capacidade adquirida de resistir aos efeitos de um agente quimioterápico, normalmente que um organismo é sensível. Como eles adquiriram:
Antimicrobianos: Resistência Bacteriana Prof. Marcio Dias Resistência Capacidade adquirida de resistir aos efeitos de um agente quimioterápico, normalmente que um organismo é sensível. Como eles adquiriram:
21/03/2017. Microbiota Residente, Indígena ou Autóctone do Corpo Humano. Características da Microbiota Residente
 Características da Microbiota Residente Interação dinâmica entre a microbiota residente e o hospedeiro. Microbiota Residente, Indígena ou Autóctone do Corpo Humano Prof. Dr. Mario Julio Avila-Campos http://www.icb.usp.br/bmm/mariojac
Características da Microbiota Residente Interação dinâmica entre a microbiota residente e o hospedeiro. Microbiota Residente, Indígena ou Autóctone do Corpo Humano Prof. Dr. Mario Julio Avila-Campos http://www.icb.usp.br/bmm/mariojac
Extracção de lípidos 2
 1 Técnicas de separação e identificação dos constituintes moleculares das membranas Extracção de lípidos 2 Mistura de solventes orgânicos, com carácter anfipático Clorofórmio/metanol, a + utilizada Métodos
1 Técnicas de separação e identificação dos constituintes moleculares das membranas Extracção de lípidos 2 Mistura de solventes orgânicos, com carácter anfipático Clorofórmio/metanol, a + utilizada Métodos
Fontes de m.o. 16/09/2015. Fontes de m.o. Plantas. algumas plantas produzem metabolitos antimicrobianos. interiores geralmente estéreis
 1 2 Plantas interiores geralmente estéreis algumas plantas produzem metabolitos antimicrobianos frutos e hortícolas têm m.o. superficiais variam com: tipo de solo fertilizantes e água qualidade do ar 1
1 2 Plantas interiores geralmente estéreis algumas plantas produzem metabolitos antimicrobianos frutos e hortícolas têm m.o. superficiais variam com: tipo de solo fertilizantes e água qualidade do ar 1
Universidade Federal de Pelotas Núcleo de Pesquisa, Ensino e Extensão em Pecuária. Pelotas, 11 de novembro de 2015
 Universidade Federal de Pelotas Núcleo de Pesquisa, Ensino e Extensão em Pecuária Pelotas, 11 de novembro de 2015 Carlos Loures Pires Josiane de Oliveira Feijó Escolha do artigo Cálcio Homeostase Hormônios
Universidade Federal de Pelotas Núcleo de Pesquisa, Ensino e Extensão em Pecuária Pelotas, 11 de novembro de 2015 Carlos Loures Pires Josiane de Oliveira Feijó Escolha do artigo Cálcio Homeostase Hormônios
ANTIBIÓTICOS EM ODONTOPEDIATRIA NÃO PROFILÁTICOS E PROFILÁTICOS
 ANTIBIÓTICOS EM ODONTOPEDIATRIA NÃO PROFILÁTICOS E PROFILÁTICOS QUANDO RECEITAR ANTIBIÓTICOS? Fístulas não usar abscessos não drenáveis comprometimento sistêmico causado pela disseminação de infecção de
ANTIBIÓTICOS EM ODONTOPEDIATRIA NÃO PROFILÁTICOS E PROFILÁTICOS QUANDO RECEITAR ANTIBIÓTICOS? Fístulas não usar abscessos não drenáveis comprometimento sistêmico causado pela disseminação de infecção de
Estratégias para a identificação de alvos para a quimioterapia antiparasitária
 Estratégias para a identificação de alvos para a quimioterapia antiparasitária Qual é importância do desenvolvimento de quimioterápicos para o controle de doenças parasitárias? Desenvolvimento de novas
Estratégias para a identificação de alvos para a quimioterapia antiparasitária Qual é importância do desenvolvimento de quimioterápicos para o controle de doenças parasitárias? Desenvolvimento de novas
Biomoléculas mais abundantes Terra
 Biomoléculas mais abundantes Terra Formados pelos organismos fotossintetizadores a partir de CO 2 e H 2 O, na presença de luz CO 2 + H 2 O O 2 + (CH 2 O) n Luz Moléculas com formula geral (CH 2 O) n Função
Biomoléculas mais abundantes Terra Formados pelos organismos fotossintetizadores a partir de CO 2 e H 2 O, na presença de luz CO 2 + H 2 O O 2 + (CH 2 O) n Luz Moléculas com formula geral (CH 2 O) n Função
Técnicas Microbiológicas
 IX Semana de Biologia da UFPB Técnicas Microbiológicas e Rotina Laboratorial Laboratório de Genética de Microrganismos - DBM Conjunto de procedimentos, ações, técnicas, metodologias, equipamentos e dispositivos
IX Semana de Biologia da UFPB Técnicas Microbiológicas e Rotina Laboratorial Laboratório de Genética de Microrganismos - DBM Conjunto de procedimentos, ações, técnicas, metodologias, equipamentos e dispositivos
Resposta imune inata (natural ou nativa)
 Universidade Federal do Pampa Campus Itaqui Curso de Nutrição Imunologia Resposta imune inata (natural ou nativa) Profa. Dra. Silvana Boeira Acreditou-se por muitos anos que a imunidade inata fosse inespecífica
Universidade Federal do Pampa Campus Itaqui Curso de Nutrição Imunologia Resposta imune inata (natural ou nativa) Profa. Dra. Silvana Boeira Acreditou-se por muitos anos que a imunidade inata fosse inespecífica
Proteínas II. (Enzimas) Bioquímica Prof. Dr. Marcelo Soares
 Proteínas II (Enzimas) Conceitos Gerais e Funções As enzimas são proteínas especializadas na catálise de reações biológicas Consideradas as biomoléculas mais notáveis devido a sua extraordinária especificidade
Proteínas II (Enzimas) Conceitos Gerais e Funções As enzimas são proteínas especializadas na catálise de reações biológicas Consideradas as biomoléculas mais notáveis devido a sua extraordinária especificidade
Vitaminas As vitaminas são nutrientes essenciais para nos.o organismo humano necessita destas vitaminas em pequenas quantidades para desempenhar
 A Química da vida A água A água é a mais abundante de todas as substâncias da célula, representando cerca de 80% da sua massa; funciona como solvente para grande parte das outras substâncias presentes
A Química da vida A água A água é a mais abundante de todas as substâncias da célula, representando cerca de 80% da sua massa; funciona como solvente para grande parte das outras substâncias presentes
ESTUDO DA EFICIÊNCIA DE ANTIBIOTICOS CONTRA BACTÉRIAS PATOGÊNICAS
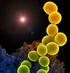 ESTUDO DA EFICIÊNCIA DE ANTIBIOTICOS CONTRA BACTÉRIAS PATOGÊNICAS Alessandra Maria Stefani NOGUEIRA Franceline Gravielle Bento PEREIRA Lisliana Garcia BELCHIOR Leizer Cordeiro da Silva FREITAS Discentes
ESTUDO DA EFICIÊNCIA DE ANTIBIOTICOS CONTRA BACTÉRIAS PATOGÊNICAS Alessandra Maria Stefani NOGUEIRA Franceline Gravielle Bento PEREIRA Lisliana Garcia BELCHIOR Leizer Cordeiro da Silva FREITAS Discentes
MULTIPLICAÇÃO OU REPLICAÇÃO VIRAL Dentre as características essenciais dos vírus, se destaca a propriedade de somente serem aptos a se multiplicar no
 MULTIPLICAÇÃO OU REPLICAÇÃO VIRAL Dentre as características essenciais dos vírus, se destaca a propriedade de somente serem aptos a se multiplicar no interior de células vivas (parasitas intracelulares
MULTIPLICAÇÃO OU REPLICAÇÃO VIRAL Dentre as características essenciais dos vírus, se destaca a propriedade de somente serem aptos a se multiplicar no interior de células vivas (parasitas intracelulares
Profª Drª Maria Luiza Poiatti Unesp - Campus de Dracena
 Profª Drª Maria Luiza Poiatti Unesp - Campus de Dracena luiza@dracena.unesp.br Probióticos: Definição Probiótico significa a favor da vida Segundo a FAO/WHO, Microrganismos vivos que ao serem administrados
Profª Drª Maria Luiza Poiatti Unesp - Campus de Dracena luiza@dracena.unesp.br Probióticos: Definição Probiótico significa a favor da vida Segundo a FAO/WHO, Microrganismos vivos que ao serem administrados
Meios de cultura bacteriano
 Meios de cultura bacteriano O material preparado no laboratório para o crescimento de microrganismos. Inóculo e Cultura; Se desejarmos o crescimento de uma cultura de um certo microrganismo, por exemplo
Meios de cultura bacteriano O material preparado no laboratório para o crescimento de microrganismos. Inóculo e Cultura; Se desejarmos o crescimento de uma cultura de um certo microrganismo, por exemplo
ED1- Citologia Microbiana
 1. Quais os principais morfotipos procarióticos? Determinação na morfologia celular coco bacilo espirilo Parede celular: confere forma e rigidez a célula Citoesqueleto: MreB e crescentina espiroqueta Bactérias
1. Quais os principais morfotipos procarióticos? Determinação na morfologia celular coco bacilo espirilo Parede celular: confere forma e rigidez a célula Citoesqueleto: MreB e crescentina espiroqueta Bactérias
Definição de Germicida
 Definição de Germicida 0 Substância química que mata formas vegetativas de microrganismos (não necessariamente os patogênicos) 0 A diferença entre um desinfetante e um germicida é que o desinfetante mata
Definição de Germicida 0 Substância química que mata formas vegetativas de microrganismos (não necessariamente os patogênicos) 0 A diferença entre um desinfetante e um germicida é que o desinfetante mata
Graduação em Biotecnologia Disciplina de Biotecnologia Microbiana II. Probióticos. Por que devemos consumí-los diariamente?
 15 de maio de 2013 Graduação em Biotecnologia Disciplina de Biotecnologia Microbiana II Probióticos Por que devemos consumí-los diariamente? Prof. Fabricio Rochedo Conceição fabricio.rochedo@ufpel.edu.br
15 de maio de 2013 Graduação em Biotecnologia Disciplina de Biotecnologia Microbiana II Probióticos Por que devemos consumí-los diariamente? Prof. Fabricio Rochedo Conceição fabricio.rochedo@ufpel.edu.br
INTRODUÇÃO À BIOQUÍMICA DA CÉLULA. Bioquímica Celular Prof. Júnior
 INTRODUÇÃO À BIOQUÍMICA DA CÉLULA Histórico INTRODUÇÃO 1665: Robert Hooke Compartimentos (Células) 1840: Theodor Schwann Teoria Celular 1. Todos os organismos são constituídos de uma ou mais células 2.
INTRODUÇÃO À BIOQUÍMICA DA CÉLULA Histórico INTRODUÇÃO 1665: Robert Hooke Compartimentos (Células) 1840: Theodor Schwann Teoria Celular 1. Todos os organismos são constituídos de uma ou mais células 2.
Membrana Celular. Objetivos da aula os estudantes deverão ser capazes de...
 Membrana Celular Objetivos da aula os estudantes deverão ser capazes de... Descrever a estrutura da membrana celular incluindo seus componentes e sua organização espacial Explicar as funções das membranas
Membrana Celular Objetivos da aula os estudantes deverão ser capazes de... Descrever a estrutura da membrana celular incluindo seus componentes e sua organização espacial Explicar as funções das membranas
Célula bacteriana. Membrana plasmática Parede celular Cápsula. DNA associado ao mesossomo. Mesossomo
 Reino Monera Célula bacteriana Mesossomo DNA associado ao mesossomo Membrana plasmática Parede celular Cápsula Enzimas relacionadas com a respiração, ligadas à face interna da membrana plasmática Flagelo
Reino Monera Célula bacteriana Mesossomo DNA associado ao mesossomo Membrana plasmática Parede celular Cápsula Enzimas relacionadas com a respiração, ligadas à face interna da membrana plasmática Flagelo
2
 1 2 3 4 5 6 7 8 9 Protoplastos: bactérias que, mesmo perdendo a parede celular, mantêm suas funções; Esferoplastos: bactérias que, na perda, mantém um pouco da sua PC e, em momento oportuno, reconstituem-na.
1 2 3 4 5 6 7 8 9 Protoplastos: bactérias que, mesmo perdendo a parede celular, mantêm suas funções; Esferoplastos: bactérias que, na perda, mantém um pouco da sua PC e, em momento oportuno, reconstituem-na.
Nutrição bacteriana. José Gregório Cabrera Gomez
 Nutrição bacteriana José Gregório Cabrera Gomez jgcgomez@usp.br Nutrição microbiana Quais os compostos químicos que constituem uma célula? 5 Nutrição microbiana De onde as bactérias captam estes elementos?
Nutrição bacteriana José Gregório Cabrera Gomez jgcgomez@usp.br Nutrição microbiana Quais os compostos químicos que constituem uma célula? 5 Nutrição microbiana De onde as bactérias captam estes elementos?
LUCIANA GARCIA FERREIRA ANÁLISE ESTRUTURAL DE POLISSACARÍDEOS POTENCIALMENTE BIOATIVOS: FUCANAS SULFATADAS DE ALGAS PARDAS (PHAEOPHYTA)
 LUCIANA GARCIA FERREIRA ANÁLISE ESTRUTURAL DE POLISSACARÍDEOS POTENCIALMENTE BIOATIVOS: FUCANAS SULFATADAS DE ALGAS PARDAS (PHAEOPHYTA) Dissertação apresentada como requisito parcial à obtenção do grau
LUCIANA GARCIA FERREIRA ANÁLISE ESTRUTURAL DE POLISSACARÍDEOS POTENCIALMENTE BIOATIVOS: FUCANAS SULFATADAS DE ALGAS PARDAS (PHAEOPHYTA) Dissertação apresentada como requisito parcial à obtenção do grau
O ácido láctico é obtido por fermentação a partir do açúcar. Sem que haja a utilização de derivados de origem animal.
 Lasilium INCI Name: Sodium Lactate Methylsilanol Lasilium é uma solução de silanol obtido por uma síntese molecular entre silício e o ácido láctico. O ácido láctico é obtido por fermentação a partir do
Lasilium INCI Name: Sodium Lactate Methylsilanol Lasilium é uma solução de silanol obtido por uma síntese molecular entre silício e o ácido láctico. O ácido láctico é obtido por fermentação a partir do
Cultura de Células. Culturas primárias x linhagens celulares. Diferentes tipos celulares podem crescer em cultura 15/03/2018
 Cultura de Células Diferentes tipos celulares podem crescer em cultura Claudia Mermelstein fibroblastos mioblastos oligodendrócitos Culturas primárias x linhagens celulares Culturas primárias x linhagens
Cultura de Células Diferentes tipos celulares podem crescer em cultura Claudia Mermelstein fibroblastos mioblastos oligodendrócitos Culturas primárias x linhagens celulares Culturas primárias x linhagens
ENFERMAGEM BIOSSEGURANÇA. Parte 4. Profª. Tatiane da Silva Campos
 ENFERMAGEM BIOSSEGURANÇA Parte 4 Profª. Tatiane da Silva Campos Higiêne das mãos A lavagem das mãos com técnica adequada, objetiva remover mecanicamente a sujidade e a maioria da flora transitória da pele.
ENFERMAGEM BIOSSEGURANÇA Parte 4 Profª. Tatiane da Silva Campos Higiêne das mãos A lavagem das mãos com técnica adequada, objetiva remover mecanicamente a sujidade e a maioria da flora transitória da pele.
Disciplina Biologia Celular. Profª Cristina Lacerda Soares Petrarolha Silva Curso de Agronomia FISMA / FEA
 Disciplina Biologia Celular Profª Cristina Lacerda Soares Petrarolha Silva Curso de Agronomia FISMA / FEA Aula 4: Bases Macromoleculares da Constituição Celular Bio Cel Profª Cristina Introdução Células
Disciplina Biologia Celular Profª Cristina Lacerda Soares Petrarolha Silva Curso de Agronomia FISMA / FEA Aula 4: Bases Macromoleculares da Constituição Celular Bio Cel Profª Cristina Introdução Células
Antibióticos. Disciplina Farmacologia Profª Janaína Santos Valente
 Antibióticos Disciplina Farmacologia Profª Janaína Santos Valente Introdução São produtos que eliminam os microorganismos vivos que causam danos aos pacientes. Os agentes antimicrobianos podem ser de origem
Antibióticos Disciplina Farmacologia Profª Janaína Santos Valente Introdução São produtos que eliminam os microorganismos vivos que causam danos aos pacientes. Os agentes antimicrobianos podem ser de origem
Métodos de Química Computacional
 Universidade Federal de Ouro Preto Instituto de Ciências Exatas e Biológicas Departamento de Química Métodos de Química Computacional Professora: Melissa Soares Caetano Química Medicinal Matemática Química
Universidade Federal de Ouro Preto Instituto de Ciências Exatas e Biológicas Departamento de Química Métodos de Química Computacional Professora: Melissa Soares Caetano Química Medicinal Matemática Química
DANIELLE LETÍCIA DA SILVA. ATIVIDADE ANTIFÚNGICA DE EXTRATOS DE PLANTAS MEDICINAIS EM AMOSTRAS DE Candida albicans ISOLADAS DE MUCOSA BUCAL
 DANIELLE LETÍCIA DA SILVA ATIVIDADE ANTIFÚNGICA DE EXTRATOS DE PLANTAS MEDICINAIS EM AMOSTRAS DE Candida albicans ISOLADAS DE MUCOSA BUCAL BELO HORIZONTE 2009 DANIELLE LETÍCIA DA SILVA ATIVIDADE ANTIFÚNGICA
DANIELLE LETÍCIA DA SILVA ATIVIDADE ANTIFÚNGICA DE EXTRATOS DE PLANTAS MEDICINAIS EM AMOSTRAS DE Candida albicans ISOLADAS DE MUCOSA BUCAL BELO HORIZONTE 2009 DANIELLE LETÍCIA DA SILVA ATIVIDADE ANTIFÚNGICA
Desenvolvimento de Processos de Recuperação de Plasmídeos. CICS Centro de Investigação em Ciências da Saúde Universidade da Beira Interior
 Desenvolvimento de Processos de Recuperação de Plasmídeos CICS Centro de Investigação em Ciências da Saúde Universidade da Beira Interior Tiago Manuel Batista Matos, m1817 12-06-2008 Universidade da Beira
Desenvolvimento de Processos de Recuperação de Plasmídeos CICS Centro de Investigação em Ciências da Saúde Universidade da Beira Interior Tiago Manuel Batista Matos, m1817 12-06-2008 Universidade da Beira
