A vacina contra o câncer de colo de útero elaborada para fazer mais*
|
|
|
- Miguel Bentes Lobo
- 8 Há anos
- Visualizações:
Transcrição
1 A vacina contra o câncer de colo de útero elaborada para fazer mais* *Proteção adicional contra as verrugas genitais, cânceres de vulva e vagina e displasia cervical. Antes de prescrever, recomendamos a leitura da Circular aos Médicos (bula) para informações detalhadas sobre o produto.
2 A vantagem da proteção com a vacina quadrivalente recombinante contra papilomavírus humano (tipos 6, 11, 16 e 18) Proteção contra o câncer de colo de útero Eficaz contra os tipos de papilomavírus humano que causam aproximadamente 70% de todos os cânceres de colo do útero em estudos clínicos Fase II e Fase III Proteção adicional contra os tipos de papilomavírus humano que causam mais de 20% de todos os cânceres de colo de útero em estudos clínicos Fase III,1 DURADOURA Proteção demonstrada com o decorrer do tempo A vacina quadrivalente recombinante contra papilomavírus humano (tipos 6, 11, 16 e 18) demonstrou memória imunológica em estudos clínicos indicação de proteção de longo prazo 2 Não houve casos de infecção para vacina quadrivalente recombinante contra papilomavírus humano (tipos 6, 11, 16 e 18) durante estudos clínicos de 5 anos,2 MAIS Ajuda a proteger pacientes contra outras doenças: verrugas genitais câncer de vulva e de vagina displasia cervical Assim como para qualquer vacina, a administração da vacina quadrivalente recombinante contra papilomavírus humano (tipos 6, 11, 16 e 18) pode não resultar em proteção a todos os indivíduos. Esta vacina não se destina ao tratamento de verrugas genitais ativas; câncer de colo de útero, de vulva nem de vagina, nem neoplasias de colo de útero, de vulva ou vagina (NIC, NIV ou NIVa). Antes de prescrever, recomendamos a leitura da Circular aos Médicos (bula) para informações detalhadas sobre o produto. Veja Desenho de Estudo A Veja Desenho de Estudo B Veja Desenho de Estudo C A vacina quadrivalente recombinante contra papilomavírus humano (tipos 6, 11, 16 e 18) é indicada para a prevenção dos cânceres de colo de útero, de vulva e de vagina; lesões pré-cancerosas ou displásicas; verrugas genitais e infecção causadas pelo papilomavírus humano tipos 6, 11, 16 e 18. Informações Selecionadas de Segurança A vacina quadrivalente recombinante contra papilomavírus humano (tipos 6, 11, 16 e 18) é contra-indicada para indivíduos que sejam hipersensíveis às substâncias ativas ou a qualquer dos excipientes da vacina.
3 Proteção e prevenção Eficácia contra o câncer de colo de útero CÂNCER DO COLO DO ÚTERO, 99% EFICAZ Cobertura homotípica contra o câncer do colo do útero Os tipos 16 e 18 causam Os tipos 31, 33, 35, 39, 45, 51, 52, 56, 58, e 59 causam ~70% >20% de todos os casos de câncer do colo do útero Cobertura não-homotípica contra o câncer do colo do útero relacionado a mais 10 tipos de papilomavírus humano II,1 de todos os casos de câncer do colo do útero 1 contra a NIC 2/3 ou AIS relacionados ao papilomavírus humano tipos 16 e 18 Os tipos 16 e 18 causam aproximadamente 70% de todos os casos de câncer do colo do útero II Veja Desenho de Estudo B. Uma análise combinada de 11 estudos clínicos conduzidos em 9 países determinou que os 12 tipos mais comuns de papilomavírus humano encontrados no câncer de colo de útero em todo o mundo eram, em ordem crescente de freqüência: papilomavírus humano 16, 18, 45, 31, 33, 52, 58, 35, 59, 51, 56 e Veja Desenho de Estudo D. Um caso no grupo que recebeu a vacina quadrivalente recombinante contra papilomavírus humano (tipos 6, 11, 16 e 18) (n=8.492) versus 85 casos no grupo que recebeu placebo (n=8.462) [IC95% 93,3-100,0] A eficácia da vacina quadrivalente recombinante contra papilomavírus humano (tipos 6, 11, 16 e 18) foi avaliada em quatro estudos clínicos fase II e III controlados com placebo, duplo-cegos e randômicos. Juntos, esses estudos avaliaram mulheres que tinham 16 a 26 anos de idade na data da inclusão. Veja o Desenho de Estudo A. O câncer invasivo do colo do útero não pode ser usado como desfecho para estudos de eficácia com vacinas de papilomavírus humano devido à importância do emprego de medidas secundárias de prevenção. Portanto, os precursores imediatos, NIC 2 (displasia cervical moderada), NIC 3 (displasia cervical de alto grau, incluindo carcinoma in situ) e AIS são os desfechos mais adequados para a demonstração da prevenção do câncer do colo do útero por vacinas de papilomavírus humano. Adenocarcinoma in situ. Um caso de NIC 3 ocorreu no grupo que recebeu a vacina quadrivalente recombinante contra papilomavírus humano (tipos 6, 11, 16 e 18), no qual os tipos de papilomavírus humano 16 e 52 foram detectados. Esse indivíduo havia sido cronicamente infectado pelo tipo 52 (infecção no dia 1, mês 32,5 e mês 33,6) em 8 de 11 espécimes, inclusive no tecido excisado durante o procedimento de excisão eletrocirúrgica de alça. O tipo 16 foi encontrado em 1 de 11 espécimes no mês 32,5, mas não foi detectado no tecido excisado durante o procedimento.
4 Proteção duradoura Não houve casos de infecção com a vacina quadrivalente recombinante A vacina quadrivalente recombinante contra papilomavírus humano (tipos 6, 11, 16 e 18) demonstrou memória imunológica Evidências de proteção de longo prazo podem ser estabelecidas por: resposta demonstrada da memória imunológica 2 eficácia clínica alta e contínua 2 avaliação contínua com base em estudos de extensão Fase III 4 Resposta de anticorpos a papilomavírus humano 16 no mês 61 Média Geométrica dos Títulos (GMT) (mmu/ml) com IC 95% Vacina quadrivalente recombinante contra papilomavírus humano (tipos 6, 11, 16 e 18) n= Tempo, meses Vacina quadrivalente recombinante contra papilomavírus humano (tipos 6, 11, 16 e 18) n= Tempo EVIDÊNCIA DE MEMÓRIA IMUNOLÓGICA: Os níveis de anticorpos eram ~2 vezes maiores do que 1 mês após a série de vacinação Estudo Nórdico compromisso de longo-prazo com a prevenção do câncer do colo do útero 4 Os resultados serão analisados continuamente por pelo menos 10 anos Análises de eficácia 3 anos 5 anos 7 anos 2003 Início do estudo anos 2013 Conclusão do estudo Série de administração da vacina quadrivalente recombinante contra papilomavírus humano (tipos 6, 11, 16 e 18) Vacinação no dia 0, mês 2 e mês 6 Aplicação de antígeno Aplicação de antígeno no mês 60 Respostas semelhantes antipapilomavírus humano foram observadas também para os tipos 6, 11 e Estudo de extensão Fase III Estudos de acompanhamento dos registros das voluntárias de pesquisa indivíduos de estudo de NIC 2/3 incluídos na região nórdica Tais registros serão utilizados para definir a duração da eficácia de longo prazo A memória imunológica é evidência de que suas pacientes vacinadas poderão produzir uma resposta de anticorpos forte o bastante para protegê-las contra infecção futura 2 Houve infecções contínuas com o placebo. 2 Em um estudo randômico, controlado com placebo, com 551 mulheres de 16 a 23 anos de idade, um subconjunto de 241 indivíduos foram avaliados por mais dois anos de acompanhamento (meses 37-60, por um total de 5 anos) 2. Veja Desenho de Estudo C. Os níveis de anticorpos foram 1,3; 4,2 e 1,7 vezes mais altos do que as GMTs após a dose três para os tipos 6, 11 e 18, respectivamente.
5 Mais proteção para mais meninas e jovens mulheres A vacina contra o câncer de colo de útero que ajuda a proteger contra as verrugas genitais A vacina contra o câncer do colo do útero ajuda a proteger contra o câncer de vulva/vagina e contra a displasia cervical VERRUGAS GENITAIS 99 % EFICAZ Os tipos 6 e 11 causam ~90% de todos os casos de verrugas genitais. CÂNCER DE VULVA/VAGINA 100 % EFICAZ contra a NIV 2/3 ou NIVa 2/3 relacionadas ao papilomavírus humano 16 e 18 Os tipos 16 e 18 causam ~70% dos casos de câncer de vulva/vagina, NIV 2/3 e NIVa 2/3 DISPLASIA CERVICAL 96 % EFICAZ contra a NIC 2/3 relacionada aos papilomavírus humanos 6, 11, 16 e 18 (NIC 1, NIC 2/3) Os tipos 6, 11, 16 e 18 causam ~35% a 50% de todos os casos de NIC 1 contra as verrugas genitais relacionadas ao papilomavírus humano tipos 6 e 11 Nenhum caso no grupo que recebeu a vacina quadrivalente recombinante contra papilomavírus humano (tipos 6, 11, 16 e 18) (n= 7.771) versus 15 casos no grupo que recebeu placebo (n= 7.742) (IC 95%: 30,9-100,0) Seis casos no grupo que recebeu a vacina quadrivalente recombinante contra papilomavírus humano (tipos 6, 11, 16 e 18) (n= 7.863) versus 148 casos no grupo que recebeu placebo (n= 7.863) (IC 95%: 91,0-98,5) Dois casos no grupo que recebeu vacina quadrivalente recombinante contra papilomavírus humano (tipos 6, 11, 16 e 18) (n= 6.931) versus 156 casos no grupo que recebeu placebo (n=6.854) (IC 95%: 95,34-99,8) A eficácia da vacina quadrivalente recombinante contra papilomavírus humano (tipos 6, 11, 16 e 18) foi avaliada em quatro estudos clínicos controlados com placebo, duplo-cegos e randômicos fases II e III. Em conjunto, esses estudos avaliaram mulheres com idade entre 16 e 26 anos à época da inclusão. Veja Desenho de Estudo A. [Quadrivalent Hoje, Human você Papillomavirus pode fazer mais (Types 6, 11, 16, 18) Recombinant Vaccine] Today, you can do more
6 Conseqüências físicas e emocionais do papilomavírus humano As conseqüências de curto prazo podem ser graves As verrugas genitais podem ser desgastantes e embaraçosas 5 >30 milhões de novos casos diagnosticados em todo o mundo a cada ano 6 Podem se desenvolver já aos três meses 7 Os tratamentos podem ser traumáticos e embaraçosos 8 As conseqüências de longo prazo podem ser fatais O câncer do colo do útero é precedido por NIC de grau alto em 1 cada 2 casos de câncer do colo do útero no mundo é fatal12 >12% dos casos de NIC 3 podem evoluir para câncer invasivo 13 Verrugas genitais não tratadas Os tratamentos freqüentemente associados a verrugas genitais 8,9 Crioterapia congelamento usando nitrogênio líquido Terapia a laser vaporização usando energia de luz infravermelha focada Eletrocirurgia destruição usando coagulação térmica Podofilotoxina indução de necrose histológica usando um agente antimicótico Imiquimod indução da produção de citocinas pró-inflamatórias Reproduzidas com permissão de A. Ferenczy. ~25% dos casos retornam após vários meses, independentemente do tratamento 9 O câncer de vagina e o de vulva são precedidos por NIVa e NIV de grau alto em 1 cada 3 em 1 cada 4 casos de câncer vagina é fatal14 casos de câncer de vulva é fatal14 ~6% de todos os tipos de câncer ginecológico são de vagina e de vulva 15 Tanto os tipos oncogênicos quanto não-oncogênicos de papilomavírus humano podem causar resultados anormais no exame de Papanicolaou 10 A falta de programas de prevenção torna o câncer de vulva e o de vagina difíceis de detectar. 15 ~3,5 milhões de exames de Papanicolaou anormais exigem acompanhamento médico a cada ano nos Estados Unidos.,11 Os números representam mais de 30 tipos de papilomavírus humano, não apenas os tipos 6, 11, 16 e 18.
7 Mais razões para tomar a vacina hoje Segundo a Organização Mundial da Saúde O momento mais eficaz para a vacinação de meninas e mulheres jovens é antes de se tornarem sexualmente ativas 16 O papilomavírus humano é disseminado principalmente por meio do contato sexual; a transmissão via contato manual-genital e oral-genital também foi documentada. 17 Apenas um encontro pode ser suficiente a infecção pode ocorrer em até um mês após o primeiro contato sexual. 17 A vacinação de meninas e mulheres jovens é recomendada em diversos calendários de imunização ACIP/CDC,18 Idade em anos Meninas de 11 a 12 anos de idade para a vacinação de rotina Adolescentes e mulheres de 13 a 26 anos de idade não vacinadas anteriormente Meninas de 9 e 10 anos podem também ser vacinadas ACIP/CDC= Comitê Consultivo de Práticas de Imunização do Centro de Controle de Doenças dos EUA. Pacientes com infecção anterior por papilomavírus humano, exames anormais de Papanicolaou ou verrugas genitais podem ser protegidas contra os tipos de papilomavírus humano da vacina com os quais ainda não tenham sido infectadas. Não é tarde demais para proteger as pacientes anteriormente expostas Em estudos clínicos com a vacina quadrivalente recombinante contra papilomavírus humano (tipos 6, 11, 16 e 18) As mulheres infectadas com 1 ou mais tipos de papilomavírus humano da vacina ainda foram protegidas contra a doença causada pelos demais tipos Somente 0,1% das mulheres tiveram exame positivo para todos os 4 tipos de papilomavírus humano da vacina. Suas pacientes sexualmente ativas ainda podem se beneficiar Análises clínicas mundiais de mais de 20 mil mulheres jovens de 16 a 26 anos de idade com histórico de 5 parceiros sexuais. 4 Veja Desenho de estudo B. Com base nas recomendações do ACIP 18 O exame de Papanicolaou para DNA ou anticorpos a papilomavírus humano não é necessário antes da vacinação em qualquer idade. Mulheres com exames anormais de Papanicolaou ou com verrugas genitais podem ser vacinadas. Cada consulta é sua chance de administrar a vacina quadrivalente recombinante contra papilomavírus humano (tipos 6, 11, 16 e 18)
8 Tolerabilidade e posologia Perfil favorável de tolerabilidade Reações adversas sistêmicas e no local da injeção relacionadas à vacina Vacina quadrivalente recombinante contra papilomavírus humano (tipos 6, 11, 16 e 18) Placebo com adjuvante (n= 3,470) Placebo de solução salina (n= 594) Sistêmicas Febre % 10 8 Dor % Inchaço % Local da Injeção Eritema % Ferimento % Prurido % Observadas dentre as recipientes da vacina quadrivalente recombinante contra papilomavírus humano (tipos 6, 11, 16 e 18) em uma freqüência de pelo menos 1,0 % e maior que a do placebo. Veja Desenho de Estudo E. 1 a 15 dias após a vacinação. 1 a 5 dias após a vacinação Dos indivíduos com reações no local da injeção, 94% consideraram sua reação adversa de intensidade leve ou moderada. As desistências do estudo devido a reações adversas relacionadas à vacina foram de 0,2%. Exames de Papanicolaou ou programas de prevenção do câncer do colo do útero deverão continuar mesmo após a aplicação da vacina quadrivalente recombinante contra papilomavírus humano (tipos 6, 11, 16 e 18). Esta vacina não protege contra os tipos de papilomavírus humano não incluídos na vacina. Esta vacina não se destina a uso para o tratamento de doenças causadas pelo papilomavírus humano. Deve-se evitar gravidez durante o regime de vacinação com a vacina quadrivalente recombinante contra papilomavírus humano (tipos 6, 11, 16 e 18). Assim como para todas as vacinas injetáveis, tratamento médico adequado deverá estar sempre prontamente disponível em caso de reações anafiláticas raras após a administração da vacina Posologia recomendada 1 1ª dose: hoje 2ª dose: dois meses 2 após a 1º dose 3 3ª dose: seis meses após a 1º dose A vacina quadrivalente recombinante contra papilomavírus humano (tipos 6, 11, 16 e 18) deverá ser administrada por via intramuscular na região deltóide superior do braço ou na área ântero-lateral superior da coxa em três doses separadas de 0,5 ml. Nenhuma diluição ou reconstituição será necessária. Flexibilidade posológica no período de um ano Se um esquema alternativo de vacinação for necessário, a segunda dose deverá ser administrada pelo menos um mês após a primeira dose e a terceira dose deverá ser administrada pelo menos três meses após a segunda dose. Uso com outros medicamentos Em estudos clínicos, a eficácia, o perfil de segurança e a imunogenicidade da vacina quadrivalente recombinante contra papilomavírus humano (tipos 6, 11, 16 e 18) não sofreram impacto de : analgésicos (11,9%) antibióticos (6,9%) medicamentos antiinflamatórios (9,5%) vitaminas (4,3%) Em estudos clínicos, o uso dos seguintes medicamentos não pareceu afetar as respostas imunológicas à vacina quadrivalente recombinante contra papilomavírus humano (tipos 6, 11, 16 e 18) : contraceptivos hormonais (57,5%) corticosteróides (3,3%) Uso concomitante com a vacina contra a hepatite B (recombinante): resultados de estudos clínicos indicam que a vacina quadrivalente recombinante contra papilomavírus humano (tipos 6, 11, 16 e 18) pode ser administrada concomitantemente (em diferente local de injeção) com a vacina contra a hepatite B (recombinante). II Porcentagem de indivíduos nos estudos clínicos que estavam usando concomitantemente os medicamentos específicos. II Veja Desenho de Estudo F.
9 Administração da vacina quadrivalente recombinante contra papilomavírus humano (tipos 6, 11, 16 e 18) As informações a seguir foram retiradas da bula do produto. Antes de administrar a vacina quadrivalente recombinante contra papilomavírus humano (tipos 6, 11, 16 e 18), recomendamos a leitura da Circular aos Médicos (bula) completa para informações detalhadas sobre o produto. Classe terapêutica A vacina quadrivalente recombinante contra papilomavírus humano (tipos 6, 11, 16 e 18) é uma vacina quadrivalente recombinante que protege contra os tipos 6, 11, 16 e 18 do papilomavírus humano. Indicações A vacina quadrivalente recombinante contra papilomavírus humano (tipos 6, 11, 16 e 18) é indicada para a prevenção do câncer do colo do útero, de vulva e de vagina, bem como de lesões pré-cancerosas ou displásicas, verrugas genitais e infecção causadas pelos tipos 6, 11, 16 e 18 do papilomavírus humano. Posologia e administração A vacina quadrivalente recombinante contra papilomavírus humano (tipos 6, 11, 16 e 18) é recomendada para crianças e adolescentes de 9 a 17 anos de idade e mulheres de 18 a 26 anos de idade. A vacina quadrivalente recombinante contra papilomavírus humano (tipos 6, 11, 16 e 18) deverá ser administrada por via intramuscular em três doses separadas de 0,5 ml, segundo o seguinte esquema : Primeira dose: na data escolhida Segunda dose: dois meses após a primeira dose Terceira dose: seis meses após a primeira dose Deve-se estimular a adesão dos pacientes ao esquema de vacinação aos 0, 2 e 6 meses. Entretanto, em estudos clínicos, a eficácia foi demonstrada em indivíduos que haviam recebido todas as três doses em um período de um ano. Se um esquema de vacinação alternativo for necessário, a segunda dose deve ser administrada pelo menos um mês após a primeira dose e a terceira dose deve ser administrada pelo menos três meses após a segunda dose. Contra-Indicações A vacina quadrivalente recombinante contra papilomavírus humano (tipos 6, 11, 16 e 18) é contra-indicada a indivíduos hipersensíveis aos princípios ativos ou a qualquer dos excipientes da vacina. Precauções Gerais Assim como para qualquer vacina, a vacinação com a vacina quadrivalente recombinante contra papilomavírus humano (tipos 6, 11, 16 e 18) pode não resultar em proteção a todos os recipientes da vacina. Esta vacina não se destina ao tratamento de verrugas genitais ativas; câncer de colo de útero, de vulva ou de vagina, nem NIC, NIV ou NIVa. A exemplo de todas as vacinas injetáveis, deve haver sempre tratamento médico disponível em caso de reações anafiláticas raras após a administração da vacina. Esta vacina não protege contra as doenças que não sejam causadas pelo papilomavírus humano. A decisão de administrar ou retardar a vacinação devido a alguma doença febril atual ou recente dependerá da intensidade dos sintomas e de sua etiologia. A febre baixa em si e a infecção respiratória superior em geral não são contra-indicações à vacinação. Indivíduos com resposta imune comprometida, seja devido a uso de terapia imunossupressora, defeito genético, infecção pelo Vírus da Imunodeficiência Humana (HIV), ou outras causas podem mostrar resposta de anticorpos reduzida à imunização ativa (veja a seção INTERAÇÕES MEDICAMENTOSAS da Bula). Esta vacina deverá ser administrada com cautela a indivíduos com trombocitopenia ou qualquer distúrbio de coagulação, porque poderá ocorrer sangramento após a administração intramuscular em tais indivíduos. Gravidez A vacina quadrivalente recombinante contra papilomavírus humano (tipos 6, 11, 16 e 18) não é recomendada durante a gravidez. Indivíduos que desenvolvam sintomas que indiquem hipersensibilidade após receber uma dose da vacina quadrivalente recombinante contra papilomavírus humano (tipos 6, 11, 16 e 18) não deverão receber as doses adicionais da vacina.
10 Desenho dos estudos Desenho do Estudo A A eficácia da vacina quadrivalente recombinante contra papilomavírus humano (tipos 6, 11, 16 e 18) foi avaliada em quatro estudos clínicos controlados com placebo, duplo-cegos, randômicos Fase II e III. O primeiro estudo fase II avaliou o componente papilomavírus humano 16 de a vacina quadrivalente recombinante contra papilomavírus humano (tipos 6, 11, 16 e 18) (Protocolo 005; N = 2.391) e o segundo avaliou todos os 4 componentes da vacina quadrivalente recombinante contra papilomavírus humano (tipos 6, 11, 16 e 18) (Protocolo 007; N = 551). Os estudos Fase III avaliaram a vacina quadrivalente recombinante contra papilomavírus humano (tipos 6, 11, 16 e 18) em (FUTURE* I) e (FUTURE II) indivíduos. Em conjunto, esses estudos avaliaram mulheres de 16 a 26 anos de idade na inclusão. A duração mediana do acompanhamento foi de 3,9; 2,9; 2,9 e 2,9 anos para o Protocolo 005, Protocolo 007, FUTURE I e FUTURE II, respectivamente. As mulheres que haviam sido expostas ao papilomavírus humano tipos 6, 11, 16 ou 18 antes do recrutamento foram incluídas. Os indivíduos receberam vacina ou placebo no dia da inclusão, dois e seis meses depois disso. As análises primárias de eficácia foram conduzidas em mulheres que receberam todas as três doses no período de um ano da inclusão, sem ter incorrido em importantes desvios do protocolo de estudo e nunca expostas aos tipos correspondentes de papilomavírus humano antes da dose 1 até um mês após a dose 3 (mês 7) (população de eficácia-por-protocolo). Desenho do Estudo B A análise da proteção cruzada e da infecção persistente foi conduzida em estudos de eficácia combinados e randômicos Fase III (FUTURE I e FUTURE II) para a vacina quadrivalente recombinante contra papilomavírus humano (tipos 6, 11, 16 e 18), envolvendo mulheres de 15 a 26 anos de idade. Os indivíduos receberam vacina ou placebo no dia 1, mês 2 e mês 6. Elas passaram por amostragem cervicovaginal e exame de Papanicolaou no dia 1 e em intervalos de seis a 12 meses por até 48 meses. As análises foram conduzidas numa população em geral nunca exposta ao papilomavírus humano, que se aproxima da população-alvo para a vacinação contra o papilomavírus: os indivíduos receberam 1 dose, nunca haviam sido expostos aos tipos 6/11/16/18, eram PCR-negativos a 10 tipos não contidos na vacina (31/33/35/39/45/51/52/56/58/59), e com resultado de exame de Papanicolaou normal no dia 1. 1 Desenho do Estudo D Um protocolo comum e um questionário foram usados para agregar dados de 11 estudos de caso-controle conduzidos em nove países e que envolveram mulheres com câncer do colo do útero de célula escamosa confirmado histologicamente e pacientes controle. As informações sobre os fatores de risco foram obtidas por entrevistas pessoais e células do colo do útero foram colhidas para a detecção de DNA de papilomavírus humano e tipagem em um laboratório central por ensaios baseados na reação da cadeia de polimerase (PCR) (com prímeros MY09/MY11 e GP5/6) 3 Desenho do Estudo E Em cinco estudos clínicos (quatro deles controlados com placebo), os indivíduos receberam a vacina quadrivalente recombinante contra papilomavírus humano (tipos 6, 11, 16 e 18) ou placebo no dia da inclusão e aproximadamente dois e seis meses mais tarde. Em todos exceto um dos estudos clínicos, a segurança foi avaliada usando cartão de vacinação (CV) vigilância auxiliar por 14 dias depois de cada injeção de a vacina quadrivalente recombinante contra papilomavírus humano (tipos 6, 11, 16 e 18) (n = 6.160) ou placebo (n = 4.064). Desenho do Estudo F A segurança e a imunogenicidade da co-administração da vacina quadrivalente recombinante contra papilomavírus humano (tipos 6, 11, 16 e 18) e vacina contra a hepatite B (recombinante) (mesma consulta, injeções em locais diferentes) foram avaliadas em um estudo randômico com mulheres que tinham de 16 a 24 anos de idade na data da inclusão. A resposta imune e o perfil de segurança da vacina contra a hepatite B (recombinante) e da vacina quadrivalente recombinante contra papilomavírus humano (tipos 6, 11, 16 e 18) foram semelhantes seja com os indivíduos vacinados na mesma consulta, seja em consultas diferentes. Desenho do Estudo C Em um estudo randômico, controlado com placebo com 551 mulheres de 16 a 23 anos de idade, um subconjunto de 241 indivíduos foi avaliado por mais 2 anos de acompanhamento (meses 37-60, por um total de cinco anos). Os indivíduos que originalmente haviam recebido vacinação na inclusão, mês 2 e mês 6, receberam uma aplicação de antígeno (uma outra dose de vacina) no mês 60. Os que haviam recebido placebo, receberam a primeira dose de um regime de três doses da vacina quadrivalente recombinante contra papilomavírus humano (tipos 6, 11, 16 e 18) no mês 60. As resposta antipapilomavírus humano foram determinadas uma semana e quatro semanas após a aplicação do antígeno (nos indivíduos que originalmente haviam recebido a vacina) ou após a dose 1 (para indivíduos que originalmente haviam recebido placebo). 2 * FUTURE (Females United To Uniterally Reduce Endo/Ectocervical Disease): Mulheres Unidas para Reduzir Unilateralmente a Doença Endo-Ectocervical.
11 Referências bibliográficas 1. Brown D, for the FUTURE Study Group. HPV type 6/11/16/18 vaccine: first analysis of cross-protection against persistent infection, cervical intraepithelial neoplasia (CIN), and adenocarcinoma in situ (AIS) caused by oncogenic HPV types in addition to 16/18. Pôster apresentado no ICAAC - 47th Interscience Conference on Antimicrobial Agents and Chemotherapy, realizado entre 17 e 20 de setembro de 2007, em Chicago, EUA. 2. Olsson S-E, Villa LL, Costa RLR, et al. Induction of immune memory following administration of a prophylactic quadrivalent human papillomavirus (HPV) types 6/11/16/18 L1 virus-like particle (VLP) vaccine. Vaccine. 2007;25: Muñoz N, Bosch FX, de Sanjosé S, et al, for the International Agency for Research on Cancer Multicenter Cervical Cancer Study Group. Epidemiologic classification of human papillomavirus types associated with cervical cancer. N Engl J Med. 2003;348: Dados de arquivo, MSD-Brasil. 5. Barr E, Tamms G. Quadrivalent human papillomavirus vaccine. Clin Infect Dis. 2007;45: World Health Organization. Executive summary: the state of world health Disponível no site: Acessado em 7 de dezembro de Dupin N. Genital warts. Clin Dermatol. 2004;22: Palefsky J. What Your Doctor May Not Tell You About HPV and Abnormal Pap Smears. New York, NY: Warner Books; Lacey CJN. Therapy for genital human papillomavirus-related disease. J Clin Virol. 2005;32(suppl):S82 S Centers for Disease Control and Prevention. Division of STD Prevention. Sexually transmitted diseases: genital HPV infection [fact sheet]. Disponível no site: Acessado em 7 de dezembro de National Cancer Institute. The Pap test: questions and answers [fact sheet]. Disponível no site: Acessado em 7 de dezembro de World Health Organization. Initiative for Vaccine Research. Viral cancers. Disponível no site: Acessado em 7 de dezembro de Östör AG. Natural history of cervical intraepithelial neoplasia: a critical review. Int J Gynecol Pathol 1993;12: American Cancer Society. Cancer Facts & Figures Atlanta, Ga: American Cancer Society; Joura EA, Leodolter S, Hernandez-Avila M, et al. Efficacy of a quadrivalent prophylactic human papillomavirus (types 6, 11, 16, and 18) L1 virus-like-particle vaccine against high-grade vulval and vaginal lesions: a combined analysis of three randomised clinical trials. Lancet. 2007;369: World Health Organization. Bulletin: vaccinating against cervical cancer. Disponível no site: Acessado em 7 de dezembro de Winer RL, Lee S-K, Hughes JP, Adam DE, Kiviat NB, Koutsky LA. Genital human papillomavirus infection: incidence and risk factors in a cohort of female university students. Am J Epidemiol. 2003;157: Centers for Disease Control and Prevention. Quadrivalent human papillomavirus vaccine: recommendations of the Advisory Committee on Immunization Practices (ACIP). MMWR. 2007;56(RR-2):1 24.
12 Resumo da Circular aos Médicos VACINA QUADRIVALENTE RECOMBINANTE CONTRA PAPILOMAVÍRUS HUMANOS (TIPOS 6, 11, 16 E 18). INDICAÇÕES: a vacina quadrivalente recombinante contra papilomavírus humano (tipos 6, 11, 16 e 18) é indicada para a prevenção de câncer, lesões pré-cancerosas ou displásicas, verrugas genitais e infecção causada pelos tipos de HPV presentes na vacina. A vacina quadrivalente recombinante contra papilomavírus humano (tipos 6, 11, 16 e 18) é indicada para a prevenção das seguintes condições causadas pelos HPV 16 e 18: câncer cervical, da vulva e da vagina; adenocarcinoma do colo do útero in situ (AIS); neoplasia intra-epitelial cervical (NIC) de grau 2 e grau 3; neoplasia intra-epitelial vulvar (NIV) de grau 2 e grau 3; neoplasia intra-epitelial vaginal (NIVa) de grau 2 e grau 3. A vacina quadrivalente recombinante contra papilomavírus humano (tipos 6, 11, 16 e 18) é indicada para a prevenção das seguintes condições causadas pelos HPV 6, 11, 16 e 18: neoplasia intra-epitelial cervical (NIC) de grau 1; verrugas genitais (condiloma acuminado); NIV de grau 1 e NIVa de grau 1; infecção por HPV. CONTRA-INDICAÇÕES: hipersensibilidade aos princípios ativos ou a qualquer dos excipientes da vacina. As pessoas que desenvolvem sintomas indicativos de hipersensibilidade após receber uma dose da vacina quadrivalente recombinante contra papilomavírus humano (tipos 6, 11, 16 e 18) não devem receber outras doses. ADVERTÊNCIAS: como ocorre com todas as vacinas, a vacinação com a vacina quadrivalente recombinante contra papilomavírus humano (tipos 6, 11, 16 e 18) pode não resultar em proteção para todos os que recebem a vacina. A vacina quadrivalente recombinante contra papilomavírus humano (tipos 6, 11, 16 e 18) não é indicada para tratamento de verrugas genitais ativas, câncer cervical, vulvar ou vaginal, NIC, NIV ou NIVa. Esta vacina não proporcionará proteção contra doenças que não sejam causadas pelo HPV. A exemplo de todas as vacinas injetáveis, deve haver sempre tratamento médico disponível em caso de reações anafiláticas raras após a administração da vacina. Pessoas com resposta imunológica comprometida seja por uso de terapia imunossupressora, defeito genético, infecção por vírus da imunodeficiência humana (HIV), ou por outras causas podem apresentar resposta de anticorpos reduzida à imunização ativa (veja INTERAÇÕES MEDICAMENTOSAS). Esta vacina deve ser administrada com cuidado a pessoas com trombocitopenia ou qualquer distúrbio de coagulação porque pode ocorrer sangramento após administração intramuscular nessas pessoas. O profissional de saúde deve informar o paciente, parente ou o responsável que a vacinação não substitui a rotina de triagem de câncer cervical. Mulheres que receberam a vacina quadrivalente recombinante contra papilomavírus humano (tipos 6, 11, 16 e 18) devem continuar a triagem de câncer cervical, conforme estabelecido pelo médico. Gravidez: categoria de risco B. INTERAÇÕES MEDICAMENTOSAS: Uso com Outras Vacinas: os resultados dos estudos clínicos indicam que a vacina quadrivalente recombinante contra papilomavírus humano (tipos 6, 11, 16 e 18) pode ser administrada concomitantemente (em locais de administração diferentes) com a vacina contra hepatite B (recombinante). O uso concomitante da vacina quadrivalente recombinante contra papilomavírus humano (tipos 6, 11, 16 e 18) com vacinas diferentes da vacina contra hepatite B ainda não foi estudado. Assim, não é indicado o uso concomitante da vacina quadrivalente recombinante contra papilomavírus humano (tipos 6, 11, 16 e 18) com vacinas diferentes da vacina contra hepatite B (por exemplo vacina dt [difteria e tétano], sarampo e rubéola). Uso com Medicamentos Comuns: nos estudos clínicos, 11,9%, 9,5%, 6,9% e 4,3% das participantes utilizavam analgésicos, antiinflamatórios, antibióticos e preparações vitamínicas, respectivamente. A eficácia, a imunogenicidade e o perfil de segurança da vacina quadrivalente recombinante contra papilomavírus humano (tipos 6, 11, 16 e 18) não sofreram impacto com o uso desses medicamentos. Uso com Contraceptivos Hormonais: nos estudos clínicos, 57,5% das mulheres (com 16 a 26 anos de idade) que receberam a vacina quadrivalente recombinante contra papilomavírus humano (tipos 6, 11, 16 e 18) usavam contraceptivos hormonais; essa associação não pareceu afetar as respostas imunológicas à vacina. Uso com Esteróides: nos estudos clínicos, 1,7% (n= 158), 0,6% (n= 56) e 1,0% (n= 89) das participantes utilizavam imunossupressores inalatórios, tópicos e parenterais, respectivamente, próximo do horário da administração de uma dose da vacina quadrivalente recombinante contra papilomavírus humano (tipos 6, 11, 16 e 18). Esses medicamentos não pareceram afetar as respostas imunológicas à vacina. Muito poucas participantes nos estudos clínicos estavam tomando esteróides, e a extensão da imunossupressão foi supostamente baixa. Uso com Medicamentos Imunossupressores Sistêmicos: não existem dados sobre o uso concomitante de imunossupressores potentes com a vacina quadrivalente recombinante contra papilomavírus humano (tipos 6, 11, 16 e 18). As pessoas que recebem agentes imunossupressores (doses sistêmicas de corticosteróides, antimetabólitos, agentes alquilantes, agentes citotóxicos) podem não responder de maneira ideal à imunização ativa. REAÇÕES ADVERSAS: as reações adversas mais freqüentemente relatadas por indivíduos que receberam a vacina quadrivalente recombinante contra papilomavírus humano (tipos 6, 11, 16 e 18) e a freqüência observada foram: locais dor (81,3%), inchaço (24, 2%), eritema (23,2%), hemorragia (3,2%) e prurido (2,7%); sistêmicas febre (10,1%). POSOLOGIA E ADMINISTRAÇÂO: a vacina quadrivalente recombinante contra papilomavírus humano (tipos 6, 11, 16 e 18) é recomendada para meninas e mulheres com 9 a 26 anos de idade. A vacina quadrivalente recombinante contra papilomavírus humano (tipos 6, 11, 16 e 18) deve ser administrada por via intramuscular em três doses separadas de 0,5 ml, de acordo com o seguinte esquema: primeira dose - em data a escolher; segunda dose 2 meses após a primeira dose; terceira dose 6 meses após a primeira dose. Deve-se estimular a adesão dos pacientes ao esquema de vacinação aos 0, 2 e 6 meses. No entanto, nos estudos clínicos, demonstrou-se eficácia nas pessoas que receberam todas as três doses em um período de um ano. Se for necessário um esquema de vacinação alternativo, a segunda dose deve ser administrada no mínimo um mês após a primeira dose e a terceira dose, no mínimo três meses após a segunda dose. Recomenda-se a leitura da Circular aos Médicos (bula) completa para mais informações sobre reconstituição, conservação e armazenamento. REGISTRO MS: VENDA SOB PRESCRIÇÃO MÉDICA. Nota: antes de prescrever a vacina quadrivalente recombinante contra papilomavírus humano (tipos 6, 11, 16 e 18), recomendamos a leitura da Circular aos Médicos (bula) completa, para informações detalhadas sobre os produtos. A PERSISTIREM OS SINTOMAS, O MÉDICO DEVERÁ SER CONSULTADO.
13 A vantagem da proteção com a vacina quadrivalente recombinante contra papilomavírus humano (tipos 6, 11, 16 e 18) Proteção contra o câncer de colo de útero Eficácia demonstrada contra os tipos de papilomavírus humano que causam aproximadamente 70% de todos os casos de câncer de colo do útero em estudos clínicos Fase II e Fase III Proteção adicional contra os tipos de papilomavírus humano que causam mais de 20% de todos os casos de câncer de colo de útero em estudos clínicos Fase III,1 DURADOURA Proteção demonstrada com o decorrer do tempo A vacina quadrivalente recombinante contra papilomavírus humano (tipos 6, 11, 16 e 18) demonstrou memória imunológica em estudos clínicos indicação de proteção de longo prazo 2 Não houve casos de infecção para vacina quadrivalente recombinante contra papilomavírus humano (tipos 6, 11, 16 e 18) durante estudos clínicos de 5 anos,2 MAIS A vantagem de ajudar a proteger pacientes contra outras doenças: verrugas genitais câncer de vulva e de vagina displasia cervical Veja Desenho de Estudo A. Veja Desenho de Estudo B. Veja Desenho de Estudo C. Faça tudo o que puder por suas pacientes vacine hoje Antes de prescrever a vacina quadrivalente recombinante contra papilomavírus humano (tipos 6, 11, 16 e 18), recomendamos a leitura da Circular aos Médicos (bula) completa para informações detalhadas sobre o produto. Copyright 2007 Merck & Co., Inc., Whitehouse Station, NJ, USA. Todos os direitos reservados. MC 172/ GRD-2007-MVD DA GRD-08-BR-172-DA
Vacina contra o câncer de colo de útero
 Vacina contra o câncer de colo de útero Antes de prescrever, recomendamos a leitura da Circular aos Médicos (bula) para informações detalhadas sobre o produto. A vantagem da proteção com a vacina quadrivalente
Vacina contra o câncer de colo de útero Antes de prescrever, recomendamos a leitura da Circular aos Médicos (bula) para informações detalhadas sobre o produto. A vantagem da proteção com a vacina quadrivalente
Identificação do Medicamento. Vacina quadrivalente recombinante contra papilomavírus humano. (tipos 6, 11, 16 e 18)
 Identificação do Medicamento Vacina quadrivalente recombinante contra papilomavírus humano (tipos 6, 11, 16 e 18) FORMA FARMACÊUTICA E APRESENTAÇÕES A vacina quadrivalente recombinante contra papilomavírus
Identificação do Medicamento Vacina quadrivalente recombinante contra papilomavírus humano (tipos 6, 11, 16 e 18) FORMA FARMACÊUTICA E APRESENTAÇÕES A vacina quadrivalente recombinante contra papilomavírus
Você sabia? 8 em cada 10 homens e mulheres já pegaram ou pegarão algum tipo de HPV. 1,2
 Você sabia? O HPV é um vírus silencioso que atinge homens e mulheres e que pode causar câncer de colo do útero e verrugas genitais. 1 8 em cada 10 já pegaram ou pegarão algum tipo de HPV. 1,2 20% das pessoas
Você sabia? O HPV é um vírus silencioso que atinge homens e mulheres e que pode causar câncer de colo do útero e verrugas genitais. 1 8 em cada 10 já pegaram ou pegarão algum tipo de HPV. 1,2 20% das pessoas
vacina papilomavírus humano 6, 11, 16 e 18 (recombinante)
 IDENTIFICAÇÃO DO MEDICAMENTO vacina papilomavírus humano 6, 11, 16 e 18 (recombinante) APRESENTAÇÕES A vacina papilomavírus humano 6, 11, 16 e 18 (recombinante) é uma suspensão injetável estéril para administração
IDENTIFICAÇÃO DO MEDICAMENTO vacina papilomavírus humano 6, 11, 16 e 18 (recombinante) APRESENTAÇÕES A vacina papilomavírus humano 6, 11, 16 e 18 (recombinante) é uma suspensão injetável estéril para administração
VACINA CONTRA PAPILOMAVÍRUS HUMANO HPV
 1º Trimestre 2007 VACINA CONTRA PAPILOMAVÍRUS HUMANO HPV Em junho de 2006, foi aprovada pela FDA (Food And Drug Administration) dos Estados Unidos (EUA) uma vacina recombinante quadrivalente contra papilomavírus
1º Trimestre 2007 VACINA CONTRA PAPILOMAVÍRUS HUMANO HPV Em junho de 2006, foi aprovada pela FDA (Food And Drug Administration) dos Estados Unidos (EUA) uma vacina recombinante quadrivalente contra papilomavírus
Papiloma Vírus Humano - HPV
 VACINAÇÃO HPV 2015 Papiloma Vírus Humano - HPV O vírus HPV é altamente contagioso, sendo possível contaminar-se com uma única exposição. A sua transmissão se dá por contato direto com a pele ou mucosa
VACINAÇÃO HPV 2015 Papiloma Vírus Humano - HPV O vírus HPV é altamente contagioso, sendo possível contaminar-se com uma única exposição. A sua transmissão se dá por contato direto com a pele ou mucosa
INFORME TÉCNICO DA VACINA HPV (PAPILOMAVÍRUS HUMANO 6, 11, 16, 18 (RECOMBINANTE)) - 2015
 INFORME TÉCNICO DA VACINA HPV (PAPILOMAVÍRUS HUMANO 6, 11, 16, 18 (RECOMBINANTE)) - 2015 Apresentação O Ministério da Saúde com o objetivo de reforçar as atuais ações de prevenção do câncer do colo do
INFORME TÉCNICO DA VACINA HPV (PAPILOMAVÍRUS HUMANO 6, 11, 16, 18 (RECOMBINANTE)) - 2015 Apresentação O Ministério da Saúde com o objetivo de reforçar as atuais ações de prevenção do câncer do colo do
ANEXO I RESUMO DAS CARACTERÍSTICAS DO MEDICAMENTO
 ANEXO I RESUMO DAS CARACTERÍSTICAS DO MEDICAMENTO 1 1. NOME DO MEDICAMENTO Gardasil, suspensão injectável. Vacina contra o Papilomavírus Humano [Tipos 6, 11, 16, 18] (Recombinante, adsorvida). 2. COMPOSIÇÃO
ANEXO I RESUMO DAS CARACTERÍSTICAS DO MEDICAMENTO 1 1. NOME DO MEDICAMENTO Gardasil, suspensão injectável. Vacina contra o Papilomavírus Humano [Tipos 6, 11, 16, 18] (Recombinante, adsorvida). 2. COMPOSIÇÃO
Vacinas contra HPV. Fábio Russomano
 Vacinas contra HPV Curso de Atualização em Patologia do Trato Genital Inferior e Colposcopia ABG RJ Instituto de Ginecologia da UFRJ 20 de junho de 2009 Fábio Russomano Sumário Cenário do Câncer de Colo
Vacinas contra HPV Curso de Atualização em Patologia do Trato Genital Inferior e Colposcopia ABG RJ Instituto de Ginecologia da UFRJ 20 de junho de 2009 Fábio Russomano Sumário Cenário do Câncer de Colo
Derrotar o cancro do útero
 Portuguese translation of Beating cervical cancer The HPV vaccine questions and answers for parents of girls in Year 9 Derrotar o cancro do útero A vacina HPV perguntas e respostas para os pais de jovens
Portuguese translation of Beating cervical cancer The HPV vaccine questions and answers for parents of girls in Year 9 Derrotar o cancro do útero A vacina HPV perguntas e respostas para os pais de jovens
Susana Aidé Profª Adjunta de Ginecologia da Uff
 Susana Aidé Profª Adjunta de Ginecologia da Uff Câncer % Associada com Alguns Tipos de HPV 90 80 70 60 50 40 30 20 10 0 + Colo do Útero+,1,2 Larínge e Trato OroVaginal/ Peniano 2,4 Anal 2,4 Aerodigestivo
Susana Aidé Profª Adjunta de Ginecologia da Uff Câncer % Associada com Alguns Tipos de HPV 90 80 70 60 50 40 30 20 10 0 + Colo do Útero+,1,2 Larínge e Trato OroVaginal/ Peniano 2,4 Anal 2,4 Aerodigestivo
RESPOSTA RÁPIDA 43/2014. VACINA HPV em paciente com diagnóstico de HPV+ (neoplasia + intraepitelial grau I)
 RESPOSTA RÁPIDA 43/2014 VACINA HPV em paciente com diagnóstico de HPV+ (neoplasia + intraepitelial grau I) SOLICITANTE NÚMERO DO PROCESSO Dra. Herilene de Oliveira Andrade Juíza de Direito da Comarca de
RESPOSTA RÁPIDA 43/2014 VACINA HPV em paciente com diagnóstico de HPV+ (neoplasia + intraepitelial grau I) SOLICITANTE NÚMERO DO PROCESSO Dra. Herilene de Oliveira Andrade Juíza de Direito da Comarca de
vacina hepatite A (inativada)
 vacina hepatite A (inativada) Forma farmacêutica e apresentações: Suspensão injetável. Cartucho contendo uma seringa de uma dose de 0,5 ml. Cartucho contendo 5 seringas de uma dose de 0,5 ml. Cartucho
vacina hepatite A (inativada) Forma farmacêutica e apresentações: Suspensão injetável. Cartucho contendo uma seringa de uma dose de 0,5 ml. Cartucho contendo 5 seringas de uma dose de 0,5 ml. Cartucho
Vacina quadrivalente recombinante contra papilomavírus humano (tipos 6, 11, 16 e 18)
 IDENTIFICAÇÃO DO MEDICAMENTO Vacina quadrivalente recombinante contra papilomavírus humano (tipos 6, 11, 16 e 18) APRESENTAÇÕES A vacina quadrivalente recombinante contra papilomavírus humano (tipos 6,
IDENTIFICAÇÃO DO MEDICAMENTO Vacina quadrivalente recombinante contra papilomavírus humano (tipos 6, 11, 16 e 18) APRESENTAÇÕES A vacina quadrivalente recombinante contra papilomavírus humano (tipos 6,
Natural History of HPV Infections NIC 1 NIC 2 NIC 3
 Natural History of HPV Infections NIC 1 NIC 2 NIC 3 Vacina Quadrivalente (GARDASIL ) Eficácia cia na Prevenção de NIC 2/3+ (20 meses) Vacina HPV (n=8.489) Placebo (n=8.460) Eficácia cia da Vacina I. C.
Natural History of HPV Infections NIC 1 NIC 2 NIC 3 Vacina Quadrivalente (GARDASIL ) Eficácia cia na Prevenção de NIC 2/3+ (20 meses) Vacina HPV (n=8.489) Placebo (n=8.460) Eficácia cia da Vacina I. C.
Perguntas e respostas sobre a vacinação contra o HPV
 Perguntas e respostas sobre a vacinação contra o HPV 1) A vacina é mesmo necessária? Atualmente, cerca de 5% de todos os cânceres do homem e 10% dos da mulher são causados pelo HPV, que atinge mais de
Perguntas e respostas sobre a vacinação contra o HPV 1) A vacina é mesmo necessária? Atualmente, cerca de 5% de todos os cânceres do homem e 10% dos da mulher são causados pelo HPV, que atinge mais de
Vacina anti HPV. Dra. Maristela Vargas Peixoto
 Vacina anti HPV Dra. Maristela Vargas Peixoto Segundo o CDC, ocorrem cerca de 300 milhões de casos de infecção cervical pelo HPV por ano, e cerca de 400.000 casos de carcinomas invasivos 0,13% das pacientes
Vacina anti HPV Dra. Maristela Vargas Peixoto Segundo o CDC, ocorrem cerca de 300 milhões de casos de infecção cervical pelo HPV por ano, e cerca de 400.000 casos de carcinomas invasivos 0,13% das pacientes
Nilma Antas Neves Profa Ginecologia da Universidade Federal da Bahia Presidente da Comissão de Vacinas da FEBRASGO Vice-Presidente da ABPTGIC
 Nilma Antas Neves Profa Ginecologia da Universidade Federal da Bahia Presidente da Comissão de Vacinas da FEBRASGO Vice-Presidente da ABPTGIC 1. Indicações e proteção global contra doenças 2. Imunidade
Nilma Antas Neves Profa Ginecologia da Universidade Federal da Bahia Presidente da Comissão de Vacinas da FEBRASGO Vice-Presidente da ABPTGIC 1. Indicações e proteção global contra doenças 2. Imunidade
QUAIS OS TIPOS DE HPV MAIS COMUNS QUE PODEM CAUSAR CÂNCER?
 O QUE É O HPV? Sigla para Papilomavírus Humano, são vírus capazes de infectar a pele ou a mucosa. Existem mais de 150 tipos diferentes de HPV, dos quais 40 podem infectar o trato genital e, destes, 12
O QUE É O HPV? Sigla para Papilomavírus Humano, são vírus capazes de infectar a pele ou a mucosa. Existem mais de 150 tipos diferentes de HPV, dos quais 40 podem infectar o trato genital e, destes, 12
HPV. Câncer do Colo do Útero Verrugas Genitais. G u i a d e P ediatria
 HPV Câncer do Colo do Útero Verrugas Genitais G u i a d e P ediatria Você tenta fazer tudo que é possível para proteger sua filha, para garantir que tudo dê certo hoje e amanhã. Ela confia em você. Essa
HPV Câncer do Colo do Útero Verrugas Genitais G u i a d e P ediatria Você tenta fazer tudo que é possível para proteger sua filha, para garantir que tudo dê certo hoje e amanhã. Ela confia em você. Essa
Vacina quadrivalente recombinante contra papilomavírus humano (tipos 6, 11, 16 e 18)
 IDENTIFICAÇÃO DO MEDICAMENTO: Vacina quadrivalente recombinante contra papilomavírus humano (tipos 6, 11, 16 e 18) APRESENTAÇÕES A vacina quadrivalente recombinante contra papilomavírus humano (tipos 6,
IDENTIFICAÇÃO DO MEDICAMENTO: Vacina quadrivalente recombinante contra papilomavírus humano (tipos 6, 11, 16 e 18) APRESENTAÇÕES A vacina quadrivalente recombinante contra papilomavírus humano (tipos 6,
HPV em mulheres infectadas pelo HIV Goldman ARNP, MPH
 Welcome to I-TECH HIV/AIDS Clinical Seminar Series 30 de Agosto de 2012 HPV em mulheres infectadas pelo HIV Goldman ARNP, MPH Objectivos 1. Discutir a epidemiologia do HPV entre mulheres infectadas pelo
Welcome to I-TECH HIV/AIDS Clinical Seminar Series 30 de Agosto de 2012 HPV em mulheres infectadas pelo HIV Goldman ARNP, MPH Objectivos 1. Discutir a epidemiologia do HPV entre mulheres infectadas pelo
BULA PARA O PACIENTE
 BULA PARA O PACIENTE Modelo de texto de bula Aldara imiquimode Forma farmacêutica: Creme Apresentação: Cartucho contendo 6 (12) sachês com 250 mg Aldara (imiquimode) deve ser administrado da seguinte forma:
BULA PARA O PACIENTE Modelo de texto de bula Aldara imiquimode Forma farmacêutica: Creme Apresentação: Cartucho contendo 6 (12) sachês com 250 mg Aldara (imiquimode) deve ser administrado da seguinte forma:
Vacina contra Papilomavírus. humano (HPV): Promessas e Desafios. Edson D. Moreira Jr., MD, PhD. Centro de Pesquisas Gonçalo. Moniz FIOCRUZ - Bahia
 Vacina contra Papilomavírus humano (HPV): Promessas e Desafios Edson D. Moreira Jr., MD, PhD Centro de Pesquisas Gonçalo Moniz FIOCRUZ - Bahia Sumário Biologia do HPV Epidemiologia e Impacto das Doenças
Vacina contra Papilomavírus humano (HPV): Promessas e Desafios Edson D. Moreira Jr., MD, PhD Centro de Pesquisas Gonçalo Moniz FIOCRUZ - Bahia Sumário Biologia do HPV Epidemiologia e Impacto das Doenças
Últimas evidências da efetividade das vacinas contra o HPV. Perspectivas clínicas
 Últimas evidências da efetividade das vacinas contra o HPV Perspectivas clínicas Fábio Russomano 30 de agosto de 2008 É permitida a reprodução total ou parcial, desde que citada a fonte: Russomano F, 2008
Últimas evidências da efetividade das vacinas contra o HPV Perspectivas clínicas Fábio Russomano 30 de agosto de 2008 É permitida a reprodução total ou parcial, desde que citada a fonte: Russomano F, 2008
NEOPLASIA INTRAEPITELIAL VULVAR RIO DE JANEIRO 2013
 NEOPLASIA INTRAEPITELIAL VULVAR diagnóstico e conduta RIO DE JANEIRO 2013 A NIV aumentou em 4 vezes nos EUA entre 1973 e 2000 A regressão da NIV existe O câncer invasor está presente em 3% das mulheres
NEOPLASIA INTRAEPITELIAL VULVAR diagnóstico e conduta RIO DE JANEIRO 2013 A NIV aumentou em 4 vezes nos EUA entre 1973 e 2000 A regressão da NIV existe O câncer invasor está presente em 3% das mulheres
HPV. Papiloma Virus. Trata-se de uma infecção adquirida através de contato sexual.
 HPV Papiloma Virus Todo ano, cerca de 230 mil mulheres morrem no mundo vítimas do câncer no colo do útero. E, para o surgimento desse tipo de câncer, é necessário que a vítima tenha sido infectada pelo
HPV Papiloma Virus Todo ano, cerca de 230 mil mulheres morrem no mundo vítimas do câncer no colo do útero. E, para o surgimento desse tipo de câncer, é necessário que a vítima tenha sido infectada pelo
Abbott Laboratórios do Brasil Ltda Rua Michigan 735, Brooklin São Paulo - SP CEP: 04566-905
 MODELO DE BULA PARA O PACIENTE SYNAGIS palivizumabe I - IDENTIFICAÇÃO DO MEDICAMENTO APRESENTAÇÕES Pó liófilo injetável de: - 100 mg em embalagem com 01 frasco-ampola para dose única contendo palivizumabe
MODELO DE BULA PARA O PACIENTE SYNAGIS palivizumabe I - IDENTIFICAÇÃO DO MEDICAMENTO APRESENTAÇÕES Pó liófilo injetável de: - 100 mg em embalagem com 01 frasco-ampola para dose única contendo palivizumabe
HPV. Câncer do Colo do Útero Verrugas Genitais. G u i a d e G i n e c o l o g i a
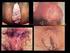 HPV Câncer do Colo do Útero Verrugas Genitais G u i a d e G i n e c o l o g i a Para você que é corajosa e tem confiança no futuro. Você tem muitos planos para obter sucesso profissional sem perder a alegria
HPV Câncer do Colo do Útero Verrugas Genitais G u i a d e G i n e c o l o g i a Para você que é corajosa e tem confiança no futuro. Você tem muitos planos para obter sucesso profissional sem perder a alegria
APRESENTAÇÃO DA EFICÁCIA DA VACINA HPV DISTRIBUÍDA PELO SUS A PARTIR DE 2014 COM BASE NOS ESTUDOS FUTURE I, FUTURE II, E VILLA et al.
 APRESENTAÇÃO DA EFICÁCIA DA VACINA HPV DISTRIBUÍDA PELO SUS A PARTIR DE 2014 COM BASE NOS ESTUDOS FUTURE I, FUTURE II, E VILLA et al. Chaline Barbosa de Laia NUNES 1, Kimberly Marques ARRUDA 1 * & Théa
APRESENTAÇÃO DA EFICÁCIA DA VACINA HPV DISTRIBUÍDA PELO SUS A PARTIR DE 2014 COM BASE NOS ESTUDOS FUTURE I, FUTURE II, E VILLA et al. Chaline Barbosa de Laia NUNES 1, Kimberly Marques ARRUDA 1 * & Théa
CREMEFENERGAN prometazina. APRESENTAÇÃO Creme 20mg/g: bisnaga de 30 g. USO TÓPICO. USO ADULTO E PEDIÁTRICO ACIMA DE 2 ANOS.
 Esta bula sofreu aumento do tamanho para adequação a legislação vigente da ANVISA. Esta bula é continuamente atualizada. Favor proceder a sua leitura antes de utilizar o medicamento. CREMEFENERGAN prometazina
Esta bula sofreu aumento do tamanho para adequação a legislação vigente da ANVISA. Esta bula é continuamente atualizada. Favor proceder a sua leitura antes de utilizar o medicamento. CREMEFENERGAN prometazina
vacina febre amarela (atenuada)
 Modelo de Bula Página 1 de 6 vacina febre amarela (atenuada) FORMA FARMACÊUTICA E APRESENTAÇÕES Pó liofilizado para suspensão injetável + diluente para reconstituição. Cartucho contendo 1 frasco-ampola
Modelo de Bula Página 1 de 6 vacina febre amarela (atenuada) FORMA FARMACÊUTICA E APRESENTAÇÕES Pó liofilizado para suspensão injetável + diluente para reconstituição. Cartucho contendo 1 frasco-ampola
recomendações Atualização de Condutas em Pediatria
 Atualização de Condutas em Pediatria nº 36 Departamentos Científicos da SPSP, gestão 2007-2009. Departamento de Neonatologia Obstrução nasal no recém-nascido Minhas dúvidas sobre o HPV Departamento de
Atualização de Condutas em Pediatria nº 36 Departamentos Científicos da SPSP, gestão 2007-2009. Departamento de Neonatologia Obstrução nasal no recém-nascido Minhas dúvidas sobre o HPV Departamento de
AVAXIM 80U vacina hepatite A (inativada) - 80U. A vacina hepatite A (inativada) - 80U - AVAXIM 80U deve ser administrada por VIA INTRAMUSCULAR.
 Modelo de Bula Página 1 de 6 AVAXIM 80U vacina hepatite A (inativada) - 80U FORMA FARMACÊUTICA E APRESENTAÇÕES Suspensão injetável. - Cartucho contendo uma seringa de 1 dose de 0,5mL; - Cartucho contendo
Modelo de Bula Página 1 de 6 AVAXIM 80U vacina hepatite A (inativada) - 80U FORMA FARMACÊUTICA E APRESENTAÇÕES Suspensão injetável. - Cartucho contendo uma seringa de 1 dose de 0,5mL; - Cartucho contendo
Vacinas Bivalente e Quadrivalente: Prós e contras
 IX S impós io de Atualização em G inecolog ia Oncológ ica III S impós io de G enitos copia do DF AB PTG IC C apítulo DF 12-14 de Maio de 2011 Vacinas Bivalente e Quadrivalente: Prós e contras Fábio Russomano
IX S impós io de Atualização em G inecolog ia Oncológ ica III S impós io de G enitos copia do DF AB PTG IC C apítulo DF 12-14 de Maio de 2011 Vacinas Bivalente e Quadrivalente: Prós e contras Fábio Russomano
HPV: DIAGNÓSTICO E PREVENÇÃO
 HPV: DIAGNÓSTICO E PREVENÇÃO Bruna Rezende, Rassan Dyego Romão Silva e Antonio Jose Dias Martins Faculdade Alfredo Nasser Aparecida de Goiânia GO Brasil rassandyego@hotmail.com Orientadora: Daniella Cavalcante
HPV: DIAGNÓSTICO E PREVENÇÃO Bruna Rezende, Rassan Dyego Romão Silva e Antonio Jose Dias Martins Faculdade Alfredo Nasser Aparecida de Goiânia GO Brasil rassandyego@hotmail.com Orientadora: Daniella Cavalcante
Febre Periódica, Estomatite Aftosa, Faringite e Adenite (PFAPA)
 www.printo.it/pediatric-rheumatology/br/intro Febre Periódica, Estomatite Aftosa, Faringite e Adenite (PFAPA) Versão de 2016 1. O QUE É A PFAPA 1.1 O que é? PFAPA significa Febre Periódica, Estomatite
www.printo.it/pediatric-rheumatology/br/intro Febre Periódica, Estomatite Aftosa, Faringite e Adenite (PFAPA) Versão de 2016 1. O QUE É A PFAPA 1.1 O que é? PFAPA significa Febre Periódica, Estomatite
GUIA PRÁTICO SOBRE O HPV PERGUNTAS E RESPOSTAS
 ESTADO DE SERGIPE PREFEITURA MUNICIPAL DE ARACAJU SECRETARIA MUNICIPAL DE SAÚDE COORDENAÇÃO DE VIGILÂNCIA DE AGRAVOS TRASMISSÍVEIS GUIA PRÁTICO SOBRE O HPV PERGUNTAS E RESPOSTAS ARACAJU JANEIRO, 2014 Prefácio
ESTADO DE SERGIPE PREFEITURA MUNICIPAL DE ARACAJU SECRETARIA MUNICIPAL DE SAÚDE COORDENAÇÃO DE VIGILÂNCIA DE AGRAVOS TRASMISSÍVEIS GUIA PRÁTICO SOBRE O HPV PERGUNTAS E RESPOSTAS ARACAJU JANEIRO, 2014 Prefácio
Desdobrável de informação ao paciente
 Desdobrável de informação ao paciente Cancro do colo do útero Secções para este tópico: Introdução Sintomas Causas Diagnóstico Tratamento Prevenção Bibliografia Parceiros de informações Introdução O cancro
Desdobrável de informação ao paciente Cancro do colo do útero Secções para este tópico: Introdução Sintomas Causas Diagnóstico Tratamento Prevenção Bibliografia Parceiros de informações Introdução O cancro
Guia Prático. Vacinação da Mulher
 Guia Prático Vacinação da Mulher 2014 GUIA DA VACINAÇÃO DA MULHER Federação Brasileira das Associações de Ginecologia e Obstetrícia DIRETORIA Presidente: Etelvino de Souza Trindade Secretária Executiva:
Guia Prático Vacinação da Mulher 2014 GUIA DA VACINAÇÃO DA MULHER Federação Brasileira das Associações de Ginecologia e Obstetrícia DIRETORIA Presidente: Etelvino de Souza Trindade Secretária Executiva:
QUESTIONÁRIO DE AVALIAÇÃO INICIAL - HOMEM VIH NEGATIVO
 INSTRUÇÕES PARA A EQUIPA DO ESTUDO: Após inscrição no estudo, os participantes devem preencher este questionário de avaliação inicial. Certifique-se de que é distribuído o questionário adequado. Após o
INSTRUÇÕES PARA A EQUIPA DO ESTUDO: Após inscrição no estudo, os participantes devem preencher este questionário de avaliação inicial. Certifique-se de que é distribuído o questionário adequado. Após o
Declaração de Conflitos de Interesse
 HPV Vacina como Ferramenta de Preventiva Câncer Cervical & Verrugas Genitais Vacina Quadrivalente Contra HPV 6, 11, 16, 18 Dra. Paula Távora Declaração de Conflitos de Interesse Nada a declarar. Vacina
HPV Vacina como Ferramenta de Preventiva Câncer Cervical & Verrugas Genitais Vacina Quadrivalente Contra HPV 6, 11, 16, 18 Dra. Paula Távora Declaração de Conflitos de Interesse Nada a declarar. Vacina
CAMPANHA DE VACINAÇÃO CONTRA O HPV - 2016
 CAMPANHA DE VACINAÇÃO CONTRA O HPV - 2016 Sobre o HPV Vírus muito disseminado, transmitido pelo contato direto com pele ou mucosas infectadas Mais de 200 tipos de HPV sendo 13 oncogênicos Os HPV tipos
CAMPANHA DE VACINAÇÃO CONTRA O HPV - 2016 Sobre o HPV Vírus muito disseminado, transmitido pelo contato direto com pele ou mucosas infectadas Mais de 200 tipos de HPV sendo 13 oncogênicos Os HPV tipos
TRATAMENTO DA NEOPLASIA INTRAEPITELIAL VULVAR: POSSIBILIDADES E LIMITES. Susana Aidé Professora Adjunta de Ginecologia- Uff
 TRATAMENTO DA NEOPLASIA INTRAEPITELIAL VULVAR: POSSIBILIDADES E LIMITES Susana Aidé Professora Adjunta de Ginecologia- Uff CARCINOGÊNESE VULVAR NIV USUAL (HPV ) NIV DIFERENCIADA 30-40% (líquen escleroso
TRATAMENTO DA NEOPLASIA INTRAEPITELIAL VULVAR: POSSIBILIDADES E LIMITES Susana Aidé Professora Adjunta de Ginecologia- Uff CARCINOGÊNESE VULVAR NIV USUAL (HPV ) NIV DIFERENCIADA 30-40% (líquen escleroso
INFORME TÉCNICO DA VACINA PAPILOMAVÍRUS HUMANO 6, 11, 16 E 18 (RECOMBINANTE) 2015 SEGUNDA DOSE
 MINISTÉRIO DA SAÚDE SECRETARIA DE VIGILÂNCIA EM SAÚDE DEPARTAMENTO DE VIGILÂNCIA DE DOENÇAS TRANSMISSÍVEIS COORDENAÇÃO-GERAL DO PROGRAMA NACIONAL DE IMUNIZAÇÕES INFORME TÉCNICO DA VACINA PAPILOMAVÍRUS
MINISTÉRIO DA SAÚDE SECRETARIA DE VIGILÂNCIA EM SAÚDE DEPARTAMENTO DE VIGILÂNCIA DE DOENÇAS TRANSMISSÍVEIS COORDENAÇÃO-GERAL DO PROGRAMA NACIONAL DE IMUNIZAÇÕES INFORME TÉCNICO DA VACINA PAPILOMAVÍRUS
Antrofi promestrieno. Eurofarma Laboratórios S.A. Creme vaginal 10 mg/g
 Antrofi promestrieno Eurofarma Laboratórios S.A. Creme vaginal 10 mg/g Antrofi promestrieno CREME VAGINAL FORMAS FARMACÊUTICAS E APRESENTAÇÕES APRESENTAÇÕES Bisnaga com 30 g de creme vaginal acompanhada
Antrofi promestrieno Eurofarma Laboratórios S.A. Creme vaginal 10 mg/g Antrofi promestrieno CREME VAGINAL FORMAS FARMACÊUTICAS E APRESENTAÇÕES APRESENTAÇÕES Bisnaga com 30 g de creme vaginal acompanhada
A Introdução dos Biológicos no Tratamento da Psoríase: experiência da Enfermagem em um Centro de Infusões
 A Introdução dos Biológicos no Tratamento da Psoríase: experiência da Enfermagem em um Centro de Infusões Enfª Resp. Téc. Ana Cristina de Almeida CIP-Centro de Infusões Pacaembú Agente Biológicos Os biológicos
A Introdução dos Biológicos no Tratamento da Psoríase: experiência da Enfermagem em um Centro de Infusões Enfª Resp. Téc. Ana Cristina de Almeida CIP-Centro de Infusões Pacaembú Agente Biológicos Os biológicos
LEIA ATENTAMENTE ESTA BULA ANTES DE INICIAR O TRATAMENTO.
 LEIA ATENTAMENTE ESTA BULA ANTES DE INICIAR O TRATAMENTO. I IDENTIFICAÇÃO DO MEDICAMENTO vacina influenza (fragmentada, inativada) APRESENTAÇÃO Suspensão injetável para administração intramuscular ou subcutânea.
LEIA ATENTAMENTE ESTA BULA ANTES DE INICIAR O TRATAMENTO. I IDENTIFICAÇÃO DO MEDICAMENTO vacina influenza (fragmentada, inativada) APRESENTAÇÃO Suspensão injetável para administração intramuscular ou subcutânea.
predisposição a diabetes, pois Ablok Plus pode mascarar os sinais e sintomas da hipoglicemia ou causar um aumento na concentração da glicose
 ABLOK PLUS Ablok Plus Atenolol Clortalidona Indicações - ABLOK PLUS No tratamento da hipertensão arterial. A combinação de baixas doses eficazes de um betabloqueador e umdiurético nos comprimidos de 50
ABLOK PLUS Ablok Plus Atenolol Clortalidona Indicações - ABLOK PLUS No tratamento da hipertensão arterial. A combinação de baixas doses eficazes de um betabloqueador e umdiurético nos comprimidos de 50
A SEGUIR ALGUMAS DICAS PARA O DESENVOLVIMENTO DE UM PROJETO CIENTÍFICO
 A SEGUIR ALGUMAS DICAS PARA O DESENVOLVIMENTO DE UM PROJETO CIENTÍFICO DESENVOLVENDO UM PROJETO 1. Pense em um tema de seu interesse ou um problema que você gostaria de resolver. 2. Obtenha um caderno
A SEGUIR ALGUMAS DICAS PARA O DESENVOLVIMENTO DE UM PROJETO CIENTÍFICO DESENVOLVENDO UM PROJETO 1. Pense em um tema de seu interesse ou um problema que você gostaria de resolver. 2. Obtenha um caderno
Modelo de Texto de Bula. betametasona (como 17-valerato)... 1mg (0,1% p/p) veículo: (carbopol, álcool isopropílico e água purificada q.s.p)...
 Betnovate valerato de betametasona Capilar FORMAS FARMACÊUTICAS E APRESENTAÇÕES: BETNOVATE Capilar é uma solução transparente, levemente viscosa, contendo 17-valerato de betametasona a 0,1% p/p. O veículo
Betnovate valerato de betametasona Capilar FORMAS FARMACÊUTICAS E APRESENTAÇÕES: BETNOVATE Capilar é uma solução transparente, levemente viscosa, contendo 17-valerato de betametasona a 0,1% p/p. O veículo
RASTREIO DO CANCRO DO COLO DO ÚTERO E VACINAÇÃO CONTRA O HPV. Pedro Vieira Baptista
 2012 Norte 24 de Outubro Quinta-feira RASTREIO DO CANCRO DO COLO DO ÚTERO E VACINAÇÃO CONTRA O HPV Pedro Vieira Baptista Para começar... Referência a condilomatose anogenital por autores gregos e romanos.
2012 Norte 24 de Outubro Quinta-feira RASTREIO DO CANCRO DO COLO DO ÚTERO E VACINAÇÃO CONTRA O HPV Pedro Vieira Baptista Para começar... Referência a condilomatose anogenital por autores gregos e romanos.
A Meta-Analytic Review of Psychosocial Interventions for Substance Use Disorders
 A Meta-Analytic Review of Psychosocial Interventions for Substance Use Disorders REVISÃO META-ANALÍTICA DO USO DE INTERVENÇÕES PSICOSSOCIAIS NO TRATAMENTO DE DEPENDÊNCIA QUÍMICA Publicado: Am J Psychiattry
A Meta-Analytic Review of Psychosocial Interventions for Substance Use Disorders REVISÃO META-ANALÍTICA DO USO DE INTERVENÇÕES PSICOSSOCIAIS NO TRATAMENTO DE DEPENDÊNCIA QUÍMICA Publicado: Am J Psychiattry
vacina influenza A/H1N1 (fragmentada e inativada)
 MODELO DE BULA vacina influenza A/H1N1 (fragmentada e inativada) APRESENTAÇÃO Frasco-ampola multidose (10 doses de 0,5 ml) Embalagem com 10 frascos-ampola. Suspensão para injeção. VIA INTRAMUSCULAR USO
MODELO DE BULA vacina influenza A/H1N1 (fragmentada e inativada) APRESENTAÇÃO Frasco-ampola multidose (10 doses de 0,5 ml) Embalagem com 10 frascos-ampola. Suspensão para injeção. VIA INTRAMUSCULAR USO
Cancer de Colo do Útero
 Cancer de Colo do Útero Câncer de colo do útero são alterações celulares que tem uma progressão gradativa e é por isto que esta é uma doença curável quando descoberta no início. Esta é a razão do exame
Cancer de Colo do Útero Câncer de colo do útero são alterações celulares que tem uma progressão gradativa e é por isto que esta é uma doença curável quando descoberta no início. Esta é a razão do exame
-Os Papiloma Vírus Humanos (HPV) são vírus da família Papovaviridae.
 -Os Papiloma Vírus Humanos (HPV) são vírus da família Papovaviridae. -Chamado de HPV, aparece na forma de doenças como condiloma acuminado, verruga genital ou crista de galo. -Há mais de 200 subtipos do
-Os Papiloma Vírus Humanos (HPV) são vírus da família Papovaviridae. -Chamado de HPV, aparece na forma de doenças como condiloma acuminado, verruga genital ou crista de galo. -Há mais de 200 subtipos do
4. COMO É FEITO O DIAGNÓSTICO MIELOIDE CRÔNICA (LMC)? E MONITORAMENTO DE LMC? É uma doença relativamente rara, que ocorre
 ÍNDICE 1. O que é Leucemia Mieloide Crônica (LMC)?... pág 4 2. Quais são os sinais e sintomas?... pág 4 3. Como a LMC evolui?... pág 5 4. Quais são os tratamentos disponíveis para a LMC?... pág 5 5. Como
ÍNDICE 1. O que é Leucemia Mieloide Crônica (LMC)?... pág 4 2. Quais são os sinais e sintomas?... pág 4 3. Como a LMC evolui?... pág 5 4. Quais são os tratamentos disponíveis para a LMC?... pág 5 5. Como
Atualização das Diretrizes Brasileiras para o rastreamento do câncer do colo do útero
 Atualização das Diretrizes Brasileiras para o rastreamento do câncer do colo do útero CERVICOLP 2011 - XXII CURSO DE ATUALIZAÇÃO EM PTGI E COLPOSCOPIA 29/9 a 01/10/2011 Fábio Russomano Possíveis conflitos
Atualização das Diretrizes Brasileiras para o rastreamento do câncer do colo do útero CERVICOLP 2011 - XXII CURSO DE ATUALIZAÇÃO EM PTGI E COLPOSCOPIA 29/9 a 01/10/2011 Fábio Russomano Possíveis conflitos
exemplo dessas alterações epidemiológicas podemos citar os dados recentemente atualizados do Estado de São Paulo:
 Recentemente foi licenciada no Brasil a vacina conjugada contra os meningococos dos sorogrupos A, C, Y, W135, produzida pelo Laboratório Novartis e conhecida internacionalmente como Menveo. A vacina é
Recentemente foi licenciada no Brasil a vacina conjugada contra os meningococos dos sorogrupos A, C, Y, W135, produzida pelo Laboratório Novartis e conhecida internacionalmente como Menveo. A vacina é
Ana Paula do Prado 1 (Apresentadora), Fernanda Rafaela Mansour. Palavras-chave: Vírus, câncer, cervical. Introdução
 ESTUDO EPIDEMIOLÓGICO PARA CARACTERIZAÇÃO DE PORTADORAS DE PAPILOMAVIRUS HUMANO (HPV) ADOLESCENTES DO SEXO FEMININO ATENDIDAS EM UM AMBULATÓRIO DE DOENÇAS SEXUALMENTE TRANSMISSÍVEIS DE UM MUNICÍPIO DE
ESTUDO EPIDEMIOLÓGICO PARA CARACTERIZAÇÃO DE PORTADORAS DE PAPILOMAVIRUS HUMANO (HPV) ADOLESCENTES DO SEXO FEMININO ATENDIDAS EM UM AMBULATÓRIO DE DOENÇAS SEXUALMENTE TRANSMISSÍVEIS DE UM MUNICÍPIO DE
vacina febre amarela (atenuada)
 vacina febre amarela (atenuada) Sanofi-Aventis Farmacêutica Ltda. Pó liofilizado para suspensão injetável + diluente para reconstituição 1.000U de Vírus atenuados da febre amarela (cepa 17 D-204)/dose
vacina febre amarela (atenuada) Sanofi-Aventis Farmacêutica Ltda. Pó liofilizado para suspensão injetável + diluente para reconstituição 1.000U de Vírus atenuados da febre amarela (cepa 17 D-204)/dose
INFECÇÃO PELO HPV: QUANDO E COMO TRATAR? UNITAU-SP Setor de Genitoscopia Prof. Dr André Luis F Santos
 INFECÇÃO PELO HPV: QUANDO E COMO TRATAR? UNITAU-SP Setor de Genitoscopia Prof. Dr André Luis F Santos QUAL O NOSSO OBJETIVO PRINCIPAL? Redução da morbi-mortalidade por CA colo Evolução lenta Evitável Ineficiência
INFECÇÃO PELO HPV: QUANDO E COMO TRATAR? UNITAU-SP Setor de Genitoscopia Prof. Dr André Luis F Santos QUAL O NOSSO OBJETIVO PRINCIPAL? Redução da morbi-mortalidade por CA colo Evolução lenta Evitável Ineficiência
Vacina de Rotavírus Humano Vivo Atenuado
 cepa RIX4414 (vírus atenuados) I ) Identificação do medicamento FORMAS FARMACÊUTICAS E APRESENTAÇÕES USO PEDIÁTRICO Vacina liofilizada para ser reconstituída antes da administração oral. A VACINA DE ROTAVÍRUS
cepa RIX4414 (vírus atenuados) I ) Identificação do medicamento FORMAS FARMACÊUTICAS E APRESENTAÇÕES USO PEDIÁTRICO Vacina liofilizada para ser reconstituída antes da administração oral. A VACINA DE ROTAVÍRUS
APROVAÇÃO DE EMBALAGEM
 NOT CLT CAPS BRE_NOT CLT CAPS BRE NOUV 03/01/12 10:11 Page1 DIMENSÕES: 210x175mm CORES: Black Programa: QuarkXpress Fontes: Times new roman - Agfa Rotis Semi Serif APROVAÇÃO DE EMBALAGEM NOT CLT CAPS BRE_NOT
NOT CLT CAPS BRE_NOT CLT CAPS BRE NOUV 03/01/12 10:11 Page1 DIMENSÕES: 210x175mm CORES: Black Programa: QuarkXpress Fontes: Times new roman - Agfa Rotis Semi Serif APROVAÇÃO DE EMBALAGEM NOT CLT CAPS BRE_NOT
Boletim Eletrônico Abril 2013 64ª edição
 Boletim Eletrônico Abril 2013 64ª edição ADOLESCENTES DE ALTO RISCO DEVERIAM REALIZAR RASTREAMENTO PARA CÂNCER DO COLO DO ÚTERO? A regressão das lesões de baixo grau (LSIL) em adolescentes é comum, mais
Boletim Eletrônico Abril 2013 64ª edição ADOLESCENTES DE ALTO RISCO DEVERIAM REALIZAR RASTREAMENTO PARA CÂNCER DO COLO DO ÚTERO? A regressão das lesões de baixo grau (LSIL) em adolescentes é comum, mais
Vacinas contra HPV: aspectos atuais
 Vacinas contra HPV: aspectos atuais Nome do Evento Local Data Fábio Russomano Sumário Breve histórico e síntese de resultados até 2008 Prevalência de HPV vs proteção cruzada Questões em aberto Resultados
Vacinas contra HPV: aspectos atuais Nome do Evento Local Data Fábio Russomano Sumário Breve histórico e síntese de resultados até 2008 Prevalência de HPV vs proteção cruzada Questões em aberto Resultados
finasterida Merck S/A comprimidos revestidos 1 mg
 finasterida Merck S/A comprimidos revestidos 1 mg finasterida Medicamento genérico Lei nº 9.787, de 1999. 1 mg APRESENTAÇÕES Comprimidos revestidos de 1 mg em embalagem com 30 ou 60 comprimidos. USO ORAL
finasterida Merck S/A comprimidos revestidos 1 mg finasterida Medicamento genérico Lei nº 9.787, de 1999. 1 mg APRESENTAÇÕES Comprimidos revestidos de 1 mg em embalagem com 30 ou 60 comprimidos. USO ORAL
Anexo A ACFOL CAZI QUIMICA FARMACÊUTICA IND. E COM. LTDA. Comprimidos e Solução Oral (gotas) 5 mg
 Anexo A ACFOL CAZI QUIMICA FARMACÊUTICA IND. E COM. LTDA Comprimidos e Solução Oral (gotas) 5 mg MODELO DE BULA (adequação à RDC n.º 47/09 Republicada em DOU 19/01/2010) INFORMAÇÕES AO PACIENTE ACFOL I
Anexo A ACFOL CAZI QUIMICA FARMACÊUTICA IND. E COM. LTDA Comprimidos e Solução Oral (gotas) 5 mg MODELO DE BULA (adequação à RDC n.º 47/09 Republicada em DOU 19/01/2010) INFORMAÇÕES AO PACIENTE ACFOL I
Micoral Laboratório Farmacêutico Elofar Ltda. Creme dermatológico 20 mg/g
 Micoral Laboratório Farmacêutico Elofar Ltda. Creme dermatológico 20 mg/g MICORAL cetoconazol APRESENTAÇÃO Creme em bisnaga de 30 g, contendo 20 mg/g de cetoconazol. USO TÓPICO USO ADULTO E PEDIÁTRICO
Micoral Laboratório Farmacêutico Elofar Ltda. Creme dermatológico 20 mg/g MICORAL cetoconazol APRESENTAÇÃO Creme em bisnaga de 30 g, contendo 20 mg/g de cetoconazol. USO TÓPICO USO ADULTO E PEDIÁTRICO
O primeiro passo para evitar o câncer do colo do útero é se informar. Que tal começar agora?
 O primeiro passo para evitar o câncer do colo do útero é se informar. Que tal começar agora? Folheto Consumidora 9x15cm.indd 1 7/21/08 6:07:48 PM A cada ano, 500.000 mulheres no mundo têm câncer do colo
O primeiro passo para evitar o câncer do colo do útero é se informar. Que tal começar agora? Folheto Consumidora 9x15cm.indd 1 7/21/08 6:07:48 PM A cada ano, 500.000 mulheres no mundo têm câncer do colo
VÍRUS DA IMUNODEFICIÊNCIA HUMANA (VIH) PREVENÇÃO DA TRANSMISSÃO VERTICAL
 VÍRUS DA IMUNODEFICIÊNCIA HUMANA () PREVENÇÃO DA TRANSMISSÃO VERTICAL Introdução A infecção na criança no nosso país faz-se quase exclusivamente por transmissão vertical pelo que é possível reduzir eficazmente
VÍRUS DA IMUNODEFICIÊNCIA HUMANA () PREVENÇÃO DA TRANSMISSÃO VERTICAL Introdução A infecção na criança no nosso país faz-se quase exclusivamente por transmissão vertical pelo que é possível reduzir eficazmente
Pode ser utilizada isolada ou associada no tratamento adjuvante e paliativo de câncer gastrointestinal, onde pode ser associada ao ácido fólico.
 Material Técnico Identificação Fórmula Molecular: C 4 H 3 FN 2 O 2 Peso molecular: 130,1 DCB/ DCI: 04174 - fluoruracila CAS: 51-21-8 INCI: Não aplicável Sinonímia: Fluorouracil, 5-Fluorouracil, 5-Fluoropyrimidine-2,4(1H,3H)-dione.
Material Técnico Identificação Fórmula Molecular: C 4 H 3 FN 2 O 2 Peso molecular: 130,1 DCB/ DCI: 04174 - fluoruracila CAS: 51-21-8 INCI: Não aplicável Sinonímia: Fluorouracil, 5-Fluorouracil, 5-Fluoropyrimidine-2,4(1H,3H)-dione.
NOTA TÉCNICA N o 014/2012
 NOTA TÉCNICA N o 014/2012 Brasília, 28 de agosto de 2012. ÁREA: Área Técnica em Saúde TÍTULO: Alerta sobre o vírus H1N1 REFERÊNCIA(S): Protocolo de Vigilância Epidemiológica da Influenza Pandêmica (H1N1)
NOTA TÉCNICA N o 014/2012 Brasília, 28 de agosto de 2012. ÁREA: Área Técnica em Saúde TÍTULO: Alerta sobre o vírus H1N1 REFERÊNCIA(S): Protocolo de Vigilância Epidemiológica da Influenza Pandêmica (H1N1)
Propil* propiltiouracila
 Propil* propiltiouracila PARTE I IDENTIFICAÇÃO DO PRODUTO Nome: Propil* Nome genérico: propiltiouracila Forma farmacêutica e apresentação: Propil* 100 mg em embalagem contendo 30 comprimidos. USO ADULTO
Propil* propiltiouracila PARTE I IDENTIFICAÇÃO DO PRODUTO Nome: Propil* Nome genérico: propiltiouracila Forma farmacêutica e apresentação: Propil* 100 mg em embalagem contendo 30 comprimidos. USO ADULTO
RASTREIO EM SITUAÇÕES ESPECIAIS
 RASTREIO EM SITUAÇÕES ESPECIAIS Maria José de Camargo IFF / FIOCRUZ CERVIX www.cervixcolposcopia.com.br Gestantes Pós-menopausa Histerectomizadas Imunossuprimidas Adolescentes Mulheres sem história de
RASTREIO EM SITUAÇÕES ESPECIAIS Maria José de Camargo IFF / FIOCRUZ CERVIX www.cervixcolposcopia.com.br Gestantes Pós-menopausa Histerectomizadas Imunossuprimidas Adolescentes Mulheres sem história de
- Vacina monovalente contra a poliomielite (VIP)
 VACINAÇÃO PERTENCENTE AO PNV - A Vacina contra a Tuberculose (BCG) Tipo de vacina: Vacina de bacilos vivos atenuados Mycobacterium bovis : Gravidez Imunodeficiência celular, congénita ou adquirida Tratamentos
VACINAÇÃO PERTENCENTE AO PNV - A Vacina contra a Tuberculose (BCG) Tipo de vacina: Vacina de bacilos vivos atenuados Mycobacterium bovis : Gravidez Imunodeficiência celular, congénita ou adquirida Tratamentos
Estudo PARTNER. Foi convidado a participar neste estudo porque tem uma relação em que é o parceiro VIH positivo.
 Informação ao participante e consentimento informado para o parceiro VIH positivo Estudo PARTNER O estudo PARTNER é um estudo levado a cabo com casais em que: (i) um parceiro é VIH positivo e o outro é
Informação ao participante e consentimento informado para o parceiro VIH positivo Estudo PARTNER O estudo PARTNER é um estudo levado a cabo com casais em que: (i) um parceiro é VIH positivo e o outro é
Vacina adsorvida meningocócica B (recombinante)
 Vacina adsorvida meningocócica B (recombinante) Novartis Biociências S.A. Suspensão injetável 50 mcg + 50 mcg + 50 mcg + 25 mcg / 0,5 ml 1 Vacina adsorvida meningocócica B (recombinante) APRESENTAÇÕES
Vacina adsorvida meningocócica B (recombinante) Novartis Biociências S.A. Suspensão injetável 50 mcg + 50 mcg + 50 mcg + 25 mcg / 0,5 ml 1 Vacina adsorvida meningocócica B (recombinante) APRESENTAÇÕES
BULA PACIENTE AMINOLEX HALEX ISTAR
 BULA PACIENTE AMINOLEX HALEX ISTAR SOLUÇÃO INJETÁVEL 24 mg/ml Aminolex IDENTIFICAÇÃO DO MEDICAMENTO Aminolex FORMA FARMACÊUTICA E APRESENTAÇÕES Solução injetável 24mg/ml. Ampola de vidro de 10 ml Solução
BULA PACIENTE AMINOLEX HALEX ISTAR SOLUÇÃO INJETÁVEL 24 mg/ml Aminolex IDENTIFICAÇÃO DO MEDICAMENTO Aminolex FORMA FARMACÊUTICA E APRESENTAÇÕES Solução injetável 24mg/ml. Ampola de vidro de 10 ml Solução
Portuguese Summary. Resumo
 Portuguese Summary Resumo 176 Resumo Cerca de 1 em 100 indivíduos não podem comer pão, macarrão ou biscoitos, pois eles têm uma condição chamada de doença celíaca (DC). DC é causada por uma das intolerâncias
Portuguese Summary Resumo 176 Resumo Cerca de 1 em 100 indivíduos não podem comer pão, macarrão ou biscoitos, pois eles têm uma condição chamada de doença celíaca (DC). DC é causada por uma das intolerâncias
APRESENTAÇÃO Creme vaginal de 10 mg/g: embalagem com 35 g + 6 aplicadores descartáveis.
 clotrimazol Medicamento Genérico, Lei nº 9.787, de 1999 APRESENTAÇÃO Creme vaginal de 10 mg/g: embalagem com 35 g + 6 aplicadores descartáveis. USO VAGINAL USO ADULTO COMPOSIÇÃO Cada grama de creme vaginal
clotrimazol Medicamento Genérico, Lei nº 9.787, de 1999 APRESENTAÇÃO Creme vaginal de 10 mg/g: embalagem com 35 g + 6 aplicadores descartáveis. USO VAGINAL USO ADULTO COMPOSIÇÃO Cada grama de creme vaginal
25 de Abril Quinta-feira RASTREIO DO CANCRO DO COLO DO ÚTERO E IMUNOPROFILAXIA PARA O HPV. Joaquim Neves
 2013 25 de Abril Quinta-feira RASTREIO DO CANCRO DO COLO DO ÚTERO E IMUNOPROFILAXIA PARA O HPV Joaquim Neves Material de colheita de amostras para colpocitologia JOAQUIM NEVES Exocervix - espátula; escova;
2013 25 de Abril Quinta-feira RASTREIO DO CANCRO DO COLO DO ÚTERO E IMUNOPROFILAXIA PARA O HPV Joaquim Neves Material de colheita de amostras para colpocitologia JOAQUIM NEVES Exocervix - espátula; escova;
Numeração Única: 0145120798114 ou 0798114-29.2012.8.13.0145
 NT 25/2012 Solicitante: João Martiniano Vieira Neto Juiz da 2ª Vara de Registros Públicos e Fazenda Pública Municipal de Juiz de Fora/MG Data: 26/11/2012 Medicamento X Material Procedimento Cobertura Numeração
NT 25/2012 Solicitante: João Martiniano Vieira Neto Juiz da 2ª Vara de Registros Públicos e Fazenda Pública Municipal de Juiz de Fora/MG Data: 26/11/2012 Medicamento X Material Procedimento Cobertura Numeração
Que no ano de 2015 até a presente data foram notificados 4 casos de microcefalia, sendo que nenhum relacionado à infecção pelo Zika vírus;
 Nota Técnica SESA N 01/2015 i - Orientação às Equipes de Saúde sobre Microcefalia Curitiba, 02 de dezembro de 2015. A Secretaria de Estado da Saúde do Paraná (SESA) considerando: A confirmação pelo Ministério
Nota Técnica SESA N 01/2015 i - Orientação às Equipes de Saúde sobre Microcefalia Curitiba, 02 de dezembro de 2015. A Secretaria de Estado da Saúde do Paraná (SESA) considerando: A confirmação pelo Ministério
ESTIMORAL. Daiichi Sankyo Brasil Farmacêutica LTDA Comprimidos 3 mg
 ESTIMORAL Daiichi Sankyo Brasil Farmacêutica LTDA Comprimidos 3 mg IDENTIFICAÇÃO DO MEDICAMENTO ESTIMORAL lisado bacteriano Staphylococcus aureus, Streptococcus pyogenes, Streptococcus mitis, Streptococcus
ESTIMORAL Daiichi Sankyo Brasil Farmacêutica LTDA Comprimidos 3 mg IDENTIFICAÇÃO DO MEDICAMENTO ESTIMORAL lisado bacteriano Staphylococcus aureus, Streptococcus pyogenes, Streptococcus mitis, Streptococcus
INFORMAÇÃO IMPORTANTE PARA PROFISSIONAIS DE SAÚDE SOBRE A UTILIZAÇÃO SEGURA E ADEQUADA DE BRINAVESS
 INFORMAÇÃO IMPORTANTE PARA PROFISSIONAIS DE SAÚDE SOBRE A UTILIZAÇÃO SEGURA E ADEQUADA DE BRINAVESS (vernacalant) concentrado para solução para perfusão BRINAVESS está indicado para rápida conversão da
INFORMAÇÃO IMPORTANTE PARA PROFISSIONAIS DE SAÚDE SOBRE A UTILIZAÇÃO SEGURA E ADEQUADA DE BRINAVESS (vernacalant) concentrado para solução para perfusão BRINAVESS está indicado para rápida conversão da
cloridrato de betaxolol Medicamento Genérico, Lei nº 9.787, de 1999 Solução Oftálmica Estéril Cristália Prod. Quím. Farm. Ltda.
 cloridrato de betaxolol Medicamento Genérico, Lei nº 9.787, de 1999 Solução Oftálmica Estéril Cristália Prod. Quím. Farm. Ltda. MODELO DE BULA PARA O PACIENTE 1 IDENTIFICAÇÃO DO MEDICAMENTO cloridrato
cloridrato de betaxolol Medicamento Genérico, Lei nº 9.787, de 1999 Solução Oftálmica Estéril Cristália Prod. Quím. Farm. Ltda. MODELO DE BULA PARA O PACIENTE 1 IDENTIFICAÇÃO DO MEDICAMENTO cloridrato
Informe Técnico Sarampo nº 9 - ALERTA SARAMPO. Novos casos confirmados de sarampo (Genótipo D4), residentes no Estado de São Paulo.
 INFORME TÉCNICO Nº 9 (Outubro) ALERTA SARAMPO 2011 GOVERNO DO ESTADO DE SÃO PAULO SECRETARIA DE ESTADO DA SAÚDE COORDENADORIA DE CONTROLE DE DOENÇAS CENTRO DE VIGILÂNCIA EPIDEMIOLÓGICA PROF. ALEXANDRE
INFORME TÉCNICO Nº 9 (Outubro) ALERTA SARAMPO 2011 GOVERNO DO ESTADO DE SÃO PAULO SECRETARIA DE ESTADO DA SAÚDE COORDENADORIA DE CONTROLE DE DOENÇAS CENTRO DE VIGILÂNCIA EPIDEMIOLÓGICA PROF. ALEXANDRE
SISCOLO RELATÓRIO 2008. PRÁ-SABER DIGITAL: Informações de Interesse à Saúde SISCOLO Porto Alegre 2008
 1 SISCOLO RELATÓRIO 2008 2 Prefeitura Municipal de Porto Alegre Prefeito José Fogaça Secretaria Municipal da Saúde Secretário Eliseu Santos Coordenadoria Geral de Vigilância em Saúde Coordenador José Ângelo
1 SISCOLO RELATÓRIO 2008 2 Prefeitura Municipal de Porto Alegre Prefeito José Fogaça Secretaria Municipal da Saúde Secretário Eliseu Santos Coordenadoria Geral de Vigilância em Saúde Coordenador José Ângelo
Bula com informações ao Paciente soro antibotrópico (pentavalente) e antilaquético. solução injetável IDENTIFICAÇÃO DO MEDICAMENTO
 soro antibotrópico (pentavalente) e antilaquético solução injetável IDENTIFICAÇÃO DO MEDICAMENTO soro antibotrópico (pentavalente) e antilaquético APRESENTAÇÃO O soro antibotrópico (pentavalente) e antilaquético,
soro antibotrópico (pentavalente) e antilaquético solução injetável IDENTIFICAÇÃO DO MEDICAMENTO soro antibotrópico (pentavalente) e antilaquético APRESENTAÇÃO O soro antibotrópico (pentavalente) e antilaquético,
Edison Natal Fedrizzi. Declaração de conflito de interesse
 Edison Natal Fedrizzi Declaração de conflito de interesse Não recebi qualquer forma de pagamento ou auxílio financeiro de entidade pública ou privada para pesquisa ou desenvolvimento de método diagnóstico
Edison Natal Fedrizzi Declaração de conflito de interesse Não recebi qualquer forma de pagamento ou auxílio financeiro de entidade pública ou privada para pesquisa ou desenvolvimento de método diagnóstico
Tema: Boceprevir para tratamento da hepatite viral crônica C associada a cirrose hepática
 Data: 15/10/2012 Nota Técnica 02/2012 Solicitante: Dr. José Augusto Lourenço dos Santos Juiz de Direito da 2.ª Vara Cível de Timóteo/MG Medicamento x Material Procedimento Cobertura Tema: Boceprevir para
Data: 15/10/2012 Nota Técnica 02/2012 Solicitante: Dr. José Augusto Lourenço dos Santos Juiz de Direito da 2.ª Vara Cível de Timóteo/MG Medicamento x Material Procedimento Cobertura Tema: Boceprevir para
PROPILRACIL propiltiouracila
 PROPILRACIL propiltiouracila Comprimido 100 mg MODELO DE BULA PARA O PROFISSIONAL DA SAÚDE MODELO DE BULA RDC 47/2009 I - IDENTIFICAÇÃO DO MEDICAMENTO: Nome comercial: Propilracil Nome genérico: propiltiouracila
PROPILRACIL propiltiouracila Comprimido 100 mg MODELO DE BULA PARA O PROFISSIONAL DA SAÚDE MODELO DE BULA RDC 47/2009 I - IDENTIFICAÇÃO DO MEDICAMENTO: Nome comercial: Propilracil Nome genérico: propiltiouracila
www.printo.it/pediatric-rheumatology/br/intro
 www.printo.it/pediatric-rheumatology/br/intro Artrite de lyme Versão de 2016 1. O QUE É ARTRITE DE LYME 1.1 O que é? A artrite de Lyme é uma das doenças causadas pela bactéria Borrelia burgdorferi (borreliose
www.printo.it/pediatric-rheumatology/br/intro Artrite de lyme Versão de 2016 1. O QUE É ARTRITE DE LYME 1.1 O que é? A artrite de Lyme é uma das doenças causadas pela bactéria Borrelia burgdorferi (borreliose
Vacina pneumocócica, polivalente, MSD
 FORMA FARMACÊUTICA E APRESENTAÇÃO Vacina pneumocócica, polivalente, MSD A vacina pneumocócica, polivalente, MSD é apresentada em frascos de dose única (0,5 ml). USO PEDIÁTRICO E ADULTO COMPOSIÇÃO Cada
FORMA FARMACÊUTICA E APRESENTAÇÃO Vacina pneumocócica, polivalente, MSD A vacina pneumocócica, polivalente, MSD é apresentada em frascos de dose única (0,5 ml). USO PEDIÁTRICO E ADULTO COMPOSIÇÃO Cada
