UNIVERSIDADE TUITUTI DO PARANÁ FACULDADE DE CIÊNCIAS BIOLÓGICAS E DA SAÚDE CURSO DE MEDICINA VETERINÁRIA TRABALHO DE CONCLUSÃO DE CURSO
|
|
|
- Lorenzo Brás Fontes
- 8 Há anos
- Visualizações:
Transcrição
1 1 UNIVERSIDADE TUITUTI DO PARANÁ FACULDADE DE CIÊNCIAS BIOLÓGICAS E DA SAÚDE CURSO DE MEDICINA VETERINÁRIA TRABALHO DE CONCLUSÃO DE CURSO CURITIBA 2010
2 2 GEÍSA DO AMARAL DO MAINARDES TRABALHO DE CONCLUSÃO DE CURSO ASPIRAÇÃO FOLICULAR, PRODUÇÃO IN VITRO E MANIPULAÇÃO DE EMBRIÕES BOVINOS. CURITIBA 2010
3 3 GEÍSA DO AMARAL MAINARDES TRABALHO DE CONCLUSÃO DE CURSO ASPIRAÇÃO FOLICULAR, PRODUÇÃO IN VITRO E MANIPULAÇÃO DE EMBRIÕES BOVINOS. Trabalho de conclusão de curso apresentado ao curso de Medicina Veterinária da Faculdade de Ciências Biológicas e da Saúde da Universidade Tuiuti do Paraná, como requisito parcial para a obtenção do titulo de Medica Veterinária. Orientadora Acadêmica: Professora Msc Beatriz Calderari Vianna Orientador Profissional: Eduardo Benedetti CURITIBA 2010
4 4 Reitor Prof. Luis Guilherme Rangel Santos Pró- Reitor Admisnistrativo Sr. Carlos Eduardo Rangel Santos Pró-Reitora Acadêmica Profª Carmen Luiza da Silva Pró-Reitor de Planejamento e Avaliação Sr. Afonso Celso Rangel dos Santos Pró-Reitoria de Pós Graduação, Pesquisa e Extensão Prof. Roberval Eloy Pereira Secretário Geral Sr. Bruno Carneiro da Cunha Diniz Diretor da Faculdade de Ciências Biológicas e da Saúde Prof. João Henrique Faryniuk Coordenadora do Curso de Medicina Veterinária Profª Dra. Ana Laura Angelli Metodologia Científica Prof. Jair Mendes Marques Coordenação de Estágio Obrigatório do Curso de Medicina Veterinária Profª Elza Maria Galvão Ciffoni e profª Ana Laura Angelli CAMPUS PROF. SIDNEY LIMA SANTOS (BARIGÜI) Rua Sidney A Rangel dos Santos 238 Bairro: Santo Inácio CEP Curitiba Paraná Telefone: (41)
5 5 TERMO DE APROVAÇÃO GEÍSA DO AMARAL MAINARDES TRABALHO DE CONCLUSÃO DE CURSO Este trabalho de Conclusão de Curso foi julgado e aprovado como requisito parcial para a obtenção do título de Médica Veterinária pela banca examinadora do curso de Medicina Veterinária da Universidade Tuiuti do Paraná. Curitiba, 16 de junho de Orientadora Professora Msc Beatriz Calderari Vianna Professor Msc Marcelo Arne Feckinghaus Professor Msc Uriel Andrade
6 6 DEDICATÓRIA Dedico esse trabalho aos meus pais Aidil e Nelci, que me deram a oportunidade de realizar este sonho, aos meus amigos, e a todas as pessoas que torceram e me apoiaram ao longo desta jornada. AGRADECIMENTOS
7 7 Agradeço primeiramente a Deus por ter iluminado meu caminho e ter me dado força para chegar até aqui. Agradeço ao meu pai Nelci Mainardes que apesar de todas as dificuldades financeiras, de todas as reviravoltas da vida, acreditou em mim e me deu a oportunidade de realizar este grande sonho. Quero agradecer todos os professores pela paciência, pela dedicação, pelo aprendizado e pelas oportunidades que nos dão. A minha Orientadora Professora Msc Beatriz Calderari Vianna pela boa vontade, pela crença na minha pessoa, pela amizade e pela força. Todos os profissionais veterinários que me deram a oportunidade de exercer a prática através do estágio, sendo às vezes verdadeiros pais, disponibilizando seu tempo, paciência e principalmente me proporcionando conhecimento. Em especial a bióloga Érika Junqueira da Fonseca que me ajudou muito na realização do estágio obrigatório, tendo paciência, compreensão e tornandose uma amiga muito especial. Torço muito por você e obrigada. As minhas amigas Giovanna, Tatiane, Viviane, Ângela, Maria do Céu e Clarice pelas risadas, momentos de distrações, por estarem ao meu lado nos momentos mais difíceis e mais felizes de minha vida. Agradeço a todos que me ajudaram diretamente e indiretamente a realizar este trabalho e contribuíram de alguma forma para esta conquista. APRESENTAÇÃO
8 8 Este trabalho de Conclusão de Curso (TCC) foi apresentado ao Curso de Medicina Veterinária da Faculdade de Ciências Biológicas e da Saúde da Universidade Tuiuti do Paraná, como requisito parcial para obtenção do título de Médico Veterinário, no qual são descritas as atividades realizadas por Geísa do Amaral Mainardes, na área de Biotecnologia da Reprodução Animal, durante o período de 2 de março a 20 de maio de 2010, totalizando 360 horas de estágio Curricular Obrigatório. O estágio obteve orientação acadêmica da Professora Msc Beatriz Calderari Vianna e orientação profissional do Médico Veterinário Eduardo Ramos Benedetti, graduado na universidade de Franca - São Paulo e da bióloga Érika Junqueira da Fonseca. Este trabalho foi realizado na empresa Sexing Technologies do Brasil, localizada em Sertãozinho, São Paulo e consiste no acompanhamento das aspirações foliculares a campo e nas diversas etapas laboratoriais da Produção In Vitro de Embriões na espécie Bovina. RESUMO
9 9 O presente trabalho tem o objetivo de relatar as atividades desenvolvidas durante o período de estágio e comparar com o que é encontrado na literatura atual. As atividades foram desenvolvidas na área de Biotecnologia da Reprodução Animal, focando em Produção in vitro de embriões, abordando os aspectos teóricos relativos ao tema, como a rotina laboratorial, passando desde a maturação in vitro, fertilização in vitro e o cultivo embrionário. Os resultados encontrados foram similares aos que encontrados na literatura, concluindo-se a necessidade de estudos mais aprofundados para desenvolver protocolos ideais de fertilização in vitro, obtendo-se maior estabilidade de produção, melhorando as taxas de blastocisto e as taxas de clivagens obtidas. Palavras-chave: Aspiração folicular, embrião, FIV, In vitro ABSTRACT
10 10 The present task has the objective of relating the developed activities during the probation period and comparing with the literature of the present days. The activities were developed in the area of Animal Reproduction Biotechnology, focusing in embryo production in vitro, approaching the theoretical aspects related to the theme, such as laboratory routine, going since the maturation in vitro, fertilization in vitro and the embrionary culture. The results found were similar to the ones found in the literature, getting to the conclusion that more studies are needed to develop ideal protocols on in vitro fertilization, obtaining bigger production stability, with better blastocysts and division taxes. Key-words: Follicular Aspiration, embryo, FIV, In vitro LISTA DE ABREVIATURAS
11 11 Bi: blastocisto inicial Bl: blastocisto Bx: blastocisto expandido BN: blastocisto em eclosão CCOs: complexo cumulus oócito CIV: cultivo in vitro CL: corpo lúteo D0: dia zero (inicio do protocolo) D4: 4 a dia do protocolo D5: 5 o dia do protocolo D6: 6 o dia do protocolo D8: 8 O dia do protocolo FIV: fertilização in vitro FSH: follicle stimulating hormone (hormônio folículo estimulante) GnRH: gonadotrophin releasing hormone (hormônio liberador de gonadotrofina) IA: inseminação artificial LH: luteinizing hormone (hormônio luteinizante) LOS: Large Offspring Síndrome (Síndrome da Cria Gigante) MIV: maturação in vitro OPU: ovum pick up, (aspiração folicular guiada por ultra-som) P 4: progesterona PGF 2 α: prostaglandina F 2 α PIV: produção in vitro SFB: soro fetal bovino
12 12 SPTZ: espermatozóide SOF CO 2 : fluído sintético do oviduto: meio de cultivo feito em estufa de CO 2 SOF O 2 : meio de cultivo feito em estufa de O 2 SOV: superovulação TALP: meio de fertilização com tyrodes, albumina, lactato e piruvato TE: transferência de embriões µl: microlitro LISTA DE GRÁFICOS
13 13 GRÁFICO 1: Atividades Desenvolvidas no Estágio Obrigatório...21
14 14 LISTA DE FIGURAS Figura 1: Entrada da empresa Figura 2: Placas de Maturação Figura 3: Geladeira e Freezer com os meios previamente prontos Figura 4: Estufa de CO 2 contendo os meios e placas estabilizando Figura 5: Escritório do Laboratório Figura 6: Sala de Aspiração Folicular Figura 7: Sala de Lavagem e Esterilização de Materiais Figura 8: Sala de Meios Figura 9: Sala de Cultivo Figura 10: Sala de Cultivo Figura 11: Sala de Manipulação de Sêmen Figura 12: Sala de Manipulação de Sêmen Figura 13: Incubadora Utilizada para o Transporte de Criotubos Contendo Oócitos da Fazenda até o Laboratório Figura 14: Material Utilizado a Campo para a Aspiração dos Ovários 52 Figura 15: Aspiração de Ovários de Matadouro Figura 16: Oócitos Maturados após 24 horas na Estufa de CO Figura 17: Colocação dos espermatozóides nas gotas de FIV Figura 18: Oócitos Devidamente Maturados em Contato com os Sptz Figura 19: Exame de Motilidade Realizado no Microscópio Figura 20: Lâminas e Câmaras de NeuBauer Prontas para a Avaliação Figura 21: Oócitos após 22 horas da Fertilização Figura 22: Observação da Clivagem dos Zigotos Figura 23: Observação e Classificação dos Embriões antes do Envase Figura 24: Envase dos Embriões... 81
15 15 SUMÁRIO 1 1 INTRODUÇÃO DESCRIÇÃO DO LOCAL DE 1 ESTÁGIO DESCRIÇÃO DAS ATIVIDADES 2 DESENVOLVIDAS DINÂMICA FOLICULAR E PROTOCOLOS DE MANIPULAÇÃO CICLO ESTRAL DE 2 BOVINOS Revisão da Literatura Seleção de Reprodutoras a Serem Utilizadas Foliculogênese, Puberdade e Ciclo Reprodutivo Hormônios Envolvidos no Ciclo Estral Protocolos de Manipulação do Ciclo Estral Descrição do Protocolo Observado Durante o Estágio Discussão Conclusão... 5 PRODUÇÃO DE MEIOS DE CULTIVO UTILIZADOS NA PRODUÇÃO DE EMBRIÕES (PIV) Revisão de Literatura Descrição dos Procedimentos observados no estágio Discussão Conclusão... 6 DESCRIÇÃO DOS PROCEDIMENTOS REALIZADOS DURANTE O ESTÁGIO OBRIGATÓRIO Infra- estrutura do Laboratório ASPIRAÇÃO FOLICULAR DE OVÁRIOS A CAMPO E SELEÇÃO DE OVÓCITOS PARA FIV Revisão Bibliográfica Seleção de Ovócitos
16 Descrição do Procedimento Observado Durante o Estágio Discussão Conclusão... 8 ASPIRAÇÃO FOLICULAR DE OVÁRIOS ORIUNDOS DE MATADOURO E SELEÇAO DE OVÓCITOS PARA FIV Revisão Bibliográfica Descrição do Procedimento Realizado no Estágio Métodos Utilizados na Classificação dos Oócitos Durante o Estágio Discussão Conclusão MATURAÇÃO IN VITRO DE 5 OVÓCITOS Revisão Bibliográfica Descrições dos Procedimentos Observados no Estágio Produção de 6 Tapete Discussão Conclusão PRODUÇÃO IN VITRO DE EMBRIÕES 6 (PIV) FERTILIZAÇÃO IN 6 VITRO Revisão Bibliográfica Descrição dos Procedimentos Realizados Durante o Estágio Motilidade Espermática Concentração Espermática Discussão Conclusão CULTIVO E MANIPULAÇÃO DE EMBRIÕES OBTIDOS POR MEIO
17 17 DE 6 FIV Revisão Bibliográfica Descrição dos Procedimentos Realizados Durante o Estágio Envase de Embriões Obtidos por Meio de FIV Realizados Durante o Período de Estágio Discussão Conclusão CONCLUSÕES REFERÊNCIAS INTRODUÇÃO
18 18 Devido ao grande crescimento na produtividade pecuária houve a necessidade do desenvolvimento de biotecnologias aplicadas à reprodução, principalmente na espécie bovina, que possui um longo intervalo entre partos e um baixo número de descendentes. (VARAGO, 2008). Sendo o Brasil o país de maior biodiversidade e o terceiro maior produtor de leite e carne no mundo, os investimentos em recursos genéticos constituem um dos maiores promissores segmentos da economia nacional. Desta maneira, incentivando a resposta aos investimentos, superando os índices zootécnicos, acelerando os melhoramentos genéticos dos rebanhos e aumentando a produção de bezerros/vaca/ano. (RUMPF, 2007). Como explicado por Gonçalves (2008), inicialmente a inseminação artificial teve papel importante na disseminação de material genético. Posteriormente técnicas como o controle do ciclo estral, superovulação (SOV) e a transferência de embriões (TE) possibilitaram um aumento na multiplicação do material genético oriundos de fêmeas. Em um segundo momento, a ultra-sonografia somou-se as técnicas já existentes para melhorar a qualidade e a quantidade do produto final, sendo um importante recurso para a monitoração da atividade ovariana. Com o aperfeiçoamento da técnica de aspiração folicular (OPU) em vacas vivas, no final da década de 90, foi possível produzir embriões em laboratórios especializados, permitindo o uso de animais gestantes, jovens e com problemas de infertilidade adquiridos.
19 19 O presente trabalho consiste na explicação dos diferentes meios de produzir embriões artificialmente, descrevendo os processos de maturação de oócitos, fertilização e cultivo in vitro de embriões bovinos.
20 20 2 DESCRIÇÃO DO LOCAL DE ESTÁGIO O estágio obrigatório foi realizado na Sexing Technologies do Brasil, empresa parceira da CRV Lagoa, que exerce a atividade de central de sêmen, ou de reprodução, existente há 40 anos e uma das maiores líderes no mercado mundial de genética bovina. Sua localização é na cidade de Sertãozinho, São Paulo, a 30 km de Ribeirão Preto, presente numa área de 40 hectares e possuindo cerca de 130 reprodutores bovinos em regime permanente de coleta de sêmen. A CRV Lagoa é a maior central de genética bovina da América Latina, existente desde 1971 e comercializando cerca de dois milhões de doses de sêmen por ano. Conta com sêmen de touros nacionais e importados, além de comercializar sêmen convencional e sexado de diversas raças bovinas (figura1). FIGURA 1: ENTRADA DA EMPRESA
21 21 3 DESCRIÇÃO DAS ATIVIDADES DESENVOLVIDAS NO PERÍODO DE ESTÁGIO CURRICULAR OBRIGATÓRIO. Este trabalho tem a finalidade de descrever os procedimentos realizados no estágio Curricular Obrigatório, realizado na Sexing Technologies do Brasil, localizada em Sertãozinho-SP, com endereço na Rodovia BR Carlos Tonani, km 88. As atividades foram desenvolvidas no período de 02 de março a 20 de maio de 2010, totalizando uma carga horária de 360 horas. Durante o período de estágio as principais atividades acompanhadas foram desenvolvidas na área de biotecnologia da reprodução animal, abrangendo desde a área de campo até o segmento laboratorial: sincronização do estro de reprodutoras, palpações retais, aspirações foliculares, além de maturação de ovócitos, Fertilização in vitro (FIV), cultivo e envase de embriões, realização de atividades de aspiração folicular em ovários de abatedouro, produção in vitro de embriões, acompanhamento de preparo de meios para a técnica de FIV e esterilização de materiais, os quais fazem parte da rotina laboratorial. O uso de edificações apropriadas facilita o trabalho e é crucial para atingir uma boa produção de embriões com as condições sanitárias adequadas.
22 22 As atividades acompanhadas durante o período de estágio obrigatório são mostradas no gráfico 1. GRAFICO 1 : ATIVIDADES DESENVOLVIDAS NO ESTÁGIO OBRIGATÓRIO
23 23 4 DINÂMICA FOLICULAR E PROTOCOLOS DE MANIPULAÇÃO DO CICLO ESTRAL DE BOVINOS 4.1 REVISÃO DE LITERATURA Seleção de Reprodutoras a serem utilizadas em programas de reprodução De acordo com o Manual Internacional de Transferência de Embriões, 2008, as fêmeas submetidas às biotecnologias devem ser examinadas quanto à saúde e a integridade reprodutiva. Deve-se usar doadoras geneticamente superiores, livre de doenças congênitas, com um bom controle sanitário e encontradas em um balanço energético positivo. As receptoras necessitam estar ciclando regularmente, com um bom escore corporal e potencial de fertilidade, possuir habilidade materna com um temperamento favorável e livre de condições estressantes. (HAFEZ, 2004) 4.2 FOLICULOGÊNESE, PUBERDADE E CICLO REPRODUTIVO O folículo é uma unidade morfofuncional do ovário, constituída por oócitos circundados por células somáticas da granulosa e da teca. A função destes folículos é proporcionar o ambiente ideal para viabilidade, crescimento e maturação oocitaria (GRUNERT et al, 1984). A foliculogênese refere-se ao crescimento desses folículos e envolve uma série de mudanças em componentes da parede folicular como células da teca, granulosa e ovócito. Esta se dá simultaneamente a oôgenese, sendo
24 24 procedente e concluída com a ovulação do oócito e posterior fecundação (GONÇALVES et al, 2008). De acordo com o mesmo autor, a população folicular dos ovários é bastante heterogênea, sendo formada de acordo com o grau de evolução. Os folículos são classificados em folículos pré- antrais e antrais, sendo os folículos pré-antrais representantes de cerca de 90-95% de toda a população folicular; são diferenciados de acordo com o número de camadas de células da granulosa que circundam o oócito imaturo e são constituídos de folículos primordiais, intermediários, primários e secundários. Os folículos primordiais são os primeiros a serem formados, sendo os menores encontrados no ovário e circundados por uma camada de células da pré-granulosa de formato epitelial pavimentoso. De acordo com o crescimento, estes folículos sofrem ativação, ocorrendo multiplicação das células da granulosa e transformação morfológica em células de formato epitelial pavimentoso para formato epitelial cúbico. Quando encontram-se folículos que possuem oócitos circundados pelos dois formatos, tanto cúbico como pavimentoso, são classificados como intermediários (Gonçalves et. al, 2008). Os folículos primordiais, primários e secundários aparecem no ovário fetal com 90, 140 e 210 dias de gestação respectivamente (RUSSE, 1983). Sua ativação é caracterizada pela aquisição de uma camada completa de células cubóides da granulosa ao redor do oócito, formando o folículo primário. Já o folículo secundário, é caracterizado pela segunda camada de células da granulosa de forma cúbica, pela deposição do material genético na zona pelúcida e pela formação de grânulos corticais no citoplasma do ovócito (FAIR et al, 1997).
25 25 Na transição para folículos terciários, também chamados de antrais, ocorrem determinadas modificações como o desenvolvimento da teca interna e externa e a formação da cavidade antral, repleta de fluido (DRIANCOURT, 1991). O ovário, antes do nascimento, já tem definido os vários folículos presentes em todas as fêmeas, porém estes números vão reduzindo de acordo com a vida reprodutiva. Estima-se que o número de folículos na vaca antes do nascimento seja de , reduzindo na fase adulta para e chegando a em vacas já consideradas velhas (ALBUQUERQUE et al, 2004). O crescimento e desenvolvimento destes folículos ocorrem sincronicamente, em determinados períodos do ciclo estral, devido às ondas de crescimento folicular, sendo cada onda precedida de um pico de hormônio folículo estimulante (FSH). As ondas estão presentes em fêmeas com duas semanas de idade (EVANS et al, 1994), e o crescimento no diâmetro destes folículos ocorre da 2 a a 14 a semana de idade. Embora o crescimento destes seja efetivado pela secreção de gonadotrofinas, este é suprimido até a puberdade e inicio da vida reprodutiva da fêmea (RAWLINGS et al, 2003). O ciclo reprodutivo é influenciado por diversos fatores, entre eles, fatores hormonais, ambientais, genéticos, fisiológicos, comportamentais e psicossociais. Além de estarem relacionados com a puberdade, maturidade sexual, envelhecimento e atividade sexual pós-parto (HAFEZ, 2004; NOGUEIRA, 2004.) A secreção de gonadotrofinas inicia-se durante a vida fetal. Nos bovinos ela começa logo após a diferenciação sexual, entre o primeiro e o
26 26 segundo mês de gestação. Esta secreção regride temporariamente, permanecendo baixa até o início da puberdade (HAFEZ, 2004). A puberdade é o momento em que os órgãos reprodutivos iniciam sua função, atingida quando o animal se torna capaz de liberar gametas e manifestar sinais de comportamento sexual. É o resultado de um ajuste gradativo entre o aumento da atividade gonadotrófica e a habilidade das gônadas em assumir simultaneamente a esteroidogênese e a gametogênese (HAFEZ, 2004). A idade do aparecimento da puberdade é influenciada por diversos fatores. Entre eles está intimamente relacionada à nutrição e o crescimento logo após o desmame, o meio ambiente, a idade e a raça (FONSECA, 1996; PINEDA, 1996). Em termos médios estima-se que a puberdade ocorra no gado leiteiro quando se atinge 30-40% do peso adulto animal e no gado de corte quando se atinge 40-45% do peso adulto do animal, apresentando uma variação de até 12 meses em raças zebuínas, consideradas mais tardias (GRUNERT et al, 1984). Passada a puberdade é iniciada a vida sexual e o ciclo estral, que compreende o ritmo funcional dos órgãos reprodutivos, caracterizada por desenvolvimento do trato genital e características sexuais secundárias (HAFEZ, 2004). Segundo Grunert et al (1984), o ciclo estral de bovinos possui uma periodicidade de 21 dias e é constituído por 2 fases distintas: a fase folicular e a fase luteínica, que são limitadas e reguladas por mecanismos endócrinos e neuroendócrinos.
27 27 A fase folicular é caracterizada pelo crescimento e desenvolvimento do folículo até a sua a ovulação. Seu principal hormônio é o estrógeno e ela pode ser subdividida em duas fases distintas: - Pró-estro Possui duração de três dias e é a fase que antecede o cio, ocorrendo o inicio do desenvolvimento folicular. É caracterizada por aumento gradativo da vascularização e tônus muscular na região genital, proliferação do epitélio vaginal, edemaciação da vulva e relaxamento da cérvix. - Estro - É a fase em que ocorre a aceitação do macho, devido aos altos níveis de estrógeno. Possui duração variável de acordo com a raça, tendo uma média de 18 horas. (GRUNERT et al, 1984). É caracterizado pela presença de muco, intensa hiperemia de mucosas e o canal cervical encontrase aberto. As alterações comportamentais são facilmente visíveis; o animal apresenta-se inquieto, com uma lordose típica, monta em outros animais, diminui a ingestão de alimentos, há menor produção leiteira e aumento da micção e fonação. Após o término do cio inicia-se a fase luiteínica, a qual é responsável pelo desenvolvimento do corpo lúteo e pelas altas concentrações de progesterona. Também é subdividida em duas fases: - Metaestro Onde há poucas manifestações psíquicas, porém compreende a fase em que ocorre a ovulação e inicio da formação do corpo lúteo. Sua duração é em média 3-5 dias e a ovulação ocorre de horas após o inicio do cio. (HAFEZ et al, 2004). - Diestro Fase de repouso sexual, de maior duração (14 dias) e predomínio da progesterona. Observa-se maturidade completa do corpo lúteo
28 28 (CL) e, ao final, não havendo prenhês, há liberação de prostaglandina F2α, para devida lise do CL e o reinício de um novo ciclo (GRUNERT et al, 1984). 4.3 HORMÔNIOS ENVOLVIDOS NO CICLO ESTRAL Como citado anteriormente, o ciclo estral é regulado por hormônios que constituem substâncias químicas de natureza diversa, produzidos por um grupo de células. Estes que agem provocando alterações morfológicas e fisiológicas em um tecido ou órgão alvo (SOUZA, 2007). Hormônios do hipotálamo, hipófise, ovário e útero controlam as mudanças no trato genital e comportamento sexual através de diversas interações (GRUNERT et al, 1984). Entre os principais, está o GnRh denominado hormônio liberador de gonadotrofinas. É secretado pelo hipotálamo, agindo na hipófise e promovendo a liberação de FSH (hormônio folículo estimulante) e LH (hormônio luteinizante) (GRUNERT et al, 1984). A hipófise ou pituitária esta situada na base do cérebro e dividida em dois lóbulos, o lóbulo anterior (adeno- hipófise) e o lóbulo posterior, (neurohipófise). A pituitária é responsável pela secreção e armazenamento de hormônios gonadotrópicos (GRUNERT et al, 1984). A hipófise anterior produz o FSH, que atua na estimulação e desenvolvimento folicular com hiperplasia das células da teca e da granulosa do ovário. Chega aos ovários através da corrente sanguínea e sua ação baseia-se no estímulo e desenvolvimento dos folículos, fazendo com que cresçam e ovulem, ou degenerem. (FERNANDES, 1999).
29 29 O estrógeno é produzido pelos folículos dominantes, no ovário. Sua função consiste em estimular a manifestação do cio, promover aceitação ao macho, determinar as características sexuais secundárias e estimular a libido. Também produzido na hipófise anterior o LH atua nos ovários, estimula a ovulação e promove a maturação e formação do corpo lúteo, o qual produzirá, por sua vez, progesterona (P 4) (FERNANDES, 1999; GONÇALVES et al, 2008; HAFEZ, 2004). A progesterona atua bloqueando a ação de GnRh, impedindo desta maneira a liberação de FSH e LH, o retorno ao cio, mantendo a gestação. O pico da P 4 é atingido por volta de 5 a 7 dias após a formação do CL (FERNANDES, 1999). Na etapa final do seu desenvolvimento, os folículos dominantes secretam inibina, que via sistêmica tem a função de bloquear a síntese de FSH na hipófise, fazendo desta maneira, o feed back negativo para a liberação de FSH. Com isso há estímulo na secreção de LH, que atuará no folículo, promovendo a sua maturação final e induzindo a ovulação. As células remanescentes dos folículos que ovularam sofrem a luteinização, formando o corpo lúteo, que produz progesterona (FERNANDES, 1999). Considerando não haver gestação, o CL após dias inicia a produção de ocitocina, que é secretada pela neuro-hipófise. Esta atuará no endométrio produzindo prostaglandina (PGF2α), responsável pela luteólise, fazendo assim, a regressão do corpo lúteo e reiniciando o ciclo (FERNANDES, 1999). Se houver gestação, o próprio feto produz substâncias que inibem a produção de PGF2α (FERNANDES, 1999).
30 PROTOCOLOS DE MANIPULAÇÃO DO CICLO ESTRAL As características desejáveis para os diferentes protocolos de sincronização do ciclo estral são a alta taxa de resposta ao tratamento hormonal, independente do estágio do ciclo em que o tratamento tenha início, melhorar as taxas de prenhez e tornar o manejo reprodutivo mais eficiente. (BALDE BRANCO, 2010) De acordo com SENEDA et al (2006), devido ao acréscimo na demanda e a crescente necessidade de melhorar a eficiência da técnica de aspiração folicular têm-se utilizado protocolos de pré-aspiração. O principal objetivo da utilização de protocolos na FIV é estimular o crescimento de diversos folículos, sem haver dominância e ovulação. Com isso o término dos protocolos acontece antecipadamente aos protocolos utilizados em outras biotecnologias. 4.5 Descrição do protocolo Observado no Período de Estágio Obrigatório No estágio obrigatório o protocolo foi realizado com a colocação de um implante de P 4 na região auricular e simultaneamente aplicação de 2 ml de Benzoato de Estradiol com mais 2 ml de P 4. Após 5 dias o implante é retirado e a palpação retal é realizada para observação da resposta ao protocolo. Se houver resposta, como a presença de diversos folículos, sem apresentar dominância, a aspiração é iniciada. Se houver dominância alguns minutos antes é aplicado PGF2α.
31 Discussão Entre os diversos protocolos existentes na prática, este observado durante o estágio é o que melhor obteve resposta e o que atendeu os requisitos necessários para a aspiração folicular, sem dominância de um folículo, pois de acordo com Hendriksen et al ( 2004), a presença do folículo dominante diminui significativamente a competência dos oócitos inclusos em folículos subordinados, além de interferir no número de folículos visualizados. 4.7 Conclusão O protocolo utilizado depende de cada médico veterinário, de acordo com a resposta observada, porém a resposta varia de animal para animal, da dieta em que esses animais são expostos e de acordo com a sanidade e o manejo do rebanho. Vários grupos de pesquisa concluíram que o melhor momento para a aspiração dos folículos é no inicio do crescimento da onda folicular, considerando a qualidade dos oócitos e o desenvolvimento embrionário, desta maneira os protocolos são feitos baseados nos melhores resultados obtidos através das diversas pesquisas.
32 32 5 PRODUÇÕES DE MEIOS DE CULTIVO UTILIZADOS NA PRODUÇÃO DE EMBRIÕES (PIV) 5.1- REVISÃO DE LITERATURA O sistema de meios utilizados na PIV são classificados como definidos, que consistem aqueles desprovidos de qualquer material biológico ou soro, semidefinidos e indefinidos, cuja composição inclui alguma substância de origem biológica (GORDON, 1994). Há também a classificação dos meios seqüenciais e não seqüenciais, sendo este critério adotado nos últimos anos, de acordo com as necessidades nutricionais requeridas pelos embriões no decorrer de seu desenvolvimento (GARDNER & LANE, 1998). Desta maneira, os meios não seqüenciais, ou estáticos são aqueles que não se efetuam modificações durante todo o período de cultivo e os seqüenciais são os que as modificações vão sendo efetuadas de acordo a adição de substâncias ou troca dos meios (GARDNER, 1998; COOKE et al, 2002; LANE et al, 2003). Todos os meios e seus suplementos, incluindo soros, enzimas e crioprotetores, devem estar livres de patógenos e contaminantes. Os meios adquiridos prontos devem ser de fontes confiáveis e o soro deve ser aprovado especificamente pelo país importador, pois pode propiciar riscos e contaminações (STRINGFELLOW et al, 1998). Devem ser adicionados antibióticos de amplo espectro aos meios e soluções para que possam atuar como bloqueio contra patógenos, fungos e microorganismos contaminantes que eventualmente possam ser encontrados. Observando o benefício, o antibiótico a ser utilizado deve suprir os contaminantes microbianos durante todo o tempo de cultura e ao mesmo
33 33 tempo não interferir no crescimento metabólico celular; também deve manter estável o ph e a osmolaridade, além de não serem tóxicos aos embriões (STRINGFELLOW et al, 1998). A tripsina também é usada como forma de remoção ou inativação de determinados vírus, como por exemplo, o vírus da Rinotraqueíte Bovina. O uso desta é prática comum para reduzir a aderência de célula-célula ou da célula ao substrato. O contato da tripsina com os embriões deve ser de no máximo um minuto, sendo desativada com o soro fetal bovino (STRINGFELLOW et al, 1998). Vários meios biológicos têm sido utilizados para a manipulação de embriões. Todos eles requerem preparação com antecedência suficiente, devendo ter uma atmosfera adequada, na temperatura ideal para que não ocorram mudanças no ph e alterações desnecessárias. O ph das soluções é de grande importância para a ocorrência das reações bioquímicas, devendo variar de 7,3 a 7,8 desde a maturação do oócitos até o cultivo embrionário. O uso de sistemas de tampões nos meios é essencial para minimizar possíveis flutuações que possam comprometer os procedimentos, devendo ter características como máxima solubilidade em água, dificuldade de atravessar a membrana celular, não possuir composição biológica, baixa toxidade e não inibir reações bioquímicas (GONÇALVES et al, 2008). A água, como citado anteriormente, deve ser desprovida de íons e impurezas. Para que possa ser utilizada tanto para a produção de meios como para a esterilização dos materiais (GONÇALVES et al, 2008).
34 34 No processo de maturação a maioria dos laboratórios utiliza o meio Tissue Culture Médium (TCM 199 ) que consiste num meio base modificado sendo geralmente adicionado de piruvato, lactato, aminoácidos, hormônios (FSH e LH), bicarbonato de sódio, vitaminas e outras substâncias geralmente encontradas no soro sanguíneo. (GORDON, 1994; GONSALVES et al, 2002 ; MINGOTI, 2005; GONSALVES et al, 2007). Este processo deve variar de horas e ser mantido em 5% de CO 2 com ar e umidade saturados, à temperatura de 39 ºC. A função dos aminoácidos é a ação reguladora de ph, participação da síntese protéica e ação como substratos energéticos. Já as vitaminas têm sido consideradas importantes para a obtenção de elevados índices de desenvolvimento, sendo fundamentais para o crescimento e expansão de blastocistos (GONÇALVES et al, 2008). O meio base do processo de fertilização in vitro mais utilizado nos laboratórios é a formulação Tyrode-albumina-lactato-piruvato (TALP), sendo o ph ótimo para a fecundação de 7,8 (GORDON, 1994), e o tempo necessário para a co-incubação dos oócitos e espermatozóides variando de 6-24 horas de acordo com os protocolos utilizados em cada laboratório (GARCIA et al, 2005 ; MINGOTI, 2005). No cultivo embrionário, alguns estudos demonstram a utilização dos meios de cultura definidos, adicionando álcool polivinílico (PVA) em substituição a albumina sérica bovina e ao soro fetal bovino, evitando a aderência dos embriões e as substâncias não conhecidas dessas fontes biológicas. (KIM et al, 1993 ; LIU & FOOT, 1995). Porém, foi constatado que meios totalmente definidos têm chance de sofrerem bloqueios embrionários e
35 35 redução da viabilidade em relação aqueles suplementados com a albumina e o soro fetal bovino (TAKAHASHI & FIRST, 1992; KESKINTEPE & BRAKETT, 1996). Deduziu-se desta forma, que para o desenvolvimento até o estagio de mórula e blastocisto os embriões necessitam de fatores adicionais exógenos existentes no soro fetal bovino para que ocorra a diferenciação e a proliferação celular (LIM et al, 1999). A utilização da albumina exerce um importante papel na nutrição do embrião em desenvolvimento, sendo especial após a compactação (LIM et al, 1999). Após diversos estudos os pesquisadores chegaram à conclusão que ainda não foi estabelecida outra fonte protéica capaz de substituir o soro fetal bovino ou a albumina sérica bovina no cultivo in vitro, pois após a utilização de aminoácidos obteve-se taxas aceitáveis de desenvolvimento, porém observouse que houve geração de amônia, tornando-se prejudicial ao embrião (MINGOTI, 2005). A maioria dos laboratórios têm feito o cultivo de embriões em meios semi-definidos, com poucas quantidades de soro e utilização de estufas contendo 5% de CO 2, 5% de O 2 e 90% de N 2, umidade saturada e temperatura de 38,8 ºC. Os meios utilizados para o cultivo podem ser o Hamster Ebryo Culture Médium (HECM), o TCM-199 ou o Sinthetic Oviductal Fluid (SOF) que apresentou melhor resultado até a fase de blastocisto (VARAGO et al, 2008). O cultivo estende-se de 7-9 dias após a fecundação in vitro, sendo neste período realizado a avaliação dos embriões quanto à taxa de eclosão e a qualidade embrionária para transferência ou criopreservação (GONÇALVES et al, 2008).
36 Descrição dos procedimentos observados no estágio A preparação dos meios e das placas no laboratório onde foi realizado o estágio obrigatório é feita com água purificada e desprovida de íons. São aferidos o ph e a osmolaridade dos mesmos, utilizando osmômetro do laboratório de Sexagem de Sêmen, levando uma pequena amostra para fazer a medição. Os meios B199 e o H199 são adquiridos comercialmente. As alíquotas necessárias dos meios de cultivo são feitas no laboratório, armazenadas em eppendorfes estéreis e congeladas (figura 3). Com exceção do soro fetal bovino, o qual é comprado inativado, sendo descongelado a 60ºC por 30 minutos, ativado e aliquotado, e a tripsina que somente é aliquotada no laboratório. Os meios finais são feitos adicionando-se todas as substâncias necessárias, homogeinizando-se no vórtex, filtrando em membrana de 0,22 µm e adicionando antibióticos. Após o preparo destes, são realizadas as devidas placas as quais são levadas a estufa necessária para calibração over nigth (durante o período da noite). Os meios finais preparados são os de lavagem, de maturação de oócitos, de fertilização e os meios de cultivo embrionário. Todos são feitos dentro do fluxo laminar, com materiais descartáveis, devidamente identificados. Os materiais necessários para a produção dos meios são: -Lavagem - É utilizado o meio H199, adicionado soro fetal bovino, e piruvato. A mistura deve ser feita e homogeneizada no vórtex e logo após sua filtragem é adicionado o antibiótico e levado para a estufa de CO 2, a qual é
37 37 fechada para atingir a temperatura ideal. Este meio é utilizado na lavagem dos oócitos a serem selecionados após a aspiração folicular. - Maturação Utiliza-se o meio B199, sendo misturado com piruvato, LH, FSH e soro fetal bovino. Após a mistura no vórtex é devidamente filtrado e adicionado estradiol e antibiótico. Terminado a produção do meio, são feitas as placas para a maturação dos ovócitos. As placas são de 60 mm, sendo feitas 4 gotas de 75 µl em suas extremidades, adicionados 10 ml de óleo mineral e novamente é colocado mais 75 µl de meio em cima das 4 gotas já feitas, totalizando 150 µl de meio, distribuído em 4 gotas submersas em óleo mineral (figura 2). Ao final do preparo, as placas e o restante de meio são transportados para a estufa de CO 2. FIGURA 2: PLACAS DE MATURAÇÃO
38 38 - Fertilização - É preparado com meio FIV, com albumina (FAF), que é pesada na balança de quatro dígitos, heparina, piruvato e PHE (penicilina, hipotaurina e epinefrina) responsável pela capacitação espermática, e após a filtragem é adicionado o antibiótico. Depois de feito o meio deve-se preparar as placas onde ocorrerá a fecundação. Essas placas são de 60 mm, feitas com o meio FIV recém produzido, onde são colocadas quatro gotas de 20 µl em suas extremidades, adicionando 10 ml de óleo e mais quatro gotas de 30 µl do meio em cima das gotas já distribuídas. Seguem para a estufa com 5% de CO 2. - Cultivo O 2 O meio de cultivo é o único feito e levado a estufa com controle de O 2, neste a albumina também é pesada, sendo adicionado o meio SOF, alanina e glicina. Após a filtragem é colocado antibiótico e feitas as placas. As placas devem ser feitas com 4 gotas de 75 µl, 10 ml de óleo mineral e acrescentados mais 75 µl de meio nas 4 gotas já preexistentes. -Cultivo SOF CO 2 7,5% - Também usado o SOF somado com soro fetal bovino, alanina e glicina. Filtrado e acrescentado antibiótico. As placas são feitas da mesma maneira, porém são conduzidas a estufa de CO 2 (figura 4).
39 39 FIGURA 3: GELADEIRA E FREEZER COM OS MEIOS PREVIAMENTE PRONTOS FIGURA 4: ESTUFA DE CO 2 CONTENDO OS MEIOS E AS PLACAS SENDO ESTABILIZADOS
40 Discussão A produção dos meios diferenciou em alguns aspectos do que foi encontrado na literatura, mas de acordo com Garcia et al & Mingoti (2005), os componentes que vão em cada meio diferenciam de acordo com os protocolos utilizados em cada laboratório. 5.3 Conclusão As regulações bioquímicas e hormonais envolvidas na produção dos diferentes meios utilizados em todas as etapas da PIV ainda não são bem conhecidas, não sendo definindo um protocolo ideal para um melhor resultado. Apesar destas limitações muitas pesquisas têm sido feitas, diversos protocolos estão sendo testados, contribuindo de modo significativo nos conhecimentos da produção animal, implementação e desenvolvimento de novas tecnologias. 6 DESCRIÇÃO DOS PROCEDIMENTOS REALIZADOS DURANTE O ESTÁGIO OBRIGATÓRIO. 6.1Infra-estrutura do Laboratório O laboratório de FIV está localizado no entorno próximo á entrada da CRV Lagoa. Este é composto da parte contaminada, também chamada de área suja onde está localizado o escritório (figura 5), o vestiário onde existem jalecos, propés, máscaras e toucas para a entrada no laboratório, e a sala de aspiração, a qual é utilizada para a aspiração de ovários provenientes de matadouros e para o armazenamento de materiais utilizados na aspiração folicular a campo. Na sala de aspiração há um óculo (janela) de dupla porta o
41 41 qual permite o acesso e a passagem de materiais para dentro do laboratório (figura 6) FIGURA 5: ESCRITÓRIO DO LABORATÓRIO. FIGURA 6: SALA DE ASPIRAÇÃO FOLICULAR.
42 42 O acesso ao laboratório de FIV é permitido apenas para pessoas autorizadas e vestidas apropriadamente. A entrada do laboratório é composta de um corredor, o qual tem acesso à sala de lavagem, onde localiza-se a autoclave e a estufa, para devida secagem e esterilização de todos os materiais que foram utilizados na manipulação dos embriões (figura 7). Nesta sala também são encontrados os aparelhos que permitem o acesso a água deionizada e água purificada (mili Q ). FIGURA 7: SALA DE LAVAGEM E ESTERILIZAÇÃO DE MATERIAIS.
43 43 Na sala ao lado desta encontra-se a sala de meios (figura 8), onde há uma geladeira com freezer contendo a grande maioria dos meios já preparados para as etapas do procedimento de Produção In Vitro (PIV). Esta sala também é provida de uma balança de precisão digital, utilizada para a pesagem de matérias primas necessárias para a preparação dos meios de manipulação e cultivo, phmetro digital para aferir o ph dos meios produzidos e a câmara a vácuo, onde estão localizadas reagentes químicos necessários como o Cloreto de cálcio (CaCl 2. 2H 2 O), Sulfato de magnésio(mgso 4.7H 2 O) e o cloreto de magnésio (MgCl 2.6H 2 O). Estes são mantidos na câmara de vácuo para que não percam suas propriedades físicas, pois podem absorver a umidade do ar e alterar suas propriedades. FIGURA 8: SALA DE MEIOS
44 44 Ao lado da sala de meios há a sala de cultivo (figura 9 e 10), onde os embriões são produzidos. Nela estão localizadas as incubadoras com controle de CO 2 e a incubadora de CO 2, O 2. Estas são mantidas a temperatura de 38,8ºC, no máximo de umidade e o controle dos referidos gases, um microscópio óptico para a análise da motilidade do sêmen utilizado na FIV, uma centrífuga para eppendorfs, uma unidade descontaminadora de ar, um microscópio estereoscópico (lupa), o vórtex para devida mistura dos meios e principalmente a capela com fluxo laminar, onde os embriões são mantidos e manipulados enquanto estiverem fora das estufas para prevenção de contaminações. FIGURA 9: SALA DE CULTIVO
45 45 FIGURA 10: SALA DE CULTIVO Próxima à sala de cultivo, está situada a sala de manipulação de sêmen, onde é realizado o descongelamento do mesmo para posterior utilização no processo de FIV. (Figuras 11 e 12). Neste ambiente encontram-se botijões de sêmen contendo nitrogênio líquido, um microscópio óptico para análise da concentração espermática, um microscópio estereoscópico (lupa) e uma descongeladora de paletas. Todas as salas são providas de desumidificadores, filtragem do ar e controle da temperatura.
46 46 FIGURA 11: SALA DE MANIPULAÇÃO DE SÊMEN FIGURA 12: SALA DEMANIPULAÇÃO DE SÊMEN
47 47 7 ASPIRAÇÃO FOLICULAR DE OVÁRIOS À CAMPO E SELEÇÃO DE OVÓCITOS PARA FIV 7.1 Revisão Bibliográfica Após uma considerável evolução em procedimentos pouco eficientes e invasivos como a laparotomia, laparoscopia transvaginal ou paralombar, a aspiração realizada em ovários in vivo pode ser feita por meio da aspiração associada à ultra-sonografia via trans-vaginal (ovum pick-up, OPU), sendo uma técnica menos traumática, estabilizada em relação a aparelhagem e de grande eficiência nos procedimentos (SENEDA et al, 2005). Os oócitos utilizados na PIV são geralmente aspirados de folículos com diâmetro entre 2 a 8 mm, pois folículos menores ainda não apresentam competência para continuar o desenvolvimento, enquanto que os maiores de 8 mm encontram-se em atresia ou já iniciaram o processo de maturação, tornando-se inviáveis para a FIV (GONÇALVES et al, 2008). A média de ovócitos obtidos por sessão de punção folicular guiada por ultra-som depende da estratégia adotada. Desta maneira, é possível puncionar os folículos de uma única doadora duas vezes por semana, produzindo-se maior porcentagem de embriões de Grau I, uma vez por semana ou até uma vez a cada duas semanas (PEIXER et al, 1996; HASLER, 1996; BOLS, 1997; NIBART et al, 1997; RODRIGUES & GARCIA, 1998 ; BOUSQUET et al, 2000). O maior risco apresentado com a utilização da OPU, segundo estudos realizados por BECKER et al (1996) e SANTL et al (1998) é o aparecimento de lesões ao estroma ovariano, principalmente em aspirações de folículos menores. De maneira geral há relação da ocorrência de lesões com a
48 48 freqüência ou intensidade em que os animais são puncionados, podendo acarretar o aparecimento de fibroses, folículos hemorrágicos e aderências (GIBBONS et al, 1994). Outro fator que pode facilitar a intensidade das lesões com a freqüência de punções é o tipo de agulha utilizada. É relatado o uso de agulhas com calibre 17 a 20, sendo descartáveis ou não. Agulhas com menor calibre apresentam menor área de corte, sendo menos danosas ao tecido, enquanto agulhas descartáveis, por terem o bisel afiado, exercem maior pressão sobre as estruturas (BOLS et al 1997) SELEÇÃO DOS OVÓCITOS Os oócitos possuem seu potencial de maturação, fertilização e desenvolvimento embrionário estimado através da aparência das CCO s, sendo classificados de acordo com a morfologia na tentativa de identificar os de maior viabilidade. Esta classificação segundo Gonçalves et al (2008) e Seneda et al (2001), possui escala de 1 a 4 e considera características das células cumulus, devendo estar envolto por várias camadas compactas destas, e do citoplasma que deve estar homogêneo, com granulações finais e coloração marrom. Qualidade 1: Apresenta-se com células do cumulus envoltas em mais de três camadas, com citoplasma homogêneo, com granulações finais, preenchendo completamente o interior da zona pelúcida e de coloração marrom. Qualidade 2 : As células do cumulus encontram-se parcialmente compactadas, em menos de três camadas celulares. O citoplasma é com
49 49 granulações distribuídas de maneira heterogênea, podendo estar mais concentradas em determinados locais, também preenche completamente a zona pelúcida. Qualidade 3 : As células do cumulus demonstram-se presentes, porém expandidas. O ooplasma fica contraído, degenerado, vacuolizado ou fragmentado, preenchendo irregularmente a zona pelúcida. Qualidade 4 : Ausência de células do cumulus, apresentando-se desnudo. 7.2 Descrição do procedimento observado/realizado durante o estágio A aspiração a campo é realizada com o auxílio de ultra-sonografia e um transdutor, que é acoplado à guia de aspiração, realizada com uma agulha em sua extremidade e conectada a uma bomba a vácuo que permite a recuperação dos ovócitos e do líquido folicular, levando-os direto para um tubo de 50 ml. Desta maneira o aparelho de ultra-som permite uma melhor visualização dos folículos e a bomba à vácuo permite a aspiração do liquido e o leva direto para o aquecedor de tubos mantendo-os a temperatura de 38 C. Inicialmente as vacas doadoras são colocadas no brete, de maneira calma, evitando ao máximo o estresse. O veterinário inicia o procedimento realizando a palpação retal, para verificar as condições dos ovários, se houve resposta ao protocolo de sincronização de onda ou não. Como o cuidado com a limpeza em todos os estágios é obrigatória, é realizada a lavagem da região perineal com água e sabão, sendo devidamente
50 50 enxaguadas e desinfetadas com álcool 70%. Após a lavagem é realizada a anestesia epidural com 5 ml de lidocaína. Assim que a anestesia epidural tenha efeito a aspiração já pode ser iniciada. Com o auxílio de uma pessoa para que os lábios vulvares sejam abertos, o veterinário introduz a probe do ultra-som via vagina e, simultaneamente faz a palpação retal manipulando os ovários manualmente para uma melhor aspiração. O liquido folicular é retirado e levado direto para um tubo de 50 ml que contém o meio de manutenção DMPBS. Esse meio foi devidamente preparado na proporção de 1 litro de DMPBS para 400 µl de heparina. O conteúdo aspirado é mantido a uma temperatura de 36 ºC em uma placa aquecedora de tubos. A heparina é utilizada tanto para evitar a coagulação do sangue, e não haver o entupimento do tubo, como para facilitar a seleção dos oócitos. Enquanto ocorrem as devidas aspirações de outros animais, outro técnico faz a parte laboratorial simultaneamente, na própria fazenda. Esta etapa consiste na filtragem do liquido folicular com filtro coletor para FIV utilizando o DMPBS com 10% de soro fetal bovino e 0,04% de heparina e seringa de 10 ml, para diluir o líquido folicular e facilitar o processo de filtração dos oócitos. Após a filtragem o DMPBS e os oócitos retidos na membrana do filtro são colocados em placas petri de 60 mm e selecionados de acordo com o grau I, grau II e grau III. Depois de selecionados é realizada a lavagem dos mesmos com meio de lavagem H199 e, se a distância ao laboratório for pequena são
51 51 levados em criotubos, devidamente identificados, com esse mesmo meio em uma garrafa térmica a temperatura de 35-36ºC. Se a distância for longa os oócitos selecionados depois de lavados com meio H199 são passados para o meio de maturação B199 em criotubos gaseificados com 5% de CO 2, 5% de O 2 e 90% de N 2 e com óleo mineral por cima para prevenir mudanças de ph, temperatura e contato do meio com o ar (STRINGFELLOW 1998). A incubadora de transporte de óocitos (Figura 13) ou a garrafa térmica com os criotubos contendo os oócitos e o respectivo meio são levadas até o laboratório. Chegado ao laboratório os oócitos passarão por todas as etapas para a produção in vitro de embriões. Para a realização dos procedimentos a campo são necessários equipamentos como o ultra-som com probe e uma bomba a vácuo, (Figura 14) aquecedor de tubos, tubos de 50 ml, agulha 40X12 ou 20 G, meio DMPBS devidamente diluído com heparina, luvas de palpação e luvas de procedimento cirúrgico, camisa sanitária para proteger a probe, álcool 70%, papel toalha, anestésico (Lidocaína) e seringas de 5 ml. FIGURA 13: INCUBADORA USADA PARA TRANSPORTAR OS CRIOTUBOS CONTENDO OÓCITOS NO SEU INTERIOR, DA PROPRIEDADE DO LABORATÓRIO.
52 52 Na parte de seleção dos oócitos dentro da propriedade os materiais essenciais para a realização são pipetas de 10 e 1000 µl com respectivas ponteiras, placas de 60 mm, banho maria, filtro de coleta de oócitos, agulhas 18g e seringas de 10 ml, botijão de transporte de sêmen, termômetro, luvas cirúrgicas descartáveis, criotubo de 2,0 ml com meio de maturação (B199)+ óleo mineral + gaseificação (5%CO 2 + 5%O N 2 ), ou criotubo de 2,0 ml com meio de lavagem (H199), álcool 70% e papel toalha, meio DMPBS, acrescentado 10% de soro fetal bovino e 0,04% de heparina, meio de lavagem (bancada) para seleção dos oócitos, lupa, incubadora de transporte de oócitos ou garrafa térmica, dependendo da distância ao laboratório e uma ficha de campo para a anotação da quantidade e tipo de oócitos encontrados em cada doadora. FIGURA14: MATERIAL UTILIZADO A CAMPO PARA A ASPIRAÇÃO DOS OVÓCITOS OU FOLÍCULOS BOVINOS.
53 Discussão Os procedimentos observados durante o estágio condizem com os encontrados na literatura consultada, sendo desde a higienização antes da punção até a seleção dos oócitos no liquido folicular após a aspiração realizados de maneira similar. O que diferencia são alguns meios utilizados no processo, como o de lavagem e a diluição ou mistura do meio DMBS feito de acordo com o protocolo utilizado na Sexing Tecnologies do Brasil. 7.4 Conclusão A aspiração folicular guiada por ultra-som pode ser realizada a campo e favorece os programas de melhoramento genético. A técnica apresenta grande potencial quando comparada aos métodos convencionais de reprodução assistida, pois possibilita a recuperação de gametas diretamente do ovário, independente da fase do ciclo estral, além de apresentar maior quantidade e estruturas, permite a utilização em animais postmortem, através da coleta das gônadas. A quantidade de folículos disponíveis apresenta uma grande variação, pois funciona de acordo com a dinâmica folicular, sendo o início do recrutamento folicular o momento ideal para a aspiração e recuperação do maior número de folículos possíveis, sem apresentar alguma dominância.
54 54 8 ASPIRAÇÃO FOLICULAR DE OVÁRIOS ORIUNDOS DE MATADOURO E SELEÇÃO DE OVÓCITOS PARA FIV 8.1 Revisão Bibliográfica De acordo com GONÇALVES et al (2008), os oócitos bovinos podem ser obtidos in vivo, a partir da punção folicular ou através da dissecação folicular, (quando há um número reduzido de ovários) em ovários provenientes de abatedouro para testes do laboratório. Nestes trabalhos o transporte dos ovários ocorre em solução salina a 0,9% de NaCl, ou solução salina fosfatada tamponada (PBS) dentro de garrafas térmicas aquecidas a 35 ºC. O tempo de obtenção dos ovários e o início da colheita não deve ultrapassar 3 horas (FILHO et al, 2003). Logo que são levados ao laboratório, os ovários devem ser lavados com a mesma solução aquecida a mesma temperatura, contendo antibiótico e submetidos à secagem com gases estéreis ou papel toalha. Em alguns protocolos é realizada a desinfecção com álcool a 70º GL (FILHO et al, 2003). A colheita destes é, em geral, efetuada por punção com agulha acoplada a uma seringa ou a uma bomba a vácuo. Terminada a aspiração o líquido deve ser colocado em placas Petri de 100X15 mm para rastreamento e isolamento das células do complexo cumulus oócito (CCOs). Os oócitos são retirados com o auxílio de micropipetas, e levados a outra placa contendo o meio de Lavagem TCM 199 onde são selecionados e transferidos para o meio de maturação. (FILHO et al, 2003).
55 Descrição do procedimento observado/realizado durante o estágio obrigatório. Os ovários provenientes de matadouro eram recebidos no começo da semana, e chegavam pelo período da manhã, trazidos por um responsável treinado para coletar os mesmos no frigorífico. Após a coleta, estes eram colocados em solução salina 0,9% dentro de um plástico sendo transportado dentro de uma garrafa térmica a uma temperatura de ºC até o laboratório. Chegando ao laboratório os ovários são lavados em solução salina 0,9%, e retirado o excesso de sangue, são colocados em um saco plástico contendo a mesma solução adicionada a antibiótico. Os ovários são mantidos em banho maria a temperatura de 36 ºC enquanto são pegos e aspirados aos poucos. Os ovários são manipulados com gases estéreis e os folículos aspirados com o auxílio de uma seringa de 10 ml e uma agulha 30X10 (Figura 15). De acordo com a aspiração, o líquido folicular retirado dos ovários é colocado em uma placa petri de 100 mm, riscada em linhas horizontais para facilitar a posterior seleção de ovócitos, que é mantida em uma placa aquecedora a 37 ºC até o volume e a quantidade requerida para sua finalidade, que pode ser para cultivo ou produção de tapete de células. FIGURA 15: ASPIRAÇÃO DE OVÁRIOS PROVENIENTES DE MATADOURO.
56 MÉTODOS UTILIZADOS PARA A CLASSIFICAÇÃO DOS OÓCITOS DURANTE O ESTÁGIO. Na classificação dos oócitos é de grande importância a visualização das células da CCOs, podendo observar o grau de compactação e o número de camadas da mesma e também deve ser observado à homogeneidade do citoplasma, visualizando a qualidade intracelular do oócito. O laboratório estabeleceu a graduação para classificação da qualidade dos oócitos aspirados, sendo classificados como grau I, grau II, grau III, desnudos, maturados ou atrésicos. Em aspiração realizada em ovários provenientes de abatedouro são selecionados apenas oócitos de Grau I e Grau II, sendo usados ovócitos que possuem mais de três camadas de células do cumulus, não expandidas e que não apresentam degeneração citoplasmática visível. - Grau I: Células do cumulus compactas, com três ou mais camadas, citoplasma igualmente distribuído na zona pelúcida, preenchendo todo o seu interior e de coloração marrom. - Grau II: Células do cumulus envolvendo oócito, apresentando menos camadas de células em relação o Grau I, com citoplasma homogêneo. - Grau III: Células do cumulus presente, em menos camadas ou não envolvendo totalmente o oócito, apresentando-se de maneira irregular, o citoplasma pode apresentar-se homogêneo ou com pequenas granulações. - Desnudos: Não apresentam nenhuma camada de células do cumulus, o citoplasma pode apresentar-se homogêneo ou com pequenas granulações.
57 57 - Maturados: Apresentam-se com o cumulus expandidas, não tendo as camadas bem definidas, ficam mais dispersas. Já o citoplasma pode estar homogêneo, escuro ou com granulações irregulares. - Atrésicos- Geralmente apresentam-se com o citoplasma granulado, transparente. 8.3Discussão A revisão bibliográfica condiz com o que foi observado durante o período de estágio, sendo corretamente realizados os procedimentos, desde a chegada dos ovários até a seleção dos oócitos para posterior maturação. 8.4 Conclusão A possibilidade da aplicação comercial de embriões produzidos a partir de ovários provenientes de abatedouro é polêmica, pois as características genéticas da mãe não são conhecidas e o estado sanitário das fêmeas abatidas não é determinado, devendo ser bem avaliado para evitar a disseminação de agentes patogênicos. 9 MATURAÇÃO IN VITRO DE OVÓCITOS 9.1 Revisão Bibliográfica A maturação do oócito envolve uma série de transformações, dentre elas modificações nucleares, citoplasmáticas, e moleculares, sendo ligada a
58 58 uma série de mudanças estruturais e bioquímicas que tornam o gameta feminino apto para ser fecundado e para conseqüentemente desenvolvimento (GONÇALVES et al, 2008). Um dos primeiros estudos sobre a maturação in vitro foi realizado em 1955, por Chang em oócitos de coelhos, tendo em vista características favoráveis desta espécie, como o oócito grande que facilitou a manipulação e a ovulação induzida pelo acasalamento (GONSALVES et al, 2002; VARAGO, 2008). As condições de cultura in vitro para a maturação de oócitos são essenciais para a obtenção de resultados satisfatórios dentro deste sistema na produção de embriões (COELHO et al, 2002). O oócito no interior do folículo está envolto por células da granulosa, formando o complexo cumulus-oócito (CCO). Estas células do cumulus possuem participação ativa no mecanismo de crescimento e maturação dos oócitos, melhorando resultados e promovendo melhores desenvolvimentos embrionários (Gonçalves et al, 2008). Quando oócitos imaturos são removidos dos folículos, estes tornam-se capazes de sofrer maturação nuclear sem nenhum estímulo hormonal, porém não são capazes de atingir seu desenvolvimento completo até o estágio necessário para devida implantação. Com isso, a adição de gonadotrofinas e esteróides torna-se necessária para que ocorra o desenvolvimento completo após a fecundação in vitro (COELHO et al, 2002). Há controvérsias quanto a real necessidade de hormônios e em relação à concentração utilizada, porém a maioria dos resultados demonstraram que o uso de gonadotrofinas ao meio de maturação aumenta a
59 59 capacidade de fecundação e melhora o desenvolvimento embrionário (GONÇALVES et al, 2008). Em diversos estudos as condições os meios produzidos para a maturação de ovócitos têm sido modificados, na tentativa de melhorar a produção in vitro de embriões. Entretanto, as taxas de blastocisto, prenhez e criopreservação de embriões obtidos através da fecundação in vivo continuam sendo superiores a embriões produzidos artificialmente. Alguns pesquisadores têm demonstrado que apesar do hormônio LH não afetar a maturação, a taxa de fecundação e a competência de desenvolvimento embrionário dos oócitos imaturos foram melhoradas (MOOR & TROUNSON, 1977 e DOMINKO & FIRST, 1992; COELHO et al, 2002). Segundo a comparação de Dominko & First (1992), o LH mostrou-se mais importante para a maturação in vitro que o FSH, promovendo maior taxa de blastocistos. Adicionalmente Brackett et al (1989), verificaram que oócitos imaturos submetidos a altas concentrações de LH apresentam melhor competência de desenvolvimento, porém quando adicionado em oócitos desnudos, desprovido de células do cumulus oophorus não houve resposta, sendo estas células mediadoras do efeito do LH, responsáveis pelo melhor resultado (COELHO et al 2002). O co-cultivo com células somáticas, também chamado de tapete, permanece como um suporte para o desenvolvimento de embriões produzidos através da FIV, sendo seu mecanismo e efeitos benéficos ao desenvolvimento embrionário ainda não bem estabelecidos. Acredita-se que as células somáticas secretem fatores embriotróficos e fatores de crescimento que
60 60 promovem o desenvolvimento, superando o bloqueio no estágio de 8 a 16 células. Por outro lado podem secretar substâncias que modificam a concentração dos constituintes do meio de cultivo. Por este motivo os meios devem ser trocados a cada três dias (REXROAD, 1989; SHAMSUDDIN, 1994). Alguns trabalhos demonstraram que oócitos bovinos maturados por 18 horas resultaram em taxas de clivagem e desenvolvimento embrionário semelhantes às observadas em 24 horas de maturação, sendo importante não ultrapassar estas 24 horas, pois oócitos observados com 32 horas de maturação apresentaram considerável redução no desenvolvimento embrionário após a fecundação (GORDON, 1994; VARAGO, 2008). 9.2 Descrição do procedimento observado/realizado durante o estágio obrigatório Durante o período de estágio a maturação dos oócitos foi realizada em placas Petri de 60 mm contendo células do cumulus como co-cultivo, também denominado de tapete. Para que os oócitos fossem capazes de serem fertilizados estes deveriam ser maturados durante horas (Figura 16). Neste período, ocorre maturação nuclear e citoplasmática, expansão das células e produção de ácido hialurônico. Esta etapa ocorre no D -1, sendo realizada a seleção e a classificação dos oócitos. Se oriundos de matadouro apenas são selecionados ovócitos de grau I e grau II sendo devidamente maturado. Se forem provenientes de uma propriedade (OPU), são escolhidos os de grau I, grau II, grau III e os desnudos.
61 61 FIGURA 16: OÓCITOS MATURADOS APÓS 24H EM ESTUFA Produção do Tapete O tapete celular é o co-cultivo com células do cumulus proveniente dos oócitos puncionados de ovários de matadouro. Sua principal finalidade é melhorar o desenvolvimento dos embriões e deve ser feito uma semana antes do uso. Para sua produção os oócitos são maturados em placas de 30 mm, contendo 3 ml de meio maturação por 24 horas em incubadora com controle de CO2. Após este período, é adicionada a tripsina durante um minuto e iniciase o processo de desnudação dos oócitos. Após um minuto é adicionado o soro fetal bovino objetivando inativar a tripsina e continuamente é feito o desnudamento.
62 62 Depois de estarem desprovidos de células do cumulus, os oócitos são descartados e as células juntamente com a tripsina e o soro fetal bovino são colocadas em um eppendorf e levadas a centrífuga, que é colocada em rotação máxima durante 10 segundos por 5 vezes. Com a centrifugação sobrenadante é eliminado, permanecendo apenas o volume de 100 µl. Neste é adicionado 1 ml de meio de cultivo SOF CO 2 7,5% e levado novamente a centrífuga com rotação máxima durante 10 segundos por 5 vezes. Novamente é deixado apenas 100 µl no eppendorf, que será diluído em um tubo de 3 ml com meio de cultivo e homogeneizado. Utiliza este meio SOF CO 2 7,5% com células do cumulus para fazer as placas de tapete celular. As placas possuem 4 gotas de 75 µl cada, sendo submersas com 10 ml de óleo mineral e levadas a estufa de CO 2. O meio das gotas de tapete celular é trocado a cada três dias. Nestes dias retira-se o excesso de tapete quando necessário, com o auxílio de uma pipeta Pasteur alongada e com a ponta lacrada. É retirado o meio antigo substituindo-se um meio novo, produzido no dia anterior. 9.3 Discussão Após muito tempo de estudo está sendo feita a primeira etapa da FIV, a maturação dos oócitos selecionados, com sucesso. Muitos fatores devem ser rigorosamente seguidos, pois a sensibilidade a alterações promove comprometimento de todo o processo.
63 63 Durante o acompanhamento do estágio obrigatório foram observados todos os detalhes do processo, e após este período foi constatado coerência da prática com a teoria contida na literatura. 9.4 Conclusão Diversas pesquisas estão sendo realizadas sobre esta técnica, principalmente com a finalidade de implementar melhorias, reduzindo os investimentos iniciais e aumentando a quantidade de oócitos recuperados. Sabe-se que a adição de hormônios no meio de maturação promove um efeito benéfico e melhora o desenvolvimento dos embriões após a fertilização, porém ainda não se conhecem as concentrações ideais destas gonadotrofinas durante o processo de maturação, sendo necessários mais estudos, experimentos e pesquisas objetivando melhorar as taxas de blastocisto e aprimorar a técnica de fertilização in vitro. 10 PRODUÇÃO IN VITRO DE EMBRIÕES (PIV) A PIV expandiu nas diferentes espécies animais em 1978, após o nascimento do primeiro bebê proveta do mundo, na Inglaterra (STEPTOE & EDWARS, 1978). Em 1981 nasceu o primeiro produto de ruminante produzido nos Estados Unidos através da Fertilização in vitro, sendo que inicialmente os embriões eram produzidos através da maturação de oócitos maturados in vivo (COELHO, 2002). A produção in vitro de embriões vem apresentando avanços consideráveis e está sendo lentamente incorporada aos projetos de produção.
64 64 Com o desenvolvimento do método de punção folicular guiado por ultra-som (Ovum Pick-up) tornou-se possível a recuperação de ovócitos de fêmeas vivas para a FIV, abrindo novos caminhos para a multiplicação de animais de interesse econômico e superando os índices de técnicas como a transferência de embriões, no que diz interesse à produção de bezerros/vaca/ano (VARAGO, 2008). Essa técnica pode ser utilizada em animais jovens a partir de 6 meses de idade, gestantes até o terceiro mês, lactantes ou animais com problemas de infertilidade adquiridos (GOODHAND et al, 1999; TANEJA et.al, 2000). Além desses aspectos, a PIV também é uma excelente ferramenta para a pesquisa de fenômenos relativos aos processos fisiológicos, bioquímicos e biotecnológicos durante a maturação, fertilização, e cultivo in vitro, capacitação espermática e eventos relacionados ao início do desenvolvimento embrionário na fase de pré-implantação (GONÇALVES et al, 2008). Todavia existem relatos na literatura de fetos produzidos in vitro apresentando um crescimento maior, o que resulta em maior peso ao nascer e aumento da incidência de distocias, prolongamento de gestações e aumento da mortalidade pré natal, fazendo parte da Síndrome da Cria Gigante (LOS Large Offspring Síndrome), esta que aparentemente está associada ao cocultivo das células da granulosa, ou a alta concentração de soro sanguíneo em meios de cultivo (YOUNG et al, 1998). Segundo Gonçalves et al (2008), a montagem da estrutura laboratorial talvez seja o ponto mais difícil e crucial para a realização da técnica com bons resultados e controle de qualidade dos futuros trabalhos. Os laboratórios de
65 65 processamento devem ser bem planejados, bem equipados e escrupulosamente mantidos, devendo ter espaço suficiente para separar os locais de preparação de meios, armazenagem de sêmen, limpeza e esterilização do material, bem como uma parte destinada a manipulação e o cultivo de gametas e embriões. O laboratório deve ter temperatura controlada, acesso restrito do pessoal, com rigorosa higiene e assepsia, proporcionando a vestimenta adequada e valendo-se de sistemas de purificação de ar e luz ultravioleta para total desinfecção do ambiente (GONÇALVES et al, 2008). As estufas de cultivo ou incubadoras utilizadas devem conter sistema de regulagem da atmosfera automático, sendo capaz de manter a temperatura e umidade constante. Também deve conter estereomicroscópicos com diferentes aumentos e microscópicos permitindo estimar a viabilidade espermática, manipulação e avaliações dos oócitos e dos embriões nas diferentes etapas da PIV (GONÇALVES et al, 2008). O sistema de purificação de água é fundamental para obtenção de uma boa produção, sendo a qualidade dos meios de cultivo e embriões dependentes da qualidade dos sais e principalmente da água. Esta deve ser oriunda de aparelhos purificadores que fornecem água ausente de microorganismos, desprovida de impurezas e de íons, minimizando os metais pesados e outros agentes possivelmente tóxicos para os embriões. A capela de fluxo laminar é requerida para a manipulação de meios e placas de cultivo, são projetadas para minimizar os riscos biológicos, fornecendo condições assépticas apropriadas (GONÇALVES et al, 2008).
66 66 Além desses equipamentos o osmômetro e o medidor de ph são aparelhos essenciais no controle de qualidade dos meio usados no laboratório.também deve conter refrigeradores, botijões de nitrogênio, recipientes de vidro e plástico, placas Petri descartáveis, seringas, agulhas, balanças analíticas, pipetadores com suas devidas ponteiras, mesas aquecedoras, centrífugas e filtros esterilizantes (GONÇALVES et al, 2008). 11 FERTILIZAÇÃO IN VITRO 11.1 Revisão Bibliográfica A bovinocultura brasileira passa por uma fase de reconhecimento da importância de biotecnologias aplicadas a reprodução animal, tendo em vista o melhor retorno financeiro por maior eficácia nos sistemas de produção. (JUNIOR et al, 2009). A Fertilização in vitro (FIV) é uma técnica de reprodução assistida, que consiste na colocação de um número significativo de espermatozóides em contato com oócitos obtido através de punção folicular de ovários oriundos de abatedouros ou de ovários de vacas pré-estimuladas hormonalmente, promovendo, desta maneira a obtenção de embriões de boa qualidade para devida implantação em vacas receptoras. (MARTINEZ; SOUZA, 2007). Na década de 40 os procedimentos foram realizados em estrelas do mar, pois ao contrário dos mamíferos, nos invertebrados marinhos a fecundação ocorre externamente ao sistema reprodutor da fêmea, permitindo melhor visualização e entendimento (GONÇALVES, 2008).
67 67 Embora o primeiro estudo em mamíferos tenha ocorrido em 1935, até a década de 50 nenhum sucesso havia sido obtido, sendo registrado o primeiro animal gerado através da FIV em 1951, um coelho por Austin e Chang, que também observaram que os espermatozóides necessitavam de algum tempo dentro do trato reprodutivo feminino antes de adquirir a capacidade de penetrar nos oócitos (capacitação espermática) (VARAGO, 2008). Somente em 9 de junho de 1981 foi constatado o nascimento do primeiro bovino produzido artificialmente, e no final desta década é que a PIV recebeu grande impulso para pesquisadores e para a realização de experimentos. (VARAGO, 2008). Entre as limitações desta técnica está o custo elevado, em função da necessidade de infra-estrutura laboratorial, a inconsistência dos resultados referentes à taxa de mórulas e blastocistos e o tempo consumido para executar a rotina de produção de embriões, que vai desde a punção folicular até o desenvolvimento in vitro de embriões (MIRANDA et al, 2007). Na última década observou-se que embriões produzidos in vitro possuem qualidade inferior àqueles produzidos in vivo, constatando-se que as taxas de produção embrionária se estabilizaram em torno de 35% de blastocistos ao sétimo dia de cultivo, variando de acordo com os protocolos utilizados (BRUM, 2004). Algumas características tornaram-se morfologicamente peculiares para embriões produzidos artificialmente. Dentre elas apresenta blastômeros mais escuros, quando comparados aos produzidos in vivo e a presença de mórulas ocupando a totalidade do espaço perivitelino, sendo normalmente ocupada apenas 60 a 70% deste espaço (GONÇALVES et al, 2008).
68 68 A Fertilização in vitro de embriões tem sido utilizada como instrumento importante para a exploração maximizada do potencial reprodutivo dos rebanhos, diminuindo o intervalo entre gerações, potencializando o grau de seleção, acelerando o melhoramento genético e utilizando animais inférteis ou com problemas reprodutivos, impedindo desta maneira, o descarte precoce de fêmeas portadoras de alterações adquiridas (VARAGO et al, 2008). In vivo os espermatozóides percorrem o trato genital feminino até chegar à ampola e fecundar o oócito, neste percurso sofrem ação de glicosaminoglicanas que induzem sua capacitação. Esta consiste na aptidão dos espermatozóides a se ligarem aos receptores específicos presentes na zona pelúcida do oócito e fecundarem o mesmo (GONÇALVES et al, 2008). Laboratorialmente essa capacitação espermática se dá através da adição de heparina que atuará ativando os canais de cálcio, promovendo alterações bioquímicas na membrana plasmática dos espermatozóides e aumentando o ph. (BAVISTER, 2002). Antes do processo de capacitação os espermatozóides precisam ser separados do plasma seminal, crioprotetores, extensores e células mortas, devendo ser selecionados (GONÇALVES et al, 2008). Como no processo de Fertilização in vitro a maioria dos laboratórios utilizam sêmen congelado, após o descongelamento a seleção espermática pode ser feita através do sistema swim-up, que consiste na deposição de 100 µl de sêmen no fundo de um tubo contendo 1 ml de meio de fertilização e a transferência para a estufa na temperatura de 39 ºC. Desta maneira ocorre a migração dos espermatozóides vivos para a porção superior do meio. Em uma segunda etapa o sobrenadante é aspirado, de uma forma que não permita o
69 69 contato dos componentes do sêmen contidos no fundo do tubo com os espermatozóides viáveis. Essa amostra é transferida para outro tubo, sendo centrifugada com rotação de 700 a 900 rpm por 5 minutos, é realizada a coleta do conteúdo depositado no fundo do tubo e formado o pellet para a formação do volume necessário na fertilização (GONÇALVES et al, 2008). No sistema de separação espermática com Percoll o sêmen é centrifugado pela passagem de diferentes gradientes para permitir a separação através da densidade dos espermatozóides ou vivos dos mortos. O Percoll na concentração de 90% é colocado no fundo de um tubo de ensaio na quantidade de 2 ml, em seguida é adicionado lentamente mais 2 ml de Percoll na concentração de 45%, sem permitir a homogeneização das duas soluções. O conteúdo da palheta de sêmen é depositado no mesmo tubo e levado a centrifugação por 30 minutos a 700 rpm. Em seguida o sobrenadante é removido, deixando apenas o pellet contendo os espermatozóides viáveis, que é colocado em um tubo de 10 ml de meio TALP e novamente centrifugado, desta vez em rotação de g por 10 minutos. Após a segunda centrifugação o sobrenadante é removido e os espermatozóides são suspensos em 500 µl de meio FERT-TALP (GONÇALVES et al, 2008). Em seguida à seleção dos espermatozóides são feitas as análises para determinar a concentração espermática, que é avaliada com o objetivo de aferir a quantidade de espermatozóides vivos presentes em cada palheta e também é feito o teste de motilidade do espermatozóide, devendo sempre ser progressiva (GONÇALVES et al, 2008). Segundo Hafez et al (2004), a concentração pode ser analisada de três formas: Pelo hemocitômetro, também conhecido como Câmara de
70 70 NeuBauer, que consiste em uma lâmina microscópica com câmaras traçadas com precisão, sendo o número de espermatozóides por câmara contado manualmente. Há também o espectofotômetro ou um colorímetro calibrado a um hemocitômetro que apresentam a vantagem de serem precisos e rápidos, porém não são acurados quando o sêmen apresenta-se contaminado ou sujo. A determinação da motilidade envolve estimativas subjetivas da viabilidade dos espermatozóides e da qualidade da motilidade (HAFEZ et al, 2004). Observa-se uma gota de sêmen entre lâmina e lamínula num aumento de 200 a 400X, verificando o percentual de espermatozóides com motilidade progressiva. Para sêmen congelado a motilidade deve ser superior a 30%. A motilidade espermática é extremamente sensível as condições ambientais, de modo que é necessário proteger o sêmen de condições ou agentes prejudiciais a análise (HAFEZ et al, 2004). A ligação do espermatozóide com o oócito é mediada por receptores espermáticos espécie-específicos presentes na zona pelúcida, ocorrendo à penetração através de ações enzimáticas e mecânicas. A reação acrossômica permite a liberação de enzimas que digerem a matriz da zona pelúcida e a expõe para a penetração do espermatozóide, que é auxiliada por sua motilidade (GONÇALVES et al, 2008). Após a penetração espermática há dois acontecimentos simultâneos, a inclusão da carga genética paterna e a ativação do oócito, necessária para o bloqueio da polispermia, (decorrente da rápida despolarização da membrana plasmática do oócito), e o inicio das divisões (clivagem). (GONÇALVES et al, 2008).
71 71 Para maximizar a capacidade fecundante, é realizado o cálculo baseado na motilidade e na população viva de espermatozóides após a centrifugação em gradiente Percoll, determinando a concentração espermática ideal para cada touro, geralmente utilizando a concentração de 2 X 10 6 espermatozóides/ml (GONÇALVES et al, 2002). Os sistemas de cultivo utilizados para a fecundação apresentam muitas diferenças. No entanto é imprescindível que o meio empregado seja capaz de propiciar ao oócito e ao espermatozóide condições ideais para que a penetração ocorra o mais rápido possível (GORDON, 1994). A fecundação é realizada com os resultados obtidos através do cálculo baseado na motilidade e na concentração espermática. A quantidade determinada de espermatozóides é colocada em contato com os oócitos presentes em cada gota do meio FIV presente nas placas Petri de 60 mm, que são cobertos com óleo mineral e logo em seguida colocados em estufa de CO2, nas mesmas condições da maturação. (DIAS et al, 2006). Atualmente o processo de fertilização in vitro na espécie bovina é o que apresenta maior sucesso dentre as espécies, sendo que 40% dos oócitos maturados e fecundados se desenvolvem até blastocisto (HALER, 1998; BAVISTER, 2002).
72 Descrição do procedimento observado/realizado durante o estágio obrigatório Durante o período de estágio na Sexing Thecnologies do Brasil foi estabelecido o dia de fecundação como D0, sendo utilizados sêmen congelado, sexado e reverso, que consiste na sexagem após o descongelamento. Devidamente maturados os oócitos são lavados em meio FIV e levados a incubadora com controle de CO 2. Enquanto isso, é preparado em um eppendorf, 400 µl de PureSperm na concentração de 80% e adicionado, lentamente para não ocorrer a mistura, mais 400µL de PureSperm na concentração de 40%. No caso de sêmen sexado essas quantidades são diminuídas para 200 µl cada. Esse gradiente corresponde ao Percoll, meio que permite a separação dos espermatozóides vivos dos mortos e diluente. Após esta adição o eppendorf vai para a estufa de CO 2, fechado, e permanece por no mínimo 15 minutos para estabilizar a temperatura. Com isso, a paleta de sêmen deve ser descongelada, sendo retirada do botijão de nitrogênio líquido com uma pinça anatômica e colocada durante 20 segundos em água a temperatura de 35,5 ºC. Feito isso a paleta é cortada em bisel e o sêmen é depositado cuidadosamente no eppendorf contendo o gradiente de PureSperm e levado a centrífuga na rotação de 3000 rpm durante 6 minutos no sêmen convencional, e 6000 rpm por 6 minutos no sêmen sexado. Com a saída dos eppendorf da centrífuga os espermatozóides mortos se encontraram entre os gradientes de PureSperm e o diluente encontra se sobre os gradientes, e devem ser eliminados, deixando cerca de 100 µl no
73 73 pellet. Após esta retirada é adicionado 400µL de meio de fertilização para retirar o excesso de PureSperm, então o eppendorf é levado novamente a centrífuga durante 3 minutos a 3000 rpm no sêmen convencional e o sexado. Após esta centrifugação, novamente deixa um pellet de 100µL, quando for sêmen convencional adiciona se 100 µl de meio de FIV, para diluir a concentração do mesmo. Com o final desse processo são retiradas pequenas quantidades para as devidas análises, é realizado o cálculo do volume de sêmen para a fecundação de cada gota e finalmente a fertilização é efetivada (figura17 e 18). FIGURA 17: COLOCAÇÃO DOS ESPERMATOZÓIDES DENTRO DAS GOTAS DE FIV
74 74 FIGURA 18: OÓCITOS MATURADOS COM ESPERMATOZÓIDES PRONTOS PARA A FERTILIZAÇÃO MOTILIDADE ESPERMÁTICA Os pellets devem ser homogeneizados e 10 µl de sêmen são transferidos para uma lâmina sobreposta por uma lamínula para se fazer o teste de motilidade espermática no microscópio. De acordo com o percentual de motilidade o sêmen é avaliado de 0 a 100%, sendo reprovados touros com uma motilidade inferior a 30% (figura 19). FIGURA 19: EXAME DE MOTILIDADE REALIZADO NO MICROSCÓPIO.
75 CONCENTRAÇÃO ESPERMÁTICA A concentração também é avaliada, sendo retirados 5 µl de sêmen e adicionado a um eppendorf com 95 µl de água e homogeneizados, os espermatozóides mortos são colocados na quantidade de 10 µl na câmara de NeuBauer (figura 20) e levados ao microscópio para devida contagem. A contagem com sêmen convencional é feita apenas em 5 quadrantes, sendo os quatro quadrados do canto e o central. No sêmen sexado a contagem é feita em todos os quadrados e o resultado é dividido por 5 para se fazer uma média. Para determinar a quantidade de espermatozóides que devem ser colocados em cada gota de FIV deve ser feito um cálculo baseado na motilidade e na concentração espermática. O resultado dos testes deve ser multiplicado um pelo outro. Como a gota de fiv é feita com 50 µl, o resultado obtido desta multiplicação é divisor de 50, o resultado equivale a uma concentração de 1x10 6 sptz por ml. Devido ao fato da fecundação ser feita, de preferência, com 3x10 6 sptz por ml, o resultado da divisão deve ser multiplicado por 3. Ex: a concentração resultou em 50 e a motilidade foi classificada em 80% 50 x 0,80 = 40 De acordo com a gota de FIV 50/40 =1,25 para 1 milhão de espermatozóides Como a fertilização é feita com 3 milhões deve-se: 1,25 x 3 = 3,75 Conclui-se que cada gota de meio de fertilização contendo os oócitos deve ser fecundada com 3,75µL de espermatozóides.
76 76 A fertilização é realizada em um período de horas e as placas são mantidas em incubadora de CO 2 a 38,8ºC e com umidade máxima. Para a efetivação desta técnica os equipamentos necessários para a montagem e realização dos procedimentos feitos em laboratório são necessários determinados materiais como: Lupa, jalecos, toucas ou gorros, pro- pés e máscaras descartáveis, placas de 35 mm, 60 mm, e 100 mm, pipetas de 10, 20, 200 e 1000 µl e ponteiras, microscópios, máquina de descongelamento de sêmen (36ºC), eppendorf de 1500 µl e 600 ul, gradiente PureSperm 80% e puresperm 40%, incubadoras com controle de CO 2 e com controle de CO 2 e O 2 (38,8ºC) com o máximo de umidade e controle dos respectivos gases, desumidificadores, unidades descontaminadoras de ar, aparelho de água deionizada e água mili Q, estufa de secagem e esterilização e autoclave, geladeira com freezer, placa aquecedora, balança de precisão com 4 dígitos, phmetro, câmara à vácuo, câmaras de Newbauer, lâminas e lamínulas, paletas e lacradores de paleta, transportadora de embriões, vórtex, centrífuga de eppendorf, pipetas Pasteur e lamparina com álcool e finalmente, um fluxo laminar. FIGURA 20: LÂMINAS E CÂMARAS DE NEUBAUER PRONTAS PARA AS AVALIAÇÕES.
77 Discussão Como relatado anteriormente, existem algumas diversidades do que foi encontrado nos livros com o que foi observado durante o período de estágio obrigatório, como por exemplo, a utilização de sêmen sexado e reverso e a diferença do gradiente de concentração. Porem a maioria condiz com o que foi visto, sendo apenas alguns métodos preferenciais do laboratório Conclusão A viabilidade econômica desta técnica está intimamente relacionada com a eficiência dos laboratórios, visando a qualidade embrionária, a porcentagem de blastocisto e clivados, a capacidade de estabelecer gestação, o desenvolvimento fetal e placentário normais e o nascimento de crias saudáveis e viáveis. A relação custo benefício pode se tornar justificável, sendo a sua produção superior a outras técnicas, aumentando o potencial de exploração zootécnica de fêmeas geneticamente superiores com um menor período de tempo e a utilização de animais com infertilidade adquirida, animais que não respondem mais a superovulação ou no caso de animais doentes ou recém mortos. 12 CULTIVO E MANIPULAÇÃO DE EMBRIÕES OBTIDOS POR MEIO DE FIV 12.1 Revisão Bibliográfica O momento crítico para o desenvolvimento embrionário começa após a fecundação, iniciando sucessivas divisões e alterações morfológicas para a formação de mórulas e blastocistos (YANAGIMACHI, 1994).
78 78 Durante muito tempo, no cultivo, muitos embriões estacionavam seu desenvolvimento entre 2 a 16 células, sendo este fato denominado bloqueio do desenvolvimento embrionário, que corresponde à carência do sistema de produção no momento da transição do genoma materno para o embrionário (BARNES & EYSTONE, 1990; PETTERS, 1992). Graças a diversos trabalhos, foi concluído que cultivar embriões em tuba uterina de diferentes espécies animais supria a dificuldade do bloqueio embrionário. Com isso, no final da década de 80 pesquisadores da área iniciaram o co-cultivo de embriões com células somáticas. (GANDOLF & MOOR, 1987). As células somáticas mais utilizadas foram as de oviduto, células da granulosa e células de VERO (linhagens celulares estabelecidas para cultivo) (GORDON, 1994; GONÇALVES et al 2002). As células somáticas do co-cutivo devem ser bastante ricas, pois irão competir com os embriões pelos nutrientes. Seu benefício está na produção de fatores de crescimento, na remoção dos componentes inibitórios do meio de cultivo como radicais livres, amônia, e metabólitos celulares. (THOMPSON, 1996; GONÇALVES et al, 2002). No entanto os compostos secretados pelas células apresentam concentrações variadas e podem alterar os nutrientes presentes no meio (GORDON, 1994; GONÇALVES et al, 2002). Embora as condições definidas de cultivo existentes suportem boas taxas de desenvolvimento e controle de qualidade sem a adição de substâncias biológicas como albumina sérica bovina e soro fetal bovino, a suplementação protéica tem se demonstrado benéfica. Estudos demonstraram que embriões cultivados na ausência de proteína possuem um menor número de células e diminuição na capacidade de desenvolvimento. (MOZZAQUATRO, 2004).
79 79 O cultivo embrionário in vitro varia de 7-9 dias a 38,8 ºC com atmosfera controlada (5% O 2, 5% CO 2 e 90% N 2 ) e umidade saturada. A taxa de blastocisto é avaliada neste período, observando a taxa de embriões eclodidos. (STRINGFELLOW; SEIDEL, 1998) Descrições do procedimento observado/realizado durante o estágio obrigatório. Durante o período de estágio obrigatório as placas são avaliadas após horas da fertilização, os embriões devem ser desnudados, ainda no meio FIV e, posteriormente são transferidos para o meio de cultivo. A transferência para o meio SOF O 2 é feita no D1, os zigotos são colocados nas devidas placas, e então levados a estufa com controle de O 2, onde permaneceram durante um dia (figura 21). Nesta etapa o máximo de cuidado deve ser tomado para evitar sujidades e posteriores contaminações. No D2 os embriões clivados são separados dos não clivados. (Figura 22). Os clivados são retirados do meio SOF O 2 e colocados em uma nova placa contendo meio SOF CO 2 7,5% e tapete celular, este produzido com células do cumulus de abatedouro. Nesta placa ocorrerá o desenvolvimento embrionário até o D7, permanecendo esse período em estufa controlada com CO 2. No ultimo dia (D7) é realizada a contagem do número de estruturas por gota, do número de clivados e a observação da quantidade de mórulas com 4 ou mais células para avaliação da porcentagem de produção.(figura 23).
80 80 Com o final destes procedimentos é realizado o envase dos embriões para transferência e os experimentos embrionários que não forem utilizados são descartados em lixo hospitalar. FIGURA 21: OÓCITOS APÓS 22 HORAS DA FERTILIZAÇÃO, NO D1. FIGURA 22: OBSERVAÇÃO DOS ZIGOTOS NO D2.
81 81 Blastocisto Blastostocisto Expandido contraído Blastocisto Blastocist o Inicial Blastocisto eclodido. Blastocisto em eclosão FIGURA 23: D7 OBSERVAÇÃO E CLASSIFICAÇÃO DOS EMBRIÕES ANTES DO ENVASE ENVASE DE EMBRIÕES OBTIDO POR MEIO DE FIV REALIZADOS DURANTE O PERÍODO DE ESTÁGIO. O envase é feito no dia 7, depois da observação e classificação dos embriões como mórula, blastocisto inicial, blastocisto, blastocisto expandido, blatocisto em eclosão e blastocisto eclodido. Este consiste na lavagem dos embriões com meio de lavagem (H199, bancada), passagem pela tripsina durante 1 minuto e o envase dos embriões em paletas com o Holding TQC. Os embriões são envasados em palhetas de 250 µl, estéreis, com o auxílio de uma seringa de insulina ou com o micro-classic. Para o envase são feitas cinco colunas, a primeira coluna com holding, a segunda coluna de ar, a terceira coluna de holding contendo e embrião, e quarta coluna de ar e a quinta coluna com holding. (Figura 24).
82 82 Após o envase a palheta é lacrada com um lacrador o qual está identificado com um número, o qual é o mesmo da ficha que apresenta a descrição do embrião. Estas palhetas são colocadas na transportadora de embrião a 36ºC ou em caixa de isopor com gel térmico aquecido e papel, para manter a temperatura do embrião. E são transportados até o local de transferência. O ideal é que todos os embriões sejam transferidos em um prazo de 7 horas após o envase. FIGURA 24: ENVASE DOS EMBRIÕES EM PALHETAS DE 250 µl
UNIVERSIDADE TUITUTI DO PARANÁ FACULDADE DE CIÊNCIAS BIOLÓGICAS E DA SAÚDE CURSO DE MEDICINA VETERINÁRIA TRABALHO DE CONCLUSÃO DE CURSO
 1 UNIVERSIDADE TUITUTI DO PARANÁ FACULDADE DE CIÊNCIAS BIOLÓGICAS E DA SAÚDE CURSO DE MEDICINA VETERINÁRIA TRABALHO DE CONCLUSÃO DE CURSO CURITIBA 2010 2 GEÍSA DO AMARAL DO MAINARDES TRABALHO DE CONCLUSÃO
1 UNIVERSIDADE TUITUTI DO PARANÁ FACULDADE DE CIÊNCIAS BIOLÓGICAS E DA SAÚDE CURSO DE MEDICINA VETERINÁRIA TRABALHO DE CONCLUSÃO DE CURSO CURITIBA 2010 2 GEÍSA DO AMARAL DO MAINARDES TRABALHO DE CONCLUSÃO
Ciclo Sexual ou Estral dos Animais Domésticos Prof. Dr. Wellerson Rodrigo Scarano Departamento de Morfologia Instituto de Biociências de Botucatu
 Controle Hormonal da Gametogênese Feminina Ciclo Sexual ou Estral dos Animais Domésticos Prof. Dr. Wellerson Rodrigo Scarano Departamento de Morfologia Instituto de Biociências de Botucatu Ovários Formato
Controle Hormonal da Gametogênese Feminina Ciclo Sexual ou Estral dos Animais Domésticos Prof. Dr. Wellerson Rodrigo Scarano Departamento de Morfologia Instituto de Biociências de Botucatu Ovários Formato
Cuidados essenciais para maior produtividade na criação de bovinos
 ebook Avanza Cuidados essenciais para maior produtividade na criação de bovinos Sumário 01 02 03 04 05 Introdução - Aumente a produtividade da sua criação Fertilização In Vitro Transferência de Embriões
ebook Avanza Cuidados essenciais para maior produtividade na criação de bovinos Sumário 01 02 03 04 05 Introdução - Aumente a produtividade da sua criação Fertilização In Vitro Transferência de Embriões
PROGRAMAS DE IATF EM NOVILHAS ZEBUÍNAS
 ANEXO TÉCNICO DO MANUAL DE SINCRONIZAÇÃO E INSEMINAÇÃO EM TEMPO FIXO EM BOVINOS PROGRAMAS DE IATF EM NOVILHAS ZEBUÍNAS Os protocolos de inseminação artificial em tempo fixo (IATF) são utilizados de forma
ANEXO TÉCNICO DO MANUAL DE SINCRONIZAÇÃO E INSEMINAÇÃO EM TEMPO FIXO EM BOVINOS PROGRAMAS DE IATF EM NOVILHAS ZEBUÍNAS Os protocolos de inseminação artificial em tempo fixo (IATF) são utilizados de forma
FISIOLOGIA DO SISTEMA REPRODUTOR FEMININO
 1 UNIVERSIDADE DE CUIABÁ Atividade Presencial: estudo através de Textos e Questionários realizado em sala de aula SOBRE A FISIOLOGIA DO SISTEMA REPRODUTOR FEMININO CADA ESTUDANTE DEVERÁ IMPRIMIR E LEVAR
1 UNIVERSIDADE DE CUIABÁ Atividade Presencial: estudo através de Textos e Questionários realizado em sala de aula SOBRE A FISIOLOGIA DO SISTEMA REPRODUTOR FEMININO CADA ESTUDANTE DEVERÁ IMPRIMIR E LEVAR
HORMÔNIOS SEXUAIS SISTEMA ENDÓCRINO FISIOLOGIA HUMANA
 HORMÔNIOS SEXUAIS SISTEMA ENDÓCRINO FISIOLOGIA HUMANA GLÂNDULAS SEXUAIS GÔNADAS MASCULINAS = TESTÍCULOS GÔNADAS FEMININAS = OVÁRIOS PRODUZEM GAMETAS E HORMÔNIOS SEXUAIS CONTROLE HORMONAL DO SISTEMA TESTÍCULOS
HORMÔNIOS SEXUAIS SISTEMA ENDÓCRINO FISIOLOGIA HUMANA GLÂNDULAS SEXUAIS GÔNADAS MASCULINAS = TESTÍCULOS GÔNADAS FEMININAS = OVÁRIOS PRODUZEM GAMETAS E HORMÔNIOS SEXUAIS CONTROLE HORMONAL DO SISTEMA TESTÍCULOS
Mas por que só pode entrar um espermatozóide no óvulo???
 Mas por que só pode entrar um espermatozóide no óvulo??? Lembre-se que os seres humanos só podem ter 46 cromossomos, sendo um par sexual, por exemplo: se dois espermatozóides com cromossomo sexual X e
Mas por que só pode entrar um espermatozóide no óvulo??? Lembre-se que os seres humanos só podem ter 46 cromossomos, sendo um par sexual, por exemplo: se dois espermatozóides com cromossomo sexual X e
2. Como devo manusear o sêmen durante a sua retirada do botijão?
 CUIDADOS NO MANUSEIO DO SÊMEN CONGELADO O manuseio adequado do sêmen congelado é essencial para manter ótimos resultados nos programas de inseminação artificial, tanto no sêmen sexado como no sêmen convencional.
CUIDADOS NO MANUSEIO DO SÊMEN CONGELADO O manuseio adequado do sêmen congelado é essencial para manter ótimos resultados nos programas de inseminação artificial, tanto no sêmen sexado como no sêmen convencional.
7ª série / 8º ano 2º bimestre U. E. 10
 7ª série / 8º ano 2º bimestre U. E. 10 Tipos de reprodução Reprodução é a capacidade que os seres vivos têm de gerar descendentes da mesma espécie. A união dos gametas é chamada fecundação, ou fertilização,
7ª série / 8º ano 2º bimestre U. E. 10 Tipos de reprodução Reprodução é a capacidade que os seres vivos têm de gerar descendentes da mesma espécie. A união dos gametas é chamada fecundação, ou fertilização,
ANATOMIA E FISIOLOGIA DO SISTEMA REPRODUTOR FEMININO. Curso Inicial & Integração Novos Representantes
 ANATOMIA E FISIOLOGIA DO SISTEMA REPRODUTOR FEMININO Curso Inicial & Integração Novos Representantes 1 SISTEMA REPRODUTOR FEMININO O conjunto de órgãos do sistema reprodutor feminino tem como função principal
ANATOMIA E FISIOLOGIA DO SISTEMA REPRODUTOR FEMININO Curso Inicial & Integração Novos Representantes 1 SISTEMA REPRODUTOR FEMININO O conjunto de órgãos do sistema reprodutor feminino tem como função principal
OVÁRIOS. Fonte de gametas e hormônios
 OVÁRIOS Fonte de gametas e hormônios OVOGÊNESE No feto células germinativas multiplicamse ovogônias Cresce meiose I para na prófase I ovócito I nascimento milhares de ovócitos primários. Ovócito primário
OVÁRIOS Fonte de gametas e hormônios OVOGÊNESE No feto células germinativas multiplicamse ovogônias Cresce meiose I para na prófase I ovócito I nascimento milhares de ovócitos primários. Ovócito primário
Manual Técnico de Processamento de Sêmen para Inseminação Artificial
 Manual Técnico de Processamento de Sêmen para Inseminação Artificial 1 Introdução A Inseminação Artificial (IA) é hoje em dia o método utilizado pela generalidade dos suinicultores, pois, permite fazer
Manual Técnico de Processamento de Sêmen para Inseminação Artificial 1 Introdução A Inseminação Artificial (IA) é hoje em dia o método utilizado pela generalidade dos suinicultores, pois, permite fazer
Punção Folicular, Denudação e Classificação Oocitária
 Punção Folicular, Denudação e Classificação Oocitária PUNÇÃO FOLICULAR Inicialmente, os oócitos eram obtidos, individualmente, por via laparoscópica, porém este tipo de procedimento exige anestesia geral
Punção Folicular, Denudação e Classificação Oocitária PUNÇÃO FOLICULAR Inicialmente, os oócitos eram obtidos, individualmente, por via laparoscópica, porém este tipo de procedimento exige anestesia geral
BIOLOGIA - 1 o ANO MÓDULO 42 APARELHO REPRODUTOR FEMININO
 BIOLOGIA - 1 o ANO MÓDULO 42 APARELHO REPRODUTOR FEMININO Fixação 1) (UERJ) O gráfico abaixo ilustra um padrão de níveis plasmáticos de vários hormônios durante o ciclo menstrual da mulher. a) Estabeleça
BIOLOGIA - 1 o ANO MÓDULO 42 APARELHO REPRODUTOR FEMININO Fixação 1) (UERJ) O gráfico abaixo ilustra um padrão de níveis plasmáticos de vários hormônios durante o ciclo menstrual da mulher. a) Estabeleça
Professor Fernando Stuchi
 REPRODUÇÃO Aulas 2 a 5 1º Bimestre Professor Fernando Stuchi Seres Vivos Segundo a Teoria Celular, todos os seres vivos (animais e vegetais) são constituídos por células (exceção dos vírus que não possuem
REPRODUÇÃO Aulas 2 a 5 1º Bimestre Professor Fernando Stuchi Seres Vivos Segundo a Teoria Celular, todos os seres vivos (animais e vegetais) são constituídos por células (exceção dos vírus que não possuem
INSEMINAÇÃO ARTIFICIAL EM TEMPO FIXO
 Universidade Federal do Ceará INSEMINAÇÃO ARTIFICIAL EM TEMPO FIXO Doutorando: MV Msc Rodrigo Vasconcelos de Oliveira Introdução Bovinocultura=> + eficiência reprodutiva Limitações: Anestro pós-parto longo
Universidade Federal do Ceará INSEMINAÇÃO ARTIFICIAL EM TEMPO FIXO Doutorando: MV Msc Rodrigo Vasconcelos de Oliveira Introdução Bovinocultura=> + eficiência reprodutiva Limitações: Anestro pós-parto longo
Unidade 1 - REPRODUÇÃO E MANIPULAÇÃO DA FERTILIDADE
 Que modificações ocorrem no organismo feminino após a nidação? A nidação e as primeiras fases de gestação encontram-se sob estreito controlo hormonal. A hormona hcg estimula o corpo lúteo a produzir hormonas,
Que modificações ocorrem no organismo feminino após a nidação? A nidação e as primeiras fases de gestação encontram-se sob estreito controlo hormonal. A hormona hcg estimula o corpo lúteo a produzir hormonas,
Quais hormônios regulam a ovogênese?
 Controle Endócrino da Ovogênese Ciclo Sexual Feminino Prof. Dr. Wellerson Rodrigo Scarano Departamento de Morfologia 1 Quais hormônios regulam a ovogênese? 2 1 CONTROLE HORMONAL DA OVOGÊNESE A ovogênese
Controle Endócrino da Ovogênese Ciclo Sexual Feminino Prof. Dr. Wellerson Rodrigo Scarano Departamento de Morfologia 1 Quais hormônios regulam a ovogênese? 2 1 CONTROLE HORMONAL DA OVOGÊNESE A ovogênese
CONHECENDO UMA CENTRAL DE INSEMINAÇÃO ARTIFICIAL
 CONHECENDO UMA CENTRAL DE INSEMINAÇÃO ARTIFICIAL Entrevistado: Marcelo Brandi Vieira Mestre em Reprodução Animal Diretor Técnico da Progen Inseminação Artificial BI: Qual a importância da Inseminação Artificial
CONHECENDO UMA CENTRAL DE INSEMINAÇÃO ARTIFICIAL Entrevistado: Marcelo Brandi Vieira Mestre em Reprodução Animal Diretor Técnico da Progen Inseminação Artificial BI: Qual a importância da Inseminação Artificial
EMBRIOLOGIA HUMANA. -Disciplina: Genética e Embriologia. -Profª: Ana Cristina Confortin -2014/1
 EMBRIOLOGIA HUMANA -Disciplina: Genética e Embriologia -Profª: Ana Cristina Confortin -2014/1 ÚTERO * Compreender a estrutura do tero é base para compreensão dos ciclos reprodutivos e da implantação do
EMBRIOLOGIA HUMANA -Disciplina: Genética e Embriologia -Profª: Ana Cristina Confortin -2014/1 ÚTERO * Compreender a estrutura do tero é base para compreensão dos ciclos reprodutivos e da implantação do
Manejo reprodutivo de caprinos e ovinos
 Manejo reprodutivo de caprinos e ovinos Professor: Aparecido Porto da Costa Disciplina: Caprinovinocultura E-mail: aparecidoport@hotmail.com Introdução Importância Produtividade do rebanho => obter sucesso
Manejo reprodutivo de caprinos e ovinos Professor: Aparecido Porto da Costa Disciplina: Caprinovinocultura E-mail: aparecidoport@hotmail.com Introdução Importância Produtividade do rebanho => obter sucesso
DE CRIADOR PARA CRIADOR
 DE CRIADOR PARA CRIADOR No clima para a máxima produção com qualidade. Altitude e temperatura perfeitas. O resultado são rebanhos com máxima produção de sêmen com qualidade, para você vender sempre mais.
DE CRIADOR PARA CRIADOR No clima para a máxima produção com qualidade. Altitude e temperatura perfeitas. O resultado são rebanhos com máxima produção de sêmen com qualidade, para você vender sempre mais.
FECUNDAÇÃO FECUNDAÇÃO OU FERTILIZAÇÃO
 FECUNDAÇÃO Prof. Dr. Wellerson Rodrigo Scarano Departamento de Morfologia 1 FECUNDAÇÃO OU FERTILIZAÇÃO Processo pelo qual o gameta masculino (espermatozóide) se une ao gameta feminino (ovócito) para formar
FECUNDAÇÃO Prof. Dr. Wellerson Rodrigo Scarano Departamento de Morfologia 1 FECUNDAÇÃO OU FERTILIZAÇÃO Processo pelo qual o gameta masculino (espermatozóide) se une ao gameta feminino (ovócito) para formar
1.1 Revisão de tópicos da morfologia e fisiologia do sistema genital feminino, sob o aspecto clínico nas diferentes espécies domésticas.
 PROGRAMA PARA O CONCURSO PÚBLICO PARA PROVIMENTO DAS VAGAS PARA O CARGO DE PROFESSOR ADJUNTO, EDITAL Nº 764, DE 23 DE NOVEMBRO DE 2015, NA ÁREA DE REPRODUÇÃO ANIMAL 1) FÊMEA - PARTE TEÓRICA: 1.1 Revisão
PROGRAMA PARA O CONCURSO PÚBLICO PARA PROVIMENTO DAS VAGAS PARA O CARGO DE PROFESSOR ADJUNTO, EDITAL Nº 764, DE 23 DE NOVEMBRO DE 2015, NA ÁREA DE REPRODUÇÃO ANIMAL 1) FÊMEA - PARTE TEÓRICA: 1.1 Revisão
SISTEMA REPRODUTOR. Sistema reprodutor feminino
 SISTEMA REPRODUTOR A reprodução é de importância tremenda para os seres vivos, pois é por meio dela que os organismos transmitem suas características hereditariamente e garantem a sobrevivência de suas
SISTEMA REPRODUTOR A reprodução é de importância tremenda para os seres vivos, pois é por meio dela que os organismos transmitem suas características hereditariamente e garantem a sobrevivência de suas
NUTRIÇÃO DE OVELHAS GESTANTES
 NUTRIÇÃO DE OVELHAS GESTANTES Acadêmicas: Caroline Wrague e Luiza P. Nunes INTRODUÇÃO: A produção ovina ocorre predominantemente em sistemas de criação extensiva no Sul do Brasil. A quantidade e qualidade
NUTRIÇÃO DE OVELHAS GESTANTES Acadêmicas: Caroline Wrague e Luiza P. Nunes INTRODUÇÃO: A produção ovina ocorre predominantemente em sistemas de criação extensiva no Sul do Brasil. A quantidade e qualidade
TECNICAS DE AMPLIFICAÇÃO REPRODUTIVA E DE BIOTECNOLOGIA APLICADAS AO MELHORAMENTO ANIMAL
 MINISTÉRIO DA EDUCAÇÃO UNIVERSIDADE FEDERAL DE PELOTAS FACULDADE DE AGRONOMIA ELISEU MACIEL DEPARTAMENTO DE ZOOTECNIA MELHORAMENTO ANIMAL TECNICAS DE AMPLIFICAÇÃO REPRODUTIVA E DE BIOTECNOLOGIA APLICADAS
MINISTÉRIO DA EDUCAÇÃO UNIVERSIDADE FEDERAL DE PELOTAS FACULDADE DE AGRONOMIA ELISEU MACIEL DEPARTAMENTO DE ZOOTECNIA MELHORAMENTO ANIMAL TECNICAS DE AMPLIFICAÇÃO REPRODUTIVA E DE BIOTECNOLOGIA APLICADAS
Classificação: valores
 ESCOLA SECUNDÁRIA DE CASQUILHOS BARREIRO 1º Teste Sumativo DISCIPLINA DE BIOLOGIA 12ºano Turma A TEMA : Reprodução Humana 20 de Outubro de 2011 90 minutos Nome: Nº Classificação: valores A professora:
ESCOLA SECUNDÁRIA DE CASQUILHOS BARREIRO 1º Teste Sumativo DISCIPLINA DE BIOLOGIA 12ºano Turma A TEMA : Reprodução Humana 20 de Outubro de 2011 90 minutos Nome: Nº Classificação: valores A professora:
O que é gametogênese?
 O que é gametogênese? É o processo pelo qual os gametas são produzidos nos organismos dotados de reprodução sexuada. Nos animais, a gametogênese acontece nas gônadas, órgãos que também produzem os hormônios
O que é gametogênese? É o processo pelo qual os gametas são produzidos nos organismos dotados de reprodução sexuada. Nos animais, a gametogênese acontece nas gônadas, órgãos que também produzem os hormônios
Gabriel Mantelato Rogatto Graduando 3º ano Zootecnia
 Gabriel Mantelato Rogatto Graduando 3º ano Zootecnia Introdução Brasil -> Nordeste Maior Produtor II)Canindé - Leite I)Boer - Carne III)Saanen - Leite Retirado de: www.caprilproduction.com Manejo Reprodutivo
Gabriel Mantelato Rogatto Graduando 3º ano Zootecnia Introdução Brasil -> Nordeste Maior Produtor II)Canindé - Leite I)Boer - Carne III)Saanen - Leite Retirado de: www.caprilproduction.com Manejo Reprodutivo
GAMETOGÊNESE. especializadas chamadas de GAMETAS. As células responsáveis pela formação desses gametas são chamadas de GÔNIAS
 Embriologia GAMETOGÊNESE É o processo de formação e desenvolvimento de células especializadas chamadas de GAMETAS As células responsáveis pela formação desses gametas são chamadas de GÔNIAS Espermatogônias
Embriologia GAMETOGÊNESE É o processo de formação e desenvolvimento de células especializadas chamadas de GAMETAS As células responsáveis pela formação desses gametas são chamadas de GÔNIAS Espermatogônias
UNIVERSIDADE FEDERAL RURAL DE PERNAMBUCO DEPARTAMENTO DE ZOOTECNIA BOVINOS LEITEIROS
 UNIVERSIDADE FEDERAL RURAL DE PERNAMBUCO DEPARTAMENTO DE ZOOTECNIA BOVINOS LEITEIROS Prof. Ricardo Alexandre Silva Pessoa MANEJO DE VACAS SECAS E PERÍODO DE TRANSIÇÃO ponto de vista tecnológico = alimentar
UNIVERSIDADE FEDERAL RURAL DE PERNAMBUCO DEPARTAMENTO DE ZOOTECNIA BOVINOS LEITEIROS Prof. Ricardo Alexandre Silva Pessoa MANEJO DE VACAS SECAS E PERÍODO DE TRANSIÇÃO ponto de vista tecnológico = alimentar
Exercícios de Reprodução Comparada
 Exercícios de Reprodução Comparada Material de apoio do Extensivo 1. (PUC) Os seres vivos podem reproduzir-se sexuada ou assexuadamente. Sobre este assunto, destaque a afirmativa correta: a) A reprodução
Exercícios de Reprodução Comparada Material de apoio do Extensivo 1. (PUC) Os seres vivos podem reproduzir-se sexuada ou assexuadamente. Sobre este assunto, destaque a afirmativa correta: a) A reprodução
Inseminação Artificial em Tempo Fixo em Vacas Leiteiras
 Inseminação Artificial em Tempo Fixo em Vacas Leiteiras Serviços em Pecuária de Leite Avaliação Ginecológica e Diagnóstico de Gestação com Aparelho de Ultrassonografia Exames Laboratoriais IATF Inseminação
Inseminação Artificial em Tempo Fixo em Vacas Leiteiras Serviços em Pecuária de Leite Avaliação Ginecológica e Diagnóstico de Gestação com Aparelho de Ultrassonografia Exames Laboratoriais IATF Inseminação
Guia do Professor Atividade - Regulação neuro-endócrina do ciclo menstrual
 Guia do Professor Atividade - Regulação neuro-endócrina do ciclo menstrual Caro Professor, O principal objetivo do projeto RIVED é oferecer aos professores do Ensino Médio novos recursos didáticos, em
Guia do Professor Atividade - Regulação neuro-endócrina do ciclo menstrual Caro Professor, O principal objetivo do projeto RIVED é oferecer aos professores do Ensino Médio novos recursos didáticos, em
HISTOLOGIA. Folículos ovarianos
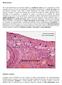 HISTOLOGIA No ovário identificamos duas porções distintas: a medula do ovário, que é constituída por tecido conjuntivo frouxo, rico em vasos sangüíneos, célula hilares (intersticiais), e a córtex do ovário,
HISTOLOGIA No ovário identificamos duas porções distintas: a medula do ovário, que é constituída por tecido conjuntivo frouxo, rico em vasos sangüíneos, célula hilares (intersticiais), e a córtex do ovário,
Curso de inseminação artificial da Alta dá dicas de como aumentar a rentabilidade em sua fazenda
 São Paulo, 12 março de 2014 Curso de inseminação artificial da Alta dá dicas de como aumentar a rentabilidade em sua fazenda Suprir a demanda de mercado com produtos de qualidade e sustentáveis. Este é
São Paulo, 12 março de 2014 Curso de inseminação artificial da Alta dá dicas de como aumentar a rentabilidade em sua fazenda Suprir a demanda de mercado com produtos de qualidade e sustentáveis. Este é
Ciclo Menstrual. Ciclo Menstrual. Ciclo ovariano. Ciclo ovariano 17/08/2014. (primeira menstruação) (ausência de menstruação por 1 ano)
 CICLO MENSTRUAL Ciclo Menstrual A maioria das mulheres passará por 300 a 400 ciclos menstruais durante sua vida Os ciclos variam entre 21 a 36 dias, em média 28 dias O sangramento dura de 3 a 8 dias A
CICLO MENSTRUAL Ciclo Menstrual A maioria das mulheres passará por 300 a 400 ciclos menstruais durante sua vida Os ciclos variam entre 21 a 36 dias, em média 28 dias O sangramento dura de 3 a 8 dias A
MELHORAMENTO GENÉTICO
 MELHORAMENTO GENÉTICO Mudança do material hereditário do rebanho de forma a capacitá-lo para produzir leite, mais economicamente em um determinado ambiente. Genética é a ciência que estuda a variação e
MELHORAMENTO GENÉTICO Mudança do material hereditário do rebanho de forma a capacitá-lo para produzir leite, mais economicamente em um determinado ambiente. Genética é a ciência que estuda a variação e
vacina? se produz uma
 Como vacina? se produz uma A tecnologia Este é o Instituto Butantan, o maior produtor de vacinas e soros da América Latina e cujo maior cliente atualmente é o Ministério da Saúde. Já a tecnologia original
Como vacina? se produz uma A tecnologia Este é o Instituto Butantan, o maior produtor de vacinas e soros da América Latina e cujo maior cliente atualmente é o Ministério da Saúde. Já a tecnologia original
Fisiologia Endócrina do Sistema Reprodutivo
 Fisiologia Endócrina do Sistema Reprodutivo Profa. Letícia Lotufo Função Reprodutiva: Diferenciação sexual Função Testicular Função Ovariana Antes e durante a gravidez 1 Diferenciação sexual Sexo Genético
Fisiologia Endócrina do Sistema Reprodutivo Profa. Letícia Lotufo Função Reprodutiva: Diferenciação sexual Função Testicular Função Ovariana Antes e durante a gravidez 1 Diferenciação sexual Sexo Genético
Inseminação Artificial em Tempo Fixo (IATF) Em Bovinos Leiteiros
 Gado de Leite 1/35 Inseminação Artificial em Tempo Fixo (IATF) Em Bovinos Leiteiros Erick Fonseca de Castilho Doutor em Reprodução Animal (UFV/MG) efcmv@yahoo.com.br 2/35 Introdução Cronologia dos conceitos
Gado de Leite 1/35 Inseminação Artificial em Tempo Fixo (IATF) Em Bovinos Leiteiros Erick Fonseca de Castilho Doutor em Reprodução Animal (UFV/MG) efcmv@yahoo.com.br 2/35 Introdução Cronologia dos conceitos
Tradução para o português: R. Nunes e L.A de Castro e Paula. DIA ( ) 2 (para referência, dia 0 = dia da fertilização) PREPARAÇÃO
 Protocolo de Fertilização In Vitro em Bovinos R.M Rivera, A.M. Brad, J.L. Edwards, A.D. Ealy, V.M. Monterroso, A.C. Majewski, C.M. Franco, and P.J. Hansen Tradução para o português: R. Nunes e L.A de Castro
Protocolo de Fertilização In Vitro em Bovinos R.M Rivera, A.M. Brad, J.L. Edwards, A.D. Ealy, V.M. Monterroso, A.C. Majewski, C.M. Franco, and P.J. Hansen Tradução para o português: R. Nunes e L.A de Castro
CIÊNCIAS DA NATUREZA REVISÃO 1 REVISÃO 2 INTERATIVIDADE SISTEMA SOLAR
 SISTEMA SOLAR 2 Aula de Revisão 1 Planeta terra Somos todos habitantes do planeta Terra. É nosso dever mantê-lo habitável. 3 Planeta Terra habitável 4 Planeta Terra não habitável 5 Dicas para cuidar melhor
SISTEMA SOLAR 2 Aula de Revisão 1 Planeta terra Somos todos habitantes do planeta Terra. É nosso dever mantê-lo habitável. 3 Planeta Terra habitável 4 Planeta Terra não habitável 5 Dicas para cuidar melhor
Curso de Capacitação em Biossegurança de OGMs Células-tronco Legislação de Biossegurança
 Curso de Capacitação em Biossegurança de OGMs Células-tronco Legislação de Biossegurança Florianópolis, Agosto 2004 Células-tronco O que são células-tronco e o que podemos fazer com elas? Qual a relação
Curso de Capacitação em Biossegurança de OGMs Células-tronco Legislação de Biossegurança Florianópolis, Agosto 2004 Células-tronco O que são células-tronco e o que podemos fazer com elas? Qual a relação
UM NOVO FOCO NA GESTÃO DAS CENTRAIS DE INSEMINAÇÃO
 UM NOVO FOCO NA GESTÃO DAS CENTRAIS DE INSEMINAÇÃO No inicio da inseminação artificial (IA) no Brasil, em meados da década de 1970, os principais argumentos gerenciais dos técnicos e produtores para a
UM NOVO FOCO NA GESTÃO DAS CENTRAIS DE INSEMINAÇÃO No inicio da inseminação artificial (IA) no Brasil, em meados da década de 1970, os principais argumentos gerenciais dos técnicos e produtores para a
EDIVAN SILVO DE OLIVEIRA TRABALHO DE CONCLUSÃO DE CURSO
 0 EDIVAN SILVO DE OLIVEIRA TRABALHO DE CONCLUSÃO DE CURSO CAMPO GRANDE - MS 2011 1 I EDIVAN SILVO DE OLIVEIRA REPRODUÇÃO DE BOVINOS Trabalho apresentado para cumprimento de Avaliação do curso de especialização
0 EDIVAN SILVO DE OLIVEIRA TRABALHO DE CONCLUSÃO DE CURSO CAMPO GRANDE - MS 2011 1 I EDIVAN SILVO DE OLIVEIRA REPRODUÇÃO DE BOVINOS Trabalho apresentado para cumprimento de Avaliação do curso de especialização
EFICIÊNCIA REPRODUTIVA EMPRENHAR A VACA O MAIS RÁPIDO POSSÍVEL APÓS O PARTO
 TIAGO LEIVA EFICIÊNCIA REPRODUTIVA EMPRENHAR A VACA O MAIS RÁPIDO POSSÍVEL APÓS O PARTO Cria em gado de corte: o bezerro é o produto comercializado. Gado de leite (alta produção): a vaca precisa parir
TIAGO LEIVA EFICIÊNCIA REPRODUTIVA EMPRENHAR A VACA O MAIS RÁPIDO POSSÍVEL APÓS O PARTO Cria em gado de corte: o bezerro é o produto comercializado. Gado de leite (alta produção): a vaca precisa parir
CAPACITAÇÃO ESPERMÁTICA. capacitação. Vaca: 6 a 7 horas Porca: 1 a 2 horas
 CAPACITAÇÃO ESPERMÁTICA Ejaculação sptz fêmea aptos a fertilização capacitação Vaca: 6 a 7 horas Porca: 1 a 2 horas CAPACITAÇÃO ESPERMÁTICA Processo mediado por proteínas das glândulas sexuais acessórias
CAPACITAÇÃO ESPERMÁTICA Ejaculação sptz fêmea aptos a fertilização capacitação Vaca: 6 a 7 horas Porca: 1 a 2 horas CAPACITAÇÃO ESPERMÁTICA Processo mediado por proteínas das glândulas sexuais acessórias
PUBERDADE. Fase fisiológica com duração de 2 a 5 anos, durante a qual ocorre a maturação sexual
 Puberdade PUBERDADE Transição entre a infância e a vida adulta Transformações físicas e psíquicas complexas Fase fisiológica com duração de 2 a 5 anos, durante a qual ocorre a maturação sexual Desenvolvimento
Puberdade PUBERDADE Transição entre a infância e a vida adulta Transformações físicas e psíquicas complexas Fase fisiológica com duração de 2 a 5 anos, durante a qual ocorre a maturação sexual Desenvolvimento
As proteínas transportadoras
 As proteínas transportadoras 10 A U L A objetivos Ao final desta aula, você deverá compreender o que são: Proteínas transportadoras: carreadores e canais. Aquaporinas. Biologia Celular As proteínas transportadoras
As proteínas transportadoras 10 A U L A objetivos Ao final desta aula, você deverá compreender o que são: Proteínas transportadoras: carreadores e canais. Aquaporinas. Biologia Celular As proteínas transportadoras
42º Congresso Bras. de Medicina Veterinária e 1º Congresso Sul-Brasileiro da ANCLIVEPA - 31/10 a 02/11 de 2015 - Curitiba - PR 1
 1 SISTEMA ANTILUTEOLÍTICO E MORTE EMBRIONÁRIA EM FÊMEAS BOVINAS JEAN CAIO FIGUEIREDO DE ALMEIDA¹, ANA KELLY MENDES DA SILVA¹, GESSIANE PEREIRA DA SILVA¹, BRENDA JULIANE SILVA DOS SANTOS¹, CAMILA DE ALMEIDA
1 SISTEMA ANTILUTEOLÍTICO E MORTE EMBRIONÁRIA EM FÊMEAS BOVINAS JEAN CAIO FIGUEIREDO DE ALMEIDA¹, ANA KELLY MENDES DA SILVA¹, GESSIANE PEREIRA DA SILVA¹, BRENDA JULIANE SILVA DOS SANTOS¹, CAMILA DE ALMEIDA
SAÚDE DA MULHER FACULDADE PITÁGORAS BETIM PROFª DANIELE REZENDE FISIOLOGIA DO SISTEMA REPRODUTOR FEMININO
 SAÚDE DA MULHER FACULDADE PITÁGORAS BETIM PROFª DANIELE REZENDE FISIOLOGIA DO SISTEMA REPRODUTOR FEMININO SISTEMA REPRODUTOR FEMININO As estruturas reprodutivas femininas externas e internas desenvolvem-se
SAÚDE DA MULHER FACULDADE PITÁGORAS BETIM PROFª DANIELE REZENDE FISIOLOGIA DO SISTEMA REPRODUTOR FEMININO SISTEMA REPRODUTOR FEMININO As estruturas reprodutivas femininas externas e internas desenvolvem-se
CHECK - LIST - ISO 9001:2000
 REQUISITOS ISO 9001: 2000 SIM NÃO 1.2 APLICAÇÃO A organização identificou as exclusões de itens da norma no seu manual da qualidade? As exclusões são relacionadas somente aos requisitos da sessão 7 da
REQUISITOS ISO 9001: 2000 SIM NÃO 1.2 APLICAÇÃO A organização identificou as exclusões de itens da norma no seu manual da qualidade? As exclusões são relacionadas somente aos requisitos da sessão 7 da
DA MULHER Manual prático para viver com saúde os melhores anos da vida
 Dr. JOSÉ BENTO Médico ginecologista e obstetra A MELHOR IDADE DA MULHER Manual prático para viver com saúde os melhores anos da vida Sumário Apresentação... 7 Introdução... 11 Capítulo 1 Um corpo de mudanças...
Dr. JOSÉ BENTO Médico ginecologista e obstetra A MELHOR IDADE DA MULHER Manual prático para viver com saúde os melhores anos da vida Sumário Apresentação... 7 Introdução... 11 Capítulo 1 Um corpo de mudanças...
Comparação do ganho de peso e desempenho de bezerras alimentadas com leite de descarte e leite normal durante a fase de aleitamento
 Comparação do ganho de peso e desempenho de bezerras alimentadas com leite de descarte e leite normal durante a fase de aleitamento Vinicius Emanoel Carvalho 1, Thiago Paim Silva 1, Marco Antônio Faria
Comparação do ganho de peso e desempenho de bezerras alimentadas com leite de descarte e leite normal durante a fase de aleitamento Vinicius Emanoel Carvalho 1, Thiago Paim Silva 1, Marco Antônio Faria
(www.gineco.com.br) Com relação às alterações hormonais que ocorrem no ciclo menstrual, é correto afirmar que
 01 - (Unicastelo SP) O gráfico representa os níveis de concentração dos diferentes hormônios femininos, no organismo, durante o ciclo menstrual. (www.gineco.com.br) Com relação às alterações hormonais
01 - (Unicastelo SP) O gráfico representa os níveis de concentração dos diferentes hormônios femininos, no organismo, durante o ciclo menstrual. (www.gineco.com.br) Com relação às alterações hormonais
Laboratórios de Pesquisa da Biologia
 Laboratórios de Pesquisa da Biologia 1 - Laboratório de Biologia e Ecologia Animal (B 1.01) Conta com um espaço físico de 12m x 12m (144m²) phmetro ou medidor de ph: é um aparelho usado para medição de
Laboratórios de Pesquisa da Biologia 1 - Laboratório de Biologia e Ecologia Animal (B 1.01) Conta com um espaço físico de 12m x 12m (144m²) phmetro ou medidor de ph: é um aparelho usado para medição de
COMPOSIÇÃO QUÍMICA DA CARNE. Profª Sandra Carvalho
 COMPOSIÇÃO QUÍMICA DA CARNE Profª Sandra Carvalho A carne magra: 75% de água 21 a 22% de proteína 1 a 2% de gordura 1% de minerais menos de 1% de carboidratos A carne magra dos diferentes animais de abate
COMPOSIÇÃO QUÍMICA DA CARNE Profª Sandra Carvalho A carne magra: 75% de água 21 a 22% de proteína 1 a 2% de gordura 1% de minerais menos de 1% de carboidratos A carne magra dos diferentes animais de abate
GUIA PARA PACIENTES. Anotações
 Anotações ENTENDENDO DO OS MIOMAS MAS UTERINOS GUIA PARA PACIENTES 1620641 - Produzido em maio/2010 AstraZeneca do Brasil Ltda. Rodovia Raposo Tavares, km 26,9 CEP 06707-000 - Cotia/SP ACCESS net/sac 0800
Anotações ENTENDENDO DO OS MIOMAS MAS UTERINOS GUIA PARA PACIENTES 1620641 - Produzido em maio/2010 AstraZeneca do Brasil Ltda. Rodovia Raposo Tavares, km 26,9 CEP 06707-000 - Cotia/SP ACCESS net/sac 0800
INTRODUÇÃO A etapa de cria na cadeia produtiva da carne bovina é muito importante, e caracteriza-se como um período fundamental no processo de
 d e b e z e r r o d e c o r t e INTRODUÇÃO A etapa de cria na cadeia produtiva da carne bovina é muito importante, e caracteriza-se como um período fundamental no processo de produção. As técnicas utilizadas
d e b e z e r r o d e c o r t e INTRODUÇÃO A etapa de cria na cadeia produtiva da carne bovina é muito importante, e caracteriza-se como um período fundamental no processo de produção. As técnicas utilizadas
EMATER PARANÁ CONDOMÍNIOS DE INSEMINAÇÃO ARTIFICIAL: UMA PROPOSTA DE MELHORAMENTO GENÉTICO EM BOVINOS DE LEITE NO MUNICÍPIO DE TOLEDO PR.
 EMATER PARANÁ CONDOMÍNIOS DE INSEMINAÇÃO ARTIFICIAL: UMA PROPOSTA DE MELHORAMENTO GENÉTICO EM BOVINOS DE LEITE NO MUNICÍPIO DE TOLEDO PR. Gelson Hein Médico Veterinário Unidade Local de Toledo NOVEMBRO
EMATER PARANÁ CONDOMÍNIOS DE INSEMINAÇÃO ARTIFICIAL: UMA PROPOSTA DE MELHORAMENTO GENÉTICO EM BOVINOS DE LEITE NO MUNICÍPIO DE TOLEDO PR. Gelson Hein Médico Veterinário Unidade Local de Toledo NOVEMBRO
REPRODUÇÃO HUMANA. Profª Fernanda Biazin
 REPRODUÇÃO HUMANA Profª Fernanda Biazin Puberdade: período de transição do desenvolvimento humano, correspondente à passagem da fase da infância para adolescência. Alterações morfológicas e fisiológicas
REPRODUÇÃO HUMANA Profª Fernanda Biazin Puberdade: período de transição do desenvolvimento humano, correspondente à passagem da fase da infância para adolescência. Alterações morfológicas e fisiológicas
FILIAÇÃO NA FECUNDAÇÃO IN VITRO. Thiago Kotula Brondani
 1 FILIAÇÃO NA FECUNDAÇÃO IN VITRO Thiago Kotula Brondani Os avanços médicos-científicos e a disseminação das técnicas de reprodução humana assistida tornaram necessária a imposição de limites éticos e
1 FILIAÇÃO NA FECUNDAÇÃO IN VITRO Thiago Kotula Brondani Os avanços médicos-científicos e a disseminação das técnicas de reprodução humana assistida tornaram necessária a imposição de limites éticos e
SISTEMA REPRODUTOR FEMININO. Professor: João Paulo
 SISTEMA REPRODUTOR FEMININO Professor: João Paulo SISTEMA REPRODUTOR FEMININO É constituído por: uma vulva (genitália externa), uma vagina, um útero, duas tubas uterinas (ovidutos ou trompas de Falópio),
SISTEMA REPRODUTOR FEMININO Professor: João Paulo SISTEMA REPRODUTOR FEMININO É constituído por: uma vulva (genitália externa), uma vagina, um útero, duas tubas uterinas (ovidutos ou trompas de Falópio),
GAMETOGÊNESES & SISTEMAS REPRODUTORES HUMANOS PROF. CARLOS FREDERICO
 GAMETOGÊNESES & SISTEMAS REPRODUTORES HUMANOS PROF. CARLOS FREDERICO GAMETOGÊNESES O processo de formação de gametas, na maioria dos animais, se dád através s da meiose e recebe a denominação de gametogênese..
GAMETOGÊNESES & SISTEMAS REPRODUTORES HUMANOS PROF. CARLOS FREDERICO GAMETOGÊNESES O processo de formação de gametas, na maioria dos animais, se dád através s da meiose e recebe a denominação de gametogênese..
COMPROMETIMENTO COM OS ANIMAIS, RESPEITO POR QUEM OS AMA.
 COMPROMETIMENTO COM OS ANIMAIS, RESPEITO POR QUEM OS AMA. CITOLOGIA CLÍNICA O exame citológico é uma das grandes ferramentas para auxiliar o médico veterinário no diagnóstico, prognóstico e na tomada de
COMPROMETIMENTO COM OS ANIMAIS, RESPEITO POR QUEM OS AMA. CITOLOGIA CLÍNICA O exame citológico é uma das grandes ferramentas para auxiliar o médico veterinário no diagnóstico, prognóstico e na tomada de
ANÁLISE MERCADOLÓGICA DE EMBRIÕES ZEBUÍNOS PRODUZIDOS A PARTIR DA TÉCNICA DE FERTILIZAÇÃO IN VITRO - FIV
 ANÁLISE MERCADOLÓGICA DE EMBRIÕES ZEBUÍNOS PRODUZIDOS A PARTIR DA TÉCNICA DE FERTILIZAÇÃO IN VITRO - FIV Autor: Jorge Dias da Silva (SILVA, J. D.) E-mail: jorge@simaoedias.com Tel: 34 9202 1195 1 - INTRODUÇÃO
ANÁLISE MERCADOLÓGICA DE EMBRIÕES ZEBUÍNOS PRODUZIDOS A PARTIR DA TÉCNICA DE FERTILIZAÇÃO IN VITRO - FIV Autor: Jorge Dias da Silva (SILVA, J. D.) E-mail: jorge@simaoedias.com Tel: 34 9202 1195 1 - INTRODUÇÃO
TOTVS Gestão Hospitalar Manual Ilustrado Central de Material Esterilizado. 11.8x. março de 2015 Versão: 3.0
 TOTVS Gestão Hospitalar Manual Ilustrado Central de Material Esterilizado 11.8x março de 2015 Versão: 3.0 1 Sumário 1 Objetivos... 4 2 Introdução... 4 3 Cadastros... 5 3.1 Cadastros de Unidades de CME...
TOTVS Gestão Hospitalar Manual Ilustrado Central de Material Esterilizado 11.8x março de 2015 Versão: 3.0 1 Sumário 1 Objetivos... 4 2 Introdução... 4 3 Cadastros... 5 3.1 Cadastros de Unidades de CME...
ZAP Zambezia Agro Pecuaria Lda - Mozambique DESENVOLVIMENTO DE GADO LEITEIRO GIROLANDA FERTILIZACAO IN VITRO IVF
 1 ZAP Zambezia Agro Pecuaria Lda - Mozambique DESENVOLVIMENTO DE GADO LEITEIRO GIROLANDA FERTILIZACAO IN VITRO IVF 2 Capitulo 1 - Parceiros e Principal Fornecedor. Parceiros do projeto In Vitro Brasil
1 ZAP Zambezia Agro Pecuaria Lda - Mozambique DESENVOLVIMENTO DE GADO LEITEIRO GIROLANDA FERTILIZACAO IN VITRO IVF 2 Capitulo 1 - Parceiros e Principal Fornecedor. Parceiros do projeto In Vitro Brasil
Aos bioquímicos, técnicos de laboratório e estagiários do setor de imunologia.
 POP-I 67 Página 1 de 5 1. Sinonímia Teste rápido Anti-½ - OraQuick ADVANCE 2. Aplicabilidade Aos bioquímicos, técnicos de laboratório e estagiários do setor de imunologia. 3. Aplicação clínica O ensaio
POP-I 67 Página 1 de 5 1. Sinonímia Teste rápido Anti-½ - OraQuick ADVANCE 2. Aplicabilidade Aos bioquímicos, técnicos de laboratório e estagiários do setor de imunologia. 3. Aplicação clínica O ensaio
A IMPORTÂNCIA DAS DISCIPLINAS DE MATEMÁTICA E FÍSICA NO ENEM: PERCEPÇÃO DOS ALUNOS DO CURSO PRÉ- UNIVERSITÁRIO DA UFPB LITORAL NORTE
 A IMPORTÂNCIA DAS DISCIPLINAS DE MATEMÁTICA E FÍSICA NO ENEM: PERCEPÇÃO DOS ALUNOS DO CURSO PRÉ- UNIVERSITÁRIO DA UFPB LITORAL NORTE ALMEIDA 1, Leonardo Rodrigues de SOUSA 2, Raniere Lima Menezes de PEREIRA
A IMPORTÂNCIA DAS DISCIPLINAS DE MATEMÁTICA E FÍSICA NO ENEM: PERCEPÇÃO DOS ALUNOS DO CURSO PRÉ- UNIVERSITÁRIO DA UFPB LITORAL NORTE ALMEIDA 1, Leonardo Rodrigues de SOUSA 2, Raniere Lima Menezes de PEREIRA
 Gestação de Substituição ASPECTOS PSICOLÓGICOS II Simpósio de Direito Biomédico OAB Cássia Cançado Avelar Psicóloga Centro Pró-Criar Gestação de Substituição Esse tratamento é indicado para pacientes que
Gestação de Substituição ASPECTOS PSICOLÓGICOS II Simpósio de Direito Biomédico OAB Cássia Cançado Avelar Psicóloga Centro Pró-Criar Gestação de Substituição Esse tratamento é indicado para pacientes que
ZOOLOGIA E HISTOLOGIA ANIMAL
 ZOOLOGIA E HISTOLOGIA ANIMAL Sistema Endócrino Prof. Fernando Stuchi Introdução Os mensageiros químicos do corpo (hormônios) são produzidos pelas glândulas endócrinas ou glândulas de secreção interna,
ZOOLOGIA E HISTOLOGIA ANIMAL Sistema Endócrino Prof. Fernando Stuchi Introdução Os mensageiros químicos do corpo (hormônios) são produzidos pelas glândulas endócrinas ou glândulas de secreção interna,
Fisiologia do Sistema Reprodutor Masculino. Carla Cristina Zeppenfeld Doutoranda Zootecnia
 Fisiologia do Sistema Reprodutor Masculino Carla Cristina Zeppenfeld Doutoranda Zootecnia Introdução Durante a gestação, a diferenciação sexual se dá ou não pela presença do hormônio antimülleriano e da
Fisiologia do Sistema Reprodutor Masculino Carla Cristina Zeppenfeld Doutoranda Zootecnia Introdução Durante a gestação, a diferenciação sexual se dá ou não pela presença do hormônio antimülleriano e da
Entenda como é produzida uma vacina Vacina de influenza, Instituto Butantan
 Entenda como é produzida uma vacina Vacina de influenza, Instituto Butantan Imagens apresentadas pela Dra. Cosue Miyaki, pesquisadora do Instituto Butantan, em Simpósio sobre Produção de Vacinas realizado
Entenda como é produzida uma vacina Vacina de influenza, Instituto Butantan Imagens apresentadas pela Dra. Cosue Miyaki, pesquisadora do Instituto Butantan, em Simpósio sobre Produção de Vacinas realizado
Um projeto de curral para o manejo de bovinos de corte: reduzindo os custos e melhorando o bem estar animal e a eficiência do trabalho.
 Um projeto de curral para o manejo de bovinos de corte: reduzindo os custos e melhorando o bem estar animal e a eficiência do trabalho. Mateus J.R. Paranhos da Costa (Grupo ETCO, Departamento de Zootecnia,
Um projeto de curral para o manejo de bovinos de corte: reduzindo os custos e melhorando o bem estar animal e a eficiência do trabalho. Mateus J.R. Paranhos da Costa (Grupo ETCO, Departamento de Zootecnia,
LISTA DE VERIFICAÇAO DO SISTEMA DE GESTAO DA QUALIDADE
 Questionamento a alta direção: 1. Quais os objetivos e metas da organização? 2. quais os principais Produtos e/ou serviços da organização? 3. Qual o escopo da certificação? 4. qual é a Visão e Missão?
Questionamento a alta direção: 1. Quais os objetivos e metas da organização? 2. quais os principais Produtos e/ou serviços da organização? 3. Qual o escopo da certificação? 4. qual é a Visão e Missão?
Bom trabalho! FICHA DE TRABALHO BIOLOGIA 12ºANO. Grupo I ESCOLA SECUNDÁRIA DOM MANUEL MARTINS 2007/08. Tigres vs. Alunos (Descubra as diferenças!
 ESCOLA SECUNDÁRIA DOM MANUEL MARTINS 2007/08 BIOLOGIA 12ºANO FICHA DE TRABALHO Bom trabalho! Tigres vs. Alunos (Descubra as diferenças! ) Grupo I Nos estudos efectuados nos últimos anos verificou-se a
ESCOLA SECUNDÁRIA DOM MANUEL MARTINS 2007/08 BIOLOGIA 12ºANO FICHA DE TRABALHO Bom trabalho! Tigres vs. Alunos (Descubra as diferenças! ) Grupo I Nos estudos efectuados nos últimos anos verificou-se a
SELEÇÃO DE REPRODUTORES PARA A UTILIZAÇÃO DA PRODUÇÃO IN VITRO DE EMBRIÕES VITRIFICADOS
 SELEÇÃO DE REPRODUTORES PARA A UTILIZAÇÃO DA PRODUÇÃO IN VITRO DE EMBRIÕES VITRIFICADOS Orivaldo Rodrigues de Oliveira 1 ; Francisca Elda Ferreira Dias 2 ; Andréa Azevedo Pires de Castro 3. 1 Aluno do
SELEÇÃO DE REPRODUTORES PARA A UTILIZAÇÃO DA PRODUÇÃO IN VITRO DE EMBRIÕES VITRIFICADOS Orivaldo Rodrigues de Oliveira 1 ; Francisca Elda Ferreira Dias 2 ; Andréa Azevedo Pires de Castro 3. 1 Aluno do
DNA Darwin Não Atento?
 DNA Darwin Não Atento? PÁGINA 1 DE 6 CIÊNCIAS BIOLOGIA QUÍMICA Darwin foi um dos maiores cientistas de todos os tempos. Ele percebeu que variações ocorrem nas populações ou seja, diferenças são encontradas
DNA Darwin Não Atento? PÁGINA 1 DE 6 CIÊNCIAS BIOLOGIA QUÍMICA Darwin foi um dos maiores cientistas de todos os tempos. Ele percebeu que variações ocorrem nas populações ou seja, diferenças são encontradas
Minha filha está ficando uma moça!
 Minha filha está ficando uma moça! A UU L AL A O que faz as meninas se transformarem em mulheres? O que acontece com seu corpo? Em geral, todos nós, homens e mulheres, somos capazes de lembrar muito bem
Minha filha está ficando uma moça! A UU L AL A O que faz as meninas se transformarem em mulheres? O que acontece com seu corpo? Em geral, todos nós, homens e mulheres, somos capazes de lembrar muito bem
Descubra quando você está ovulando
 1 Descubra quando você está ovulando O maior segredo para engravidar logo é saber exatamente quando você está ovulando, ou seja, quando um de seus dois ovários está liberando um óvulo. Pense neste óvulo
1 Descubra quando você está ovulando O maior segredo para engravidar logo é saber exatamente quando você está ovulando, ou seja, quando um de seus dois ovários está liberando um óvulo. Pense neste óvulo
Outubro 2013 VERSÂO 1. 1. Observe a figura a lado que representa o sistema reprodutor masculino.
 BIOLOGIA 1 12º A Outubro 2013 VERSÂO 1 1. Observe a figura a lado que representa o sistema reprodutor masculino. Figura 1 1.1. Complete a legenda da figura 1. 1.2. Identifique a estrutura onde ocorre a
BIOLOGIA 1 12º A Outubro 2013 VERSÂO 1 1. Observe a figura a lado que representa o sistema reprodutor masculino. Figura 1 1.1. Complete a legenda da figura 1. 1.2. Identifique a estrutura onde ocorre a
3 Classificação. 3.1. Resumo do algoritmo proposto
 3 Classificação Este capítulo apresenta primeiramente o algoritmo proposto para a classificação de áudio codificado em MPEG-1 Layer 2 em detalhes. Em seguida, são analisadas as inovações apresentadas.
3 Classificação Este capítulo apresenta primeiramente o algoritmo proposto para a classificação de áudio codificado em MPEG-1 Layer 2 em detalhes. Em seguida, são analisadas as inovações apresentadas.
O corpo humano está organizado desde o mais simples até o mais complexo, ou seja, do átomo microscópico ao complexo organismo humano macroscópico.
 1 O corpo humano está organizado desde o mais simples até o mais complexo, ou seja, do átomo microscópico ao complexo organismo humano macroscópico. Note essa organização na figura abaixo. - Átomos formam
1 O corpo humano está organizado desde o mais simples até o mais complexo, ou seja, do átomo microscópico ao complexo organismo humano macroscópico. Note essa organização na figura abaixo. - Átomos formam
Biologia 12ºA Outubro 2013
 Biologia 12ºA Outubro 2013 1 VERSÂO 2 1. Observe a figura a lado que representa o sistema reprodutor masculino. Figura 1 1.1. Complete a legenda da figura. 1.2. Identifique a estrutura onde ocorre a maturação
Biologia 12ºA Outubro 2013 1 VERSÂO 2 1. Observe a figura a lado que representa o sistema reprodutor masculino. Figura 1 1.1. Complete a legenda da figura. 1.2. Identifique a estrutura onde ocorre a maturação
MEIOS DE CULTURA DESENVOLVIMENTO OU PRODUÇÃO DE MEIOS DE CULTURA. Necessidade Bactérias Leveduras
 MEIOS DE CULTURA Associação equilibrada de agentes químicos (nutrientes, ph, etc.) e físicos (temperatura, viscosidade, atmosfera, etc) que permitem o cultivo de microorganismos fora de seu habitat natural.
MEIOS DE CULTURA Associação equilibrada de agentes químicos (nutrientes, ph, etc.) e físicos (temperatura, viscosidade, atmosfera, etc) que permitem o cultivo de microorganismos fora de seu habitat natural.
Posso fazer a barba?
 A UU L AL A Posso fazer a barba? Você estudou na Aula 6 as transformações que acontecem durante a puberdade feminina. Agora chegou a hora de falarmos da puberdade masculina. Para os meninos, a puberdade
A UU L AL A Posso fazer a barba? Você estudou na Aula 6 as transformações que acontecem durante a puberdade feminina. Agora chegou a hora de falarmos da puberdade masculina. Para os meninos, a puberdade
Precocidade Sexual e a Inseminação Artificial em Tempo Fixo
 4º Workshop Precocidade Sexual. Precocidade Sexual e a Inseminação Artificial em Tempo Fixo José Luiz Moraes Vasconcelos DPA FMVZ UNESP Botucatu, SP vasconcelos@fca.unesp.br Precocidade em novilhas Nelore
4º Workshop Precocidade Sexual. Precocidade Sexual e a Inseminação Artificial em Tempo Fixo José Luiz Moraes Vasconcelos DPA FMVZ UNESP Botucatu, SP vasconcelos@fca.unesp.br Precocidade em novilhas Nelore
