UNIVERSIDADE DE SÃO PAULO
|
|
|
- Cecília Camilo Castanho
- 8 Há anos
- Visualizações:
Transcrição
1 í i "ANALISE TEÓRICA E EXPERIMENTAL DO ENRI QUECIMENTO ISOTOPICO DE NITROGÊNIO-15', NO SISTEMA MON0XIO0 OE NITROGÊNIO E ACIDO NlTRICO". CARLOS DUCATTI UNIVERSIDADE DE SÃO PAULO INSTITUTO DE FÍSICA E QUÍMICA DE SÀO CARLOS DEPARTAMENTO DE FÍSICA E CIÊNCIA DOS MATERIAIS CP SÀO CARLOS -SP - CEP BRASIL
2 "ANALISE TEÓRICA E EXPERIMENTAL DO ENFU QUECIMENTO ISOTOPICO DE NITROGÊNIO-15. NO SISTEMA MONOXIDO DE NITROGÊNIO E ÁCIDO NITRICO". CARLOS DUCATTI Tese apresentada ao Instituto de Física e Química de São Carlos, para a obtenção do titulo de Doutor em Ciências (Física Aplicada). Orientador: Dr. Eiichi Natsui INSTITUTO DE FlSICA E QUÍMICA DE SAO CARLOS SAO CARLOS/1985
3 MEMBROS DA COMISSÃO JULGADORA DA TESE DE DOUTORADO DE Carlos Ducatti APRESENTADA AO INSTITUTO DE FÍSICA E QUÍMICA DE SAO CARLOS, DA UNIVERSIDADE DE SAO PAULO, EM 20 DE dezenfcro DE COMISSÃO JULGADORA: Dr. Eli chi Matsui - Orientador D r. Antonio Aparecido Mozeto Robert Leaiinmerman Dr. tjohaan Matvienko
4 AGRADECIMENTOS Â minha famtlia t ã CLEIRE e â RHANI. Ao prof. Dr. Eiichi Matsui, IPEN/CNEN/São Paulo, pela orientação, ens^ namentos e dedicação. são. Ao prof. Or. Eneas Salati, CENA/USP, pelos ensinamentos e iniciação. Ao prof. Dr. AttTlio Dali'olio, DEN/UFPE, pelos ensinamentos e Ao Dr. Reynaldo Luiz Victoria, CENA/USP, pelo apoio e cooperação. discus Ao Dr. Paulo Cesar Ocheuse Trivelin, CENA/USP, pelo apoio e cooperação. Ao químico industrial José Aurélio Bonassi, pela cooperação. A prof? Roseli Borghesi Ducatti, pela revisão gramatical. Ao desenhista Antonio Aparecido Martins, pelas ilustrações. A secretária Neisa Jovencio Narcizo, pelo trabalho datilogrãfico. Ao Centro de Energia Nuclear na Agricultura/USP, pela infraestrutura oferecida. Em consignação ã Seção de IsÓtopos Estáveis e Hidrologia/CENA, pr fessores e funcionários, pela colaboração e discussão. Ao Departamento de Física, IFQSC/USP, professores e colaboradores, p Io ensino. Ao Departamento de Biofísica, IBBMA/UNESP, professores e funcionários, pelo apoio e estímulo. Ã CAPES/PICD e ao CNPq, pelo apoio financeiro. A todos aqueles que de uma forma direta ou indireta, auxiliaram trabalho. neste
5 ÍNDICE Pagina Lista das ilustrações, i Lista das tabelas >.... <1 Resumo e Sumary Vi CAPITULO I - INTRODUÇÃO, ORGANIZAÇÃO DO TRABALHO, OBJETIVOS E DESCRI^ CÃO GERAL DOS CAPÍTULOS Introdução Organização do trabalho Objetivos e descrição geral dos capítulos 5 CAPITULO II - FUNDAMENTOS TEÓRICOS DA EQUIPARTIÇÃO IS'MSJM, NA ES TIMATIVA DA CONSTANTE DE EQUILÍBRIO E DO FATOR DE Fi? CIONAMENTO, EM REAÇÕES DE TROCA ISOTÔPICA Introdução e revisão bibliográfica, Razões das funções de partição Razões das funções de partição para as espécies isotópúrus,ie_r tendentes â molécula diatõmica da fase gasosa Razões das funções de partição para as espécies isotópicos p-r tencentes à molécula poliatõmica da fase gasosa Simplificação na razão das funções de partição Constante de equilíbrio isotópico, fator de fracionamento e fvn_ ções de partição Constante de equilíbrio isotópicoj envolvendo sistema hcter-ogê_ i * 7160 de fases gasosa e liquida?8 i i CAPITULO III *- ESTIMATIVA DAS CONSTANTES DE EQUILÍBRIO E Dõ.1 FATORES l l l ' DE FRACIONAMENTO PARA A EQUIPARTIÇÃO DE l i ENTRE O ÁCIDO NÍTRICO E OS ÔXIDOS DE NITROCStilO NlTROtôllIO-16, Y
6 3.1. Estimativa da constante de equilíbrio K, entre as fases homoge^ neas gasosas. Resultados, discussão e conclusões Estimativa da constante de equilíbrio K., entre as fases ftete royêieas gás-liquido. Resultados, discussão e conclusões 51 CAPITULO IV - FUNDAt-JENTOS TEÓRICOS DA SEPARAÇÃO ISOTÓPICA EM COLUNA DE CONTRACORRENTE Introdução e revisão bibliográfica A equação de transporte isotópico Coluna de troca isotópica em contracorrente Número total de placas teóricas, fração molar do isótopo pesa_ do na alimentação e produto e enriquecimento isotópico relativo Determinação simultânea do número total de placas teóricas, f<± tor de fraaionamento e altura equivalente de uma placa teórica 79 CAPITULO V - COLUNA DE ENRIQUECIMENTO DE NITROGÊMO-15 NO ÁCIDO itf TRICÔ DA FASE LÍQUIDA, EM CONTRACORRENTE, COM OS ÕXIDOS DE NITROGÊNIO DA FASE GASOSA Introdução e revisão bibliográfica Construção e descrição da coluna de contracorrente, para enri^ quecimento de nitrogênio-lè no sistema NO/üNO, em escala de lo^ boratório Resultados parciais, discussão e conclusões 92 CAPITULO VI - MÉTODO DE PREPARO DE AMOSTRA, PARA ANÁLISE DE NITRO_ GÊNIO-U, POR ESPECTROMETRIA DE MASSA Introdução e revisão bibliográfica Método de determinação da concentração em átomo % da N... 98
7 6.3. Método de redução do ácido nttrioo a nitrogênio molecular, para a análise de nitrogsnio-ls Resultados e conclusões 102 CAPITULO VII - DETERMINAÇÃO EXPERIMENTAL DO FATOR IE FRACIONAMENTO DO SISTEMA NO/HNO. E DO NÚMERO TOTAL DE PLACAS TEÔRI o CAS DA COLUNA DE CONTRACORRENTE Introdução Modelo do balanço âe massa para o nitrogênio, na zona do produ_ to coletado, durante o equilíbrio dinâmico isotópico Resultados Primeiro experimento Segundo experimento Expressões de s versus o,do primeiro v segundo experimer^ tos Terceiro experimento Expressões de s versus a, do terceiro experimento Discussão e conclusões Balanço de massa de nitrogênio-lè Fator de fradonamento experimental do sietema NO/HNO, Produção de H NO- na coluna de troca isotópica Estimativas para altas concentrações em átomo % N t na nova coluna de troca isotópica NO/HNO- 152 CAPÍTULO VIII - MODELO PARA 0 PROCESSO DE TROCA ISOTÓPICA DE NITRO^ CÊNIO-U, NO SISTEMA NO/HNO Introdução Modelo fator âe fracionamonto independente ãe fane
8 8.4. Resultados, discussão z conclusões 168 REFERÊNCIAS BIBLIOGRÁFICAS 183
9 1 LISTA DAS ILUSTRAÇÕES Página Figura 1 - Célula de contvacorrente 61 Figura?. - Simbolismo adotado na célula de conbvacorrente 63 Fi gura 3 - Difusão através da interface Ixquido-gás 64 Figura 4 - Célula de ccntracorrente, alimentada por uma vazão L.. 68 Fi gura 5 - Co luna em cascata 70 Figura 6 - Determinação gráfica do número total de placas teõri cas e do fator de fracionamento t nas condições de equi^ líbrio dinâmico isotópico 81 Figura 7 - Diagrama das principais unidades operacionais, e as principais reações no sistema NO / HNO? 83 Figura 8 - Coluna em contracorrente, para enriquecimento de nitro^ gênio-15, em escala de laboratório 85 Figura 9 - Detalhe do arranjo experimental com bomba peristaltica. 89 Figura 10 - Detalhe do arranjo experimental do refluxador secunda rio 90 Figura 11 - Diagrama geral em blocos, do espectrômetro de massa Figura 12 - Diagrama geral em blocos t do método de redução do ácido nítriao a nitrogênio molecular 101 Figura 13 - Entrada modificada do sistema de admissão do eepectrõme^ tro de massa 101 Figura 14 - Diagrama da zona de produto coletado 106 Figura 15 - Curvas de s versus a do primeiro e segundo experimentos 128 Figura 16 - Curvas de s versus a do terceiro experimento 142 Figura 17 - Curvas de produção de H ls lfo s 151
10 ii LISTA DAS TABELAS Página Tabela Ieótopos de nitrogênio 2 Tabela Métodos utilizados para a produção de nitrogênio-ls 4 Tabela II.1 - Smário das funções d» partição 12 Tabela II.2 - Valores da função G(y*) e das variações relativas de AG/Apj, para os diferentes valores de \i* 34 Tabela III.l - Freqüências fundamentais vibracionais, teóricas e ób_ servaãas, de 8 N0 3 e H NO, na fase gasosa e as nz mães dos principais momentos de inércia 40 Tabela II1.2 - Freqüências fundamentais vibracionais, mervadas, de U NO, ls NO, l4 N0 9 e ÍS N0 9 na fase teóricas e ob_ gaso ma e as razões dos principais momentos de inércia.. 41 Tabela II Sumário das razões de funções de partição, para molé\ cuias di e poliatõmicas, 43 Tabela II1.4 - Constantes para as espécies isotópicas de HNOy NO e HO 2 44 Tabela II1.5 - Razões das funções de partição, utilizando as fre^ quências fundamentais teóricas.. 45 Tabela II1.6 - Razões das funções de partição, utilizando as fre^ quênaias fundamentais observadas 46 Tabela II1.7 - Regra produto de Teller-Redlick 48 Tabela II1.8 - Estimativa da constante de equilíbrio entre as esp cies isotópicae de ácido nitrico e óxidos de nitrogê_ nio, para as fases gác-gàs 50 Tabela II1.9 - Freqüências fundamentais vibraaionais (freqüências 7 A 1 K internas), de H NO, e H NO, nas fases gasosa e li quiãa 54 Tabela III Razão das pressões de vapor entre II NO., e U^NO. 56
11 iii Tabela Estimativa da constante de equilíbrio, entire as espé_ cies isotópicas de ácido nltricô e óxidos de nitrogê^ nioj para as fases gás-liquido 57 Tabela V.l - Pai'ametros de colunas em contraaorr^nte 93 Tabela V.2 - Parâmetros obtidos do refluxador secundário, nos quilibrios dinâmicos isotópicos do terceiro expjri_ mento 95 Tabela VI. 1 - Amostras de ácido nitrico de concentrações distintas em átomo % de tf 102 Tabela VII.l - Dados referentes ao primeiro experimento. Controle de ácido nitrico produto coletado 110 Tabela VI1.2 - Dados referentes ao primeiro experimento. Controle de ácido nitrico da alimentação 111 Tabela VI1.3 - Amostras de ácido nitrico produto, retiradas durante o equilíbrio dinâmico isotópico, do primeiro expert^ mento 112 Tabela VI1.4 - Dados referentes ao segundo experimento. Controle de ácido nitrico produto 114 Tabela VI1.5 - Dados referentes ao segundo experimento. Controle de ácido nitrico da alimentação 117 Tabela VI1.6 - Amostras de ácido nitrico produto, retiradas durante os equilibrios dinâmicos isotópicos, do segundo expe^ rimento 118 Tabela VII.7 - Vazões médias nos equilibrios dinâmicos isotópicos, do primeiro e segundo experimentos e os respectivos desvios padrões 123 Tabela VI1.8 - Concentrações médias da mistura isotopica, nos equi^ librios dinâmicos isotópicos, do primeiro 8 segundo experimentos e os respectivos desvios padrões 124
12 Tabela VII.9 - Produto de razões no primeiro e segundo experimentos 125 Tabela VI Expressões de o versus a para o primeiro e segundo ' experimentos 126 J Tabela VII.11 - Retas de 8 versus a do primeiro e segundo experimen_ tos 127 ( Tabela VII.12 - Parâmetros experimentais da coluna de troca isotópi^ I. ca, do primeiro e segundo experimentos 127 I I Tabela VII.13 - Dados referentes ao terceiro experimento. Controle ( de ácido nitrico da alimentação 130 Tabela VII.14 - Dados referentes ao terceiro experimento. Controle 4 de ácido nitrico sub-produto, coletado no refluxador secundário 131 i Tabela VI Amostras de ácido nitrico produto, retiradas durante ( os equilibriob dinâmicos isotópico8 do terceiro expe_ i rimento 134 Tabela VII.16 - Vazões médias nos eq-iilibrios dinâmicob ÍBotópico8 do terceiro experimento e OB respectivos desvios pa_ ( ãrões 138 I Tabela VII Concentrações médias da mistura isotópica, nos equi_, libriob dinâmicos ÍBOtópico8 do terceiro experimento e OB reepecti)ob desvios padrões 139 Tabela VII.18 - Produto de razões do terceiro experimento 140 Tabela VII.19 - Expressões de B versus a para o terceiro experimento 141 Tabela VI Retas de e versus a do terceiro experimento 141 Tabela VI Parâmetros experimentais da coluna de troca ieotópi^ ca, do terceiro experimento 143 Tabela VI Balanço de maesa de nitrogênio-l5 f referente aos quilibrioe dinâmicos isotópiaos do terceiro expert^ mento.,.,,..,,...'..., ( I i I i i
13 V Tabela VII.23 - Parâmetros experimentais da coluna de troca isotópi^ ca,referentes ao primeiro^segundo e terceiro expert^ merios 147 Tabela VII.24 - Parâmetros experimentais para a produção de H NO Tabela VIII. 1 - Fator de fracionamento experimental e a concentração de ácido nttrico à temperatura de 25 C 157 Tabela VIII.2 - Composição da fase gasosa em equilíbrio com a fase liquida de ácido nítrico, â temperatura de 2S C e à pressão atmosférica 159 Tabela VIII.3 - Fator de fracionamento resultante õ, versus concen_ tração de ácido nítrico, á temperatura de 25 C 169 Tabela VIII.4 - Fator de fracionamento resultante 3, versus concern tração de ácido nitrico t â temperatura de 25 C 172
14 VI RESUMO O enriquecimento isotõpico de nitrogênio-15 por troca química r.o sistíí ma NO/HNO^ foi estudado através de duas teorias distintas. Os fatores de fracionamento isotopicos, obtidos pela teoria de contra_ corrente e os estimados pela teoria da equipartição isotopica, foram confronta^ dos através de um modelo. Construiu-se uma coluna de contracorrente, em escala de laboratório, e parâmetros tais como: número de placas teóricas, altura equivalente de uma pla^ ca teórica, tipo de enchimento, altura total da coluna, produção de H N0 3 /sji mana, obtidos em condições de equilíbrio dinâmico isotõpico, foram estudados comparativamente aos da literatura. SIM4ARY Nitrogen-15 isotope enrichment by chemical exchange in N0/HN0 3 system was studied using two different theories. The isotope fractionation factors obtained by the ccuntercurrent theory was compared to those estimated by the isotope equipartition theory were confronted through a model. It was built a column in countercurrent at laboratory scale and parameters such as: number of theoretical plates, height equivalent to a theoretical plate, type of packing, total height of column, production of H NO-j/week, N0 3 obtained under isotope dynamic equilibrium equiv conditions, were studied in comparison to those in the literature.
15 1 CAPITULO I INTRODUÇÃO, ORGANIZAÇÃO DO TRABALHO, OBJETIVOS B DESCRIÇÃO GERAL DOS CAPÍTULOS 1.1. Introdução De uma forma geral, os isõtopos de um dado elemento químico, apresen tam um comportamento ftsico-qutmico similar, principalmente entre os isõtopos estáveis. Entretanto, as eventuais diferenças nas moléculas que diferem na sua composição isotõpica, são muito menores que as observáveis entre elementos dú tintos, mesmo se pertencentes a um grupo qutmico. Estas pequenas diferenças de comportamento podem conduzir ao fraciona_ mento isotõpico, o qual, pode ser interpretado como a variação das concentra^ ções das várias espécies isotopicas participantes, em diferentes regiões de um sistema físico, sujeito a um determinado processo. As diferenças de comportamento podem, inclusive, influenciar o conjun_ to dos níveis energéticos a ntvel vibracional, rotacional e translacional, quando as espécies isotopicas de um mesmo elemento são comparadas ei.tre si. Percebe-se que o fator de fracionamento, o fator mensurável, pode ser estudado a nível:- das variações de concentrações das espécies Isotopicas, ob_ jeto de estudo da Teoria çeral da separação isotõpica; - das variações dos m_ veis energéticos, através da Termodinâmica estatística, especificamente, no am bito da Termodinâmica das reações de troca isotõpica. A determiiiaçao do fator de fracionamento, apresente ainda dois aspec tos cornplementares: o uso propriamente do valor e suas correlações, como utun técnica de pesquisa e, conseqüentemente, a análise c a interpretação do probljí ma, ou, a estimativa deste efeito isotõpico no problema considerado. Percebe-se entretanto, da literatura, que ambos os aspectos são utivi. zados de forma distinta, em separado e raramente são abordados cm conjunto. De uniy forma ou de outra, a determinação desse efeito isotõpico, como
16 fcnte de informações, ê utilizada em vários campos da pesquisa, como instrumen to de elevada potencialidade. EspecTficamente neste trabalho, os isótopos de interesse são os de n trogênio, como ilustn a Tabela 1.1, e dentre eles, os estáveis de.iúmeros de massa 14 e 15. TABELA 1.1 ISOTOPOS DE NITROGÊNIO Isótopos Concentração Natural em Átomo % Tipo de. Desintegração Meia Vida ,011 s 9,97 min 14», 99,63 estável r 0.37 estável 7N 0" 7.2 s 17» f. in) 4,16 s 0" 0.63 s FONTE: HEATH (1977) Segundo TRIVELIN et al11 (1973). TRIVELIN et al11 (1979). o emprego de Isõtopos estáveis de nitrogênio como traçadores. tanto em estudos com an va riações da razão Isotõpica natural N/ N, como no uso de compostos químicos de concentrações em átomo % N t diferentes das encontradas naturalmente, le
17 vam vantagem em relação ao uso dos radioativos, uma vez que, a meia vida destes e da ordem de minutos, tomando pouco viável, o emprego dos radioisõtopos, prin eipaintente em pesquisas biológicas. Segundo estes mesmos autores, muito embora o nitrogênio-15 venha sendo empregado como traçador por mais de quarenta anos, o alto preço aquisitivo de compostos químicos enriquecidos ou empobrecidos em N, tem-se constituido como um fator limitante, em função dos custos dos processos de separação isotõpica, podendo variar conforme o grau de enriquecimento, e também, com o tipo de com posto químico desejado. 0 nitrogênio-15 tem sido separado e concentrado por uma variedade de métodos, e segundo KRELL (1976), os mais utilizados na produção de altas concert trações em átomo % N, são sumarizados na Tabela 1.2. Segundo TAYLOR e SPINDEL (1957), outros métodos, e entre eles, a desti. lação, difusão gasosa, centrifugação gasosa, eletrõlise, eletromagnético, etc, tem sido propostos na separação Isotõpica de nitrogênio-15. Normalmente, os sistemas de troca química entre duas fases, líquido e gás, sãu os mais utilizados em relação aos demais métodos, particularmente devj[ do ã rápida troca entre as formas químicas utilizadas. Especificamente, o sistema de troca isotõpica entre solução de ácido nttrico e monõxido de nitrogênio, torna-se o mais atrativo, devido ao seu alto fator de fracionamento, como ilustra a Tabela 1.2.
18 TABELA 1.2 MÉTODOS UTILIZADOS PARA A PRODUÇÃO DE NITROGÊNIO-15 Sis ternas Métodos Fator de Fracionamento Autores N 2 Termodifusão - CLUSIUS (1950) N 2 Distilação a baixa temperatura (-209 C) 1,006 CLUSIUS e KEYER (1953) NO Destilação a baixa temperatura (-156,1 C 1,030 CLUSIUS e SCKLEICH (1953) NH 3 - NH 4 R Troca iõnica 1,026 SPEDDING et alii (1955) NH 3 - NH* Troca química 1,023 THODE e UREY (1939) NO - HNO 3 Troca química 1,055 SPINDEL e TAYLOR (1956) NC-NOC1 Troca química 1,026 YEATIS (1953) M0-N0(HS0 4 ) Troca química 1,033 STIEHL (1961) NH 3 FotoquTmica - AMSARTSUMJAN et alii (1973) N 2 Absorção conttnua(-195,l C) 1,016 ZELVENKIJ et alii (1974) FONTE: KRELL (1976) STASCHEWSKI (1975), citado por KRELL e JONAS (1977), faz uma análise comparativa entre o sistema de troca qutmica (NO, N0 2 )/HN0 3 ã temperatura 25 C, e o de desti laçao a baixa temperatura (~121 C), do monoxido de nitrogênio no sistema NO liq./no gas. Estes autores, relatam que o sistema desenvolvido portaylor e SPINDEL (1957), torna-se ornais atraente, em função do alto fator de fracionamento, 1,055 contra 1,027, e também devido ao baixo custo de ácido nttrico produto, por átomo grama de isótopo N puro, obtido na concentração de 95 a 99 átomo % 15, N. Paralelamente, esses autores, comentam que, com o apoio de uma indus de
19 tria química de alta infraestrutura no sistema NQ/HNO,, toma-se possível majr car com N, mais de duzentos e cincoenta compostos químicos diferentes. Como uma citação adicional e atrativa, ABRUDEM et alii (1981), dese volveram uma unidade experimental a nível de laboratório, consistindo de duas colunas de troca isotõpica para a separação simultânea de N e 0, baseando -se no sistema (N0,N0 2 )/HN0 3 detaylor e SPINDEL (1957) Organização do trabalho Visando a organização, ordenaram-se os diferentes assuntos em capítju los, numerando-os com algarismos romanos. As equações oriundas dos capítulos, levam ã mesma numeração e na sje qüincia destas, utilizou-se da numeração progressiva, com algarismos arábicos. A mesma disposição foi utilizada nas tabelas. Para a seqüência destas, utilizou-se da numeração progressiva, com algarismos arábicos. As ilustrações foram numeradas em seqüência com algarismos arábicos, independentemente dos capítulos. Para os diferentes assuntos, dispostos em capítulos, citaram-se as re ferências específicas. Quando possível, apôs o desenvolvimento dos assuntos, extrairam-se re sultados e conclusões Objetivos e descrição geral dos capítulos A motivação geral e o Interesse maior neste trabalho, residem na im plantação de uma unidade experimental do sistema NO/HNOj, em coluna de contra_ corrente, entre o monóxido de nitrogênio gasoso e a solução de ácido nítrico, para a produção de nitrogênio-15, no Centro de Energia Nuclear na Agricultura/ USP/Piracicaba. Paralelamente i objetivo também, iniciar-se nos estudos da determina^ ção teórica e experimental, do fator de fracionamento do sistema NO/HNO3, vez que da literatura, vários valores, tanto teóricos como experimentais, uma são
20 atribuídos a este processo. Procurar-se-ã desenvolver um modelo, para contribuir na compreensão do processo de troca isotõpica de nitrogenio-le no sistema Nü/HNO.*. Os objetivos específicos, estão correlacicnadcs cem a descrição geral de cada capitulo. Assim, no Capitulo I I, o qual se refere aos fundamentos teóricos da quipartição isotõpica, procura-se cano objetivo, evidenciar os conceitos equações necessárias, para a estimativa da constante de equilíbrio e do de fracionamento, entre espécies isotõpicas, pertencentes a moléculas di e as fator e po liatênricas, nas fases horaogineas gãs-gãs. Posteriormente, as equações complementares na correção para as fases heterogêneas, gas-líquido, explicitando-as era termos de parâmetros moleculares, principalmente em função das freqüências fundamentais vibracionais. Como aplicação e objetivo destes fundamentos, procura-se estimar no Ca_ pítulo III, a constante de equilíbrio e o fator de fracionamento das principais reações de troca isotõpica de nitrogênio-15 no sistema NO/HNO3, ã temperatura de 25 C. Utilizando-se das constantes moleculares e das freqüências vibraciç> na is, teóricas e experimentais, obtidas por diversos autores, foram analisados os valores, através das expressões utilizadas nas razões das funções de partly ção para HNO 3 ( ) /NO(g) ; HN0 3 ( ) /N0 2 (g)e HNO 3 (í)/hno 3 (g), nas quais (*) e (g) significam fase líquida e gasosa, respectivamente. No Capítulo IV, referente aos fundamentos teóricos da separação isoto pica em coluna de contracorrente, procura-se como objetivo, dar ênfase aos prini cipais conceitos e definições utilizados, e ã principal equação necessária calculo simultâneo, do fator de fracionamento e do número total de placas no teó cas, a partir de parâmetros de alimentação e produto, em condições de equih brios isotõpicos dinâmicos. Tendo-se por referência, o sistema original N0/HN0 3, de TAYLOR e SPIN DEL (1957), foi construída com modificações, uma coluna de contracorrente, para a produção em escala de laboratório, de ácido nítrico enriquecido em N. A descrição das principais unidades operacionais dessa coluna, são a
21 presents das no Capitulo V. Neste capitulo, constam também, análises compara ti^ vas de alguns parâmetros da coluna de troca isotopica, aos da literatura. 0 mitodo de redução do ácido nttricô a nitroginio molecular, para a analise da concentração em átomo % N, com precisão da ordem de 1%., por e pectrometria de massa, descreve-se no Capitulo VI. No referido capitulo relata-se também, as modificações efetuadas no método de preparo de amostra, método de Dumas, bem como a alteração introduzida no sistema de entrada de amostra do espectrômetro de massa. Como aplicação e objetivo dos fundamentos teóricos da separação pira em coluna de contracorrente, determina-se no Capitulo VII, o fator de isotô fra cionamento do sistema NO/HNO-, e o núrcero total de placas teóricas da coluna em pregada, atravis de três experimentos. Neste capitulo, obtiveram-se expressões de número total de placas teõ ricas versus fator de ^racionamento. Através de determinação grafica, pode-se explicitar simultaneamente, o fator de fracionamento do sistema NO/HNO3, e oní mero xotai de placas teóricas da coluna, nas condições de trabalho empregadas. No capitulo VII, focaliza-se também a atenção para o balanço de massa de nitrogênio-15, jênio-15, no sentido de localizar a provável fonte de perdas de N no sistema NO/HNO Analisa-se também, neste capitulo, a produção de N, sob um mesmo in tervaio de tempo, através da análise de compromisso, entre a quantidade de pro duto retirado, e a concentração de N obtida. Através dos parâmetros experimentais da coluna de troca isotopica, e dos fundamentos teóricos da separação isotopica, procura-se estimar a altura de uma nova coluna de contracorrente, para a produção de ácido nftrico, com alta concentração de nitrogênio-15. Utilizando-se dos princípios fundamentais de ambas as teorias, nas principais reações de troca isotõpica de nitrogênio-15 no sistema NO/HNO3, e dos fatores de fracionamento, teóricos e experimentais, obtidos por diversos a tores, e também neste trabalho, sugere-se como objetivo final, um modelo, para o processo de troca de nitroginio-15 no sistema utilizado. Este modelo, descre ve-se no CapUuio VIII.
22 CAPITULO II FUXDAVHüTOS TEÓRICOS DA EQIJ1PARTIÇÃO ISOTÔPICA, NA EST11-1ATIVA DA CONSTANTE DE EQUILÍBRIO E DO FATOR DE FRACIONAMEtno, EM REAÇÕES DE TROCA ISOTÔPICA 2.1. Introdução e revisão bibliográfica A teoria do fracionamento dos isõtopos estáveis, segundo RICHET et alii (1977), provavelmente inicioi- se cora LINDEMANN (1919) e LINDEMAHN e ASTCW (1919), os quais, aplicaram a termodinâmica estatística, para calcular a dif rença da pressão de vapor entre os isótopos de chumbo. Sagundo RICHET et alii (1977), apôs LINDEKANN (1919), os autores UREY e RITTENBERG (1933), calcularam as constantes de equilíbrio para as reações de troca, envolvendo hidrogênio e deutério, hidrogênio e compostos de halogêneos deuterados. Segundo RICHET et alii (1977), FARKAS e FARKAS (1934), fizeram o mesmo para a troca de hidrogênio e deutério na água. UREY e GREIFF (1935), realiza_ ram cálculos, envolvendo hidrogênio, lttio, carbono, nitrogênio, oxigênio e ha_ logêneos, admitindo moléculas di e polia tônicas na constante de equilíbrio is tópico. Destes autores, segundo RICHET et alii (1977), WALDMANN (1943), desen, volveu provavelmente as principais equações convenientes para os cálculos de troca isotõpica. BIGELEISEN e MAYER (1947), desenvolveram independentemente as mesmas expressões que WALDMANN, assim como UREY (1947). Desde então, segundo RICHET et alii (1977), autores de diversas áreas, tem usado as expressões de UREY (1947), ou as de WALDMANN (1943), ou as de BIGE LEISEN e MAYER (1947), na estimativa da constante de equilíbrio. Subentende-se, neste capitulo, que a estimativa da constante de equilt brio e do fator de fracionamento, em reações de troca isotõpica, refere-se ã re_ visão bibliográfica da teoria desenvolvida por UREY e RITTENBERG (1933), UREY e GREIFF (1935), e de uma forma mais simplificada, por BIGELEISEN e MAYER (1947).
23 Procurar-se-a, como objetivo, conduzir o desenvolvimento das KSHS, para a estimativa da constante de equilíbrio, entre fases honogineas gãs-gãs, e posteriormente corrigi-ia para fases heterogêneas g?s-liquido. Devido ã numerosa sinboiogia e conceitos empregados na teoria e na sim plificação da mesma, abordar-se-ão os tópicos necessários a perfeita compreen são, a fim de evitar a necessidade de recorrer ãs literaturas originais. A reação química de troca isotopica i aquela na qual, esquematicamente pode ser representada por uma reação do tipo: Ax + Bx* ^=± Ax* Bx (II.1) onde x* e x, são os isõtopos pesado e leve do par isotópico tomado em considera^ ção. A concentração isotopica das espécies Bx* e Ax* ou Bx e Ax, segundo JOHNS (1961), difere levemente uma da outra nas condições experimentais de equi^ ltbrio. Métodos de troca química para a separação isotopica, fazem uso destas pequenas diferenças de concentração no equilíbrio. Estes métodos, tem mostrado serem os mais satisfatórios na separação dos isõtopos para a maioria dos elemen tos leves. A constante de equilíbrio da reação II.1, obtida experimentalmente, s gundo JOHNS (1961), difere da obtida pela teoria da equipartição isotopica e, quanto mais as espécies isotópicas se aproximarem de um gás ideal, mais próxj^ mas as constantes, teórica e experimental, estarão entre s1. SegundoUREY e GREIFF (1935), BIGELEISEN e MAYER (1947), a estimativa do calculo da constante de equilíbrio entre fases homogêneas gãs-gãs, utilizaji do-se da equipartição de energia nas espécies isotópicas <ta reação 11,1, expres_ sa-se por: K. n q produtos (II 2) * n Q reagentes
24 10 Na expressão II.2, n i o produto das funções de partição Q's. as quais serão detalhadas oportunamente, e K i a constante de equilíbrio entre as espécies isotópicas envolvidas, pertencentes as fases gasosas. 0 cálculo das funções de partição dos produtos e dos reagentes, perai_ te então o cálculo da constante de equilíbrio. Tera-se para a reação II.1, que: Q(Ax*)Q(Bx) - Q(Ax*)/ QfAx) (,, 3) Q(Ax) Q(Bx*J Q(3x*)/ Q(Bx) 0 fator^' de fracionamento a da expressão II.1, o qual está intimaraen te correlacionado com a constante da equilíbrio, será detalhado oportunamente. De una forma geral, segundo PIERCE (1968), a energia total e^ adquiri^ da por uma molécula no equilíbrio térmico, reflete a contribuição: da energia translacional et; da energia rotacional er; da energia vibracionai e/; da ene gia de excitação eletrônica ce; e da energia do spin nuclear en. A energia total e.- era primeira aproximação, pode ser representada como uma simples soma de todas estas formas de energia. e- = et + er + e/ + ee + en. Desde que uma espécie molecular apresente um conjunto particular de es_ tados de energia e^, a função da distribuição destes estados de energia na mole cuia, pede ser expressa pela função de partição total Q = z i g i exp (-e^/kt), na qual g^, i a degenerescência de e^ ou o fator estatístico, que indica a coa lescência de dois ou mais níveis de energia era um; k é a constante de Boltanann e T a temperatura absoluta. Assim sendo, pode-se escrever que: Q = E 1 g i exp (-et í /kt)exp(-er i /kt)exp(-e/ i /kt)exp(-ee i /kt)exp(en i /kt) (II.5) ( ) As definições de fator de fradonamento o, e do enriquecimento relativo e, estão explícitas no Capítulo IV e em 2.6.
CAP. I ERROS EM CÁLCULO NUMÉRICO
 CAP. I ERROS EM CÁLCULO NUMÉRICO 0. Introdução Por método numérico entende-se um método para calcular a solução de um problema realizando apenas uma sequência finita de operações aritméticas. A obtenção
CAP. I ERROS EM CÁLCULO NUMÉRICO 0. Introdução Por método numérico entende-se um método para calcular a solução de um problema realizando apenas uma sequência finita de operações aritméticas. A obtenção
Resolução de Matemática da Prova Objetiva FGV Administração - 06-06-10
 QUESTÃO 1 VESTIBULAR FGV 010 JUNHO/010 RESOLUÇÃO DAS 15 QUESTÕES DE MATEMÁTICA DA PROVA DA MANHÃ MÓDULO OBJETIVO PROVA TIPO A O mon i tor de um note book tem formato retangular com a di ag o nal medindo
QUESTÃO 1 VESTIBULAR FGV 010 JUNHO/010 RESOLUÇÃO DAS 15 QUESTÕES DE MATEMÁTICA DA PROVA DA MANHÃ MÓDULO OBJETIVO PROVA TIPO A O mon i tor de um note book tem formato retangular com a di ag o nal medindo
Resolução feita pelo Intergraus! Módulo Objetivo - Matemática FGV 2010/1-13.12.2009
 FGV 010/1-13.1.009 VESTIBULAR FGV 010 DEZEMBRO 009 MÓDULO OBJETIVO PROVA TIPO A PROVA DE MATEMÁTICA QUESTÃO 1 (Prova: Tipo B Resposta E; Tipo C Resposta C; Tipo D Resposta A) O gráfico abaio fornece o
FGV 010/1-13.1.009 VESTIBULAR FGV 010 DEZEMBRO 009 MÓDULO OBJETIVO PROVA TIPO A PROVA DE MATEMÁTICA QUESTÃO 1 (Prova: Tipo B Resposta E; Tipo C Resposta C; Tipo D Resposta A) O gráfico abaio fornece o
OBJETIVOS: CARGA HORÁRIA MÍNIMA CRONOGRAMA:
 ESTUDO DIRIGIDO COMPONENTE CURRICULAR: Controle de Processos e Instrumentação PROFESSOR: Dorival Rosa Brito ESTUDO DIRIGIDO: Métodos de Determinação de Parâmetros de Processos APRESENTAÇÃO: O rápido desenvolvimento
ESTUDO DIRIGIDO COMPONENTE CURRICULAR: Controle de Processos e Instrumentação PROFESSOR: Dorival Rosa Brito ESTUDO DIRIGIDO: Métodos de Determinação de Parâmetros de Processos APRESENTAÇÃO: O rápido desenvolvimento
ANÁLISE QUÍMICA INSTRUMENTAL
 ANÁLISE QUÍMICA INSTRUMENTAL CROMATOGRAFIA 2 1 6 Ed. Cap. 10 268-294 6 Ed. Cap. 6 Pg.209-219 6 Ed. Cap. 28 Pg.756-829 6 Ed. Cap. 21 Pg.483-501 3 Separação Química Princípios de uma separação. Uma mistura
ANÁLISE QUÍMICA INSTRUMENTAL CROMATOGRAFIA 2 1 6 Ed. Cap. 10 268-294 6 Ed. Cap. 6 Pg.209-219 6 Ed. Cap. 28 Pg.756-829 6 Ed. Cap. 21 Pg.483-501 3 Separação Química Princípios de uma separação. Uma mistura
( ) ( ) ( ( ) ( )) ( )
 Física 0 Duas partículas A e, de massa m, executam movimentos circulares uniormes sobre o plano x (x e representam eixos perpendiculares) com equações horárias dadas por xa ( t ) = a+acos ( ωt ), ( t )
Física 0 Duas partículas A e, de massa m, executam movimentos circulares uniormes sobre o plano x (x e representam eixos perpendiculares) com equações horárias dadas por xa ( t ) = a+acos ( ωt ), ( t )
Tópico 11. Aula Teórica/Prática: O Método dos Mínimos Quadrados e Linearização de Funções
 Tópico 11. Aula Teórica/Prática: O Método dos Mínimos Quadrados e Linearização de Funções 1. INTRODUÇÃO Ao se obter uma sucessão de pontos experimentais que representados em um gráfico apresentam comportamento
Tópico 11. Aula Teórica/Prática: O Método dos Mínimos Quadrados e Linearização de Funções 1. INTRODUÇÃO Ao se obter uma sucessão de pontos experimentais que representados em um gráfico apresentam comportamento
6 Conclusões e Trabalhos futuros 6.1. Conclusões
 6 Conclusões e Trabalhos futuros 6.1. Conclusões Neste trabalho estudou-se o comportamento do sistema que foi denominado pendulo planar com a adição de uma roda de reação na haste do pendulo composta de
6 Conclusões e Trabalhos futuros 6.1. Conclusões Neste trabalho estudou-se o comportamento do sistema que foi denominado pendulo planar com a adição de uma roda de reação na haste do pendulo composta de
IBM1018 Física Básica II FFCLRP USP Prof. Antônio Roque Aula 6. O trabalho feito pela força para deslocar o corpo de a para b é dado por: = =
 Energia Potencial Elétrica Física I revisitada 1 Seja um corpo de massa m que se move em linha reta sob ação de uma força F que atua ao longo da linha. O trabalho feito pela força para deslocar o corpo
Energia Potencial Elétrica Física I revisitada 1 Seja um corpo de massa m que se move em linha reta sob ação de uma força F que atua ao longo da linha. O trabalho feito pela força para deslocar o corpo
Movimento Harmônico Simples: Exemplos (continuação)
 Movimento Harmônico Simples: Exemplos (continuação) O Pêndulo Físico O chamado pêndulo físico é qualquer pêndulo real. Ele consiste de um corpo rígido (com qualquer forma) suspenso por um ponto O e que
Movimento Harmônico Simples: Exemplos (continuação) O Pêndulo Físico O chamado pêndulo físico é qualquer pêndulo real. Ele consiste de um corpo rígido (com qualquer forma) suspenso por um ponto O e que
Cinética Química Aplicada (LOQ 4003)
 - Universidade de São Paulo - Escola de Engenharia de Lorena Cinética Química Aplicada (LOQ 4003) 1º semestre de 2014 Prof. Dr. João Paulo Alves Silva jpalves80@usp.br Aula anterior Equação de Velocidade
- Universidade de São Paulo - Escola de Engenharia de Lorena Cinética Química Aplicada (LOQ 4003) 1º semestre de 2014 Prof. Dr. João Paulo Alves Silva jpalves80@usp.br Aula anterior Equação de Velocidade
Tópico 3. Limites e continuidade de uma função (Parte 2)
 Tópico 3. Limites e continuidade de uma função (Parte 2) Nessa aula continuaremos nosso estudo sobre limites de funções. Analisaremos o limite de funções quando o x ± (infinito). Utilizaremos o conceito
Tópico 3. Limites e continuidade de uma função (Parte 2) Nessa aula continuaremos nosso estudo sobre limites de funções. Analisaremos o limite de funções quando o x ± (infinito). Utilizaremos o conceito
CAP. 2 CONSIDERAÇÕES SOBRE OS CRITÉRIOS DE DECISÃO
 CAP. 2 CONSIDERAÇÕES SOBRE OS CRITÉRIOS DE DECISÃO 1. OS CRITÉRIOS DE DECISÃO Dentre os métodos para avaliar investimentos, que variam desde o bom senso até os mais sofisticados modelos matemáticos, três
CAP. 2 CONSIDERAÇÕES SOBRE OS CRITÉRIOS DE DECISÃO 1. OS CRITÉRIOS DE DECISÃO Dentre os métodos para avaliar investimentos, que variam desde o bom senso até os mais sofisticados modelos matemáticos, três
Introdução à Análise Química QUI 094 ERRO E TRATAMENTO DE DADOS ANALÍTICOS
 Introdução a Analise Química - II sem/2012 Profa Ma Auxiliadora - 1 Introdução à Análise Química QUI 094 1 semestre 2012 Profa. Maria Auxiliadora Costa Matos ERRO E TRATAMENTO DE DADOS ANALÍTICOS Introdução
Introdução a Analise Química - II sem/2012 Profa Ma Auxiliadora - 1 Introdução à Análise Química QUI 094 1 semestre 2012 Profa. Maria Auxiliadora Costa Matos ERRO E TRATAMENTO DE DADOS ANALÍTICOS Introdução
SESSÃO 5: DECLINAÇÃO SOLAR AO LONGO DO ANO
 SESSÃO 5: DECLINAÇÃO SOLAR AO LONGO DO ANO Respostas breves: 1.1) 9,063 N 1.2) norte, pois é positiva. 1.3) São José (Costa Rica). 2) Não, porque Santa Maria não está localizada sobre ou entre os dois
SESSÃO 5: DECLINAÇÃO SOLAR AO LONGO DO ANO Respostas breves: 1.1) 9,063 N 1.2) norte, pois é positiva. 1.3) São José (Costa Rica). 2) Não, porque Santa Maria não está localizada sobre ou entre os dois
Transições de Fase de Substâncias Simples
 Transições de Fase de Substâncias Simples Como exemplo de transição de fase, vamos discutir a liquefação de uma amostra de gás por um processo de redução de volume a temperatura constante. Consideremos,
Transições de Fase de Substâncias Simples Como exemplo de transição de fase, vamos discutir a liquefação de uma amostra de gás por um processo de redução de volume a temperatura constante. Consideremos,
Cálculo de amostra para monitoria de qualidade em Call Center
 Cálculo de amostra para monitoria de qualidade em Call Center Esta metodologia tem como objetivo definir o tamanho mínimo ideal da amostra, garantindo a representatividade da população de chamadas em um
Cálculo de amostra para monitoria de qualidade em Call Center Esta metodologia tem como objetivo definir o tamanho mínimo ideal da amostra, garantindo a representatividade da população de chamadas em um
Do ponto de vista da Termodinâmica, gás ideal é aquele para o qual vale, para quaisquer valores de P e T, a equação de estado de Clapeyron:
 Equação de Estado de Van der Waals Do ponto de vista da Termodinâmica, gás ideal é aquele para o qual vale, para quaisquer valores de P e T, a equação de estado de Clapeyron: P i V i = nrt em que colocamos
Equação de Estado de Van der Waals Do ponto de vista da Termodinâmica, gás ideal é aquele para o qual vale, para quaisquer valores de P e T, a equação de estado de Clapeyron: P i V i = nrt em que colocamos
EQUILÍBRIO QUÍMICO 1
 EQUILÍBRIO QUÍMICO 1 1- Introdução Uma reação química é composta de duas partes separadas por uma flecha, a qual indica o sentido da reação. As espécies químicas denominadas como reagentes ficam à esquerda
EQUILÍBRIO QUÍMICO 1 1- Introdução Uma reação química é composta de duas partes separadas por uma flecha, a qual indica o sentido da reação. As espécies químicas denominadas como reagentes ficam à esquerda
QFD: Quality Function Deployment QFD: CASA DA QUALIDADE - PASSO A PASSO
 QFD: CASA DA QUALIDADE - PASSO A PASSO 1 - INTRODUÇÃO Segundo Akao (1990), QFD é a conversão dos requisitos do consumidor em características de qualidade do produto e o desenvolvimento da qualidade de
QFD: CASA DA QUALIDADE - PASSO A PASSO 1 - INTRODUÇÃO Segundo Akao (1990), QFD é a conversão dos requisitos do consumidor em características de qualidade do produto e o desenvolvimento da qualidade de
ESTUDO DA CINÉTICA DE HIDRÓLISE ÁCIDA DO COMPOSTO Trans-[(Co(en) 2 Cl 2 )Cl]
![ESTUDO DA CINÉTICA DE HIDRÓLISE ÁCIDA DO COMPOSTO Trans-[(Co(en) 2 Cl 2 )Cl] ESTUDO DA CINÉTICA DE HIDRÓLISE ÁCIDA DO COMPOSTO Trans-[(Co(en) 2 Cl 2 )Cl]](/thumbs/26/8060460.jpg) TRABALHO 3 ESTUDO DA CINÉTICA DE HIDRÓLISE ÁCIDA DO COMPOSTO Trans-[(Co(en) 2 Cl 2 )Cl] 1. OBJECTIVO Estudo da cinética da reacção de hidrólise ácida do composto Trans-[Co(en) 2 Cl 2 ]Cl. Determinação
TRABALHO 3 ESTUDO DA CINÉTICA DE HIDRÓLISE ÁCIDA DO COMPOSTO Trans-[(Co(en) 2 Cl 2 )Cl] 1. OBJECTIVO Estudo da cinética da reacção de hidrólise ácida do composto Trans-[Co(en) 2 Cl 2 ]Cl. Determinação
IBM1018 Física Básica II FFCLRP USP Prof. Antônio Roque Aula 3
 Linhas de Força Mencionamos na aula passada que o físico inglês Michael Faraday (79-867) introduziu o conceito de linha de força para visualizar a interação elétrica entre duas cargas. Para Faraday, as
Linhas de Força Mencionamos na aula passada que o físico inglês Michael Faraday (79-867) introduziu o conceito de linha de força para visualizar a interação elétrica entre duas cargas. Para Faraday, as
Um estudo da correlação dos resultados patrimoniais e operacionais das seguradoras Francisco Galiza, Mestre em Economia (FGV)
 Um estudo da correlação dos resultados patrimoniais e operacionais das seguradoras Francisco Galiza, Mestre em Economia (FGV) Este estudo aborda a correlação entre os resultados operacionais e patrimoniais
Um estudo da correlação dos resultados patrimoniais e operacionais das seguradoras Francisco Galiza, Mestre em Economia (FGV) Este estudo aborda a correlação entre os resultados operacionais e patrimoniais
Introdução ao estudo de equações diferenciais
 Matemática (AP) - 2008/09 - Introdução ao estudo de equações diferenciais 77 Introdução ao estudo de equações diferenciais Introdução e de nição de equação diferencial Existe uma grande variedade de situações
Matemática (AP) - 2008/09 - Introdução ao estudo de equações diferenciais 77 Introdução ao estudo de equações diferenciais Introdução e de nição de equação diferencial Existe uma grande variedade de situações
Introdução a Química Analítica. Professora Mirian Maya Sakuno
 Introdução a Química Analítica Professora Mirian Maya Sakuno Química Analítica ou Química Quantitativa QUÍMICA ANALÍTICA: É a parte da química que estuda os princípios teóricos e práticos das análises
Introdução a Química Analítica Professora Mirian Maya Sakuno Química Analítica ou Química Quantitativa QUÍMICA ANALÍTICA: É a parte da química que estuda os princípios teóricos e práticos das análises
Revisão de Estatística Básica:
 Revisão de Estatística Básica: Estatística: Um número é denominado uma estatística (singular). Ex.: As vendas de uma empresa no mês constituem uma estatística. Estatísticas: Uma coleção de números ou fatos
Revisão de Estatística Básica: Estatística: Um número é denominado uma estatística (singular). Ex.: As vendas de uma empresa no mês constituem uma estatística. Estatísticas: Uma coleção de números ou fatos
Escola Básica da Gafanha da Encarnação Físico-Química 8º ano Ficha de trabalho 2014/2015 Nome N.º Turma Data: Enc. Educação Professora
 Escola Básica da Gafanha da Encarnação Físico-Química 8º ano Ficha de trabalho 2014/2015 Nome N.º Turma Data: Enc. Educação Professora 1. A Maria adicionou uma colher de chocolate em pó a um copo com Leite
Escola Básica da Gafanha da Encarnação Físico-Química 8º ano Ficha de trabalho 2014/2015 Nome N.º Turma Data: Enc. Educação Professora 1. A Maria adicionou uma colher de chocolate em pó a um copo com Leite
Se um sistema troca energia com a vizinhança por trabalho e por calor, então a variação da sua energia interna é dada por:
 Primeira Lei da Termodinâmica A energia interna U de um sistema é a soma das energias cinéticas e das energias potenciais de todas as partículas que formam esse sistema e, como tal, é uma propriedade do
Primeira Lei da Termodinâmica A energia interna U de um sistema é a soma das energias cinéticas e das energias potenciais de todas as partículas que formam esse sistema e, como tal, é uma propriedade do
LEI DE OHM. Professor João Luiz Cesarino Ferreira. Conceitos fundamentais
 LEI DE OHM Conceitos fundamentais Ao adquirir energia cinética suficiente, um elétron se transforma em um elétron livre e se desloca até colidir com um átomo. Com a colisão, ele perde parte ou toda energia
LEI DE OHM Conceitos fundamentais Ao adquirir energia cinética suficiente, um elétron se transforma em um elétron livre e se desloca até colidir com um átomo. Com a colisão, ele perde parte ou toda energia
Objetivos: Construção de tabelas e gráficos, escalas especiais para construção de gráficos e ajuste de curvas à dados experimentais.
 7aula Janeiro de 2012 CONSTRUÇÃO DE GRÁFICOS I: Papel Milimetrado Objetivos: Construção de tabelas e gráficos, escalas especiais para construção de gráficos e ajuste de curvas à dados experimentais. 7.1
7aula Janeiro de 2012 CONSTRUÇÃO DE GRÁFICOS I: Papel Milimetrado Objetivos: Construção de tabelas e gráficos, escalas especiais para construção de gráficos e ajuste de curvas à dados experimentais. 7.1
Capítulo 3. Avaliação de Desempenho. 3.1 Definição de Desempenho
 20 Capítulo 3 Avaliação de Desempenho Este capítulo aborda como medir, informar e documentar aspectos relativos ao desempenho de um computador. Além disso, descreve os principais fatores que influenciam
20 Capítulo 3 Avaliação de Desempenho Este capítulo aborda como medir, informar e documentar aspectos relativos ao desempenho de um computador. Além disso, descreve os principais fatores que influenciam
Potenciação no Conjunto dos Números Inteiros - Z
 Rua Oto de Alencar nº 5-9, Maracanã/RJ - tel. 04-98/4-98 Potenciação no Conjunto dos Números Inteiros - Z Podemos epressar o produto de quatro fatores iguais a.... por meio de uma potência de base e epoente
Rua Oto de Alencar nº 5-9, Maracanã/RJ - tel. 04-98/4-98 Potenciação no Conjunto dos Números Inteiros - Z Podemos epressar o produto de quatro fatores iguais a.... por meio de uma potência de base e epoente
5. Resultados e Análises
 66 5. Resultados e Análises Neste capítulo é importante ressaltar que as medições foram feitas com uma velocidade constante de 1800 RPM, para uma freqüência de 60 Hz e uma voltagem de 220 V, entre as linhas
66 5. Resultados e Análises Neste capítulo é importante ressaltar que as medições foram feitas com uma velocidade constante de 1800 RPM, para uma freqüência de 60 Hz e uma voltagem de 220 V, entre as linhas
Qualificação de Procedimentos
 Qualificação de Procedimentos Os equipamentos em geral são fabricados por meio de uniões de partes metálicas entre si empregando-se soldas. Há, portanto a necessidade de se garantir, nestas uniões soldadas,
Qualificação de Procedimentos Os equipamentos em geral são fabricados por meio de uniões de partes metálicas entre si empregando-se soldas. Há, portanto a necessidade de se garantir, nestas uniões soldadas,
PARTE 2 FUNÇÕES VETORIAIS DE UMA VARIÁVEL REAL
 PARTE FUNÇÕES VETORIAIS DE UMA VARIÁVEL REAL.1 Funções Vetoriais de Uma Variável Real Vamos agora tratar de um caso particular de funções vetoriais F : Dom(f R n R m, que são as funções vetoriais de uma
PARTE FUNÇÕES VETORIAIS DE UMA VARIÁVEL REAL.1 Funções Vetoriais de Uma Variável Real Vamos agora tratar de um caso particular de funções vetoriais F : Dom(f R n R m, que são as funções vetoriais de uma
Método dos mínimos quadrados - ajuste linear
 Apêndice A Método dos mínimos quadrados - ajuste linear Ao final de uma experiência muitas vezes temos um conjunto de N medidas na forma de pares (x i, y i ). Por exemplo, imagine uma experiência em que
Apêndice A Método dos mínimos quadrados - ajuste linear Ao final de uma experiência muitas vezes temos um conjunto de N medidas na forma de pares (x i, y i ). Por exemplo, imagine uma experiência em que
Reações a altas temperaturas. Diagrama de Equilíbrio
 Reações a altas temperaturas Diagrama de Equilíbrio Propriedades de um corpo cerâmico Determinadas pelas propriedades de cada fase presente e pelo modo com que essas fases (incluindo a porosidade) estão
Reações a altas temperaturas Diagrama de Equilíbrio Propriedades de um corpo cerâmico Determinadas pelas propriedades de cada fase presente e pelo modo com que essas fases (incluindo a porosidade) estão
Introdução. Muitas reações ocorrem completamente e de forma irreversível como por exemplo a reação da queima de um papel ou palito de fósforo.
 Introdução Muitas reações ocorrem completamente e de forma irreversível como por exemplo a reação da queima de um papel ou palito de fósforo. Existem também sistemas, em que as reações direta e inversa
Introdução Muitas reações ocorrem completamente e de forma irreversível como por exemplo a reação da queima de um papel ou palito de fósforo. Existem também sistemas, em que as reações direta e inversa
4 Avaliação Econômica
 4 Avaliação Econômica Este capítulo tem o objetivo de descrever a segunda etapa da metodologia, correspondente a avaliação econômica das entidades de reservas. A avaliação econômica é realizada a partir
4 Avaliação Econômica Este capítulo tem o objetivo de descrever a segunda etapa da metodologia, correspondente a avaliação econômica das entidades de reservas. A avaliação econômica é realizada a partir
Capítulo 2 - Problemas de Valores Fronteira para Equações Diferenciais Ordinárias
 Capítulo 2 - Problemas de Valores Fronteira para Equações Diferenciais Ordinárias Departamento de Matemática balsa@ipb.pt Mestrados em Engenharia da Construção Métodos de Aproximação em Engenharia 1 o
Capítulo 2 - Problemas de Valores Fronteira para Equações Diferenciais Ordinárias Departamento de Matemática balsa@ipb.pt Mestrados em Engenharia da Construção Métodos de Aproximação em Engenharia 1 o
QUIMICA ORGÂNICA BÁSICA
 QUIMICA ORGÂNICA BÁSICA Hibridização Revisão - Química Orgânica Básica 1 Tabela Periódica 2 Moléculas Diatômicas 3 Moléculas Poliatômicas 4 Eletronegatividade 5 A interação da luz e a matéria 6 Hibridização
QUIMICA ORGÂNICA BÁSICA Hibridização Revisão - Química Orgânica Básica 1 Tabela Periódica 2 Moléculas Diatômicas 3 Moléculas Poliatômicas 4 Eletronegatividade 5 A interação da luz e a matéria 6 Hibridização
3.2 Equilíbrio de Fases Vapor - Líquida - Sólida numa Substância Pura Consideremos como sistema a água contida no conjunto êmbolo - cilindro abaixo:
 - Resumo do Capítulo 0 de Termodinâmica: Capítulo - PROPRIEDADES DE UMA SUBSTÂNCIA PURA Nós consideramos, no capítulo anterior, três propriedades familiares de uma substância: volume específico, pressão
- Resumo do Capítulo 0 de Termodinâmica: Capítulo - PROPRIEDADES DE UMA SUBSTÂNCIA PURA Nós consideramos, no capítulo anterior, três propriedades familiares de uma substância: volume específico, pressão
A) a existência do oceano líquido é uma hipótese possível, pois um sal solúvel só forma uma mistura homogênea com a água, quando ela está líquida.
 TEXTO PARA A QUESTÃO 1. Sonda espacial detecta sal de cozinha em lua de Saturno A análise da composição química do anel mais externo de Saturno revelou a presença de 98% de água, 1% de cloreto de sódio,
TEXTO PARA A QUESTÃO 1. Sonda espacial detecta sal de cozinha em lua de Saturno A análise da composição química do anel mais externo de Saturno revelou a presença de 98% de água, 1% de cloreto de sódio,
GUIA DE REDAÇÃO PARA TRABALHO DE EM974
 GUIA DE REDAÇÃO PARA TRABALHO DE EM974 CONSIDERAÇÕES GERAIS O objetivo deste documento é informar a estrutura e a informação esperadas num texto de Trabalho de Graduação. O conteúdo do texto deverá ser
GUIA DE REDAÇÃO PARA TRABALHO DE EM974 CONSIDERAÇÕES GERAIS O objetivo deste documento é informar a estrutura e a informação esperadas num texto de Trabalho de Graduação. O conteúdo do texto deverá ser
UNIVERSIDADE FEDERAL DO ESPÍRITO SANTO PROGRAMA DE EDUCAÇÃO TUTORIAL - MATEMÁTICA PROJETO FUNDAMENTOS DE MATEMÁTICA ELEMENTAR
 UNIVERSIDADE FEDERAL DO ESPÍRITO SANTO PROGRAMA DE EDUCAÇÃO TUTORIAL - MATEMÁTICA PROJETO FUNDAMENTOS DE MATEMÁTICA ELEMENTAR Assuntos: Matrizes; Matrizes Especiais; Operações com Matrizes; Operações Elementares
UNIVERSIDADE FEDERAL DO ESPÍRITO SANTO PROGRAMA DE EDUCAÇÃO TUTORIAL - MATEMÁTICA PROJETO FUNDAMENTOS DE MATEMÁTICA ELEMENTAR Assuntos: Matrizes; Matrizes Especiais; Operações com Matrizes; Operações Elementares
9. Derivadas de ordem superior
 9. Derivadas de ordem superior Se uma função f for derivável, então f é chamada a derivada primeira de f (ou de ordem 1). Se a derivada de f eistir, então ela será chamada derivada segunda de f (ou de
9. Derivadas de ordem superior Se uma função f for derivável, então f é chamada a derivada primeira de f (ou de ordem 1). Se a derivada de f eistir, então ela será chamada derivada segunda de f (ou de
Estequiometria. Prof a. Dr a. Flaviana Tavares Vieira
 Universidade Federal dos Vales do Jequitinhonha e Mucuri Bacharelado em Ciência e Tecnologia Diamantina - MG Estequiometria Prof a. Dr a. Flaviana Tavares Vieira -A palavra estequiometria deriva das palavras
Universidade Federal dos Vales do Jequitinhonha e Mucuri Bacharelado em Ciência e Tecnologia Diamantina - MG Estequiometria Prof a. Dr a. Flaviana Tavares Vieira -A palavra estequiometria deriva das palavras
Termodinâmica Química: Lista 1: Gases. Resolução comentada de exercícios selecionados
 Termodinâmica Química: Lista 1: Gases. Resolução comentada de exercícios selecionados Prof. Fabrício R. Sensato Semestre 4º Engenharia: Materiais Período: Matutino/diurno Regimes: Normal/DP Agosto, 2005
Termodinâmica Química: Lista 1: Gases. Resolução comentada de exercícios selecionados Prof. Fabrício R. Sensato Semestre 4º Engenharia: Materiais Período: Matutino/diurno Regimes: Normal/DP Agosto, 2005
Universidade Federal da Paraíba Centro de Ciências Exatas e da Natureza Departamento de Química Disciplina: Físico-Química II Professora: Claudia
 Universidade Federal da Paraíba Centro de Ciências Exatas e da Natureza Departamento de Química Disciplina: Físico-Química II Professora: Claudia Aluno: Julys Pablo Atayde Fernandes Células a Combustível:
Universidade Federal da Paraíba Centro de Ciências Exatas e da Natureza Departamento de Química Disciplina: Físico-Química II Professora: Claudia Aluno: Julys Pablo Atayde Fernandes Células a Combustível:
94 (8,97%) 69 (6,58%) 104 (9,92%) 101 (9,64%) 22 (2,10%) 36 (3,44%) 115 (10,97%) 77 (7,35%) 39 (3,72%) 78 (7,44%) 103 (9,83%)
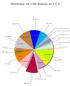 Distribuição das 1.048 Questões do I T A 94 (8,97%) 104 (9,92%) 69 (6,58%) Equações Irracionais 09 (0,86%) Equações Exponenciais 23 (2, 101 (9,64%) Geo. Espacial Geo. Analítica Funções Conjuntos 31 (2,96%)
Distribuição das 1.048 Questões do I T A 94 (8,97%) 104 (9,92%) 69 (6,58%) Equações Irracionais 09 (0,86%) Equações Exponenciais 23 (2, 101 (9,64%) Geo. Espacial Geo. Analítica Funções Conjuntos 31 (2,96%)
VENTILADORES INTRODUÇÃO: Como outras turbomáquinas, os ventiladores são equipamentos essenciais a determinados processos
 Universidade Federal do Paraná Curso de Engenharia Industrial Madeireira MÁQUINAS HIDRÁULICAS AT-087 Dr. Alan Sulato de Andrade alansulato@ufpr.br INTRODUÇÃO: Como outras turbomáquinas, os ventiladores
Universidade Federal do Paraná Curso de Engenharia Industrial Madeireira MÁQUINAS HIDRÁULICAS AT-087 Dr. Alan Sulato de Andrade alansulato@ufpr.br INTRODUÇÃO: Como outras turbomáquinas, os ventiladores
Esse grupo já foi conhecido como gases raros e gases inertes.
 GASES NOBRES GRUPO 18 OU VIIIA Esse grupo já foi conhecido como gases raros e gases inertes. Gases raros não é apropriado porque o argônio (Ar) não é raro (é mais abundante que o CO 2 no ar). Gases Inertes
GASES NOBRES GRUPO 18 OU VIIIA Esse grupo já foi conhecido como gases raros e gases inertes. Gases raros não é apropriado porque o argônio (Ar) não é raro (é mais abundante que o CO 2 no ar). Gases Inertes
Carga dos alimentadores
 50 Análise de consumo de energia e aplicações Capítulo V Carga dos alimentadores Por Manuel Luís Barreira Martinez* Em continuidade ao capítulo anterior, Locação de cargas métodos para a locação de carga
50 Análise de consumo de energia e aplicações Capítulo V Carga dos alimentadores Por Manuel Luís Barreira Martinez* Em continuidade ao capítulo anterior, Locação de cargas métodos para a locação de carga
1. Objectivo Durante uma experiência, medem-se certas variáveis, ex.: concentrações, pressões, temperaturas,
 MODELAÇÃO E DETERMINAÇÃO DE PARÂMETROS CINÉTICOS FILIPE GAMA FREIRE 1. Objectivo Durante uma experiência, medem-se certas variáveis, ex.: concentrações, pressões, temperaturas, etc. a que chamaremos y
MODELAÇÃO E DETERMINAÇÃO DE PARÂMETROS CINÉTICOS FILIPE GAMA FREIRE 1. Objectivo Durante uma experiência, medem-se certas variáveis, ex.: concentrações, pressões, temperaturas, etc. a que chamaremos y
Exemplo 1: As Indústrias Químicas SA tem como um de seus produtos principais o 3- vinil- 1,5- hexadieno que é processado em um tanque com agitação
 Exemplo 1: As Indústrias Químicas SA tem como um de seus produtos principais o 3- vinil- 1,5- hexadieno que é processado em um tanque com agitação que funciona com cargas intermitentes. Você é convidado
Exemplo 1: As Indústrias Químicas SA tem como um de seus produtos principais o 3- vinil- 1,5- hexadieno que é processado em um tanque com agitação que funciona com cargas intermitentes. Você é convidado
CINÉTICA QUÍMICA CINÉTICA QUÍMICA EQUAÇÃO DE ARRHENIUS
 CINÉTICA QUÍMICA CINÉTICA QUÍMICA EQUAÇÃO DE ARRHENIUS A DEPENDÊNCIA DA VELOCIDADE DE REAÇÃO COM A TEMPERATURA A velocidade da maioria das reações químicas aumenta à medida que a temperatura também aumenta.
CINÉTICA QUÍMICA CINÉTICA QUÍMICA EQUAÇÃO DE ARRHENIUS A DEPENDÊNCIA DA VELOCIDADE DE REAÇÃO COM A TEMPERATURA A velocidade da maioria das reações químicas aumenta à medida que a temperatura também aumenta.
TIPO DE PROVA: A. Questão 1. Questão 4. Questão 2. Questão 3. alternativa D. alternativa A. alternativa D. alternativa C
 Questão TIPO DE PROVA: A Se a circunferência de um círculo tiver o seu comprimento aumentado de 00%, a área do círculo ficará aumentada de: a) 00% d) 00% b) 400% e) 00% c) 50% Aumentando o comprimento
Questão TIPO DE PROVA: A Se a circunferência de um círculo tiver o seu comprimento aumentado de 00%, a área do círculo ficará aumentada de: a) 00% d) 00% b) 400% e) 00% c) 50% Aumentando o comprimento
Ajuste dos Parâmetros de um Controlador PI em uma Coluna de Destilação Binária
 Ajuste dos Parâmetros de um Controlador PI em uma Coluna de Destilação Binária Marina Roberto Martins 1*, Fernando Palú 1 (1) Universidade Estadual do Oeste do Paraná, Curso de Engenharia Química. e-mail:
Ajuste dos Parâmetros de um Controlador PI em uma Coluna de Destilação Binária Marina Roberto Martins 1*, Fernando Palú 1 (1) Universidade Estadual do Oeste do Paraná, Curso de Engenharia Química. e-mail:
Geração de Energia Elétrica
 Geração de Energia Elétrica Aspectos Dinâmicos da Geração Hidroelétrica Joinville, 21 de Março de 2012 Escopo dos Tópicos Abordados Controle de Carga-Frequência Regulação Primária Modelo do Sistema de
Geração de Energia Elétrica Aspectos Dinâmicos da Geração Hidroelétrica Joinville, 21 de Março de 2012 Escopo dos Tópicos Abordados Controle de Carga-Frequência Regulação Primária Modelo do Sistema de
Abordagem de Processo: conceitos e diretrizes para sua implementação
 QP Informe Reservado Nº 70 Maio/2007 Abordagem de Processo: conceitos e diretrizes para sua implementação Tradução para o português especialmente preparada para os Associados ao QP. Este guindance paper
QP Informe Reservado Nº 70 Maio/2007 Abordagem de Processo: conceitos e diretrizes para sua implementação Tradução para o português especialmente preparada para os Associados ao QP. Este guindance paper
Todos os exercícios sugeridos nesta apostila se referem ao volume 1. MATEMÁTICA I 1 FUNÇÃO DO 1º GRAU
 FUNÇÃO IDENTIDADE... FUNÇÃO LINEAR... FUNÇÃO AFIM... GRÁFICO DA FUNÇÃO DO º GRAU... IMAGEM... COEFICIENTES DA FUNÇÃO AFIM... ZERO DA FUNÇÃO AFIM... 8 FUNÇÕES CRESCENTES OU DECRESCENTES... 9 SINAL DE UMA
FUNÇÃO IDENTIDADE... FUNÇÃO LINEAR... FUNÇÃO AFIM... GRÁFICO DA FUNÇÃO DO º GRAU... IMAGEM... COEFICIENTES DA FUNÇÃO AFIM... ZERO DA FUNÇÃO AFIM... 8 FUNÇÕES CRESCENTES OU DECRESCENTES... 9 SINAL DE UMA
x0 = 1 x n = 3x n 1 x k x k 1 Quantas são as sequências com n letras, cada uma igual a a, b ou c, de modo que não há duas letras a seguidas?
 Recorrências Muitas vezes não é possível resolver problemas de contagem diretamente combinando os princípios aditivo e multiplicativo. Para resolver esses problemas recorremos a outros recursos: as recursões
Recorrências Muitas vezes não é possível resolver problemas de contagem diretamente combinando os princípios aditivo e multiplicativo. Para resolver esses problemas recorremos a outros recursos: as recursões
O tornado de projeto é admitido, para fins quantitativos, com as seguintes características [15]:
![O tornado de projeto é admitido, para fins quantitativos, com as seguintes características [15]: O tornado de projeto é admitido, para fins quantitativos, com as seguintes características [15]:](/thumbs/27/10931177.jpg) 4 Tornado de Projeto O tornado de projeto é admitido, para fins quantitativos, com as seguintes características [15]: Tornado do tipo F3-médio; Velocidade máxima de 233km/h = 64,72m/s; Velocidade translacional
4 Tornado de Projeto O tornado de projeto é admitido, para fins quantitativos, com as seguintes características [15]: Tornado do tipo F3-médio; Velocidade máxima de 233km/h = 64,72m/s; Velocidade translacional
4 Segmentação. 4.1. Algoritmo proposto
 4 Segmentação Este capítulo apresenta primeiramente o algoritmo proposto para a segmentação do áudio em detalhes. Em seguida, são analisadas as inovações apresentadas. É importante mencionar que as mudanças
4 Segmentação Este capítulo apresenta primeiramente o algoritmo proposto para a segmentação do áudio em detalhes. Em seguida, são analisadas as inovações apresentadas. É importante mencionar que as mudanças
Química Atomística Profª: Bruna Villas Bôas. Exercícios
 NÚMERO ATÔMICO (Z) Os diferentes tipos de átomos (elementos químicos) são identificados pela quantidade de prótons (P) que possui. Esta quantidade de prótons recebe o nome de número atômico e é representado
NÚMERO ATÔMICO (Z) Os diferentes tipos de átomos (elementos químicos) são identificados pela quantidade de prótons (P) que possui. Esta quantidade de prótons recebe o nome de número atômico e é representado
PROPRIEDADES DA MATÉRIA
 Profª Msc.Anna Carolina A. Ribeiro PROPRIEDADES DA MATÉRIA RELEMBRANDO Matéria é tudo que tem massa e ocupa lugar no espaço. Não existe vida nem manutenção da vida sem matéria. Corpo- Trata-se de uma porção
Profª Msc.Anna Carolina A. Ribeiro PROPRIEDADES DA MATÉRIA RELEMBRANDO Matéria é tudo que tem massa e ocupa lugar no espaço. Não existe vida nem manutenção da vida sem matéria. Corpo- Trata-se de uma porção
3 Espectroscopia no Infravermelho 3.1. Princípios Básicos
 3 Espectroscopia no Infravermelho 3.1. Princípios Básicos A espectroscopia estuda a interação da radiação eletromagnética com a matéria, sendo um dos seus principais objetivos o estudo dos níveis de energia
3 Espectroscopia no Infravermelho 3.1. Princípios Básicos A espectroscopia estuda a interação da radiação eletromagnética com a matéria, sendo um dos seus principais objetivos o estudo dos níveis de energia
3.4 O Princípio da Equipartição de Energia e a Capacidade Calorífica Molar
 3.4 O Princípio da Equipartição de Energia e a Capacidade Calorífica Molar Vimos que as previsões sobre as capacidades caloríficas molares baseadas na teoria cinética estão de acordo com o comportamento
3.4 O Princípio da Equipartição de Energia e a Capacidade Calorífica Molar Vimos que as previsões sobre as capacidades caloríficas molares baseadas na teoria cinética estão de acordo com o comportamento
Práticas de Marketing relacionadas com o sucesso no lançamento de novos produtos
 Práticas de Marketing relacionadas com o sucesso no lançamento de novos produtos Revista de Administração, v. 18, n. 1, Janeiro/Março 1983, p. 44 a 51 Fauze Najib Mattar Entre os vários fatores internos
Práticas de Marketing relacionadas com o sucesso no lançamento de novos produtos Revista de Administração, v. 18, n. 1, Janeiro/Março 1983, p. 44 a 51 Fauze Najib Mattar Entre os vários fatores internos
DISTRIBUIÇÃO DE WEIBULL CONCEITOS BÁSICOS APLICAÇÕES
 LUIZ CLAUDIO BENCK KEVIN WONG TAMARA CANDIDO DISTRIBUIÇÃO DE WEIBULL CONCEITOS BÁSICOS APLICAÇÕES Trabalho apresentado para avaliação na disciplina de Estatística e Métodos Numéricos do Curso de Administração
LUIZ CLAUDIO BENCK KEVIN WONG TAMARA CANDIDO DISTRIBUIÇÃO DE WEIBULL CONCEITOS BÁSICOS APLICAÇÕES Trabalho apresentado para avaliação na disciplina de Estatística e Métodos Numéricos do Curso de Administração
Cláudio Tadeu Cristino 1. Julho, 2014
 Inferência Estatística Estimação Cláudio Tadeu Cristino 1 1 Universidade Federal de Pernambuco, Recife, Brasil Mestrado em Nutrição, Atividade Física e Plasticidade Fenotípica Julho, 2014 C.T.Cristino
Inferência Estatística Estimação Cláudio Tadeu Cristino 1 1 Universidade Federal de Pernambuco, Recife, Brasil Mestrado em Nutrição, Atividade Física e Plasticidade Fenotípica Julho, 2014 C.T.Cristino
5910170 Física II Ondas, Fluidos e Termodinâmica USP Prof. Antônio Roque Aula 1
 597 Física II Ondas, Fluidos e Termodinâmica USP Prof. Antônio Roque Movimentos Periódicos Para estudar movimentos oscilatórios periódicos é conveniente ter algum modelo físico em mente. Por exemplo, um
597 Física II Ondas, Fluidos e Termodinâmica USP Prof. Antônio Roque Movimentos Periódicos Para estudar movimentos oscilatórios periódicos é conveniente ter algum modelo físico em mente. Por exemplo, um
Exercícios Teóricos Resolvidos
 Universidade Federal de Minas Gerais Instituto de Ciências Exatas Departamento de Matemática Exercícios Teóricos Resolvidos O propósito deste texto é tentar mostrar aos alunos várias maneiras de raciocinar
Universidade Federal de Minas Gerais Instituto de Ciências Exatas Departamento de Matemática Exercícios Teóricos Resolvidos O propósito deste texto é tentar mostrar aos alunos várias maneiras de raciocinar
ActivALEA. active e actualize a sua literacia
 ActivALEA active e actualize a sua literacia N.º 0 - DIIAGRAMA DE EXTREMOS E QUARTIIS Por: Maria Eugénia Graça Martins Departamento de Estatística e Investigação Operacional da FCUL memartins@fc.ul.pt
ActivALEA active e actualize a sua literacia N.º 0 - DIIAGRAMA DE EXTREMOS E QUARTIIS Por: Maria Eugénia Graça Martins Departamento de Estatística e Investigação Operacional da FCUL memartins@fc.ul.pt
Explorações de alunos
 A partir dos exemplos sugeridos e explorados pelos alunos pretende-se que possam conjecturar que, dadas duas funções reais de variável real f e g, o domínio da função quociente pode ser dado por: f f g
A partir dos exemplos sugeridos e explorados pelos alunos pretende-se que possam conjecturar que, dadas duas funções reais de variável real f e g, o domínio da função quociente pode ser dado por: f f g
ɸ E = ΣE.A (5) 14/04/2015. Bacharelado em Engenharia Civil. Física III
 Bacharelado em Engenharia Civil Física III Prof a.: M.Sc. Mariana de Faria Gardingo Diniz FLUXO DE CAMPO ELÉTRICO Imagine que as linhas de campo da figura abaixo representem um campo elétrico de cargas
Bacharelado em Engenharia Civil Física III Prof a.: M.Sc. Mariana de Faria Gardingo Diniz FLUXO DE CAMPO ELÉTRICO Imagine que as linhas de campo da figura abaixo representem um campo elétrico de cargas
- A velocidade da reação direta (V1) é igual à velocidade da reação inversa (V2) V 1 = V 2
 EQUILÍBRIO QUÍMICO Equilíbrio Químico - Equilíbrio químico é a parte da físico-química que estuda as reações reversíveis e as condições para o estabelecimento desta atividade equilibrada. A + B C + D -
EQUILÍBRIO QUÍMICO Equilíbrio Químico - Equilíbrio químico é a parte da físico-química que estuda as reações reversíveis e as condições para o estabelecimento desta atividade equilibrada. A + B C + D -
James Clerk Maxwell (1831-1879)
 4 Introdução à Teoria Cinética James Clerk Maxwell (1831-1879) Físico britânico nascido em Dumfrieshire na Escócia, que desde muito jovem demonstrou possuir dotes excepcionais para a matemática. Em 1857
4 Introdução à Teoria Cinética James Clerk Maxwell (1831-1879) Físico britânico nascido em Dumfrieshire na Escócia, que desde muito jovem demonstrou possuir dotes excepcionais para a matemática. Em 1857
Departamento de Matemática - UEL - 2010. Ulysses Sodré. http://www.mat.uel.br/matessencial/ Arquivo: minimaxi.tex - Londrina-PR, 29 de Junho de 2010.
 Matemática Essencial Extremos de funções reais Departamento de Matemática - UEL - 2010 Conteúdo Ulysses Sodré http://www.mat.uel.br/matessencial/ Arquivo: minimaxi.tex - Londrina-PR, 29 de Junho de 2010.
Matemática Essencial Extremos de funções reais Departamento de Matemática - UEL - 2010 Conteúdo Ulysses Sodré http://www.mat.uel.br/matessencial/ Arquivo: minimaxi.tex - Londrina-PR, 29 de Junho de 2010.
O ESPAÇO NULO DE A: RESOLVENDO AX = 0 3.2
 3.2 O Espaço Nulo de A: Resolvendo Ax = 0 11 O ESPAÇO NULO DE A: RESOLVENDO AX = 0 3.2 Esta seção trata do espaço de soluções para Ax = 0. A matriz A pode ser quadrada ou retangular. Uma solução imediata
3.2 O Espaço Nulo de A: Resolvendo Ax = 0 11 O ESPAÇO NULO DE A: RESOLVENDO AX = 0 3.2 Esta seção trata do espaço de soluções para Ax = 0. A matriz A pode ser quadrada ou retangular. Uma solução imediata
Faculdade Sagrada Família
 AULA 12 - AJUSTAMENTO DE CURVAS E O MÉTODO DOS MÍNIMOS QUADRADOS Ajustamento de Curvas Sempre que desejamos estudar determinada variável em função de outra, fazemos uma análise de regressão. Podemos dizer
AULA 12 - AJUSTAMENTO DE CURVAS E O MÉTODO DOS MÍNIMOS QUADRADOS Ajustamento de Curvas Sempre que desejamos estudar determinada variável em função de outra, fazemos uma análise de regressão. Podemos dizer
Como escrever um bom RELATÓRIO
 Como escrever um bom RELATÓRIO Mas o que é uma EXPERIÊNCIA? e um RELATÓRIO? Profa. Ewa W. Cybulska Profa. Márcia R. D. Rodrigues Experiência Relatório Pergunta à Natureza e a procura da Resposta Divulgação
Como escrever um bom RELATÓRIO Mas o que é uma EXPERIÊNCIA? e um RELATÓRIO? Profa. Ewa W. Cybulska Profa. Márcia R. D. Rodrigues Experiência Relatório Pergunta à Natureza e a procura da Resposta Divulgação
EE210 Sistemas de Comunicação II 2ª Avaliação (PV2) 22/04/2015 15h30min Profs. Dayan A. Guimarães e Rausley A. A. de Souza. Aluno(a): Matrícula.
 EE1 Sistemas de Comunicação II ª Avaliação (PV) /4/15 15h3min Profs. Dayan A. Guimarães e Rausley A. A. de Souza Nota : Nota P: Aluno(a): Matrícula. Prova sem consulta, com duração de 1h5min. A interpretação
EE1 Sistemas de Comunicação II ª Avaliação (PV) /4/15 15h3min Profs. Dayan A. Guimarães e Rausley A. A. de Souza Nota : Nota P: Aluno(a): Matrícula. Prova sem consulta, com duração de 1h5min. A interpretação
Aula 8 Circuitos Integrados
 INTRODUÇÃO À ENGENHRI DE COMPUTÇÃO PONTIFÍCI UNIVERSIDDE CTÓLIC DO RIO GRNDE DO SUL FCULDDE DE ENGENHRI ula Circuitos Integrados Introdução Portas Lógicas em Circuitos Integrados Implementação de Funções
INTRODUÇÃO À ENGENHRI DE COMPUTÇÃO PONTIFÍCI UNIVERSIDDE CTÓLIC DO RIO GRNDE DO SUL FCULDDE DE ENGENHRI ula Circuitos Integrados Introdução Portas Lógicas em Circuitos Integrados Implementação de Funções
2 Comportamento Termodinâmico de Fluidos no Reservatório
 Comportamento Termodinâmico de Fluidos no Reservatório 39 2 Comportamento Termodinâmico de Fluidos no Reservatório 2.1 Introdução Apresenta-se neste capítulo uma breve análise dos princípios básicos do
Comportamento Termodinâmico de Fluidos no Reservatório 39 2 Comportamento Termodinâmico de Fluidos no Reservatório 2.1 Introdução Apresenta-se neste capítulo uma breve análise dos princípios básicos do
E A D - S I S T E M A S L I N E A R E S INTRODUÇÃO
 E A D - S I S T E M A S L I N E A R E S INTRODUÇÃO Dizemos que uma equação é linear, ou de primeiro grau, em certa incógnita, se o maior expoente desta variável for igual a um. Ela será quadrática, ou
E A D - S I S T E M A S L I N E A R E S INTRODUÇÃO Dizemos que uma equação é linear, ou de primeiro grau, em certa incógnita, se o maior expoente desta variável for igual a um. Ela será quadrática, ou
4. Introdução à termodinâmica
 4. Introdução à termodinâmica 4.1. Energia interna O estabelecimento do princípio da conservação da energia tornou-se possível quando se conseguiu demonstrar que junto com a energia mecânica, os corpos
4. Introdução à termodinâmica 4.1. Energia interna O estabelecimento do princípio da conservação da energia tornou-se possível quando se conseguiu demonstrar que junto com a energia mecânica, os corpos
ficha 3 espaços lineares
 Exercícios de Álgebra Linear ficha 3 espaços lineares Exercícios coligidos por Jorge Almeida e Lina Oliveira Departamento de Matemática, Instituto Superior Técnico 2 o semestre 2011/12 3 Notação Sendo
Exercícios de Álgebra Linear ficha 3 espaços lineares Exercícios coligidos por Jorge Almeida e Lina Oliveira Departamento de Matemática, Instituto Superior Técnico 2 o semestre 2011/12 3 Notação Sendo
Cálculo de potência; Limites de confiança; Análise estatística (ANOVA).
 CENTRO UNIVERSITÁRIO FRANCISCANO UNIFRA CURSO DE FARMÁCIA CONTROLE BIOLÓGICO DA QUALIDADE DE MEDICAMENTOS DELINEAMENTO: 3 x 3 3 doses do padrão Prof. Marcos R. dos Santos P2 A1 A3 A2 P1 A = amostra P=
CENTRO UNIVERSITÁRIO FRANCISCANO UNIFRA CURSO DE FARMÁCIA CONTROLE BIOLÓGICO DA QUALIDADE DE MEDICAMENTOS DELINEAMENTO: 3 x 3 3 doses do padrão Prof. Marcos R. dos Santos P2 A1 A3 A2 P1 A = amostra P=
MÓDULO 6 INTRODUÇÃO À PROBABILIDADE
 MÓDULO 6 INTRODUÇÃO À PROBBILIDDE Quando estudamos algum fenômeno através do método estatístico, na maior parte das vezes é preciso estabelecer uma distinção entre o modelo matemático que construímos para
MÓDULO 6 INTRODUÇÃO À PROBBILIDDE Quando estudamos algum fenômeno através do método estatístico, na maior parte das vezes é preciso estabelecer uma distinção entre o modelo matemático que construímos para
PÓS GRADUAÇÃO EM CIÊNCIAS DE FLORESTAS TROPICAIS-PG-CFT INSTITUTO NACIONAL DE PESQUISAS DA AMAZÔNIA-INPA. 09/abril de 2014
 PÓS GRADUAÇÃO EM CIÊNCIAS DE FLORESTAS TROPICAIS-PG-CFT INSTITUTO NACIONAL DE PESQUISAS DA AMAZÔNIA-INPA 09/abril de 2014 Considerações Estatísticas para Planejamento e Publicação 1 Circularidade do Método
PÓS GRADUAÇÃO EM CIÊNCIAS DE FLORESTAS TROPICAIS-PG-CFT INSTITUTO NACIONAL DE PESQUISAS DA AMAZÔNIA-INPA 09/abril de 2014 Considerações Estatísticas para Planejamento e Publicação 1 Circularidade do Método
Prova de Recuperação Bimestral de Ciências Nome Completo: Data: / /2010
 COLÉGIO MARIA IMACULADA QI 05 ch. 72 LAGO SUL BRASÍLIA DF E-MAIL: cmidf@cmidf.com.br FONE: 248 4768 SITE: www.cmidf.com.br VALOR:10 pontos. NOTA: 9ºano 2º PERÍODO Prova de Recuperação Bimestral de Ciências
COLÉGIO MARIA IMACULADA QI 05 ch. 72 LAGO SUL BRASÍLIA DF E-MAIL: cmidf@cmidf.com.br FONE: 248 4768 SITE: www.cmidf.com.br VALOR:10 pontos. NOTA: 9ºano 2º PERÍODO Prova de Recuperação Bimestral de Ciências
APLICAÇÕES DA DERIVADA
 Notas de Aula: Aplicações das Derivadas APLICAÇÕES DA DERIVADA Vimos, na seção anterior, que a derivada de uma função pode ser interpretada como o coeficiente angular da reta tangente ao seu gráfico. Nesta,
Notas de Aula: Aplicações das Derivadas APLICAÇÕES DA DERIVADA Vimos, na seção anterior, que a derivada de uma função pode ser interpretada como o coeficiente angular da reta tangente ao seu gráfico. Nesta,
SÉRIE: 2º ano EM Exercícios de recuperação final DATA / / DISCIPLINA: QUÍMICA PROFESSOR: FLÁVIO QUESTÕES DE MÚLTIPLA ESCOLHA
 SÉRIE: 2º ano EM Exercícios de recuperação final DATA / / DISCIPLINA: QUÍMICA PROFESSOR: FLÁVIO QUESTÕES DE MÚLTIPLA ESCOLHA QUESTÃO 01 Em uma determinada transformação foi constatado que poderia ser representada
SÉRIE: 2º ano EM Exercícios de recuperação final DATA / / DISCIPLINA: QUÍMICA PROFESSOR: FLÁVIO QUESTÕES DE MÚLTIPLA ESCOLHA QUESTÃO 01 Em uma determinada transformação foi constatado que poderia ser representada
Resposta Transitória de Circuitos com Elementos Armazenadores de Energia
 ENG 1403 Circuitos Elétricos e Eletrônicos Resposta Transitória de Circuitos com Elementos Armazenadores de Energia Guilherme P. Temporão 1. Introdução Nas últimas duas aulas, vimos como circuitos com
ENG 1403 Circuitos Elétricos e Eletrônicos Resposta Transitória de Circuitos com Elementos Armazenadores de Energia Guilherme P. Temporão 1. Introdução Nas últimas duas aulas, vimos como circuitos com
REPRESENTAÇÃO FASORIAL DE SINAIS SENOIDAIS
 REPRESENTAÇÃO FASORIAL DE SINAIS SENOIDAIS Neste capítulo será apresentada uma prática ferramenta gráfica e matemática que permitirá e facilitará as operações algébricas necessárias à aplicação dos métodos
REPRESENTAÇÃO FASORIAL DE SINAIS SENOIDAIS Neste capítulo será apresentada uma prática ferramenta gráfica e matemática que permitirá e facilitará as operações algébricas necessárias à aplicação dos métodos
Análise de Regressão Linear Simples e Múltipla
 Análise de Regressão Linear Simples e Múltipla Carla Henriques Departamento de Matemática Escola Superior de Tecnologia de Viseu Carla Henriques (DepMAT ESTV) Análise de Regres. Linear Simples e Múltipla
Análise de Regressão Linear Simples e Múltipla Carla Henriques Departamento de Matemática Escola Superior de Tecnologia de Viseu Carla Henriques (DepMAT ESTV) Análise de Regres. Linear Simples e Múltipla
QUÍMICA TECNOLÓGICA I
 Universidade Federal dos Vales do Jequitinhonha e Mucuri Bacharelado em Ciência e Tecnologia Diamantina - MG QUÍMICA TECNOLÓGICA I Prof a. Dr a. Flaviana Tavares Vieira flaviana.tavares@ufvjm.edu.br Alquimia
Universidade Federal dos Vales do Jequitinhonha e Mucuri Bacharelado em Ciência e Tecnologia Diamantina - MG QUÍMICA TECNOLÓGICA I Prof a. Dr a. Flaviana Tavares Vieira flaviana.tavares@ufvjm.edu.br Alquimia
Protocolo em Rampa Manual de Referência Rápida
 Protocolo em Rampa Manual de Referência Rápida 1 O que é o Protocolo em Rampa O protocolo em rampa é um protocolo para testes de esforço que não possui estágios. Nele o incremento da carga se dá de maneira
Protocolo em Rampa Manual de Referência Rápida 1 O que é o Protocolo em Rampa O protocolo em rampa é um protocolo para testes de esforço que não possui estágios. Nele o incremento da carga se dá de maneira
DOCUMENTOS COMPLEMENTARES...51
 SUMÁRIO Página 1. OBJETIVO...51 2. DOCUMENTOS COMPLEMENTARES...51 3. DEFINIÇÕES...51 3.1. Tabela...51 3.2. Espaços...51 3.2.1. Topo...51 3.2.2. Centro...51 3.2.2.1. Espaço do cabeçalho...51 3.2.2.2. Coluna...52
SUMÁRIO Página 1. OBJETIVO...51 2. DOCUMENTOS COMPLEMENTARES...51 3. DEFINIÇÕES...51 3.1. Tabela...51 3.2. Espaços...51 3.2.1. Topo...51 3.2.2. Centro...51 3.2.2.1. Espaço do cabeçalho...51 3.2.2.2. Coluna...52
