OS METAIS DO BLOCO S: METAIS ALCALINOS TERROSOS (GRUPO 2)
|
|
|
- Dina Medina Lancastre
- 8 Há anos
- Visualizações:
Transcrição
1 OS METAIS DO BLOCO S: METAIS ALCALINOS (GRUPO 1) METAIS ALCALINOS TERROSOS (GRUPO 2)
2 METAIS ALCALINOS (1A) Os Alcalinos são os elementos do Grupo 1 (1A) da Tabela Periódica. Formada pelos seguintes metais: lítio (Li), sódio (Na), potássio (K), rubídio (Rb), césio (Cs) e frâncio (Fr). Têm este nome porque reagem muito facilmente com a água e, quando isso ocorre, formam hidróxidos e gás hidrogênio. 2 Li(s) + 2 H 2 O(l) 2 LiOH(aq) + H 2 (g) A química é dominada pela perda de seu único elétron s: M M + + e- A reatividade aumenta ao descermos no grupo. Todos os metais alcalinos são macios.
3
4 METAIS ALCALINOS (1A) Os metais alcalinos emitem cores características quando colocados em uma chama à alta temperatura. O elétron s é excitado por uma chama e emite energia quando retorna ao estado fundamental.
5 METAIS ALCALINOS (1A) Lítio Sódio Potássio
6 As cores características da chama para os diferentes elementos não se devem todas à mesma transição, ou à mesma espécie.
7
8 Empacotamento Cúbico de Corpo Centrado(CCC)
9
10
11 Energias de hidratação - É a energia liberada quando moléculas de água se separam uma das outras e são atraídas por moléculas ou íons de um soluto que esta se dissociando na água. (Valores em kj/mol) H hid Li -519 Na -406 K -322 Rb -293 Cs -264
12 Segundo as regras de Fajans, qual dos metais alcalinos e alcalinos terrosos devem apresentar um caráter covalente mais acentuado em seus compostos? Justifique.
13 A capacidade que uma espécie tem de tirar elétrons de outra espécie é medida pelo potencial de redução, E o.
14 Abundância A abundância é muito variada na crosta terrestre: desde o Cálcio (5º metal mais abundante), seguido pelo Sódio, Magnésio até aos metais mais raros como Césio e Berílio. Abundância na crosta: as quantidades citadas estão na base 10
15 Ocorrência e Obtenção Sódio, Potássio, Magnésio e Cálcio são abundantes na crosta terrestre, mas a obtenção dos metais requer muita energia e consequentemente é cara!!! METAL FONTE NATURAL MÉTODO DE OBTENÇÃO LÍTIO espodumênio (LiAl(SiO 3 ) Eletrólise de LiCl + KCl fundido SÓDIO sal-gema (NaCl), água do mar Eletrólise de NaCl + CaCl 2 fundido POTÁSSIO silvita (KCl) Ação do sódio sobre KCl a 850 C CÁLCIO Calcáreo (CaCO 3 ) Eletrólise de CaCl 2 fundido MAGNÉSIO Dolomita, (CaMg(CO 3 ) 2 ) 2 MgCaO 2(l) + FeSi 1150 C (l) Mg (g) + Fe (l) + CaSiO 4(l)
16
17 Obtenção dos Compostos de Sódio
18 METAIS ALCALINOS (1A) Os metais alcalinos produzem diferentes óxidos ao reagirem com o O 2 : 4Li(s) + O 2 (g) 2Li 2 O(s) (óxido) 2Na(s) + O 2 (g) Na 2 O 2 (s) (peróxido) K(s) + O 2 (g) KO 2 (s) (superóxido) Sob condições apropriadas todos formam óxidos normais, os quais são sólidos iônicos que reagem violentamente com a água produzindo os hidróxidos respectivos: M 2 O + H 2 O 2MOH Os peróxidos e superóxidos reagem também com a água da seguinte maneira: M 2 O 2 + H 2 O 2MOH + H 2 O 2 MO 2 + H 2 O 2MOH + H 2 O 2 + O 2 Apenas o Li reage com o N 2 formando o nitreto de litio: 6Li (s) + 2N 2(g) 2Li 3 N (s)
19
20 O
21 O sódio metálico emprega-se em síntese orgânica como agente redutor. É também componente do cloreto de sódio ( NaCl) necessário para a vida. Outros usos: Em ligas antiatritocom o chumbo para a produção de balas ( projécteis). Com o chumbo também é usado para a produção aditivos antidetonantes para as gasolinas. Na fabricação de detergentes combinando-o com ácidos graxos. Na purificação de metais fundidos. A liga NaKé empregada como transferente de calor. O sódio também é usado como refrigerante. É empregado na fabricação de células fotoelétricas. Na iluminação pública, através das lâmpadas de vapor de sódio
22
23
24
25
26 METAIS ALCALINOS TERROSOS (2A) Os alcalino-terrosos são os elementos químicos do grupo 2 (2 A) da tabela periódica, e são os seguintes: berílio (Be), magnésio (Mg), cálcio (Ca), estrôncio (Sr), bário (Ba) e radio (Ra). O nome alcalino-terroso provém do nome que recebiam seus óxidos: terras. Possuem propriedades básicas (alcalinas). Os metais alcalinos terrosos são mais duros e mais densos do que os metais alcalinos. A química é dominada pela perda de dois elétrons s: M M e- Mg(s) + Cl 2(g) MgCl 2(s) 2Mg(s) + O 2(g) 2MgO(s)
27 METAIS ALCALINOS TERROSOS (2A) O Be difere dos demais elementos do grupo, pois o átomo e o íon são extremamente pequenos, sendo o aumento relativo do Be 2+ para o Mg 2+ quatro vezes maior que do Li + para o Na +. O Be não reage com água. O Mg reagirá apenas com água quente.do Ca em diante: Ca(s) + 2H 2 O(l) Ca(OH) 2(aq) + H 2(g) O Be tende a formar compostos covalentes, já que é extremamente pequeno.
28 H hid Be Mg Ca Sr Ba Complexo [Be(H 2 O) 4 ] 2+ NaCle KClsão anidros; MgCl 2. 6H 2 O, CaCl 2. 6H 2 O, BaCl 2. 2H 2 O
29 Bee Mg-hexagonal compacta Ca e Sr -cúbica de face centrada Ba-cúbica de corpo centrado
30 Comportamento Anômalo do Berílio NCT = 4
31 Processo Dow para obtenção do Magnésio
32 Todos os elementos desse grupo formam óxidos, MO
33 Aplicações BERÍLIO:Usado na obtenção de ligas com outros metais. A adição de 2% de Beao metal cobre aumenta sua resistência por um fator de 5 ou 6. Um liga de Bee Nié utilizada na fabricação de molas e contatos elétricos. Tanto o Becomo o BeO(este tem propriedades cerâmicas) foram usados em reatores nucleares. MAGNÉSIO:o magnésio é um metal estrutural leve extremamente importante por causa de sua baixa densidade (1,74 gcm -3, comparado com o aço 7,8 gcm -3 ou o alumínio 2,7 gcm -3 ). O Mgforma muitas ligas binárias, frequentementecontendo até 9% de Al, 3% de Zn e 1% de Mn, traços dos lantanídeos praseodímio Pre neodímio Nd, e traços de tório. O metal e suas ligas podem ser fundidos, trabalhados e soldados com facilidade. Ele é utilizado na fabricação de aeronaves, peças de avião e motores de automóveis. Bulbos fotográficos antigos continham magnésio em um ambiente de oxigênio; o magnésio era inflamado eletricamente. A adição usual de 5% de Mgao alumínio melhora as qualidades deste. Do ponto vista químico, ele é importante em reagentes de Grignard, como por exemplo C 2 H 5 MgBr.
34 CÁLCIO:O cálcio é usado em larga escala como CaO(óxido de cálcio) -cal. É usado na indústria alimentícia, na indústria do papel, na construção civil, na indústria do vidro, na indústria do aço e obtido da calcinação do CaCO 3 no processo para fabricação do cimento portland. O metal Ca é usado na fabricação de ligas com Al para mancais. Ele é usado também na indústria do ferro e do aço para controlar o carbono no ferro fundido e para remoção de P, O e S. Outros usos são: como redutor na obtenção de outros metais -Zr, Cr, The U -e na remoção de traços de N 2 no argônio. Do ponto de vista químico, o CaH 2 é às vezes usado como fonte de hidrogênio. ESTRÔNCIO:Compostos de Sr são utilizados em fogos de artifício e na sinalização vermelha das rodovias. BÁRIO:O sulfato de bário é tão insolúvel que embora Ba 2+ seja tóxico, o BaSO 4 pode ser ingerido sem perigo. Por esse fato e considerando que íons Ba 2+ refletem fortemente os raios-x, BaSO 4 é aplicado na medicina em radiografias; estruturas interiores do corpo podem ser claramente caracterizadas porque o BaSO 4 é opaco aos raios-x. RÁDIO:Antigamente era usado como emissor alfa no tratamento de câncer.
35 IMPORTÂNCIA BIOLÓGICA Os íons Mg +2 se concentram nas células animais, e os íons Ca 2+ se concentram nos fluídos corpóreos fora da célula, de modo semelhante à concentração do K + no interior da célula e do Na + no seu exterior. Os íons Mg 2+ formam um complexo com o ATP, e são constituintes dos fosfoidrolasese das fosfotransferases, que são enzimas para reações envolvendo o ATP e liberando energia. São também essenciais para a transmissão de impulsos ao longo de fibras nervosas. O Mg 2+ é importante na clorofila, nas partes verdes das plantas. O Ca 2+ é importante em ossos e dentes como a apatita, Ca 3 (PO 4 ) 2, e no esmalte dos dentes, como fluorapatita, 3(Ca 3 (PO 4 ) 2 ).CaF 2. Os íons Ca 2+ são importantes na coagulação do sangue, e são necessários para dar início à contração dos músculos e para manter o batimento regular do coração.
Metais alcalinos - Grupo 1A
 Metais alcalinos - Grupo 1A Li / Na / K / Rb / Cs / Fr Na e K são os mais abundantes ns 1 - aparecem normalmente como iões positivos ( +) Não se encontram isolados na natureza / reacção com não-metais
Metais alcalinos - Grupo 1A Li / Na / K / Rb / Cs / Fr Na e K são os mais abundantes ns 1 - aparecem normalmente como iões positivos ( +) Não se encontram isolados na natureza / reacção com não-metais
Metais Alcalino-Terrosos
 Metais Alcalino-Terrosos Produtos Químicos Produção nos EUA Classificação Produto Químico Milhões de toneladas 1 Ácido sulfúrico 36,64 2 Etileno 25,41 3 Cal 20,12 4 Propileno 16,17 5 Ácido fosfórico 11,00
Metais Alcalino-Terrosos Produtos Químicos Produção nos EUA Classificação Produto Químico Milhões de toneladas 1 Ácido sulfúrico 36,64 2 Etileno 25,41 3 Cal 20,12 4 Propileno 16,17 5 Ácido fosfórico 11,00
Prof. Rafa - Química Cálculo Estequiométrico
 Prof. Rafa - Química Cálculo Estequiométrico Lista de exercícios 01. (UFBA) Hidreto de sódio reage com água, dando hidrogênio, segundo a reação: NaH + H 2 O NaOH + H 2 Para obter 10 mols de H 2, são necessários
Prof. Rafa - Química Cálculo Estequiométrico Lista de exercícios 01. (UFBA) Hidreto de sódio reage com água, dando hidrogênio, segundo a reação: NaH + H 2 O NaOH + H 2 Para obter 10 mols de H 2, são necessários
Grupo 2: Metais alcalinos terrosos
 Características gerais dos metais alcalinos terrosos Mostram as mesmas tendências nas propriedades que foram observadas nos metais alcalinos (Be difere do restante do grupo); Todos metais do grupo 2 formam
Características gerais dos metais alcalinos terrosos Mostram as mesmas tendências nas propriedades que foram observadas nos metais alcalinos (Be difere do restante do grupo); Todos metais do grupo 2 formam
Prova de Química Resolvida Segunda Etapa Vestibular UFMG 2011 Professor Rondinelle Gomes Pereira
 QUESTÃO 01 Neste quadro, apresentam-se as concentrações aproximadas dos íons mais abundantes em uma amostra de água típica dos oceanos e em uma amostra de água do Mar Morto: 1. Assinalando com um X a quadrícula
QUESTÃO 01 Neste quadro, apresentam-se as concentrações aproximadas dos íons mais abundantes em uma amostra de água típica dos oceanos e em uma amostra de água do Mar Morto: 1. Assinalando com um X a quadrícula
Pergunta I II III IV Total. Nota: Apresente todos os cálculos que efetuar
 3 de março 2012 (Semifinal) Pergunta I II III IV Total Classificação Escola:. Nome:. Nome:. Nome:. Nota: Apresente todos os cálculos que efetuar Dados: Constante de Avogadro: N A = 6,022 x 10 23 mol -1
3 de março 2012 (Semifinal) Pergunta I II III IV Total Classificação Escola:. Nome:. Nome:. Nome:. Nota: Apresente todos os cálculos que efetuar Dados: Constante de Avogadro: N A = 6,022 x 10 23 mol -1
Exercícios Sobre LigaÇões iônicas
 Exercícios Sobre LigaÇões iônicas Dados: 01. (Ufrj - adaptado) A caiação é um processo tradicionalmente utilizado na pintura de casas. Uma das maneiras de se preparar o pigmento consiste em misturar cal
Exercícios Sobre LigaÇões iônicas Dados: 01. (Ufrj - adaptado) A caiação é um processo tradicionalmente utilizado na pintura de casas. Uma das maneiras de se preparar o pigmento consiste em misturar cal
9. REAÇÕES DE OXIRREDUÇÃO
 Departamento de Química Inorgânica IQ / UFRJ IQG 18 / IQG 31 9. REAÇÕES DE OXIRREDUÇÃO I. INTRODUÇÃO As reações de oxirredução estão entre as reações químicas mais comuns e importantes. Estão envolvidas
Departamento de Química Inorgânica IQ / UFRJ IQG 18 / IQG 31 9. REAÇÕES DE OXIRREDUÇÃO I. INTRODUÇÃO As reações de oxirredução estão entre as reações químicas mais comuns e importantes. Estão envolvidas
Química. Energia de formação (KJ mol -1 )
 Química 01. A formação dos compostos iônicos é geralmente um processo exotérmico cuja energia liberada será tanto maior quanto maior for a força de interação entre o cátion e o ânion. gráfico abaixo apresenta
Química 01. A formação dos compostos iônicos é geralmente um processo exotérmico cuja energia liberada será tanto maior quanto maior for a força de interação entre o cátion e o ânion. gráfico abaixo apresenta
Química de Águas Naturais. -todas as formas de vida existentes no planeta Terra dependem da água;
 Química de Águas Naturais todas as formas de vida existentes no planeta Terra dependem da água; a água cobre 70% da superfície do planeta, apenas uma parte dessa quantidade (~2,8%) é água doce sendo que
Química de Águas Naturais todas as formas de vida existentes no planeta Terra dependem da água; a água cobre 70% da superfície do planeta, apenas uma parte dessa quantidade (~2,8%) é água doce sendo que
Homogêneo: algo que não pode ser fisicamente dividido em componentes químicos mais simples.
 MINERAIS HALITA Um mineral é um sólido, homogêneo, natural, com uma composição química definida e um arranjo atômico altamente ordenado. É geralmente formado por processos inorgânicos. Sólido: as substâncias
MINERAIS HALITA Um mineral é um sólido, homogêneo, natural, com uma composição química definida e um arranjo atômico altamente ordenado. É geralmente formado por processos inorgânicos. Sólido: as substâncias
1. Qual a fórmula do composto formado entre o cálcio, Ca (Z = 20) e o flúor F (Z = 9)?
 EXERCÍCIOS REVISÃO 1ª série 1. Qual a fórmula do composto formado entre o cálcio, Ca (Z = 20) e o flúor F (Z = 9)? 2. Qual a fórmula do composto formado entre o potássio, K (Z = 19) e o enxofre, S (Z =
EXERCÍCIOS REVISÃO 1ª série 1. Qual a fórmula do composto formado entre o cálcio, Ca (Z = 20) e o flúor F (Z = 9)? 2. Qual a fórmula do composto formado entre o potássio, K (Z = 19) e o enxofre, S (Z =
CARACTERÍSTICAS GERAIS DOS ELEMENTOS DO BLOCO S
 1 CARACTERÍSTICAS GERAIS DOS ELEMENTOS DO BLOCO S Os cátions dos metais alcalinos (Grupo 1) e alcalino-terrosos (Grupo 2) são normalmente encontrados em minerais e águas naturais, e alguns são constituintes
1 CARACTERÍSTICAS GERAIS DOS ELEMENTOS DO BLOCO S Os cátions dos metais alcalinos (Grupo 1) e alcalino-terrosos (Grupo 2) são normalmente encontrados em minerais e águas naturais, e alguns são constituintes
Características Gerais
 Universidade Federal dos Vales do Jequitinhonha e Mucuri Instituto de Ciência e Tecnologia Diamantina - MG Metais Alcalinos Prof a. Dr a. Flaviana Tavares Vieira flaviana.tavares@ufvjm.edu.br 1 Tópicos
Universidade Federal dos Vales do Jequitinhonha e Mucuri Instituto de Ciência e Tecnologia Diamantina - MG Metais Alcalinos Prof a. Dr a. Flaviana Tavares Vieira flaviana.tavares@ufvjm.edu.br 1 Tópicos
Compostos Binários Iônicos
 79 Compostos Binários Iônicos www.aulasdequimica.com.br 79 Página 02 79 Página 03 Os compostos binários são aqueles formados por dois elementos químicos. Saiba mais! Os compostos binários são aqueles em
79 Compostos Binários Iônicos www.aulasdequimica.com.br 79 Página 02 79 Página 03 Os compostos binários são aqueles formados por dois elementos químicos. Saiba mais! Os compostos binários são aqueles em
Aproximadamente 80% do vanádio produzido são empregados como ferrovanádio ou como aditivo em aço. Possui outras aplicações como:
 Aula: 14 Temática: Metais de Transição Externa (parte 3) Olá! Nesta aula iremos continuar nos metais de transição, agora falaremos sobre o grupo do vanádio, que contém os elementos Vanádio, Nióbio, Tantálio
Aula: 14 Temática: Metais de Transição Externa (parte 3) Olá! Nesta aula iremos continuar nos metais de transição, agora falaremos sobre o grupo do vanádio, que contém os elementos Vanádio, Nióbio, Tantálio
CURSO de QUÍMICA - Gabarito
 UNIVERSIDADE FEDERAL FLUMINENSE TRANSFERÊNCIA 2 o semestre letivo de 2009 e 1 o semestre letivo de 2010 CURSO de QUÍMICA - Gabarito INSTRUÇÕES AO CANDIDATO Verifique se este caderno contém: PROVA DE REDAÇÃO
UNIVERSIDADE FEDERAL FLUMINENSE TRANSFERÊNCIA 2 o semestre letivo de 2009 e 1 o semestre letivo de 2010 CURSO de QUÍMICA - Gabarito INSTRUÇÕES AO CANDIDATO Verifique se este caderno contém: PROVA DE REDAÇÃO
CO 3 H 2. (aq) e H 2. O, ocorrendo, portanto, acidose
 11 A maior parte do dióxido de carbono gerado no metabolismo celular, no corpo humano, por reagir rapidamente com a água contida no sangue, é conduzida pela corrente sanguínea, para eliminação nos pulmões.
11 A maior parte do dióxido de carbono gerado no metabolismo celular, no corpo humano, por reagir rapidamente com a água contida no sangue, é conduzida pela corrente sanguínea, para eliminação nos pulmões.
Simulador de Química Reações de dupla-troca
 Lista de exercícios A seguir, apresentamos uma série de exercícios relacionados ao tema de reações de dupla- -troca. Na primeira parte, estão atividades baseadas no conteúdo multimídia Simulador de Química
Lista de exercícios A seguir, apresentamos uma série de exercícios relacionados ao tema de reações de dupla- -troca. Na primeira parte, estão atividades baseadas no conteúdo multimídia Simulador de Química
Capítulo 6: Estrutura dos Materiais Ligação química e propriedades
 Capítulo 6: Estrutura dos Materiais Ligação química e propriedades Questões a abordar... O que promove a ligação química? Que tipos de ligações químicas existem? Que propriedades dependem da ligação química?
Capítulo 6: Estrutura dos Materiais Ligação química e propriedades Questões a abordar... O que promove a ligação química? Que tipos de ligações químicas existem? Que propriedades dependem da ligação química?
CURSO APOIO QUÍMICA RESOLUÇÃO
 QUÍMICA CURS API 15. hidróxido de magnésio, Mg() 2, massa molar 58,3 g mol 1, apresenta propriedades antiácidas e laxativas. Ao ser ingerido, reage com o ácido clorídrico presente no estômago, formando
QUÍMICA CURS API 15. hidróxido de magnésio, Mg() 2, massa molar 58,3 g mol 1, apresenta propriedades antiácidas e laxativas. Ao ser ingerido, reage com o ácido clorídrico presente no estômago, formando
Química Avançada 06 - Soluções
 Química Avançada 06 - Soluções Nome: Turma: 1) (UFF-adaptada) O ácido nítrico é um importante produto industrial. Um dos processos de obtenção do ácido nítrico é fazer passar amônia e ar, sob pressão,
Química Avançada 06 - Soluções Nome: Turma: 1) (UFF-adaptada) O ácido nítrico é um importante produto industrial. Um dos processos de obtenção do ácido nítrico é fazer passar amônia e ar, sob pressão,
UFMG - 2003 3º DIA QUÍMICA BERNOULLI COLÉGIO E PRÉ-VESTIBULAR
 UFMG - 2003 3º DIA QUÍMICA BERNULLI CLÉGI E PRÉ-VESTIBULAR Química Questão 01 A glicose, C 6 6, é uma das fontes de energia mais importantes para os organismos vivos. A levedura, por exemplo, responsável
UFMG - 2003 3º DIA QUÍMICA BERNULLI CLÉGI E PRÉ-VESTIBULAR Química Questão 01 A glicose, C 6 6, é uma das fontes de energia mais importantes para os organismos vivos. A levedura, por exemplo, responsável
SIMULADO de QUÍMICA GABARITO COMENTADO 3º ANO 1º BIMESTRE/2011
 SIMULADO de QUÍMICA GABARITO COMENTADO 3º ANO 1º BIMESTRE/2011 1. (FATEC-2011) Os elementos cloro (Z = 17) e iodo (Z = 53) pertencem ao mesmo grupo da tabela periódica. Assim, átomos neutros desses elementos
SIMULADO de QUÍMICA GABARITO COMENTADO 3º ANO 1º BIMESTRE/2011 1. (FATEC-2011) Os elementos cloro (Z = 17) e iodo (Z = 53) pertencem ao mesmo grupo da tabela periódica. Assim, átomos neutros desses elementos
C 5 H 12 O álcool 88g/mol. x 12,5g x = 9,94g 5CO 2 + 5H 2 O
 Questão 1 O esquema abaixo mostra compostos que podem ser obtidos a partir de um alceno de fórmula molecular C 5 H 10. A seguir, responda às questões relacionadas a esse esquema, considerando sempre o
Questão 1 O esquema abaixo mostra compostos que podem ser obtidos a partir de um alceno de fórmula molecular C 5 H 10. A seguir, responda às questões relacionadas a esse esquema, considerando sempre o
QUÍMICA VESTIBULAR 2005 2ª ETAPA
 QUÍMICA VESTIBULAR 2005 2ª ETAPA 1 2 3 4 5 6 7 1 1 1, 00 2 3 4 Li Be 6, 94 9, 01 11 12 Na Mg 22, 99 24, 31 19 20 K Ca 39, 10 40, 08 37 38 Rb Sr 85, 47 87, 62 55 56 Cs Ba 132, 91 137, 33 87 88 Fr Ra 223,
QUÍMICA VESTIBULAR 2005 2ª ETAPA 1 2 3 4 5 6 7 1 1 1, 00 2 3 4 Li Be 6, 94 9, 01 11 12 Na Mg 22, 99 24, 31 19 20 K Ca 39, 10 40, 08 37 38 Rb Sr 85, 47 87, 62 55 56 Cs Ba 132, 91 137, 33 87 88 Fr Ra 223,
SAIS. I) Ocorrência de sais na natureza : Os sais são encontrados na natureza constituindo jazidas minerais.dentre eles, destacam-se:
 SAIS 1 I) Ocorrência de sais na natureza : Os sais são encontrados na natureza constituindo jazidas minerais.dentre eles, destacam-se: a) Carbonato de cálcio (CaCO 3 ) É um dos sais mais espalhados na
SAIS 1 I) Ocorrência de sais na natureza : Os sais são encontrados na natureza constituindo jazidas minerais.dentre eles, destacam-se: a) Carbonato de cálcio (CaCO 3 ) É um dos sais mais espalhados na
Metais Alcalino-Terrosos
 Metais Alcalino-Terrosos GRUPO 2 Produtos Químicos Produção Mundial Classificação Produto Químico Milhões de toneladas 1 Cal 283 2 Ácido sulfúrico 200 3 Etileno 156 4 Uréia 151 5 Amônia 140 6 Propileno
Metais Alcalino-Terrosos GRUPO 2 Produtos Químicos Produção Mundial Classificação Produto Químico Milhões de toneladas 1 Cal 283 2 Ácido sulfúrico 200 3 Etileno 156 4 Uréia 151 5 Amônia 140 6 Propileno
CPV o cursinho que mais aprova na fgv Fgv - 05/12/2004
 37 QUÍMICA 31. s irradiadores de alimentos representam hoje uma opção interessante na sua preservação. alimento irradiado, ao contrário do que se imagina, não se torna radioativo, uma vez que a radiação
37 QUÍMICA 31. s irradiadores de alimentos representam hoje uma opção interessante na sua preservação. alimento irradiado, ao contrário do que se imagina, não se torna radioativo, uma vez que a radiação
REDUÇÃO E OXIDAÇÃO EM SISTEMAS INORGÂNICOS
 REDUÇÃO E OXIDAÇÃO EM SISTEMAS INORGÂNICOS EXTRAÇÃO DE ELEMENTOS A definição original de oxidação foi a da reação que um elemento reage com oxigênio e é convertido em seu óxido. Comparativamente, redução
REDUÇÃO E OXIDAÇÃO EM SISTEMAS INORGÂNICOS EXTRAÇÃO DE ELEMENTOS A definição original de oxidação foi a da reação que um elemento reage com oxigênio e é convertido em seu óxido. Comparativamente, redução
Como sendo aquelas cujos valores variam apenas com o número atômico e não com a ordem da Tabela Periódica. São propriedades que não se repetem em
 Como sendo aquelas cujos valores variam apenas com o número atômico e não com a ordem da Tabela Periódica. São propriedades que não se repetem em ciclos, períodos ou famílias. O Calor Específico varia
Como sendo aquelas cujos valores variam apenas com o número atômico e não com a ordem da Tabela Periódica. São propriedades que não se repetem em ciclos, períodos ou famílias. O Calor Específico varia
IX Olimpíada Catarinense de Química 2013. Etapa I - Colégios
 I Olimpíada Catarinense de Química - 2013 I Olimpíada Catarinense de Química 2013 Etapa I - Colégios Imagem: Oxidação Fonte:Gilson Rocha Reynaldo, 2013 Primeiro Ano Conselho Regional de Química CRQ III
I Olimpíada Catarinense de Química - 2013 I Olimpíada Catarinense de Química 2013 Etapa I - Colégios Imagem: Oxidação Fonte:Gilson Rocha Reynaldo, 2013 Primeiro Ano Conselho Regional de Química CRQ III
PROPRIEDADES PERIÓDICAS II
 PROPRIEDADES PERIÓDICAS II EXERCÍCIOS DE APLICAÇÃO 01 (PUC-RS) Com relação à classificação periódica dos elementos, pode-se afirmar que o: a) hidrogênio é um metal alcalino localizado na 1ª coluna. b)
PROPRIEDADES PERIÓDICAS II EXERCÍCIOS DE APLICAÇÃO 01 (PUC-RS) Com relação à classificação periódica dos elementos, pode-se afirmar que o: a) hidrogênio é um metal alcalino localizado na 1ª coluna. b)
ELETRÓLISE - TEORIA. Eletrólitos são condutores iônicos de corrente elétrica. Para que ocorra essa condução, é necessário:
 ELETRÓLISE - TEORIA Introdução Dentro do estudo de eletroquímica temos a eletrólise, que consiste num processo não-espontâneo, baseado na decomposição de uma espécie química (eletrólito) por uma corrente
ELETRÓLISE - TEORIA Introdução Dentro do estudo de eletroquímica temos a eletrólise, que consiste num processo não-espontâneo, baseado na decomposição de uma espécie química (eletrólito) por uma corrente
PILHAS E BATERIAS COMERCIAIS. Química II Professora: Raquel Malta 3ª série Ensino Médio
 PILHAS E BATERIAS COMERCIAIS Química II Professora: Raquel Malta 3ª série Ensino Médio NOMENCLATURA Pilha: dispositivo constituído unicamente de dois eletrodos e um eletrólito, arranjados de maneira a
PILHAS E BATERIAS COMERCIAIS Química II Professora: Raquel Malta 3ª série Ensino Médio NOMENCLATURA Pilha: dispositivo constituído unicamente de dois eletrodos e um eletrólito, arranjados de maneira a
Questão 76. Questão 78. Questão 77. alternativa D. alternativa C. alternativa A
 Questão 76 O hidrogênio natural é encontrado na forma de três isótopos de números de massa, 1, 2 e 3, respectivamente: 1 1 H, 2 1 H e 3 1 H As tabelas periódicas trazem o valor 1,008 para a sua massa atômica,
Questão 76 O hidrogênio natural é encontrado na forma de três isótopos de números de massa, 1, 2 e 3, respectivamente: 1 1 H, 2 1 H e 3 1 H As tabelas periódicas trazem o valor 1,008 para a sua massa atômica,
Nesta aula falaremos sobre os metais da família do Boro e do. Ocorrência, Estrutura, Métodos de Obtenção, Aplicações e Propriedades
 Aula 11 Temática: Metais da Família do Boro e do Carbono Carbono. Boa aula! Nesta aula falaremos sobre os metais da família do Boro e do METAIS DA FAMÍLIA DO BORO Ocorrência, Estrutura, Métodos de Obtenção,
Aula 11 Temática: Metais da Família do Boro e do Carbono Carbono. Boa aula! Nesta aula falaremos sobre os metais da família do Boro e do METAIS DA FAMÍLIA DO BORO Ocorrência, Estrutura, Métodos de Obtenção,
= 0 molécula. cada momento dipolar existente na molécula. Lembrando que u R
 Lista de Exercícios de Geometria e Ligações 1) Numere a segunda coluna (estruturas geométricas) de acordo com a primeira coluna (compostos químicos). 1. NH 3 ( ) linear 2. CO 2 ( ) angular 3. H 2 O ( )
Lista de Exercícios de Geometria e Ligações 1) Numere a segunda coluna (estruturas geométricas) de acordo com a primeira coluna (compostos químicos). 1. NH 3 ( ) linear 2. CO 2 ( ) angular 3. H 2 O ( )
Continuaremos com nosso estudo sobre os metais, agora com os. Ocorrência, Estrutura, Métodos de Obtenção, Aplicações e Propriedades
 Aula: 10 Temática: Metais Alcalino Terrosos terrosos. Vamos lá! Continuaremos com nosso estudo sobre os metais, agora com os METAIS ALCALINOS TERROSOS Ocorrência, Estrutura, Métodos de Obtenção, Aplicações
Aula: 10 Temática: Metais Alcalino Terrosos terrosos. Vamos lá! Continuaremos com nosso estudo sobre os metais, agora com os METAIS ALCALINOS TERROSOS Ocorrência, Estrutura, Métodos de Obtenção, Aplicações
COLÉGIO NOSSA SENHORA DA PIEDADE. Programa de Recuperação Final. 1ª Etapa 2013. Ano: 1
 COLÉGIO NOSSA SENHORA DA PIEDADE Programa de Recuperação Final 1ª Etapa 2013 Disciplina: Química Professora: Maria Luiza Ano: 1 Caro aluno, você está recebendo o conteúdo de recuperação. Faça a lista de
COLÉGIO NOSSA SENHORA DA PIEDADE Programa de Recuperação Final 1ª Etapa 2013 Disciplina: Química Professora: Maria Luiza Ano: 1 Caro aluno, você está recebendo o conteúdo de recuperação. Faça a lista de
PROVA DE QUÍMICA II. Dados: R = 0,082L.atm/mol.K, N = 6,0x10 23. A) 4,1x10-14 B) 4,1x10-22 D) 4,1x10-18 C) 1,0x10-18 E) 1,0x10 15
 PROVA DE QUÍMCA 01. A concentração de um gás poluente na atmosfera, medida a 1 atm e 27ºC, é de 1 ppm. A concentração desse poluente, em moléculas/cm 3 de ar, é igual a Dados: R = 0,082L.atm/mol.K, N =
PROVA DE QUÍMCA 01. A concentração de um gás poluente na atmosfera, medida a 1 atm e 27ºC, é de 1 ppm. A concentração desse poluente, em moléculas/cm 3 de ar, é igual a Dados: R = 0,082L.atm/mol.K, N =
LIGAÇÕES INTERATÔMICAS
 UNIDADE 2 - LIGAÇÕES INTERATÔMICAS 2.1. FORÇAS DE LIGAÇÃO FORTES Importante conhecer-se as atrações que mantêm os átomos unidos formando os materiais sólidos. Por exemplo, uma peça de cobre contém 8,4x10
UNIDADE 2 - LIGAÇÕES INTERATÔMICAS 2.1. FORÇAS DE LIGAÇÃO FORTES Importante conhecer-se as atrações que mantêm os átomos unidos formando os materiais sólidos. Por exemplo, uma peça de cobre contém 8,4x10
a) Incorreta. O aumento da temperatura desloca o equilíbrio para o lado direito, no sentido da formação do vapor (transformação endotérmica).
 01 a) Incorreta. O aumento da temperatura desloca o equilíbrio para o lado direito, no sentido da formação do vapor (transformação endotérmica). b) Incorreta. Quanto mais volátil o líquido, menor será
01 a) Incorreta. O aumento da temperatura desloca o equilíbrio para o lado direito, no sentido da formação do vapor (transformação endotérmica). b) Incorreta. Quanto mais volátil o líquido, menor será
ESCOLA ESTADUAL PROFESSOR MORAIS. Atividade: Lista de Exercícios sobre termoquímica Valor: Nota:
 ESCOLA ESTADUAL PROFESSOR MORAIS Disciplina: Química Ensino Médio Atividade: Lista de Exercícios sobre termoquímica Valor: Nota: Série: 2º ano 3º Bimestre Data: 04/09/2015 Professor: Júnior Aluno(a): N
ESCOLA ESTADUAL PROFESSOR MORAIS Disciplina: Química Ensino Médio Atividade: Lista de Exercícios sobre termoquímica Valor: Nota: Série: 2º ano 3º Bimestre Data: 04/09/2015 Professor: Júnior Aluno(a): N
P R O V A D E Q UÍMICA I. A tabela abaixo apresenta os pontos de ebulição e a solubilidade em água de alguns álcoois e éteres importantes.
 17 P R O V A D E Q UÍMICA I QUESTÃO 46 A tabela abaixo apresenta os pontos de ebulição e a solubilidade em água de alguns álcoois e éteres importantes. Composto Pe ( o C) Solubilidade em água CH 3 CH 2
17 P R O V A D E Q UÍMICA I QUESTÃO 46 A tabela abaixo apresenta os pontos de ebulição e a solubilidade em água de alguns álcoois e éteres importantes. Composto Pe ( o C) Solubilidade em água CH 3 CH 2
Oxirredução. O professor recomenda: Estude pelos seguintes livros/páginas sobre a oxirredução e faça os exercícios! 26/10/2011
 Oxirredução O professor recomenda: Estude pelos seguintes livros/páginas sobre a oxirredução e faça os exercícios! Shriver Ed 4 Cap.4 p.164-190 Atkins & Jones 1 ED Cap. 12 p. 603-635 Brown Cap. 20 p. 721-754
Oxirredução O professor recomenda: Estude pelos seguintes livros/páginas sobre a oxirredução e faça os exercícios! Shriver Ed 4 Cap.4 p.164-190 Atkins & Jones 1 ED Cap. 12 p. 603-635 Brown Cap. 20 p. 721-754
FIEB FUNDAÇÃO INSTITUTO DE EDUCAÇÃO DE BARUERI CURSINHO PREPARATÓRIO PARA VESTIBULARES PROVA DE QUÍMICA 2016
 FIEB FUNDAÇÃO INSTITUTO DE EDUCAÇÃO DE BARUERI CURSINHO PREPARATÓRIO PARA VESTIBULARES PROVA DE QUÍMICA 2016 NOME: INSCRIÇÃO: RG: E-MAIL: TEL: INSTRUÇÕES Verifique se este caderno corresponde a sua opção
FIEB FUNDAÇÃO INSTITUTO DE EDUCAÇÃO DE BARUERI CURSINHO PREPARATÓRIO PARA VESTIBULARES PROVA DE QUÍMICA 2016 NOME: INSCRIÇÃO: RG: E-MAIL: TEL: INSTRUÇÕES Verifique se este caderno corresponde a sua opção
Escola Básica e Secundária Gonçalves Zarco Ciências Físico-Químicas, 9º ano Ano lectivo 2006 / 2007
 Escola Básica e Secundária Gonçalves Zarco Ciências Físico-Químicas, 9º ano Ano lectivo 2006 / 2007 Ficha de Trabalho, nº 2 CORRECÇÃO Nome: n.º aluno: Turma: 1. Nas frases seguintes, risca as palavras
Escola Básica e Secundária Gonçalves Zarco Ciências Físico-Químicas, 9º ano Ano lectivo 2006 / 2007 Ficha de Trabalho, nº 2 CORRECÇÃO Nome: n.º aluno: Turma: 1. Nas frases seguintes, risca as palavras
Lista de exercícios 11 Classificação periódica
 Lista de exercícios 11 Classificação periódica 01. (UNESP) Associar os números das regiões da tabela periódica esquematizada a seguir com: a) os metais alcalinos, b) os não-metais, c) os gases nobres,
Lista de exercícios 11 Classificação periódica 01. (UNESP) Associar os números das regiões da tabela periódica esquematizada a seguir com: a) os metais alcalinos, b) os não-metais, c) os gases nobres,
ESTRUTURA QUÍMICA TESTE DE CHAMA
 ESTRUTURA QUÍMICA TESTE DE CHAMA META Demonstrar fatos que comprovem a transição eletrônica através do teste da chama. Apresentar os conceitos da técnica do teste de chama. OBJETIVOS Identificar os constituintes
ESTRUTURA QUÍMICA TESTE DE CHAMA META Demonstrar fatos que comprovem a transição eletrônica através do teste da chama. Apresentar os conceitos da técnica do teste de chama. OBJETIVOS Identificar os constituintes
S 2 O 5 (aq) + 2 H + (aq) " 2 SO 2(aq) + H 2 O (,) 2 (aq) + 2 OH (aq) " 2 SO 3 2 (aq) + H 2 O (,) QUESTÃO 2. Combustível.
 Química QUESTÃO 1 O metabissulfito de potássio (K 2 S 2 O 5 ) e o dióxido de enxofre (SO 2 ) são amplamente utilizados na conservação de alimentos como sucos de frutas, retardando a deterioração provocada
Química QUESTÃO 1 O metabissulfito de potássio (K 2 S 2 O 5 ) e o dióxido de enxofre (SO 2 ) são amplamente utilizados na conservação de alimentos como sucos de frutas, retardando a deterioração provocada
ENERGIA E AS REAÇÕES QUÍMICAS
 ENERGIA E AS REAÇÕES QUÍMICAS Termoquímica é a parte da química que estuda as trocas de energia entre o sistema e o meio durante a ocorrência de uma reação química ou de um processo físico. ENTALPIA É
ENERGIA E AS REAÇÕES QUÍMICAS Termoquímica é a parte da química que estuda as trocas de energia entre o sistema e o meio durante a ocorrência de uma reação química ou de um processo físico. ENTALPIA É
muito gás carbônico, gás de enxofre e monóxido de carbono. extremamente perigoso, pois ocupa o lugar do oxigênio no corpo. Conforme a concentração
 A UU L AL A Respiração A poluição do ar é um dos problemas ambientais que mais preocupam os governos de vários países e a população em geral. A queima intensiva de combustíveis gasolina, óleo e carvão,
A UU L AL A Respiração A poluição do ar é um dos problemas ambientais que mais preocupam os governos de vários países e a população em geral. A queima intensiva de combustíveis gasolina, óleo e carvão,
11.1 EQUAÇÃO GERAL DOS BALANÇOS DE ENERGIA. Acúmulo = Entrada Saída + Geração Consumo. Acúmulo = acúmulo de energia dentro do sistema
 11 BALANÇOS DE ENERGIA EM PROCESSOS FÍSICOS E QUÍMICOS Para utilizar adequadamente a energia nos processos é preciso que sejam entendidos os princípios básicos envolvidos na geração, utilização e transformação
11 BALANÇOS DE ENERGIA EM PROCESSOS FÍSICOS E QUÍMICOS Para utilizar adequadamente a energia nos processos é preciso que sejam entendidos os princípios básicos envolvidos na geração, utilização e transformação
Vestibular UFRGS 2015. Resolução da Prova de Química
 Vestibular UFRGS 2015 Resolução da Prova de Química 26. Alternativa (C) Assunto: Propriedades físicas das substâncias densidade Os materiais apresentam diferentes densidades e mesma massa envolvida logo,
Vestibular UFRGS 2015 Resolução da Prova de Química 26. Alternativa (C) Assunto: Propriedades físicas das substâncias densidade Os materiais apresentam diferentes densidades e mesma massa envolvida logo,
Cadex Pré-vestibular Química Volume I Série 4 Geometria molecular; polaridade; forças intermoleculares
 01 I. H 2, linear (a) II. O 2, linear (a) III. H 2 O, angular (b) IV. NH 3, piramidal (c) V. CH 4, tetraédrica (e) VI. CO 2, linear (a) VII. BF 3, trigonal (d) VIII. H 2 S, angular (b) IX. CCl 4, tetraédrica
01 I. H 2, linear (a) II. O 2, linear (a) III. H 2 O, angular (b) IV. NH 3, piramidal (c) V. CH 4, tetraédrica (e) VI. CO 2, linear (a) VII. BF 3, trigonal (d) VIII. H 2 S, angular (b) IX. CCl 4, tetraédrica
QUÍMICA - 3 o ANO MÓDULO 13 SAIS
 QUÍMICA - 3 o ANO MÓDULO 13 SAIS Ácido ídrico eto oso ito ico ato Sal nome do ácido de origem eto ito ato nome do cátion da base de origem +y B x +x A y Como pode cair no enem O etanol é considerado um
QUÍMICA - 3 o ANO MÓDULO 13 SAIS Ácido ídrico eto oso ito ico ato Sal nome do ácido de origem eto ito ato nome do cátion da base de origem +y B x +x A y Como pode cair no enem O etanol é considerado um
Resolução da Prova de Química Vestibular Verão UERGS/2003 Prof. Emiliano Chemello
 Fácil Resolução da Prova de Química Vestibular Verão UERGS/2003 Prof. Emiliano Chemello Médio www.quimica.net/emiliano emiliano@quimica.net Difícil Níveis de dificuldade das Questões 01. Em um frasco,
Fácil Resolução da Prova de Química Vestibular Verão UERGS/2003 Prof. Emiliano Chemello Médio www.quimica.net/emiliano emiliano@quimica.net Difícil Níveis de dificuldade das Questões 01. Em um frasco,
Características do processo
 SOLDAGEM POR OXIGÁS Processo de soldagem que utiliza o calor gerado por uma chama de um gás combustível e o oxigênio para fundir o metal-base e o metal de adição A temperatura obtida através da chama é
SOLDAGEM POR OXIGÁS Processo de soldagem que utiliza o calor gerado por uma chama de um gás combustível e o oxigênio para fundir o metal-base e o metal de adição A temperatura obtida através da chama é
Aula 5: Minerais e Rochas Prof. Daniel Caetano
 Geologia para Engenharia 1 Aula 5: Minerais e Rochas Prof. Daniel Caetano Objetivo: Compreender o que são minerais, suas propriedades e sua identificação e classificação. INTRODUÇÃO - "Pedras Preciosas"
Geologia para Engenharia 1 Aula 5: Minerais e Rochas Prof. Daniel Caetano Objetivo: Compreender o que são minerais, suas propriedades e sua identificação e classificação. INTRODUÇÃO - "Pedras Preciosas"
Química 1ª série Ensino Médio v. 3
 1ª série Ensino Médio v. Exercícios 01) a) SbO O + + SbO b) SiO O + + SiO O c) SCN + + SCN d) PO O + + PO e) SO O + + SO 0) I) a) monoácido b) ternário c) oxiácido d) moderado 0) A 0) C 05) C 06) E II)
1ª série Ensino Médio v. Exercícios 01) a) SbO O + + SbO b) SiO O + + SiO O c) SCN + + SCN d) PO O + + PO e) SO O + + SO 0) I) a) monoácido b) ternário c) oxiácido d) moderado 0) A 0) C 05) C 06) E II)
Processo Seletivo/UFU - Janeiro 2004-2ª Prova Comum - PROVA TIPO 1 QUÍMICA QUESTÃO 32
 QUÍMICA QUESTÃO 31 Considerando a Tabela Periódica e as propriedades dos elementos químicos, assinale a alternativa correta A) Um metal é uma substância dúctil e maleável que conduz calor e corrente elétrica
QUÍMICA QUESTÃO 31 Considerando a Tabela Periódica e as propriedades dos elementos químicos, assinale a alternativa correta A) Um metal é uma substância dúctil e maleável que conduz calor e corrente elétrica
International Junior Science Olympiad
 International Junior Science Olympiad IJSO Brasil 2009 Segunda Fase Gabarito Q U A D R O D E R E S P O S T A S Física Química Biologia A B C D E 01 X 02 X 03 X 04 X 05 X 06 X 07 X 08 X 09 X 10 X A B C
International Junior Science Olympiad IJSO Brasil 2009 Segunda Fase Gabarito Q U A D R O D E R E S P O S T A S Física Química Biologia A B C D E 01 X 02 X 03 X 04 X 05 X 06 X 07 X 08 X 09 X 10 X A B C
Ciclos Biogeoquímicos
 Ciclos Biogeoquímicos Ciclos que envolvem o movimento dos elementos ou compostos essenciais à vida entre o meio biótico e abiótico. Bio: Porque as transformações ocorrem com a participação dos seres vivos.
Ciclos Biogeoquímicos Ciclos que envolvem o movimento dos elementos ou compostos essenciais à vida entre o meio biótico e abiótico. Bio: Porque as transformações ocorrem com a participação dos seres vivos.
Química. Resolução das atividades complementares. Q7 Gráficos de mudança de fase
 Resolução das atividades complementares Química Q7 Gráficos de mudança de fase p. 39 Uma amostra sólida é submetida a aquecimento constante. temperatura da amostra é anotada em intervalos regulares de.
Resolução das atividades complementares Química Q7 Gráficos de mudança de fase p. 39 Uma amostra sólida é submetida a aquecimento constante. temperatura da amostra é anotada em intervalos regulares de.
QUÍMICA SEGUNDA ETAPA - 1997
 QUÍMICA SEGUNDA ETAPA - 1997 QUESTÃO 01 Os valores das sucessivas energias de ionização de um átomo constituem uma evidência empírica da existência de níveis de energia. Os diagramas abaixo pretendem representar,
QUÍMICA SEGUNDA ETAPA - 1997 QUESTÃO 01 Os valores das sucessivas energias de ionização de um átomo constituem uma evidência empírica da existência de níveis de energia. Os diagramas abaixo pretendem representar,
Associação Catarinense das Fundações Educacionais ACAFE PARECER RECURSO DISCIPLINA QUÍMICA
 33) Assinale a alternativa correta, na qual todas as substâncias são compostas e líquidas à temperatura ambiente. A O 3, O 2 ; CH 3 CH 2 OH B H 2 ; CO 2 ; CH 3 OH C H 2 O; NH 3 ; CO D H 2 O; CH 3 CH 2
33) Assinale a alternativa correta, na qual todas as substâncias são compostas e líquidas à temperatura ambiente. A O 3, O 2 ; CH 3 CH 2 OH B H 2 ; CO 2 ; CH 3 OH C H 2 O; NH 3 ; CO D H 2 O; CH 3 CH 2
Metais Pesados Tóxicos. -Classe de elementos químicos muitos dos quais venenosos para os seres humanos; p. ex: As, Pb, Cd, Hg.
 Metais Pesados Tóxicos -Classe de elementos químicos muitos dos quais venenosos para os seres humanos; p. ex: As, Pb, Cd, Hg. -Locais de fixação final desses metais pesados: Solos e Sedimentos; Características
Metais Pesados Tóxicos -Classe de elementos químicos muitos dos quais venenosos para os seres humanos; p. ex: As, Pb, Cd, Hg. -Locais de fixação final desses metais pesados: Solos e Sedimentos; Características
Classificação dos materiais. Profa. Daniela Becker
 Classificação dos materiais Profa. Daniela Becker Classificação dos materiais A classificação tradicional dos materiais é geralmente baseada na estrutura atômica e química destes. Classificação dos materiais
Classificação dos materiais Profa. Daniela Becker Classificação dos materiais A classificação tradicional dos materiais é geralmente baseada na estrutura atômica e química destes. Classificação dos materiais
Funções inorgânicas - Sais
 Funções inorgânicas - Sais 01. Faça as equações de neutralização (ou salificação) total entre os seguintes compostos: 02. (UNESP) Os sais hidrogenocarbonato de potássio, ortofosfato de cálcio, cianeto
Funções inorgânicas - Sais 01. Faça as equações de neutralização (ou salificação) total entre os seguintes compostos: 02. (UNESP) Os sais hidrogenocarbonato de potássio, ortofosfato de cálcio, cianeto
TERMOQUÍMICA. Desta forma podemos dizer que qualquer mudança química geralmente envolve energia.
 TERMOQUÍMICA 1 Introdução A sociedade moderna depende das mais diversas formas de energia para sua existência. Quase toda a energia de que dependemos é obtida a partir de reações químicas, como a queima
TERMOQUÍMICA 1 Introdução A sociedade moderna depende das mais diversas formas de energia para sua existência. Quase toda a energia de que dependemos é obtida a partir de reações químicas, como a queima
QUI 326 Primeira lista de exercícios 1/2013
 Exercícios de revisão QUI 326 Primeira lista de exercícios 1/2013 1) Balanceie as equações abaixo: a) Cu + HNO 3 Cu (NO 3 ) 2 + NO +H 2 O b) CrO 3 + SnCl 2 + HCl CrCl 3 + SnCl 4 + H 2 O c) PbO 2 + HCl
Exercícios de revisão QUI 326 Primeira lista de exercícios 1/2013 1) Balanceie as equações abaixo: a) Cu + HNO 3 Cu (NO 3 ) 2 + NO +H 2 O b) CrO 3 + SnCl 2 + HCl CrCl 3 + SnCl 4 + H 2 O c) PbO 2 + HCl
UFMG - 2005 3º DIA QUÍMICA BERNOULLI COLÉGIO E PRÉ-VESTIBULAR
 UFMG - 2005 3º DIA QUÍMICA BERNOULLI COLÉGIO E PRÉ-VESTIBULAR Química Questão 01 Carbono é um elemento cujos átomos podem se organizar sob a forma de diferentes alótropos. Alótropos H de combustão a 25
UFMG - 2005 3º DIA QUÍMICA BERNOULLI COLÉGIO E PRÉ-VESTIBULAR Química Questão 01 Carbono é um elemento cujos átomos podem se organizar sob a forma de diferentes alótropos. Alótropos H de combustão a 25
QUÍMICA. 4. Um professor, utilizando comprimidos de antiácido efervescente à base de NaHCO 3, realizou quatro procedimentos, ilustrados a seguir:
 QUÍMICA Prof. Rodrigo Rocha 1. Alguns fatores podem alterar a rapidez das reações químicas. A seguir, destacam-se três exemplos no contexto da preparação e da conservação de alimentos: 1) A maioria dos
QUÍMICA Prof. Rodrigo Rocha 1. Alguns fatores podem alterar a rapidez das reações químicas. A seguir, destacam-se três exemplos no contexto da preparação e da conservação de alimentos: 1) A maioria dos
COMENTÁRIO GERAL (EQUIPE DE BIOLOGIA)
 COMENTÁRIO GERAL (EQUIPE DE BIOLOGIA) A prova de Biologia ENEM 2010 apresentou como eixo central questões envolvendo meio ambiente e ecologia geral. Desta forma houve um desequilíbrio na distribuição de
COMENTÁRIO GERAL (EQUIPE DE BIOLOGIA) A prova de Biologia ENEM 2010 apresentou como eixo central questões envolvendo meio ambiente e ecologia geral. Desta forma houve um desequilíbrio na distribuição de
APL 12º ano: SÍNTESE DE BIODIESEL A PARTIR DE ÓLEO ALIMENTAR Protocolo experimental a microescala
 Projeto Ciência Viva INTRODUÇÃO À QUÍMICA VERDE, COMO SUPORTE DA SUSTENTABILIDADE, NO ENSINO SECUNDÁRIO APL 12º ano: SÍNTESE DE BIODIESEL A PARTIR DE ÓLEO ALIMENTAR Protocolo experimental a microescala
Projeto Ciência Viva INTRODUÇÃO À QUÍMICA VERDE, COMO SUPORTE DA SUSTENTABILIDADE, NO ENSINO SECUNDÁRIO APL 12º ano: SÍNTESE DE BIODIESEL A PARTIR DE ÓLEO ALIMENTAR Protocolo experimental a microescala
Curso de MIQ - Profa. Simone P. Taguchi Borges DEMAR/EEL/USP Titânio e suas ligas 1. Ligas de titânio: classificação, propriedades e
 Curso de MIQ - Profa. Simone P. Taguchi Borges DEMAR/EEL/USP Titânio e suas ligas 1 Ligas de titânio: classificação, propriedades e aplicações práticas Curso de MIQ - Profa. Simone P. Taguchi Borges DEMAR/EEL/USP
Curso de MIQ - Profa. Simone P. Taguchi Borges DEMAR/EEL/USP Titânio e suas ligas 1 Ligas de titânio: classificação, propriedades e aplicações práticas Curso de MIQ - Profa. Simone P. Taguchi Borges DEMAR/EEL/USP
Aulas 13 e 14. Soluções
 Aulas 13 e 14 Soluções Definição Solução é a denominação ao sistema em que uma substância está distribuída, ou disseminada, numa segunda substância sob forma de pequenas partículas. Exemplos Dissolvendo-se
Aulas 13 e 14 Soluções Definição Solução é a denominação ao sistema em que uma substância está distribuída, ou disseminada, numa segunda substância sob forma de pequenas partículas. Exemplos Dissolvendo-se
CLASSIFICAÇÃO PERIÓDICA DOS ELEMENTOS
 CLASSIFICAÇÃO PERIÓDICA DOS ELEMENTOS EXERCÍCIOS Questão 01) O correto uso da tabela periódica permite determinar os elementos químicos a partir de algumas de suas características. Recorra a tabela periódica
CLASSIFICAÇÃO PERIÓDICA DOS ELEMENTOS EXERCÍCIOS Questão 01) O correto uso da tabela periódica permite determinar os elementos químicos a partir de algumas de suas características. Recorra a tabela periódica
COLÉGIO NOSSA SENHORA DA PIEDADE. Programa de Recuperação Paralela. 2ª Etapa 2014. 3ª Série Turma: FG
 COLÉGIO NOSSA SENHORA DA PIEDADE Programa de Recuperação Paralela 2ª Etapa 2014 Disciplina: QUÍMICA Professora: Maria Luiza 3ª Série Turma: FG Caro aluno, você está recebendo o conteúdo de recuperação.
COLÉGIO NOSSA SENHORA DA PIEDADE Programa de Recuperação Paralela 2ª Etapa 2014 Disciplina: QUÍMICA Professora: Maria Luiza 3ª Série Turma: FG Caro aluno, você está recebendo o conteúdo de recuperação.
Capítulo 3 - MINERAIS
 Capítulo 3 - MINERAIS CONCEITOS MINERAL é toda substância homogênea, sólida ou líquida, de origem inorgânica que surge naturalmente na crosta terrestre. Normalmente com composição química definida e, se
Capítulo 3 - MINERAIS CONCEITOS MINERAL é toda substância homogênea, sólida ou líquida, de origem inorgânica que surge naturalmente na crosta terrestre. Normalmente com composição química definida e, se
Roteiro de Estudos 2 trimestre - 2015 Disciplina: Química 1ª SÉRIE
 Roteiro de Estudos 2 trimestre - 2015 Disciplina: Química 1ª SÉRIE Professor: Ricardo Augusto Marques da Costa O que devo saber: Unidade 6: Dissociação e ionização condutividade elétrica. Conceito de ácido,
Roteiro de Estudos 2 trimestre - 2015 Disciplina: Química 1ª SÉRIE Professor: Ricardo Augusto Marques da Costa O que devo saber: Unidade 6: Dissociação e ionização condutividade elétrica. Conceito de ácido,
 Lista de estequiometria 1. (Ufes) A decomposição térmica do carbonato de cálcio produz óxido de cálcio e dióxido de carbono. Decompondo-se 5,0g de carbonato de cálcio impuro e recolhendo-se todo o dióxido
Lista de estequiometria 1. (Ufes) A decomposição térmica do carbonato de cálcio produz óxido de cálcio e dióxido de carbono. Decompondo-se 5,0g de carbonato de cálcio impuro e recolhendo-se todo o dióxido
Aula 12 Sistema respiratório
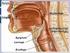 Aula 12 Sistema respiratório Respiração é o conjunto de mecanismos que permite as trocas gasosas (obtenção de O 2, e eliminação de CO 2 ) entre os animais e o meio ambiente. Através de trocas no interior
Aula 12 Sistema respiratório Respiração é o conjunto de mecanismos que permite as trocas gasosas (obtenção de O 2, e eliminação de CO 2 ) entre os animais e o meio ambiente. Através de trocas no interior
Água e Soluções Biológicas
 Universidade Federal do Ceará Centro de Ciências Departamento de Bioquímica e Biologia Molecular Disciplina de Biofísica Água e Soluções Biológicas 1. Introdução 2. A estrutura da molécula de água 2.1.
Universidade Federal do Ceará Centro de Ciências Departamento de Bioquímica e Biologia Molecular Disciplina de Biofísica Água e Soluções Biológicas 1. Introdução 2. A estrutura da molécula de água 2.1.
Características gerais dos elementos do bloco s
 Características gerais dos elementos do bloco s IA IIA Li Be Na Mg K Ca Bloco s Bloco d Bloco p Rb Sr Cs Ba Bloco f Em desuso! Fr Ra IA Metais alcalinos IIA Metais alcalinos terrosos Características gerais
Características gerais dos elementos do bloco s IA IIA Li Be Na Mg K Ca Bloco s Bloco d Bloco p Rb Sr Cs Ba Bloco f Em desuso! Fr Ra IA Metais alcalinos IIA Metais alcalinos terrosos Características gerais
EXERCÍCIOS DO ITA (1980-1999)
 EXERCÍCIOS DO ITA (1980-1999) 1- (ITA-1980) Um ânion mononuclear bivalente com 10 elétrons apresenta: a) 10 prótons nucleares b) a mesma estrutura eletrônica que a do Mg 2+. c) número de massa igual a
EXERCÍCIOS DO ITA (1980-1999) 1- (ITA-1980) Um ânion mononuclear bivalente com 10 elétrons apresenta: a) 10 prótons nucleares b) a mesma estrutura eletrônica que a do Mg 2+. c) número de massa igual a
TABELA PERIÓDICA Propriedades periódicas e aperiódicas
 TABELA PERIÓDICA Propriedades periódicas e aperiódicas De um modo geral, muitas propriedades dos elementos químicos variam periodicamente com o aumento de seus números atômicos (portanto, ao longo dos
TABELA PERIÓDICA Propriedades periódicas e aperiódicas De um modo geral, muitas propriedades dos elementos químicos variam periodicamente com o aumento de seus números atômicos (portanto, ao longo dos
ABRA APENAS QUANDO FOR AUTORIZADO. Leia atentamente as instruções: 1- Verifique se o seu caderno de provas possui 18 questões.
 Processo Seletivo 211 Modalidade B 3º Ano ABRA APENAS QUANDO FOR AUTORIZADO Leia atentamente as instruções: 1 Verifique se o seu caderno de provas possui 18 questões. 2 Verifique se recebeu o caderno de
Processo Seletivo 211 Modalidade B 3º Ano ABRA APENAS QUANDO FOR AUTORIZADO Leia atentamente as instruções: 1 Verifique se o seu caderno de provas possui 18 questões. 2 Verifique se recebeu o caderno de
Reações orgânicas. Mestranda: Daniele Potulski Disciplina: Química da Madeira I
 Reações orgânicas Mestranda: Daniele Potulski Disciplina: Química da Madeira I Introdução Quase todos os compostos orgânicos tem moléculas apolares ou com baixa polaridade; Essa característica é um fator
Reações orgânicas Mestranda: Daniele Potulski Disciplina: Química da Madeira I Introdução Quase todos os compostos orgânicos tem moléculas apolares ou com baixa polaridade; Essa característica é um fator
QUÍMICA COMENTÁRIO DA PROVA DE QUÍMICA
 CMENTÁRI DA PRVA DE QUÍMICA que se espera de uma boa prova de vestibular é que seja seletiva. Para tanto, ela deve conter questões fáceis, médias e difíceis. Nesse sentido, a prova foi boa. Algumas ressalvas,
CMENTÁRI DA PRVA DE QUÍMICA que se espera de uma boa prova de vestibular é que seja seletiva. Para tanto, ela deve conter questões fáceis, médias e difíceis. Nesse sentido, a prova foi boa. Algumas ressalvas,
UNIVERSIDADE FEDERAL DO ACRE DISCIPLINA DE SOLOS I/PEDOLOGIA. Dr. José Ribamar Silva
 UNIVERSIDADE FEDERAL DO ACRE DISCIPLINA DE SOLOS I/PEDOLOGIA UNIDADE IV - PROCESSOS PEDOGENÉTICOS Dr. José Ribamar Silva 1. Conceito - Reações e/ou mecanismos (químico, físico e biológico) que produzem
UNIVERSIDADE FEDERAL DO ACRE DISCIPLINA DE SOLOS I/PEDOLOGIA UNIDADE IV - PROCESSOS PEDOGENÉTICOS Dr. José Ribamar Silva 1. Conceito - Reações e/ou mecanismos (químico, físico e biológico) que produzem
Manual de Segurança do Laboratório de Química
 Manual de Segurança do Laboratório de Química Universidade Federal do Pampa Campus Caçapava do Sul 1 INTRODUÇÃO O Manual de Segurança do Laboratório de Química foi elaborado com o objetivo de fornecer
Manual de Segurança do Laboratório de Química Universidade Federal do Pampa Campus Caçapava do Sul 1 INTRODUÇÃO O Manual de Segurança do Laboratório de Química foi elaborado com o objetivo de fornecer
Concurso de Seleção 2005-1 NÚMERO DE INSCRIÇÃO - QUÍMICA
 QUÍMICA QUESTÃO 1 As fórmulas dos compostos químicos não são frutos do acaso. A capacidade de um átomo combinar-se com outro depende da disponibilidade de receber, doar ou compartilhar elétrons. Qual a
QUÍMICA QUESTÃO 1 As fórmulas dos compostos químicos não são frutos do acaso. A capacidade de um átomo combinar-se com outro depende da disponibilidade de receber, doar ou compartilhar elétrons. Qual a
Metais em água. metais tem um papel crucial em. como espécies hidroxiladas, ex.: FeOH(H 2 O)
 Metais em água Para a estabilização dos elétrons mais externos os cátions metálicos em água são ligados (coordenados) a outras espécies. Assim, os metais em soluções aquosas procuram a máxima estabilidade
Metais em água Para a estabilização dos elétrons mais externos os cátions metálicos em água são ligados (coordenados) a outras espécies. Assim, os metais em soluções aquosas procuram a máxima estabilidade
Exercícios sobre Termoquímica- lei de hess
 Exercícios sobre Termoquímica- lei de hess 01. (Unesp - adaptada) Definir, ou conceituar, e discutir, usando exemplos quando julgar conveniente: a) entalpia molar padrão de formação de uma substância;
Exercícios sobre Termoquímica- lei de hess 01. (Unesp - adaptada) Definir, ou conceituar, e discutir, usando exemplos quando julgar conveniente: a) entalpia molar padrão de formação de uma substância;
PROVA DESAFIO EM QUÍMICA 04/10/14
 PROVA DESAFIO EM QUÍMICA 04/10/14 Nome: Nº de Inscrição: Assinatura: Questão Valor Grau 1 a 2,0 2 a 2,0 3 a 2,0 4 a 2,0 5 a 2,0 Total 10,0 IMPORTANTE: 1) Explique e justifique a resolução de todas as questões.
PROVA DESAFIO EM QUÍMICA 04/10/14 Nome: Nº de Inscrição: Assinatura: Questão Valor Grau 1 a 2,0 2 a 2,0 3 a 2,0 4 a 2,0 5 a 2,0 Total 10,0 IMPORTANTE: 1) Explique e justifique a resolução de todas as questões.
www.professormazzei.com Propriedades da Matéria Folha 1 Prof.: João Roberto Mazzei
 www.professormazzei.com Propriedades da Matéria Folha 1 Prof.: João Roberto Mazzei 01. Classifique cada uma das propriedades específicas referentes ao hidróxido de sódio em: física, química ou organoléptica.
www.professormazzei.com Propriedades da Matéria Folha 1 Prof.: João Roberto Mazzei 01. Classifique cada uma das propriedades específicas referentes ao hidróxido de sódio em: física, química ou organoléptica.
7- (PUCCAMP) Examine as equações químicas a seguir: I- 2CrO 4
 OXIRREDUÇÃO 1- Se X, Y e Q apresentam número de oxidação máximo nas espécies químicas XO 4 2-, MgYO 3 e H 3 QO 4, então pertencem, respectivamente, à família dos: A) Metais Alcalinos, Carbono e Nitrogênio.
OXIRREDUÇÃO 1- Se X, Y e Q apresentam número de oxidação máximo nas espécies químicas XO 4 2-, MgYO 3 e H 3 QO 4, então pertencem, respectivamente, à família dos: A) Metais Alcalinos, Carbono e Nitrogênio.
Sumário 20 Pilhas/Baterias
 Sumário 2 Pilhas/Baterias 1. Definições e características 2. Baterias primárias 2.1 Baterias de Leclanché (pilhas secas) 2.2 Baterias Alcalinas 2.3 Baterias de Lítio 3. Baterias secundárias 3.1 Baterias
Sumário 2 Pilhas/Baterias 1. Definições e características 2. Baterias primárias 2.1 Baterias de Leclanché (pilhas secas) 2.2 Baterias Alcalinas 2.3 Baterias de Lítio 3. Baterias secundárias 3.1 Baterias
