MODELO DE BULA MAXCEF (cloridrato de cefepima) 500 mg, 1 g ou 2 g PÓ PARA SOLUÇÃO INJETÁVEL
|
|
|
- Luiz Guilherme Bugalho Dinis
- 8 Há anos
- Visualizações:
Transcrição
1 MODELO DE BULA MAXCEF (cloridrato de cefepima) 500 mg, 1 g ou 2 g PÓ PARA SOLUÇÃO INJETÁVEL BRISTOL-MYERS SQUIBB MAXCEF cloridrato de cefepima USO INTRAMUSCULAR OU INTRAVENOSO APRESENTAÇÃO MAXCEF 500 mg, 1 g ou 2 g pó para solução injetável é apresentado em embalagens com 1 frascoampola. MAXCEF 500 mg e 1 g são acompanhados de ampola com 1,5 ml e 3,0 ml de diluente, respectivamente. USO PEDIÁTRICO OU ADULTO COMPOSIÇÃO Cada frasco-ampola contém cloridrato de cefepima equivalente a 500 mg, 1 g ou 2 g de cefepima, respectivamente, com aproximadamente 725 mg de L-arginina por grama de cefepima. INFORMAÇÕES AO PACIENTE AÇÃO DO MEDICAMENTO MAXCEF é um antibiótico da classe das cefalosporinas. MAXCEF promove a melhora do paciente com o alívio dos sinais e sintomas da infecção. INDICAÇÕES DO MEDICAMENTO - Adultos MAXCEF é indicado no tratamento das infecções relacionadas a seguir, quando causadas por bactérias sensíveis à cefepima: - Infecções do trato respiratório inferior, incluindo pneumonia e bronquite; - Infecções complicadas do trato urinário, incluindo pielonefrite (infecção nos rins); - Infecções não complicadas do trato urinário; - Infecções da pele e estruturas cutâneas; 1
2 - Infecções intra-abdominais, incluindo peritonite e infecções do trato biliar; - Infecções ginecológicas; - Septicemia (infecção generalizada); - Tratamento específico em pacientes que apresentam Neutropenia Febril (quantidade menor e anormal de neutrófilos, que se relaciona com febre); - MAXCEF também está indicado para a profilaxia cirúrgica em pacientes submetidos à cirurgia intraabdominal. - Crianças MAXCEF é indicado no tratamento, em pacientes pediátricos, das infecções relacionadas a seguir, quando causadas por bactérias sensíveis à cefepima: - Pneumonia; - Infecções complicadas do trato urinário, incluindo pielonefrite (infecção nos rins); - infecções não complicadas do trato urinário; - Infecções da pele e estruturas cutâneas; - Septicemia (infecções generalizadas); - Tratamento específico em pacientes que apresentam Neutropenia Febril (quantidade menor e anormal de neutrófilos, que se relaciona com febre); - Meningite bacteriana; RISCOS DO MEDICAMENTO Contra-indicações MAXCEF é contra-indicado para pacientes alérgicos a algum componente da formulação, a antibióticos da classe das cefalosporinas, a penicilinas ou a outros antibióticos beta-lactâmicos. Advertências Se você apresenta insuficiência renal, ou outras condições que possam comprometer a função dos rins, o seu médico irá ajustar a dose de MAXCEF para compensar o índice menor de eliminação renal. Durante a experiência pós-comercialização, houve casos de eventos indesejáveis sérios como encefalopatia reversível (distúrbios de consciência incluindo confusão, alucinações, lentidão e coma), mioclonia (movimentos musculares involuntários), convulsões (incluindo estado epiléptico não convulsivo), e/ou insuficiência renal. A maioria dos casos ocorreu em pacientes com problemas renais que receberam doses de MAXCEF maiores que a recomendada. 2
3 Em geral, os sintomas de toxicidade neurológica são resolvidos após a interrupção do tratamento com cefepima e/ou após a hemodiálise. Porém, alguns destes casos tiveram efeito fatal. Precauções Os antibióticos devem ser administrados com cautela a qualquer paciente que tenha demonstrado alguma alergia, principalmente a medicamentos. Se você apresentar reação alérgica ao usar MAXCEF, você deve interromper o tratamento e procurar seu médico imediatamente. Clostridium difficile associado à diarréia (CDAD) foi descrito com o uso de praticamente todos os agentes antibacterianos, incluindo MAXCEF, e pode variar quanto ao grau de gravidade, desde diarréia leve até colite fatal. Se há suspeita e confirmação de CDAD, o uso de antibióticos que não ajam diretamente contra C. Difficile pode ter que ser descontinuado. Você deve procurar seu medico caso apresente esses sintomas. Você deve ter acompanhamento médico em relação à função renal se estiver utilizando medicamentos que possam causar toxicidade neurológica (por ex., aminoglicósideos e potentes diuréticos) juntamente com MAXCEF. Como ocorre com outros antibióticos, o uso de MAXCEF pode levar a um supercrescimento de organismos não sensíveis (ou seja, organismos que não respondem ao medicamento). Na ocorrência de superinfecção durante a terapia, o seu médico deverá tomar medidas apropriadas. Não há dados sobre o efeito que MAXCEF possa causar sobre pacientes dirigindo veículos ou operando máquinas. Gravidez Não há estudos adequados e bem controlados em mulheres grávidas. Você só deverá utilizar este medicamento na gravidez sob orientação de um médico. Lactação A cefepima é excretada no leite humano em concentrações muito baixas. A administração de cefepima deve ser feita com muita cautela a lactantes. Você não deve utilizar este medicamento, se estiver grávida ou amamentando, somente sob orientação de seu médico. Informe ao seu médico se ficar grávida ou iniciar amamentação durante o uso de MAXCEF. Uso em crianças A segurança de MAXCEF em lactentes e crianças é similar à observada em adultos. Em estudos clínicos, o evento adverso mais freqüentemente relatado e considerado relacionado a MAXCEF foi erupção da pele. Uso em idosos Nos estudos clínicos, os pacientes idosos que receberam a dose usualmente recomendada para adultos mostraram eficácia clínica e segurança semelhantes às de pacientes adultos não-idosos. O seu médico deverá fazer ajustes de dose, se a função renal estiver comprometida. 3
4 Há casos de pacientes idosos com insuficiência renal que apresentaram eventos adversos sérios, incluindo encefalopatia reversível (distúrbios de consciência incluindo confusão, alucinações, torpor e coma), mioclonia (movimentos musculares involuntários), convulsões (incluindo estado epiléptico não convulsivo) e/ou insuficiência renal, ao utilizar doses usuais de cefepima. Você não deve usar este medicamento sem o conhecimento do seu médico. Pode ser perigoso para a sua saúde. Interações medicamentosas Você deve ter acompanhamento médico em relação à função renal, se estiver utilizando altas doses de antibióticos aminoglicosídeos juntamente com MAXCEF, pois podem aumentar o risco de nefrotoxicidade (toxicidade renal) e ototoxicidade (toxicidade auditiva). Há casos de toxicidade renal com o uso de outras cefalosporinas com diuréticos potentes (por ex., furosemida). Você deve informar ao seu médico se está fazendo uso de algum outro medicamento. MODO DE USO Aspecto físico e características organolépticas O cloridrato de cefepima é um pó branco a amarelo claro. Após a preparação da solução injetável, sua cor pode variar de incolor a âmbar. Como usar Modo de preparo MAXCEF pó deve ser reconstituído por um profissional de saúde, utilizando-se os volumes de diluentes descritos na Tabela 1; os diluentes a serem utilizados são identificados após a tabela. Administração Tabela 1: Preparo das soluções de MAXCEF Volume Volume de diluente a aproximado no ser adicionado (ml) frasco-ampola (ml) Concentração aproximada de cefepima (mg/ml) Intravenosa 500mg frascoampola 5 5,7 90 1g frasco-ampola 10 11,4 90 2g frasco-ampola 10 12,8 160 Intramuscular 500mg frascoampola 1,5 2, g frasco-ampola 3 4,
5 Administração intravenosa (IV) É a via de administração preferencial para pacientes com infecções graves ou com risco de morte, principalmente se existe a possibilidade de choque. Para a administração IV direta, reconstituir MAXCEF com água estéril para injeção, solução injetável de glicose a 5% ou soro fisiológico a 0,9%, utilizando-se os volumes de diluente descritos na tabela 1. A solução resultante deve ser injetada diretamente na veia por período de três a cinco minutos ou injetada no tubo do equipo de administração, enquanto o paciente estiver recebendo líquido intravenoso compatível (vide Compatibilidade e Estabilidade). Para infusão IV, reconstituir a dose de 500 mg, 1 g ou 2 g, como descrito anteriormente para administração IV direta e adicionar a quantidade apropriada da solução resultante em um recipiente com um dos líquidos intravenosos compatíveis (vide Compatibilidade e Estabilidade). A solução resultante deve ser administrada por um período de aproximadamente 30 minutos. Administração intramuscular (IM) MAXCEF deve ser reconstituído com um dos seguintes diluentes (utilizando-se os volumes descritos na tabela 1): água estéril para injeção, soro fisiológico a 0,9%, solução injetável de glicose a 5% ou água bacteriostática para injeção com parabenos ou álcool benzílico; então administrado por injeção IM profunda em uma grande massa muscular (como o quadrante superior externo da região glútea). Em um estudo farmacocinético, doses de 1 g (volume < 3,1 ml) foram administradas em injeção local única; a dose máxima IM (2 g/6,2 ml) foi administrada em dois locais. Embora MAXCEF possa ser reconstituído com cloridrato de lidocaína a 0,5 ou 1,0%, esta normalmente não é necessária, pois MAXCEF causa pouca ou nenhuma dor na administração IM. Compatibilidade e estabilidade As soluções de MAXCEF, assim como a maioria dos antibióticos beta-lactâmicos, não devem ser associadas com soluções de metronidazol, vancomicina, gentamicina, sulfato de tobramicina ou sulfato de netilmicina, devido à incompatibilidade física e química. Entretanto, caso a terapia concomitante com MAXCEF seja indicada, cada um desses antibióticos poderá ser administrado separadamente. Intravenosa MAXCEF é compatível em concentrações entre 1 e 40 mg/ml com os seguintes líquidos para infusão IV: soro fisiológico a 0,9%, solução injetável de glicose a 5% ou 10%, injeção de lactato de sódio M/6, solução injetável de glicose a 5% e soro fisiológico a 0,9%, solução injetável de Ringer Lactato e solução injetável de glicose a 5%. Estas soluções são estáveis por 24 à temperatura ambiente controlada (20-25ºC) ou por 7 dias sob refrigeração (entre 2ºC e 8ºC). Informações sobre a estabilidade e compatibilidade de MAXCEF em associações estão resumidas na Tabela 2 a seguir. Tabela 2: Estabilidade da cefepima em associações Tempo de Estabilidade 5
6 Concentração de Maxcef 40 mg/ml 40 mg/ml 40 mg/ml 40 mg/ml 40 mg/ml 4 mg/ml 4-40 mg/ml 4 mg/ml 4 mg/ml 4 mg/ml 1-4 mg/ml 0,125-0,25 mg/ml Droga Associada e Concentração Solução para Infusão IV Temp. Ambiente (20 C-25 C) e iluminação Refrigeração Amicacina 6 mg/ml SF ou SG5% 24 7 dias Ampicilina 1 mg/ml SG5% 8 8 Ampicilina 10mg/mL SG5% 2 8 Ampicilina 1 mg/ml SF Ampicilina 10mg/mL SF 8 48 Ampicilina 40mg/mL SF 8 8 Clindamicina SF ou 0,25-6 mg/ml SG5% 24 7 dias Heparina SF ou unidades/ml SG5% 24 7 dias Cloreto de potássio meq/l SF ou SG5% 24 7 dias Teofilina 0,8 mg/ml SG5% 24 7 dias Solução NA para nutrição parenteral a 8 3 dias NA Solução para diálise peritoneal b 24 à temp. ambiente e iluminação ou 37ºC 7 dias a = Aminosina II 4,25% em glicose 25% com eletrólitos e cálcio. b = Inpersol com 4,25% de glicose. SF = Solução fisiológica a 0,9% para injeção. SG5% = Solução injetável de glicose a 5% NA = não aplicável Intramuscular MAXCEF reconstituído como descrito (tabela 1) é estável por 24 à temperatura ambiente controlada (20ºC e 25ºC) ou por 7 dias sob refrigeração (2ºC a 8ºC) quando são usados os seguintes diluentes: água estéril para injeção, soro fisiológico a 0,9%, solução injetável de glicose a 5%, água bacteriostática para injeção com parabenos ou álcool benzílico, ou cloridrato de lidocaína a 0,5 ou 1,0%. 6
7 NOTA: Os medicamentos de uso parenteral devem ser visualmente inspecionados antes da administração com relação a materiais estranhos, e não devem ser utilizados se estes estiverem presentes. Como ocorre com outras cefalosporinas, a cor de MAXCEF pó e da solução reconstituída pode escurecer durante a armazenagem, porém a potência do produto permanece inalterada. Posologia MAXCEF pode ser administrado por via intravenosa ou por via intramuscular. A dose e a via de administração variam de acordo com a sensibilidade do patógeno (agente que causa a infecção), com a gravidade da infecção, com a função renal e com a condição geral do paciente. Adultos e Pacientes Pediátricos > 40 kg A Tabela 3 mostra a dose de MAXCEF que deve ser utilizada, bem como o intervalo das doses para pacientes adultos e crianças com peso corpóreo > 40 kg com função renal normal. Tabela 3 Esquema de Dosagem Recomendada para Adultos e Pacientes pediátricos > 40 kg com Função Renal Normal* Dose e Via de Gravidade da Infecção Intervalo da dose Administração Infecções leves a moderadas do trato urinário Outras infecções leves a moderadas, diferentes das infecções do trato urinário Infecções graves Infecções muito graves ou com risco de morte 500 mg a 1 g IV ou IM 1 g IV ou IM 2 g IV 2 g IV A cada 12 A cada 12 A cada 12 A cada 8 * A duração normal do tratamento é de 7 a 10 dias; porém, infecções mais graves podem necessitar de tratamento mais prolongado. Para o tratamento empírico de neutropenia febril, a duração prevista da terapia é de 7 dias ou até a resolução da neutropenia Profilaxia Cirúrgica (Adultos) Segue abaixo a dose recomendada para prevenir infeções em pacientes submetidos a cirurgia intraabdominal: - Uma dose única de 2 g IV de MAXCEF (infusão com duração de 30 min) 60 minutos antes da incisão cirúrgica inicial. Uma dose única de 500 mg IV de metronidazol deve ser administrada imediatamente após o término da infusão de MAXCEF. O metronidazol deve ser preparado e administrado de acordo com a bula oficial do produto. MAXCEF e metronidazol não devem ser misturados no mesmo recipiente. - Caso o procedimento cirúrgico se prolongue por mais de 12 a partir da dose profilática inicial, 7
8 uma segunda dose de MAXCEF seguida por metronidazol deve ser administrada 12 após a dose profilática inicial. Pacientes pediátricos com função renal normal (1 mês de idade ou mais) Doses recomendadas, nos casos de: Pneumonia, infecções do trato urinário, infecções da pele e estruturas cutâneas Pacientes com mais de 2 meses de idade e peso corpóreo 40kg: 50 mg/kg a cada 12 durante 10 dias. Para infecções mais graves pode ser usado um intervalo de 8 entre as doses. Septicemia, meningite bacteriana e tratamento empírico da neutropenia febril Pacientes com mais de 2 meses de idade e peso corpóreo 40kg: 50 mg/kg a cada 8 durante 7 10 dias. Não há dados suficientes em relação ao uso de MAXCEF em crianças com menos de 2 meses de idade. De acordo com estudos com pacientes com mais de 2 meses de idade, pode ser considerada a dose de 30 mg/kg a cada 8 ou 12 para pacientes entre 1 e 2 meses de idade. As doses de 50 mg/kg para pacientes com mais de 2 meses de idade e 30 mg/kg para pacientes entre 1 e 2 meses de idades são comparáveis à dose de 2 g para adultos. Para crianças com peso corpóreo acima de 40 kg, aplicam-se as doses recomendadas para adultos (vide tabela 3). A dose recomendada para crianças não deve exceder a dose máxima recomendada para adultos (2 g a cada 8 ). Não há dados suficientes em relação à administração intramuscular em pacientes pediátricos. Pacientes com disfunção renal Em pacientes com disfunção renal, a dose de cefepima deve ser ajustada para compensar o índice menor de eliminação renal. A dose inicial recomendada de cefepima em pacientes com disfunção renal leve a moderada deve ser a mesma que em pacientes com função renal normal. As doses de manutenção recomendadas de cefepima em pacientes adultos com disfunção renal estão presentes na Tabela 4. Quando somente uma medida da creatinina sérica está disponível, a seguinte fórmula (equação de Cockcroft e Gault) pode ser usada para estimar o clearance da creatinina. A creatinina sérica deve representar uma condição normal da função renal: Homens: clearance da creatinina (ml/min) = peso (kg) x (140-idade) / 72 x creatinina sérica (mg/dl) Mulheres: 0,85 x valor calculado usando a fórmula para homens. Tabela 4 Esquema de doses de manutenção recomendada em pacientes adultos com disfunção renal* clearance de CREATININA (ml/min) DOSE DE MANUTENÇÃO RECOMENDADA (Dose usual, sem ajuste necessário) >50 2g a cada 8 2g a cada 12 1g a cada mg a cada 12 8
9 g a cada 12 2g a cada 24 1g a cada g a cada 24 1g a cada g a cada mg a cada mg a cada 24 Hemodiálise* *O modelo farmacocinético indica que a redução de dose é necessária para estes pacientes. Pacientes que estão submetidos a hemodiálise e concomitantemente recebendo cefepima, a dose de cefepima deve ser como segue: 1g de cefepima como dose de ataque no primeiro dia de tratamento e 500mg por dia a partir do 2º dia. Nos dias de diálise, cefepima deve ser administrada após a diálise. Sempre que possível cefepima deve ser administrada na mesma hora a cada dia. Pacientes submetidos à diálise Em pacientes submetidos à hemodiálise, aproximadamente 68% da quantidade total de cefepima presente no organismo no início da diálise será removida durante um período de 3 de diálise. Em pacientes submetidos à diálise peritoneal contínua em ambulatório, a cefepima pode ser administrada nas mesmas doses recomendadas para pacientes com função renal normal, isto é, 500 mg, 1 g ou 2 g, dependendo da gravidade da infecção, porém com intervalo entre as doses de 48. Pacientes pediátricos com disfunção renal Uma vez que a excreção urinária é a principal via de eliminação da cefepima em pacientes pediátricos, o ajuste das doses de MAXCEF deve ser considerado nesta população. Como recomendado anteriormente na Tabela 4, os mesmos aumentos nos intervalos das doses e/ou reduções de doses devem ser usados. Quando somente o valor da creatinina sérica estiver disponível, o clearance de creatinina pode ser estimado utilizando-se os seguintes métodos: ou clearance de creatinina (ml/min/1,73m 2 ) = 0,55 x altura (centímetros) creatinina sérica (mg/dl) clearance de creatinina (ml/min/1,73m 2 ) = 0,52 x altura (centímetros) - 3,6 creatinina sérica (mg/dl) Disfunção hepática Não é necessário ajuste de dose para pacientes com alterações da função do fígado. 9
10 Você deve seguir a orientação de seu médico, respeitando sempre os horários, as doses e a duração do tratamento. Você não deve interromper o tratamento sem o conhecimento do seu médico. Você não deve usar este medicamento com o prazo de validade vencido. Antes de usar observe o seu aspecto. REAÇÕES ADVERSAS Os seguintes eventos adversos e testes laboratoriais alterados foram relatados para os antibióticos da classe das cefalosporinas: síndrome de Stevens-Johnson (forma bolhosa de eritema multiforme ), necrólise epidérmica tóxica, nefropatia (doença relacionada ao rim) tóxica, anemia aplástica (formação diminuída de hemácias e hemoglobinas), anemia hemolítica (maior destruição das hemácias), hemorragia e testes falso-positivos para glicose urinária. Experiência clínica MAXCEF é geralmente bem tolerado. Os eventos indesejáveis mais comuns foram sintomas no aparelho digestivo e as reações alérgicas. Podem ocorrer também os seguintes eventos. Os eventos adversos que ocorreram a uma incidência de >0,1 a 1% foram: Hipersensibilidade (alergia): erupções da pele (1,8%), prurido (coceira), urticária. Gastrintestinais: náuseas, vômitos, candidíase oral, diarréia (1,2%), colite (inflamação do cólon - inclusive colite pseudomembranosa). Sistema nervoso central: cefaléia (dor de cabeça). Outros: febre, vaginite (inflamação da vagina), eritema (vermelhidão inflamatória da pele). Reações no local da administração da infusão intravenosa ocorreram em 5,2% dos pacientes; estas reações foram: flebite (inflamação de uma veia - 2,9%) e inflamação (0,1%). A administração intramuscular de MAXCEF foi muito bem-tolerada; apenas 2,6% dos pacientes apresentaram dor ou inflamação no local da aplicação. O perfil de segurança de MAXCEF em crianças e lactentes é similiar ao dos adultos. O evento adverso relatado ao MAXCEF que foi reportado com maior freqüência foi erupção cutânea. As alterações nos testes laboratoriais que ocorreram durante estudos clínicos em pacientes com valores basais normais foram passageiras. Experiência de pós-comercialização 10
11 As seguintes experiências adversas foram relatadas durante a experiência de pós-comercialização. Encefalopatia (distúrbios de consciência incluindo confusão, alucinação, lentidão e coma), convulsões, mioclonia (movimentos musculares involuntários), e/ou insuficiência renal. A maioria dos casos ocorreu em pacientes com problemas renais que receberam doses de MAXCEF maiores do que a recomendada. Assim como outras cefalosporinas, foram relatadas reações anafiláticas, incluindo choque anafilático, leucopenia(quantidade menor e anormal de leucócitos no sangue) passageira, neutropenia (quantidade menor e anormal de neutrófilos no sangue), agranulocitose e trombocitopenia (quantidade menor e anormal de plaquetas no sangue). 11
12 Os seguintes eventos adversos e testes laboratoriais alterados foram relatados para os antibióticos da classe das cefalosporinas: síndrome de Stevens-Johnson (forma bolhosa de eritema multiforme ), necrólise epidérmica tóxica, nefropatia (doença relacionada ao rim) tóxica, anemia aplástica (formação diminuída de hemácias e hemoglobinas), anemia hemolítica (maior destruição das hemácias), hemorragia e testes falso-positivos para glicose urinária. Você deve informar ao seu médico o aparecimento de reações indesejáveis. CONDUTA EM CASO DE SUPERDOSE Sintomas de superdose incluem: encefalopatia (distúrbio de consciência, incluindo confusão, alucinações, torpor e coma) mioclonia, convulsões e excitabilidade neuromuscular. No caso de superdose grave, especialmente em pacientes com a função renal comprometida, a hemodiálise ajudará na remoção da cefepima do organismo; diálise peritoneal não é indicada nestes casos. Se você tomar este medicamento em uma dose maior do que a recomendada, você deve procurar um médico imediatamente. CUIDADOS DE CONSERVAÇÃO Você deve conservar MAXCEF pó para solução injetável, antes de sua reconstituição, em temperatura ambiente até 30ºC. Mantenha protegido da luz. TODO MEDICAMENTO DEVE SER MANTIDO FORA DO ALCANCE DAS CRIANÇAS. INFORMAÇÕES AO PROFISSIONAL DE SAÚDE CARACTERÍSTICAS FARMACOLÓGICAS Descrição MAXCEF (cloridrato de cefepima) pó para solução injetável é um antibiótico cefalosporínico de amplo espectro para administração intramuscular ou intravenosa. MAXCEF é uma mistura estéril de cloridrato de cefepima e L-arginina. A L-arginina, em uma concentração aproximada de 725 mg/g de cefepima, é adicionada para controlar o ph da solução reconstituída entre 4,0 e 6,0. O cloridrato de cefepima é um pó branco a amarelo claro, e é altamente solúvel em água; a cor da solução reconstituída de MAXCEF pode variar de incolor a âmbar. Farmacocinética As concentrações plasmáticas médias de cefepima observadas em adultos sadios do sexo masculino em vários momentos após infusões intravenosas ou injeções intramusculares únicas de 30 minutos com 500 mg, 1 g e 2 g estão resumidas na Tabela 1. TABELA 1 Concentrações plasmáticas médias de cefepima (µg/ml) em pacientes adultos sadios do sexo masculino Dose de cefepima 0,5h 1h 2h 4h 8h 12h
13 500mg IV 38,2 21,6 11,6 5 1,4 0,2 1g IV 78,7 44,5 24,3 10,5 2,4 0,6 2g IV 163,1 85,8 44,8 19,2 3,9 1,1 500mg IM 8,2 12,5 12 6,9 1,9 0,7 1g IM 14,8 25,9 26,3 16,0 4,5 1,4 2g IM 36,1 49,9 51,3 31,5 8,7 2,3 Absorção Após administração intramuscular, a cefepima é completamente absorvida. Distribuição As concentrações de cefepima em tecidos e nas secreções corpóreas específicas estão apresentadas na Tabela 2 A ligação da cefepima às proteínas séricas é em média de 16,4% e não depende da concentração no soro. TABELA 2 Concentrações médias de cefepima em várias secreções corpóreas (µg/ml) e tecidos (µg/g) em pacientes adultos sadios do sexo masculino Tecido ou Fluido Dose IV Tempo médio da amostra após a dose (h) Concentração média 500mg Urina 1g g Bile 2g 9,4 17,8 Fluido Peritoneal 2g 4,4 18,3 Fluido Pustular 2g 1,5 81,4 Mucosa Brônquica 2g 4,8 24,1 Escarro 2g 4 7,4 Próstata 2g 1 31,5 Apêndice 2g 5,7 5,2 Vesícula Biliar 2g 8,9 11,9 Metabolismo A cefepima é metabolizada a N-metilpirrolidina, que é rapidamente convertida a N-óxido. A recuperação urinária da cefepima inalterada representa aproximadamente 85% da dose administrada; altas concentrações de cefepima inalterada são encontradas na urina. Menos de 1% da dose administrada é recuperada da urina como N-metilpirrolidina, 6,8% como N-óxido e 2,5% como um epímero da cefepima. Eliminação A meia-vida média de eliminação da cefepima é de aproximadamente 2 e não varia com relação à dose entre 250 mg a 2 g. Não houve acúmulo em indivíduos sadios recebendo doses de até 2 g IV a cada 8 por um período de 9 dias. O clearance corpóreo total médio é de 120 ml/min. O clearance renal médio da cefepima é de 110 ml/min, sugerindo que a cefepima é eliminada quase que exclusivamente por mecanismos renais, principalmente por filtração glomerular.
14 Populações Especiais Foi observada melhora clínica com o uso de MAXCEF no tratamento da exacerbação de infecções pulmonares agudas em pacientes com fibrose cística (N=24, média de idade de 15 anos, variando de 5 a 47 anos de idade). A terapia antibacteriana pode não alcançar a erradicação bacteriológica nesta população de pacientes. Não foram observadas alterações clinicamente relevantes na farmacocinética da cefepima em pacientes com fibrose cística. Insuficiência renal Em pacientes com vários graus de insuficiência renal, a meia-vida de eliminação é prolongada, apresentando uma relação linear entre o clearance corpóreo total e o clearance da creatinina. Isto serve como base para recomendações de ajuste de dose neste grupo de pacientes (vide POSOLOGIA). A meia-vida média em pacientes com disfunção grave, que necessitam de diálise, é de 13 para hemodiálise e de 19 para diálise peritoneal contínua de ambulatório. Insuficiência hepática A farmacocinética da cefepima permaneceu inalterada em pacientes com disfunção hepática que receberam dose única de 1 g. Não é necessário alterar a dose de MAXCEF nesta população de pacientes. Pacientes idosos Constatou-se que voluntários sadios com 65 anos de idade, ou mais, que receberam dose única de 1 g IV de MAXCEF, tiveram valores de área sob a curva (AUC) maiores e de clearance renal menores, quando comparados a pacientes mais jovens. O ajuste de dose em pacientes idosos é recomendado se a função renal estiver comprometida (vide POSOLOGIA e USO EM IDOSOS, CRIANÇAS E OUTROS GRUPOS DE RISCO). Crianças e Adolescentes A farmacocinética da cefepima em doses múltiplas e em dose única foi avaliada em pacientes com idades entre 2,1 meses a 11,2 anos que receberam doses de 50 mg/kg administradas por infusão IV ou injeção IM; doses múltiplas foram administradas a cada 8 ou 12 durante pelo menos 48. Após dose única IV, a média do clearance corpóreo total foi de 3,3 ml/min/kg e o volume médio de distribuição foi de 0,3 L/kg. A meia-vida média de eliminação foi de 1,7. A recuperação urinária média da cefepima inalterada foi de 60,4% da dose administrada e o clearance renal foi a principal via de eliminação com média de 2,0 ml/min/kg. Após múltiplas doses IV, as concentrações plasmáticas médias de cefepima no estado de equilíbrio foram similares às concentrações após a primeira dose, com discreto acúmulo após repetidas doses. Outros parâmetros farmacocinéticos em lactentes e crianças não foram diferentes entre a primeira dose e determinações em estado de equilíbrio, independentemente do intervalo entre as doses (a cada 8 ou 12 ). Também não houve diferenças farmacocinéticas entre os pacientes de diferentes idades ou entre pacientes do sexo masculino e feminino. Após injeção IM em estado de equilíbrio, a concentração plasmática média de 68µg /ml foi obtida depois de 0,75 hora. A média da concentração mínima, após injeção IM em estado de equilíbrio foi de 6,0 µg/ml em 8. A biodisponibilidade média foi de 82% após injeção IM. Concentrações de cefepima no líquido cefalorraquidiano e plasmático são apresentadas na Tabela 3: TABELA 3
15 Média (desvio padrão - DP) das concentrações no líquido cefalorraquidiano (LCR) e plasmático (PL), e índice LCR/PL da cefepima em lactentes e crianças.* Horário da Concentração Concentração no N Coleta (h) Plasmática (µg/ml) LCR (µg/ml) Índice LCR/PL 0,5 7 67,1 (51,2) 5,7 (7,3) 0,12 (0,14) ,1 (7,8) 4,3 (1,5) 0,10 (0,04) ,9 (12,9) 3,6 (2,0) 0,17 (0,09) ,7 (15,7) 4,2 (1,1) 0,87 (0,56) 8 5 4,9 (5,9) 3,3 (2,8) 1,02 (0,64) * Pacientes com idades entre 3,1 meses a 12 anos, com média de idade (DP) de 2,6 (3,0) anos. Pacientes com suspeita de infecção no Sistema Nervoso Central (SNC) foram tratados com cefepima, 50 mg/kg, administrada por infusão IV de 5 a 20 minutos a cada 8. Amostras de sangue e de LCR foram coletadas de pacientes selecionados, aproximadamente em 0,5, 1, 2, 4 e 8 após o final da infusão no 2º ou 3º dia de terapia com a cefepima. Outros A farmacocinética da cefepima não mudou num grau clinicamente significante em pacientes com fibrose cística. Não é necessário ajustar a dose de MAXCEF nesta população de pacientes. Mecanismo de ação Microbiologia A cefepima é um agente bactericida que age por inibição da síntese da parede celular bacteriana. A cefepima tem amplo espectro de atividade contra uma grande variedade de bactérias Grampositivas e Gram-negativas, incluindo a maioria das cepas resistentes aos aminoglicosídeos ou às cefalosporinas de terceira geração. A cefepima é altamente resistente à hidrólise pela maioria das beta-lactamases e tem baixa afinidade por beta-lactamases cromossomicamente codificadas, exibindo rápida penetração nas células bacterianas Gram-negativas. Em estudos usando Escherichia coli e Enterobacter cloacae, a cefepima demonstrou máxima afinidade pela proteína de ligação à penicilina (PLP) 3, seguida pela PLP 2 e, então, pelas PLP s 1a e 1b. A ligação à PLP 2 ocorre com afinidade significantemente mais alta do que com outras cefalosporinas parenterais, o que pode aumentar sua atividade antibacteriana. A afinidade moderada da cefepima pelas PLP s 1a e 1b também pode contribuir para sua atividade bactericida total. A cefepima mostrou-se bactericida pela análise da relação tempo-inibição (curva de inibição) e pela determinação das concentrações bactericidas mínimas (CBM) para uma ampla variedade de bactérias. O índice CBM/CIM (concentração inibitória mínima) não foi maior que 2 para a maioria (mais de 80%) dos isolados de todas as espécies Gram-positivas e Gram-negativas analisadas. Foi demonstrado sinergismo com os aminoglicosídeos in vitro, principalmente com isolados de Pseudomonas aeruginosa. A cefepima mostrou-se ativa contra a maioria das cepas dos seguintes microrganismos: Gram-positivos aeróbios: Staphylococcus aureus (incluindo cepas produtoras de beta-lactamase), Staphylococcus epidermidis (incluindo cepas produtoras de beta-lactamase), outros estafilococos entre os quais S. hominis e S. saprophyticus.
16 Streptococcus pyogenes (estreptococos do Grupo A), Streptococcus agalactiae (estreptococos do Grupo B), Streptococcus pneumoniae (incluindo cepas de resistência intermediária à penicilina com CIM de 0,1 a 1 μg/ml), outros estreptococos beta-hemolíticos (Grupos C, G, F), S. bovis (Grupo D) e estreptococos Viridans. NOTA: A maioria das cepas de enterococos, por exemplo Enterococcus faecalis, e estafilococos resistentes à meticilina, são resistentes à maioria das cefalosporinas, inclusive à cefepima. Gram-negativos aeróbios: Acinetobacter calcoaceticus (subsp. anitratus, lwoffi) Aeromonas hydrophila Capnocytophaga sp. Citrobacter sp., entre os quais C. diversus e C. freundii Campylobacter jejuni Enterobacter sp., entre os quais E. cloacae, E. aerogenes e E. sakazakii Escherichia coli Gardnerella vaginalis Haemophilus ducreyi, Haemophilus influenzae (incluindo cepas produtoras de betalactamase), Haemophilus parainfluenzae Hafnia alvei Klebsiella sp., entre os quais K. pneumoniae, K. oxytoca e K. ozaenae Legionella sp Morganella morganii Moraxella catarrhalis (Branhamella catarrhalis) (incluindo cepas produtoras de betalactamase) Neisseria gonorrhoeae (incluindo cepas produtoras de beta-lactamase), Neisseria meningitidis Pantoea agglomerans (anteriormente conhecido como Enterobacter agglomerans) Proteus sp., entre os quais P. mirabilis e P. vulgaris Providencia sp., entre os quais P. rettgeri e P. stuartii Pseudomonas sp., entre os quais P. aeruginosa, P. putida e P. stutzeri Salmonella sp., Serratia, entre os quais S. marcescens e S. liquefaciens Shigella sp. Yersinia enterocolitica. NOTA: a cefepima é inativa contra muitas cepas de Stenotrophomonas maltophilia (anteriormente conhecida como Xanthomonas maltophilia e Pseudomonas maltophilia). Anaeróbios: Bacteroides sp. Clostridium perfringens Fusobacterium sp. Mobiluncus sp. Peptostreptococcus sp. Prevotella melaninogenica (anteriormente conhecida como Bacteroides melaninogenicus) Veillonella sp. NOTA: a cefepima é inativa contra Bacteroides fragilis e Clostridium difficile. A prevalência de resistência adquirida pode variar geograficamente e com o tempo, para espécies selecionadas. Informação sobre o teste padrão local da resistência de um laboratório bacteriológico local e considerada na escolha da terapia empírica.
17 Testes de sensibilidade Técnicas de difusão: Resultados laboratoriais de testes de sensibilidade com disco único padronizado, usando-se discos de 30µg de cefepima, conforme determinação do National Committee for Clinical Laboratory Standards (NCCLS), devem ser interpretados de acordo com o seguinte critério: Microorganismo Microorganismos que não sejam Haemophilus sp. * e S. pneumoniae. * Diâmetro do halo (mm) Suscetível Intermediário Resistente (S) (I) (R) Haemophilus sp. * 26 - * - * * NOTA: Isolados destas espécies devem ser testados quanto a sensibilidade usando métodos de teste especializados. Isolados de Haemophilus sp. com halos <26 mm devem ser considerados equivocados e devem ser avaliados adicionalmente. Isolados de S. pneumoniae devem ser testados novamente contra um disco de 1µg de oxacilina; isolados com halos de oxacilina >= 20 mm podem ser considerados sensíveis à cefepima. Sensível indica que o patógeno é, provavelmente, inibido por concentrações plasmáticas que são geralmente alcançadas. Intermediário indica que o organismo é sensível quando altas doses são usadas ou quando a infecção está confinada a tecidos e fluidos (p. ex.: fluido intersticial e urina), nos quais altos níveis de antibióticos são atingidos. Resistente indica que é improvável que a concentração de antibiótico alcançável seja inibitória e outra terapia deve ser instituída. A sensibilidade dos microrganismos deve ser avaliada com discos de cefepima, porque esta temse mostrado ativa in vitro contra certas cepas resistentes a outros discos de beta-lactamase. O disco de cefepima não deve ser utilizado para avaliar a sensibilidade frente a outras cefalosporinas. Procedimentos padronizados de controle de qualidade preconizam o uso de cepas controle. Técnicas de diluição Usando-se métodos padronizados de diluição ou equivalentes (ex.: E-test), os valores da Concentração Inibitória Mínima (CIM) obtidos devem ser interpretados de acordo com o seguinte critério: Microorganismo CIM (μg/ml) Suscetível Intermediário Resistente (S) (I) (R)
18 Microorganismos que não sejam Haemophilus sp. * e S. pneumoniae. * Haemophilus sp. * 2 - * - * Streptococcus pneumoniae * 0,5 1* 2 * NOTA: isolados destas espécies devem ser testados quanto à sensibilidade usando métodos de testes de diluição especializados. Cepas de Haemophilus sp. com CIM s maiores que 2 µg/ml devem ser consideradas equivocadas e devem ser avaliadas adicionalmente. Se o isolado de S. pneumoniae não for recuperado de um paciente com meningite, cepas de pneumococos com CIM s intermediárias podem responder à terapia com cefepima. Assim como as técnicas de difusão, as técnicas de diluição preconizam o uso de cepas controle. RESULTADOS DE EFICÁCIA Pacientes Neutropênicos Febris A segurança e eficácia da monoterapia empírica com cefepima para pacientes neutropênicos febris foram avaliadas em dois estudos multicêntricos, randomizados, comparando monoterapia com cefepima (dose de 2g a cada 8, IV) à monoterapia com ceftazidima (dose de 2g a cada 8, IV). Esses estudos foram realizados com 317 pacientes. A Tabela 4 descreve as características da população de pacientes avaliáveis. Tabela 4: Demografia dos pacientes avaliáveis (apenas primeiros episódios) cefepima (n=164) ceftazidima (n=153) Idade média 56 (faixa 18-82) 55 (faixa 16-84) Homens 86 (52%) 85 (56%) Mulheres 78 (48%) 68 (44%) Leucemia 65 (40%) 52 (34%) Outras malignidades hematológicas 43 (26%) 36 (24%) Tumor sólido 54 (33%) 56 (37%) CAN nadir médio (céls/μl) 20,0 (faixa 0-500) 20,0 (faixa 0-500) Duração média da neutropenia (dias) 6,0 (faixa 0-39) 6,0 (faixa 0-32) Catéter venoso de demora 97 (59%) 86 (56%) Profilaxia com antibiótico 62 (38%) 64 (42%) Corrupção da medula 9 (5%) 7 (5%) PAS < 90 mm Hg na entrada 7 (4%) 2 (1%) CAN = contagem absoluta de neutrófilos; PAS = pressão arterial sistólica A Tabela 5 descreve as taxas das respostas clínicas observadas Para todos os resultados medidos, a cefepima mostrou-se terapeuticamente equivalente a ceftazimida. TABELA 5 Taxas de respostas conjuntas para terapia empírica em pacientes
19 Resultados medidos Episódio primário resolvido sem modificação no tratamento, não houve novos episódios febris ou infecção, e o uso de antibióticos orais foram permitidos para complementar o tratamento Episódio primário resolvido sem modificação no tratamento, não houve novos episódios febris ou infecção, e antibióticos orais não foram utilizados no pós-tratamento Sobrevivência, com permissão de qualquer modificação no tratamento Episódio primário resolvido sem modificação no tratamento e antibióticos orais foram permitidos para complementar o tratamento Episódio primário resolvido sem modificação no tratamento, e antibióticos orais não foram utilizados no pós-tratamento neutropênicos febris cefepima (n=164) ceftazidima (n=153) Não existem dados suficientes que comprovem a eficácia da monoterapia com cefepima em pacientes com alto risco de infecções severas (incluindo pacientes com histórico de recente transplante de medula, com hipotensão, malignidade hematológica subjacente, ou com neutropenia severa ou prolongada). Não há dados sobre pacientes com choque séptico. Profilaxia Cirúrgica Esta indicação está baseada em um estudo clínico randomizado, aberto, multicêntrico com pacientes com 19 anos de idade ou mais (média de idade de 66 anos) submetidos à cirurgia coloretal, nos quais uma administração pré-cirúrgica IV de uma dose única de 2 g de MAXCEF seguida de uma dose única IV de 500 mg de metronidazol (N=307) foi comparada com uma dose única IV de 2 g de ceftriaxona seguida por metronidazol (N=308). A administração da dose variou de 0 a 3 antes da incisão cirúrgica inicial. As taxas de sucesso clínico (ausência de infecções intra-abdominais e na região cirúrgica durante as 6 semanas após a cirurgia) foram de 75% em cada grupo de tratamento. (vide POSOLOGIA). INDICAÇÕES Adultos MAXCEF é indicado no tratamento, em adultos, das infecções relacionadas a seguir, quando causadas por bactérias sensíveis à cefepima: - Infecções do trato respiratório inferior, incluindo pneumonia e bronquite; - Infecções complicadas do trato urinário, incluindo pielonefrite e infecções não complicadas; - Infecções da pele e estruturas cutâneas;
20 - Infecções intra-abdominais, incluindo peritonite e infecções do trato biliar; - Infecções ginecológicas; - Septicemia; - Terapia empírica em pacientes neutropênicos febris: monoterapia com cefepima é indicada para o tratamento empírico de pacientes neutropênicos febris. Em pacientes com alto risco de infecção grave (por exemplo, pacientes com histórico de recente transplante de medula, com hipotensão, malignidade hematológica subjacente, ou com neutropenia grave ou prolongada), monoterapia antimicrobiana pode não ser apropriada. Não há dados suficientes que comprovem a eficácia da monoterapia com cefepima nestes pacientes (vide RESULTADOS DE EFICÁCIA). MAXCEF também está indicado para a profilaxia cirúrgica em pacientes submetidos à cirurgia intra-abdominal (vide RESULTADOS DE EFICÁCIA Profilaxia Cirúrgica). Pediátricos MAXCEF é indicado no tratamento, em pacientes pediátricos, das infecções relacionadas a seguir, quando causadas por bactérias sensíveis à cefepima: - Pneumonia; - Infecções complicadas do trato urinário, incluindo pielonefrite e infecções não complicadas; - Infecções da pele e estruturas cutâneas; - Septicemia; - Terapia empírica em pacientes neutropênicos febris: monoterapia com cefepima é indicada para o tratamento empírico de pacientes neutropênicos febris. Em pacientes com alto risco de infecção grave (por exemplo, pacientes com histórico de recente transplante de medula, com hipotensão, malignidade hematológica subjacente, ou com neutropenia grave ou prolongada), monoterapia antimicrobiana pode não ser apropriada. Não há dados suficientes que comprovem a eficácia da monoterapia com cefepima nestes pacientes (vide RESULTADOS DE EFICÁCIA); - Meningite bacteriana; Devem ser realizados testes de cultura e sensibilidade quando apropriados para se determinar a sensibilidade do patógeno à cefepima. A terapia empírica com MAXCEF pode ser instituída antes de se conhecer os resultados dos testes de sensibilidade; entretanto, a antibioticoterapia deverá ser ajustada de acordo com os resultados, assim que estiverem disponíveis. Devido ao seu amplo espectro de atividade bactericida contra bactérias Gram-positivas e Gramnegativas, MAXCEF pode ser usado como monoterapia antes da identificação do(s) patógeno(s). Em pacientes sob risco de infecções mistas de aeróbios-anaeróbios, particularmente se bactérias não-sensíveis à cefepima estiverem presentes (vide CARACTERÍSTICAS FARMACOLÓGICAS- Microbiologia), terapia inicial concomitante com um agente antianaeróbio é recomendada antes que o patógeno seja conhecido. Uma vez que estes resultados estiverem disponíveis, a terapia concomitante com MAXCEF e outros agentes antiinfecciosos pode ou não ser necessária, dependendo da sensibilidade do microrganismo.
21 CONTRA-INDICAÇÕES MAXCEF é contra-indicado para pacientes que tenham demonstrado reações prévias de hipersensibilidade a algum componente da formulação, a antibióticos da classe das cefalosporinas, a penicilinas ou a outros antibióticos beta-lactâmicos. MODO DE USAR E CUIDADOS DE CONSERVAÇÃO DEPOIS DE ABERTO MAXCEF pode ser administrado por via intramuscular ou intravenosa. Preparação das soluções e administração MAXCEF pó deve ser reconstituído utilizando-se os volumes de diluentes descritos na Tabela 6; os diluentes a serem utilizados são identificados após a tabela a seguir. TABELA 6 Preparo das soluções de MAXCEF Administração (frasco-ampola) Volume de diluente a ser adicionado (ml) Volume aproximado no frasco-ampola (ml) Concentração aproximada de cefepima (mg/ml) Intravenosa 500mg 5 5,7 90 1g 10 11,4 90 2g 10 12,8 160 Intramuscular 500mg 1,5 2, g 3 4,4 230 Administração intravenosa (IV) É a via de administração preferencial para pacientes com infecções graves ou com risco de morte, principalmente se existe a possibilidade de choque. Para a administração IV direta, reconstituir MAXCEF com água estéril para injeção, solução injetável de glicose a 5% ou soro fisiológico a 0,9%, utilizando-se os volumes de diluente descritos na Tabela 6. A solução resultante deve ser injetada diretamente na veia por período de três a cinco minutos ou injetada no tubo do equipo de administração, enquanto o paciente estiver recebendo líquido intravenoso compatível (vide Compatibilidade e Estabilidade). Para infusão IV, reconstituir a dose de 500 mg, 1 g ou 2 g, como descrito anteriormente para administração IV direta e adicionar a quantidade apropriada da solução resultante em um recipiente com um dos líquidos intravenosos compatíveis (vide Compatibilidade e Estabilidade). A solução resultante deve ser administrada por um período de aproximadamente 30 minutos. Administração intramuscular (IM) MAXCEF deve ser reconstituído com um dos seguintes diluentes (utilizando-se os volumes descritos na Tabela 6): água estéril para injeção, soro fisiológico a 0,9%, solução injetável de glicose a 5% ou água bacteriostática para injeção com parabenos ou álcool benzílico; então administrado por injeção IM profunda em uma grande massa muscular (como o quadrante
22 superior externo da região glútea). Em um estudo farmacocinético, doses de 1 g (volume < 3,1 ml) foram administradas em injeção local única; a dose máxima IM (2 g/6,2 ml) foi administrada em dois locais. Embora MAXCEF possa ser reconstituído com cloridrato de lidocaína a 0,5 ou 1,0%, esta normalmente não é necessária, pois MAXCEF causa pouca ou nenhuma dor na administração IM. Compatibilidade e estabilidade As soluções de MAXCEF, assim como a maioria dos antibióticos beta-lactâmicos, não devem ser associadas com soluções de metronidazol, vancomicina, gentamicina, sulfato de tobramicina ou sulfato de netilmicina, devido à incompatibilidade física e química. Entretanto, caso a terapia concomitante com MAXCEF seja indicada, cada um desses antibióticos poderá ser administrado separadamente. Intravenosa MAXCEF é compatível em concentrações entre 1 e 40 mg/ml com os seguintes líquidos para infusão IV: soro fisiológico a 0,9%, solução injetável de glicose a 5% ou 10%, injeção de lactato de sódio M/6, solução injetável de glicose a 5% e soro fisiológico a 0,9%, solução injetável de Ringer Lactato e solução injetável de glicose a 5%. Estas soluções são estáveis por 24 à temperatura ambiente controlada (20-25ºC) ou por 7 dias sob refrigeração (entre 2ºC e 8ºC). Informações sobre a estabilidade e compatibilidade de MAXCEF em associações estão resumidas na Tabela 7: TABELA 7 Estabilidade da cefepima em associações Tempo de Estabilidade Concentração de Maxcef Droga Associada e Concentração Solução para Infusão IV Temp. Ambiente (20oC- 25oC) e iluminação Refrigeração 40 mg/ml 40 mg/ml 40 mg/ml 40 mg/ml 40 mg/ml 4 mg/ml 4-40 mg/ml 4 mg/ml 4 mg/ml 4 mg/ml Amicacina 6 mg/ml SF ou SG5% 24 7 dias Ampicilina 1 mg/ml SG5% 8 8 Ampicilina 10mg/mL SG5% 2 8 Ampicilina 1 mg/ml SF Ampicilina 10mg/mL SF 8 48 Ampicilina 40mg/mL SF 8 8 Clindamicina SF ou 0,25-6 mg/ml SG5% 24 7 dias Heparina SF ou unidades/ml SG5% 24 7 dias Cloreto de potássio SF ou meq/l SG5% 24 7 dias Teofilina 0,8 mg/ml SG5% 24 7 dias
23 1-4 mg/ml NA Solução para nutrição parenteral a 8 3 dias 0,125-0,25 mg/ml NA Solução para diálise peritoneal b 24 à temp. ambiente e iluminação ou 37ºC 7 dias a = Aminosina II 4,25% em glicose 25% com eletrólitos e cálcio. b = Inpersol com 4,25% de glicose. SF = Solução fisiológica a 0,9% para injeção. SG5% = Solução injetável de glicose a 5% NA = não aplicável Intramuscular MAXCEF reconstituído como descrito (Tabela 6) é estável por 24 à temperatura ambiente controlada (20ºC e 25ºC) ou por 7 dias sob refrigeração (2ºC a 8ºC) quando são usados os seguintes diluentes: água estéril para injeção, soro fisiológico a 0,9%, solução injetável de glicose a 5%, água bacteriostática para injeção com parabenos ou álcool benzílico, ou cloridrato de lidocaína a 0,5 ou 1,0%. NOTA: Os medicamentos de uso parenteral devem ser visualmente inspecionados antes da administração com relação a materiais estranhos, e não devem ser utilizados se estes estiverem presentes. Como ocorre com outras cefalosporinas, a cor de MAXCEF pó e da solução reconstituída pode escurecer durante a armazenagem, porém a potência do produto permanece inalterada. POSOLOGIA MAXCEF pode ser administrado por via intravenosa ou por via intramuscular. A dose e a via de administração variam de acordo com a sensibilidade do patógeno, com a gravidade da infecção, com a função renal e com a condição geral do paciente. Adultos e Pacientes Pediátricos > 40 kg Um guia para as doses de MAXCEF em adultos e pacientes pediátricos com peso corpóreo > 40 kg com função renal normal é apresentado na Tabela 8. TABELA 8 Esquema de Dosagem Recomendada para Adultos e Pacientes pediátricos >40 kg com Função Renal Normal* Dose e Via de Gravidade da Infecção Intervalo da dose Administração Infecções leves a moderadas do trato urinário Outras infecções leves a moderadas, diferentes das infecções do trato urinário 500 mg a 1 g IV ou IM 1 g IV ou IM A cada 12 A cada 12
24 Infecções graves Infecções muito graves ou com risco de morte 2 g IV 2 g IV A cada 12 A cada 8 * A duração normal do tratamento é de 7 a 10 dias; porém, infecções mais graves podem necessitar de tratamento mais prolongado. Para o tratamento empírico de neutropenia febril, a duração prevista da terapia é de 7 dias ou até a resolução da neutropenia Profilaxia Cirúrgica (Adultos) A dose recomendada para a profilaxia de pacientes submetidos a cirurgia intra-abdominal segue abaixo: - Uma dose única de 2 g IV de MAXCEF (infusão com duração de 30 min, ver MODO DE USAR E CUIDADOS DE CONSERVAÇÃO APÓS ABERTO/Preparação das soluções e Administração) iniciando 60 min antes da incisão cirúrgica inicial. Uma dose única de 500 mg IV de metronidazol deve ser administrada imediatamente após o término da infusão de MAXCEF. O metronidazol deve ser preparado e administrado de acordo com a bula oficial do produto. Devido à incompatibilidade, MAXCEF e metronidazol não devem ser misturados no mesmo recipiente (ver MODO DE USAR E CUIDADOS DE CONSERVAÇÃO DEPOIS DE ABERTO-Compatibilidade e Estabilidade); recomenda-se enxaguar o equipo de administração intravenosa com um líquido compatível antes da infusão do metronidazol. - Caso o procedimento cirúrgico se prolongue por mais de 12 a partir da dose profilática inicial, uma segunda dose de MAXCEF seguida por metronidazol deve ser administrada 12 após a dose profilática inicial. Pacientes pediátricos com função renal normal (1 mês de idade ou mais) Doses comumente recomendadas: Pneumonia, infecções do trato urinário, infecções da pele e estruturas cutâneas Pacientes pediátricos com mais de 2 meses de idade e peso corpóreo 40kg: 50 mg/kg a cada 12 durante 10 dias. Para infecções mais graves pode ser usado um intervalo de 8 entre as doses. Septicemia, meningite bacteriana e tratamento empírico da neutropenia febril Pacientes pediátricos com mais de 2 meses de idade e peso corpóreo 40kg: 50 mg/kg a cada 8 durante 7 10 dias. A experiência com o uso de MAXCEF em pacientes pediátricos com menos de 2 meses de idade é limitada. Embora esta experiência tenha sido alcançada usando-se a dose de 50 mg/kg, os dados farmacocinéticos obtidos em pacientes com mais de 2 meses de idade sugerem que a dose de 30 mg/kg a cada 8 ou 12 pode ser considerada para pacientes entre 1 e 2 meses de idade. As doses de 50 mg/kg para pacientes com mais de 2 meses de idade e de 30 mg/kg para pacientes entre 1 e 2 meses de idades são comparáveis à dose de 2 g para adultos. A administração de MAXCEF nestes pacientes deverá ser cuidadosamente monitorada. Para pacientes pediátricos com peso corpóreo acima de 40 kg, aplicam-se as doses recomendadas para adultos (vide Tabela 8). A dose recomendada para pacientes pediátricos não
MAXCEF 1 g ou 2 g pó para solução injetável é apresentado em embalagens com 1 frasco-ampola.
 USO INTRAMUSCULAR OU INTRAVENOSO APRESENTAÇÃO MAXCEF 1 g ou 2 g pó para solução injetável é apresentado em embalagens com 1 frasco-ampola. USO ADULTO E PEDIÁTRICO COMPOSIÇÃO Cada frasco-ampola contém cloridrato
USO INTRAMUSCULAR OU INTRAVENOSO APRESENTAÇÃO MAXCEF 1 g ou 2 g pó para solução injetável é apresentado em embalagens com 1 frasco-ampola. USO ADULTO E PEDIÁTRICO COMPOSIÇÃO Cada frasco-ampola contém cloridrato
MAXCEF promove a melhora do paciente com o alívio dos sinais e sintomas da infecção.
 APRESENTAÇÕES MAXCEF (cloridrato de cefepima) é apresentado na forma farmacêutica de pó para solução injetável nas concentrações de 1 g ou 2 g em embalagens com 1 frasco-ampola. USO INTRAMUSCULAR OU INTRAVENOSO
APRESENTAÇÕES MAXCEF (cloridrato de cefepima) é apresentado na forma farmacêutica de pó para solução injetável nas concentrações de 1 g ou 2 g em embalagens com 1 frasco-ampola. USO INTRAMUSCULAR OU INTRAVENOSO
meropeném Novafarma Indústria Farmacêutica Ltda. Pó para solução injetável 500mg 1g Página 1 de 8
 meropeném Novafarma Indústria Farmacêutica Ltda. Pó para solução injetável 500mg 1g Página 1 de 8 meropeném Medicamento Genérico, Lei nº 9.787, de 1999. IDENTIFICAÇÃO DO MEDICAMENTO Nome genérico: meropeném
meropeném Novafarma Indústria Farmacêutica Ltda. Pó para solução injetável 500mg 1g Página 1 de 8 meropeném Medicamento Genérico, Lei nº 9.787, de 1999. IDENTIFICAÇÃO DO MEDICAMENTO Nome genérico: meropeném
Bristol-Myers Squibb Farmacêutica S.A. USO ORAL APRESENTAÇÃO. Cápsulas e pó para suspensão oral.
 USO ORAL APRESENTAÇÃO Cápsulas e pó para suspensão oral. CEFAMOX 500 mg cápsulas é apresentado em embalagens com 1 blíster contendo 8 cápsulas. CEFAMOX 250 mg/5 ml pó para suspensão oral é apresentado
USO ORAL APRESENTAÇÃO Cápsulas e pó para suspensão oral. CEFAMOX 500 mg cápsulas é apresentado em embalagens com 1 blíster contendo 8 cápsulas. CEFAMOX 250 mg/5 ml pó para suspensão oral é apresentado
TOPLANINA teicoplanina 400 mg Liófilo injetável
 TOPLANINA teicoplanina 400 mg Liófilo injetável FORMA FARMACÊUTICA E APRESENTAÇÃO Toplanina é um pó liófilo injetável de coloração branca a quase branca, para uso após reconstituição. Apresenta-se em frasco-ampola
TOPLANINA teicoplanina 400 mg Liófilo injetável FORMA FARMACÊUTICA E APRESENTAÇÃO Toplanina é um pó liófilo injetável de coloração branca a quase branca, para uso após reconstituição. Apresenta-se em frasco-ampola
MODELO DE BULA PACIENTE RDC 47/09. APRESENTAÇÕES Pó injetável. Embalagem contendo 100 frascos-ampola de 1000 mg de cefalotina base.
 MODELO DE BULA PACIENTE RDC 47/09 CEFARISTON cefalotina sódica APRESENTAÇÕES Pó injetável. Embalagem contendo 100 frascos-ampola de 1000 mg de cefalotina base. VIA DE ADMINISTRAÇÃO: INTRAVENOSA E INTRAMUSCULAR
MODELO DE BULA PACIENTE RDC 47/09 CEFARISTON cefalotina sódica APRESENTAÇÕES Pó injetável. Embalagem contendo 100 frascos-ampola de 1000 mg de cefalotina base. VIA DE ADMINISTRAÇÃO: INTRAVENOSA E INTRAMUSCULAR
Bactomax. teicoplanina. Pó liófilo injetável 200mg e 400mg. Cristália Prod. Quím. Farm. Ltda. MODELO DE BULA PARA O PACIENTE
 Bactomax teicoplanina Pó liófilo injetável 200mg e 400mg Cristália Prod. Quím. Farm. Ltda. MODELO DE BULA PARA O PACIENTE 1 IDENTIFICAÇÃO DO MEDICAMENTO Bactomax 200mg e 400mg teicoplanina APRESENTAÇÃO
Bactomax teicoplanina Pó liófilo injetável 200mg e 400mg Cristália Prod. Quím. Farm. Ltda. MODELO DE BULA PARA O PACIENTE 1 IDENTIFICAÇÃO DO MEDICAMENTO Bactomax 200mg e 400mg teicoplanina APRESENTAÇÃO
teicoplanina Medicamento genérico Lei nº 9.787, de 1999
 teicoplanina Medicamento genérico Lei nº 9.787, de 1999 IDENTIFICAÇÃO DO MEDICAMENTO Nome Genérico: teicoplanina APRESENTAÇÕES teicoplanina 200 mg: cada frasco-ampola contém 200 mg de teicoplanina na forma
teicoplanina Medicamento genérico Lei nº 9.787, de 1999 IDENTIFICAÇÃO DO MEDICAMENTO Nome Genérico: teicoplanina APRESENTAÇÕES teicoplanina 200 mg: cada frasco-ampola contém 200 mg de teicoplanina na forma
TYGACIL (tigeciclina)
 TYGACIL (tigeciclina) I- IDENTIFICAÇÃO DO MEDICAMENTO Nome comercial: Tygacil Nome genérico: tigeciclina APRESENTAÇÃO Tygacil 50 mg pó liofilizado estéril para infusão em embalagem contendo 10 frascos-ampolas.
TYGACIL (tigeciclina) I- IDENTIFICAÇÃO DO MEDICAMENTO Nome comercial: Tygacil Nome genérico: tigeciclina APRESENTAÇÃO Tygacil 50 mg pó liofilizado estéril para infusão em embalagem contendo 10 frascos-ampolas.
MODELO DE BULA. cefoxitina sódica Medicamento genérico Lei nº 9.787, de 1999
 MODELO DE BULA cefoxitina sódica Medicamento genérico Lei nº 9.787, de 1999 USO ADULTO E PEDIÁTRICO FORMA FARMACÊUTICA E APRESENTAÇÕES: Pó Injetável Embalagens contendo 1, 20, 50 ou 100 frascos-ampola.
MODELO DE BULA cefoxitina sódica Medicamento genérico Lei nº 9.787, de 1999 USO ADULTO E PEDIÁTRICO FORMA FARMACÊUTICA E APRESENTAÇÕES: Pó Injetável Embalagens contendo 1, 20, 50 ou 100 frascos-ampola.
BULA DO PRODUTO CEFZIL (cefprozila monoidratada) 250mg OU 500mg COMPRIMIDOS E 125mg/5mL OU 250mg/5mL PÓ PARA SUSPENSÃO ORAL
 BULA DO PRODUTO CEFZIL (cefprozila monoidratada) 250mg OU 500mg COMPRIMIDOS E 125mg/5mL OU 250mg/5mL PÓ PARA SUSPENSÃO ORAL BRISTOL-MYERS SQUIBB CEFZIL cefprozila monoidratada comprimidos e pó para suspensão
BULA DO PRODUTO CEFZIL (cefprozila monoidratada) 250mg OU 500mg COMPRIMIDOS E 125mg/5mL OU 250mg/5mL PÓ PARA SUSPENSÃO ORAL BRISTOL-MYERS SQUIBB CEFZIL cefprozila monoidratada comprimidos e pó para suspensão
MODELO DE BULA PACIENTE RDC 47/09
 MODELO DE BULA PACIENTE RDC 47/09 TEICOSTON teicoplanina APRESENTAÇÕES Pó liófilo injetável. Embalagem contendo 1 frasco-ampola de 200 mg ou 400 mg + 1 ampola de diluente de 3 ml. VIA DE ADMINISTRAÇÃO:
MODELO DE BULA PACIENTE RDC 47/09 TEICOSTON teicoplanina APRESENTAÇÕES Pó liófilo injetável. Embalagem contendo 1 frasco-ampola de 200 mg ou 400 mg + 1 ampola de diluente de 3 ml. VIA DE ADMINISTRAÇÃO:
Cilinon ampicilina sódica
 Cilinon ampicilina sódica USO ADULTO E PEDIÁTRICO Apresentação Pó injetável Embalagem contendo 1 frasco-ampola + ampola de diluente. Embalagem contendo 100 frascos-ampolas com ou sem ampolas de diluente.
Cilinon ampicilina sódica USO ADULTO E PEDIÁTRICO Apresentação Pó injetável Embalagem contendo 1 frasco-ampola + ampola de diluente. Embalagem contendo 100 frascos-ampolas com ou sem ampolas de diluente.
BULA DO PACIENTE CEFALOTINA SÓDICA HALEX ISTAR
 BULA DO PACIENTE CEFALOTINA SÓDICA HALEX ISTAR PÓ PARA SOLUÇÃO INJETAVEL 1 G cefalotina sódica Medicamento genérico - Lei nº 9.787 de 1.999 IDENTIFICAÇÃO DO MEDICAMENTO Nome genérico: cefalotina sódica
BULA DO PACIENTE CEFALOTINA SÓDICA HALEX ISTAR PÓ PARA SOLUÇÃO INJETAVEL 1 G cefalotina sódica Medicamento genérico - Lei nº 9.787 de 1.999 IDENTIFICAÇÃO DO MEDICAMENTO Nome genérico: cefalotina sódica
sulfato de amicacina Medicamento genérico Lei nº 9.787, de 1999.
 MODELO DE BULA COM INFORMAÇÕES AO PACIENTE sulfato de amicacina Medicamento genérico Lei nº 9.787, de 1999. APRESENTAÇÕES Solução injetável 50mg/mL Embalagens contendo 1 e 50 ampolas com 2mL. Solução injetável
MODELO DE BULA COM INFORMAÇÕES AO PACIENTE sulfato de amicacina Medicamento genérico Lei nº 9.787, de 1999. APRESENTAÇÕES Solução injetável 50mg/mL Embalagens contendo 1 e 50 ampolas com 2mL. Solução injetável
meropeném Novafarma Indústria Farmacêutica Ltda. Pó para solução injetável 500mg 1g Página 1 de 9
 meropeném Novafarma Indústria Farmacêutica Ltda. Pó para solução injetável 500mg 1g Página 1 de 9 meropeném Medicamento Genérico, Lei nº 9.787, de 1999. IDENTIFICAÇÃO DO MEDICAMENTO Nome genérico: meropeném
meropeném Novafarma Indústria Farmacêutica Ltda. Pó para solução injetável 500mg 1g Página 1 de 9 meropeném Medicamento Genérico, Lei nº 9.787, de 1999. IDENTIFICAÇÃO DO MEDICAMENTO Nome genérico: meropeném
LEIA ATENTAMENTE ESTA BULA ANTES DE INICIAR O TRATAMENTO. I - IDENTIFICAÇÃO DO MEDICAMENTO Keroxime cefuroxima sódica
 2 LEIA ATENTAMENTE ESTA BULA ANTES DE INICIAR O TRATAMENTO I - IDENTIFICAÇÃO DO MEDICAMENTO Keroxime cefuroxima sódica APRESENTAÇÃO Keroxime (cefuroxima) 750 mg: frasco-ampola contendo 750 mg de cefuroxima
2 LEIA ATENTAMENTE ESTA BULA ANTES DE INICIAR O TRATAMENTO I - IDENTIFICAÇÃO DO MEDICAMENTO Keroxime cefuroxima sódica APRESENTAÇÃO Keroxime (cefuroxima) 750 mg: frasco-ampola contendo 750 mg de cefuroxima
Cefaclor bd. Referência. Ceclor BD (EMS. Apresentação de Cefaclor bd
 Cefaclor bd Referência Ceclor BD (EMS Apresentação de Cefaclor bd Comprimidos revestidos de liberação prolongada 500 mg: caixa com 10 comprimidos revestidos. Comprimidos revestidos de liberação prolongada
Cefaclor bd Referência Ceclor BD (EMS Apresentação de Cefaclor bd Comprimidos revestidos de liberação prolongada 500 mg: caixa com 10 comprimidos revestidos. Comprimidos revestidos de liberação prolongada
Zinnat. cefuroxima LEIA ATENTAMENTE ESTA BULA ANTES DE INICIAR O TRATAMENTO
 Zinnat cefuroxima LEIA ATENTAMENTE ESTA BULA ANTES DE INICIAR O TRATAMENTO I) Identificação do medicamento Formas farmacêuticas, vias de administração e apresentações comercializadas Zinnat é apresentado
Zinnat cefuroxima LEIA ATENTAMENTE ESTA BULA ANTES DE INICIAR O TRATAMENTO I) Identificação do medicamento Formas farmacêuticas, vias de administração e apresentações comercializadas Zinnat é apresentado
cefalexina Pó para suspensão oral 250mg/5mL
 cefalexina Pó para suspensão oral 250mg/5mL MODELO DE BULA COM INFORMAÇÕES TÉCNICAS AOS PROFISSIONAIS DE SAÚDE cefalexina Medicamento genérico Lei nº 9.787, de 1999. APRESENTAÇÕES Pó para suspensão oral
cefalexina Pó para suspensão oral 250mg/5mL MODELO DE BULA COM INFORMAÇÕES TÉCNICAS AOS PROFISSIONAIS DE SAÚDE cefalexina Medicamento genérico Lei nº 9.787, de 1999. APRESENTAÇÕES Pó para suspensão oral
BULA DE NALDECON DOR COMPRIMIDOS
 BULA DE NALDECON DOR COMPRIMIDOS BRISTOL-MYERS SQUIBB NALDECON DOR paracetamol Dores em geral Febre Uma dose = 2 comprimidos FORMA FARMACÊUTICA E APRESENTAÇÃO NALDECON DOR é apresentado em displays com
BULA DE NALDECON DOR COMPRIMIDOS BRISTOL-MYERS SQUIBB NALDECON DOR paracetamol Dores em geral Febre Uma dose = 2 comprimidos FORMA FARMACÊUTICA E APRESENTAÇÃO NALDECON DOR é apresentado em displays com
BULA PACIENTE CEFAZOLINA SÓDICA HALEX ISTAR
 BULA PACIENTE CEFAZOLINA SÓDICA HALEX ISTAR PÓ PARA SOLUÇÃO INJETAVEL 1 G cefazolina sódica Medicamento genérico - Lei nº 9.787 de 1.999 IDENTIFICAÇÃO DO MEDICAMENTO Nome genérico: Cefazolina sódica FORMA
BULA PACIENTE CEFAZOLINA SÓDICA HALEX ISTAR PÓ PARA SOLUÇÃO INJETAVEL 1 G cefazolina sódica Medicamento genérico - Lei nº 9.787 de 1.999 IDENTIFICAÇÃO DO MEDICAMENTO Nome genérico: Cefazolina sódica FORMA
UROVIT (cloridrato de fenazopiridina)
 UROVIT (cloridrato de fenazopiridina) União Química Farmacêutica Nacional S.A 100 mg e 200 mg UROVIT cloridrato de fenazopiridina IDENTIFICAÇÃO DO PRODUTO FORMA FARMACÊUTICA E APRESENTAÇÕES 100 mg: embalagem
UROVIT (cloridrato de fenazopiridina) União Química Farmacêutica Nacional S.A 100 mg e 200 mg UROVIT cloridrato de fenazopiridina IDENTIFICAÇÃO DO PRODUTO FORMA FARMACÊUTICA E APRESENTAÇÕES 100 mg: embalagem
sulfato de amicacina Medicamento genérico Lei nº 9.787, de 1999.
 MODELO DE BULA COM INFORMAÇÕES TÉCNICAS AOS PROFISSIONAIS DE SAÚDE sulfato de amicacina Medicamento genérico Lei nº 9.787, de 1999. APRESENTAÇÕES Solução injetável 50mg/mL Embalagens contendo 1 e 50 ampolas
MODELO DE BULA COM INFORMAÇÕES TÉCNICAS AOS PROFISSIONAIS DE SAÚDE sulfato de amicacina Medicamento genérico Lei nº 9.787, de 1999. APRESENTAÇÕES Solução injetável 50mg/mL Embalagens contendo 1 e 50 ampolas
MERONEM I.V. meropeném. MERONEM I.V.: pó para solução injetável contendo 500 mg ou 1 g de meropeném em embalagens com 10 frascos-ampolas.
 MERONEM I.V. meropeném I) IDENTIFICAÇÃO DO MEDICAMENTO MERONEM I.V. meropeném APRESENTAÇÕES MERONEM I.V.: pó para solução injetável contendo 500 mg ou 1 g de meropeném em embalagens com 10 frascos-ampolas.
MERONEM I.V. meropeném I) IDENTIFICAÇÃO DO MEDICAMENTO MERONEM I.V. meropeném APRESENTAÇÕES MERONEM I.V.: pó para solução injetável contendo 500 mg ou 1 g de meropeném em embalagens com 10 frascos-ampolas.
MODELO DE BULA PACIENTE RDC 47/09
 MODELO DE BULA PACIENTE RDC 47/09 Clafordil cefotaxima sódica APRESENTAÇÕES Pó injetável. Embalagens contendo 20 frascos-ampola de 1.000 mg acompanhados com 20 ampolas de diluente de 5 ml. Embalagens contendo
MODELO DE BULA PACIENTE RDC 47/09 Clafordil cefotaxima sódica APRESENTAÇÕES Pó injetável. Embalagens contendo 20 frascos-ampola de 1.000 mg acompanhados com 20 ampolas de diluente de 5 ml. Embalagens contendo
Cefradur CEFRADINA 1. O QUE É CEFRADUR E PARA QUE É UTILIZADO
 Cefradur CEFRADINA Leia atentamente este folheto antes de tomar o medicamento Conserve este folheto. Pode ter necessidade de o reler. Caso tenha dúvidas, consulte o seu médico ou farmacêutico. Este medicamento
Cefradur CEFRADINA Leia atentamente este folheto antes de tomar o medicamento Conserve este folheto. Pode ter necessidade de o reler. Caso tenha dúvidas, consulte o seu médico ou farmacêutico. Este medicamento
UNASYN Injetável sulbactam sódica/ampicilina sódica Intramuscular/intravenoso
 UNASYN Injetável sulbactam sódica/ampicilina sódica Intramuscular/intravenoso PARTE I IDENTIFICAÇÃO DO MEDICAMENTO Nome comercial: Unasyn injetável Nome genérico: sulbactam sódica/ampicilina sódica Forma
UNASYN Injetável sulbactam sódica/ampicilina sódica Intramuscular/intravenoso PARTE I IDENTIFICAÇÃO DO MEDICAMENTO Nome comercial: Unasyn injetável Nome genérico: sulbactam sódica/ampicilina sódica Forma
Cetazima cefotaxima sódica
 Cetazima cefotaxima sódica IDENTIFICAÇÃO DO MEDICAMENTO Nome comercial: Cetazima Nome genérico: cefotaxima sódica FORMA FARMACÊUTICA E APRESENTAÇÕES Pó para solução injetável Cetazima 500mg: caixa com
Cetazima cefotaxima sódica IDENTIFICAÇÃO DO MEDICAMENTO Nome comercial: Cetazima Nome genérico: cefotaxima sódica FORMA FARMACÊUTICA E APRESENTAÇÕES Pó para solução injetável Cetazima 500mg: caixa com
ANADOR PRT paracetamol 750 mg. Forma farmacêutica e apresentação Comprimidos 750 mg: embalagem com 20 e 256 comprimidos.
 ANADOR PRT paracetamol 750 mg Antitérmico e analgésico Forma farmacêutica e apresentação Comprimidos 750 mg: embalagem com 20 e 256 comprimidos. Outra forma farmacêutica e apresentação Solução oral: frasco
ANADOR PRT paracetamol 750 mg Antitérmico e analgésico Forma farmacêutica e apresentação Comprimidos 750 mg: embalagem com 20 e 256 comprimidos. Outra forma farmacêutica e apresentação Solução oral: frasco
MODELO DE BULA PARA O PACIENTE. Cada ml contém: levosimendana... 2,5 mg Excipientes: polividona, ácido cítrico e etanol.
 MODELO DE BULA PARA O PACIENTE IDENTIFICAÇÃO DO MEDICAMENTO: SIMDAX levosimendana Formas Farmacêuticas, vias de administração e apresentações: SIMDAX (levosimendana) 2,5 mg/ml: embalagens com 1 frasco-ampola
MODELO DE BULA PARA O PACIENTE IDENTIFICAÇÃO DO MEDICAMENTO: SIMDAX levosimendana Formas Farmacêuticas, vias de administração e apresentações: SIMDAX (levosimendana) 2,5 mg/ml: embalagens com 1 frasco-ampola
BULA PACIENTE AMINOLEX HALEX ISTAR
 BULA PACIENTE AMINOLEX HALEX ISTAR SOLUÇÃO INJETÁVEL 24 mg/ml Aminolex IDENTIFICAÇÃO DO MEDICAMENTO Aminolex FORMA FARMACÊUTICA E APRESENTAÇÕES Solução injetável 24mg/ml. Ampola de vidro de 10 ml Solução
BULA PACIENTE AMINOLEX HALEX ISTAR SOLUÇÃO INJETÁVEL 24 mg/ml Aminolex IDENTIFICAÇÃO DO MEDICAMENTO Aminolex FORMA FARMACÊUTICA E APRESENTAÇÕES Solução injetável 24mg/ml. Ampola de vidro de 10 ml Solução
DROGA DIALISÁVEL OBSERVAÇÕES 1. ANTIBIÓTICOS AMICACINA AMOXICILINA AMPICILINA AMPICILINA+ SULBACTAM AZTREONAM
 ROGA IALISÁVEL OBSERVAÇÕES 1. ANTIBIÓTICOS Administrar a dose pós-diálise ou administrar 2 / 3 da dose normal como dose suplementar pós-diálise; acompanhar os níveis. AMICACINA P: dosar assim como o Cl
ROGA IALISÁVEL OBSERVAÇÕES 1. ANTIBIÓTICOS Administrar a dose pós-diálise ou administrar 2 / 3 da dose normal como dose suplementar pós-diálise; acompanhar os níveis. AMICACINA P: dosar assim como o Cl
ampicilina sódica e sulbactam sódico Medicamento genérico Lei nº 9.787, de 1999
 ampicilina sódica e sulbactam sódico Medicamento genérico Lei nº 9.787, de 1999 Pó para solução injetável 1,5 g e 3 g 1 2 ampicilina sódica e sulbactam sódico Medicamento genérico Lei nº 9.787, de 1999
ampicilina sódica e sulbactam sódico Medicamento genérico Lei nº 9.787, de 1999 Pó para solução injetável 1,5 g e 3 g 1 2 ampicilina sódica e sulbactam sódico Medicamento genérico Lei nº 9.787, de 1999
TRIFAMOX IBL 250 - Embalagem contendo frasco com 30 g de pó para reconstituir 60 ml de suspensão.
 TRIFAMOX IBL amoxicilina sulbactam Formas farmacêuticas e apresentações Pó para suspensão oral extemporânea TRIFAMOX IBL 250 - Embalagem contendo frasco com 30 g de pó para reconstituir 60 ml de suspensão.
TRIFAMOX IBL amoxicilina sulbactam Formas farmacêuticas e apresentações Pó para suspensão oral extemporânea TRIFAMOX IBL 250 - Embalagem contendo frasco com 30 g de pó para reconstituir 60 ml de suspensão.
Amplacilina. Bula para paciente. Cápsula 500 MG
 Amplacilina Bula para paciente Cápsula 500 MG AMPLACILINA ampicilina Cápsula FORMAS FARMACÊUTICAS E APRESENTAÇÕES: Embalagens contendo 12 cápsulas de 500 mg USO ADULTO USO ORAL Composição: Cada cápsula
Amplacilina Bula para paciente Cápsula 500 MG AMPLACILINA ampicilina Cápsula FORMAS FARMACÊUTICAS E APRESENTAÇÕES: Embalagens contendo 12 cápsulas de 500 mg USO ADULTO USO ORAL Composição: Cada cápsula
MODELO DE BULA DO PACIENTE RDC 47/09
 MODELO DE BULA DO PACIENTE RDC 47/09 Oxanon oxacilina sódica APRESENTAÇÕES Pó injetável contendo 500 mg de oxacilina sódica. Embalagens contendo 50 frascos-ampola + 50 ampolas de diluente, 50 frascos-ampola
MODELO DE BULA DO PACIENTE RDC 47/09 Oxanon oxacilina sódica APRESENTAÇÕES Pó injetável contendo 500 mg de oxacilina sódica. Embalagens contendo 50 frascos-ampola + 50 ampolas de diluente, 50 frascos-ampola
Abbott Laboratórios do Brasil Ltda Rua Michigan 735, Brooklin São Paulo - SP CEP: 04566-905
 MODELO DE BULA PARA O PACIENTE SYNAGIS palivizumabe I - IDENTIFICAÇÃO DO MEDICAMENTO APRESENTAÇÕES Pó liófilo injetável de: - 100 mg em embalagem com 01 frasco-ampola para dose única contendo palivizumabe
MODELO DE BULA PARA O PACIENTE SYNAGIS palivizumabe I - IDENTIFICAÇÃO DO MEDICAMENTO APRESENTAÇÕES Pó liófilo injetável de: - 100 mg em embalagem com 01 frasco-ampola para dose única contendo palivizumabe
Vigamox moxifloxacino 0,5% cloridrato
 Vigamox moxifloxacino 0,5% cloridrato Solução Oftálmica Estéril FORMA FARMACÊUTICA, VIA DE ADMINISTRAÇÃO E APRESENTAÇÃO: Frasco plástico conta-gotas contendo 5 ml de Solução Oftálmica Estéril. USO ADULTO
Vigamox moxifloxacino 0,5% cloridrato Solução Oftálmica Estéril FORMA FARMACÊUTICA, VIA DE ADMINISTRAÇÃO E APRESENTAÇÃO: Frasco plástico conta-gotas contendo 5 ml de Solução Oftálmica Estéril. USO ADULTO
Triaxon ceftriaxona dissódica
 MODELO DE BULA COM INFORMAÇÕES AO PACIENTE Triaxon ceftriaxona dissódica CEFALOSPORINA PARENTERAL DE AMPLO ESPECTRO E AÇÃO PROLONGADA APRESENTAÇÕES Pó para solução injetável IV 500mg: Embalagens contendo
MODELO DE BULA COM INFORMAÇÕES AO PACIENTE Triaxon ceftriaxona dissódica CEFALOSPORINA PARENTERAL DE AMPLO ESPECTRO E AÇÃO PROLONGADA APRESENTAÇÕES Pó para solução injetável IV 500mg: Embalagens contendo
Formas farmacêuticas e apresentações - BACTRIM. Propriedades e efeitos - BACTRIM. Bactrim. Sulfametoxazol + trimetoprima
 Bactrim Sulfametoxazol + trimetoprima Quimioterápico bactericida com duplo mecanismo de ação Uso adulto e pediátrico Formas farmacêuticas e apresentações - BACTRIM Bactrim Comprimido:Sulfametoxazol 400
Bactrim Sulfametoxazol + trimetoprima Quimioterápico bactericida com duplo mecanismo de ação Uso adulto e pediátrico Formas farmacêuticas e apresentações - BACTRIM Bactrim Comprimido:Sulfametoxazol 400
BRONCHO VAXOM. Takeda Pharma Ltda. Cápsula. 3,5 e 7,0 mg
 BRONCHO VAXOM Takeda Pharma Ltda. Cápsula 3,5 e 7,0 mg APRESENTAÇÕES Pediátrico: Cápsulas de 3,5 mg. Embalagem com 10 unidades. Adulto: Cápsulas de 7 mg. Embalagens com 10 e 30 unidades. USO ORAL USO ADULTO
BRONCHO VAXOM Takeda Pharma Ltda. Cápsula 3,5 e 7,0 mg APRESENTAÇÕES Pediátrico: Cápsulas de 3,5 mg. Embalagem com 10 unidades. Adulto: Cápsulas de 7 mg. Embalagens com 10 e 30 unidades. USO ORAL USO ADULTO
BRONCHO VAXOM. Takeda Pharma Ltda. Granulado. 3,5 mg/sachê
 BRONCHO VAXOM Takeda Pharma Ltda. Granulado 3,5 mg/sachê APRESENTAÇÕES Granulado de 3,5 mg/ sachê. Embalagem com 30 sachês. USO ORAL USO PEDIÁTRICO. COMPOSIÇÃO Cada sachê contém 3,5 mg de lisado bacteriano
BRONCHO VAXOM Takeda Pharma Ltda. Granulado 3,5 mg/sachê APRESENTAÇÕES Granulado de 3,5 mg/ sachê. Embalagem com 30 sachês. USO ORAL USO PEDIÁTRICO. COMPOSIÇÃO Cada sachê contém 3,5 mg de lisado bacteriano
TERAPÊUTICA ANTIBIÓTICA EMPÍRICA DA FEBRE NEUTROPÉNICA
 TERAPÊUTICA ANTIBIÓTICA EMPÍRICA DA FEBRE NEUTROPÉNICA DEFINIÇÕES Febre neutropénica: T. auricular > 38ºC mantida durante 1 h, em doente com contagem absoluta de neutrófilos (CAN) < 500/mm 3, ou < 1000/mm
TERAPÊUTICA ANTIBIÓTICA EMPÍRICA DA FEBRE NEUTROPÉNICA DEFINIÇÕES Febre neutropénica: T. auricular > 38ºC mantida durante 1 h, em doente com contagem absoluta de neutrófilos (CAN) < 500/mm 3, ou < 1000/mm
IDENTIFICAÇÃO DO MEDICAMENTO Alburex 20 albumina humana
 IDENTIFICAÇÃO DO MEDICAMENTO Alburex 20 albumina humana APRESENTAÇÃO Alburex 20: embalagem contendo 1 frasco-ampola com 50 ml de solução hiperoncótica de albumina humana para infusão (20%). VIA INTRAVENOSA
IDENTIFICAÇÃO DO MEDICAMENTO Alburex 20 albumina humana APRESENTAÇÃO Alburex 20: embalagem contendo 1 frasco-ampola com 50 ml de solução hiperoncótica de albumina humana para infusão (20%). VIA INTRAVENOSA
PNEUMONIAS COMUNITÁRIAS
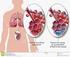 PNEUMONIAS COMUNITÁRIAS A maior parte dos casos são as chamadas comunitárias ou não nosocomiais Típica Não relacionada à faixa etária. Causada por S. pneumoniae, H. influenzae e S. aureus. Sintomatologia
PNEUMONIAS COMUNITÁRIAS A maior parte dos casos são as chamadas comunitárias ou não nosocomiais Típica Não relacionada à faixa etária. Causada por S. pneumoniae, H. influenzae e S. aureus. Sintomatologia
Buscopan butilbrometo de escopolamina. Cada ampola de 1 ml contém 20 mg de butilbrometo de escopolamina, correspondentes a 13,78 mg de escopolamina.
 IDENTIFICAÇÃO DO MEDICAMENTO Abcd Buscopan butilbrometo de escopolamina FORMA FARMACÊUTICA E APRESENTAÇÃO Solução injetável: embalagem com 5 ampolas. Uso injetável. USO ADULTO E PEDIÁTRICO Cada ampola
IDENTIFICAÇÃO DO MEDICAMENTO Abcd Buscopan butilbrometo de escopolamina FORMA FARMACÊUTICA E APRESENTAÇÃO Solução injetável: embalagem com 5 ampolas. Uso injetável. USO ADULTO E PEDIÁTRICO Cada ampola
Kavit fitomenadiona. Solução Injetável 10 mg/ml. Cristália Produtos Químicos Farmacêuticos Ltda. MODELO DE BULA PARA O PACIENTE
 Kavit fitomenadiona Solução Injetável 10 mg/ml Cristália Produtos Químicos Farmacêuticos Ltda. MODELO DE BULA PARA O PACIENTE IDENTIFICAÇÃO DO MEDICAMENTO KAVIT fitomenadiona APRESENTAÇÃO Caixa contendo
Kavit fitomenadiona Solução Injetável 10 mg/ml Cristália Produtos Químicos Farmacêuticos Ltda. MODELO DE BULA PARA O PACIENTE IDENTIFICAÇÃO DO MEDICAMENTO KAVIT fitomenadiona APRESENTAÇÃO Caixa contendo
Drenol hidroclorotiazida. Drenol 50 mg em embalagem contendo 30 comprimidos. Cada comprimido de Drenol contém 50 mg de hidroclorotiazida.
 Drenol hidroclorotiazida PARTE I IDENTIFICAÇÃO DO PRODUTO Nome: Drenol Nome genérico: hidroclorotiazida Forma farmacêutica e apresentações: Drenol 50 mg em embalagem contendo 30 comprimidos. USO ADULTO
Drenol hidroclorotiazida PARTE I IDENTIFICAÇÃO DO PRODUTO Nome: Drenol Nome genérico: hidroclorotiazida Forma farmacêutica e apresentações: Drenol 50 mg em embalagem contendo 30 comprimidos. USO ADULTO
TYNEO. (paracetamol)
 TYNEO (paracetamol) Brainfarma Indústria Química e Farmacêutica S.A. Solução Oral 200mg/mL I - IDENTIFICAÇÃO DO MEDICAMENTO: TYNEO paracetamol APRESENTAÇÃO Solução oral gotas 200mg/mL: Embalagem com 1
TYNEO (paracetamol) Brainfarma Indústria Química e Farmacêutica S.A. Solução Oral 200mg/mL I - IDENTIFICAÇÃO DO MEDICAMENTO: TYNEO paracetamol APRESENTAÇÃO Solução oral gotas 200mg/mL: Embalagem com 1
MEDICAMENTO SIMILAR EQUIVALENTE AO MEDICAMENTO DE REFERÊNCIA
 PAMIGEN cloridrato de gencitabina MEDICAMENTO SIMILAR EQUIVALENTE AO MEDICAMENTO DE REFERÊNCIA APRESENTAÇÃO 200 mg - Embalagem com 1 frasco ampola 1 g - Embalagem com 1 frasco ampola FORMA FARMACÊUTICA
PAMIGEN cloridrato de gencitabina MEDICAMENTO SIMILAR EQUIVALENTE AO MEDICAMENTO DE REFERÊNCIA APRESENTAÇÃO 200 mg - Embalagem com 1 frasco ampola 1 g - Embalagem com 1 frasco ampola FORMA FARMACÊUTICA
Tylemax Gotas. Natulab Laboratório SA. Solução Oral. 200 mg/ml
 Tylemax Gotas Natulab Laboratório SA. Solução Oral 200 mg/ml TYLEMAX paracetamol APRESENTAÇÕES Solução oral em frasco plástico opaco gotejador com 10, 15 e 20ml, contendo 200mg/mL de paracetamol. USO ADULTO
Tylemax Gotas Natulab Laboratório SA. Solução Oral 200 mg/ml TYLEMAX paracetamol APRESENTAÇÕES Solução oral em frasco plástico opaco gotejador com 10, 15 e 20ml, contendo 200mg/mL de paracetamol. USO ADULTO
KEFLIN NEUTRO (cefalotina sódica) Pó para solução injetável 1 g
 KEFLIN NEUTRO (cefalotina sódica) Pó para solução injetável 1 g 1 KEFLIN NEUTRO cefalotina sódica 2 I) IDENTIFICAÇÃO DO MEDICAMENTO Keflin Neutro Nome genérico: cefalotina sódica APRESENTAÇÃO KEFLIN NEUTRO
KEFLIN NEUTRO (cefalotina sódica) Pó para solução injetável 1 g 1 KEFLIN NEUTRO cefalotina sódica 2 I) IDENTIFICAÇÃO DO MEDICAMENTO Keflin Neutro Nome genérico: cefalotina sódica APRESENTAÇÃO KEFLIN NEUTRO
Vancocina CP cloridrato de vancomicina. Pó para solução injetável 500 mg e 1 g
 Vancocina CP cloridrato de vancomicina Pó para solução injetável 500 mg e 1 g 1 VANCOCINA CP cloridrato de vancomicina 2 I) IDENTIFICAÇÃO DO MEDICAMENTO VANCOCINA CP Nome genérico: cloridrato de vancomicina
Vancocina CP cloridrato de vancomicina Pó para solução injetável 500 mg e 1 g 1 VANCOCINA CP cloridrato de vancomicina 2 I) IDENTIFICAÇÃO DO MEDICAMENTO VANCOCINA CP Nome genérico: cloridrato de vancomicina
TIENAM (imipeném/cilastatina sódica), MSD Merck Sharp & Dohme Farmacêutica Ltda. Pó para solução injetável 500 mg/500 mg
 TIENAM (imipeném/cilastatina sódica), MSD Merck Sharp & Dohme Farmacêutica Ltda. Pó para solução injetável 500 mg/500 mg IDENTIFICAÇÃO DO MEDICAMENTO: TIENAM (imipeném/cilastatina sódica), MSD APRESENTAÇÕES
TIENAM (imipeném/cilastatina sódica), MSD Merck Sharp & Dohme Farmacêutica Ltda. Pó para solução injetável 500 mg/500 mg IDENTIFICAÇÃO DO MEDICAMENTO: TIENAM (imipeném/cilastatina sódica), MSD APRESENTAÇÕES
azitromicina di-hidratada Laboratório Globo Ltda. Comprimido Revestido 500 mg
 azitromicina di-hidratada Laboratório Globo Ltda. Comprimido Revestido 500 mg azitromicina di-hidratada Medicamento genérico Lei nº 9.787, de 1999 FORMA FARMACÊUTICA E APRESENTAÇÕES: azitromicina di-hidratada
azitromicina di-hidratada Laboratório Globo Ltda. Comprimido Revestido 500 mg azitromicina di-hidratada Medicamento genérico Lei nº 9.787, de 1999 FORMA FARMACÊUTICA E APRESENTAÇÕES: azitromicina di-hidratada
As ampolas de Nolotil também não deverão ser utilizadas em:
 Folheto informativo: Informação para o utilizador Nolotil 2000 mg/5 ml solução injetável Metamizol magnésico Leia com atenção todo este folheto antes de começar a utilizar este medicamento pois contém
Folheto informativo: Informação para o utilizador Nolotil 2000 mg/5 ml solução injetável Metamizol magnésico Leia com atenção todo este folheto antes de começar a utilizar este medicamento pois contém
Solução Glicofisiológica
 Solução Glicofisiológica Solução injetável cloreto de sódio + glicose 9 mg/ml + 50 mg/ml 1 Forma farmacêutica e apresentações: Solução injetável MODELO DE BULA Solução Glicofisiológica cloreto de sódio
Solução Glicofisiológica Solução injetável cloreto de sódio + glicose 9 mg/ml + 50 mg/ml 1 Forma farmacêutica e apresentações: Solução injetável MODELO DE BULA Solução Glicofisiológica cloreto de sódio
EPITEZAN ALLERGAN PRODUTOS FARMACÊUTICOS LTDA. Pomada Oftálmica Estéril Tubo contendo 3,5 g de pomada oftálmica estéril
 EPITEZAN ALLERGAN PRODUTOS FARMACÊUTICOS LTDA Pomada Oftálmica Estéril Tubo contendo 3,5 g de pomada oftálmica estéril APRESENTAÇÃO Pomada Oftálmica Estéril Tubo contendo 3,5 g de pomada oftálmica estéril
EPITEZAN ALLERGAN PRODUTOS FARMACÊUTICOS LTDA Pomada Oftálmica Estéril Tubo contendo 3,5 g de pomada oftálmica estéril APRESENTAÇÃO Pomada Oftálmica Estéril Tubo contendo 3,5 g de pomada oftálmica estéril
BAYCUTEN N I) IDENTIFICAÇÃO DO MEDICAMENTO. clotrimazol acetato de dexametasona
 I) IDENTIFICAÇÃO DO MEDICAMENTO BAYCUTEN N clotrimazol acetato de dexametasona FORMA FARMACÊUTICA E APRESENTAÇÃO USO ADULTO E PEDIÁTRICO USO TÓPICO Baycuten N é apresentado em bisnagas contendo 20, 30
I) IDENTIFICAÇÃO DO MEDICAMENTO BAYCUTEN N clotrimazol acetato de dexametasona FORMA FARMACÊUTICA E APRESENTAÇÃO USO ADULTO E PEDIÁTRICO USO TÓPICO Baycuten N é apresentado em bisnagas contendo 20, 30
DOBEVEN. dobesilato de cálcio. APRESENTAÇÕES Cápsula gelatinosa dura contendo 500 mg de dobesilato de cálcio: Caixas com 5 e 30 cápsulas.
 DOBEVEN dobesilato de cálcio APRESENTAÇÕES Cápsula gelatinosa dura contendo 500 mg de dobesilato de cálcio: Caixas com 5 e 30 cápsulas. USO ORAL USO ADULTO COMPOSIÇÃO Cada cápsula gelatinosa dura contém:
DOBEVEN dobesilato de cálcio APRESENTAÇÕES Cápsula gelatinosa dura contendo 500 mg de dobesilato de cálcio: Caixas com 5 e 30 cápsulas. USO ORAL USO ADULTO COMPOSIÇÃO Cada cápsula gelatinosa dura contém:
Bula com informações ao Paciente soro antibotrópico (pentavalente) e antilaquético. solução injetável IDENTIFICAÇÃO DO MEDICAMENTO
 soro antibotrópico (pentavalente) e antilaquético solução injetável IDENTIFICAÇÃO DO MEDICAMENTO soro antibotrópico (pentavalente) e antilaquético APRESENTAÇÃO O soro antibotrópico (pentavalente) e antilaquético,
soro antibotrópico (pentavalente) e antilaquético solução injetável IDENTIFICAÇÃO DO MEDICAMENTO soro antibotrópico (pentavalente) e antilaquético APRESENTAÇÃO O soro antibotrópico (pentavalente) e antilaquético,
Cleanbac (Nitrofural) Prati-Donaduzzi Pomada dermatológica 2 mg/g
 Cleanbac (Nitrofural) Prati-Donaduzzi Pomada dermatológica 2 mg/g Cleanbac_bula_paciente INFORMAÇÕES AO PACIENTE Cleanbac nitrofural APRESENTAÇÃO Pomada dermatológica de 2 mg/g em embalagem com 1 bisnaga
Cleanbac (Nitrofural) Prati-Donaduzzi Pomada dermatológica 2 mg/g Cleanbac_bula_paciente INFORMAÇÕES AO PACIENTE Cleanbac nitrofural APRESENTAÇÃO Pomada dermatológica de 2 mg/g em embalagem com 1 bisnaga
Keflaxina Sandoz do Brasil Ind. Farm. Ltda. Pó para Suspensão Oral 50 mg/ml
 Keflaxina Sandoz do Brasil Ind. Farm. Ltda. Pó para Suspensão Oral 50 mg/ml I. IDENTIFICAÇÃO DO MEDICAMENTO Keflaxina cefalexina APRESENTAÇÃO Suspensão oral 250 mg/5ml. Embalagem contendo frasco com pó
Keflaxina Sandoz do Brasil Ind. Farm. Ltda. Pó para Suspensão Oral 50 mg/ml I. IDENTIFICAÇÃO DO MEDICAMENTO Keflaxina cefalexina APRESENTAÇÃO Suspensão oral 250 mg/5ml. Embalagem contendo frasco com pó
TETRALYSAL 150 & 300 LIMECICLINA Cápsulas. FORMA FARMACÊUTICA E APRESENTAÇÕES: cápsulas em embalagens com 16 e 28 unidades.
 MODELO DE BULA TETRALYSAL 150 & 300 LIMECICLINA Cápsulas FORMA FARMACÊUTICA E APRESENTAÇÕES: cápsulas em embalagens com 16 e 28 unidades. USO ADULTO COMPOSIÇÃO Limeciclina (expressa como tetraciclina base)...
MODELO DE BULA TETRALYSAL 150 & 300 LIMECICLINA Cápsulas FORMA FARMACÊUTICA E APRESENTAÇÕES: cápsulas em embalagens com 16 e 28 unidades. USO ADULTO COMPOSIÇÃO Limeciclina (expressa como tetraciclina base)...
nitrofurantoína Cápsula 100mg
 nitrofurantoína Cápsula 100mg MODELO DE BULA COM INFORMAÇÕES TÉCNICAS AOS PROFISSIONAIS DE SAÚDE nitrofurantoína Medicamento genérico Lei nº 9.787, de 1999. APRESENTAÇÕES Cápsula 100mg Embalagens contendo
nitrofurantoína Cápsula 100mg MODELO DE BULA COM INFORMAÇÕES TÉCNICAS AOS PROFISSIONAIS DE SAÚDE nitrofurantoína Medicamento genérico Lei nº 9.787, de 1999. APRESENTAÇÕES Cápsula 100mg Embalagens contendo
ALTERAÇÕES A INCLUIR NAS SECÇÕES RELEVANTES DO RESUMO DAS CARACTERÍSTICAS DOS MEDICAMENTOS QUE CONTENHAM NIMESULIDA (FORMULAÇÕES SISTÉMICAS)
 ANEXO III 58 ALTERAÇÕES A INCLUIR NAS SECÇÕES RELEVANTES DO RESUMO DAS CARACTERÍSTICAS DOS MEDICAMENTOS QUE CONTENHAM NIMESULIDA (FORMULAÇÕES SISTÉMICAS) Adições aparecem em itálico e sublinhado; rasuras
ANEXO III 58 ALTERAÇÕES A INCLUIR NAS SECÇÕES RELEVANTES DO RESUMO DAS CARACTERÍSTICAS DOS MEDICAMENTOS QUE CONTENHAM NIMESULIDA (FORMULAÇÕES SISTÉMICAS) Adições aparecem em itálico e sublinhado; rasuras
Gyno-Icaden nitrato de isoconazol. Informação importante! Leia com atenção!
 Gyno-Icaden nitrato de isoconazol Informação importante! Leia com atenção! Formas farmacêuticas e apresentações: - Creme vaginal: cartucho contendo 1 bisnaga de 40 g com 7 aplicadores. - Creme vaginal:
Gyno-Icaden nitrato de isoconazol Informação importante! Leia com atenção! Formas farmacêuticas e apresentações: - Creme vaginal: cartucho contendo 1 bisnaga de 40 g com 7 aplicadores. - Creme vaginal:
AZITROMICINA Brainfarma Indústria Química e Farmacêutica S.A. Comprimido Revestido 500mg
 AZITROMICINA Brainfarma Indústria Química e Farmacêutica S.A. Comprimido Revestido 500mg I - IDENTIFICAÇÃO DO MEDICAMENTO: AZITROMICINA Medicamento genérico Lei n 9.787, 1999 APRESENTAÇÕES Comprimido revestido
AZITROMICINA Brainfarma Indústria Química e Farmacêutica S.A. Comprimido Revestido 500mg I - IDENTIFICAÇÃO DO MEDICAMENTO: AZITROMICINA Medicamento genérico Lei n 9.787, 1999 APRESENTAÇÕES Comprimido revestido
Pletil tinidazol. Pletil 500 mg em embalagens contendo 4 ou 8 comprimidos revestidos.
 Pletil tinidazol PARTE I IDENTIFICAÇÃO DO PRODUTO Nome: Pletil Nome genérico: tinidazol Forma farmacêutica e apresentações: Pletil 500 mg em embalagens contendo 4 ou 8 comprimidos revestidos. USO ADULTO
Pletil tinidazol PARTE I IDENTIFICAÇÃO DO PRODUTO Nome: Pletil Nome genérico: tinidazol Forma farmacêutica e apresentações: Pletil 500 mg em embalagens contendo 4 ou 8 comprimidos revestidos. USO ADULTO
RESUMO DAS CARACTERÍSTICAS DO MEDICAMENTO
 RESUMO DAS CARACTERÍSTICAS DO MEDICAMENTO Página 1 de 12 1. NOME DO MEDICAMENTO VETERINÁRIO Paracilina SP 800 mg, pó para solução oral. 2. COMPOSIÇÃO QUALITATIVA E QUANTITATIVA Cada grama contém: Substância
RESUMO DAS CARACTERÍSTICAS DO MEDICAMENTO Página 1 de 12 1. NOME DO MEDICAMENTO VETERINÁRIO Paracilina SP 800 mg, pó para solução oral. 2. COMPOSIÇÃO QUALITATIVA E QUANTITATIVA Cada grama contém: Substância
Anexo A DIAFURAN CAZI QUIMICA FARMACÊUTICA IND. E COM. LTDA. Comprimidos. 2 mg
 Anexo A DIAFURAN CAZI QUIMICA FARMACÊUTICA IND. E COM. LTDA Comprimidos 2 mg DIAFURAN cloridrato de loperamida I - IDENTIFICAÇÃO DO MEDICAMENTO Nome comercial: DIAFURAN Nome genérico: cloridrato de loperamida
Anexo A DIAFURAN CAZI QUIMICA FARMACÊUTICA IND. E COM. LTDA Comprimidos 2 mg DIAFURAN cloridrato de loperamida I - IDENTIFICAÇÃO DO MEDICAMENTO Nome comercial: DIAFURAN Nome genérico: cloridrato de loperamida
FORMAS FARMACÊUTICAS E APRESENTAÇÕES: - EBASTEL COMPOSIÇÃO: - EBASTEL INFORMAÇÕES AO PACIENTE: - EBASTEL. Ebastel. ebastina. Oral.
 Ebastel ebastina Oral Xarope USO PEDIÁTRICO (ACIMA DE 2 ANOS) Comprimido USO PEDIÁTRICO (ACIMA DE 12 ANOS) E ADULTO FORMAS FARMACÊUTICAS E APRESENTAÇÕES: - EBASTEL Comprimidos revestidos contendo 10 mg
Ebastel ebastina Oral Xarope USO PEDIÁTRICO (ACIMA DE 2 ANOS) Comprimido USO PEDIÁTRICO (ACIMA DE 12 ANOS) E ADULTO FORMAS FARMACÊUTICAS E APRESENTAÇÕES: - EBASTEL Comprimidos revestidos contendo 10 mg
FORMA FARMACÊUTICA E APRESENTAÇÃO
 Página 1 de 6 Duspatalin cloridrato de mebeverina BULA DO PACIENTE FORMA FARMACÊUTICA E APRESENTAÇÃO DUSPATALIN 200 mg (cloridrato de mebeverina) é apresentado em cartuchos contendo 30 cápsulas de liberação
Página 1 de 6 Duspatalin cloridrato de mebeverina BULA DO PACIENTE FORMA FARMACÊUTICA E APRESENTAÇÃO DUSPATALIN 200 mg (cloridrato de mebeverina) é apresentado em cartuchos contendo 30 cápsulas de liberação
PYR-PAM pamoato de pirvínio DRÁGEA 100 MG SUSPENSÃO ORAL 10 MG/ML
 pamoato de pirvínio DRÁGEA 100 MG SUSPENSÃO ORAL 10 MG/ML Bula Profissional da Saúde Pyr-Pam UCI-FARMA Conforme RDC 47/09 Página 1 pamoato de pirvínio FORMAS FARMACÊUTICAS E APRESENTAÇÕES DRÁGEA 100 MG:
pamoato de pirvínio DRÁGEA 100 MG SUSPENSÃO ORAL 10 MG/ML Bula Profissional da Saúde Pyr-Pam UCI-FARMA Conforme RDC 47/09 Página 1 pamoato de pirvínio FORMAS FARMACÊUTICAS E APRESENTAÇÕES DRÁGEA 100 MG:
cloridrato de betaxolol Medicamento Genérico, Lei nº 9.787, de 1999 Solução Oftálmica Estéril Cristália Prod. Quím. Farm. Ltda.
 cloridrato de betaxolol Medicamento Genérico, Lei nº 9.787, de 1999 Solução Oftálmica Estéril Cristália Prod. Quím. Farm. Ltda. MODELO DE BULA PARA O PACIENTE 1 IDENTIFICAÇÃO DO MEDICAMENTO cloridrato
cloridrato de betaxolol Medicamento Genérico, Lei nº 9.787, de 1999 Solução Oftálmica Estéril Cristália Prod. Quím. Farm. Ltda. MODELO DE BULA PARA O PACIENTE 1 IDENTIFICAÇÃO DO MEDICAMENTO cloridrato
Meningite Bacteriana
 Meningite Bacteriana Conceito Infecção aguda que acomete as leptomeninges (aracnóide e pia-máter), envolvendo o cérebro e a medula espinhal. Page 2 Epidemiologia Doença comum, de alta mortalidade e morbidade
Meningite Bacteriana Conceito Infecção aguda que acomete as leptomeninges (aracnóide e pia-máter), envolvendo o cérebro e a medula espinhal. Page 2 Epidemiologia Doença comum, de alta mortalidade e morbidade
BELPELE. Farmoquímica S/A GEL 3 mg/g. Belpele_AR011113_Bula Paciente
 BELPELE Farmoquímica S/A GEL 3 mg/g BULA PACIENTE BELPELE adapaleno APRESENTAÇÕES: Gel adapaleno 3 mg/g (0,3%) embalagem contendo bisnaga com 30g. VIA TÓPICA USO ADULTO E PEDIÁTRICO ACIMA DE 12 ANOS COMPOSIÇÃO:
BELPELE Farmoquímica S/A GEL 3 mg/g BULA PACIENTE BELPELE adapaleno APRESENTAÇÕES: Gel adapaleno 3 mg/g (0,3%) embalagem contendo bisnaga com 30g. VIA TÓPICA USO ADULTO E PEDIÁTRICO ACIMA DE 12 ANOS COMPOSIÇÃO:
n Calcium Sandoz + Vitamina C laranja carbonato de cálcio lactogliconato de cálcio ácido ascórbico
 Calcium Sandoz + Vitamina C laranja carbonato de cálcio lactogliconato de cálcio ácido ascórbico Forma farmacêutica, via de administração e apresentação: Comprimidos efervescentes. Uso oral. Embalagem
Calcium Sandoz + Vitamina C laranja carbonato de cálcio lactogliconato de cálcio ácido ascórbico Forma farmacêutica, via de administração e apresentação: Comprimidos efervescentes. Uso oral. Embalagem
MODELO DE BULA PROFISSIONAL DE SAÚDE RDC 47/09
 MODELO DE BULA PROFISSIONAL DE SAÚDE RDC 47/09 Clafordil cefotaxima sódica APRESENTAÇÕES Pó injetável. Embalagens contendo 20 frascos-ampola de 1.000 mg acompanhados com 20 ampolas de diluente de 5 ml.
MODELO DE BULA PROFISSIONAL DE SAÚDE RDC 47/09 Clafordil cefotaxima sódica APRESENTAÇÕES Pó injetável. Embalagens contendo 20 frascos-ampola de 1.000 mg acompanhados com 20 ampolas de diluente de 5 ml.
Laboratório. Apresentação de Valcyte. Valcyte - Indicações. Contra-indicações de Valcyte. Advertências. Roche. fr. c/ 60 compr. rev. de 450mg.
 Laboratório Roche Apresentação de Valcyte fr. c/ 60 compr. rev. de 450mg. Valcyte - Indicações Valcyte (cloridrato de valganciclovir) é indicado para o tratamento de retinite por citomegalovírus (CMV)
Laboratório Roche Apresentação de Valcyte fr. c/ 60 compr. rev. de 450mg. Valcyte - Indicações Valcyte (cloridrato de valganciclovir) é indicado para o tratamento de retinite por citomegalovírus (CMV)
Endonidazol. metronidazol 0,5%
 Endonidazol metronidazol 0,5% Forma farmacêutica e apresentações: Solução injetável: 1 frasco plástico transparente de 100 ml de solução a 0,5% (500 mg) de metronidazol. SISTEMA FECHADO USO INTRAVENOSO,
Endonidazol metronidazol 0,5% Forma farmacêutica e apresentações: Solução injetável: 1 frasco plástico transparente de 100 ml de solução a 0,5% (500 mg) de metronidazol. SISTEMA FECHADO USO INTRAVENOSO,
Cloridrato de Ondansetrona
 BULA DO PACIENTE Cloridrato de Ondansetrona HALEX ISTAR SOLUÇÃO INJETÁVEL 2mg/mL 2mL 2mg/mL 4mL cloridrato de ondansetrona Medicamento genérico - Lei nº 9.787 de 1.999 APRESENTAÇÕES Solução injetável -
BULA DO PACIENTE Cloridrato de Ondansetrona HALEX ISTAR SOLUÇÃO INJETÁVEL 2mg/mL 2mL 2mg/mL 4mL cloridrato de ondansetrona Medicamento genérico - Lei nº 9.787 de 1.999 APRESENTAÇÕES Solução injetável -
Propil* propiltiouracila
 Propil* propiltiouracila PARTE I IDENTIFICAÇÃO DO PRODUTO Nome: Propil* Nome genérico: propiltiouracila Forma farmacêutica e apresentação: Propil* 100 mg em embalagem contendo 30 comprimidos. USO ADULTO
Propil* propiltiouracila PARTE I IDENTIFICAÇÃO DO PRODUTO Nome: Propil* Nome genérico: propiltiouracila Forma farmacêutica e apresentação: Propil* 100 mg em embalagem contendo 30 comprimidos. USO ADULTO
MARIOL INDUSTRIAL LTDA.
 PARACETAMOL GOTAS Medicamento genérico Lei n 9.787 de 1999 MARIOL INDUSTRIAL LTDA. Solução Oral (Gotas) 200 mg/ml PARACETAMOL paracetamol DCB: 06827 FORMA FARMACÊUTICA Solução Oral VIA DE ADMINISTRAÇÃO
PARACETAMOL GOTAS Medicamento genérico Lei n 9.787 de 1999 MARIOL INDUSTRIAL LTDA. Solução Oral (Gotas) 200 mg/ml PARACETAMOL paracetamol DCB: 06827 FORMA FARMACÊUTICA Solução Oral VIA DE ADMINISTRAÇÃO
PEMEGLENN Glenmark Farmacêutica Ltda. Pó liófilo para solução injetável 100 mg e 500 mg
 PEMEGLENN Glenmark Farmacêutica Ltda. Pó liófilo para solução injetável 100 mg e 500 mg Pemeglenn_VP02 Página 1 PEMEGLENN pemetrexede dissódico LEIA ATENTAMENTE ESTA BULA ANTES DE INICIAR O TRATAMENTO
PEMEGLENN Glenmark Farmacêutica Ltda. Pó liófilo para solução injetável 100 mg e 500 mg Pemeglenn_VP02 Página 1 PEMEGLENN pemetrexede dissódico LEIA ATENTAMENTE ESTA BULA ANTES DE INICIAR O TRATAMENTO
INFECÇÃO DO TRATO URINÁRIO
 MATERNIDADEESCOLAASSISCHATEAUBRIAND Diretrizesassistenciais INFECÇÃO DO TRATO URINÁRIO INFECÇÃO DO TRATO URINÁRIO Gilberto Gomes Ribeiro Francisco Edson de Lucena Feitosa IMPORTÂNCIA A infecção do trato
MATERNIDADEESCOLAASSISCHATEAUBRIAND Diretrizesassistenciais INFECÇÃO DO TRATO URINÁRIO INFECÇÃO DO TRATO URINÁRIO Gilberto Gomes Ribeiro Francisco Edson de Lucena Feitosa IMPORTÂNCIA A infecção do trato
SANVAL Comércio e Indústria Ltda. Indústria Farmacêutica
 sulfato de neomicina + bacitracina Medicamento genérico lei n 9.787 de 1999 FORMAS FARMACÊUTICAS E APRESENTAÇÕES: Pomada dermatológica - 1 e 50 Bisnagas com 10g. Pomada dermatológica - 1 e 50 Bisnagas
sulfato de neomicina + bacitracina Medicamento genérico lei n 9.787 de 1999 FORMAS FARMACÊUTICAS E APRESENTAÇÕES: Pomada dermatológica - 1 e 50 Bisnagas com 10g. Pomada dermatológica - 1 e 50 Bisnagas
Rocephin 500 mg/2 ml pó e solvente para solução injetável Ceftriaxona (na forma de Ceftriaxona Sódica)
 Folheto informativo: Informação para o utilizador Rocephin 500 mg/2 ml pó e solvente para solução injetável Ceftriaxona (na forma de Ceftriaxona Sódica) Leia com atenção todo este folheto antes de começar
Folheto informativo: Informação para o utilizador Rocephin 500 mg/2 ml pó e solvente para solução injetável Ceftriaxona (na forma de Ceftriaxona Sódica) Leia com atenção todo este folheto antes de começar
AMPICILINA EMS S/A COMPRIMIDO. 500 mg
 AMPICILINA EMS S/A COMPRIMIDO 500 mg ampicilina Medicamento genérico, Lei nº 9.787 de 1999 APRESENTAÇÕES Comprimidos de 500 mg: Embalagens contendo 6, 12 e 24 comprimidos. Embalagens fracionáveis contendo
AMPICILINA EMS S/A COMPRIMIDO 500 mg ampicilina Medicamento genérico, Lei nº 9.787 de 1999 APRESENTAÇÕES Comprimidos de 500 mg: Embalagens contendo 6, 12 e 24 comprimidos. Embalagens fracionáveis contendo
Antibioticoterapia NA UTI. Sammylle Gomes de Castro PERC 2015.2
 Antibioticoterapia NA UTI Sammylle Gomes de Castro PERC 2015.2 O uso racional de Antimicrobianos 1) Qual antibiótico devo escolher? 2) Antibióticos dão reações alérgicas? 3) Vírus fica bom com antibiótico?????????
Antibioticoterapia NA UTI Sammylle Gomes de Castro PERC 2015.2 O uso racional de Antimicrobianos 1) Qual antibiótico devo escolher? 2) Antibióticos dão reações alérgicas? 3) Vírus fica bom com antibiótico?????????
dicloridrato de cetirizina Solução oral 1mg/mL
 dicloridrato de cetirizina Solução oral 1mg/mL MODELO DE BULA COM INFORMAÇÕES AO PACIENTE dicloridrato de cetirizina Medicamento genérico Lei nº 9.787, de 1999. APRESENTAÇÃO Solução oral 1mg/mL Embalagem
dicloridrato de cetirizina Solução oral 1mg/mL MODELO DE BULA COM INFORMAÇÕES AO PACIENTE dicloridrato de cetirizina Medicamento genérico Lei nº 9.787, de 1999. APRESENTAÇÃO Solução oral 1mg/mL Embalagem
