Cinética Química Parte I
|
|
|
- Judite Marques Barata
- 8 Há anos
- Visualizações:
Transcrição
1 Aluna(o): Nº: Turma: 2º ano Recife, de de 2013 Disciplina: Química Professor: Eber Barbosa ] 01 ntrodução RECFE Colégio Salesiano Sagrado Coração Algumas vezes precisamos acelerar uma reação química para que possamos obter o produto desejado e conseguir maior rentabilidade (rendimento) do processo. Outras vezes, precisamos desacelerar uma reação para retardar um processo químico. Neste último caso, podemos, por exemplo, retardar a deterioração dos alimentos, conservando-os numa geladeira ou num freezer. Neste capítulo, estudaremos a velocidade (ou rapidez) das reações químicas e os fatores e leis que influem na velocidade dessas reações. Dentro desse contexto vamos analisar também o mecanismo das reações, ou seja, a maneira íntima (microscópica) das moléculas reagirem. A cinética química é a parte da química que estuda a velocidade ou rapidez das reações e os fatores que influenciam essa velocidade, ou seja, um dos objetivos da Química é o de controlar a velocidade das reações químicas, de modo que sejam rápidas o suficiente para proporcionar o melhor aproveitamento do ponto de vista prático e econômico, mas não tão rápidas a ponto de oferecer risco de acidentes. Da mesma forma também é fundamental saber retardar uma reação de forma que determinado reagente demore mais a ser consumido. Em resumo, o ideal é ter reações com velocidades controladas. Para abrirmos nossa discussão observe as simples imagens de dois fenômenos bastante conhecidos... Percebemos então que existem fenômenos rápidos e lentos. sso nos faz entender que é possível dimensionar a velocidade com que as reações ocorrem. Mas qual é a concepção de velocidade em química? Para responder essa pergunta, primeiro temos que entender que durante uma reação química ocorrem variações das concentrações das substâncias reagentes e produtos. Por exemplo: em uma cozinha supostamente fechada, antes de ligarmos a boca do fogão, no início do dia há uma grande quantidade de gás no botijão e de oxigênio no ar... C C Ao longo dos afazeres do dia, constantemente o corre a seguinte reação na boca do fogão... 1 C 4 H 10(g) + 13/2 4 C + 5 H 2 O (g) C 4H 10(g) C C 4H 4H 10(g) 10(g) C 4H 10(g) C 4H 10(g)...onde observamos o consumo de gás de cozinha, C 4 H 10(g), e do oxigênio do ar,, ao passo em que se dá a produção de gás carbônico, C, e vapores de água, H 2 O (g). 107
2 C C Ao final do dia temos a seguinte situação... C H 2O (g) C C C H 2O (g) H 2O (g) H 2O (g) Percebemos que ha uma diminuição da concentração do gás de cozinha (butano C 4 H 10 ) e, adotando a cozinha como um ambiente com portas e janelas fechadas, constata-se redução da concentração do gás oxigênio (O 2 ) no ar da cozinha ao passo em que aumentam as concentrações de gás carbônico (CO 2 ) e vapores de água (H 2 O) C C 4H 10(g) H 2O (g) H 2O (g) C C Esse fato cotidiano pode ser descrito em linguagem gráfica conforme indicado a seguir... Concentração Concentração Concentração C C... o oxigênio do ar é gasto enquanto a quantidade de gás carbônico vai aumentando... Tempo Agora fica fácil entender que... Tempo Tempo...a cinética química se preocupa em determinar com que velocidade as substâncias são consumidas ou produzidas durante uma ração química: V Substância = Quantidade da substância Tempo A velocidade com que uma substância participa de uma reação química é a razão entre a variação da quantidade dessa substância durante a reação e o intervalo de tempo necessário à ocorrência do fenômeno. É fundamental argumentar que a quantidade da substância pode ser expressa em termos de massa, volume, pressão, quantidade de matéria (mol) ou, com maior importância, concentração molar (mol/l). Quanto ao intervalo de tempo, pode ser dado em minutos, horas, segundos ou qualquer outra unidade de tempo. Exemplo: Considere que um botijão de gás contém 10 litros de gás de cozinha e suponha que após cozinhar um pacote de macarrão restavam apenas 4 litros de gás. Admitindo que o macarrão levou 3 horas para cozinhar em panela de pressão, determine a velocidade de consumo do gás de cozinha em litros/hora. Quantidade = 6 litros Tempo = 3 horas VC 4 H 10 = 2 litros/hora Significado desse resultado: Em média, a cada hora são consumidos 2 litros de gás de cozinha. Agora determine a velocidade de produção de C e a velocidade de formação de H 2 O (g) supondo todos os gases sob as mesmas condições de temperatura e pressão... 1 C 4 H 10(g) + 13/2 4 C + 5 H 2 O (g) 2 litros/h 8 litros/h 10 litros/h Conclusão: Em média, a cada hora, na medida em que são gastos 2 litros de butano são produzidos 8 litros de gás carbônico e 5 litros de vapores de água considerando todas as substâncias nas mesmas condições de temperatura e pressão. Quando as quantidades das substâncias são medidas em termos de volume, pressão ou quantidade de matéria as velocidades de consumo e produção das substâncias em uma reação química são diretamente proporcionais aos coeficientes estequiométricos de cada substância na equação química devidamente balanceada. 108
3 Observação importante: Na análise gráfica da variação da concentração das substâncias em função do tempo para o caso de reações que ocorrem em pequena escala e envolvem componentes do ar como o gás oxigênio (O 2 ) e o gás nitrogênio (N 2 ), é fundamental observa se o fenômeno em questão ocorre em ambiente fechado ou aberto, uma vez que em ambiente aberto não ocorrerão variações das concentrações dos componentes do ar. Como exemplo, vamos analisar graficamente a variação das concentrações em função do tempo das substâncias N 2, O 2, e NO 2 durante a ocorrência da seguinte reação. N 2(g) N 1º) Em ambiente aberto... 2º) Em ambiente fechado... Mol/L Mol/L NO 2 O 2 N 2 Tempo As [ O 2 ] e [ N 2 ] se mantém constantes porque são renovadas pela presença do ar. NO 2 N 2 O 2 Tempo Perceba que, nesse segundo gráfico, a intensidade das curvas são diretamente proporcionas aos coeficientes estequiométricos da equação balanceada. É fundamental relembrar que essa proporcionalidade destacada no comportamento do 2º gráfico não ocorre no caso em que as quantidades das substâncias são medidas em termos de massa, pois segundo a equação de Clapeyron, P. V = n. R. T, pressões e volumes de substâncias diferentes são diretamente proporcionais a quantidade de mols, mas as massas de substâncias diferentes não guardam essa proporção direta com as quantidades de mols estabelecidas pelos coeficientes estequiométricos da equação química devidamente balanceada. Testes de Vestibulares 01 (UFPE 1 a fase/2001) A produção de trióxido de enxofre durante a combustão de carvão em usinas termoelétricas (sistema aberto ao ar) causa problemas ambientais relacionados com a chuva ácida. Esta reação para a produção de trióxido de enxofre, na presença de óxido de nitrogênio é descrita pelo mecanismo a seguir: 2 NO (g) + 2 N 2 N + 2 S 2 SO 3(g) +2 NO (g) 2 S + 2 SO 3(g) (reação global) Qual dos gráficos abaixo melhor representa a concentração molar (eixo das ordenadas) das principais espécies envolvidas na produção de trióxido de enxofre em função do tempo (eixo das abcissas)? a) c) e) b) d) 109
4 02 (UFPE 2 a fase/99) Uma boca de fogão a gás queima 5,0 de butano (C 4 H 10 ) por hora. Qual a velocidade da produção de gás carbônico nesta reação em /hora nas mesmas condições de temperatura e pressão? 03 (UFPE 1 a fase/2006)a reação de decomposição da amônia gasosa foi realizada em um recipiente fechado: 2 NH 3 N H 2 A tabela abaixo indica a variação na concentração de reagente em função do tempo. Concentração de NH 3 em mol L 1 8,0 6,0 4,0 1,0 Tempo em horas 0 1,0 2,0 3,0 Qual é a velocidade média de consumo do reagente nas duas primeiras horas de reação? a) 4,0 mol L 1 h 1 b) 2,0 mol L 1 h 1 c) 10 km h 1 d) 1,0 mol L 1 h 1 e) 2,3 mol h 1 04 (UFPE 1 a fase/2002) Óxidos de nitrogênio, NO x, são substâncias de interesse ambiental, pois são responsáveis pela destruição de ozônio na atmosfera, e, portanto, suas reações são amplamente estudadas. Num dado experimento, em um recipiente fechado, a concentração de NO 2 em função do tempo apresentou o seguinte comportamento: O papel do NO 2 neste sistema reacional é: a) reagente. b) intermediário. c) produto. d) catalisador. e) inerte. 05 (FESP UPE/98) O gráfico abaixo mostra as variações das concentrações dos reagentes e produtos de uma reação em função do tempo. mol/ L 1,50 1,00 A C 0,50 D B Qual das equações abaixo balanceada está de acordo com o gráfico acima? a) A + B 3 C + D d) 4 A + 2 B 2 C + 2 D b) 3 A + B 3 C + 2 D e) A + 2 B 2 C + D c) 3 A + B 2 C + D 06 (PUC MG) Considere a equação: 2 N + 4 CO (g) N 2(g) + 4 C Admita que a formação do N 2(g) tem uma velocidade média constante igual a 0,05 mol/l min. A massa de C, em gramas, formada em 1 hora, é: a) 8,8 b) 44,0 c) 84,0 d) 132,0 e) 528,08 110
5 07 (UFPE 1 a fase/96) O gráfico abaixo representa a variação de concentração das espécies A, B e C com o tempo: Conc. (mol/l) 1,0 0,5 0,0 Qual das alternativas abaixo contém a equação que melhor descreve a reação representada pelo gráfico? a) 2A + B C c) B + 2C A e) B + C A b) A 2B + C d) 2B + C A B A C Tempo 08 (UFPE 1 a fase/2003) No início do século XX, a expectativa da Primeira Guerra Mundial gerou uma grande necessidade de compostos nitrogenados. Haber foi o pioneiro na produção de amônia, a partir do nitrogênio do ar. Se a amônia for colocada num recipiente fechado, sua decomposição ocorre de acordo com a seguinte equação química não balanceada: NH 3(g) N 2(g) + H 2(g). As variações das concentrações com o tempo estão ilustradas na figura abaixo: A partir da análise da figura acima, podemos afirmar que as curvas A, B e C representam a variação temporal das concentrações dos seguintes componentes da reação, respectivamente: a) H 2, N 2 e NH 3 c) NH 3, N 2 e H 2 e) H 2, NH 3 e N 2 b) NH 3, H 2 e N 2 d) N 2, H 2 e NH 3 09 (FESP UPE/97) A reação de decomposição do amoníaco produz 8,40 g/min de nitrogênio. A velocidade dessa reação em mols de NH 3 por hora é: (Dados: N = 14; H = 1) a) 0,30 mols/h b) 60 mols/h c) 18 mols/h d) 36 mols/h e) 1,80 mols/h 10 (FESP UPE/89) Considere a equação abaixo: 2 N 2 O 5(g) 4 N + Admita que a formação do O 2 tem uma velocidade média constante e igual a 0,05 mol/s. A massa de NO 2 formada em 1 minuto será: (Dados: N = 14 u; O 16 u) a) 96g b) 55,2g c) 12,0g d) 552g e) 5,52g 11 (Mackenzie SP) A combustão da gasolina pode ser equacionada por C 8 H 18 + O 2 CO 2 + H 2 O (equação não balanceada). Considere que após uma hora e meia de reação foram produzidos 36 mols de CO 2. Dessa forma, a velocidade de reação, expressa em número de mols de gasolina consumida por minuto, é de: a) 3,0 b) 4,5 c) 0,1 d) 0,4 e) 0,05 111
6 02 Teoria das Colisões Segundo essa teoria as reações dependem dos choques (colisões) entre as moléculas. Vamos ilustrar essa teoria utilizando a reação de síntese do H (g), a partir de H 2(g) e 2(g). H 2(g) + 2(g) 2 H (g) + Energia 1 o ) É necessário agitar, ou seja, aumentar a energia das moléculas para que se aproximem com grande velocidade (dotadas de elevada energia cinética). H H 2 o ) As moléculas colidem violentamente, proporcionando uma colisão eficaz... H H 3 o ) As ligações químicas das moléculas iniciais são enfraquecidas e novas ligações são fortalecidas... Forma-se o complexo ativado 4 o ) Tem-se a formação das novas moléculas (produtos finais)... H H H H 2.A Análise da teoria das colisões Colisões Eficazes As moléculas não reagem com apenas uma colisão. Uma reação ocorre através de muitas colisões sucessivas entre as moléculas, porém nem todas as colisões intermoleculares de fato redundam em reação, ou seja, nem todas as colisões intermoleculares são eficazes. Colisões eficazes são aquelas que realmente provocam reações químicas. Três fatores caracterizam colisões eficazes: 1 o ) ntensidade: É necessário que haja uma grande energia envolvida no momento da colisão. 2 o ) Frequência: Não é suficiente a ocorrência de colisões violentas; é necessário que ocorra uma grande quantidade de colisões em um curto espaço de tempo, ou seja, as colisões devem ocorrer com elevada freqüência. 3 o ) Geometria ou Orientação: Além de intensas e frequentes, as colisões devem ser bem orientadas. Uma colisão frontal entre as moléculas é mais eficaz (mais bem orientada) que uma colisão lateral. H H Colisão bem orientada. Colisão eficaz. H H Colisão mal orientada. Colisão não eficaz. 112
7 Complexo ativado É o início efetivo da reação. É o estado de mais alta energia de todo processo podendo resultar nos produtos ou voltar à forma de reagentes. O complexo ativado é muito instável, razão pela qual apresenta vida muito curta (é instantâneo). Observação: A energia necessária para que se forme o complexo ativado é chamada de energia de ativação. Energia de ativação (E AT ) É a energia necessária para que haja a formação do complexo ativado. É a menor energia necessária para se iniciar a reação. É a energia que se deve fornecer aos reagentes para que esses alcancem o complexo ativado. mportante: Quanto maior for a energia necessária para se formar o complexo ativado, mais difícil será o início da reação. Dessa forma entendemos que quanto maior é a energia de ativação, mais lenta é a reação. Análise gráfica da teoria das colisões Energia Energia Complexo Ativado E at H R H H P Pergunta: Qual das duas reações é mais rápida? Reag. Prod. Reag. Prod. Reação Ocorrência A reação da reação é mais rápida porque exige menor energia para ser ativada, ou seja, a reação ocorre com maior facilidade. 2.B Catalisadores e nibidores Os catalisadores e inibidores são os únicos fatores que podem alterar a energia de ativação de uma reação química. Em linguagem coloquial catalisadores são substâncias que aumentam a velocidade das reações, diminuindo a energia de ativação. Na verdade o catalisador estabelece um caminho alternativo para ocorrência da reação, caminho esse que exige menor energia para ser processado, ou seja, o catalisador faz a reação ocorrer por um mecanismo de menor energia de ativação. Os inibidores apresentam uma atuação oposta a dos catalisadores, pois diminuem a velocidade das reações aumentando a energia de ativação do processo. O mecanismo de ação do inibidor consiste, na verdade, na destruição dos catalisadores já presentes no sistema. mpurezas Por exemplo: a reação 2 H 2 O 2 2 H 2 O + O 2 é rápida em função da presença das impurezas que atuam como catalisadores. Se o meio reacional torna-se ácido ocorre o consumo, a destruição do catalisador e conseqüente aumento da energia de ativação com diminuição da velocidade do processo. H + 2 H 2 O 2 2 H 2 O + O 2 (muito lenta) 113
8 Entalpia (H) Análise gráfica da influencia dos Caminho da reação não catalisada H R Energia E 1 E 2 E 3 E 4 Caminho da reação catalisada Caminho da reação com inibidor E 1 Eat da reação não catalisada E 2 Eat da reação inversa E 3 Abaixamento da energia de ativação E 4 Eat da reação catalisada E 5 E 5 H da reação H P Ocorrência da reação Obs 1 : No caminho, por haver menor energia de ativação, a reação é mais rápida. Obs 2 : Os catalisadores não alteram o H da reação. Obs 3 : Os catalisadores não são consumidos pela reação global. 2.C Como perceber o catalisador em um conjunto de reações sucessivas? Considerando que em termos de processo global os catalisadores não são consumidos temos: 1ª possibilidade: O catalisador pode ser consumido em uma reação intermediária e produzido de volta em outra fase intermediária pertencente à mesma reação global. Etapa 1 Etapa 2 A + B D D E + B A E (Reação global) Nesse contexto podemos inferir que: As etapas 1 e 2 são consideradas fases intermediárias da reação global B é um catalisador porque foi consumido na 1ª reação, mas foi reposto na 2 a reação, ou seja, B não foi consumido pela reação global. D é um composto intermediário porque foi produzido na 1 a reação e consumido pela 2 a reação. Em um conjunto de reações sucessivas o composto intermediário é o produto de uma das etapas da reação e o reagente de uma das próximas etapas do processo. É fundamental enfatizar que os intermediários não interferem na velocidade das reações químicas. Dentre as duas fases apresentadas a 1ª etapa é a mais rápida pois ela apresenta o catalisador como sendo um reagente. Nesse caso entendemos que a 2ª fase do processo é a etapa mais lenta. A 2ª fase, por ser a mais lenta, é a etapa que define a velocidade da reação global. Em um processo que ocorre em várias etapas, será etapa intermediária mais lenta que definirá a velocidade do processo global. Uma possível representação gráfica para esse processo poderia ser dada por: A + B D E + B Observe que a etapa apresenta menor energia de ativação uma vez que é a etapa mais rápida em função da presença do catalisador. Caminho da reação 114
9 Quantidade de reagente Quantidade de produto 2ª possibilidade: O catalisador pode ser consumido em uma reação intermediária e produzido de volta na mesma fase intermediária da reação global. Etapa 1 Etapa 2 A + B D + B D E A E (Reação global) Nesse contexto podemos inferir que: As etapas 1 e 2 são consideradas fases intermediárias da reação global B é um catalisador porque foi consumido na 1ª reação, mas foi reposto na mesma reação, ou seja, B não foi consumido pela reação global. D é um composto intermediário porque foi produzido na 1 a reação e consumido pela 2 a reação. 2.D Enzimas Enzimas são catalisadores produzidos pelos seres vivos, que aceleram reações importantes para o metabolismo do próprio ser vivo. Podemos afirmar que sem a colaboração das enzimas seria impossível a vida dos vegetais e animais tal como a conhecemos em nosso planeta. Assim, por exemplo, em nosso tubo digestivo, a enzima denominada lipase provoca a reação: Lipídio + Água Lipase Ácido graxo + Álcool Outras enzimas são responsáveis por muitas fermentações, caseiras ou industriais, que são empregadas na fabricação de queijos, coalhadas, cervejas, etc. As enzimas são substâncias complexas, de natureza protéica e coloidal, que agem de maneira muito seletiva, isto é, só catalisam um tipo muito bem definido de reação, chegando inclusive a distinguir um reagente de um seu isômero. Essa extraordinária especificidade decorre do fato de a enzima encaixar-se perfeitamente nas moléculas reagentes (substratos), como uma chave se encaixa na fechadura correspondente. Moléculas de enzimas. Moléculas candidatas à reação. Apenas as moléculas 2 e 4 se encaixam na enzima. 2.E Variações das quantidades de reagentes e produtos em função das catálises Apenas as moléculas 2 e 4 reagem formando uma nova molécula. Caminho : consumo do reagente na reação não catalisada. Caminho : consumo do reagente na reação catalisada. Caminho : formação do produto na reação não catalisada. Caminho : formação do produto na reação catalisada. Tempo de reação Tempo de reação 115
10 Testes de Vestibulares 01 (UFPE 1 a fase/2002) O metano é um poluente atmosférico e sua combustão completa é descrita pela equação química balanceada e pode ser esquematizada pelo diagrama abaixo. CH 4(g) + 2 C + 2 H 2 O (g) Sobre este processo químico, podemos afirmar que: a) A variação de entalpia é 890 kj/mol, e portanto é exotérmico. d) A entalpia de ativação é 890 kj/mol. b) A entalpia de ativação é 1140 kj/mol. e) A entalpia de ativação é 890 kj/mol. c) A variação de entalpia é 1140 kj/mol, e portanto é endotérmico. 02 (UPE/2002) Analise o gráfico a seguir, que mostra a variação da energia potencial em função do caminho da reação química, representada pela equação X Y, e assinale a alternativa correta. kj/mol Y ,0 X Caminho da Reação a) O gráfico corresponde à variação da energia de uma reação (X Y) exotérmica. b) A variação da entalpia da reação direta é + 10 kj/mol. c) A energia de ativação da reação X Y é 50 kj/mol. d) A energia de ativação da reação direta é duas vezes maior que a energia de ativação da reação inversa (Y X). e) A variação de entalpia da reação X Y é 30kJ/mol. 03 (UFPE Serra Telhada/2007) Algumas substâncias químicas apresentam a capacidade de acelerar uma determinada reação. Estas substâncias são chamadas de catalisadores. Qual o papel de um catalisador em uma reação química? a) Alterar as energias de reagentes e produtos. b) Encontrar um novo caminho reacional com uma menor energia de ativação. c) Ser consumido durante a reação, ocasionando uma maior quantidade de reagente. d) Eliminar completamente a energia de ativação. e) nibir os choques efetivos de reagentes e produtos, durante o processo reacional. 116
11 04 (UFPE 2 a fase/2000) O gráfico abaixo indica na abscissa o andamento de uma reação química desde os reagentes ( A + B ) até os produtos ( C + D ) e na ordenada as energias envolvidas na reação. Qual o valor indicado pelo gráfico para a energia de ativação da reação A + B C + D? Energia C + D A + B (FESP UPE/99) Analise as afirmativas abaixo. ) A energia de ativação das reações endotérmicas aumenta com o aumento de temperatura. ) Quando a energia potencial do estado de transição é alta, é necessária uma grande quantidade de energia durante a colisão para formar o complexo ativado. ) Todas as colisões que ocorrem entre as moléculas das substâncias reagentes no estado gasoso são efetivas, razão pela qual os gases são bastante reativos. V) Ação catalítica em última análise é proporcionar á reação química, um mecanismo alternativo de mais baixa energia, para formação dos produtos. São verdadeiras: a),,, e V b) e V c), e V d),, e V e) e V 06 (UFPE 2 a fase/2002) Uma descrição simplificada da destruição do ozônio por óxido de nitrogênio é dada pelas seguintes reações: O 3(g) + NO (g) + N N + O (g) NO (g) + Com relação a este processo, pode-se afirmar que: 0 0 A reação global para a destruição do ozônio é: O 3(g) + O (g) 2, e o óxido de nitrogênio atua como catalisador. 1 1 A reação global para a destruição do ozônio é: O 3(g) + O (g) 2, e o dióxido de nitrogênio atua como catalisador. 2 2 A reação global para a destruição do ozônio é: O 3(g) + NO (g) + N, e o óxido de nitrogênio atua como intermediário da reação. 3 3 A reação global para a destruição do ozônio é: O 3(g) + O (g) 2, e o dióxido de nitrogênio atua como um intermediário da reação. 4 4 A reação global para a destruição do ozônio é: ½ O 3(g) + ½ O (g), e o dióxido de nitrogênio atua como inibidor. 07 (Vunesp) Sobre catalisadores, são feitas as quatro afirmações seguintes.. São substâncias que aumentam a velocidade de uma reação.. Reduzem a energia de ativação da reação.. As reações nas quais atuam não ocorreriam nas suas ausências. V. Enzimas são catalisadores biológicos. Dentre essas afirmações, estão corretas apenas: a) e. b) e. c), e. d), e V. e), e V. 117
12 08 (UFPE 2 a fase/2001) A respiração celular produz dióxido de carbono, que precisa ser transportado até os pulmões para ser eliminado do organismo. Este processo envolve a transformação do dióxido de carbono em hidrogenocarbonato (bicarbonato), através da reação com água, representada como: C + H 2 O (l) HCO 3(aq) + H + (aq). O perfil desta reação, isto é, a variação da entalpia (eixo da ordenada) com relação à coordenada de reação (eixo da abscissa) está representado abaixo pela curva. Na presença da anidrase carbônica, este perfil muda, de acordo com a curva da figura abaixo. Considerando estes perfis de reação, julgue os itens abaixo. 0 0 A anidrase carbônica atua como catalisador. 1 1 A presença da anidrase carbônica torna a reação endotérmica. 2 2 A reação é endotérmica, independente da presença da anidrase carbônica. 3 3 A reação na ausência da anidrase carbônica apresenta energia de ativação menor. 4 4 A presença da anidrase carbônica não altera a variação de entalpia da reação. 09 (UFPE Vitória e Caruaru/2007.2) O peróxido de hidrogênio (H 2 O 2 ), conhecido comercialmente como água oxigenada, sofre uma decomposição lenta em água (H 2 O) e oxigênio (O 2 ). A velocidade desta reação pode ser aumentada pela presença da enzima catalase (hidroperoxidase), que atua nesta reação como catalisador. Nas reações químicas, o catalisador tem o papel de: a) alterar a variação de entalpia da reação. b) diminuir a energia dos reagentes em uma reação. c) diminuir a energia dos produtos em uma reação. d) encontrar um novo caminho reacional, com uma maior energia de ativação. e) encontrar um novo caminho reacional, com uma menor energia de ativação. 10 (UFPE 1 a fase/97) Considere os seguintes diagramas de energia de reação nas mesmas condições de temperatura e pressão e em função deles indique a alternativa correta: Diagrama 1 Diagrama 2 Reagentes A + B Energia de ativação Reagentes A + B Energia de ativação H 0 H 0 C + D Produtos C + D Produtos a) Quando o equilíbrio for atingido as concentrações de C e D serão maiores no caso do diagrama 1. b) A reação A + B C + D é endotérmica. c) A variação de entalpia padrão é maior no caso do diagrama 1. d) No caso do diagrama 2 tem-se um catalisador. e) No caso do diagrama 1 a reação é mais rápida. 118
13 11 (UFPE Serra Telhada / 2007: Prova de Biologia) Sabendo-se que a velocidade das reações enzimáticas pode ser influenciada por diferentes fatores, um dos quais é a temperatura, qual dos cinco gráficos abaixo melhor representa a velocidade das reações enzimáticas em humanos, em relação à temperatura? a) b) c) 0 40 o C 0 40 o C 0 40 o C d) e) 0 40 o C 0 40 o C 12 (PUC MG) Considere o diagrama de energia abaixo para uma dada reação química. Leia com atenção as seguintes afirmativas:. A reação é endotérmica.. O ΔH da reação é dado por X.. A energia de ativação sem catalisador é dada por Y. V. O abaixamento da energia de ativação, verificado pela adição de um catalisador, é dado por Z. São corretas somente as afirmativas: a), e V. b), e. c), e V. d) e. e) e V. 13 (SSA 1º Ano/2011 Prova de Biologia) Por que, ao se utilizar água oxigenada (peróxido de hidrogênio) no ferimento, ela espuma? A água oxigenada - peróxido de hidrogênio - reage quimicamente com o sangue e o plasma expostos em uma ferida, liberando o átomo de oxigênio que estava "sobrando". É essa liberação que faz o líquido borbulhar - restando, então, apenas, água comum. A enzima chamada acelera a decomposição da água oxigenada, liberando o gás oxigênio, que para algumas bactérias que possam estar no ferimento é um veneno. Peróxidos de hidrogênio são continuamente formados em vesículas denominadas , presentes em nossas células, principalmente as hepáticas. Assinale a alternativa que completa, CORRETAMENTE, as lacunas 1 e 2 do trecho acima. a) 1-catalase ; 2-lisossomos d) 1-catalase ; 2-peroxissomos b) 1-peroxidase ; 2-mitocôndrias e) 1-oxidase ; 2-ribossomos c) 1-lipase ; 2-retículo endoplasmático granuloso 119
14 03 Fatores que modificam a velocidade da reação De acordo com a teoria das colisões, todos os fatores que aumentam a intensidade e afrequência das colisões intermoleculares, serão capazes de aumentar a velocidade das reações... 3.A Estado físico dos reagentes V Sólidos < V Liquidos < V Gases A velocidade entre gases é maior porque neste estado físico há maior agitação molecular, tornando os choques mais freqüentes e violentos (intensos), o que aumenta a quantidade de colisões eficazes. 3.B Temperatura De forma geral as reações são mais rápidas em temperaturas mais elevadas. sto ocorre porque em temperaturas mais elevadas as moléculas se apresentam mais agitadas, os choques intermoleculares ocorrem com maior energia e as moléculas são quebradas com maior facilidade, tornando a reação mais rápida. Exemplo 1 : As frutas amadurecem mais rápido em local abafado. sso porque em temperaturas altas as reações químicas que envolvem o amadurecimento ocorrem com maior intensidade. Exemplo 2 : Um comprimido efervescente é dissolvido rapidamente em água quente e lentamente em água gelada. sso porque com água quente as colisões intermoleculares são mais intensas e frequentes. Exemplo 3 : Os alimentos cozinham mais rápido em panelas de pressão porque no interior dessas panelas a temperatura da água em ebulição é maior que em panelas abertas. mportante: Aumentar a temperatura proporciona aumento da velocidade da reação não porque provoca diminuição da energia de ativação. Cuidado, acelerar uma reação através de aquecimento não é o mesmo que catalisar a reação. O aquecimento acelera o processo porque faz com que as moléculas reagentes alcancem ou superem a energia necessária para ativar a reação O efeito da eletricidade na velocidade das reações Do mesmo modo que o calor, a eletricidade também é uma forma de energia que influi na velocidade de muitas reações químicas. Esse fato é observado, por exemplo, quando raios saltam na atmosfera, provocando a reação: N 2(g) + 2 NO (g) ; O NO formado se transforma em NO 2 e, em seguida, em HNO 3, que vai formar, no solo, os nitratos necessários ao desenvolvimento dos vegetais. automóveis. Outro exemplo é o da faísca elétrica que provoca a explosão da gasolina, nos cilindros dos motores dos C 8 H 18(l) + 8 C + 9 H 2 O (g) Nessa reação a um aumento na quantidade de mols de compostos gasosos, o que proporciona aumento de pressão no interior do cilindro impulsionando-o e gerando movimento do automóvel. elétrica: Um terceiro exemplo é o da reação do hidrogênio com o oxigênio, também provocada por uma faísca 2 H 2(g) + 2 H 2 O (g) Nessa reação, a faísca elétrica fornece energia para que algumas moléculas de H 2 e de O 2 ultrapassem a elevação correspondente à energia de ativação; como a própria reação libera muita energia, isso será suficiente para desencadear a reação na totalidade das moléculas de H 2 e de O 2 restantes. 120
15 O efeito da luz na velocidade das reações Da mesma maneira que o calor e a eletricidade, a luz (bem como as demais radiações eletromagnéticas) também é uma forma de energia que influi em muitas reações químicas. Quando ficamos diretamente expostos ao sol do meio-dia, por exemplo, as queimaduras que sofremos na pele são o resultado da quebra das moléculas formadoras da própria pele aliás, não se esqueça de que devemos evitar a exposição direta ao sol entre as 10 e as 15 horas, quando a maior quantidade de radiação ultravioleta, de energia ainda maior do que a luz visível, provoca graves queimaduras. Como segundo exemplo, lembre-se de que a água oxigenada deve ser guardada em frascos escuros, pois ela se decompõe rapidamente quando exposta à luz. Um terceiro exemplo interessante é o das misturas de H2 e Cl2 que não reagem no escuro; no entanto elas explodem quando expostas à luz solar direta: H 2(g) + Cl 2(g) 2 HCl (g) A explicação para esses fenômenos é idêntica àquela já apresentada para a eletricidade. No caso presente, é a luz (ou outra forma de radiação eletromagnética) que fornece a energia necessária para as moléculas reagentes ultrapassarem a barreira da energia de ativação. As reações que são influenciadas pela luz são chamadas de reações fotoquímicas. Elas podem ser classificadas em: Fotossíntese: quando, a partir de moléculas menores, obtemos moléculas maiores: H 2(g) + Cl 2(g) 2 HCl (g) C + H 2 O (l) Açúcares, amido, celulose, etc. (na fotossíntese dos vegetais) Fotólise: quando, a partir de moléculas maiores, obtemos moléculas menores: 2 AgBr 2(s) Ag (s) + Br 2(l) (nas chapas fotográficas, gerando um enegrecimento na passagem de AgBr 2 para Ag) 2 H 2 O 2 2 H 2 O (l) + (nos frascos transparentes contendo água oxigenada) 3.C Concentração dos Reagentes Quanto maior a concentração do reagente, mais rápida é a reação. sto ocorre porque meios mais concentrados apresentam grande quantidade de moléculas em um pequeno volume. Dessa forma há maior probabilidade de ocorrência de colisões intermoleculares (maior frequência), proporcionando maior velocidade à reação. Exemplo: Dissolução de uma barra de ferro em solução de ácido sulfúrico. Fe (s) Fe (s) No caso o consumo do ferro é mais rápido porque o ácido está mais concentrado. H 2 SO 4 1,0 M H 2 SO 4 2,0 M mportante: No caso dos sistemas gasosos o aumento da pressão total do sistema produz redução do volume e conseqüente aumento da concentração dos reagentes gasosos. Em função disso podemos afirmar que o aumento da pressão aumenta a velocidade das reações em que participam reagentes gasosos. 121
16 3.D Superfície de Contato Superfície de contato é a área superficial de um material que entra em contato efetivo com os demais reagentes. Conforme a teoria das colisões as reações ocorrem através do contato entre os reagentes. Em função disso concluímos que quanto maior a superfície de contato, mais rápida é a reação. Exemplo: Dissolução de um comprimido efervescente em água. No caso a dissolução do comprimido é mais rápida porque há uma maior superfície de contato entre o comprimido e a água. Observação 1 : Quanto mais fracionado (pulverizado) estiver o material, maior será sua superfície de contato fazendo com que seja maior a velocidade da ração. Observação 2 : É importante perceber que nos fenômenos naturais as transformações ocorrem do exterior para o interior dos materiais. Exemplo: O apodrecimento de uma fruta, verdura ou um pedaço de carne começa pelas superfícies externas. Adsorção dos reagentes Algumas catálises dependem da superfície de contato entre os reagentes e o catalisador A decomposição do H (g), a 500 o C, é catalisada por platina em pó: A platina adsorve (isto é, retém em sua superfície) moléculas de H. Como a platina é um metal de transição (tem a última e a penúltima camadas eletrônicas incompletas), ela é deficitária em elétrons e procura atrair as nuvens eletrônicas do hidrogênio e do iodo. Forma-se, então, um complexo ativado entre a platina e o H, determinando um enfraquecimento da ligação entre o hidrogênio e o iodo que acelera a quebra da molécula H e, em consequência, aumenta a velocidade da reação. Observe que, mesmo nesse caso, há formação de um composto intermediário entre o reagente (H) e o catalisador (Pt). Por outro lado, é bom salientar que a ação catalítica não depende tanto da quantidade de catalisador, e sim da superfície disponível de catalisador; é por isso que a platina será tanto mais ativa quanto mais pulverizada ela estiver. 3.E Afinidade Química Por fim, é fundamental, também, que os reagentes tenham certa afinidade química, ou seja, uma tendência natural para reagir. Por exemplo, o ferro se oxida (enferruja) lentamente quando exposto ao ar; em contrapartida, a oxidação do sódio no ar é muito rápida, devido à afinidade química entre o sódio e o oxigênio tanto que o sódio é guardado imerso em querosene para não se oxidar. Afinidade química, enfim, é um fator que depende da própria natureza das substâncias envolvidas na reação. mportante: É indispensável lembrar que o fato de colocar os reagentes em contato e a existência de afinidade entre os compostos reagentes são condições fundamentais para a ocorrência das reações. 122
17 Testes de Vestibulares 01 (UFPE 2 a fase/2007) Sobre os parâmetros e variáveis que governam a velocidade de reações químicas, podemos afirmar que: 0 0 Em geral, as reações aumentam de velocidade com o aumento da temperatura. 1 1 Em geral, as reações diminuem de velocidade com o aumento da concentração dos reagentes em solução. 2 2 A uma dada temperatura, a velocidade de uma reação será maior quanto menor for sua energia de ativação. 3 3 O aumento da pressão parcial dos reagentes provoca um aumento na velocidade de uma reação entre substâncias no estado gasoso. 4 4 Um catalisador atua aumentando a energia de ativação para uma determinada etapa de uma reação química. 02 (UFPE 1 a fase/98) Em qual das situações abaixo o processo de deterioração de 1 Kg de carne de boi será mais lento? a) Peça inteira colocada em nitrogênio líquido. b) Fatiada e colocada em gelo comum. c) Fatiada e colocada em gelo seco (CO 2 sólido). d) Peça inteira em gelo comum. e) Fatiada, cada fatia envolvida individualmente em plástico e colocada em uma freezer de uso doméstico. 03 (UFPE 1 a fase/99) A dissolução de um comprimido efervescente foi realizada de dois modos: 1) Em água natural, com o comprimido quebrado em pequenos pedaços; 2) Em água gelada, com o comprimido inteiro. A dissolução será: a) Mais lenta em 1, porque, com a temperatura mais alta, a reação é mais lenta. b) Mais lenta em 2, porque a área de contato do comprimido com a água é maior. c) Mais rápida em 1, porque a temperatura é mais alta, e a área de contato é maior. d) gualmente rápida nas duas, pois a temperatura da água não afeta a velocidade da reação. e) Mais rápida em 2, porque o comprimido inteiro possui maior área de contato com a água. 04 (UFPE 1 a fase/92) Quais dos itens abaixo que, associados, aumentam a velocidade da reação entre ferro metálico e ácido clorídrico. ) Ferro em lâminas ) Ácido clorídrico 6 mols/l ) Ferro finamente dividido V) Ácido clorídrico 1,0 mol/l Assinale, entre as alternativas abaixo, aquela que responde corretamente a questão. a) e V b) e c) e d) e e) e V 05 (UFPE 1 a fase/95) Você está cozinhando batatas e fazendo carne grelhada, tudo em fogo baixo, num fogão a gás. Se você passar as duas bocas do fogão para fogo alto, o que acontecerá com o tempo de preparo? a) Diminuirá para os dois alimentos. b) Diminuirá para a carne e aumentará para as batatas. c) Não será afetado. d) Diminuirá para as batatas e não será afetado para a carne. e) Diminuirá para a carne e permanecerá o mesmo para as batatas. 06 (UFPE 1 a fase/94) Em qual das cidades indicadas abaixo, é mais demorado o cozimento de uma feijoada em panela de barro? a) Rio de Janeiro b) São Paulo c) Recife d) La Paz e) Brasília 123
18 07 (UFPE 1 a fase/90) O que você faria para aumentar a velocidade de dissolução de um comprimido efervescente em água? ) Usaria água gelada. ) Dissolveria o comprimido inteiro. ) Usaria água a temperatura ambiente. V) Dissolveria o comprimido partido em 4 partes. Assinale das alternativas abaixo aquela que responde corretamente a questão. a) e V b) e c) d) e e) e V 08 (UPE 2001) Assinale dentre as afirmativas abaixo a verdadeira. a) Conforme os fundamentos da teoria das colisões, as colisões moleculares efetivas, envolvendo três moléculas simultaneamente, são muito mais freqüentes que as colisões bimoleculares. b) Todas as moléculas de um sistema reacional têm, na mesma temperatura, valores iguais de energia cinética e de ativação. c) O catalisador é uma substância que, presente em uma reação química, aumenta progressivamente a energia de ativação da reação sem alterar o seu rendimento. d) O cozimento dos alimentos é mais rápido numa panela de pressão do que numa panela comum pelo fato de a água, na panela de pressão, estar a uma temperatura mais alta, o que favorece as reações envolvidas. e) As enzimas atuam como catalisadores em processos biológicos nos quais sua função é aumentar a concentração do complexo ativado, mantendo constante a energia de ativação do processo. 09 (Unicap Quí. /2000) 0 0 Toda reação que libera calor só pode ser de combustão, não importando o estado físico da substância queimada. 1 1 A dissolução de alguns sais em água é um processo que absorve calor, sendo um processo endotérmico; logo ao segurarmos um tubo de ensaio, com esse procedimento sentimos frio na mão. 2 2 Em qualquer combustão a velocidade de consumo do combustível será sempre igual à velocidade de consumo do comburente. 3 3 Em água natural e estando pulverizado, um comprimido efervescente se dissolverá mais rapidamente do que em água gelada, se estiver inteiro. 4 4 Uma reação só será exotérmica se a entalpia dos produtos for maior que a dos reagentes. 10 (UPE Quí. /2005) 0 0 É mais fácil conservar 500,0g de carne de boi não fatiada em nitrogênio líquido do que a mesma quantidade de carne fatiada em gelo comum. 1 1 A irrigação artificial intensa pode levar à salinização do solo, tornando-o impróprio para a agricultura, o mesmo acontecendo em regiões onde chove regularmente e não se utiliza a irrigação. 2 2 Quando se coloca água gelada em copo de vidro, constata-se que o copo fica molhado por fora, fato esse explicado pela passagem lenta, mas contínua de moléculas de água pelas paredes do vidro. 3 3 O gás carbônico é menos solúvel em água destilada do que em água destilada adicionada de hidróxido de sódio. 4 4 O cloreto de sódio e o cloreto de potássio originam soluções eletrolíticas, quando dissolvidos em água destilada, mas, quando no estado sólido, o cloreto de potássio é um melhor condutor de corrente elétrica do que o cloreto de sódio, porque o raio atômico do potássio é maior do que o raio atômico do sódio. 11 (UPE Cursos à Distância/2011 Prova de Biologia) Ao analisarmos a bioquímica celular na membrana plasmática, verificamos que existem estruturas que podem acelerar as reações, sem modificá-las. Podem, também, atuar no transporte ativo de íons. Porém, se, por acaso, a temperatura corporal ficar elevada acima de 42 C, poderá ocorrer uma desnaturação, isto é, uma destruição dessas moléculas. Com base nessa afirmação, estamos nos referindo aos(às) a) ácidos nucléicos. b) carboidratos. c) lipídios. d) enzimas. e) proteínas. 124
19 12 (UFPE 2 a fase/2001) Quando colocamos água oxigenada num ferimento observamos a formação de bolhas devido à liberação de gás oxigênio, de acordo com a seguinte equação química: 2 H 2 O 2( ) 2 H 2 O ( ) + Num recipiente fechado, podemos observar a variação da pressão, à medida que a reação de decomposição se processa, e assim, determinar a dependência da concentração molar de H 2 O 2 com o tempo de reação. A cinética desta reação foi determinada para duas condições, e, e estão representadas na figura abaixo. Julgue os itens abaixo referentes a esta cinética: 0 0 A velocidade da reação para a condição é maior que para a condição. 1 1 A condição contém um catalisador. 2 2 O número de mols de oxigênio formado, após 4 minutos do início da reação, é maior para a condição do que para a condição. 3 3 A concentração de água oxigenada, após 2 minutos do início da reação, é maior para a condição do que para a condição. 4 4 Se inicialmente os dois recipientes contiverem, exclusivamente, água oxigenada, então a temperatura da condição é diferente da temperatura da condição. 13 (UFPE Serra Talhada/2007) Em uma reação química ocorrem transformações de um ou mais reagentes, dando origem a um ou mais produtos. Em geral, estas reações não acontecem de maneira espontânea. As reações necessitam, na sua grande maioria, de uma energia para que possa ter início. Esta energia é chamada de: a) energia de combustão. c) energia de solubilização. e) energia de ativação. b) energia de vaporização. d) energia de neutralização. 14 (UPE SSA 2º Ano/2011) Durante uma aula de química, a professora cortou um pedaço de fita de magnésio e, com o auxílio de uma lixa, retirou um sólido branco que recobria a sua superfície. Essa substância havia sido formada em decorrência da lenta reação entre o metal e o oxigênio. Após esse procedimento, ela transferiu o pedaço da fita para dentro de um béquer e queimou a sua extremidade superior. mediatamente, observou-se a emissão de uma luz branca muito intensa e brilhante. Verificou-se, também, o aquecimento do béquer e a formação de uma substância sólida e de cor branca, presente na cinza residual. Abaixo, são feitas algumas considerações em relação a essa atividade experimental.. O composto formado após a combustão do magnésio é um sal.. O procedimento realizado na sala envolve uma reação exotérmica.. O processo permite observar a influência da temperatura na velocidade de uma reação. Está(ão) em conformidade com os procedimentos utilizados e os resultados obtidos nessa atividade experimental apenas o(s) item(ns) a). b). c). d) e. e) e. 125
20 Energia Libvre de Gibbs Energia Libvre de Gibbs Energia Libvre de Gibbs 15 (UFPE 2ª fase/2012) Catalisadores viabilizam a maioria dos processos químicos comerciais, além de várias reações em sistemas biológicos e ambientais, alterando o perfil energético da reação. O perfil energético de uma reação, com e sem catalisador, pode ser representado apenas pelos gráficos: 0 0 não-catalisada catalisada reagentes produtos 1 1 Coordenada de reação reagentes não-catalisada produtos catalisada Coordenada de reação 2 2 reagentes produtos Coordenada de reação não-catalisada catalisada 126
21 Energia Libvre de Gibbs Energia Libvre de Gibbs 3 3 não-catalisada catalisada reagentes produtos 4 4 Coordenada de reação reagentes produtos catalisada não-catalisada Coordenada de reação 16 (UPE SSA 2º Ano/2011) Analise as informações contidas no seguinte gráfico Energia de ativação E At (direta) Reação 1 E At E At (direta) Reação 1 Reagentes Produtos Caminho da reação Assinale a alternativa que expressa o processo evidenciado nesse gráfico. a) Modificações nos rendimentos de uma reação. b) Variações endotérmicas de um mesmo tipo de reação. c) Dependência da concentração de reagentes sobre o rendimento de uma reação. d) Efeitos das concentrações dos reagentes sobre a velocidade de uma reação. e) nfluência da presença de um catalisador no andamento de uma reação. 127
22 17 (ENEM 2ª aplicação/2010) Alguns fatores podem alterar a rapidez das reações químicas. A seguir destacam-se três exemplos no contexto da preparação e da conservação de alimentos: 1. A maioria dos produtos alimentícios se conserva por muito tempo quando submetidos à refrigeração. Esse procedimento diminui a rapidez das reações que contribuem para a degradação de certos alimentos. 2. Um procedimento muito comum utilizado em práticas de culinária é o corte dos alimentos para acelerar o seu cozimento, caso não se tenha panela de pressão. 3. Na preparação de iogurtes, adicionam-se ao leite bactérias produtoras de enzimas que aceleram as reações envolvendo açúcares e proteinas lácteas. Com base no texto, quais são os fatores que influenciam a rapidez das transformações químicas relacionadas aos exemplos 1, 2 e 3, respectivamente? a) Temperatura, superfície de contato e concentração. d) Superfície de contato, temperatura e concentração. b) Concentração, superfície de contato e catalisadores. e) Temperatura, concentração e catalisadores. c) Temperatura, superfície de contato e catalisadores. 18 (UFPE 1ª Fase/2007) A reação de hidrogenação do etino a etano possui uma constante de equilíbrio, a 25 o C, de 2,65 x Sabe-se que esta reação é catalisada por platina. Considerando essas informações, assinale a afirmativa correta. a) A reação de hidrogenação é, com certeza, muito rápida mesmo na ausência de platina, pois o valor da constante de equilíbrio é muito elevado. b) A reação na presença de platina deve ser mais rápida que na ausência de platina. c) A reação na presença de platina possui uma constante de equilíbrio maior que na ausência de platina. d) A energia livre de Gibbs padrão da reação de hidrogenação é negativa e deve ser menor ainda na presença de platina. e) A presença da platina aumenta a energia de ativação dessa reação. 19 (UFPE Vitória e Caruarú/ Prova de Biologia) Nos gráficos abaixo são mostradas diferentes concentrações de gás carbônico no sangue humano, num determinado período de tempo, tendo o início do registro das concentrações ocorrido logo após o processo da hematose. Considerando que, e devem corresponder às concentrações de CO 2 no sangue dos capilares pulmonares, dos capilares dos tecidos e das veias cavas, assinale o gráfico correto. a) c) e) b) d) 128
23 Resoluções de Testes Comentários Adicionais 129
24 Resoluções de Testes Comentários Adicionais Gabarito do Capítulo: (43 questões) Gabarito das páginas 109, 110 e 111: N o Resposta N o Resposta N o Resposta N o Resposta 01 B 04 A 07 C 10 D C 08 D 11 D 03 B 06 A 09 D Gabarito das páginas 116, 117, 118 e 119: N o Resposta N o Resposta N o Resposta N o Resposta 01 A 05 B 09 E 13 D 02 C 06 VFFVF 10 D 03 B 07 D 11 B VFFFV 12 A Gabarito das páginas 123, 124, 125, 126, 127 e 128: N o Resposta N o Resposta N o Resposta N o Resposta 01 VFVVF 06 D 11 D 16 E 02 A 07 E 12 VFFVV 17 C 03 C 08 D 13 E 18 B 04 C 09 FVFVF 14 E 19 A 05 E 10 VFFVF 15 VFFVF Comunique-se com seu professor: quimicaeber@hotmail.com 130
QUÍMICA. 4. Um professor, utilizando comprimidos de antiácido efervescente à base de NaHCO 3, realizou quatro procedimentos, ilustrados a seguir:
 QUÍMICA Prof. Rodrigo Rocha 1. Alguns fatores podem alterar a rapidez das reações químicas. A seguir, destacam-se três exemplos no contexto da preparação e da conservação de alimentos: 1) A maioria dos
QUÍMICA Prof. Rodrigo Rocha 1. Alguns fatores podem alterar a rapidez das reações químicas. A seguir, destacam-se três exemplos no contexto da preparação e da conservação de alimentos: 1) A maioria dos
UFU 2014 VESTIBULAR DE MAIO 1ª FASE
 UFU 2014 VESTIBULAR DE MAIO 1ª FASE 1-O iodo-132, devido à sua emissão de partículas beta e radiação gama, tem sido muito empregado no tratamento de problemas na tireoide. A curva abaixo ilustra o decaimento
UFU 2014 VESTIBULAR DE MAIO 1ª FASE 1-O iodo-132, devido à sua emissão de partículas beta e radiação gama, tem sido muito empregado no tratamento de problemas na tireoide. A curva abaixo ilustra o decaimento
Prova de Química Resolvida Segunda Etapa Vestibular UFMG 2011 Professor Rondinelle Gomes Pereira
 QUESTÃO 01 Neste quadro, apresentam-se as concentrações aproximadas dos íons mais abundantes em uma amostra de água típica dos oceanos e em uma amostra de água do Mar Morto: 1. Assinalando com um X a quadrícula
QUESTÃO 01 Neste quadro, apresentam-se as concentrações aproximadas dos íons mais abundantes em uma amostra de água típica dos oceanos e em uma amostra de água do Mar Morto: 1. Assinalando com um X a quadrícula
Professora Sonia Exercícios sobre Cinética gasosa
 Exercícios sobre Cinética gasosa O próximo enunciado se refere às questões de 01 a 09. Coloque V (verdadeiro) e F (falso) para as questões a seguir. 01. ( ) As partículas que formam um gás (que podem ser
Exercícios sobre Cinética gasosa O próximo enunciado se refere às questões de 01 a 09. Coloque V (verdadeiro) e F (falso) para as questões a seguir. 01. ( ) As partículas que formam um gás (que podem ser
Educação Química CINÉTICA QUÍMICA
 CINÉTICA QUÍMICA É a parte da química que estuda a rapidez ou taxa de variação das reações e os fatores que nela influem. - Antigamente denominada de velocidade 1, é uma medida da rapidez com que são consumidos
CINÉTICA QUÍMICA É a parte da química que estuda a rapidez ou taxa de variação das reações e os fatores que nela influem. - Antigamente denominada de velocidade 1, é uma medida da rapidez com que são consumidos
UFMG - 2005 3º DIA QUÍMICA BERNOULLI COLÉGIO E PRÉ-VESTIBULAR
 UFMG - 2005 3º DIA QUÍMICA BERNOULLI COLÉGIO E PRÉ-VESTIBULAR Química Questão 01 Carbono é um elemento cujos átomos podem se organizar sob a forma de diferentes alótropos. Alótropos H de combustão a 25
UFMG - 2005 3º DIA QUÍMICA BERNOULLI COLÉGIO E PRÉ-VESTIBULAR Química Questão 01 Carbono é um elemento cujos átomos podem se organizar sob a forma de diferentes alótropos. Alótropos H de combustão a 25
Nome:...N o...turma:... Data: / / ESTUDO DOS GASES E TERMODINÂMICA
 Ensino Médio Nome:...N o...turma:... Data: / / Disciplina: Física Dependência Prof. Marcelo Vettori ESTUDO DOS GASES E TERMODINÂMICA I- ESTUDO DOS GASES 1- Teoria Cinética dos Gases: as moléculas constituintes
Ensino Médio Nome:...N o...turma:... Data: / / Disciplina: Física Dependência Prof. Marcelo Vettori ESTUDO DOS GASES E TERMODINÂMICA I- ESTUDO DOS GASES 1- Teoria Cinética dos Gases: as moléculas constituintes
Calor de Reação Forma de determinar a energia absorvida ou liberada em uma reação = ΔH da reação.
 TERMOQUIMICA Estuda a variação de energia, ou seja, a variação de temperatura nas reações químicas. Essa energia é chamada de Entalpia representada pelo símbolo H. Reação endotérmica (absorve energia)
TERMOQUIMICA Estuda a variação de energia, ou seja, a variação de temperatura nas reações químicas. Essa energia é chamada de Entalpia representada pelo símbolo H. Reação endotérmica (absorve energia)
TERMOQUÍMICA. Desta forma podemos dizer que qualquer mudança química geralmente envolve energia.
 TERMOQUÍMICA 1 Introdução A sociedade moderna depende das mais diversas formas de energia para sua existência. Quase toda a energia de que dependemos é obtida a partir de reações químicas, como a queima
TERMOQUÍMICA 1 Introdução A sociedade moderna depende das mais diversas formas de energia para sua existência. Quase toda a energia de que dependemos é obtida a partir de reações químicas, como a queima
QUÍMICA SEGUNDA ETAPA - 1997
 QUÍMICA SEGUNDA ETAPA - 1997 QUESTÃO 01 Os valores das sucessivas energias de ionização de um átomo constituem uma evidência empírica da existência de níveis de energia. Os diagramas abaixo pretendem representar,
QUÍMICA SEGUNDA ETAPA - 1997 QUESTÃO 01 Os valores das sucessivas energias de ionização de um átomo constituem uma evidência empírica da existência de níveis de energia. Os diagramas abaixo pretendem representar,
muito gás carbônico, gás de enxofre e monóxido de carbono. extremamente perigoso, pois ocupa o lugar do oxigênio no corpo. Conforme a concentração
 A UU L AL A Respiração A poluição do ar é um dos problemas ambientais que mais preocupam os governos de vários países e a população em geral. A queima intensiva de combustíveis gasolina, óleo e carvão,
A UU L AL A Respiração A poluição do ar é um dos problemas ambientais que mais preocupam os governos de vários países e a população em geral. A queima intensiva de combustíveis gasolina, óleo e carvão,
LISTA COMPLEMENTAR DE EXERCÍCIOS. Ensino Médio 3º ano. Cinética Química Equilíbrio Químico Equilíbrio Iônico
 LISTA COMPLEMENTAR DE EXERCÍCIOS Ensino Médio 3º ano Cinética Química Equilíbrio Químico Equilíbrio Iônico Prof. Ricardo Finkler 2011 1) A velocidade de uma reação química depende: I. Do número de colisões
LISTA COMPLEMENTAR DE EXERCÍCIOS Ensino Médio 3º ano Cinética Química Equilíbrio Químico Equilíbrio Iônico Prof. Ricardo Finkler 2011 1) A velocidade de uma reação química depende: I. Do número de colisões
Exercícios de Revisão
 Exercícios de Revisão (UESC-BA) O NO 2 proveniente dos escapamentos dos veículos automotores é também responsável pela destruição da camada de ozônio. As reações que podem ocorrer no ar poluído pelo NO
Exercícios de Revisão (UESC-BA) O NO 2 proveniente dos escapamentos dos veículos automotores é também responsável pela destruição da camada de ozônio. As reações que podem ocorrer no ar poluído pelo NO
Profa. Maria Fernanda - Química nandacampos.mendonc@gmail.com
 Profa. Maria Fernanda - Química nandacampos.mendonc@gmail.com Estudo de caso Reúnam-se em grupos de máximo 5 alunos e proponha uma solução para o seguinte caso: A morte dos peixes ornamentais. Para isso
Profa. Maria Fernanda - Química nandacampos.mendonc@gmail.com Estudo de caso Reúnam-se em grupos de máximo 5 alunos e proponha uma solução para o seguinte caso: A morte dos peixes ornamentais. Para isso
CINÉTICA QUÍMICA CINÉTICA QUÍMICA EQUAÇÃO DE ARRHENIUS
 CINÉTICA QUÍMICA CINÉTICA QUÍMICA EQUAÇÃO DE ARRHENIUS A DEPENDÊNCIA DA VELOCIDADE DE REAÇÃO COM A TEMPERATURA A velocidade da maioria das reações químicas aumenta à medida que a temperatura também aumenta.
CINÉTICA QUÍMICA CINÉTICA QUÍMICA EQUAÇÃO DE ARRHENIUS A DEPENDÊNCIA DA VELOCIDADE DE REAÇÃO COM A TEMPERATURA A velocidade da maioria das reações químicas aumenta à medida que a temperatura também aumenta.
Ciclos Biogeoquímicos
 Os organismos retiram constantemente da natureza os elementos químicos de que necessitam, mas esses elementos sempre retornam ao ambiente. O processo contínuo de retirada e de devolução de elementos químicos
Os organismos retiram constantemente da natureza os elementos químicos de que necessitam, mas esses elementos sempre retornam ao ambiente. O processo contínuo de retirada e de devolução de elementos químicos
UFMG - 2003 3º DIA QUÍMICA BERNOULLI COLÉGIO E PRÉ-VESTIBULAR
 UFMG - 2003 3º DIA QUÍMICA BERNULLI CLÉGI E PRÉ-VESTIBULAR Química Questão 01 A glicose, C 6 6, é uma das fontes de energia mais importantes para os organismos vivos. A levedura, por exemplo, responsável
UFMG - 2003 3º DIA QUÍMICA BERNULLI CLÉGI E PRÉ-VESTIBULAR Química Questão 01 A glicose, C 6 6, é uma das fontes de energia mais importantes para os organismos vivos. A levedura, por exemplo, responsável
EXERCÍCIOS PROPOSTOS RESUMO. ΔH: variação de entalpia da reação H R: entalpia dos reagentes H P: entalpia dos produtos
 Química Frente IV Físico-química Prof. Vitor Terra Lista 04 Termoquímica Entalpia (H) e Fatores que Alteram o ΔH RESUMO Entalpia (H) é a quantidade total de energia de um sistema que pode ser trocada na
Química Frente IV Físico-química Prof. Vitor Terra Lista 04 Termoquímica Entalpia (H) e Fatores que Alteram o ΔH RESUMO Entalpia (H) é a quantidade total de energia de um sistema que pode ser trocada na
O estado no qual um ou mais corpos possuem a mesma temperatura e, dessa forma, não há troca de calor entre si, denomina-se equilíbrio térmico.
 4. CALORIMETRIA 4.1 CALOR E EQUILÍBRIO TÉRMICO O objetivo deste capítulo é estudar a troca de calor entre corpos. Empiricamente, percebemos que dois corpos A e B, a temperaturas iniciais diferentes, ao
4. CALORIMETRIA 4.1 CALOR E EQUILÍBRIO TÉRMICO O objetivo deste capítulo é estudar a troca de calor entre corpos. Empiricamente, percebemos que dois corpos A e B, a temperaturas iniciais diferentes, ao
Biologia. Sistema circulatório
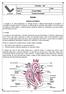 Aluno (a): Série: 3ª Turma: TUTORIAL 10R Ensino Médio Equipe de Biologia Data: Biologia Sistema circulatório O coração e os vasos sanguíneos e o sangue formam o sistema cardiovascular ou circulatório.
Aluno (a): Série: 3ª Turma: TUTORIAL 10R Ensino Médio Equipe de Biologia Data: Biologia Sistema circulatório O coração e os vasos sanguíneos e o sangue formam o sistema cardiovascular ou circulatório.
Química na cozinha: www.interaulaclube.com.br
 Química na cozinha: funções químicas Na Aula 43, você estudou um processo chamado fermentação, que determinados seres vivos promovem para sobreviver. Você aprendeu qual a importância da fermentação para
Química na cozinha: funções químicas Na Aula 43, você estudou um processo chamado fermentação, que determinados seres vivos promovem para sobreviver. Você aprendeu qual a importância da fermentação para
CADERNO DE EXERCÍCIOS 2F
 CADERNO DE EXERCÍCIOS 2F Ensino Médio Ciências da Natureza Questão 1. 2. Conteúdo Extração do ferro a partir do minério, representações químicas das substâncias e reações químicas Habilidade da Matriz
CADERNO DE EXERCÍCIOS 2F Ensino Médio Ciências da Natureza Questão 1. 2. Conteúdo Extração do ferro a partir do minério, representações químicas das substâncias e reações químicas Habilidade da Matriz
Olimpíada Brasileira de Química - 2009
 A Olimpíada Brasileira de Química - 2009 MODALIDADE A ( 1º e 2º anos ) PARTE A - QUESTÕES MÚLTIPLA ESCOLHA 01. O gás SO 2 é formado na queima de combustíveis fósseis. Sua liberação na atmosfera é um grave
A Olimpíada Brasileira de Química - 2009 MODALIDADE A ( 1º e 2º anos ) PARTE A - QUESTÕES MÚLTIPLA ESCOLHA 01. O gás SO 2 é formado na queima de combustíveis fósseis. Sua liberação na atmosfera é um grave
Ciclos do elementos Carbono, Nitrogênio e Enxofre
 Ciclos do elementos Carbono, Nitrogênio e Enxofre Atmosfera Atmosfera é a camada gasosa ao redor da Terra. Hidrosfera é a parte líquida da Terra que corresponde a cerca de 80% da superfície. A água dos
Ciclos do elementos Carbono, Nitrogênio e Enxofre Atmosfera Atmosfera é a camada gasosa ao redor da Terra. Hidrosfera é a parte líquida da Terra que corresponde a cerca de 80% da superfície. A água dos
5. (Espcex (Aman) 2013) Uma amostra de 5 g de hidróxido de sódio (NaOH) impuro foi dissolvida em água suficiente para formar 1L de solução.
 1. (Enem ª aplicação 010) Alguns fatores podem alterar a rapidez das reações químicas. A seguir, destacam-se três exemplos no contexto da preparação e da conservação de alimentos: 1. A maioria dos produtos
1. (Enem ª aplicação 010) Alguns fatores podem alterar a rapidez das reações químicas. A seguir, destacam-se três exemplos no contexto da preparação e da conservação de alimentos: 1. A maioria dos produtos
EXERCÍCIOS (RECUPERAÇÃO)
 EXERCÍCIOS (RECUPERAÇÃO) Professor: ALEX ALUNO(A): DATA: 8/09/05 Físico-Química Cinética Química. A indústria de doces utiliza grande quantidade de açúcar invertido para a produção de biscoitos, bolos,
EXERCÍCIOS (RECUPERAÇÃO) Professor: ALEX ALUNO(A): DATA: 8/09/05 Físico-Química Cinética Química. A indústria de doces utiliza grande quantidade de açúcar invertido para a produção de biscoitos, bolos,
H = +25,4 kj / mol Neste caso, dizemos que a entalpia da mistura aumentou em 25,4 kj por mol de nitrato de amônio dissolvido.
 Lei de Hess 1. Introdução Termoquímica é o ramo da termodinâmica que estuda o calor trocado entre o sistema e sua vizinhança devido à ocorrência de uma reação química ou transformação de fase. Desta maneira,
Lei de Hess 1. Introdução Termoquímica é o ramo da termodinâmica que estuda o calor trocado entre o sistema e sua vizinhança devido à ocorrência de uma reação química ou transformação de fase. Desta maneira,
Exercícios sobre Termoquímica- lei de hess
 Exercícios sobre Termoquímica- lei de hess 01. (Unesp - adaptada) Definir, ou conceituar, e discutir, usando exemplos quando julgar conveniente: a) entalpia molar padrão de formação de uma substância;
Exercícios sobre Termoquímica- lei de hess 01. (Unesp - adaptada) Definir, ou conceituar, e discutir, usando exemplos quando julgar conveniente: a) entalpia molar padrão de formação de uma substância;
TESTES REFERENTES A PARTE 1 DA APOSTILA FUNDAMENTOS DA CORROSÃO INDIQUE SE AS AFIRMAÇÕES A SEGUIR ESTÃO CERTAS OU ERRADAS
 TESTES REFERENTES A PARTE 1 DA APOSTILA FUNDAMENTOS DA CORROSÃO INDIQUE SE AS AFIRMAÇÕES A SEGUIR ESTÃO CERTAS OU ERRADAS 1) Numa célula eletroquímica a solução tem que ser um eletrólito, mas os eletrodos
TESTES REFERENTES A PARTE 1 DA APOSTILA FUNDAMENTOS DA CORROSÃO INDIQUE SE AS AFIRMAÇÕES A SEGUIR ESTÃO CERTAS OU ERRADAS 1) Numa célula eletroquímica a solução tem que ser um eletrólito, mas os eletrodos
Equilíbrio Químico. PROF. NÚRIA Kc, Kp, Ka, Ki, Kb E ph
 Equilíbrio Químico PROF. NÚRIA Kc, Kp, Ka, Ki, Kb E ph 1 - "O conceito de equilíbrio é fundamental na química, mas não é exclusivo da química. Vivemos em uma situação social e econômica que constitui equilíbrio
Equilíbrio Químico PROF. NÚRIA Kc, Kp, Ka, Ki, Kb E ph 1 - "O conceito de equilíbrio é fundamental na química, mas não é exclusivo da química. Vivemos em uma situação social e econômica que constitui equilíbrio
Leonnardo Cruvinel Furquim TERMOQUÍMICA 2
 Leonnardo Cruvinel Furquim TERMOQUÍMICA 2 Calorimetria Os reagentes são colocados num recipiente de aço de paredes resistentes chamado bomba, o qual está imerso numa quantidade de água contida num recipiente
Leonnardo Cruvinel Furquim TERMOQUÍMICA 2 Calorimetria Os reagentes são colocados num recipiente de aço de paredes resistentes chamado bomba, o qual está imerso numa quantidade de água contida num recipiente
38 C 37 B 39 D. Sabendo-se que a amônia (NH 3. ) é constituída por moléculas polares e apresenta boa solubilidade em água. o diclorometano (CH 2.
 QUÍMICA 37 B Sabendo-se que a amônia (N 3 ) é constituída por moléculas polares e apresenta boa solubilidade em água o diclorometano (C Cl ) não possui isômeros Sua molécula apresenta polaridade, devido
QUÍMICA 37 B Sabendo-se que a amônia (N 3 ) é constituída por moléculas polares e apresenta boa solubilidade em água o diclorometano (C Cl ) não possui isômeros Sua molécula apresenta polaridade, devido
As Propriedades das Misturas (Aulas 18 a 21)
 As Propriedades das Misturas (Aulas 18 a 21) I Introdução Em Química, solução é o nome dado a dispersões cujo tamanho das moléculas dispersas é menor que 1 nanometro (10 Angstrons). A solução ainda pode
As Propriedades das Misturas (Aulas 18 a 21) I Introdução Em Química, solução é o nome dado a dispersões cujo tamanho das moléculas dispersas é menor que 1 nanometro (10 Angstrons). A solução ainda pode
9- (UFC) O número de átomos de H, em 2,02 g de H 2, é: A) 12,046 x 10 23 B) 18,069 x 10 23 C) 6,023 x 10 23 D) 3,012 x 10 23 E) 24,092 x 10 23
 CÁLCULOS QUÍMICOS 1- (CESGRANRIO) Sabendo-se que: X ++ íon isoeletrônico do gás nobre do 3º período da tabela periódica Q halogênio mais eletronegativo O número de mols contido em 3,90g do composto XQ
CÁLCULOS QUÍMICOS 1- (CESGRANRIO) Sabendo-se que: X ++ íon isoeletrônico do gás nobre do 3º período da tabela periódica Q halogênio mais eletronegativo O número de mols contido em 3,90g do composto XQ
QUÍMICA POR QUE ESTUDAR QUÍMICA?
 QUÍMICA POR QUE ESTUDAR QUÍMICA? A Química contribui para a melhora da qualidade de vida das pessoas, se souber usá-la corretamente. Nosso futuro depende de como vamos usar o conhecimento Químico. A química
QUÍMICA POR QUE ESTUDAR QUÍMICA? A Química contribui para a melhora da qualidade de vida das pessoas, se souber usá-la corretamente. Nosso futuro depende de como vamos usar o conhecimento Químico. A química
3 Propriedades Coligativas
 3 Propriedades Coligativas 1 Introdução É bastante comum as pessoas adicionarem sal à água que será utilizada no cozimento de alimentos. Com a adição de sal de cozinha, a água demora mais tempo para entrar
3 Propriedades Coligativas 1 Introdução É bastante comum as pessoas adicionarem sal à água que será utilizada no cozimento de alimentos. Com a adição de sal de cozinha, a água demora mais tempo para entrar
Vestibular UFRGS 2015. Resolução da Prova de Química
 Vestibular UFRGS 2015 Resolução da Prova de Química 26. Alternativa (C) Assunto: Propriedades físicas das substâncias densidade Os materiais apresentam diferentes densidades e mesma massa envolvida logo,
Vestibular UFRGS 2015 Resolução da Prova de Química 26. Alternativa (C) Assunto: Propriedades físicas das substâncias densidade Os materiais apresentam diferentes densidades e mesma massa envolvida logo,
DETERMINAÇÃO DA CONSTANTE UNIVERSAL DOS GASES, R.
 DETERMINAÇÃO DA CONSTANTE UNIVERSAL DOS GASES, R. Aula 2 META Conhecer um pouco sobre estequiometria, reatividade de metais com ácido e como utilizar desses conceitos para determinar a constante universal
DETERMINAÇÃO DA CONSTANTE UNIVERSAL DOS GASES, R. Aula 2 META Conhecer um pouco sobre estequiometria, reatividade de metais com ácido e como utilizar desses conceitos para determinar a constante universal
COMENTÁRIO GERAL (EQUIPE DE BIOLOGIA)
 COMENTÁRIO GERAL (EQUIPE DE BIOLOGIA) A prova de Biologia ENEM 2010 apresentou como eixo central questões envolvendo meio ambiente e ecologia geral. Desta forma houve um desequilíbrio na distribuição de
COMENTÁRIO GERAL (EQUIPE DE BIOLOGIA) A prova de Biologia ENEM 2010 apresentou como eixo central questões envolvendo meio ambiente e ecologia geral. Desta forma houve um desequilíbrio na distribuição de
EXERCÍCIOS DE REVISÃO CITOPLASMA E METABOLISMO
 Componente Curricular: Biologia Professor: Leonardo Francisco Stahnke Aluno(a): Turma: Data: / /2015 EXERCÍCIOS DE REVISÃO CITOPLASMA E METABOLISMO 1. A respeito da equação ao lado, que representa uma
Componente Curricular: Biologia Professor: Leonardo Francisco Stahnke Aluno(a): Turma: Data: / /2015 EXERCÍCIOS DE REVISÃO CITOPLASMA E METABOLISMO 1. A respeito da equação ao lado, que representa uma
IX Olimpíada Catarinense de Química 2013. Etapa I - Colégios
 I Olimpíada Catarinense de Química - 2013 I Olimpíada Catarinense de Química 2013 Etapa I - Colégios Imagem: Oxidação Fonte:Gilson Rocha Reynaldo, 2013 Primeiro Ano Conselho Regional de Química CRQ III
I Olimpíada Catarinense de Química - 2013 I Olimpíada Catarinense de Química 2013 Etapa I - Colégios Imagem: Oxidação Fonte:Gilson Rocha Reynaldo, 2013 Primeiro Ano Conselho Regional de Química CRQ III
C 5 H 12 O álcool 88g/mol. x 12,5g x = 9,94g 5CO 2 + 5H 2 O
 Questão 1 O esquema abaixo mostra compostos que podem ser obtidos a partir de um alceno de fórmula molecular C 5 H 10. A seguir, responda às questões relacionadas a esse esquema, considerando sempre o
Questão 1 O esquema abaixo mostra compostos que podem ser obtidos a partir de um alceno de fórmula molecular C 5 H 10. A seguir, responda às questões relacionadas a esse esquema, considerando sempre o
3. Elemento Químico Elemento Químico é um conjunto de átomos iguais (do mesmo tipo). E na linguagem dos químicos eles são representados por Símbolos.
 Química Profª SIMONE MORGADO Aula 1 Elemento, substância e mistura 1. Conceito de Química A Química é uma ciência que busca compreender os mistérios da matéria, sua organização e transformações, bem como
Química Profª SIMONE MORGADO Aula 1 Elemento, substância e mistura 1. Conceito de Química A Química é uma ciência que busca compreender os mistérios da matéria, sua organização e transformações, bem como
Departamento de Química Inorgânica 2. SOLUÇÕES
 2. SOLUÇÕES I. INTRODUÇÃO Soluções são misturas homogêneas de dois ou mais componentes, sendo que estes estão misturados uniformemente em nível molecular. Em nosso cotidiano temos diversos exemplos de
2. SOLUÇÕES I. INTRODUÇÃO Soluções são misturas homogêneas de dois ou mais componentes, sendo que estes estão misturados uniformemente em nível molecular. Em nosso cotidiano temos diversos exemplos de
QUÍMICA. Resolução: a) CH 4 b) Ligações de Hidrogênio. c) 3,3 10 16 L
 QUÍMICA ª QUESTÃO O aquecimento global é o aumento da temperatura terrestre e tem preocupado a comunidade científica cada vez mais. Acredita-se que seja devido ao uso de combustíveis fósseis e outros processos
QUÍMICA ª QUESTÃO O aquecimento global é o aumento da temperatura terrestre e tem preocupado a comunidade científica cada vez mais. Acredita-se que seja devido ao uso de combustíveis fósseis e outros processos
Exercícios sobre Termoquímica- variação de entalpia
 Exercícios sobre Termoquímica- variação de entalpia 01. (Cesgranrio) Quando se adiciona cal viva (CaO) à água, há uma liberação de calor devida à seguinte reação química: CaO + H 2O Ca(OH) 2 + X kcal/mol
Exercícios sobre Termoquímica- variação de entalpia 01. (Cesgranrio) Quando se adiciona cal viva (CaO) à água, há uma liberação de calor devida à seguinte reação química: CaO + H 2O Ca(OH) 2 + X kcal/mol
Aula 19 PROPRIEDADES DAS SOLUÇÕES. Eliana Midori Sussuchi Samísia Maria Fernandes Machado Valéria Regina de Souza Moraes
 Aula 19 PROPRIEDADES DAS SOLUÇÕES META Apresentar os fatores que influenciam no processo de dissolução. OBJETIVOS Ao final desta aula, o aluno deverá: reconhecer um processo de dissolução; identificar
Aula 19 PROPRIEDADES DAS SOLUÇÕES META Apresentar os fatores que influenciam no processo de dissolução. OBJETIVOS Ao final desta aula, o aluno deverá: reconhecer um processo de dissolução; identificar
EDUCAÇÃO E MEIO AMBIENTE. 1.0 Introdução
 EDUCAÇÃO E MEIO AMBIENTE 1.0 Introdução O presente trabalho é resultado de uma visão futurística acerca da preservação do meio ambiente e da manutenção da vida. Alguns anos de estudo e pesquisas na área
EDUCAÇÃO E MEIO AMBIENTE 1.0 Introdução O presente trabalho é resultado de uma visão futurística acerca da preservação do meio ambiente e da manutenção da vida. Alguns anos de estudo e pesquisas na área
Química. 2º Ano. Nome completo: N.º
 Data: / /2012 Química 2º Ano Jesus 2ª UA B Nome completo: N.º ASSUNTO: TERMOQUÍMICA e CNÉTICA QUÍMICA PROFESSOR: JESUS I-Termoquímica Conceito: É o estudo das trocas de energia, na forma de calor, envolvidas
Data: / /2012 Química 2º Ano Jesus 2ª UA B Nome completo: N.º ASSUNTO: TERMOQUÍMICA e CNÉTICA QUÍMICA PROFESSOR: JESUS I-Termoquímica Conceito: É o estudo das trocas de energia, na forma de calor, envolvidas
Equipe de Química QUÍMICA
 Aluno (a): Série: 3ª Turma: TUTORIAL 11R Ensino Médio Equipe de Química Data: QUÍMICA SOLUÇÕES As misturas podem ser homogêneas ou heterogêneas. As misturas homogêneas possuem uma fase distinta. As misturas
Aluno (a): Série: 3ª Turma: TUTORIAL 11R Ensino Médio Equipe de Química Data: QUÍMICA SOLUÇÕES As misturas podem ser homogêneas ou heterogêneas. As misturas homogêneas possuem uma fase distinta. As misturas
EXERCÍCIOS ON LINE DE CIÊNCIAS - 9 ANO
 EXERCÍCIOS ON LINE DE CIÊNCIAS - 9 ANO 1- Com a finalidade de diminuir a dependência de energia elétrica fornecida pelas usinas hidroelétricas no Brasil, têm surgido experiências bem sucedidas no uso de
EXERCÍCIOS ON LINE DE CIÊNCIAS - 9 ANO 1- Com a finalidade de diminuir a dependência de energia elétrica fornecida pelas usinas hidroelétricas no Brasil, têm surgido experiências bem sucedidas no uso de
Física. Questão 1. Questão 2. Avaliação: Aluno: Data: Ano: Turma: Professor:
 Avaliação: Aluno: Data: Ano: Turma: Professor: Física Questão 1 (Unirio 2000) Um aluno pegou um fina placa metálica e nela recortou um disco de raio r. Em seguida, fez um anel também de raio r com um fio
Avaliação: Aluno: Data: Ano: Turma: Professor: Física Questão 1 (Unirio 2000) Um aluno pegou um fina placa metálica e nela recortou um disco de raio r. Em seguida, fez um anel também de raio r com um fio
PROVA DE QUÍMICA II. Dados: R = 0,082L.atm/mol.K, N = 6,0x10 23. A) 4,1x10-14 B) 4,1x10-22 D) 4,1x10-18 C) 1,0x10-18 E) 1,0x10 15
 PROVA DE QUÍMCA 01. A concentração de um gás poluente na atmosfera, medida a 1 atm e 27ºC, é de 1 ppm. A concentração desse poluente, em moléculas/cm 3 de ar, é igual a Dados: R = 0,082L.atm/mol.K, N =
PROVA DE QUÍMCA 01. A concentração de um gás poluente na atmosfera, medida a 1 atm e 27ºC, é de 1 ppm. A concentração desse poluente, em moléculas/cm 3 de ar, é igual a Dados: R = 0,082L.atm/mol.K, N =
Química de Águas Naturais. -todas as formas de vida existentes no planeta Terra dependem da água;
 Química de Águas Naturais todas as formas de vida existentes no planeta Terra dependem da água; a água cobre 70% da superfície do planeta, apenas uma parte dessa quantidade (~2,8%) é água doce sendo que
Química de Águas Naturais todas as formas de vida existentes no planeta Terra dependem da água; a água cobre 70% da superfície do planeta, apenas uma parte dessa quantidade (~2,8%) é água doce sendo que
LISTA 1 NÍVEL 1. Material Extra
 LISTA 1 NÍVEL 1 01. (UEMA) Das três fases de uma substância, a que possui menor energia cinética é a fase, cuja característica é apresentar. Os termos que preenchem corretamente as lacunas são: a) Sólida
LISTA 1 NÍVEL 1 01. (UEMA) Das três fases de uma substância, a que possui menor energia cinética é a fase, cuja característica é apresentar. Os termos que preenchem corretamente as lacunas são: a) Sólida
Conceito de fogo. Elementos que compõem o fogo
 Conceito de fogo Fogo é um processo químico de transformação. Podemos também defini-lo como o resultado de uma reação química que desprende luz e calor devido à combustão de materiais diversos. Elementos
Conceito de fogo Fogo é um processo químico de transformação. Podemos também defini-lo como o resultado de uma reação química que desprende luz e calor devido à combustão de materiais diversos. Elementos
11.1 EQUAÇÃO GERAL DOS BALANÇOS DE ENERGIA. Acúmulo = Entrada Saída + Geração Consumo. Acúmulo = acúmulo de energia dentro do sistema
 11 BALANÇOS DE ENERGIA EM PROCESSOS FÍSICOS E QUÍMICOS Para utilizar adequadamente a energia nos processos é preciso que sejam entendidos os princípios básicos envolvidos na geração, utilização e transformação
11 BALANÇOS DE ENERGIA EM PROCESSOS FÍSICOS E QUÍMICOS Para utilizar adequadamente a energia nos processos é preciso que sejam entendidos os princípios básicos envolvidos na geração, utilização e transformação
Densímetro de posto de gasolina
 Densímetro de posto de gasolina Eixo(s) temático(s) Ciência e tecnologia Tema Materiais: propriedades Conteúdos Densidade, misturas homogêneas e empuxo Usos / objetivos Introdução ou aprofundamento do
Densímetro de posto de gasolina Eixo(s) temático(s) Ciência e tecnologia Tema Materiais: propriedades Conteúdos Densidade, misturas homogêneas e empuxo Usos / objetivos Introdução ou aprofundamento do
PROPRIEDADES COLIGATIVAS
 RORIEDADES COLIGAIVAS O artigo abaixo trata de um tema extremamente cobrado nas provas do IME e do IA dos últimos anos. Em nosso site já existem dois outros artigos com exercícios sobre esse assunto e
RORIEDADES COLIGAIVAS O artigo abaixo trata de um tema extremamente cobrado nas provas do IME e do IA dos últimos anos. Em nosso site já existem dois outros artigos com exercícios sobre esse assunto e
Associação Catarinense das Fundações Educacionais ACAFE PARECER RECURSO DISCIPLINA QUÍMICA
 33) Assinale a alternativa correta, na qual todas as substâncias são compostas e líquidas à temperatura ambiente. A O 3, O 2 ; CH 3 CH 2 OH B H 2 ; CO 2 ; CH 3 OH C H 2 O; NH 3 ; CO D H 2 O; CH 3 CH 2
33) Assinale a alternativa correta, na qual todas as substâncias são compostas e líquidas à temperatura ambiente. A O 3, O 2 ; CH 3 CH 2 OH B H 2 ; CO 2 ; CH 3 OH C H 2 O; NH 3 ; CO D H 2 O; CH 3 CH 2
SISTEMAS MATERIAIS - 2012
 SISTEMAS MATERIAIS - 2012 1- (UFV) A obtenção de gasolina a partir do petróleo é feita por: A) destilação fracionada; B) destilação simples; C) filtração simples; D) filtração sob pressão reduzida; E)
SISTEMAS MATERIAIS - 2012 1- (UFV) A obtenção de gasolina a partir do petróleo é feita por: A) destilação fracionada; B) destilação simples; C) filtração simples; D) filtração sob pressão reduzida; E)
Projeto rumo ao ita. Química. Exercícios de Fixação. Exercícios Propostos. Termodinâmica. ITA/IME Pré-Universitário 1. 06. Um gás ideal, com C p
 Química Termodinâmica Exercícios de Fixação 06. Um gás ideal, com C p = (5/2)R e C v = (3/2)R, é levado de P 1 = 1 bar e V 1 t = 12 m³ para P 2 = 12 bar e V 2 t = 1m³ através dos seguintes processos mecanicamente
Química Termodinâmica Exercícios de Fixação 06. Um gás ideal, com C p = (5/2)R e C v = (3/2)R, é levado de P 1 = 1 bar e V 1 t = 12 m³ para P 2 = 12 bar e V 2 t = 1m³ através dos seguintes processos mecanicamente
LOQ - 4007 Físico-Química Capítulo 2: A Primeira Lei: Conceitos TERMOQUÍMICA Atkins & de Paula (sétima edição)
 LOQ - 4007 Físico-Química Capítulo 2: A Primeira Lei: Conceitos TERMOQUÍMICA Atkins & de Paula (sétima edição) Profa. Dra. Rita de Cássia L.B. Rodrigues Departamento de Biotecnologia LOT E-mail: rita@debiq.eel.usp.br
LOQ - 4007 Físico-Química Capítulo 2: A Primeira Lei: Conceitos TERMOQUÍMICA Atkins & de Paula (sétima edição) Profa. Dra. Rita de Cássia L.B. Rodrigues Departamento de Biotecnologia LOT E-mail: rita@debiq.eel.usp.br
DISCIPLINA: BIOLOGIA PROFª. CRISTINA DE SOUZA 1ª SÉRIE DO ENSINO MÉDIO
 DISCIPLINA: BIOLOGIA PROFª. CRISTINA DE SOUZA 1ª SÉRIE DO ENSINO MÉDIO Ciclo Biogeoquímico 1. É a troca cíclica de elementos químicos que ocorre entre os seres vivos e o ambiente. 2. Todos os elementos
DISCIPLINA: BIOLOGIA PROFª. CRISTINA DE SOUZA 1ª SÉRIE DO ENSINO MÉDIO Ciclo Biogeoquímico 1. É a troca cíclica de elementos químicos que ocorre entre os seres vivos e o ambiente. 2. Todos os elementos
Resolução da Prova de Química Vestibular Verão UERGS/2003 Prof. Emiliano Chemello
 Fácil Resolução da Prova de Química Vestibular Verão UERGS/2003 Prof. Emiliano Chemello Médio www.quimica.net/emiliano emiliano@quimica.net Difícil Níveis de dificuldade das Questões 01. Em um frasco,
Fácil Resolução da Prova de Química Vestibular Verão UERGS/2003 Prof. Emiliano Chemello Médio www.quimica.net/emiliano emiliano@quimica.net Difícil Níveis de dificuldade das Questões 01. Em um frasco,
CONTROLE DE POLUIÇÃO DE ÁGUAS
 CONTROLE DE POLUIÇÃO DE ÁGUAS NOÇÕES DE ECOLOGIA. A ÁGUA NO MEIO A ÁGUA É UM DOS FATORES MAIS IMPORTANTES PARA OS SERES VIVOS, POR ISSO É MUITO IMPORTANTE SABER DE QUE MANEIRA ELA SE ENCONTRA NO MEIO,
CONTROLE DE POLUIÇÃO DE ÁGUAS NOÇÕES DE ECOLOGIA. A ÁGUA NO MEIO A ÁGUA É UM DOS FATORES MAIS IMPORTANTES PARA OS SERES VIVOS, POR ISSO É MUITO IMPORTANTE SABER DE QUE MANEIRA ELA SE ENCONTRA NO MEIO,
ESCOLA ESTADUAL PROFESSOR MORAIS. Atividade: Lista de Exercícios sobre termoquímica Valor: Nota:
 ESCOLA ESTADUAL PROFESSOR MORAIS Disciplina: Química Ensino Médio Atividade: Lista de Exercícios sobre termoquímica Valor: Nota: Série: 2º ano 3º Bimestre Data: 04/09/2015 Professor: Júnior Aluno(a): N
ESCOLA ESTADUAL PROFESSOR MORAIS Disciplina: Química Ensino Médio Atividade: Lista de Exercícios sobre termoquímica Valor: Nota: Série: 2º ano 3º Bimestre Data: 04/09/2015 Professor: Júnior Aluno(a): N
O Princípio da Complementaridade e o papel do observador na Mecânica Quântica
 O Princípio da Complementaridade e o papel do observador na Mecânica Quântica A U L A 3 Metas da aula Descrever a experiência de interferência por uma fenda dupla com elétrons, na qual a trajetória destes
O Princípio da Complementaridade e o papel do observador na Mecânica Quântica A U L A 3 Metas da aula Descrever a experiência de interferência por uma fenda dupla com elétrons, na qual a trajetória destes
RESUMOS TEÓRICOS de QUÍMICA GERAL e EXPERIMENTAL
 RESUMOS TEÓRICOS de QUÍMICA GERAL e EXPERIMENTAL 5 ESTUDO DA MATÉRIA 1 DEFINIÇÕES Matéria é tudo que ocupa lugar no espaço e tem massa. Nem tudo que existe no universo e matéria. Por exemplo, o calor e
RESUMOS TEÓRICOS de QUÍMICA GERAL e EXPERIMENTAL 5 ESTUDO DA MATÉRIA 1 DEFINIÇÕES Matéria é tudo que ocupa lugar no espaço e tem massa. Nem tudo que existe no universo e matéria. Por exemplo, o calor e
P R O V A D E Q UÍMICA I. A tabela abaixo apresenta os pontos de ebulição e a solubilidade em água de alguns álcoois e éteres importantes.
 17 P R O V A D E Q UÍMICA I QUESTÃO 46 A tabela abaixo apresenta os pontos de ebulição e a solubilidade em água de alguns álcoois e éteres importantes. Composto Pe ( o C) Solubilidade em água CH 3 CH 2
17 P R O V A D E Q UÍMICA I QUESTÃO 46 A tabela abaixo apresenta os pontos de ebulição e a solubilidade em água de alguns álcoois e éteres importantes. Composto Pe ( o C) Solubilidade em água CH 3 CH 2
Aulas 13 e 14. Soluções
 Aulas 13 e 14 Soluções Definição Solução é a denominação ao sistema em que uma substância está distribuída, ou disseminada, numa segunda substância sob forma de pequenas partículas. Exemplos Dissolvendo-se
Aulas 13 e 14 Soluções Definição Solução é a denominação ao sistema em que uma substância está distribuída, ou disseminada, numa segunda substância sob forma de pequenas partículas. Exemplos Dissolvendo-se
Sistema Respiratório Introdução
 Introdução Nesse caso, o termo respiração é empregado incluindo as trocas gasosas através do corpo e as trocas gasosas nas células dos diferentes tecidos. As trocas gasosas são realizadas através da superfície
Introdução Nesse caso, o termo respiração é empregado incluindo as trocas gasosas através do corpo e as trocas gasosas nas células dos diferentes tecidos. As trocas gasosas são realizadas através da superfície
41 Por que não bebemos água do mar?
 A U A UL LA Por que não bebemos água do mar? Férias no verão! Que maravilha! Ir à praia, tomar um solzinho, nadar e descansar um pouco do trabalho. Enquanto estamos na praia nos divertindo, não devemos
A U A UL LA Por que não bebemos água do mar? Férias no verão! Que maravilha! Ir à praia, tomar um solzinho, nadar e descansar um pouco do trabalho. Enquanto estamos na praia nos divertindo, não devemos
Compostagem doméstica: como fazer?
 Compostagem, o que é? É um processo dereciclagem de resíduos orgânicos (de cozinha, da horta, do jardim...) realizado através de microrganismos que transformam os resíduos biodegradáveis num fertilizante
Compostagem, o que é? É um processo dereciclagem de resíduos orgânicos (de cozinha, da horta, do jardim...) realizado através de microrganismos que transformam os resíduos biodegradáveis num fertilizante
C5. Formação e evolução estelar
 AST434: C5-1/68 AST434: Planetas e Estrelas C5. Formação e evolução estelar Mário João P. F. G. Monteiro Mestrado em Desenvolvimento Curricular pela Astronomia Mestrado em Física e Química em Contexto
AST434: C5-1/68 AST434: Planetas e Estrelas C5. Formação e evolução estelar Mário João P. F. G. Monteiro Mestrado em Desenvolvimento Curricular pela Astronomia Mestrado em Física e Química em Contexto
PROVA DESAFIO EM QUÍMICA 04/10/14
 PROVA DESAFIO EM QUÍMICA 04/10/14 Nome: Nº de Inscrição: Assinatura: Questão Valor Grau 1 a 2,0 2 a 2,0 3 a 2,0 4 a 2,0 5 a 2,0 Total 10,0 IMPORTANTE: 1) Explique e justifique a resolução de todas as questões.
PROVA DESAFIO EM QUÍMICA 04/10/14 Nome: Nº de Inscrição: Assinatura: Questão Valor Grau 1 a 2,0 2 a 2,0 3 a 2,0 4 a 2,0 5 a 2,0 Total 10,0 IMPORTANTE: 1) Explique e justifique a resolução de todas as questões.
Exercícios Sobre LigaÇões iônicas
 Exercícios Sobre LigaÇões iônicas Dados: 01. (Ufrj - adaptado) A caiação é um processo tradicionalmente utilizado na pintura de casas. Uma das maneiras de se preparar o pigmento consiste em misturar cal
Exercícios Sobre LigaÇões iônicas Dados: 01. (Ufrj - adaptado) A caiação é um processo tradicionalmente utilizado na pintura de casas. Uma das maneiras de se preparar o pigmento consiste em misturar cal
~ 1 ~ PARTE 1 TESTES DE ESCOLHA SIMPLES. Olimpíada de Química do Rio Grande do Sul 2011
 CATEGORIA EM-2 Nº INSCRIÇÃO: Olimpíada de Química do Rio Grande do Sul 2011 Questão 3: O chamado soro caseiro é uma tecnologia social que consiste na preparação e administração de uma mistura de água,
CATEGORIA EM-2 Nº INSCRIÇÃO: Olimpíada de Química do Rio Grande do Sul 2011 Questão 3: O chamado soro caseiro é uma tecnologia social que consiste na preparação e administração de uma mistura de água,
CORPO DE BOMBEIRO MILITAR DO DISTRITO FEDERAL DIRETORIA DE ENSINO E INSTRUÇÃO CENTRO DE ASSISTÊNCIA AO ENSINO COLÉGIO MILITAR DOM PEDRO II
 CORPO DE BOMBEIRO MILITAR DO DISTRITO FEDERAL DIRETORIA DE ENSINO E INSTRUÇÃO CENTRO DE ASSISTÊNCIA AO ENSINO COLÉGIO MILITAR DOM PEDRO II Questão 01 - O esquema a seguir representa, de forma simplificada,
CORPO DE BOMBEIRO MILITAR DO DISTRITO FEDERAL DIRETORIA DE ENSINO E INSTRUÇÃO CENTRO DE ASSISTÊNCIA AO ENSINO COLÉGIO MILITAR DOM PEDRO II Questão 01 - O esquema a seguir representa, de forma simplificada,
CPV o cursinho que mais aprova na fgv Fgv - 05/12/2004
 37 QUÍMICA 31. s irradiadores de alimentos representam hoje uma opção interessante na sua preservação. alimento irradiado, ao contrário do que se imagina, não se torna radioativo, uma vez que a radiação
37 QUÍMICA 31. s irradiadores de alimentos representam hoje uma opção interessante na sua preservação. alimento irradiado, ao contrário do que se imagina, não se torna radioativo, uma vez que a radiação
TECNOLOGIA MECÂNICA. Aula 08. Tratamentos Térmicos das Ligas Ferrosas (Parte 2) Tratamentos Termo-Físicos e Termo-Químicos
 Aula 08 Tratamentos Térmicos das Ligas Ferrosas (Parte 2) e Termo-Químicos Prof. Me. Dario de Almeida Jané Tratamentos Térmicos Parte 2 - Introdução - - Recozimento - Normalização - Têmpera - Revenido
Aula 08 Tratamentos Térmicos das Ligas Ferrosas (Parte 2) e Termo-Químicos Prof. Me. Dario de Almeida Jané Tratamentos Térmicos Parte 2 - Introdução - - Recozimento - Normalização - Têmpera - Revenido
Resoluções das Atividades
 Resoluções das Atividades Sumário Módulo 1 Estudo das dispersões Definição, classificação, estudo dos coloides, coeficiente de solubilidade... 1 Módulo 2 Concentração de soluções... 3 Módulo 3 Propriedades
Resoluções das Atividades Sumário Módulo 1 Estudo das dispersões Definição, classificação, estudo dos coloides, coeficiente de solubilidade... 1 Módulo 2 Concentração de soluções... 3 Módulo 3 Propriedades
Período de injeção. Período que decorre do início da pulverização no cilindro e o final do escoamento do bocal.
 CAPÍTULO 9 - MOTORES DIESEL COMBUSTÃO EM MOTORES DIESEL Embora as reações químicas, durante a combustão, sejam indubitavelmente muito semelhantes nos motores de ignição por centelha e nos motores Diesel,
CAPÍTULO 9 - MOTORES DIESEL COMBUSTÃO EM MOTORES DIESEL Embora as reações químicas, durante a combustão, sejam indubitavelmente muito semelhantes nos motores de ignição por centelha e nos motores Diesel,
 Lista de estequiometria 1. (Ufes) A decomposição térmica do carbonato de cálcio produz óxido de cálcio e dióxido de carbono. Decompondo-se 5,0g de carbonato de cálcio impuro e recolhendo-se todo o dióxido
Lista de estequiometria 1. (Ufes) A decomposição térmica do carbonato de cálcio produz óxido de cálcio e dióxido de carbono. Decompondo-se 5,0g de carbonato de cálcio impuro e recolhendo-se todo o dióxido
Um sistema bem dimensionado permite poupar, em média, 70% a 80% da energia necessária para o aquecimento de água que usamos em casa.
 Mais Questões Isildo M. C. Benta, Assistência Técnica Certificada de Sistemas Solares Quanto poupo se instalar um painel solar térmico? Um sistema bem dimensionado permite poupar, em média, 70% a 80% da
Mais Questões Isildo M. C. Benta, Assistência Técnica Certificada de Sistemas Solares Quanto poupo se instalar um painel solar térmico? Um sistema bem dimensionado permite poupar, em média, 70% a 80% da
BANCO DE QUESTÕES - BIOLOGIA - 1ª SÉRIE - ENSINO MÉDIO ==============================================================================================
 PROFESSOR: Leonardo Mariscal BANCO DE QUESTÕES - BIOLOGIA - 1ª SÉRIE - ENSINO MÉDIO ============================================================================================== Assunto: Organelas citoplasmáticas
PROFESSOR: Leonardo Mariscal BANCO DE QUESTÕES - BIOLOGIA - 1ª SÉRIE - ENSINO MÉDIO ============================================================================================== Assunto: Organelas citoplasmáticas
PARECER DOS RECURSOS
 Associação Catarinense das Fundações Educacionais ACAFE PROCESSO SELETIVO ADMISSÃO DE PROFESSORES EM CARÁTER TEMPORÁRIO EDITAL Nº 15/ 2012/ SED PARECER DOS RECURSOS CARGO: Professor de Química 11) Com
Associação Catarinense das Fundações Educacionais ACAFE PROCESSO SELETIVO ADMISSÃO DE PROFESSORES EM CARÁTER TEMPORÁRIO EDITAL Nº 15/ 2012/ SED PARECER DOS RECURSOS CARGO: Professor de Química 11) Com
Química. Energia de formação (KJ mol -1 )
 Química 01. A formação dos compostos iônicos é geralmente um processo exotérmico cuja energia liberada será tanto maior quanto maior for a força de interação entre o cátion e o ânion. gráfico abaixo apresenta
Química 01. A formação dos compostos iônicos é geralmente um processo exotérmico cuja energia liberada será tanto maior quanto maior for a força de interação entre o cátion e o ânion. gráfico abaixo apresenta
Processo Seletivo/UFU - Janeiro 2004-2ª Prova Comum - PROVA TIPO 1 QUÍMICA QUESTÃO 32
 QUÍMICA QUESTÃO 31 Considerando a Tabela Periódica e as propriedades dos elementos químicos, assinale a alternativa correta A) Um metal é uma substância dúctil e maleável que conduz calor e corrente elétrica
QUÍMICA QUESTÃO 31 Considerando a Tabela Periódica e as propriedades dos elementos químicos, assinale a alternativa correta A) Um metal é uma substância dúctil e maleável que conduz calor e corrente elétrica
CAPÍTULO 6 Termologia
 CAPÍTULO 6 Termologia Introdução Calor e Temperatura, duas grandezas Físicas bastante difundidas no nosso dia-a-dia, e que estamos quase sempre relacionando uma com a outra. Durante a explanação do nosso
CAPÍTULO 6 Termologia Introdução Calor e Temperatura, duas grandezas Físicas bastante difundidas no nosso dia-a-dia, e que estamos quase sempre relacionando uma com a outra. Durante a explanação do nosso
AVALIAÇÃO DIAGNÓSTICA
 Caderno N0901 AVALIAÇÃO DIAGNÓSTICA 2 BIMESTRE Ciências 9 ano do Ensino Fundamental Nome do Aluno(a): Orientações Você está recebendo um caderno com 27 questões. Você dispõe de 2 horas para responder a
Caderno N0901 AVALIAÇÃO DIAGNÓSTICA 2 BIMESTRE Ciências 9 ano do Ensino Fundamental Nome do Aluno(a): Orientações Você está recebendo um caderno com 27 questões. Você dispõe de 2 horas para responder a
LIGAÇÕES INTERATÔMICAS
 UNIDADE 2 - LIGAÇÕES INTERATÔMICAS 2.1. FORÇAS DE LIGAÇÃO FORTES Importante conhecer-se as atrações que mantêm os átomos unidos formando os materiais sólidos. Por exemplo, uma peça de cobre contém 8,4x10
UNIDADE 2 - LIGAÇÕES INTERATÔMICAS 2.1. FORÇAS DE LIGAÇÃO FORTES Importante conhecer-se as atrações que mantêm os átomos unidos formando os materiais sólidos. Por exemplo, uma peça de cobre contém 8,4x10
Universidade Paulista Unip
 Elementos de Produção de Ar Comprimido Compressores Definição Universidade Paulista Unip Compressores são máquinas destinadas a elevar a pressão de um certo volume de ar, admitido nas condições atmosféricas,
Elementos de Produção de Ar Comprimido Compressores Definição Universidade Paulista Unip Compressores são máquinas destinadas a elevar a pressão de um certo volume de ar, admitido nas condições atmosféricas,
O homem transforma o ambiente
 Acesse: http://fuvestibular.com.br/ O homem transforma o ambiente Vimos até agora que não dá para falar em ambiente sem considerar a ação do homem. Nesta aula estudaremos de que modo as atividades humanas
Acesse: http://fuvestibular.com.br/ O homem transforma o ambiente Vimos até agora que não dá para falar em ambiente sem considerar a ação do homem. Nesta aula estudaremos de que modo as atividades humanas
CORPO DE BOMBEIROS MILITAR Vidas alheias, riquezas a salvar
 CORPO DE BOMBEIROS MILITAR Vidas alheias, riquezas a salvar COMBATE A INCÊNDIOS E EXTINTORES Apresentação: 1º Sgt Evandro de Mello do Amaral FATORES DE ÊXITO NA PREVENÇÃO DE INCÊNDIOS Estar em dia com
CORPO DE BOMBEIROS MILITAR Vidas alheias, riquezas a salvar COMBATE A INCÊNDIOS E EXTINTORES Apresentação: 1º Sgt Evandro de Mello do Amaral FATORES DE ÊXITO NA PREVENÇÃO DE INCÊNDIOS Estar em dia com
Biologia Fascículo 04 Lara Regina Parra de Lazzari
 Biologia Fascículo 04 Lara Regina Parra de Lazzari Índice Fotossíntese e Respiração... 1 Fotossíntese... 1 Respiração... 4 Exercícios... 5 Gabarito... 8 Fotossíntese e Respiração Fotossíntese Definição
Biologia Fascículo 04 Lara Regina Parra de Lazzari Índice Fotossíntese e Respiração... 1 Fotossíntese... 1 Respiração... 4 Exercícios... 5 Gabarito... 8 Fotossíntese e Respiração Fotossíntese Definição
SOLUÇÕES SOLUÇÕES MISTURAS
 MISTURAS SOLUÇÕES Quando juntamos duas espécies químicas diferentes e, não houver reação química entre elas, isto é, não houver formação de nova(s) espécie(s), teremos uma mistura. Exemplos: Mistura de
MISTURAS SOLUÇÕES Quando juntamos duas espécies químicas diferentes e, não houver reação química entre elas, isto é, não houver formação de nova(s) espécie(s), teremos uma mistura. Exemplos: Mistura de
a) Incorreta. O aumento da temperatura desloca o equilíbrio para o lado direito, no sentido da formação do vapor (transformação endotérmica).
 01 a) Incorreta. O aumento da temperatura desloca o equilíbrio para o lado direito, no sentido da formação do vapor (transformação endotérmica). b) Incorreta. Quanto mais volátil o líquido, menor será
01 a) Incorreta. O aumento da temperatura desloca o equilíbrio para o lado direito, no sentido da formação do vapor (transformação endotérmica). b) Incorreta. Quanto mais volátil o líquido, menor será
a) h0/16 b) h0/8 c) h0/4 d) h0/3 e) h0/2 Gabarito: A
 FÍSICA. Para um corpo em MHS de amplitude A, que se encontra incialmente na posição A/, com velocidade positiva, a fase inicial é, em radianos, a) b) c) d) e). O planeta Terra possui raio R e gira com
FÍSICA. Para um corpo em MHS de amplitude A, que se encontra incialmente na posição A/, com velocidade positiva, a fase inicial é, em radianos, a) b) c) d) e). O planeta Terra possui raio R e gira com
Lista de exercícios 15 Transformações gasosas
 Lista de exercícios 15 Transformações gasosas 01. Desenhe a curva correspondente (numa dada temperatura) para a transformação isotérmica, explique o porquê desta denominação. 02. Desenhe a curva correspondente
Lista de exercícios 15 Transformações gasosas 01. Desenhe a curva correspondente (numa dada temperatura) para a transformação isotérmica, explique o porquê desta denominação. 02. Desenhe a curva correspondente
