TERMODINÂMICA QUÍMICA
|
|
|
- Adriano Frade Canário
- 4 Há anos
- Visualizações:
Transcrição
1 TERMODINÂMICA QUÍMICA CAPÍTULO DA QUÍMICA FÍSICA QUE ESTUDA A VARIAÇÃO DE ENERGIA DOS SISTEMAS ENVOLVIDOS EM REACÇÕES QUÍMICAS QUALQUER SISTEMA EVOLUI ESPONTANEAMENTE DE UM ESTADO DE MAIOR ENERGIA PARA UM ESTADO DE MENOR ENERGIA Dssolução do NH 4 Cl e do CaCl 2 parece contrarar esta afrmação
2 SISTEMA: PORÇÃO DO UNIVERSO A QUE NOS REFERIMOS ISOLADO: NÃO TROCA ENERGIA NEM MASSA COM O EXTERIOR
3 SISTEMA: PORÇÃO DO UNIVERSO A QUE NOS REFERIMOS FECHADO: NÃO TROCA MASSA COM O EXTERIOR
4 SISTEMA: PORÇÃO DO UNIVERSO A QUE NOS REFERIMOS ABERTO: TROCA ENERGIA E MASSA COM O EXTERIOR
5 ENERGIA TOTAL E INTERNA DE UM SISTEMA E total = Ecnétca + Epotencal + U(energa nterna) Num sstema em repouso (E cnétca = 0)e sueto a um campo exteror constante (campo gravítco; E potencal = cte) (sstema mas comum em laboratóros) E = U
6 U = U + U + U + U + U + trans vb rot pot electro U relat U translaconal U vbraconal U rotaconal U potencal forças ntermoleculares U electrónco U relatvsta E = mc 2
7 1ª LEI DA TERMODINÂMICA (LEI DA CONSERVAÇÃO DA ENERGIA) A Energa nterna do Unverso permanece constante - embora haa transformações de tpos de Energa Ex: Queda de um corpo: E potencal E cnétca Num sstema fechado ocorrem trocas de calor e realzação de trabalho por nteracção com o exteror U = q + w Convenções: U = U fnal - U ncal q > 0, transformação endotérmca w > 0, trabalho realzado sobre o sstema
8 U = U fnal - U ncal FUNÇÃO DE ESTADO: que não depende do modo como o estado fnal fo atngdo apenas dependem do estado ncal e do estado fnal, não dependem do camnho percorrdo
9 dl Fdl = pdv p,v F Trabalho das forças de pressão dw = -pdv ( por convenção o trabalho é postvo quando realzado sobre o sstema e dv < 0) du = dq + dw = dq - pdv du = dq V ( Se V = cte)
10 A maora das transformações químcas ocorre a P constante. Surge assm uma nova função de estado ENTALPIA Calor transferdo a pressão constante H = U + pv U = q P - p V U 2 - U 1 = q P - P (V 2 - V 1 ) (U 2 + PV 2 ) - (U 1 + PV 1 ) = q P H = H 2 - H 1 = q P
11 EXOTÉRMICA ENDOTÉRMICA H Reagentes H Produtos H < 0 Reagentes H > 0 Produtos
12 ENTALPIA DE TRANSFORMAÇÃO Defne se uma transformação é exotérmca ( H<0) ou se é endotérmca ( H>0) H = H ( produto) H H = f(composto, P, T, estado físco) É necessáro defnr CONDIÇÕES PADRÃO ( reagente) T = 298 K P = 1 bar H 2 (g) + ½ O 2 (g) H 2 O(lq) Hº (1 bar, 298K) = -285 kj/mole A Entalpa da reacção nversa tem o mesmo valor, mas com snal contráro 285 kj/mole
13 ENTALPIA DE FORMAÇÃO PADRÃO H 2 (g) + ½ O 2 (g) H 2 O(lq) Hº (1 bar, 298K) = -285 kj/mole Este Hº corresponde à Entalpa de Formação da água líquda em condções padrão: Hº f (H 2 O, lq, 298 K, 1 bar) = kj/mole Entalpa de formação padrão: Entalpa da reacção de formação de 1 mole do composto, no estado padrão, a partr dos seus elementos consttuntes, também no estado padrão As Entalpas de formação padrão estão tabeladas A Entalpa de formação de um elemento no seu estado de referênca é zero
14 ENTALPIA DE REACÇÃO Como vmos H é uma Função de Estado: não depende do camnho segudo LEI DE HESS: H só depende do estado ncal e do fnal, qualquer que sea o camnho segudo H r º = ν H º ( produto) ν H f f º ( reagente)
15 EXEMPLO 1 2 NO (g) + O 2 (g) 2 NO 2 (g) H r º = 2 H f º (NO 2, g) - 2 H f º (NO, g) 2 NO (g) N 2 (g) + O 2 (g) - 2 H f º (NO, g) 2 O 2 (g) + N 2 (g) 2 NO 2 (g) 2 H f º (NO 2, g) 2 NO (g) + O 2 (g) 2 NO 2 (g) H r º = 2 H f º (NO 2, g) - 2 H f º (NO, g)
16 C (grafte) + O 2 (g) H H 1 =? CO (g) + ½ O 2 (g) H 2 = kj.mole -1 H 3 = kj.mole -1 = H f (CO 2, g) CO 2 (g) H 1 = kj.mole -1
17 EXEMPLO 2: Calcular H r º de 2 N 2 H 4 (lq) + N 2 O 4 (lq) 3 N 2 (g) + 4 H 2 O (lq) DADOS: H f º (N 2 O 4, lq) = kj/mole N 2 (g) + 2 O 2 (g) N 2 O 4 (g) H combustão º (N 2 H 4, lq) = kj/mole N 2 H 4 (lq) + O 2 (g) N 2 (g) + 2 H 2 O (lq)
18 2 N 2 H 4 (lq) + N 2 O 4 (lq) 3 N 2 (g) + 4 H 2 O (lq) 2 X [N 2 H 4 (lq) + O 2 (g) N 2 (g) + 2 H 2 O (lq)] H 1 = 2 x H combustão (N 2 H 4 ) N 2 (g) + 2 O 2 (g) N 2 O 4 (g) INVERTER O SENTIDO DA REACÇÃO DE FORMAÇÃO N 2 O 4 (g) N 2 (g) + 2 O 2 (g) H 2 = - H f º (N 2 O 4 )
19 2 N 2 H 4 (lq) + 2 O 2 (g) 2 N 2 (g) + 4 H 2 O (lq)] N 2 O 4 (g) N 2 (g) + 2 O 2 (g) 2 N 2 H 4 (lq) + N 2 O 4 (lq) 3 N 2 (g) + 4 H 2 O (lq) H r = H 1 + H 2 = 2 x H combustão (N 2 H 4 ) - H f º (N 2 O 4 ) = 2 x ( ) (-19.56) = kj/mol
20 CAPACIDADE CALORÍFICA MOLAR A quantdade de calor transferda é proporconal à varação de temperatura do sstema q p = nc p T q v = nc v T C p,v = Capacdade calorífca molar a P e V constante J.K -1.mol -1 q p = mc p T q v = mc v T c p,v = Calor específco a P e V constante J.K -1.g -1
21 CALORES LATENTES Quantdade de calor não assocadas a dferenças de temperatura Entalpas de transformação, uma vez que se referem a transformações a P constante H 2 O (-10ºC) 2 moles H 2 O (110ºC) q p = n C p(sol) T 1 + n H fusão + n C p(lq) T 2 + n H vap + n C p(gas) T 3 q p = m c p(sol) T 1 + n H fusão + m c p(lq) T 2 + n H vap + m c p(gasl) T 3 n = 2 moles m = 2 x 18 g T 1 = 10 (-10 a 0ºC) T 2 = 100 (0 a 100ºC) T 3 = 10 (100 a 110ºC)
22 ESPONTANEIDADE E EQUILÍBRIO Saber se um dado acontecmento ocorre naturalmente (sem auda exteror) - espontâneo Exemplos de acontecmentos expontâneos: - Fusão de gelo à temperatura ambente - Formação de ferrugem - Reacções ácdo-base - Mscbldade de líqudos
23 ESPONTANEIDADE E EQUILÍBRIO Termodnâmca e Cnétca A termodnâmca apenas se preocupa com o sentdo em que se dá o acontecmento até se atngr o equlíbro A cnétca preocupa-se com a velocdade com que se atnge o equlíbro Processos rápdos: Fusão do gelo e Reacções ácdo-base Processos lentos: Formação de ferrugem No equlíbro a velocdade do processo drecto é gual à velocdade do processo nverso
24 FACTORES QUE AFECTAM A ESPONTANEIDADE A -ENERGIA E < 0 Ex: FOGO lbertação de calor ( q < 0) ( U = qv) MAS - Dssolução de NH 4 Cl é endotérmca e espontânea* - Fusão ou evaporação dos lagos é endotérmca e espontânea* * Nestes processos tem lugar uma maor desorganzação do sstema no estado fnal
25 FACTORES QUE AFECTAM A ESPONTANEIDADE B -ENTROPIA ENTROPIA: Nº de confgurações possíves de um sstema S = k B lnω k B cte de Boltzman ω = multplcdade de estados mcroscópcos possíves num dado sstema macroscópco
26 SUBSTÂNCIA SÓLIDA PURA, T = 0 K ω = 1 S = 0
27 Fusão é endotérmca e espontânea
28 ENTROPIA: - Calor posto em ogo numa transformação reversível (que se realza tão lentamente que a varação das Funções de Estado é dmnuta) (que passa por sucessvos estados de equlíbro) Ex: Expansão nfntamente lenta de um gás S = q rev T
29 2ª LEI DA TERMODINÂMICA Um processo é espontâneo quando provoca um aumento de entropa do Unverso S Unv = S sst + S ext > 0 A Entropa é uma Função de Estado S = ν S ( produto) ν S ( reagente) Nas condções padrão Sº = ν Sº ( produto) ν Sº ( reagente)
30 ENERGIA LIVRE DE GIBS Consderando um processo reversível a P = cte q P = H S Temos Unv = S qrev S = S = S + S > 0 Unv sst ext T sst + H T ext > 0 Como este calor é trocado com o exteror S sst + H T sst > 0
31 H S + sst > 0 H T S < 0 sst T Surge assm uma nova Função de Estado ENERGIA LIVRE DE GIBBS G = H T S G = ν G ( produto) ν G ( reagente) Gº = ν Gº ( produto) ν Gº ( reagente)
32 G = H T S
33 CRITÉRIO DE ESPONTANEIDADE Uma transformação espontânea é acompanhada de uma dmnução da Energa Lvre de Gbbs do sstema Para P e T ctes o sstema evolu espontaneamente quando G = H T S < 0 Quando G = 0 o sstema está em equlíbro
34 CRITÉRIO DE ESPONTANEIDADE G = H T S < 0
35 PROBLEMA: Calcule a T mínma a que a segunte reacção é espontânea 2 Fe 2 O 3 (s) + 3 C (grafte) 4 Fe (s) + 3 CO 2 (g) DADOS (25 C) G = kj/mole H = kj/mole S = J/mole.K Gº = H º T S º = H º = T Sº H º T = = 835K Sº 0 Acma de T = 835 K, G < 0 e a reacção é espontânea
36 DEPENDÊNCIA DE G COM A PRESSÃO P G = 2 G1 nrt ln P 2 1 Se P 1 = P 0 = 1 atm (padrão) G = P Gº + nrt ln = Gº + nrt 0 P ln P
37 DEPENDÊNCIA DE G COM A CONCENTRAÇÃO PV = nrt n P = RT = RTc V P 2 = RT ( n 2 / V 2 ) = c 2 P 1 RT ( n 1 / V 1 ) c 1
38 DEPENDÊNCIA DE G COM A CONCENTRAÇÃO P 2 G = = 2 G1 nrt ln nrt ln P1 Se c 1 = c 0 = 1 mole dm -3 (padrão) c c 2 1 G = c Gº + nrt ln = Gº + nrt 0 c ln c
39 VARIAÇÃO DE G NUMA TRANSFORMAÇÃO QUÍMICA POTENCIAL QUÍMICO Varação elementar de G por varação elementar do nº de moles a P e T ctes dg µ = dg = µ dn dn Como P e T são ctes dg dn dgº = + RT ln P µ = µº+rt ln P dn VARIAÇÃO DE G DE UMA MISTURA REACCIONAL dg = µ dn ( produto) µ dn G = Gº+ nrt ln P ( reagente)
40 VARIAÇÃO DE G NUMA TRANSFORMAÇÃO QUÍMICA αa (g) + βb (g) γc (g) + δd (g) níco na nb nc nd fnal na-αdφ nb-βdφ nc+γdφ nd+δdφ φ - grau de avanço da reacção = nº de undades de reacção entre o nstante ncal e um dado nstante (fnal) Varação do nº de moles por composto dn A =-αdφ dn B =-βdφ dn C =+γdφ dn D =+δdφ
41 VARIAÇÃO DE G NUMA TRANSFORMAÇÃO QUÍMICA αa (g) + βb (g) γc (g) + δd (g) níco na nb nc nd fnal na-αφ nb-β φ nc+γ φ nd+δ φ varação dn A =-αdφ dn B =-βdφ dn C =+γdφ dn D =+δdφ dg dg = µ dn ( produto) µ dn = ( reagente) ( µ α φ µ β φ ) µ γdφ µ δdφ d d + + C D A dg d φ = γµ C + δµ D B ( αµ + βµ ) A B
42 dg = γµ C dφ + δµ D ( αµ + βµ ) A B Como µ = µº+rt ln P dg = γµ C º + δµ D º dφ RT ( αµ º + βµ º ) [ γ ln P + δ ln P ( α ln P + β ln P )] C D A A B + B dg = dφ dgº + dφ RT ln ( ) γ ( ) δ P P C D ( ) α ( ) β P A P B G = Gº+ RT ln Q P Q = P ( ) γ ( ) δ P P C D ( ) α ( ) β P A P B
43 Q = P ( ) γ ( ) δ PC PD ( ) α ( ) β P A P B K P = ( ) γ ( ) eq P C δ ( ) α ( ) β P A eq P P D B eq eq Q < P K P dg G < 0 dφ Q > P K P dg > 0 dφ Q = K P P dg = 0 dφ φ
Termodinâmica Química
 Escola da Engenharia de Lorena Departamento de Engenharia Química Termodinâmica Química Prof. Fabrício Maciel Gomes Ementa: Sistemas de composição variável e equilíbrio químico; Equilíbrio de fases em
Escola da Engenharia de Lorena Departamento de Engenharia Química Termodinâmica Química Prof. Fabrício Maciel Gomes Ementa: Sistemas de composição variável e equilíbrio químico; Equilíbrio de fases em
γ = C P C V = C V + R = q = 2 γ 1 = 2 S gas = dw = W isotermico
 Q1 Um clndro feto de materal com alta condutvdade térmca e de capacdade térmca desprezível possu um êmbolo móvel de massa desprezível ncalmente fxo por um pno. O rao nterno do clndro é r = 10 cm, a altura
Q1 Um clndro feto de materal com alta condutvdade térmca e de capacdade térmca desprezível possu um êmbolo móvel de massa desprezível ncalmente fxo por um pno. O rao nterno do clndro é r = 10 cm, a altura
Termodinâmica dos Sistemas Abertos Sistemas heterogêneos: Potencial Químico. Grandezas Molares.
 Termodnâmca dos Sstemas Abertos Sstemas heterogêneos: Potencal Químco. Grandezas Molares. A aplcação da função Energa Lvre de Gbbs aos sstemas de um únco componente permte a construção dos Dagramas de
Termodnâmca dos Sstemas Abertos Sstemas heterogêneos: Potencal Químco. Grandezas Molares. A aplcação da função Energa Lvre de Gbbs aos sstemas de um únco componente permte a construção dos Dagramas de
18 e 20/Abr/2016 Aulas 12 e 13. Introdução à Física Estatística Postulados Equilíbrio térmico Função de Partição; propriedades termodinâmicas
 01/Abr/2016 Aula 11 Potencas termodnâmcos Energa nterna total Entalpa Energas lvres de Helmholtz e de Gbbs Relações de Maxwell 18 e 20/Abr/2016 Aulas 12 e 13 Introdução à Físca Estatístca Postulados Equlíbro
01/Abr/2016 Aula 11 Potencas termodnâmcos Energa nterna total Entalpa Energas lvres de Helmholtz e de Gbbs Relações de Maxwell 18 e 20/Abr/2016 Aulas 12 e 13 Introdução à Físca Estatístca Postulados Equlíbro
Termodinâmica. Termodinâmica é o estudo das mudanças de energia que acompanham os processos físicos e químicos. QUÍMICA GERAL Fundamentos
 Termodinâmica é o estudo das mudanças de energia que acompanham os processos físicos e químicos 1 Calor e Trabalho Calor e trabalho são formas relacionadas de energia Calor pode ser convertido em trabalho
Termodinâmica é o estudo das mudanças de energia que acompanham os processos físicos e químicos 1 Calor e Trabalho Calor e trabalho são formas relacionadas de energia Calor pode ser convertido em trabalho
Cálculo de variações de entropia
 álculo de varações de entropa I stema de um corpo em nteracção com uma onte de calor quecmento rreversível, a volume constante m, c c onte F F onte onte entropa é uma unção de estado e a sua varação é
álculo de varações de entropa I stema de um corpo em nteracção com uma onte de calor quecmento rreversível, a volume constante m, c c onte F F onte onte entropa é uma unção de estado e a sua varação é
SISTEMAS DE COMPOSIÇÃO VARIÁVEL EQUILÍBRIO QUÍMICO
 ESCOLA DE ENGENHARIA DE LORENA EEL/USP TERMODINÂMICA QUÍMICA PROF. ANTONIO CARLOS DA SILVA SISTEMAS DE COMPOSIÇÃO VARIÁVEL EQUILÍBRIO QUÍMICO 1. EQUAÇÃO FUNDAMENTAL DA ENERGIA DE GIBBS Para uma substância
ESCOLA DE ENGENHARIA DE LORENA EEL/USP TERMODINÂMICA QUÍMICA PROF. ANTONIO CARLOS DA SILVA SISTEMAS DE COMPOSIÇÃO VARIÁVEL EQUILÍBRIO QUÍMICO 1. EQUAÇÃO FUNDAMENTAL DA ENERGIA DE GIBBS Para uma substância
Termodinâmica dos Sistemas Abertos Sistemas heterogêneos: Potencial Químico. Grandezas Molares.
 Termoâmca dos Sstemas Abertos Sstemas heterogêneos: Potencal Químco. Grandezas Molares. A aplcação da função Energa Lvre de Gbbs aos sstemas de um únco componente permte a construção dos Dagramas de Fases
Termoâmca dos Sstemas Abertos Sstemas heterogêneos: Potencal Químco. Grandezas Molares. A aplcação da função Energa Lvre de Gbbs aos sstemas de um únco componente permte a construção dos Dagramas de Fases
QB70C:// Química (Turmas S71/S72) Termodinâmica. Prof. Dr. Eduard Westphal ( Capítulo 8 Atkins (5ª ed.
 QB70C:// Química (Turmas S71/S72) Termodinâmica Prof. Dr. Eduard Westphal (http://paginapessoal.utfpr.edu.br/eduardw) Capítulo 8 Atkins (5ª ed.) Entalpia Em um sistema rígido (onde não exista outra forma
QB70C:// Química (Turmas S71/S72) Termodinâmica Prof. Dr. Eduard Westphal (http://paginapessoal.utfpr.edu.br/eduardw) Capítulo 8 Atkins (5ª ed.) Entalpia Em um sistema rígido (onde não exista outra forma
TERMODINÂMICA QUÍMICA. Espontaneidade e Equilíbrio
 TERMODINÂMICA QUÍMICA Espontaneidade e Equilíbrio Calculando a variação de entropia do Universo... Critério de espontaneidade: ΔS universo > 0 processo espontâneo ΔS universo = 0 equilíbrio ΔS universo
TERMODINÂMICA QUÍMICA Espontaneidade e Equilíbrio Calculando a variação de entropia do Universo... Critério de espontaneidade: ΔS universo > 0 processo espontâneo ΔS universo = 0 equilíbrio ΔS universo
Termodinâmica A primeira Lei
 Departamento de Química e Bioquímica Termodinâmica A primeira Lei Cap. 7 Atkins FUNDAMENTOS DE QUÍMICA Termodinâmica Estudo das transformações de energia entre as suas diferentes formas Sistema + Vizinhança
Departamento de Química e Bioquímica Termodinâmica A primeira Lei Cap. 7 Atkins FUNDAMENTOS DE QUÍMICA Termodinâmica Estudo das transformações de energia entre as suas diferentes formas Sistema + Vizinhança
AULA 10 Entropia e a Segunda Lei da Termodinâmica
 UFABC - BC0205 - Prof. Germán Lugones AULA 10 Entropa e a Segunda Le da ermodnâmca Sad Carnot [1796-1832] R. Clausus [1822-1888] W. homson (Lord Kelvn) [1824-1907] Quando um saco de ppocas é aquecdo em
UFABC - BC0205 - Prof. Germán Lugones AULA 10 Entropa e a Segunda Le da ermodnâmca Sad Carnot [1796-1832] R. Clausus [1822-1888] W. homson (Lord Kelvn) [1824-1907] Quando um saco de ppocas é aquecdo em
2/Mar/2016 Aula 4. 26/Fev/2016 Aula 3
 6/Fev/016 Aula 3 Calor e Primeira Lei da Termodinâmica Calor e energia térmica Capacidade calorífica e calor específico Calor latente Diagrama de fases para a água Primeira Lei da Termodinâmica Trabalho
6/Fev/016 Aula 3 Calor e Primeira Lei da Termodinâmica Calor e energia térmica Capacidade calorífica e calor específico Calor latente Diagrama de fases para a água Primeira Lei da Termodinâmica Trabalho
Energia de Gibbs. T e P ctes. = ΔS sistema - ΔH sistema / T 0 = 0 reversível > 0 espontâneo Multiplica por ( -T )
 Energia de Gibbs ΔS total = ΔS sistema + ΔS viz T e P ctes = ΔS sistema + ΔH viz / T = ΔS sistema - ΔH sistema / T 0 = 0 reversível > 0 espontâneo Multiplica por ( -T ) -TΔS total = ΔH sistema - TΔS sistema
Energia de Gibbs ΔS total = ΔS sistema + ΔS viz T e P ctes = ΔS sistema + ΔH viz / T = ΔS sistema - ΔH sistema / T 0 = 0 reversível > 0 espontâneo Multiplica por ( -T ) -TΔS total = ΔH sistema - TΔS sistema
Entropia e energia livre de Gibbs. Prof. Leandro Zatta
 Entropia e energia livre de Gibbs Prof. Leandro Zatta 1 Segunda e a terceira leis Ideias importantes Sentido Natural Desordem Medido por Energia livre de Gibbs 2 Chave para compreensão da ocorrência ou
Entropia e energia livre de Gibbs Prof. Leandro Zatta 1 Segunda e a terceira leis Ideias importantes Sentido Natural Desordem Medido por Energia livre de Gibbs 2 Chave para compreensão da ocorrência ou
Primeira Lei da Termodinâmica
 Físico-Química I Profa. Dra. Carla Dalmolin Primeira Lei da Termodinâmica Definição de energia, calor e trabalho Trabalho de expansão Trocas térmicas Entalpia Termodinâmica Estudo das transformações de
Físico-Química I Profa. Dra. Carla Dalmolin Primeira Lei da Termodinâmica Definição de energia, calor e trabalho Trabalho de expansão Trocas térmicas Entalpia Termodinâmica Estudo das transformações de
Entropia. Energia de Gibbs e Equilíbrio
 Entropia Energia de Gibbs e Equilíbrio Mestrado integrado em Engenharia Biológica Disciplina Química II, 2º semestre 2009/10 Professsora Ana Margarida Martins TRANSFORMAÇÕES ESPONTÂNEAS Uma reacção diz-se
Entropia Energia de Gibbs e Equilíbrio Mestrado integrado em Engenharia Biológica Disciplina Química II, 2º semestre 2009/10 Professsora Ana Margarida Martins TRANSFORMAÇÕES ESPONTÂNEAS Uma reacção diz-se
QUÍMICA GERAL Termodinâmica
 QUÍMICA GERAL Termodinâmica Prof. Dr. Anselmo E. de Oliveira Instituto de Química, UFG anselmo.quimica.ufg.br anselmo.disciplinas@gmail.com 18 de Setembro de 2018 Agronomia Sistemas, Estados e Energia
QUÍMICA GERAL Termodinâmica Prof. Dr. Anselmo E. de Oliveira Instituto de Química, UFG anselmo.quimica.ufg.br anselmo.disciplinas@gmail.com 18 de Setembro de 2018 Agronomia Sistemas, Estados e Energia
N 2 O 4 (g) 2 NO 2 (g) [ ] Para T=298 K. tempo
![N 2 O 4 (g) 2 NO 2 (g) [ ] Para T=298 K. tempo N 2 O 4 (g) 2 NO 2 (g) [ ] Para T=298 K. tempo](/thumbs/71/65187689.jpg) Equilíbrio Químico N 2 O 4 (g) 2 NO 2 (g) [ ] [ N O ] 2 4 2 NO 2 cte = 4.63x10 3 Concentração Concentração tempo Para T=298 K Concentração 2 SO 2 (g) + O 2 (g) 2 SO 3 (g) 2 [ SO ] [SO 2 ] / mol dm -3 [O
Equilíbrio Químico N 2 O 4 (g) 2 NO 2 (g) [ ] [ N O ] 2 4 2 NO 2 cte = 4.63x10 3 Concentração Concentração tempo Para T=298 K Concentração 2 SO 2 (g) + O 2 (g) 2 SO 3 (g) 2 [ SO ] [SO 2 ] / mol dm -3 [O
BCL 0307 Transformações Químicas
 BCL 0307 Transformações Químicas Prof. Dr. André Sarto Polo Bloco B S. 1014 ou L202 andre.polo@ufabc.edu.br Aula 06 http://pesquisa.ufabc.edu.br/pologroup/transformacoes_quimicas.html Ciclo termodinâmico
BCL 0307 Transformações Químicas Prof. Dr. André Sarto Polo Bloco B S. 1014 ou L202 andre.polo@ufabc.edu.br Aula 06 http://pesquisa.ufabc.edu.br/pologroup/transformacoes_quimicas.html Ciclo termodinâmico
Física do Calor Licenciatura: 14ª Aula (02/10/2015)
 Físca do Calor Lcencatura: 4ª ula (2//25) Pro. lvaro annucc mos, na últma aula: Conceto de Entropa (S): exprme a tendênca de todos os sstemas íscos de evoluírem espontaneamente para uma stuação de maor
Físca do Calor Lcencatura: 4ª ula (2//25) Pro. lvaro annucc mos, na últma aula: Conceto de Entropa (S): exprme a tendênca de todos os sstemas íscos de evoluírem espontaneamente para uma stuação de maor
QUÍMICA GERAL Termodinâmica: 2a e 3a Leis
 QUÍMICA GERAL Termodinâmica: 2a e 3a Leis Prof. Dr. Anselmo E. de Oliveira Instituto de Química, UFG anselmo.quimica.ufg.br anselmo.disciplinas@gmail.com 14 de Setembro de 2018 Agronomia Entropia 1 Entropia
QUÍMICA GERAL Termodinâmica: 2a e 3a Leis Prof. Dr. Anselmo E. de Oliveira Instituto de Química, UFG anselmo.quimica.ufg.br anselmo.disciplinas@gmail.com 14 de Setembro de 2018 Agronomia Entropia 1 Entropia
Segunda Lei da Termodinâmica
 Físico-Química I Profa. Dra. Carla Dalmolin Segunda Lei da Termodinâmica Espontaneidade das reações químicas Entropia Terceira Lei da Termodinâmica Primeira Lei da Termodinâmica Estabelece que as transformações
Físico-Química I Profa. Dra. Carla Dalmolin Segunda Lei da Termodinâmica Espontaneidade das reações químicas Entropia Terceira Lei da Termodinâmica Primeira Lei da Termodinâmica Estabelece que as transformações
Fisica do Calor ( ) Prof. Adriano Mesquita Alencar Dep. Física Geral Instituto de Física da USP B03. Primeira Lei da Termodinâmica
 Fisica do Calor (4300159) Prof. Adriano Mesquita Alencar Dep. Física Geral Instituto de Física da USP B03 Primeira Lei da Termodinâmica Data Programa do curso August 9 August 12 August 16 August 19 August
Fisica do Calor (4300159) Prof. Adriano Mesquita Alencar Dep. Física Geral Instituto de Física da USP B03 Primeira Lei da Termodinâmica Data Programa do curso August 9 August 12 August 16 August 19 August
Capítulo 18 Entropia, Energia de Gibbs e Equilíbrio
 Capítulo 18 Entropia, Energia de Gibbs e Equilíbrio As Três Leis da Termodinâmica Processos Espontâneos Entropia A Segunda Lei da Termodinâmica Energia de Gibbs Energia de Gibbs e Equilíbrio Químico Termodinâmica
Capítulo 18 Entropia, Energia de Gibbs e Equilíbrio As Três Leis da Termodinâmica Processos Espontâneos Entropia A Segunda Lei da Termodinâmica Energia de Gibbs Energia de Gibbs e Equilíbrio Químico Termodinâmica
INTRODUÇÃO À QUÍMICA FÍSICA
 FACULDADE DE CIÊNCIAS E TECNOLOGIA DEPARTAMENTO DE QUÍMICA, BIOQUÍMICA E FARMÁCIA Orientação tutorial INTRODUÇÃO À QUÍMICA FÍSICA 1º Ano Q/BQ/CF/F/MIEB/BT Ano Lectivo: 2008 / 2009 (5º Módulo) 2009 IQF
FACULDADE DE CIÊNCIAS E TECNOLOGIA DEPARTAMENTO DE QUÍMICA, BIOQUÍMICA E FARMÁCIA Orientação tutorial INTRODUÇÃO À QUÍMICA FÍSICA 1º Ano Q/BQ/CF/F/MIEB/BT Ano Lectivo: 2008 / 2009 (5º Módulo) 2009 IQF
IDENTIFICAÇÃO: Atenção: Esteja atento à numeração das páginas Questão 1
 Atenção: Esteja atento à numeração das páginas Questão 1 Determine o volume molar (em unidades de L mol 1 ) e o fator de compressibilidade Z do vapor saturado de água à pressão de 1,00 bar e temperatura
Atenção: Esteja atento à numeração das páginas Questão 1 Determine o volume molar (em unidades de L mol 1 ) e o fator de compressibilidade Z do vapor saturado de água à pressão de 1,00 bar e temperatura
TERMODINÂMICA QUÍMICA
 TERMODINÂMICA QUÍMICA Processos Espontâneos 1ª Lei da termodinâmica: Energia de um sistema é conservada ΔE = variação da energia interna q = calor absorvido pelo sistema w = trabalho realizado pela vizinhança
TERMODINÂMICA QUÍMICA Processos Espontâneos 1ª Lei da termodinâmica: Energia de um sistema é conservada ΔE = variação da energia interna q = calor absorvido pelo sistema w = trabalho realizado pela vizinhança
Física do Calor. Entropia e Segunda Lei II
 4300159 Física do Calor Entropia e Segunda Lei II C A = C B = C A B f f A > B ds = dq rev S A = R dq rev = C A R f A d = C ln f A < 0 S B = R dq rev = C B R f B d = C ln f B > 0 S sis = S A + S B = C ln
4300159 Física do Calor Entropia e Segunda Lei II C A = C B = C A B f f A > B ds = dq rev S A = R dq rev = C A R f A d = C ln f A < 0 S B = R dq rev = C B R f B d = C ln f B > 0 S sis = S A + S B = C ln
Universidade Federal do Ceará Centro de Ciências Departamento de Bioquímica e Biologia Molecular Disciplina de Biofísica.
 Universidade Federal do Ceará Centro de Ciências Departamento de Bioquímica e Biologia Molecular Disciplina de Biofísica Termodinâmica 1. Introdução 2. Conceitos Importantes em Termodinâmica 3. Leis da
Universidade Federal do Ceará Centro de Ciências Departamento de Bioquímica e Biologia Molecular Disciplina de Biofísica Termodinâmica 1. Introdução 2. Conceitos Importantes em Termodinâmica 3. Leis da
Versão integral disponível em digitalis.uc.pt
 Versão ntegral dsponível em dgtals.uc.pt 1 E N S I N O Versão ntegral dsponível em dgtals.uc.pt 2 EDIÇÃO Imprensa da Unversdade de Combra Emal: mprensauc@c.uc.pt URL: http://www.uc.pt/mprensa_uc Vendas
Versão ntegral dsponível em dgtals.uc.pt 1 E N S I N O Versão ntegral dsponível em dgtals.uc.pt 2 EDIÇÃO Imprensa da Unversdade de Combra Emal: mprensauc@c.uc.pt URL: http://www.uc.pt/mprensa_uc Vendas
Diagramas de Energia
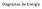 Diagramas de Energia 1.1- Análise Gráfica Reação exotérmica Reação endotérmica (a) Energia de ativação (Ea) para a reação inversa (b) Energia de ativação (Ea) para a reação direta (c) ΔH 1.2- Entropia
Diagramas de Energia 1.1- Análise Gráfica Reação exotérmica Reação endotérmica (a) Energia de ativação (Ea) para a reação inversa (b) Energia de ativação (Ea) para a reação direta (c) ΔH 1.2- Entropia
Fisica do Corpo Humano ( ) Prof. Adriano Mesquita Alencar Dep. Física Geral Instituto de Física da USP B01. Temperatura Aula 5 e 1/2 da 6
 Fisica do Corpo Humano (4300325) Prof. Adriano Mesquita Alencar Dep. Física Geral Instituto de Física da USP B01 Temperatura Aula 5 e 1/2 da 6 1. Existem em torno de uma centena de átomos 2. Cada átomo
Fisica do Corpo Humano (4300325) Prof. Adriano Mesquita Alencar Dep. Física Geral Instituto de Física da USP B01 Temperatura Aula 5 e 1/2 da 6 1. Existem em torno de uma centena de átomos 2. Cada átomo
PROFª. KAÍZA CAVALCANTI
 Processos Químicos Quando ocorre uma alteração qualitativa do sistema, dos tipos de substâncias presentes ou de suas proporções. Processos Físicos Quando ocorre uma alteração qualitativa do sistema, dos
Processos Químicos Quando ocorre uma alteração qualitativa do sistema, dos tipos de substâncias presentes ou de suas proporções. Processos Físicos Quando ocorre uma alteração qualitativa do sistema, dos
Apresentar as aplicações conjuntas do primeiro e do segundo princípio; apresentar as equações fundamentais da termodinâmica.
 ENERGIA LIVRE E POTENCIAL QUÍMICO Metas Apresentar as aplicações conjuntas do primeiro e do segundo princípio; apresentar as equações fundamentais da termodinâmica. Objetivos Ao final desta aula, o aluno
ENERGIA LIVRE E POTENCIAL QUÍMICO Metas Apresentar as aplicações conjuntas do primeiro e do segundo princípio; apresentar as equações fundamentais da termodinâmica. Objetivos Ao final desta aula, o aluno
Profª. Drª. Ana Cláudia Kasseboehmer Monitor: Israel Rosalino
 Universidade de São Paulo Instituto de Química de São Carlos Departamento de Físico-Química Laboratório de Investigações em Ensino de Ciências Naturais Profª. Drª. Ana Cláudia Kasseboehmer claudiaka@iqsc.usp.br
Universidade de São Paulo Instituto de Química de São Carlos Departamento de Físico-Química Laboratório de Investigações em Ensino de Ciências Naturais Profª. Drª. Ana Cláudia Kasseboehmer claudiaka@iqsc.usp.br
UNIVERSIDADE FEDERAL DO RIO DE JANEIRO UFRJ INSTITUTO DE QUÍMICA IQG127. Termodinâmica
 UNIVERSIDADE FEDERAL DO RIO DE JANEIRO UFRJ INSTITUTO DE QUÍMICA IQG127 Termodinâmica Prof. Antonio Guerra Departamento de Química Geral e Inorgânica - DQI Energia e Trabalho Energia A capacidade de realizar
UNIVERSIDADE FEDERAL DO RIO DE JANEIRO UFRJ INSTITUTO DE QUÍMICA IQG127 Termodinâmica Prof. Antonio Guerra Departamento de Química Geral e Inorgânica - DQI Energia e Trabalho Energia A capacidade de realizar
Primeira Lei da Termodinâmica
 Físico-Química I Profa. Dra. Carla Dalmolin Primeira Lei da Termodinâmica Definição de energia, calor e trabalho Trocas térmicas Entalpia e termoquímica Termodinâmica Estudo das transformações de energia
Físico-Química I Profa. Dra. Carla Dalmolin Primeira Lei da Termodinâmica Definição de energia, calor e trabalho Trocas térmicas Entalpia e termoquímica Termodinâmica Estudo das transformações de energia
CQ110 : Princípios de FQ
 CQ 110 Prncípos de Físco Químca Curso: Farmáca Prof. Dr. Marco Vdott mvdott@ufpr.br 1 soluções eletrolítcas Qual a dferença entre uma solução 1,0 mol L -1 de glcose e outra de NaCl de mesma concentração?
CQ 110 Prncípos de Físco Químca Curso: Farmáca Prof. Dr. Marco Vdott mvdott@ufpr.br 1 soluções eletrolítcas Qual a dferença entre uma solução 1,0 mol L -1 de glcose e outra de NaCl de mesma concentração?
INSTITUTO FEDERAL DE EDUCAÇÃO, CIÊNCIA E TECNOLOGIA DO RIO GRANDE DO NORTE IFRN Campus Mossoró. Equilíbrio Químico. Albino O.
 INSTITUTO FEDERAL DE EDUCAÇÃO, CIÊNCIA E TECNOLOGIA DO RIO GRANDE DO NORTE IFRN Campus Mossoró Equilíbrio Químico Albino O. Nunes SUMÁRIO OBJETIVOS; INTRODUÇÃO; DEFINIÇÃO; CONCEITOS BÁSICOS DE EQUILÍBRIO;
INSTITUTO FEDERAL DE EDUCAÇÃO, CIÊNCIA E TECNOLOGIA DO RIO GRANDE DO NORTE IFRN Campus Mossoró Equilíbrio Químico Albino O. Nunes SUMÁRIO OBJETIVOS; INTRODUÇÃO; DEFINIÇÃO; CONCEITOS BÁSICOS DE EQUILÍBRIO;
Energia, calor, entalpia e variação de entalpia.
 Combustíveis Energia e Ambiente De onde vem a energia dos combustíveis? Energia, calor, entalpia e variação de entalpia. Sistema; Universo; Sistema Aberto, Fechado e Isolado; Estado final e Inicial; Energia
Combustíveis Energia e Ambiente De onde vem a energia dos combustíveis? Energia, calor, entalpia e variação de entalpia. Sistema; Universo; Sistema Aberto, Fechado e Isolado; Estado final e Inicial; Energia
BCL Transformações Químicas
 Transformações Químicas ANDERSON ORZARI RIBEIRO Anderson.ribeiro@ufabc.edu.br Bloco B, 10º andar - Sala 1043 Transformações Químicas AULA 6 Energia Livre de Gibbs CAPÍTULO 6 e 7 Peter Atkins, Loretta Jones,
Transformações Químicas ANDERSON ORZARI RIBEIRO Anderson.ribeiro@ufabc.edu.br Bloco B, 10º andar - Sala 1043 Transformações Químicas AULA 6 Energia Livre de Gibbs CAPÍTULO 6 e 7 Peter Atkins, Loretta Jones,
Termodinâmica. Entalpia. Prof. Nelson Luiz Reyes Marques TERMODINÂMICA REVISÃO
 Termodinâmica Entalpia Prof. Nelson Luiz Reyes Marques Entalpia (H) Na solução de problemas envolvendo sistemas, certos produtos ou somas de propriedades ocorrem com regularidade. Uma combinação de propriedades
Termodinâmica Entalpia Prof. Nelson Luiz Reyes Marques Entalpia (H) Na solução de problemas envolvendo sistemas, certos produtos ou somas de propriedades ocorrem com regularidade. Uma combinação de propriedades
8 Soluções Não Ideais
 8 Soluções Não Ideas 8.1 Convenções para o coefcente de atvdade na escala de frações molares Para a solução deal temos ln x onde é função apenas da pressão e temperatura. Fo anterormente mostrado que todas
8 Soluções Não Ideas 8.1 Convenções para o coefcente de atvdade na escala de frações molares Para a solução deal temos ln x onde é função apenas da pressão e temperatura. Fo anterormente mostrado que todas
% Al 48 b) Alumínio que fica em solução. Precisamos calcular o equilíbrio da alumina com Al e O no aço:
 1a Verfcação Refno dos s I EEIMVR-UFF, Setembro de 11 Prova A 1. Calcule o valor de γ no ferro, a 17 o C, com os dados fornecdos na prova. Vmos em aula que o 1% G e o γ estão relaconados através de 1%
1a Verfcação Refno dos s I EEIMVR-UFF, Setembro de 11 Prova A 1. Calcule o valor de γ no ferro, a 17 o C, com os dados fornecdos na prova. Vmos em aula que o 1% G e o γ estão relaconados através de 1%
Física do Calor. Entropia II
 4300159 Física do Calor Entropia II Entropia, Processos Reversíveis e Irreversíveis Os processos naturais são irreversíveis. Apenas processos idealizados que ocorrem na condição de quase equilíbrio (processos
4300159 Física do Calor Entropia II Entropia, Processos Reversíveis e Irreversíveis Os processos naturais são irreversíveis. Apenas processos idealizados que ocorrem na condição de quase equilíbrio (processos
Ajuste de um modelo linear aos dados:
 Propagação de erros Suponhamos que se pretende determnar uma quantdade Z, a partr da medda drecta das grandezas A, B, C,, com as quas se relacona através de Z = f(a,b,c, ). Se os erros assocados a A, B,
Propagação de erros Suponhamos que se pretende determnar uma quantdade Z, a partr da medda drecta das grandezas A, B, C,, com as quas se relacona através de Z = f(a,b,c, ). Se os erros assocados a A, B,
A Primeira Lei da Termodinâmica. Energia. U = variação na energia de um sistema U = U final -U inicial
 Química Aplicada à Engenharia Civil Termodinâmica Química Continuação Profa. Geisamanda Pedrini Brandão Athayde Revisão Calor Sistema ganha calor Æ q > 0 Æ Processo Endotérmico Sistema perde calor Æ q
Química Aplicada à Engenharia Civil Termodinâmica Química Continuação Profa. Geisamanda Pedrini Brandão Athayde Revisão Calor Sistema ganha calor Æ q > 0 Æ Processo Endotérmico Sistema perde calor Æ q
Segunda e Terceira Lei da Termodinâmica Entropia Energia Livre de Gibbs
 Química Geral e Inorgânica QGI0001 Eng a. de Produção e Sistemas Prof a. Dr a. Carla Dalmolin Segunda e Terceira Lei da Termodinâmica Entropia Energia Livre de Gibbs Primeira Lei da Termodinâmica U = q
Química Geral e Inorgânica QGI0001 Eng a. de Produção e Sistemas Prof a. Dr a. Carla Dalmolin Segunda e Terceira Lei da Termodinâmica Entropia Energia Livre de Gibbs Primeira Lei da Termodinâmica U = q
TERMODINÂMICA (Parte 1)
 TERMODINÂMICA (Parte 1) Estudo das transformações da energia. Baseia-se em duas leis: 1ª Lei: acompanha as variações de energia e permite o cálculo da quantidade de calor produzida numa reação. 2ª Lei:
TERMODINÂMICA (Parte 1) Estudo das transformações da energia. Baseia-se em duas leis: 1ª Lei: acompanha as variações de energia e permite o cálculo da quantidade de calor produzida numa reação. 2ª Lei:
EQUILÍBRIO QUÍMICO Equilíbrio químico numa mistura:
 Equilíbrio químico numa mistura: Considere a seguinte reação: A + B C a) Se G mist < 0 reação expontânea (ocorre até atingir o equilíbrio G min ) b) Se G mist > 0 reação ocorre no sentido inverso. Para
Equilíbrio químico numa mistura: Considere a seguinte reação: A + B C a) Se G mist < 0 reação expontânea (ocorre até atingir o equilíbrio G min ) b) Se G mist > 0 reação ocorre no sentido inverso. Para
TERMODINÂMICA TERMOQUÍMICA
 TERMODINÂMICA TERMOQUÍMICA Termodinâmica é a ciência que estuda as transformações de energia nas quais as variações de temperatura são importantes. A maioria das transformações químicas resulta em alterações
TERMODINÂMICA TERMOQUÍMICA Termodinâmica é a ciência que estuda as transformações de energia nas quais as variações de temperatura são importantes. A maioria das transformações químicas resulta em alterações
Trabalho e calor. 1º Princípio da termodinâmica. Entalpia.
 Trabalho e calor. 1º Princípio da termodinâmica. Entalpia. 1. O volume de um gás aumenta de 2,0 L até 6,0 L a temperatura constante. Calcule o trabalho feito pelo gás se ele se expandir: a) contra o vácuo
Trabalho e calor. 1º Princípio da termodinâmica. Entalpia. 1. O volume de um gás aumenta de 2,0 L até 6,0 L a temperatura constante. Calcule o trabalho feito pelo gás se ele se expandir: a) contra o vácuo
Capítulo by Pearson Education
 QUÍMICA A Ciência Central 9ª Edição Termodinâmica química David P. White Processos espontâneos A termodinâmica está relacionada com a pergunta: uma reação pode ocorrer? A primeira lei de termodinâmica:
QUÍMICA A Ciência Central 9ª Edição Termodinâmica química David P. White Processos espontâneos A termodinâmica está relacionada com a pergunta: uma reação pode ocorrer? A primeira lei de termodinâmica:
Física 10 Questões [Difícil]
![Física 10 Questões [Difícil] Física 10 Questões [Difícil]](/thumbs/71/65281624.jpg) Físca Questões [Dfícl] - (UF MG) Um líqudo encontra-se, ncalmente, à temperatura T o, pressão P o e volume o, em um recpente fechado e solado termcamente do ambente, conforme lustra a fgura ao lado. Após
Físca Questões [Dfícl] - (UF MG) Um líqudo encontra-se, ncalmente, à temperatura T o, pressão P o e volume o, em um recpente fechado e solado termcamente do ambente, conforme lustra a fgura ao lado. Após
TERMODINÂMICA TERMOQUÍMICA
 TERMODINÂMICA TERMOQUÍMICA Termodinâmica é a ciência que estuda as transformações de energia nas quais as variações de temperatura são importantes. A maioria das transformações químicas resulta em alterações
TERMODINÂMICA TERMOQUÍMICA Termodinâmica é a ciência que estuda as transformações de energia nas quais as variações de temperatura são importantes. A maioria das transformações químicas resulta em alterações
Cap. 6 - Energia Potencial e Conservação da Energia Mecânica
 Unversdade Federal do Ro de Janero Insttuto de Físca Físca I IGM1 014/1 Cap. 6 - Energa Potencal e Conservação da Energa Mecânca Prof. Elvs Soares 1 Energa Potencal A energa potencal é o nome dado a forma
Unversdade Federal do Ro de Janero Insttuto de Físca Físca I IGM1 014/1 Cap. 6 - Energa Potencal e Conservação da Energa Mecânca Prof. Elvs Soares 1 Energa Potencal A energa potencal é o nome dado a forma
Parênteses termodinâmico
 Parênteses termodnâmco Lembrando de 1 dos lmtes de valdade da dstrbução de Maxwell-Boltzmann: λ
Parênteses termodnâmco Lembrando de 1 dos lmtes de valdade da dstrbução de Maxwell-Boltzmann: λ
Capítulo 24: Potencial Elétrico
 Capítulo 24: Potencal Energa Potencal Elétrca Potencal Superfíces Equpotencas Cálculo do Potencal a Partr do Campo Potencal Produzdo por uma Carga Pontual Potencal Produzdo por um Grupo de Cargas Pontuas
Capítulo 24: Potencal Energa Potencal Elétrca Potencal Superfíces Equpotencas Cálculo do Potencal a Partr do Campo Potencal Produzdo por uma Carga Pontual Potencal Produzdo por um Grupo de Cargas Pontuas
Entalpia. O trabalho realizado por esta reação é denominado trabalho de pressão-volume (trabalho PV)
 Entalpia As reações químicas podem absorver ou liberar calor e também podem provocar a realização de trabalho. Quando um gás é produzido, ele pode ser utilizado para empurrar um pistão: Zn(s) + 2H + (aq)
Entalpia As reações químicas podem absorver ou liberar calor e também podem provocar a realização de trabalho. Quando um gás é produzido, ele pode ser utilizado para empurrar um pistão: Zn(s) + 2H + (aq)
Física estatística. Termodinâmica: potenciais termodinâmicos e a 3 a lei MEFT, IST
 Física estatística Termodinâmica: potenciais termodinâmicos e a 3 a lei MEFT, IST Fourth Law of Thermodynamics: If the probability of success is not almost one, then it is damn near zero. David Ellis A
Física estatística Termodinâmica: potenciais termodinâmicos e a 3 a lei MEFT, IST Fourth Law of Thermodynamics: If the probability of success is not almost one, then it is damn near zero. David Ellis A
Transformações Físicas
 Físico-Química I Profa. Dra. Carla Dalmolin Transformações Físicas Transições de Fase de Substâncias Puras Diagrama de Fases Transformações Físicas Transformações onde não ocorrem mudança na composição
Físico-Química I Profa. Dra. Carla Dalmolin Transformações Físicas Transições de Fase de Substâncias Puras Diagrama de Fases Transformações Físicas Transformações onde não ocorrem mudança na composição
4 Sistemas de partículas
 4 Sstemas de partículas Nota: será feta a segunte convenção: uma letra em bold representa um vector,.e. b b Nesta secção estudaremos a generalzação das les de Newton a um sstema de váras partículas e as
4 Sstemas de partículas Nota: será feta a segunte convenção: uma letra em bold representa um vector,.e. b b Nesta secção estudaremos a generalzação das les de Newton a um sstema de váras partículas e as
CQ110 : Princípios de FQ
 CQ110 : Prncípos de FQ CQ 110 Prncípos de Físco Químca Curso: Farmáca Prof. Dr. Marco Vdott mvdott@ufpr.br Potencal químco, m potencal químco CQ110 : Prncípos de FQ Propredades termodnâmcas das soluções
CQ110 : Prncípos de FQ CQ 110 Prncípos de Físco Químca Curso: Farmáca Prof. Dr. Marco Vdott mvdott@ufpr.br Potencal químco, m potencal químco CQ110 : Prncípos de FQ Propredades termodnâmcas das soluções
Gabarito para a prova de 1º Ano e 8ª serie (atual 9º Ano)
 Gabarto para a prova de 1º Ano e 8ª sere (atual 9º Ano) 1. t t c F 5 3 9 ; t c 451 3 5 9 o ; tc 33 C ΔS. a) Δ t 5 s V 4, 1 mnuto possu 6 s, portanto, dos 5 s temos: 8 mnutos (equvale a 48 s) e sobram segundos.
Gabarto para a prova de 1º Ano e 8ª sere (atual 9º Ano) 1. t t c F 5 3 9 ; t c 451 3 5 9 o ; tc 33 C ΔS. a) Δ t 5 s V 4, 1 mnuto possu 6 s, portanto, dos 5 s temos: 8 mnutos (equvale a 48 s) e sobram segundos.
Expansão livre de um gás ideal
 Expansão lvre de um gás deal (processo não quase-estátco, logo, rreversível) W=0 na expansão lvre (P e = 0) Paredes adabátcas a separar o gás das vznhanças Q = 0 ª Le U gás = Q + W = 0 U = U Para um gás
Expansão lvre de um gás deal (processo não quase-estátco, logo, rreversível) W=0 na expansão lvre (P e = 0) Paredes adabátcas a separar o gás das vznhanças Q = 0 ª Le U gás = Q + W = 0 U = U Para um gás
Prova de Físico-Química
 CPF/PASSAPORTE: 1 PROCESSO DE SELEÇÃO E ADMISSÃO AO CURSO DE PARA O SEMESTRE 2017/02 EDITAL PPGQ Nº 002/2017 Prova de Físico-Química Instruções: 1) O candidato deverá identificar-se apenas com o número
CPF/PASSAPORTE: 1 PROCESSO DE SELEÇÃO E ADMISSÃO AO CURSO DE PARA O SEMESTRE 2017/02 EDITAL PPGQ Nº 002/2017 Prova de Físico-Química Instruções: 1) O candidato deverá identificar-se apenas com o número
Química II 2º Exame A 30 de Junho de ª Parte
 Química II 2º Exame A 30 de Junho de 2018 Nome nº MEQ MEBiol Sala Duração: 3h 1: 2: 3: 4: 5: 6: 7: 8: 9: 10: Total: Responda às perguntas 1 a 6 na folha do enunciado No fim do enunciado encontra todos
Química II 2º Exame A 30 de Junho de 2018 Nome nº MEQ MEBiol Sala Duração: 3h 1: 2: 3: 4: 5: 6: 7: 8: 9: 10: Total: Responda às perguntas 1 a 6 na folha do enunciado No fim do enunciado encontra todos
Físico-Química I. Profa. Dra. Carla Dalmolin. Termoquímica. Transformações físicas. Transformações químicas
 Físico-Química I Profa. Dra. Carla Dalmolin Termoquímica Transformações físicas Transformações químicas Termoquímica Estudo do calor trocado quando ocorrem reações químicas Sistema Sistema Vizinhança Se
Físico-Química I Profa. Dra. Carla Dalmolin Termoquímica Transformações físicas Transformações químicas Termoquímica Estudo do calor trocado quando ocorrem reações químicas Sistema Sistema Vizinhança Se
TERMODINÂMICA NO EQUILÍBRIO QUÍMICO 1
 TERMODINÂMICA NO EQUILÍBRIO QUÍMICO 1 1. Conceitos fundamentais A ciência da termodinâmica se originou do reconhecimento de que a transformação de calor e trabalho poderia ser prevista através de umas
TERMODINÂMICA NO EQUILÍBRIO QUÍMICO 1 1. Conceitos fundamentais A ciência da termodinâmica se originou do reconhecimento de que a transformação de calor e trabalho poderia ser prevista através de umas
( ) ( ) ( ) ( ) Algumas consequências do Primeiro Princípio. Método das misturas (utilizado para determinar calores específicos, em calorimetria)
 Método das msturas (utlzado para determnar calores especícos, em calormetra) Joseph lack (sec. XIII) ( ) ( ) ( ) ( ) W W W W ª Le aplcada a cada um dos subsstemas: No nteror de uma parede adabátca (calorímetro),
Método das msturas (utlzado para determnar calores especícos, em calormetra) Joseph lack (sec. XIII) ( ) ( ) ( ) ( ) W W W W ª Le aplcada a cada um dos subsstemas: No nteror de uma parede adabátca (calorímetro),
Transformações Físicas
 Físico-Química I Profa. Dra. Carla Dalmolin Transformações Físicas Transições de Fase de Substâncias Puras Diagrama de Fases Transformações Físicas Transformações onde não ocorrem mudança na composição
Físico-Química I Profa. Dra. Carla Dalmolin Transformações Físicas Transições de Fase de Substâncias Puras Diagrama de Fases Transformações Físicas Transformações onde não ocorrem mudança na composição
Química II 2º Exame B 30 de Junho de ª Parte
 Química II 2º Exame B 30 de Junho de 2018 Nome nº MEQ MEBiol Sala Duração: 3h 1: 2: 3: 4: 5: 6: 7: 8: 9: 10: SubTotal: Responda às perguntas 1 a 6 na folha do enunciado No fim do enunciado encontra todos
Química II 2º Exame B 30 de Junho de 2018 Nome nº MEQ MEBiol Sala Duração: 3h 1: 2: 3: 4: 5: 6: 7: 8: 9: 10: SubTotal: Responda às perguntas 1 a 6 na folha do enunciado No fim do enunciado encontra todos
Nome.. nº Sala... Duração : 1h 30m. Responder às perguntas 1, 2, 3 na folha do enunciado
 Química II 1º teste A 8 de Abril de 2015 Mestrado Integrado Eng. Química Mestrado Integrado Eng. Biológica Nome.. nº Sala... Duração : 1h 30m Responder às perguntas 1, 2, 3 na olha do enunciado 1A. Classiique
Química II 1º teste A 8 de Abril de 2015 Mestrado Integrado Eng. Química Mestrado Integrado Eng. Biológica Nome.. nº Sala... Duração : 1h 30m Responder às perguntas 1, 2, 3 na olha do enunciado 1A. Classiique
Equilíbrio Químico. Estágio da reação química em que não existe mais tendência a mudar a composição da mistura de uma reação
 Equilíbrio Químico 1 Equilíbrio Químico Estágio da reação química em que não existe mais tendência a mudar a composição da mistura de uma reação Equilíbrio dinâmico: as reações direta e inversa ocorrem
Equilíbrio Químico 1 Equilíbrio Químico Estágio da reação química em que não existe mais tendência a mudar a composição da mistura de uma reação Equilíbrio dinâmico: as reações direta e inversa ocorrem
Equação do Gás Ideal
 Capítulo 5 Gases Substâncias que Existem como Gases Pressão de um Gás Leis dos Gases Equação do Gás Ideal Estequiometria com Gases Lei de Dalton das Pressões Parciais Teoria Cinética Molecular dos Gases
Capítulo 5 Gases Substâncias que Existem como Gases Pressão de um Gás Leis dos Gases Equação do Gás Ideal Estequiometria com Gases Lei de Dalton das Pressões Parciais Teoria Cinética Molecular dos Gases
FIS01183 Turma C/CC Prova da área 2 07/05/2010. Nome: Matrícula: Explicite seu raciocínio e os cálculos realizados em cada passo!
 FIS8 urma C/CC rova da área 7/5/ Nome: Matrícula: Em todas as questões: Cudado com as undades! Explcte seu racocíno e os cálculos realzados em cada passo! BOA ROA! uestão - Laboratóro (, pontos) Na aula
FIS8 urma C/CC rova da área 7/5/ Nome: Matrícula: Em todas as questões: Cudado com as undades! Explcte seu racocíno e os cálculos realzados em cada passo! BOA ROA! uestão - Laboratóro (, pontos) Na aula
Problemas Propostos. Frações mássicas, volúmicas ou molares. Estequiometria.
 Elementos de Engenhara Químca I II. Frações e Estequometra (problemas resolvdos) Problemas Propostos. Frações másscas, volúmcas ou molares. Estequometra.. Em 5 moles de Benzeno (C 6 H 6 ) quanto é que
Elementos de Engenhara Químca I II. Frações e Estequometra (problemas resolvdos) Problemas Propostos. Frações másscas, volúmcas ou molares. Estequometra.. Em 5 moles de Benzeno (C 6 H 6 ) quanto é que
CAPITULO II - FORMULAÇAO MATEMATICA
 CAPITULO II - FORMULAÇAO MATEMATICA II.1. HIPOTESES BASICAS A modelagem aqu empregada está baseado nas seguntes hpóteses smplfcadoras : - Regme permanente; - Ausênca de forças de campo; - Ausênca de trabalho
CAPITULO II - FORMULAÇAO MATEMATICA II.1. HIPOTESES BASICAS A modelagem aqu empregada está baseado nas seguntes hpóteses smplfcadoras : - Regme permanente; - Ausênca de forças de campo; - Ausênca de trabalho
Físico-Química I. Profa. Dra. Carla Dalmolin. Misturas Simples. Físico-Química, cap. 5: Transformações Físicas de Substâncias Puras
 Físico-Química I Profa. Dra. Carla Dalmolin Misturas Simples Físico-Química, cap. 5: Transformações Físicas de Substâncias Puras Misturas Simples Misturas de substâncias que não reagem Modelo simples para
Físico-Química I Profa. Dra. Carla Dalmolin Misturas Simples Físico-Química, cap. 5: Transformações Físicas de Substâncias Puras Misturas Simples Misturas de substâncias que não reagem Modelo simples para
Física do Calor Licenciatura: 6ª Aula (19/08/2015)
 Físca do Calor Lcencatura: 6ª Aula (9/08/05) Pro. Alaro annucc mos, na últma aula: Se um gás sore uma transormação sotérmca, então o trabalho é calculado por: W F I Pd usando que P = KT: W n K T d W( T
Físca do Calor Lcencatura: 6ª Aula (9/08/05) Pro. Alaro annucc mos, na últma aula: Se um gás sore uma transormação sotérmca, então o trabalho é calculado por: W F I Pd usando que P = KT: W n K T d W( T
Físico-Química Farmácia 2014/02
 Físico-Química Farmácia 2014/02 1 2 Aspectos termodinâmicos das transições de fase A descrição termodinâmica das misturas Referência: Peter Atkins, Julio de Paula, Físico-Química Biológica 3 Condição de
Físico-Química Farmácia 2014/02 1 2 Aspectos termodinâmicos das transições de fase A descrição termodinâmica das misturas Referência: Peter Atkins, Julio de Paula, Físico-Química Biológica 3 Condição de
Instituto de Física. FEP112 - FÍSICA II para o Instituto Oceanográfico 1º Semestre de 2009
 .. Unersdade de São aulo Insttuto de Físca FE11 - FÍSIA II para o Insttuto Oceanográco 1º Semestre de 009 Qunta Lsta de Exercícos Temperatura, alor, 1ª Le da Termodnâmca e ropredades dos Gases 1) Um relógo
.. Unersdade de São aulo Insttuto de Físca FE11 - FÍSIA II para o Insttuto Oceanográco 1º Semestre de 009 Qunta Lsta de Exercícos Temperatura, alor, 1ª Le da Termodnâmca e ropredades dos Gases 1) Um relógo
CAPITULO 3 A Segunda lei da termodinâmica
 O objetivo deste capitulo é explicar a origem da espontaneidade das mudanças ísicas e quimicas. Procura mostrar que é possivel deinir, medir e usar uma propriedade, a entropia, na discussão quantitativa
O objetivo deste capitulo é explicar a origem da espontaneidade das mudanças ísicas e quimicas. Procura mostrar que é possivel deinir, medir e usar uma propriedade, a entropia, na discussão quantitativa
Conceitos Básicos. Lei zero da Termodinâmica. Termodinâmica. Primeira lei da Termodinâmica. Trabalho e Calor
 Conceitos Básicos Termodinâmica Lei zero da Termodinâmica Primeira lei da Termodinâmica Trabalho e Calor Calor sensível Essa medição irá nos informar a quantidade de calor (cal) que uma quantidade de massa
Conceitos Básicos Termodinâmica Lei zero da Termodinâmica Primeira lei da Termodinâmica Trabalho e Calor Calor sensível Essa medição irá nos informar a quantidade de calor (cal) que uma quantidade de massa
TERMODINÂMICA TERMOQUÍMICA
 Termodinâmica é a ciência que estuda as transformações de energia nas quais as variações de temperatura são importantes. A maioria das transformações químicas resulta em alterações nas temperaturas e,
Termodinâmica é a ciência que estuda as transformações de energia nas quais as variações de temperatura são importantes. A maioria das transformações químicas resulta em alterações nas temperaturas e,
Fundamentos da Termodinâmica
 1 Fundamentos da Termodinâmica Objetivos: Definição de sistema e vizinhança Compreender o trabalho P-V Compreender processos reversíveis e irreversíveis Definir a primeira Lei da termodinâmica Cálculo
1 Fundamentos da Termodinâmica Objetivos: Definição de sistema e vizinhança Compreender o trabalho P-V Compreender processos reversíveis e irreversíveis Definir a primeira Lei da termodinâmica Cálculo
Química Aplicada EQUILÍBRIO QUÍMICO
 Química Aplicada EQUILÍBRIO QUÍMICO Equilíbrio Químico Todas as reações tendem alcançar o equilíbrio químico Quando as velocidades das reações direta e inversa forem iguais e as concentrações dos reagentes
Química Aplicada EQUILÍBRIO QUÍMICO Equilíbrio Químico Todas as reações tendem alcançar o equilíbrio químico Quando as velocidades das reações direta e inversa forem iguais e as concentrações dos reagentes
Prova de Físico-Química
 CPF/PASSAPORTE: 1 PROCESSO DE SELEÇÃO E ADMISSÃO AO CURSO DE PARA O SEMESTRE 2017/01 EDITAL PPGQ Nº 002/2016 Prova de Físico-Química Instruções: 1) O candidato deverá identificar-se apenas com o número
CPF/PASSAPORTE: 1 PROCESSO DE SELEÇÃO E ADMISSÃO AO CURSO DE PARA O SEMESTRE 2017/01 EDITAL PPGQ Nº 002/2016 Prova de Físico-Química Instruções: 1) O candidato deverá identificar-se apenas com o número
Aula 8 Entropia e espontaneidade
 Universidade Tecnológica Federal do Paraná Departamento Acadêmico de Química e Biologia Aula 8 Entropia e espontaneidade Dr. Tiago P. Camargo Reações químicas e espontaneidade Ocorrer ou não ocorrer...
Universidade Tecnológica Federal do Paraná Departamento Acadêmico de Química e Biologia Aula 8 Entropia e espontaneidade Dr. Tiago P. Camargo Reações químicas e espontaneidade Ocorrer ou não ocorrer...
Disciplina de Química Geral Profa. Marcia Margarete Meier
 Processos espontâneos A termodinâmica está relacionada com a pergunta: uma reação pode ocorrer? 2 Al (s) + Fe 2 O 3 (s) Al 2 O 3 (s) + 2 Fe (s) H 2 (g) + 1/2O 2 (g) H 2 O(g) 2 2 2 A primeira lei de termodinâmica:
Processos espontâneos A termodinâmica está relacionada com a pergunta: uma reação pode ocorrer? 2 Al (s) + Fe 2 O 3 (s) Al 2 O 3 (s) + 2 Fe (s) H 2 (g) + 1/2O 2 (g) H 2 O(g) 2 2 2 A primeira lei de termodinâmica:
do Semi-Árido - UFERSA
 Unversdade Federal Rural do Sem-Árdo - UFERSA Temperatura e Calor Subêna Karne de Mederos Mossoró, Outubro de 2009 Defnção: A Termodnâmca explca as prncpas propredades damatéra e a correlação entre estas
Unversdade Federal Rural do Sem-Árdo - UFERSA Temperatura e Calor Subêna Karne de Mederos Mossoró, Outubro de 2009 Defnção: A Termodnâmca explca as prncpas propredades damatéra e a correlação entre estas
V.1. Introdução. Reações Químicas.
 V.1. Introdução. Reações Químcas. V. Balanços Materas a Processos com Reação Químca Uma equação químca acertada ornece muta normação. Por exemplo, a reação de síntese do metanol: CO (g) + 3H (g) CH 3 OH
V.1. Introdução. Reações Químcas. V. Balanços Materas a Processos com Reação Químca Uma equação químca acertada ornece muta normação. Por exemplo, a reação de síntese do metanol: CO (g) + 3H (g) CH 3 OH
F r. PASES 2 a ETAPA TRIÊNIO o DIA GAB. 1 5 FÍSICA QUESTÕES DE 11 A 20
 PSES 2 a ETP TRIÊNIO 2004-2006 1 o DI G. 1 5 FÍSI QUESTÕES DE 11 20 11. onsdere um sstema consttuído por duas partículas. Uma das partículas está ncalmente se movendo e colde nelastcamente com a outra
PSES 2 a ETP TRIÊNIO 2004-2006 1 o DI G. 1 5 FÍSI QUESTÕES DE 11 20 11. onsdere um sstema consttuído por duas partículas. Uma das partículas está ncalmente se movendo e colde nelastcamente com a outra
Segunda Lei da Termodinâmica, Entropia e Máquinas Térmicas Biblografia: Halliday, Resnick e Walker, vol 2, cap20 8 a Ed, vol2
 Segunda Lei da Termodinâmica, Entropia e Máquinas Térmicas Biblografia: Halliday, Resnick e Walker, vol 2, cap20 8 a Ed, vol2 O tempo tem um sentido, que é aquele no qual envelhecemos.! Na natureza, os
Segunda Lei da Termodinâmica, Entropia e Máquinas Térmicas Biblografia: Halliday, Resnick e Walker, vol 2, cap20 8 a Ed, vol2 O tempo tem um sentido, que é aquele no qual envelhecemos.! Na natureza, os
FUNÇÕES DE ESTADO TERMODINÂMICAS: ENTALPIA E ENERGIA LIVRE Parte 1
 FUNÇÕES DE ESTADO TERMODINÂMICAS: ENTALPIA E ENERGIA LIVRE Parte 1 [texto baseado nas seções 2.5 (a e b) e 2.7 de Physical Chemistry, P. Atkins e J. de Paula, Freeman 2006] Funções de estado termodinâmico
FUNÇÕES DE ESTADO TERMODINÂMICAS: ENTALPIA E ENERGIA LIVRE Parte 1 [texto baseado nas seções 2.5 (a e b) e 2.7 de Physical Chemistry, P. Atkins e J. de Paula, Freeman 2006] Funções de estado termodinâmico
03/Mar/2017 Aula 3. 01/Mar/2017 Aula 2
 01/Mar/2017 Aula 2 Teoria Cinética dos Gases Teoria Cinética e Equação dos Gases Ideais Gás Ideal num Campo Gravitacional Distribuição de Boltzmann; distribuição de velocidades de Maxwell e Boltzmann Velocidades
01/Mar/2017 Aula 2 Teoria Cinética dos Gases Teoria Cinética e Equação dos Gases Ideais Gás Ideal num Campo Gravitacional Distribuição de Boltzmann; distribuição de velocidades de Maxwell e Boltzmann Velocidades
MÓDULOS 37 E 38 QUÍMICA. Termodinâmica I e II. Ciências da Natureza, Matemática e suas Tecnologias. 1. Trabalho de expansão à pressão constante
 Ciências da Natureza, Matemática e suas Tecnologias QUÍMICA MÓDULOS 37 E 38 Termodinâmica I e II 1. Trabalho de expansão à pressão constante Vamos considerar um gás aprisionado em um cilindro com pistão
Ciências da Natureza, Matemática e suas Tecnologias QUÍMICA MÓDULOS 37 E 38 Termodinâmica I e II 1. Trabalho de expansão à pressão constante Vamos considerar um gás aprisionado em um cilindro com pistão

 Prof. Valdr Gumarães Físca para Engenhara FEP111 (4300111) 1º Semestre de 013 nsttuto de Físca- Unversdade de São Paulo Aula 8 Rotação, momento nérca e torque Professor: Valdr Gumarães E-mal: valdrg@f.usp.br
Prof. Valdr Gumarães Físca para Engenhara FEP111 (4300111) 1º Semestre de 013 nsttuto de Físca- Unversdade de São Paulo Aula 8 Rotação, momento nérca e torque Professor: Valdr Gumarães E-mal: valdrg@f.usp.br