ITA18 - Revisão LQUI9B - ITA Questão 1
|
|
|
- João Henrique Chaplin
- 5 Há anos
- Visualizações:
Transcrição
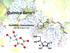
1 ITA18 - Revisão LQUI9B - ITA 2018 Questão 1 Aminoácidos são compostos orgânicos que contêm um grupo amina e um grupo carboxílico. Nos -aminoácidos, os dois grupos encontram-se nas extremidades da molécula e entre ele há um átomo de carbono, denominado carbono-, que também está ligado a um grupo R, conforme a figura. Considere os seguintes aminoácidos: Assinale a opção que contém o(s) aminoácidos(s) que possui(em) grupos(s) R polar(es) a) Alanina e Fenilalanina b) Asparagina e Glicina c) Asparagina e Serina d) Fenilalanina e) Glicina, Fenilalanina e Serina Questão 2 Considere as seguintes proposições a respeito dos valores, em módulo, da energia de orbitais atômicos 2s e 2p Das proposições acima, está(ão) CORRETA(S) a) Apenas I b) Apenas II c) Apenas III d) Apenas I e III e) Todas
2 Questão 3 (Ita 2018) Entre as substâncias e a) CBr 4 é a de maior ponto de ebulição. b) CH 2 Br 2 é mais volátil que o CH 2 Cl 2 c) CHBr 3 tem maior pressão de vapor que o CH 3 Cl d) CH 4 é a de maior força de interação intermolecular. e) quatro destas moléculas são apolares. Questão 4 (Ita 2018) Considere as proposições a seguir. I. O alceno C 6 H 12 apresenta cinco isômeros. II. Existem três diferentes compostos com a fórmula C 2 H 2 Cl 2 III. Existem quatro diferentes éteres com a fórmula C 4 H 10 O IV. O trimetilbenzeno tem três isômeros estruturais. Das proposições acima estão CORRETAS a) apenas I, II e IV. b) apenas I e III. c) apenas II, III e IV. d) apenas II e IV. e) todas. Questão 5 Um recipiente de 240 L de capacidade contém uma mistura dos gases ideais hidrogênio e dióxido de carbono, a 27 C. Sabendo que a pressão parcial do dióxido de carbono é três vezes menor que a pressão parcial do hidrogênio e que a pressão total da mistura gasosa é de 0,82 atm, assinale a alternativa que apresenta, respectivamente, as massas de hidrogênio e de dióxido de carbono contidas no recipiente. a) 2 g e 44 g. b) 6 g e 44 g. c) 8 g e 88 g. d) 12 g e 88 g. e) 16 g e 44 g. f) não sei. Questão 6 Deseja-se aquecer 586 g de água pura da temperatura ambiente até 91º C em pressão ambiente. Utilizando um forno de micro-
3 ondas convencional que emite radiação eletromagnética com frequência de 2,45 GHz e considerando a capacidade calorífica da água constante e igual a 4,18 J g -1 º C -1 assinale a alternativa que apresenta o número aproximado de fótons necessário para realizar este aquecimento. a) 3 x b) 4 x c) 1 x d) 5 x e) 2 x Questão 7 (Ita 2018) Considere um recipiente de 320 L ao qual são adicionados gases ideais nas seguintes condições: I. Hélio: 30,000 cm 3 a 760 cmhg e 27ºC II. Monóxido de carbono: 250 L a mmhg e -23º C III. Monóxido de nitrogênio: 2 m 3 a 0,273 atm e 0º C Sabendo que a pressão total da mistura gasosa é de 4,5 atm assinale a opção que apresenta a pressão parcial do hélio na mistura gasosa. a) 0,1 atm b) 0,2 atm c) 0,5 atm d) 1,0 atm e) 2,0 atm Questão 8 (Ita 2018) Dentre os processos químicos abaixo, assinale aquele que ocorre em uma única etapa elementar. a) Eletrólise do metanol b) Decomposição do peróxido de hidrogênio c) Fotodecomposição do ozônio d) Produção de água a partir de H 2 (g) e O 2 (g) e) Produção de cloreto de sódio a partir de Na(s) e Cl 2 (g) (Ita 2018) Considere as seguintes proposições: Questão 9 I. Massa crítica representa a massa mínima de um nuclídeo físsil em um determinado volume necessária para manter uma reação em cadeia. II. Reações nucleares em cadeia referem-se a processos nos quais elétrons liberados na fissão produzem nova fissão em, no mínimo, um outro núcleo.
4 III. Os núcleos de 226 Ra podem sofrer decaimentos radioativos consecutivos até atingirem a massa de 206 (chumbo), adquirindo estabilidade. Das proposições acima, está(ão) CORRETA(S) a) apenas I. b) apenas II c) apenas III. d) apenas I e II. e) apenas I e III. Questão 10 São feitas as seguintes proposições a respeito da produção de biocombustíveis: I. A hidrólise ácida de triacilgliceróis é a etapa final na produção do biodiesel. II. Etanol é comumente produzido por processo de fermentação, o qual gera CO 2 como subproduto. III. Na síntese do bioquerosene, podem ser utilizados ácidos graxos com cadeias lineares ou cíclicas, saturadas ou insaturadas. Das proposições acima, está(ão) CORRETA(S) a) apenas I. b) apenas II. c) apenas III. d) apenas I e II. e) apenas II e III. (Ita 2018) Considere as seguintes proposições: Questão 11 I. A propriedade básica associada ao fracionamento do petróleo é o ponto de ebulição. II. Em geral, no craqueamento térmico do petróleo ocorre formação de radicais livres por meio da quebra de ligação homolítica, enquanto que no craqueamento catalítico ocorre a ruptura heterolítica. III. Metano não é produzido na destilação fracionada do petróleo. IV. Indústria petroquímica é o termo utilizado para designar o ramo da indústria química que utiliza derivados de petróleo como matéria-prima para a fabricação de novos materiais, como medicamentos,fertilizantes e explosivos. V. Os rendimentos de derivados diretos do petróleo no processo de destilação fracionada não dependem do tipo de petróleo utilizado. Das proposições acima são CORRETAS a) apenas I, II e IV. b) apenas I, III, IV e V. c) apenas I, III e V. d) apenas II, IV e V.
5 e) todas. Questão 12 (Ita 2018) O composto 3,3-dimetil-1-penteno reage com água em meio ácido e na ausência de peróxidos, formando um composto X que, a seguir, é oxidado para formar um composto Y. Os compostos X e Y formados preferencialmente são, respectivamente, a) um álcool e um éster. b) um álcool e uma cetona. c) um aldeído e um ácido carboxílico. d) uma cetona e um aldeído. e) uma cetona e um éster. Questão 13 (Ita 2018) Um recipiente de paredes adiabáticas e de volume constante contém duas amostras de água pura separadas por uma parede também adiabática e de volume desprezível. Uma das amostras consiste em 54 g de água a 25ºC e, a outra, em 126 g a 75º C Considere que a parede que separa as amostras é retirada e que as amostras de água se misturam até atingir o equilíbrio. Sobre esse processo são feitas as seguintes afirmações: I. A temperatura da mistura no equilíbrio é de 323 K II. A variação de entalpia no processo é nula. III. A variação de energia interna no processo é nula. IV. A variação de entropia no processo é nula. Assinale a opção que apresenta a(s) afirmação(ões) CORRETA(S) sobre a mistura das amostras de água. a) Apenas I b) Apenas I e II c) Apenas II e III d) Apenas III e IV e) Apenas IV Questão 14 (Ita 2018) São feitas as seguintes proposições a respeito de propriedades coligativas: I. A pressão osmótica depende do tipo de solvente para um dado soluto. II. A criometria usa o abaixamento do ponto de congelamento do solvente para medir a massa molar do soluto. III. Na ebuliometria, a variação da temperatura de ebulição depende da concentração molal de soluto não volátil utilizado. IV. Na tonometria, ocorre abaixamento da pressão de vapor de uma solução que contém um soluto não volátil, em relação ao solvente puro.
6 Das proposições acima é(são) CORRETA(S) a) apenas I. b) apenas I e III c) apenas II, III e IV. d) apenas II e IV. e) todas. Questão 15 Em temperatura ambiente, adicionou-se uma porção de ácido clorídrico 6 mol L 1 a uma solução aquosa contendo os íons metálicos Co 2+ ; Cu 2+ ; Hg 2 2+ e Pb 2+ ; Assinale a opção que apresenta os íons metálicos que não foram precipitados. a) Co 2+ e Cu 2+ b) Co 2+ e Hg 2 2+ c) Cu 2+ e Hg 2 2+ d) Cu 2+ e Pb 2+ e) Hg 2 2+ e Pb 2+ Questão 16 (Ita 2018) Considere dadas as constantes de dissociação ácida (K a ) ou básica (K b ) das seguintes substâncias, a 25ºC fenol (C 6 H 5 OH), K a = 1x e anilina (C 6 H 5 NH 2 ), K b = 7 x Sobre o ph de soluções aquosas dessas substâncias são feitas as seguintes afirmações: I. A solução aquosa de fenol a 1 x 10-4 tem ph < 5 II. A solução aquosa de anilina a 1 x 10-4 tem ph > 9 III. Ambas as soluções aquosas a 1 x 10-4 têm ph aproximadamente iguais. Das afirmações acima está(ão) CORRETA(S) a) apenas I. b) apenas I e II. c) apenas II. d) apenas II e III. e) apenas III. Questão 17
7 (Ita 2018) Sobre indicadores de ph, é ERRADO afirmar que a) são ácidos ou bases fracas. b) em solução aquosa são usados como tampão. c) geralmente possuem anéis aromáticos em sua estrutura molecular. d) devem apresentar mínima interferência no sistema químico de interesse. e) respondem à presença de íons hidrogênio em solução aquosa por deslocamento de equilíbrio entre as formas associada e ionizada. Questão 18 (Ita 2018) Considere as seguintes semirreações de oxirredução e seus respectivos potenciais padrão na escala do eletrodo padrão de hidrogênio (EPH) Assinale a opção que apresenta a afirmação ERRADA sobre uma célula eletroquímica em que a semirreação I ocorre no anodo e a semirreação II, no catodo. a) A reação global é exotérmica b) Trata-se de uma célula a combustível. c) O potencial padrão da célula é de 1,144 V d) O trabalho máximo que pode ser obtido é, em módulo, de KJ por mol de etanol. e) A célula converte energia livre da reação de combustão do etanol em trabalho elétrico. Questão 19 (Ita 2018) O perclorato de amônio (PA) é um dos componentes mais utilizados em propelentes de foguetes. Para aperfeiçoar seu desempenho, hidrogênio pode ser utilizado como aditivo. Considere dadas as entalpias de combustão destas espécies: Com base nessas informações, assinale a opção que apresenta a equação linear da variação da entalpia de combustão da mistura de PA com H 2 em função da quantidade de H 2 a) y = -0,48x b) y = -0,48x c) y = -0,48x d) y = -0,97x e) y = -0,97x - 208
8 Questão 20 (Ita 2018) Um dado material sólido em equilíbrio térmico emite radiação semelhante a de um corpo negro. Assinale a opção que apresenta a curva que expressa a relação experimental CORRETA entre o comprimento de onda do máximo de emissão e a temperatura desse material. a) b) c) d) e)
E ( ) Glicina, Fenilalanina e Serina CONSTANTES DEFINIÇÕES MASSAS MOLARES. Massa Molar (g mol"1) Químico Atômico. Massa Molar (g mol1)
 CONSTANTES Constante de Avogadro (NA) Constante de Faraday (F) Volume molar de gás ideal Carga elementar Constante dos gases (R) Constante gravitacional (g) Constante de Planck (h) Velocidade da luz no
CONSTANTES Constante de Avogadro (NA) Constante de Faraday (F) Volume molar de gás ideal Carga elementar Constante dos gases (R) Constante gravitacional (g) Constante de Planck (h) Velocidade da luz no
PSVS/UFES 2014 MATEMÁTICA 1ª QUESTÃO. O valor do limite 2ª QUESTÃO. O domínio da função real definida por 3ª QUESTÃO
 MATEMÁTICA 1ª QUESTÃO O valor do limite 3 x 8 lim é x 2 x 2 2ª QUESTÃO O domínio da função real definida por é 3ª QUESTÃO A imagem da função real definida por, para todo, é GRUPO 2 PROVA DE MATEMÁTICA
MATEMÁTICA 1ª QUESTÃO O valor do limite 3 x 8 lim é x 2 x 2 2ª QUESTÃO O domínio da função real definida por é 3ª QUESTÃO A imagem da função real definida por, para todo, é GRUPO 2 PROVA DE MATEMÁTICA
DEFINIÇÕES MASSAS MOLARES. Número Atômico. Massa Molar (g mol -1 ) Elemento Químico
 CONSTANTES Constante de Avogadro (NA) = 6,0 x 10 3 mol -1 Constante de Faraday (F) = 9,65 x 10 4 C mol -1 = 9,65 x 10 4 A s mol -1 = 9,65 x 10 4 J V -1 mol -1 Volume molar de gás ideal =,4 L (CNTP) Carga
CONSTANTES Constante de Avogadro (NA) = 6,0 x 10 3 mol -1 Constante de Faraday (F) = 9,65 x 10 4 C mol -1 = 9,65 x 10 4 A s mol -1 = 9,65 x 10 4 J V -1 mol -1 Volume molar de gás ideal =,4 L (CNTP) Carga
Escola Secundária de Alcácer do Sal Química 12º ano teste 3 17/02/2004
 Escola Secundária de Alcácer do Sal Química 12º ano teste 3 17/02/2004 I Escreva na sua folha de respostas a letra correspondente à alternativa correcta que seleccionar para cada item. A indicação de mais
Escola Secundária de Alcácer do Sal Química 12º ano teste 3 17/02/2004 I Escreva na sua folha de respostas a letra correspondente à alternativa correcta que seleccionar para cada item. A indicação de mais
Escola Secundária de Alcácer do Sal Química 12º ano teste 5 25/05/2004
 Escola Secundária de Alcácer do Sal Química 12º ano teste 5 25/05/2004 I Escreva na sua folha de respostas a letra correspondente à alternativa correcta que seleccionar para cada item. A indicação de mais
Escola Secundária de Alcácer do Sal Química 12º ano teste 5 25/05/2004 I Escreva na sua folha de respostas a letra correspondente à alternativa correcta que seleccionar para cada item. A indicação de mais
Curso Preparatório para o Ingresso no Ensino Superior (Pré-Vestibular)
 Curso Preparatório para o Ingresso no Ensino Superior (Pré-Vestibular) Os conteúdos conceituais de Química estão distribuídos em 5 frentes. Química Extensivo A)Meio ambiente; estrutura atômica; Classificação
Curso Preparatório para o Ingresso no Ensino Superior (Pré-Vestibular) Os conteúdos conceituais de Química estão distribuídos em 5 frentes. Química Extensivo A)Meio ambiente; estrutura atômica; Classificação
Fuvest 2009 (Questão 1 a 8)
 (Questão 1 a 8) 1. Água pode ser eletrolisada com a finalidade de se demonstrar sua composição. A figura representa uma aparelhagem em que foi feita a eletrólise da água, usando eletrodos inertes de platina.
(Questão 1 a 8) 1. Água pode ser eletrolisada com a finalidade de se demonstrar sua composição. A figura representa uma aparelhagem em que foi feita a eletrólise da água, usando eletrodos inertes de platina.
QUÍMICA PRIMEIRA ETAPA
 QUÍMICA PRIMEIRA ETAPA - 1998 QUESTÃO 01 Uma mistura de hidrogênio, H 2 (g), e oxigênio, O 2 (g), reage, num recipiente hermeticamente fechado, em alta temperatura e em presença de um catalisador, produzindo
QUÍMICA PRIMEIRA ETAPA - 1998 QUESTÃO 01 Uma mistura de hidrogênio, H 2 (g), e oxigênio, O 2 (g), reage, num recipiente hermeticamente fechado, em alta temperatura e em presença de um catalisador, produzindo
PROVA DE QUÍMICA. Tendo em vista as propriedades coligativas dessas soluções, é CORRETO afirmar
 17 PROVA DE QUÍMICA Q U E S T Ã O 2 6 Z e X são elementos químicos que apresentam respectivamente 2 e 6 elétrons no nível de valência. A fórmula química resultante da combinação entre átomos dos elementos
17 PROVA DE QUÍMICA Q U E S T Ã O 2 6 Z e X são elementos químicos que apresentam respectivamente 2 e 6 elétrons no nível de valência. A fórmula química resultante da combinação entre átomos dos elementos
PROVA 3 conhecimentos específicos
 PROVA 3 conhecimentos específicos Química QUESTÕES OBJETIVAS QUESTÕES APLICADAS A TODOS OS CANDIDATOS QUE REALIZARAM A PROVA ESPECÍFICA DE química. UEM Comissão Central do Vestibular Unificado GABARITO
PROVA 3 conhecimentos específicos Química QUESTÕES OBJETIVAS QUESTÕES APLICADAS A TODOS OS CANDIDATOS QUE REALIZARAM A PROVA ESPECÍFICA DE química. UEM Comissão Central do Vestibular Unificado GABARITO
PROVA 3 conhecimentos específicos
 PROVA 3 conhecimentos específicos QUÍMICA QUESTÕES OBJETIVAS QUESTÕES APLICADAS A TODOS OS CANDIDATOS QUE REALIZARAM A PROVA ESPECÍFICA DE QUÍMICA. UEM Comissão Central do Vestibular Unificado GABARITO
PROVA 3 conhecimentos específicos QUÍMICA QUESTÕES OBJETIVAS QUESTÕES APLICADAS A TODOS OS CANDIDATOS QUE REALIZARAM A PROVA ESPECÍFICA DE QUÍMICA. UEM Comissão Central do Vestibular Unificado GABARITO
PROVA 3 conhecimentos específicos
 PROVA 3 conhecimentos específicos QUÍMICA QUESTÕES OBJETIVAS QUESTÕES APLICADAS A TODOS OS CANDIDATOS QUE REALIZARAM A PROVA ESPECÍFICA DE QUÍMICA. UEM Comissão Central do Vestibular Unificado GABARITO
PROVA 3 conhecimentos específicos QUÍMICA QUESTÕES OBJETIVAS QUESTÕES APLICADAS A TODOS OS CANDIDATOS QUE REALIZARAM A PROVA ESPECÍFICA DE QUÍMICA. UEM Comissão Central do Vestibular Unificado GABARITO
01 O chumbo participa da composição de diversas ligas metálicas. No bronze arquitetônico, por
 01 O chumbo participa da composição de diversas ligas metálicas. No bronze arquitetônico, por exemplo, o teor de chumbo corresponde a 4,14% em massa da liga. Seu isótopo radioativo 210 Pb decai pela emissão
01 O chumbo participa da composição de diversas ligas metálicas. No bronze arquitetônico, por exemplo, o teor de chumbo corresponde a 4,14% em massa da liga. Seu isótopo radioativo 210 Pb decai pela emissão
UNIVERSIDADE DO ESTADO DO RIO DE JANEIRO INSTITUTO DE QUÍMICA PROGRAMA DE PÓS-GRADUAÇÃO EM QUÍMICA PROVA DE SELEÇÃO/2011 DO CURSO DE MESTRADO
 UNIVERSIDADE DO ESTADO DO RIO DE JANEIRO INSTITUTO DE QUÍMICA PROGRAMA DE PÓS-GRADUAÇÃO EM QUÍMICA PROVA DE SELEÇÃO/2011 DO CURSO DE MESTRADO 08/11/2010 PROVA ESCRITA Assinatura do candidato: Área de concentração:
UNIVERSIDADE DO ESTADO DO RIO DE JANEIRO INSTITUTO DE QUÍMICA PROGRAMA DE PÓS-GRADUAÇÃO EM QUÍMICA PROVA DE SELEÇÃO/2011 DO CURSO DE MESTRADO 08/11/2010 PROVA ESCRITA Assinatura do candidato: Área de concentração:
1 a Questão: Valor : 1,0 FOLHA DE DADOS. I ) Entalpias de Formação (H o f ) H 2. O (líquida) = - 68,3 kcal / mol. CO 2 (gasoso) = - 94,1 kcal / mol
 PROVA DE QUÍMICA DO VESTIBULAR 96/97 DO INSTITUTO MILITAR DE ENGENHARIA (04/12/96) FOLHA DE DADOS I ) Entalpias de Formação (H o f ) H 2 O (líquida) = - 68,3 kcal / mol CO 2 (gasoso) = - 94,1 kcal / mol
PROVA DE QUÍMICA DO VESTIBULAR 96/97 DO INSTITUTO MILITAR DE ENGENHARIA (04/12/96) FOLHA DE DADOS I ) Entalpias de Formação (H o f ) H 2 O (líquida) = - 68,3 kcal / mol CO 2 (gasoso) = - 94,1 kcal / mol
UFSC. Química (Amarela) Resposta: = 05
 Resposta: 01 + 04 = 05 01. Correto. Apresenta carboxila e grupamento amino no carbono alfa. 02. Incorreto. Com a elevação do ph ocorre a desprotonação da carboxila formando carga negativa. 04. Correto.
Resposta: 01 + 04 = 05 01. Correto. Apresenta carboxila e grupamento amino no carbono alfa. 02. Incorreto. Com a elevação do ph ocorre a desprotonação da carboxila formando carga negativa. 04. Correto.
UNIVERSIDADE ESTADUAL DO SUDOESTE DA BAHIA PROGRAMA DE PÓS-GRADUAÇÃO EM QUÍMICA EXAME GERAL EM QUÍMICA EDITAL N 002/2017
 UNIVERSIDADE ESTADUAL DO SUDOESTE DA BAHIA PROGRAMA DE PÓS-GRADUAÇÃO EM QUÍMICA EXAME GERAL EM QUÍMICA EDITAL N 002/2017 Seleção para o 1º Semestre de 2017 14 de Fevereiro de 2017 CADERNO DE QUESTÕES Tempo
UNIVERSIDADE ESTADUAL DO SUDOESTE DA BAHIA PROGRAMA DE PÓS-GRADUAÇÃO EM QUÍMICA EXAME GERAL EM QUÍMICA EDITAL N 002/2017 Seleção para o 1º Semestre de 2017 14 de Fevereiro de 2017 CADERNO DE QUESTÕES Tempo
X EXAME Questões Objetivas. RESPONDA AS QUESTÕES DE 1 a 30, MARCANDO UMA DAS ALTERNATIVAS DE ACORDO COM O QUE SE PEDE.
 Questões bjetivas RESPNDA AS QUESTÕES DE 1 a 30, MARCAND UMA DAS ALTERNATIVAS DE ACRD CM QUE SE PEDE. Questão 01 (Peso 1) A partícula formadora da substância água é a molécula H 2. Sobre essa substância
Questões bjetivas RESPNDA AS QUESTÕES DE 1 a 30, MARCAND UMA DAS ALTERNATIVAS DE ACRD CM QUE SE PEDE. Questão 01 (Peso 1) A partícula formadora da substância água é a molécula H 2. Sobre essa substância
Vestibular UFRGS 2013 Resolução da Prova de Química
 Vestibular UFRGS 2013 Resolução da Prova de Química 26. Alternativa (B) Somente os fenômenos químicos constituem uma Reação Química, portanto: I fenômeno físico. II fenômeno químico III fenômeno físico
Vestibular UFRGS 2013 Resolução da Prova de Química 26. Alternativa (B) Somente os fenômenos químicos constituem uma Reação Química, portanto: I fenômeno físico. II fenômeno químico III fenômeno físico
COVEST/UFPE ª ETAPA
 COVEST/UFPE 2000 2ª ETAPA. A partir das entalpias padrão das reações de oxidação do ferro dadas abaixo: determine a quantidade de calor liberada a 298K e 1 atm na reação:. Iguais volumes de amônia e cloreto
COVEST/UFPE 2000 2ª ETAPA. A partir das entalpias padrão das reações de oxidação do ferro dadas abaixo: determine a quantidade de calor liberada a 298K e 1 atm na reação:. Iguais volumes de amônia e cloreto
COVEST/UFPE ª ETAPA
 COVEST/UFPE 2004 2ª ETAPA 81. Ao longo da história, diversos modelos atômicos foram propostos até chegarmos ao modelo atual. Com relação ao modelo atômico de Rutherford, podemos afirmar que: 0 0 foi baseado
COVEST/UFPE 2004 2ª ETAPA 81. Ao longo da história, diversos modelos atômicos foram propostos até chegarmos ao modelo atual. Com relação ao modelo atômico de Rutherford, podemos afirmar que: 0 0 foi baseado
CO2, CO, H2O, NO, SO2
 Q U Í M I C A 01- A figura a seguir representa, esquematicamente, estruturas de diferentes substâncias, participando de quatro reações de síntese não balanceadas, nas condições ideais para que elas ocorram.
Q U Í M I C A 01- A figura a seguir representa, esquematicamente, estruturas de diferentes substâncias, participando de quatro reações de síntese não balanceadas, nas condições ideais para que elas ocorram.
Prova 3 Química QUESTÕES APLICADAS A TODOS OS CANDIDATOS QUE REALIZARAM A PROVA ESPECÍFICA DE QUÍMICA. QUESTÕES OBJETIVAS GABARITO 3
 Prova 3 QUESTÕES OBJETIVAS QUESTÕES APLICADAS A TODOS OS CANDIDATOS QUE REALIZARAM A PROVA ESPECÍFICA DE QUÍMICA. UEM Comissão Central do Vestibular Unificado QUÍMICA 01 Assinale a alternativa correta.
Prova 3 QUESTÕES OBJETIVAS QUESTÕES APLICADAS A TODOS OS CANDIDATOS QUE REALIZARAM A PROVA ESPECÍFICA DE QUÍMICA. UEM Comissão Central do Vestibular Unificado QUÍMICA 01 Assinale a alternativa correta.
VII Olimpíada Catarinense de Química Etapa I - Colégios
 VII Olimpíada Catarinense de Química 2011 Etapa I - Colégios Fonte: Chemistryland Terceira Série Conselho Regional de Química CRQ III 1 01 200 ml de uma solução de hidróxido de alumínio são diluídos em
VII Olimpíada Catarinense de Química 2011 Etapa I - Colégios Fonte: Chemistryland Terceira Série Conselho Regional de Química CRQ III 1 01 200 ml de uma solução de hidróxido de alumínio são diluídos em
Prova 3 Química QUESTÕES APLICADAS A TODOS OS CANDIDATOS QUE REALIZARAM A PROVA ESPECÍFICA DE QUÍMICA. QUESTÕES OBJETIVAS GABARITO 4
 Prova 3 QUESTÕES OBJETIVAS QUESTÕES APLICADAS A TODOS OS CANDIDATOS QUE REALIZARAM A PROVA ESPECÍFICA DE QUÍMICA. UEM Comissão Central do Vestibular Unificado QUÍMICA 01 Assinale a alternativa incorreta.
Prova 3 QUESTÕES OBJETIVAS QUESTÕES APLICADAS A TODOS OS CANDIDATOS QUE REALIZARAM A PROVA ESPECÍFICA DE QUÍMICA. UEM Comissão Central do Vestibular Unificado QUÍMICA 01 Assinale a alternativa incorreta.
Prova 3 Química QUESTÕES APLICADAS A TODOS OS CANDIDATOS QUE REALIZARAM A PROVA ESPECÍFICA DE QUÍMICA. QUESTÕES OBJETIVAS GABARITO 1
 Prova 3 QUESTÕES OBJETIVAS QUESTÕES APLICADAS A TODOS OS CANDIDATOS QUE REALIZARAM A PROVA ESPECÍFICA DE QUÍMICA. UEM Comissão Central do Vestibular Unificado QUÍMICA 01 A quantidade de Na 2 CO 3.10H 2
Prova 3 QUESTÕES OBJETIVAS QUESTÕES APLICADAS A TODOS OS CANDIDATOS QUE REALIZARAM A PROVA ESPECÍFICA DE QUÍMICA. UEM Comissão Central do Vestibular Unificado QUÍMICA 01 A quantidade de Na 2 CO 3.10H 2
Prova 3 Química QUESTÕES APLICADAS A TODOS OS CANDIDATOS QUE REALIZARAM A PROVA ESPECÍFICA DE QUÍMICA. QUESTÕES OBJETIVAS GABARITO 2
 Prova 3 QUESTÕES OBJETIVAS QUESTÕES APLICADAS A TODOS OS CANDIDATOS QUE REALIZARAM A PROVA ESPECÍFICA DE QUÍMICA. UEM Comissão Central do Vestibular Unificado QUÍMICA 01 Considere que, a 25 o C, temos
Prova 3 QUESTÕES OBJETIVAS QUESTÕES APLICADAS A TODOS OS CANDIDATOS QUE REALIZARAM A PROVA ESPECÍFICA DE QUÍMICA. UEM Comissão Central do Vestibular Unificado QUÍMICA 01 Considere que, a 25 o C, temos
QUÍMICA. em 100mL dessa solução.
 QUÍMICA 36. Essa questão trata sobre soluções aquosas e as diferentes formas de expressar suas concentrações. Trata ainda de suas propriedades e das reações que podem ocorrer entre elas. 0 0 A concentração
QUÍMICA 36. Essa questão trata sobre soluções aquosas e as diferentes formas de expressar suas concentrações. Trata ainda de suas propriedades e das reações que podem ocorrer entre elas. 0 0 A concentração
com o oxigênio, formando o trióxido de enxofre (SO 3 ), e deste com a água, resultando no H 2
 11 Em 2004 iniciou-se, no Brasil, a exploração de uma importante jazida de minério de cobre. Nestes minérios, o metal é normalmente encontrado na forma de sulfetos, como o CuS, e para sua obtenção o minério
11 Em 2004 iniciou-se, no Brasil, a exploração de uma importante jazida de minério de cobre. Nestes minérios, o metal é normalmente encontrado na forma de sulfetos, como o CuS, e para sua obtenção o minério
FUVEST Segunda Fase. Química 06/01/2003
 FUVEST 2003 Segunda Fase Química 06/01/2003 Q.01 Em 1861, o pesquisador Kekulé e o professor secundário Loschmidt apresentaram, em seus escritos, as seguintes fórmulas estruturais para o ácido acético
FUVEST 2003 Segunda Fase Química 06/01/2003 Q.01 Em 1861, o pesquisador Kekulé e o professor secundário Loschmidt apresentaram, em seus escritos, as seguintes fórmulas estruturais para o ácido acético
Sumário PREFÁCIO...13
 Sumário PREFÁCIO...13 CAPÍTULO 1 Operações com Grandezas e Unidades de Medida...17 Objetivos...17 1.1 Notação científica...18 1.2 Exponenciais e logaritmos...19 1.3 Grandezas físicas e unidades de medida:
Sumário PREFÁCIO...13 CAPÍTULO 1 Operações com Grandezas e Unidades de Medida...17 Objetivos...17 1.1 Notação científica...18 1.2 Exponenciais e logaritmos...19 1.3 Grandezas físicas e unidades de medida:
QUÍMICA. UFBA 99 2ª etapa Quím. 12
 QUÍMICA UFBA 99 2ª etapa Quím. 12 QUESTÕES DE 11 A 20 QUESTÕES DE 11 A 18 INSTRUÇÃO: Assinale as proposições verdadeiras, some os números a elas associados e marque o resultado na Folha de Respostas. Questão
QUÍMICA UFBA 99 2ª etapa Quím. 12 QUESTÕES DE 11 A 20 QUESTÕES DE 11 A 18 INSTRUÇÃO: Assinale as proposições verdadeiras, some os números a elas associados e marque o resultado na Folha de Respostas. Questão
PROVA 3 conhecimentos específicos
 PROVA 3 conhecimentos específicos QUÍMICA QUESTÕES OBJETIVAS QUESTÕES APLICADAS A TODOS OS CANDIDATOS QUE REALIZARAM A PROVA ESPECÍFICA DE QUÍMICA. UEM Comissão Central do Vestibular Unificado GABARITO
PROVA 3 conhecimentos específicos QUÍMICA QUESTÕES OBJETIVAS QUESTÕES APLICADAS A TODOS OS CANDIDATOS QUE REALIZARAM A PROVA ESPECÍFICA DE QUÍMICA. UEM Comissão Central do Vestibular Unificado GABARITO
Observe o gráfico, cujas curvas representam as variações das massas desses radioisótopos ao longo das duas horas de duração do experimento.
 Revisão Específicas 1. (UERJ 2015) Os preços dos metais para reciclagem variam em função da resistência de cada um à corrosão: quanto menor a tendência do metal à oxidação, maior será o preço. Na tabela,
Revisão Específicas 1. (UERJ 2015) Os preços dos metais para reciclagem variam em função da resistência de cada um à corrosão: quanto menor a tendência do metal à oxidação, maior será o preço. Na tabela,
COVEST/UFPE ª FASE
 CVEST/UFPE 2006 1ª FASE 33. s elementos químicos conhecidos foram, em sua maioria, sintetizados através de processos nucleares que ocorrem em estrelas. Um exemplo está mostrado na seqüência de reações
CVEST/UFPE 2006 1ª FASE 33. s elementos químicos conhecidos foram, em sua maioria, sintetizados através de processos nucleares que ocorrem em estrelas. Um exemplo está mostrado na seqüência de reações
Questões Objetivas. RESPONDA AS QUESTÕES DE 1 a 30, MARCANDO UMA DAS ALTERNATIVAS DE ACORDO COM O QUE SE PEDE.
 6ª EXAME 2011 Questões Objetivas RESPONDA AS QUESTÕES DE 1 a 30, MARCANDO UMA DAS ALTERNATIVAS DE ACORDO COM O QUE SE PEDE. Questão 01. (Peso 2) A dissolução do cloreto de amônio, NH 4 Cl(s), em água ocorre
6ª EXAME 2011 Questões Objetivas RESPONDA AS QUESTÕES DE 1 a 30, MARCANDO UMA DAS ALTERNATIVAS DE ACORDO COM O QUE SE PEDE. Questão 01. (Peso 2) A dissolução do cloreto de amônio, NH 4 Cl(s), em água ocorre
Professora Sonia ITA 2018 CONSTANTES DEFINIÇÕES
 onstante de Avogadro = 1 6,0 10 mol ITA 018 ONSTANTES 4 1 4 1 4 1 1 onstante de Faraday (F) = 9,65 10. mol 9,65 10 A. s. mol 9,65 10 J. V. mol Volume molar de gás ideal =,4 L (NTP) 19 arga elementar =
onstante de Avogadro = 1 6,0 10 mol ITA 018 ONSTANTES 4 1 4 1 4 1 1 onstante de Faraday (F) = 9,65 10. mol 9,65 10 A. s. mol 9,65 10 J. V. mol Volume molar de gás ideal =,4 L (NTP) 19 arga elementar =
PROVA DE QUÍMICA 44 PROVA DE QUÍMICA
 44 QUESTÃO 46 1 Uma certa quantidade de água é colocada em um congelador, cuja temperatura é de 20 o C. Após estar formado e em equilíbrio térmico com o congelador, o gelo é transferido para outro congelador,
44 QUESTÃO 46 1 Uma certa quantidade de água é colocada em um congelador, cuja temperatura é de 20 o C. Após estar formado e em equilíbrio térmico com o congelador, o gelo é transferido para outro congelador,
FUVEST 1981 Primeira fase e Segunda fase
 FUVEST 1981 Primeira fase e Segunda fase CONHECIMENTOS GERAIS 5. Nas condições ambientes, pastilhas de hidróxido de sódio, expostas ao ar durante várias horas, transformam-se em um líquido claro. Este
FUVEST 1981 Primeira fase e Segunda fase CONHECIMENTOS GERAIS 5. Nas condições ambientes, pastilhas de hidróxido de sódio, expostas ao ar durante várias horas, transformam-se em um líquido claro. Este
UFU 2008/2-1ª FASE. 1-A substância, representada pela fórmula estrutural abaixo, é bastante utilizada como analgésico (aspirina).
 UFU 2008/2-1ª FASE 1-A substância, representada pela fórmula estrutural abaixo, é bastante utilizada como analgésico (aspirina). Com base nessas informações, marque a alternativa correta. A) Uma massa
UFU 2008/2-1ª FASE 1-A substância, representada pela fórmula estrutural abaixo, é bastante utilizada como analgésico (aspirina). Com base nessas informações, marque a alternativa correta. A) Uma massa
Química FUVEST b) Calcule a quantidade, em mols, de carbonato de amônio e de carbonato de cálcio na mistura original.
 Q.01 Uma mistura de carbonato de amônio e carbonato de cálcio foi aquecida até a completa decomposição. Obteve-se 0,20 mol de um resíduo sólido, além de uma mistura gasosa que, resfriada a 25 ºC, condensou-se
Q.01 Uma mistura de carbonato de amônio e carbonato de cálcio foi aquecida até a completa decomposição. Obteve-se 0,20 mol de um resíduo sólido, além de uma mistura gasosa que, resfriada a 25 ºC, condensou-se
ITA Professora Sonia. DADOS PERGUNTA 2 PESOS ATÔMICOS DE ALGUNS ELEMENTOS PERGUNTA 3
 ITA 1979 (Duração da prova: 4 h) DADOS 1 faraday 9,65 x 10 4 C Volume Molar 22,4 litros (CNTP) 1 atmosfera 760 mmhg 0 o C 273 K Caloria Litro.atm J R 1, 987 0, 08205 8,314 K.mol K.mol K.mol CNTP condições
ITA 1979 (Duração da prova: 4 h) DADOS 1 faraday 9,65 x 10 4 C Volume Molar 22,4 litros (CNTP) 1 atmosfera 760 mmhg 0 o C 273 K Caloria Litro.atm J R 1, 987 0, 08205 8,314 K.mol K.mol K.mol CNTP condições
2-A ductilidade é a propriedade de um material deformar-se, comprimir-se ou estirar-se sem se romper.
 UNESP 2012 1-O magma que sai dos vulcões durante as erupções é constituído por rochas fundidas e vários tipos de gases e vapores, tais como CO, CO 2, SO 2, SO 3, HCl e H 2 O. A respeito dessas substâncias,
UNESP 2012 1-O magma que sai dos vulcões durante as erupções é constituído por rochas fundidas e vários tipos de gases e vapores, tais como CO, CO 2, SO 2, SO 3, HCl e H 2 O. A respeito dessas substâncias,
Obs.: foram analisadas 90 questões dos últimos cinco anos
 Conteúdo Nº de questões % Química ambiental 16 17,78 INORGÂNICA (Química Solucionada) Estequiometria 06 6,67% Cálculos químicos 01 1,11% Reações inorgânicas 05 5,55% Química elementar 07 7,78% Funções
Conteúdo Nº de questões % Química ambiental 16 17,78 INORGÂNICA (Química Solucionada) Estequiometria 06 6,67% Cálculos químicos 01 1,11% Reações inorgânicas 05 5,55% Química elementar 07 7,78% Funções
QUÍMICA QUESTÃO O oxigênio e o enxofre podem ser encontrados como moléculas O 2 QUESTÃO 32
 T 20 QUÍMCA QUESTÃ 3 Com exceção dos gases nobres, os elementos químicos, em condições ambientais, podem ser encontrados sob diferentes formas: como metais ou ligas, substâncias moleculares, substâncias
T 20 QUÍMCA QUESTÃ 3 Com exceção dos gases nobres, os elementos químicos, em condições ambientais, podem ser encontrados sob diferentes formas: como metais ou ligas, substâncias moleculares, substâncias
Pb 2e Pb E 0,13 v. Ag 2e Ag E +0,80 v. Zn 2e Zn E 0,76 v. Al 3e Al E 1,06 v. Mg 2e Mg E 2,4 v. Cu 2e Cu E +0,34 v
 QUÍMICA 1ª QUESTÃO Umas das reações possíveis para obtenção do anidrido sulfúrico é a oxidação do anidrido sulfuroso por um agente oxidante forte em meio aquoso ácido, como segue a reação. Anidrido sulfuroso
QUÍMICA 1ª QUESTÃO Umas das reações possíveis para obtenção do anidrido sulfúrico é a oxidação do anidrido sulfuroso por um agente oxidante forte em meio aquoso ácido, como segue a reação. Anidrido sulfuroso
RESOLUÇÃO DA PROVA DE QUÍMICA - UFRGS 2019
 RESOLUÇÃO DA PROVA DE QUÍMICA - UFRGS 2019 26. Resposta letra C O estado gasoso é um fluido. As propriedades do líquido são intermediárias entre sólido e gasoso. 27. Resposta letra A A dissolução fracionada
RESOLUÇÃO DA PROVA DE QUÍMICA - UFRGS 2019 26. Resposta letra C O estado gasoso é um fluido. As propriedades do líquido são intermediárias entre sólido e gasoso. 27. Resposta letra A A dissolução fracionada
Resolução do Vestibular UDESC 2019/1
 A concentração de H 3 O + é maior com a utilização de carvão fóssil como combustível por este apresentar como impurezas compostos de enxofre e de nitrogênio. Logo ocorrendo em sua combustão a formação
A concentração de H 3 O + é maior com a utilização de carvão fóssil como combustível por este apresentar como impurezas compostos de enxofre e de nitrogênio. Logo ocorrendo em sua combustão a formação
UFSC. Química (Amarela) , temos 10 mol de Mg, ou seja, 243 g de Mg. Resposta: = 98. Comentário
 Resposta: 02 + 32 + 64 = 98 01. Incorreta. carbonato de magnésio é um sal insolúvel em H 2, logo não dissocia-se em Mg 2+ e (aq) C2. 3(aq) 02. Correta. 12 Mg 2+ = 1s 2 2s 2 2p 6 K L 04. Incorreta. É um
Resposta: 02 + 32 + 64 = 98 01. Incorreta. carbonato de magnésio é um sal insolúvel em H 2, logo não dissocia-se em Mg 2+ e (aq) C2. 3(aq) 02. Correta. 12 Mg 2+ = 1s 2 2s 2 2p 6 K L 04. Incorreta. É um
TERMOQUÍMICA. 1 Fenômenos endotérmicos e exotérmicos
 TERMOQUÍMICA 1 Fenômenos endotérmicos e exotérmicos a) Processos exotérmicos: Ocorrem com liberação de calor. Possuem variação de entalpia ( H) negativa. Ex: Combustão do metano (CH4) CH4 (g) + 2 O2 (g)
TERMOQUÍMICA 1 Fenômenos endotérmicos e exotérmicos a) Processos exotérmicos: Ocorrem com liberação de calor. Possuem variação de entalpia ( H) negativa. Ex: Combustão do metano (CH4) CH4 (g) + 2 O2 (g)
Química. Questão 17 A gasolina é uma mistura de hidrocarbonetos diversos que apresenta, dentre outros, os seguintes componentes:
 Questão 16 Uma molécula de água, isolada, não apresenta certas propriedades físicas - como ponto de fusão e de ebulição - que dependem de interações entre moléculas. Em 1998, um grupo de pesquisadores
Questão 16 Uma molécula de água, isolada, não apresenta certas propriedades físicas - como ponto de fusão e de ebulição - que dependem de interações entre moléculas. Em 1998, um grupo de pesquisadores
44. Com relação aos compostos representados abaixo, é INCORRETO afirmar que: N(CH 2 CH 3 ) 3 CH 3 CO 2 H ClCH 2 CO 2 H I II III
 22 GABARITO 1 1º DIA 2º Processo Seletivo/2004 44. Com relação aos compostos representados abaixo, é INCORRETO afirmar que: N(CH 2 CH 3 ) 3 CH 3 CO 2 H ClCH 2 CO 2 H I II III a) o composto III é um ácido
22 GABARITO 1 1º DIA 2º Processo Seletivo/2004 44. Com relação aos compostos representados abaixo, é INCORRETO afirmar que: N(CH 2 CH 3 ) 3 CH 3 CO 2 H ClCH 2 CO 2 H I II III a) o composto III é um ácido
A prova escrita é composta de 10 questões, sendo 4 obrigatórias e 6 eletivas.
 A prova escrita é composta de 10 questões, sendo 4 obrigatórias e 6 eletivas. O candidato deverá responder 8 questões: as 4 obrigatórias (questões de números 1 a 4) e outras 4 escolhidas dentre as eletivas
A prova escrita é composta de 10 questões, sendo 4 obrigatórias e 6 eletivas. O candidato deverá responder 8 questões: as 4 obrigatórias (questões de números 1 a 4) e outras 4 escolhidas dentre as eletivas
UNIT º semestre - 2º dia (16/06/2008).
 UNIT 2008-2º semestre - 2º dia (16/06/2008). Atenção: O texto abaixo se refere às questões de números 61 a 65. Uma estação de tratamento de água pode realizar os seguintes processos: Pré-cloração (adição
UNIT 2008-2º semestre - 2º dia (16/06/2008). Atenção: O texto abaixo se refere às questões de números 61 a 65. Uma estação de tratamento de água pode realizar os seguintes processos: Pré-cloração (adição
QUÍMICA PRIMEIRA ETAPA
 QUÍMICA PRIMEIRA ETAPA - 1999 QUESTÃO 46 Um limão foi espremido num copo contendo água e as sementes ficaram no fundo do recipiente. A seguir, foi adicionado ao sistema um pouco de açúcar, que se dissolveu
QUÍMICA PRIMEIRA ETAPA - 1999 QUESTÃO 46 Um limão foi espremido num copo contendo água e as sementes ficaram no fundo do recipiente. A seguir, foi adicionado ao sistema um pouco de açúcar, que se dissolveu
3º Trimestre Sala de estudos Química Data: 03/12/18 Ensino Médio 3º ano classe: A_B Profª Danusa Nome: nº
 3º Trimestre Sala de estudos Química Data: 03/12/18 Ensino Médio 3º ano classe: A_B Profª Danusa Nome: nº Conteúdo: FAMERP/UNIFESP (REVISÃO) Questão 01 - (FAMERP SP/2018) A tabela indica a abundância aproximada
3º Trimestre Sala de estudos Química Data: 03/12/18 Ensino Médio 3º ano classe: A_B Profª Danusa Nome: nº Conteúdo: FAMERP/UNIFESP (REVISÃO) Questão 01 - (FAMERP SP/2018) A tabela indica a abundância aproximada
(D) NaCl2O, NaCl2 ecl2. (E) NaCl2O, Na2Cl e Cl2.
 UNIVERSIDADE TIRADENTES UNIT. Vestibular 2006 / 1 Semestre / data 19/12/2005. Prova de Química. 1. O ar é uma mistura constituída por aproximadamente 78% de N2, 21% de O2 e 1 % de outros gases. A partir
UNIVERSIDADE TIRADENTES UNIT. Vestibular 2006 / 1 Semestre / data 19/12/2005. Prova de Química. 1. O ar é uma mistura constituída por aproximadamente 78% de N2, 21% de O2 e 1 % de outros gases. A partir
Polimerização e Reações Orgânicas
 Polimerização e Reações Orgânicas Material de Apoio para Monitoria 1. (FATEC-SP) A polimerização por adição consiste na reação entre moléculas de uma mesma substância, na qual em sua estrutura, ocorre
Polimerização e Reações Orgânicas Material de Apoio para Monitoria 1. (FATEC-SP) A polimerização por adição consiste na reação entre moléculas de uma mesma substância, na qual em sua estrutura, ocorre
Química Geral I. Química - Licenciatura Prof. Udo Eckard Sinks
 Química Geral I Química - Licenciatura Prof. Udo Eckard Sinks Conteúdo 19/05/2017 Contextualização Química Química Inorgânica Química Orgânica Físico Química Química Analítica Funções Químicas Funções
Química Geral I Química - Licenciatura Prof. Udo Eckard Sinks Conteúdo 19/05/2017 Contextualização Química Química Inorgânica Química Orgânica Físico Química Química Analítica Funções Químicas Funções
IME º DIA QUÍMICA BERNOULLI COLÉGIO E PRÉ-VESTIBULAR
 IME - 2003 3º DIA QUÍMICA BERNOULLI COLÉGIO E PRÉ-VESTIBULAR Química Questão 01 Uma fonte de vanádio é o mineral vanadinita, cuja fórmula é Pb 5 (VO 4 ) 3 Cl. DETERMINE: A) A porcentagem em massa de vanádio
IME - 2003 3º DIA QUÍMICA BERNOULLI COLÉGIO E PRÉ-VESTIBULAR Química Questão 01 Uma fonte de vanádio é o mineral vanadinita, cuja fórmula é Pb 5 (VO 4 ) 3 Cl. DETERMINE: A) A porcentagem em massa de vanádio
LISTA 02 - TEORIA ATÔMICA MOLECULAR
 LISTA 02 - TEORIA ATÔMICA MOLECULAR 1º ano QUÍMICA PROF. PEDRO 2º Bimestre Questão 01) A massa de uma molécula de ácido acético, CH 3 COOH, é: a) 1,0. 10-21 g b) 1,0. 10-22 g c) 1,0. 10-23 g d) 1,0. 10-24
LISTA 02 - TEORIA ATÔMICA MOLECULAR 1º ano QUÍMICA PROF. PEDRO 2º Bimestre Questão 01) A massa de uma molécula de ácido acético, CH 3 COOH, é: a) 1,0. 10-21 g b) 1,0. 10-22 g c) 1,0. 10-23 g d) 1,0. 10-24
Está correto o contido em a) I apenas. b) I e II apenas. c) I e III apenas. d) II e III apenas. e) I, II e III. Resolução
 7 b QUÍMICA Um estudante construiu, em um mesmo diagrama, as curvas da temperatura em função do tempo resultantes do aquecimento, sob pressão normal, de três líquidos em três béqueres distintos. Com base
7 b QUÍMICA Um estudante construiu, em um mesmo diagrama, as curvas da temperatura em função do tempo resultantes do aquecimento, sob pressão normal, de três líquidos em três béqueres distintos. Com base
FUVEST 1984 Primeira fase e Segunda fase
 FUVEST 1984 Primeira fase e Segunda fase Professora Sonia 9. A melhor maneira de separar os três componentes de uma mistura de areia com solução aquosa de sal é: CONHECIMENTOS GERAIS 5. O peso atômico
FUVEST 1984 Primeira fase e Segunda fase Professora Sonia 9. A melhor maneira de separar os três componentes de uma mistura de areia com solução aquosa de sal é: CONHECIMENTOS GERAIS 5. O peso atômico
UFJF CONCURSO VESTIBULAR PROVA DE QUÍMICA
 Questão 1 Sabe-se que compostos constituídos por elementos do mesmo grupo na tabela periódica possuem algumas propriedades químicas semelhantes. Entretanto, enquanto a água é líquida em condições normais
Questão 1 Sabe-se que compostos constituídos por elementos do mesmo grupo na tabela periódica possuem algumas propriedades químicas semelhantes. Entretanto, enquanto a água é líquida em condições normais
Resposta Capítulo 17: Eletroquímica: Pilhas
 Resposta Capítulo 7: Eletroquímica: Pilhas. B Correta. O óxido de LiCoO é oxidado a CoO, na recarga da pilha. Li e Li. Reação global da pilha eletroquímica formada por cobre e ferro:,34 V >,44 V Cu e Cu
Resposta Capítulo 7: Eletroquímica: Pilhas. B Correta. O óxido de LiCoO é oxidado a CoO, na recarga da pilha. Li e Li. Reação global da pilha eletroquímica formada por cobre e ferro:,34 V >,44 V Cu e Cu
Lista de Exercícios - Monitorias
 Monitoria de Química - 18/12 1) (UFRGS-2017) Observe a figura abaixo, sobre o perfil de energia de uma reação em fase gasosa. Considere as seguintes afirmações a respeito dessa reação. I - A posição de
Monitoria de Química - 18/12 1) (UFRGS-2017) Observe a figura abaixo, sobre o perfil de energia de uma reação em fase gasosa. Considere as seguintes afirmações a respeito dessa reação. I - A posição de
CAPÍTULO 1 Quantidades e Unidades 1. CAPÍTULO 2 Massa Atômica e Molecular; Massa Molar 16. CAPÍTULO 3 O Cálculo de Fórmulas e de Composições 26
 Sumário CAPÍTULO 1 Quantidades e Unidades 1 Introdução 1 Os sistemas de medida 1 O Sistema Internacional de Unidades (SI) 1 A temperatura 2 Outras escalas de temperatura 3 O uso e o mau uso das unidades
Sumário CAPÍTULO 1 Quantidades e Unidades 1 Introdução 1 Os sistemas de medida 1 O Sistema Internacional de Unidades (SI) 1 A temperatura 2 Outras escalas de temperatura 3 O uso e o mau uso das unidades
Sumário. 1 Introdução: matéria e medidas 1. 2 Átomos, moléculas e íons Estequiometria: cálculos com fórmulas e equações químicas 67
 Prefácio 1 Introdução: matéria e medidas 1 1.1 O estudo da química 1 1.2 Classificações da matéria 3 1.3 Propriedades da matéria 8 1.4 Unidades de medida 12 1.5 Incerteza na medida 18 1.6 Análise dimensional
Prefácio 1 Introdução: matéria e medidas 1 1.1 O estudo da química 1 1.2 Classificações da matéria 3 1.3 Propriedades da matéria 8 1.4 Unidades de medida 12 1.5 Incerteza na medida 18 1.6 Análise dimensional
Abuso Sexual nas Escolas Não dá para aceitar
 Abuso Sexual nas Escolas Não dá para aceitar Por uma Escola livre do SIDA República de Moçambique Química Ministério da Educação 1ª Época 12ª Classe / 2011 Conselho Nacional de Exames, Certificação e Equivalências
Abuso Sexual nas Escolas Não dá para aceitar Por uma Escola livre do SIDA República de Moçambique Química Ministério da Educação 1ª Época 12ª Classe / 2011 Conselho Nacional de Exames, Certificação e Equivalências
P R O V A D E Q U Í M I C A I I
 20 P R V A D E Q U Í M I C A I I QUESTÃ 46 Na fabricação de pães, a glicose contida na massa se transforma em álcool etílico e gás carbônico com a ajuda da enzima zimase, de acordo com a seguinte reação,
20 P R V A D E Q U Í M I C A I I QUESTÃ 46 Na fabricação de pães, a glicose contida na massa se transforma em álcool etílico e gás carbônico com a ajuda da enzima zimase, de acordo com a seguinte reação,
XII Olimpíada Baiana de Química Exame 2017
 Questão 01 (Peso 1) Questões objetivas (QUESTÕES DE 01 A 30) A fórmula estrutural condensada, CH 3 CH 2 CH 2 COOCH 3, representa: A) um éster B) uma amida C) um aldeído D) um anidrido E) um ácido carboxílico
Questão 01 (Peso 1) Questões objetivas (QUESTÕES DE 01 A 30) A fórmula estrutural condensada, CH 3 CH 2 CH 2 COOCH 3, representa: A) um éster B) uma amida C) um aldeído D) um anidrido E) um ácido carboxílico
c. o valor da força eletromotriz (fem) da pilha.
 1 a Questão: Valor: 1.0 Alguns elementos apresentam irregularidades na sua distribuição eletrônica já que as configurações d 5, d 10, f 7 e f 14 são muito estáveis. Por exemplo, o Cu (Z=29), em vez de
1 a Questão: Valor: 1.0 Alguns elementos apresentam irregularidades na sua distribuição eletrônica já que as configurações d 5, d 10, f 7 e f 14 são muito estáveis. Por exemplo, o Cu (Z=29), em vez de
A estrutura atômica do hidrogênio, a mais simples de todos os elementos químicos, apresenta um próton no núcleo, e um elétron, na camada externa.
 O ELEMENTO HIDROGÊNIO INTRODUÇÃO Embora na terra ocupe o nono lugar entre os elementos em termos de ocorrência, correspondendo a 0,9% da massa do planeta, é o mais abundante no universo, pois apresenta
O ELEMENTO HIDROGÊNIO INTRODUÇÃO Embora na terra ocupe o nono lugar entre os elementos em termos de ocorrência, correspondendo a 0,9% da massa do planeta, é o mais abundante no universo, pois apresenta
SIMULADO EXTENSIVO QUÍMICA
 P R É - V E S T I B U L A R 04.09 QUÍMICA QUESTÃ 49 jornal Folha de São Paulo publicou, em 19/06/07, matéria sobre empresas norte-americanas que estavam falsificando suco de laranja. produto, vendido como
P R É - V E S T I B U L A R 04.09 QUÍMICA QUESTÃ 49 jornal Folha de São Paulo publicou, em 19/06/07, matéria sobre empresas norte-americanas que estavam falsificando suco de laranja. produto, vendido como
O hidrogênio é usado na fabricação de inúmeros produtos importantes:
 Q.01 O hidrogênio é usado na fabricação de inúmeros produtos importantes: I. H 2 + X metanol II. H 2 + Y ciclo-hexano III. H 2 + Z tripalmitato de glicerila (gordura saturada) a) Identifique X, Y e Z.
Q.01 O hidrogênio é usado na fabricação de inúmeros produtos importantes: I. H 2 + X metanol II. H 2 + Y ciclo-hexano III. H 2 + Z tripalmitato de glicerila (gordura saturada) a) Identifique X, Y e Z.
CPV seu pé direito também na Medicina
 seu pé direito também na Medicina UNIFESP 17/dezembro/2010 QUÍMICA 06. Ligas metálicas são comuns no cotidiano e muito utilizadas nas indústrias automobilística, aeronáutica, eletrônica e na construção
seu pé direito também na Medicina UNIFESP 17/dezembro/2010 QUÍMICA 06. Ligas metálicas são comuns no cotidiano e muito utilizadas nas indústrias automobilística, aeronáutica, eletrônica e na construção
CONCURSO DE ADMISSÃO AO CURSO DE FORMAÇÃO E GRADUAÇÃO QUÍMICA FOLHA DE QUESTÕES
 CONCURSO DE ADMISSÃO AO CURSO DE FORMAÇÃO E GRADUAÇÃO QUÍMICA FOLHA DE QUESTÕES 2007 1 a QUESTÃO Valor: 1,0 A A configuração eletrônica de um átomo X é [ X ]. Determine: Z a) os valores de Z e de n, para
CONCURSO DE ADMISSÃO AO CURSO DE FORMAÇÃO E GRADUAÇÃO QUÍMICA FOLHA DE QUESTÕES 2007 1 a QUESTÃO Valor: 1,0 A A configuração eletrônica de um átomo X é [ X ]. Determine: Z a) os valores de Z e de n, para
O ALUNO DEVERÁ VIR PARA A AULA DE RECUPERAÇÃO COM A LISTA PRONTA PARA TIRAR DÚVIDAS.
 Lista de exercícios para a prova de recuperação final 2º ano EM Conteúdo. O ALUNO DEVERÁ VIR PARA A AULA DE RECUPERAÇÃO COM A LISTA PRONTA PARA TIRAR DÚVIDAS. - Química orgânica. - Termoquímica. - Estudo
Lista de exercícios para a prova de recuperação final 2º ano EM Conteúdo. O ALUNO DEVERÁ VIR PARA A AULA DE RECUPERAÇÃO COM A LISTA PRONTA PARA TIRAR DÚVIDAS. - Química orgânica. - Termoquímica. - Estudo
Gabarito-R Profº Jaqueline Química. a) Dados: Solubilidade do KOH em etanol a 25 C
 1: a) Dados: Solubilidade do KOH em etanol a 25 C 40 g em 100 ml. Adicionou-se 1,5 g de KOH a 35 ml de etanol, agitando-se continuamente a mistura. 100 ml (etanol) 40 g (KOH) 35 ml (etanol) mkoh mkoh 14
1: a) Dados: Solubilidade do KOH em etanol a 25 C 40 g em 100 ml. Adicionou-se 1,5 g de KOH a 35 ml de etanol, agitando-se continuamente a mistura. 100 ml (etanol) 40 g (KOH) 35 ml (etanol) mkoh mkoh 14
3ª Série / Vestibular. As equações (I) e (II), acima, representam reações que podem ocorrer na formação do H 2SO 4. É correto afirmar que, na reação:
 3ª Série / Vestibular 01. I _ 2SO 2(g) + O 2(g) 2SO 3(g) II _ SO 3(g) + H 2O(l) H 2SO 4(ag) As equações (I) e (II), acima, representam reações que podem ocorrer na formação do H 2SO 4. É correto afirmar
3ª Série / Vestibular 01. I _ 2SO 2(g) + O 2(g) 2SO 3(g) II _ SO 3(g) + H 2O(l) H 2SO 4(ag) As equações (I) e (II), acima, representam reações que podem ocorrer na formação do H 2SO 4. É correto afirmar
Prova 3 Química QUESTÕES APLICADAS A TODOS OS CANDIDATOS QUE REALIZARAM A PROVA ESPECÍFICA DE QUÍMICA. QUESTÕES OBJETIVAS GABARITO 4
 Prova 3 QUESTÕES OBJETIVAS QUESTÕES APLICADAS A TODOS OS CANDIDATOS QUE REALIZARAM A PROVA ESPECÍFICA DE QUÍMICA. UEM Comissão Central do Vestibular Unificado QUÍMICA 01 Considerando as seguintes semi-reações
Prova 3 QUESTÕES OBJETIVAS QUESTÕES APLICADAS A TODOS OS CANDIDATOS QUE REALIZARAM A PROVA ESPECÍFICA DE QUÍMICA. UEM Comissão Central do Vestibular Unificado QUÍMICA 01 Considerando as seguintes semi-reações
Prova 3 Química QUESTÕES APLICADAS A TODOS OS CANDIDATOS QUE REALIZARAM A PROVA ESPECÍFICA DE QUÍMICA. QUESTÕES OBJETIVAS GABARITO 1
 Prova 3 QUESTÕES OBJETIVAS QUESTÕES APLICADAS A TODOS OS CANDIDATOS QUE REALIZARAM A PROVA ESPECÍFICA DE QUÍMICA. UEM Comissão Central do Vestibular Unificado QUÍMICA 01 Em um recipiente fechado sob pressão
Prova 3 QUESTÕES OBJETIVAS QUESTÕES APLICADAS A TODOS OS CANDIDATOS QUE REALIZARAM A PROVA ESPECÍFICA DE QUÍMICA. UEM Comissão Central do Vestibular Unificado QUÍMICA 01 Em um recipiente fechado sob pressão
Prova 3 Química QUESTÕES APLICADAS A TODOS OS CANDIDATOS QUE REALIZARAM A PROVA ESPECÍFICA DE QUÍMICA. QUESTÕES OBJETIVAS GABARITO 3
 Prova 3 QUESTÕES OBJETIVAS QUESTÕES APLICADAS A TODOS OS CANDIDATOS QUE REALIZARAM A PROVA ESPECÍFICA DE QUÍMICA. UEM Comissão Central do Vestibular Unificado QUÍMICA 01 Assinale a alternativa correta.
Prova 3 QUESTÕES OBJETIVAS QUESTÕES APLICADAS A TODOS OS CANDIDATOS QUE REALIZARAM A PROVA ESPECÍFICA DE QUÍMICA. UEM Comissão Central do Vestibular Unificado QUÍMICA 01 Assinale a alternativa correta.
Prova 3 Química QUESTÕES APLICADAS A TODOS OS CANDIDATOS QUE REALIZARAM A PROVA ESPECÍFICA DE QUÍMICA. QUESTÕES OBJETIVAS GABARITO 2
 Prova 3 QUESTÕES OBJETIVAS QUESTÕES APLICADAS A TODOS OS CANDIDATOS QUE REALIZARAM A PROVA ESPECÍFICA DE QUÍMICA. UEM Comissão Central do Vestibular Unificado QUÍMICA 01 Assinale a alternativa incorreta.
Prova 3 QUESTÕES OBJETIVAS QUESTÕES APLICADAS A TODOS OS CANDIDATOS QUE REALIZARAM A PROVA ESPECÍFICA DE QUÍMICA. UEM Comissão Central do Vestibular Unificado QUÍMICA 01 Assinale a alternativa incorreta.
METAIS E LIGAS METÁLICAS
 DEPARTAMENTO DE C. Físico-Químicas DISCIPLINA: Química COMPETÊNCIAS/CONTEÚDOS 12º ano... Domínios / Objetivos Conceitos/ Conteúdos Calendarização (blocos) METAIS E LIGAS METÁLICAS METAIS E LIGAS METÁLICAS
DEPARTAMENTO DE C. Físico-Químicas DISCIPLINA: Química COMPETÊNCIAS/CONTEÚDOS 12º ano... Domínios / Objetivos Conceitos/ Conteúdos Calendarização (blocos) METAIS E LIGAS METÁLICAS METAIS E LIGAS METÁLICAS
AULA ESPECÍFICA. Prof. Rodrigo Becker Cordeiro
 AULA ESPECÍFICA Prof. Rodrigo Becker Cordeiro Química 2ª fase UFPR Apogeu Aula 03 Assuntos abordados Propriedades coligativas Teorias ácido-base Propriedades dos compostos orgânicos Pilhas (ACAFE-SC) O
AULA ESPECÍFICA Prof. Rodrigo Becker Cordeiro Química 2ª fase UFPR Apogeu Aula 03 Assuntos abordados Propriedades coligativas Teorias ácido-base Propriedades dos compostos orgânicos Pilhas (ACAFE-SC) O
Olimpíada Brasileira de Química ) Um elemento químico apresenta a configuração eletrônica [Xe]4f 14 5d 7 6s 2, portanto, é um:
![Olimpíada Brasileira de Química ) Um elemento químico apresenta a configuração eletrônica [Xe]4f 14 5d 7 6s 2, portanto, é um: Olimpíada Brasileira de Química ) Um elemento químico apresenta a configuração eletrônica [Xe]4f 14 5d 7 6s 2, portanto, é um:](/thumbs/65/52626462.jpg) Olimpíada Brasileira de Química - 2003 Exame nacional - fase III MODALIDADE A PARTE I: QUESTÕES MÚLTIPLA ESCOLHA 1) Um elemento químico apresenta a configuração eletrônica [Xe]4f 14 5d 7 6s 2, portanto,
Olimpíada Brasileira de Química - 2003 Exame nacional - fase III MODALIDADE A PARTE I: QUESTÕES MÚLTIPLA ESCOLHA 1) Um elemento químico apresenta a configuração eletrônica [Xe]4f 14 5d 7 6s 2, portanto,
química caderno de prova instruções informações gerais 13/12/2009 boa prova! 2ª fase exame discursivo
 2ª fase exame discursivo 13/12/2009 química caderno de prova Este caderno, com dezesseis páginas numeradas sequencialmente, contém dez questões de Química. A Classificação Periódica dos Elementos está
2ª fase exame discursivo 13/12/2009 química caderno de prova Este caderno, com dezesseis páginas numeradas sequencialmente, contém dez questões de Química. A Classificação Periódica dos Elementos está
VII Olimpíada Catarinense de Química Etapa I - Colégios
 VII Olimpíada Catarinense de Química 2011 Etapa I - Colégios Fonte: Chemistryland Segunda Série 1 01 200 ml de uma solução de hidróxido de alumínio são diluídos em água destilada até a sua concentração
VII Olimpíada Catarinense de Química 2011 Etapa I - Colégios Fonte: Chemistryland Segunda Série 1 01 200 ml de uma solução de hidróxido de alumínio são diluídos em água destilada até a sua concentração
Observe a equação química que corresponde ao processo de obtenção descrito no texto.
 Utilize o texto abaixo para responder às questões de números 01 e 02. Uma das experiências realizadas em aulas práticas de Química é a obtenção do 2-cloro 2-metil propano, usualmente denominado cloreto
Utilize o texto abaixo para responder às questões de números 01 e 02. Uma das experiências realizadas em aulas práticas de Química é a obtenção do 2-cloro 2-metil propano, usualmente denominado cloreto
Processo Seletivo/UFU - Fevereiro ª Prova Comum QUÍMICA T I P O QUESTÃO 31 QUESTÃO 32. Considere os seguintes átomos:.
 QUÍMCA QUESÃ 3 Considere os seguintes átomos:. Em relação a esses átomos, marque a alternativa NCRREA. A) B é um átomo mais eletronegativo que A. B) raio atômico do átomo A é maior que o do átomo B. C)
QUÍMCA QUESÃ 3 Considere os seguintes átomos:. Em relação a esses átomos, marque a alternativa NCRREA. A) B é um átomo mais eletronegativo que A. B) raio atômico do átomo A é maior que o do átomo B. C)
FUVEST 1978 Primeira fase e Segunda fase
 FUVEST 1978 Primeira fase e Segunda fase CNECIMENTS GERAIS 61. Bolinhas de naftalina ao serem colocadas em armários, com o decorrer do tempo, diminuem de tamanho. A causa desse comportamento deve-se ao
FUVEST 1978 Primeira fase e Segunda fase CNECIMENTS GERAIS 61. Bolinhas de naftalina ao serem colocadas em armários, com o decorrer do tempo, diminuem de tamanho. A causa desse comportamento deve-se ao
UNIFEV MEDICINA - Segundo Semestre CENTRO UNIVERSITÁRIO DE VOTUPORANGA
 UNIFEV 2015 - MEDICINA - Segundo Semestre CENTRO UNIVERSITÁRIO DE VOTUPORANGA 07. Para combater o subdiagnóstico da osteoporose no sexo masculino, os homens foram o foco da campanha internacional Ame seus
UNIFEV 2015 - MEDICINA - Segundo Semestre CENTRO UNIVERSITÁRIO DE VOTUPORANGA 07. Para combater o subdiagnóstico da osteoporose no sexo masculino, os homens foram o foco da campanha internacional Ame seus
QUÍMICA. Qual a fórmula molecular do menor alcadieno halênico com carbono quiral?
 QUÍMICA Qual a fórmula molecular do menor alcadieno halênico com carbono quiral? C 6 H 10 ; C 7 H 10 ; C 7 H 12 ; C 6 H 8. C 6 H 12 ; O mirceno, composto responsável pelo gosto amargo da cerveja, possui
QUÍMICA Qual a fórmula molecular do menor alcadieno halênico com carbono quiral? C 6 H 10 ; C 7 H 10 ; C 7 H 12 ; C 6 H 8. C 6 H 12 ; O mirceno, composto responsável pelo gosto amargo da cerveja, possui
O ALUNO DEVERÁ VIR PARA A AULA DE RECUPERAÇÃO COM A LISTA PRONTA PARA TIRAR DÚVIDAS.
 Lista de exercícios para a prova de recuperação final 2º ano EM Conteúdo. O ALUNO DEVERÁ VIR PARA A AULA DE RECUPERAÇÃO COM A LISTA PRONTA PARA TIRAR DÚVIDAS. - Termoquímica. - Eletroquímica. - Equilíbrio
Lista de exercícios para a prova de recuperação final 2º ano EM Conteúdo. O ALUNO DEVERÁ VIR PARA A AULA DE RECUPERAÇÃO COM A LISTA PRONTA PARA TIRAR DÚVIDAS. - Termoquímica. - Eletroquímica. - Equilíbrio
ITA Professora Sonia.
 ITA 1991 Cada TESTE de múltipla-escolha admite sempre uma única resposta dentre as cinco opções apresentadas. TODAS as respostas aos 25 (vinte e cinco) testes deverão ser justificadas no CADERNO DE REPOSTAS.
ITA 1991 Cada TESTE de múltipla-escolha admite sempre uma única resposta dentre as cinco opções apresentadas. TODAS as respostas aos 25 (vinte e cinco) testes deverão ser justificadas no CADERNO DE REPOSTAS.
FUVEST As fórmulas estruturais de alguns componentes de óleos essenciais, responsáveis pelo aroma de certas ervas e flores, são:
 FUVEST 2012. 1-Na obra O poço do Visconde, de Monteiro Lobato, há o seguinte diálogo entre o Visconde de sabugosa e a boneca Emília: - Senhora Emília, explique-me o que é hidrocarboneto. A atrapalhadeira
FUVEST 2012. 1-Na obra O poço do Visconde, de Monteiro Lobato, há o seguinte diálogo entre o Visconde de sabugosa e a boneca Emília: - Senhora Emília, explique-me o que é hidrocarboneto. A atrapalhadeira
COLÉGIO SHALOM Ensino Médio 3EM Prof.º: Hélen Cristina Disciplina Química Aluno (a):. No.
 COLÉGIO SHALOM Ensino Médio 3EM Prof.º: Hélen Cristina Disciplina Química Aluno (a):. No. Trabalho de Recuperação I Data: / / Valor: Questão 01: A 250 C, a constante de equilíbrio de dimerização do ciclopentadieno
COLÉGIO SHALOM Ensino Médio 3EM Prof.º: Hélen Cristina Disciplina Química Aluno (a):. No. Trabalho de Recuperação I Data: / / Valor: Questão 01: A 250 C, a constante de equilíbrio de dimerização do ciclopentadieno
QUESTÕES APLICADAS A TODOS OS CANDIDATOS QUE REALIZARAM A PROVA ESPECÍFICA DE QUÍMICA. Prova 3 Química QUESTÕES OBJETIVAS GABARITO 4
 Prova 3 QUESTÕES OBJETIVAS QUESTÕES APLICADAS A TODOS OS CANDIDATOS QUE REALIZARAM A PROVA ESPECÍFICA DE QUÍMICA. UEM Comissão Central do Vestibular Unificado QUÍMICA 01 Considerando os compostos I e II,
Prova 3 QUESTÕES OBJETIVAS QUESTÕES APLICADAS A TODOS OS CANDIDATOS QUE REALIZARAM A PROVA ESPECÍFICA DE QUÍMICA. UEM Comissão Central do Vestibular Unificado QUÍMICA 01 Considerando os compostos I e II,
