Versa. Solução injetável
|
|
|
- Gabriel Bonilha Castanho
- 8 Há anos
- Visualizações:
Transcrição
1 Versa enoxaparina sódica Solução injetável FORMA FARMACÊUTICA E APRESENTAÇÕES Versa (enoxaparina sódica) solução injetável: - 20 mg/0,2 ml e 40 mg/0,4 ml - embalagens com 2 e 10 seringas pré-enchidas mg/0,6 ml e 80 mg/0,8 ml - embalagem com 2 seringas pré-enchidas graduadas. USO ADULTO Uso subcutâneo ou intravenoso. Composições: Cada seringa pré-enchida contém: Apresentação 20 mg 40 mg 60 mg 80 mg enoxaparina 80,0 mg 20,0 mg 40,0 mg 60,0 mg sódica água para 0,8 ml 0,2 ml 0,4 ml 0,6 ml injeção q.s.p. INFORMAÇÕES AO PACIENTE COMO ESTE MEDICAMENTO FUNCIONA? Diminuir o risco de desenvolvimento de uma trombose venosa profunda e sua conseqüência mais grave, a embolia pulmonar. Versa (enoxaparina sódica) previne e trata estas duas patologias, evitando sua progressão ou recorrência, além de tratar angina instável e infarto do miocárdio sem onda Q. Versa (enoxaparina sódica) também evita a coagulação do sangue no circuito de hemodiálise. A duração de uso de Versa (enoxaparina sódica) pode variar de um indivíduo para o outro. POR QUE ESTE MEDICAMENTO FOI INDICADO? Versa (enoxaparina sódica) é indicado em: - tratamento da trombose venosa profunda já estabelecida com ou sem embolismo pulmonar; - profilaxia do tromboembolismo venoso e recidivas, associados à cirurgia ortopédica ou à cirurgia geral; - profilaxia do tromboembolismo venoso e recidivas em pacientes acamados, devido a doenças agudas incluindo insuficiência cardíaca, insuficiência respiratória, infecções graves e doenças reumáticas; - prevenção da coagulação do circuito de circulação extracorpórea durante a hemodiálise; - tratamento da angina instável e infarto do miocárdio sem onda Q, quando administrado concomitantemente ao ácido acetilsalicílico. QUANDO NÃO DEVO USAR ESTE MEDICAMENTO? Versa (enoxaparina sódica) não deve ser utilizado nos seguintes casos: - alergia à enoxaparina sódica, à heparina e seus derivados, inclusive outras heparinas de baixo peso molecular; - hemorragias ativas de grande porte e condições com alto risco de desenvolvimento de hemorragia incontrolável, incluindo acidente vascular cerebral hemorrágico recente. Este medicamento é contraindicado em crianças. ADVERTÊNCIAS Não administrar Versa (enoxaparina sódica) por via intramuscular. Hemorragia Assim como outros anticoagulantes, pode ocorrer sangramento em qualquer local (ver item REAÇÕES ADVER- SAS ). Se ocorrer sangramento, a origem da hemorragia deve ser investigada e tratamento apropriado deve ser instituído; Monitorização da contagem plaquetária O risco de trombocitopenia induzida por heparina (reação mediada por anticorpos) também existe com heparinas de baixo peso molecular. Pode ocorrer trombocitopenia, geralmente entre o 5º e 21º dias após o início do tratamento com enoxaparina sódica. Recomenda-se, portanto, a realização de contagem plaquetária antes do início e regularmente durante o tratamento com enoxaparina sódica. Na prática, em caso de confirmação de diminuição significativa da contagem plaquetária (30 a 50% do valor inicial), o tratamento com enoxaparina sódica deve ser imediatamente interrompido e substituído por outra terapia. As heparinas de baixo peso molecular (HBPM) As heparinas de baixo peso molecular (HBPM) devem ser utilizadas individualmente, pois existem diferenças básicas entre elas quanto a: processo de produção, peso molecular, atividade anti-xa específica, unidade e dosagem. Isto ocasiona diferenças em suas atividades farmacocinética e biológica associadas, como por exemplo, a atividade antitrombina e a interação com as plaquetas. Portanto, é necessário obedecer às instruções de uso de cada medicamento. Anestesia espinhal/peridural Assim como com outros anticoagulantes, foram relatados casos de hematoma intra-espinhal com o uso concomitante de enoxaparina sódica e anestesia espinhal/peridural, que podem resultar em paralisia prolongada ou permanente. Estes eventos são raros com a administração de doses iguais ou inferiores a 40 mg/dia de enoxaparina sódica. O risco destes eventos pode ser aumentado pela administração de doses maiores de enoxaparina sódica, uso de cateter epidural pós-operatório ou em caso de administração concomitante de medicamentos que alteram a hemostasia, como antiinflamatórios não esteroidais (ver item INTERAÇÕES MEDICAMENTOSAS ). O risco parece também ser aumentado por traumatismo ou punções espinhais repetidas. Para reduzir o risco potencial de sangramento associado ao uso concomitante de enoxaparina sódica e anestesia/ analgesia peridural ou espinhal, deve-se considerar o perfil farmacocinético da enoxaparina sódica. A introdução e remoção do cateter devem ser realizadas quando o efeito
2 anticoagulante da enoxaparina sódica estiver baixo. A introdução ou remoção do cateter deve ser postergada para horas após a administração de enoxaparina sódica na profilaxia da trombose venosa profunda, enquanto que em pacientes recebendo doses maiores de enoxaparina sódica (1 mg/kg duas vezes ao dia ou 1,5 mg/kg uma vez ao dia), a introdução ou remoção do cateter deverá ocorrer 24 horas após a administração. A dose subseqüente de enoxaparina sódica deve ser administrada no mínimo 2 horas após a remoção do cateter. O médico deve decidir sobre a administração de anticoagulantes durante o uso de anestesia peridural/espinhal. Devese empregar extrema cautela e monitorização freqüente para detectar qualquer sinal ou sintoma de lesão neurológica, tais como, dor na região lombar, deficiências sensoriais e motoras (entorpecimento ou fraqueza dos membros inferiores), alterações intestinais e/ou urinárias. Os pacientes devem informar imediatamente seu médico caso apresentem qualquer sintoma ou sinal descrito acima. Em caso de suspeita de sinais ou sintomas de hematoma intra-espinhal, devem ser efetuados o diagnóstico e tratamento, incluindo descompressão da medula espinhal, com urgência. Procedimentos de revascularização coronária percutânea Para minimizar o risco de sangramento após a instrumentação vascular durante o tratamento da angina instável e infarto do miocárdio sem onda Q, a bainha de acesso vascular deve permanecer no local durante um período de 6 a 8 horas após a administração subcutânea de enoxaparina sódica. A próxima dose de enoxaparina sódica programada não deve ser administrada antes de 6 a 8 horas após a remoção da bainha. Deve-se ter atenção especial ao local do procedimento para detecção de sinais de sangramento ou formação de hematoma. A utilização de Versa (enoxaparina sódica) não afeta a habilidade de dirigir ou operar máquinas. Verifique sempre o prazo de validade que se encontra na embalagem do produto e confira o nome para não haver enganos. Não utilize Versa (enoxaparina sódica) caso haja sinais de violação ou danificações da embalagem. Risco de uso por via de administração não recomendada Não há estudos dos efeitos de Versa (enoxaparina sódica) administrado por vias não recomendadas. Portanto, por segurança e para eficácia deste medicamento, a administração deve ser somente pela via intravenosa ou subcutânea, conforme recomendada pelo médico. Gravidez Estudos em animais não demonstraram qualquer evidência de toxicidade ao feto ou malformação fetal. Em ratas prenhes, a passagem de 35 S-enoxaparina sódica através da placenta é mínima. Em humanos, não existe evidência da passagem da enoxaparina sódica através da placenta durante o segundo trimestre da gravidez. Ainda não existem informações disponíveis a este respeito durante o primeiro e terceiro trimestres da gravidez. Como não foram realizados estudos adequados e bem controlados em gestantes e como os estudos realizados em animais nem sempre são bons indicativos da resposta humana, deve-se utilizar enoxaparina sódica durante a gravidez somente se o médico considerar como estritamente necessário. Este medicamento não deve ser utilizado por mulheres grávidas sem orientação médica ou do cirurgião-dentista. Amamentação Em ratas lactantes, a concentração de 35 S-enoxaparina sódica ou de seus metabólitos marcados no leite é muito baixa. Não se sabe se a enoxaparina sódica inalterada é excretada no leite humano. A absorção oral da enoxaparina sódica é improvável, porém como precaução, não se deve amamentar durante o tratamento com Versa (enoxaparina sódica). INFORME AO MÉDICO OU CIRURGIÃO-DENTISTA O APARECIMENTO DE REAÇÕES INDESEJÁVEIS. INFORME AO SEU MÉDICO OU CIRURGIÃO-DENTISTA SE VOCÊ ESTÁ FAZENDO USO DE ALGUM OUTRO ME- DICAMENTO. NÃO USE MEDICAMENTO SEM O CONHECIMENTO DO SEU MÉDICO. PODE SER PERIGOSO PARA A SUA SAÚ- DE. PRECAUÇÕES Pacientes idosos Não foi observado aumento na tendência de hemorragia em idosos com doses profiláticas. Porém, pacientes idosos (especialmente pacientes 80 anos de idade) podem ter um aumento no risco de complicações hemorrágicas com doses terapêuticas. Portanto, aconselha-se monitorização clínica cuidadosa (ver item POSOLOGIA). Pacientes idosos podem apresentar eliminação reduzida da enoxaparina. Crianças A segurança e eficácia da enoxaparina sódica em crianças ainda não foram estabelecidas. Restrições a grupos de risco A enoxaparina sódica, assim como qualquer outro anticoagulante, deve ser utilizada com cautela em pacientes com alto risco de hemorragia, como nos seguintes casos: - alterações na hemostasia; - história de úlcera péptica; - acidente vascular cerebral isquêmico recente; - hipertensão arterial grave não controlada por medicamentos; - retinopatia diabética; - neurocirurgia ou cirurgia oftálmica recente; - uso concomitante de medicamentos que afetem a
3 hemostasia (ver item INTERAÇÕES MEDICAMENTO- SAS ). Próteses mecânicas valvulares cardíacas O uso de Versa (enoxaparina sódica) não foi adequadamente estudado para casos de tromboprofilaxia em pacientes com próteses valvulares cardíacas. Foram relatados casos isolados de trombose com próteses valvulares cardíacas em pacientes com próteses mecânicas valvulares que receberam enoxaparina para tromboprofilaxia. A avaliação destes casos é limitada devido aos fatores causais serem confusos - incluindo doenças anteriores e dados clínicos insuficientes. Alguns destes casos foram em gestantes nas quais a trombose resultou em óbitos materno e fetal. Gestantes com próteses mecânicas valvulares cardíacas podem apresentar maior risco para tromboembolismo. Insuficiência dos rins Em pacientes com insuficiência dos rins, existe aumento da exposição à enoxaparina sódica, aumentando também o risco de hemorragia. Como a exposição à enoxaparina sódica aumenta significativamente em pacientes com insuficiência severa dos rins (clearance de creatinina < 30mL/ min), o ajuste posológico é recomendado para dosagens terapêuticas e profiláticas. Embora não seja recomendado ajuste posológico em pacientes com insuficiência moderada dos rins (clearance de creatinina ml/min) e leve (clearance de creatinina ml/min), é aconselhável realizar monitorização clínica cuidadosa (ver item POSOLOGIA); Peso baixo Um aumento na exposição à enoxaparina sódica em doses profiláticas (não ajustadas ao peso) tem sido observado em mulheres de peso baixo (< 45 Kg) e homens de baixo peso (< 57 Kg), que pode resultar em maior risco de hemorragia. Portanto, é aconselhável realizar monitorização clínica cuidadosa nestes pacientes. Trombocitopenia induzida pela heparina Versa (enoxaparina sódica) deve ser utilizado com extrema cautela em pacientes com história de trombocitopenia induzida pela heparina, com ou sem trombose. O risco de trombocitopenia induzida por heparina pode persistir por vários anos. Em caso de suspeita de trombocitopenia induzida por heparina, os testes in vitro de agregação plaquetária têm valor preditivo limitado. A decisão do uso de enoxaparina sódica em tais casos deve ser tomada somente por um especialista; Gestantes com próteses mecânicas valvulares cardíacas Não foram realizados estudos adequados para avaliar a utilização de Versa (enoxaparina sódica) na tromboprofilaxia em gestantes com próteses mecânicas valvulares cardíacas. Em um estudo clínico em gestantes com próteses mecânicas valvulares cardíacas, administrou-se enoxaparina (1 mg/kg duas vezes ao dia) para redução do risco de tromboembolismo, 2 de 8 gestantes desenvolveram coágulos resultando em bloqueio da válvula, resultando em óbitos materno e fetal. Houve relatos isolados de farmacovigilância de trombose em gestantes com próteses mecânicas valvulares cardíacas enquanto eram medicadas com enoxaparina para tromboprofilaxia. Gestantes com próteses mecânicas valvulares cardíacas podem apresentar maiores risco de tromboembolismo. INTERAÇÕES MEDICAMENTOSAS Recomenda-se a interrupção do uso de medicamentos que afetam a hemostasia antes do início do tratamento com enoxaparina sódica, a menos que seu uso seja estritamente indicado. Tais medicamentos incluem: - salicilatos sistêmicos, ácido acetilsalicílico e outros antiinflamatórios não-esteroidais (AINEs), incluindo o cetorolaco de trometamina; - dextran 40, ticlopidina e clopidogrel; - glicocorticóides sistêmicos; - agentes trombolíticos e anticoagulantes; - outros agentes antiplaquetários, incluindo os antagonistas de glicoproteína IIb/IIIa. Em caso de indicação do uso de qualquer uma destas associações, deve-se utilizar Versa (enoxaparina sódica) sob monitorização clínica e laboratorial apropriadas. Interferência em exames de laboratório Nas doses utilizadas na profilaxia do tromboembolismo venoso, a enoxaparina sódica não influencia significantemente o tempo de sangramento e os testes de coagulação global, nem afeta a agregação plaquetária ou a ligação do fibrinogênio às plaquetas. Pode ocorrer aumento do tempo de tromboplastina parcial ativada (TTPa) e do tempo de coagulação ativada (TCA) com a administração de altas doses. Aumentos no TTPa e TCA não estão linearmente correlacionados ao aumento da atividade antitrombótica da enoxaparina sódica, sendo, portanto, inadequados e inseguros para a monitorização da atividade da enoxaparina sódica. COMO DEVO USAR ESTE MEDICAMENTO? INSTRUÇÕES DE USO Para administração do Versa (enoxaparina sódica) pela via subcutânea, deve-se seguir as instruções de uso mencionadas abaixo como técnica de injeção subcutânea, ignorandose o item 2 da Posologia (Prevenção da coagulação do circuito extracorpóreo durante a hemodiálise - Administração por via intravenosa).
4 Técnica de injeção subcutânea: 1. Antes de administrar Versa (enoxaparina sódica), confira a embalagem com a prescrição do médico. 2. A seringa já está pronta para uso. Observe que existe uma pequena bolha de gás dentro da seringa. Este gás é inerte e não se deve retirar esta bolha de gás da seringa. (Figura A). 3. Versa (enoxaparina sódica) deverá ser administrado, de preferência, com o paciente deitado (Figura B). 4. O local ideal para a injeção subcutânea é no tecido celular subcutâneo do abdômen (cintura), alternando-se, a cada aplicação, o lado direito com o esquerdo (Figura C). 5. Deve-se proceder a limpeza do local da aplicação com algodão hidrófilo ou gaze embebidos em anti-séptico (álcool 70%, por exemplo). A injeção subcutânea consiste na introdução da agulha verticalmente em todo o seu comprimento, na espessura de uma prega cutânea feita entre os dedos polegar e indicador (Figura D). 6. Injetar lentamente o conteúdo da seringa (Figura E). 7. Mantenha esta prega cutânea até o final da injeção (Figura F). 8. Ao final, faça discreta compressão local sem massagear. Depois de abertas, as seringas de Versa (enoxaparina sódica) devem ser utilizadas imediatamente. Se houver solução remanescente após o uso, descartá-la. DOSAGEM ( Ver item POSOLOGIA ) SIGA A ORIENTAÇÃO DO SEU MÉDICO, RESPEITANDO SEMPRE OS HORÁRIOS, AS DOSES E A DURAÇÃO DO TRATAMENTO. NÃO INTERROMPA O TRATAMENTO SEM O CONHECI- MENTO DO SEU MÉDICO. NÃO USE O MEDICAMENTO COM O PRAZO DE VALIDA- DE VENCIDO, CONVERSE COM O SEU MÉDICO E SIGA TODAS AS SUAS RECOMENDAÇÕES COM RELAÇÃO AS DOSES PRESCRITAS. ANTES DE USAR OBSERVE O ASPECTO DO MEDICA- MENTO. ASPECTO FÍSICO Solução límpida, incolor e isenta de partículas. CARACTERÍSTICAS ORGANOLÉPTICAS Ver item ASPECTO FÍSICO. QUAIS OS MALES QUE ESTE MEDICAMENTO PODE CAUSAR? Hemorragia: assim como com outros anticoagulantes, pode ocorrer sangramento na presença de fatores de risco associados como: lesões orgânicas suscetíveis de sangramento, procedimentos cirúrgicos ou uso de certas associações medicamentosas que afetam a hemostasia (ver itens ADVER- TÊNCIAS, PRECAUÇÕES e INTERAÇÕES MEDICAMEN- TOSAS). A origem do sangramento deve ser investigada devendo-se instituir tratamento apropriado. Foram relatados sangramentos de grande porte incluindo sangramento retroperitoneal e intracraniano, sendo que alguns casos foram fatais. Houve relatos de hematomas intra-espinhais com o uso concomitante de enoxaparina sódica e anestesia espinhal/epidural ou punção espinhal. Estas reações resultaram em graus variados de lesão neurológica, incluindo paralisia por tempo prolongado ou permanente (ver item ADVER- TÊNCIAS ). Trombocitopenia: relatou-se trombocitopenia leve, transitória e assintomática durante os primeiros dias de tratamento. Foram relatados raros casos de trombocitopenia imunoalérgica com trombose. Em alguns casos, a trombose foi complicada por infarto orgânico ou isquemia de extremidade (ver itens ADVERTÊNCIAS e Restrições a grupos de risco ). Reações locais: podem ocorrer dor, hematoma e irritação local leve após a administração subcutânea de enoxaparina sódica. Observou-se raramente no local de aplicação da enoxaparina sódica a presença de nódulos inflamatórios endurecidos (que não são inclusões císticas) que desapareceram após alguns dias e não devem ser motivo de interrupção do tratamento. Foram relatados casos excepcionais de necrose cutânea no local da administração de heparina e de heparinas de baixo peso molecular. Estes fenômenos são geralmente precedidos por púrpura ou placas eritematosas, infiltradas e dolorosas, devendo-se interromper o tratamento com enoxaparina sódica. Outras reações: embora raramente, podem ocorrer reações alérgicas cutâneas (erupções bolhosas) ou sistêmicas incluindo reações anafilactóides. Em alguns casos, pode ser necessária a interrupção do tratamento. Casos muito raros de vasculite por hipersensibilidade cutânea foram relatados. Foram relatadas elevações assintomáticas e reversíveis na contagem plaquetária e nos níveis de enzimas do fígado. O QUE FAZER SE ALGUÉM USAR UMA GRANDE QUAN- TIDADE DESTE MEDICAMENTO DE UMA SÓ VEZ? Sintomas e gravidade A superdosagem acidental após administração intravenosa, extracorporal ou subcutânea de Versa (enoxaparina sódica) pode causar complicações hemorrágicas. A absorção de
5 enoxaparina sódica após a administração oral, mesmo em altas doses, é pouco provável. Em caso de superdose acidental, procure imediatamente atendimento médico de emergência. Tratamento Os efeitos anticoagulantes podem ser, em grande parte, neutralizados pela administração intravenosa lenta de protamina. A dose de protamina deve ser idêntica à dose de enoxaparina sódica administrada, ou seja, 1 mg de protamina neutraliza o efeito anticoagulante de 1 mg de enoxaparina sódica, se a enoxaparina sódica foi administrada nas primeiras 8 horas. Uma infusão de 0,5 mg de protamina para 1 mg de enoxaparina sódica pode ser administrada se a enoxaparina sódica foi administrada em um período maior que 8 horas anteriores à administração da protamina, ou se tiver sido determinado que uma segunda dose de protamina seja necessária. Após 12 horas da injeção de enoxaparina sódica, a administração da protamina pode não ser necessária. Entretanto, mesmo com doses elevadas de protamina, a atividade anti-xa nunca é completamente neutralizada (máximo de aproximadamente 60%). ONDE E COMO DEVO GUARDAR ESTE MEDICAMEN- TO? Versa (enoxaparina sódica) deve ser conservado dentro da embalagem original, em temperatura ambiente (entre 15 e 30 ºC) e ao abrigo da luz. Não congelar as seringas préenchidas. TODO MEDICAMENTO DEVE SER MANTIDO FORA DO ALCANCE DAS CRIANÇAS. INFORMAÇÕES TÉCNICAS AOS PROFISSIONAIS DE SAÚDE CARACTERÍSTICAS FARMACOLÓGICAS Propriedades farmacodinâmicas O princípio ativo de Versa é a enoxaparina sódica. Trata-se de uma heparina de baixo peso molecular com peso médio de dáltons. A enoxaparina sódica é um sal de sódio. A distribuição do peso molecular é: <2000 dáltons 20% 2000 a 8000 dáltons 68% >8000 dáltons 18% A enoxaparina sódica é obtida pela despolimerização alcalina do éster benzil heparina derivado da mucosa intestinal suína. Sua estrutura é caracterizada por um grupo ácido 2-O-sulfo-4-enepiranosurônico no final não redutor da cadeia e um 2-N, 6-O-dissulfo-D-glicosamina no final redutor da cadeia polissacarídica. Aproximadamente 20% (variando entre 15% e 25%) da estrutura da enoxaparina contém um derivado 1,6 anidro no final redutor da cadeia polissacarídica. Em sistema purificado in vitro, a enoxaparina sódica apresenta alta atividade anti-xa (aproximadamente 100 U.I./mg) e baixa atividade anti-iia ou antitrombina (aproximadamente 28 U.I./mg). Estudos em voluntários sadios mostraram parâmetros farmacodinâmicos comparáveis de concentrações de enoxaparina sódica com intervalo de mg/ml. Propriedades farmacocinéticas Os parâmetros farmacocinéticos da enoxaparina sódica foram estudados principalmente em relação ao tempo da atividade plasmática anti-xa e também em relação à atividade anti-iia, nos intervalos de dose recomendados após administrações subcutâneas únicas e repetidas e após administração intravenosa única. A determinação quantitativa das atividades farmacocinéticas anti-xa e anti-iia foi realizada por métodos amidolíticos validados com substratos específicos e com a enoxaparina padrão calibrada contra o padrão internacional para heparinas de baixo peso molecular (NIBSC National institute for biological standards and control) Biodisponibilidade e Absorção A biodisponibilidade absoluta da enoxaparina sódica após administração subcutânea é próxima de 100%, baseada na atividade anti-xa. Volumes de injeção e concentração de doses no intervalo de mg/ml não afetam os parâmetros farmacocinéticos em voluntários sadios. A média da atividade anti-xa plasmática é observada 3 a 5 horas após administração subcutânea alcançando, aproximadamente, 0,2, 0,4, 1,0 e 1,3 UI anti-xa/ml após administração subcutânea de doses únicas de 20 mg, 40 mg, 1 mg e 1,5 mg/kg, respectivamente. A farmacocinética da enoxaparina parece ser linear nos intervalos de dose recomendados. A variabilidade intra e inter-pacientes é baixa. Após repetidas administrações subcutâneas de 40 mg, uma vez ao dia, e de 1,5 mg/kg uma vez ao dia, em voluntários sadios, o estado de equilíbrio é alcançado no 2 dia, com uma taxa de exposição média aproximadamente 15% maior do que após a administração de dose única. O nível de atividade da enoxaparina no estado de equilíbrio é bem previsível pela farmacocinética de dose única. Após administrações subcutâneas repetidas de 1 mg/kg, num regime de 2 vezes ao dia, o estado de equilíbrio é alcançado entre o 3 e o 4 dias, com uma exposição média aproximadamente 65% maior do que após administração de dose única, e as concentrações máxima e mínima médias de aproximadamente 1,2 e 0,52 U.I./mL, respectivamente. Baseada na farmacocinética da enoxaparina sódica, esta diferença no estado de equilíbrio é esperada e está dentro do intervalo terapêutico. A atividade plasmática anti-iia após a administração subcutânea é aproximadamente 10 vezes menor do que a atividade anti-xa. A média da atividade máxima anti-iia é observada aproximadamente 3-4 horas após administração subcutânea e alcança 0,13 U.I./mL e 0,19 U.I./mL após repetidas administrações de 1 mg/kg, duas vezes ao dia e de 1,5 mg/kg, uma vez ao dia, respectivamente. Distribuição O volume de distribuição da atividade anti-xa da enoxapari-
6 na sódica é de aproximadamente 5 L e é próximo ao volume sangüíneo. Eliminação e Metabolismo A enoxaparina sódica é um fármaco de baixa depuração, com média de clearance plasmático anti-xa de 0,74 L/h após infusão intravenosa de 1,5 mg/kg em 6 horas. A eliminação parece ser monofásica, com meia-vida de aproximadamente 4 horas após uma dose subcutânea única, e até aproximadamente 7 horas após doses repetidas. A enoxaparina é metabolizada principalmente no fígado por dessulfatação e/ou despolimerização formando moléculas de peso menor, que apresentam potência biológica muito reduzida. O clearance renal dos metabólitos ativos representa aproximadamente 10% da dose administrada e a excreção renal total de metabólitos ativos e não-ativos é de 40% da dose. Populações especiais Idosos: com base nos resultados da análise farmacocinética populacional, o perfil cinético da enoxaparina sódica não é diferente em voluntários idosos comparados a voluntários jovens quando a função renal é normal. Entretanto, como é conhecido que a função renal diminui com o aumento da idade, pacientes idosos podem apresentar eliminação reduzida da enoxaparina sódica (ver itens Pacientes idosos e POSOLOGIA ). Insuficiência renal: observou-se uma relação linear entre o clearance plasmático de anti-xa e o clearance de creatinina no estado de equilíbrio, o que indica um decréscimo do clearance da enoxaparina sódica em pacientes com função renal reduzida. A exposição anti-xa representada pela AUC ( área abaixo da curva =AAC), no estado de equilíbrio, é levemente aumentada na insuficiência renal leve (clearance de creatinina ml/min) e moderada (clearance de creatinina ml/min) após repetidas doses subcutâneas de 40 mg, uma vez ao dia. Em pacientes com insuficiência renal severa (clearance de creatinina < 30 ml/min), a AAC no estado de equilíbrio é significativamente aumentada em média de 65% após repetidas doses únicas diárias subcutâneas de 40 mg (ver os itens PRECAUÇÕES e PO- SOLOGIA ). Peso: após repetidas doses subcutâneas de 1,5 mg/kg, uma vez ao dia, a média da AAC de atividade anti-xa é levemente maior no estado de equilíbrio em voluntários sadios obesos (IMC Kg/m 2 ) em comparação aos voluntários controle não-obesos, enquanto a área máxima não é aumentada. Há menor clearance ajustado ao peso em voluntários obesos tratados com doses subcutâneas. Quando se administram doses não ajustadas ao peso, a exposição da atividade anti-xa é 50% maior em mulheres de peso baixo (< 45 Kg) e 27% maior em homens de peso baixo (< 57 Kg), após uma dose subcutânea única de 40 mg, quando comparada aos voluntários controle com peso normal (ver item Restrições a grupos de risco ). Hemodiálise: em um único estudo, a taxa de eliminação apresentou-se semelhante, porém a AAC foi duas vezes maior que na população controle, após uma dose intravenosa única de 0,25 ou 0,50 mg/kg. RESULTADOS DE EFICÁCIA Em um grande estudo multicêntrico, 3171 pacientes na fase aguda de angina instável ou infarto do miocárdio sem onda Q foram randomizados para receber, em associação com ácido acetilsalicílico (100 a 325 mg, uma vez ao dia), 1 mg/ kg de enoxaparina sódica em injeção subcutânea a cada 12 horas, ou heparina não-fracionada por administração intravenosa, ajustada com base no tempo de tromboplastina parcial ativada (TTPa). Os pacientes foram tratados em ambiente hospitalar por um período mínimo de 2 e máximo de 8 dias, até estabilização clínica, procedimentos de revascularização ou alta hospitalar. Os pacientes foram acompanhados por até 30 dias. A enoxaparina sódica, em comparação à heparina, diminuiu significantemente a incidência de angina recorrente, infarto do miocárdio e óbito, com redução do risco relativo de 16,2% no 14º dia, mantido por um período maior do que 30 dias. Além disto, um número menor de pacientes do grupo tratado com enoxaparina sódica foi submetido à angioplastia coronariana transluminal percutânea (ACTP) ou à revascularização cirúrgica (15,8% de redução do risco relativo no 30º dia). INDICAÇÕES - Tratamento da trombose venosa profunda já estabelecida com ou sem embolismo pulmonar; - Profilaxia do tromboembolismo venoso e recidivas, associados à cirurgia ortopédica ou à cirurgia geral; - Profilaxia do tromboembolismo venoso e recidivas em pacientes acamados, devido a doenças agudas incluindo insuficiência cardíaca, insuficiência respiratória, infecções graves e doenças reumáticas; - Prevenção da coagulação do circuito de circulação extracorpórea durante a hemodiálise; - Tratamento da angina instável e infarto do miocárdio sem onda Q,quando administrado concomitantemente ao ácido acetilsalicílico. CONTRAINDICAÇÕES - Hipersensibilidade à enoxaparina sódica, à heparina e seus derivados, inclusive outras heparinas de baixo peso molecular; - Hipersensibilidade ao álcool benzílico, componente da apresentação em frasco multidose; - Hemorragias ativas de grande porte e condições com alto risco de desenvolvimento de hemorragia incontrolável, incluindo acidente vascular cerebral hemorrágico recente. MODO DE USAR E CUIDADOS DE CONSERVAÇÃO DE- POIS DE ABERTO Ver item INSTRUÇÃO DE USO. POSOLOGIA 1. Profilaxia da trombose venosa profunda e recidivas e na profilaxia do tromboembolismo pulmonar A posologia de Versa (enoxaparina sódica) é determinada pela predisposição individual de ocorrer o tromboembolis-
7 mo venoso em situações desencadeantes como cirurgia, imobilização prolongada e trauma, entre outras. Dessa maneira, são considerados com risco moderado os indivíduos que apresentem os seguintes fatores predisponentes: idade superior a 40 anos, obesidade, varizes dos membros inferiores, neoplasia à distância, doença pulmonar ou cardíaca crônica, estrogenioterapia, puerpério, infecções sistêmicas, entre outros. São considerados com alto risco os indivíduos com história de tromboembolismo venoso prévio, neoplasia abdominal ou pélvica, cirurgia ortopédica de grande porte dos membros inferiores, entre outros. Administração por via subcutânea ( ver item INSTRU- ÇÃO DE USO ) Pacientes cirúrgicos: - Em pacientes que apresentam risco moderado de tromboembolismo (por exemplo: cirurgia abdominal), a profilaxia é obtida com a dose recomendada de Versa (enoxaparina sódica) de 20 mg uma vez ao dia por via subcutânea. Na cirurgia geral, a primeira injeção deve ser administrada 2 horas antes da intervenção cirúrgica. - Em pacientes com alto risco de tromboembolismo (por exemplo: cirurgia ortopédica), a profilaxia do tromboembolismo é obtida com injeção única diária subcutânea de Versa (enoxaparina sódica) 40 mg (0,4 ml correspondendo a U.I. anti-xa). A primeira injeção deve ser aplicada 12 horas antes da intervenção. A duração do tratamento depende da persistência do risco tromboembólico, em geral, até a deambulação do paciente (em média, 7 a 10 dias após a intervenção). Duração de tratamento mais prolongado pode ser apropriado em alguns pacientes e deve ser continuado enquanto houver risco de tromboembolismo venoso e até a deambulação do paciente. A administração única diária de 40 mg de Versa (enoxaparina sódica) por mais 3 semanas além da profilaxia inicial (em geral, após a alta hospitalar), comprovou ser benéfica em pacientes submetidos à cirurgia ortopédica. Para recomendações especiais sobre o intervalo entre as dosagens para anestesia espinhal/peridural e procedimentos de revascularização coronária percutânea: (ver item ADVERTÊNCIAS ). Pacientes clínicos A dose recomendada para pacientes clínicos é de 40 mg de enoxaparina sódica, uma vez ao dia, administrada por via subcutânea. A duração do tratamento deve ser de, no mínimo, 6 dias, devendo ser continuado até a deambulação total do paciente, por um período máximo de 14 dias. 2. Prevenção da coagulação do circuito extracorpóreo durante a hemodiálise Administração por via intravenosa A dose recomendada é de 1 mg/kg de Versa (enoxaparina sódica) injetada na linha arterial do circuito, no início da sessão de hemodiálise. O efeito desta dose geralmente é suficiente para uma sessão com duração de 4 horas. No caso de aparecimento de anéis de fibrina ou de uma sessão mais longa que o normal deve-se administrar dose complementar de 0,5 a 1,0 mg/kg de Versa (enoxaparina sódica). Em pacientes sob alto risco hemorrágico, a dose deve ser reduzida para 0,5 mg/kg quando o acesso vascular for duplo ou 0,75 mg/kg quando o acesso vascular for simples. 3. Tratamento da trombose venosa profunda A posologia de Versa (enoxaparina sódica) recomendada para o tratamento da trombose venosa profunda é de 1,5 mg/kg, uma vez ao dia ou 1 mg/kg, duas vezes ao dia, administrada por via subcutânea. Para pacientes com tromboembolismo complicado, recomenda-se a dose de 1 mg/kg, duas vezes ao dia. A enoxaparina sódica é geralmente prescrita por um período médio de 10 dias. A terapia anticoagulante oral deve ser iniciada quando apropriado e o tratamento com Versa (enoxaparina sódica) deve ser mantido até o início do efeito terapêutico do anticoagulante oral, medido através do tempo de protrombina ou do INR (2 a 3). 4. Tratamento de angina instável e infarto do miocárdio sem onda Q A posologia de Versa (enoxaparina sódica) recomendada é de 1 mg/kg a cada 12 horas, por via subcutânea, administrada concomitantemente com ácido acetilsalicílico (100 a 325 mg, uma vez ao dia). Nestes pacientes, o tratamento com Versa (enoxaparina sódica) deve ser prescrito por no mínimo 2 dias, e mantido até estabilização clínica. A duração normal do tratamento é de 2 a 8 dias. Populações Especiais Idosos Não é necessário realizar ajuste posológico em idosos, a menos que a função renal esteja prejudicada (ver itens Pacientes idosos, FARMACOCINÉTICA ). Crianças A segurança e eficácia da enoxaparina sódica em crianças ainda não foram estabelecidas. Insuficiência renal (Ver itens USO EM IDOSOS, CRIANÇAS E OUTROS GRUPOS DE RISCO e PROPRIEDADES FARMACOCI- NÉTICAS ) Insuficiência renal grave: é necessário realizar ajuste posológico em pacientes com insuficiência renal grave (clearance de creatinina < 30 ml/min), de acordo com as tabelas a seguir, visto que a exposição à enoxaparina sódica é significativamente aumentada nesta população. Para uso terapêutico, os seguintes ajustes posológicos são recomendados: Dose padrão...insuficiência grave dos rins 1 mg/kg, duas vezes ao dia... 1 mg/ Kg, uma vez ao dia 1,5 mg/kg, uma vez ao dia... 1 mg/kg, uma vez ao dia
8 Para uso profilático, os seguintes ajustes posológicos são recomendados: Dose padrão...insuficiência grave dos rins 40 mg, uma vez ao dia...20 mg, uma vez ao dia 20 mg, uma vez ao dia...20 mg, uma vez ao dia Estes ajustes posológicos não se aplicam à indicação de hemodiálise. Insuficiência renal leve e moderada: embora não seja recomendado realizar ajuste posológico em pacientes com insuficiência renal moderada (clearance de creatinina ml/min) e leve (clearance de creatinina ml/min), é aconselhável que se faça monitorização clínica cuidadosa. Insuficiência hepática: devido à ausência de estudos clínicos, recomenda-se cautela em pacientes com insuficiência hepática. Conduta necessária caso haja esquecimento de administração. Caso o paciente esqueça de administrar uma dose, ele deve administrá-la assim que possível, no entanto, se estiver próximo do horário da dose seguinte o paciente deverá esperar por este horário, respeitando sempre o intervalo determinado pela posologia. Nunca devem ser administradas duas doses ao mesmo tempo. ADVERTÊNCIAS Não administrar Versa (enoxaparina sódica) por via intramuscular. Hemorragia Assim como outros anticoagulantes, pode ocorrer sangramento em qualquer local ( REAÇÕES ADVERSAS ). Se ocorrer sangramento, a origem da hemorragia deve ser investigada e tratamento apropriado deve ser instituído; Monitorização da contagem plaquetária O risco de trombocitopenia induzida por heparina (reação mediada por anticorpos) também existe com heparinas de baixo peso molecular. Pode ocorrer trombocitopenia, geralmente entre o 5º e 21º dias após o início do tratamento com enoxaparina sódica. Recomenda-se, portanto, a realização de contagem plaquetária antes do início e regularmente durante o tratamento com enoxaparina sódica. Na prática, em caso de confirmação de diminuição significativa da contagem plaquetária (30 a 50% do valor inicial), o tratamento com enoxaparina sódica deve ser imediatamente interrompido e substituído por outra terapia. As heparinas de baixo peso molecular (HBPM) As heparinas de baixo peso molecular (HBPM) devem ser utilizadas individualmente, pois existem diferenças básicas entre elas quanto a: processo de produção, peso molecular, atividade anti-xa específica, unidade e dosagem. Isto ocasiona diferenças em suas atividades farmacocinética e biológica associadas, como por exemplo, a atividade antitrombina e a interação com as plaquetas. Portanto, é necessário obedecer às instruções de uso de cada medicamento. Anestesia espinhal/peridural Assim como com outros anticoagulantes, foram relatados casos de hematoma intra-espinhal com o uso concomitante de enoxaparina sódica e anestesia espinhal/peridural, que podem resultar em paralisia prolongada ou permanente. Estes eventos são raros com a administração de doses iguais ou inferiores a 40 mg/dia de enoxaparina sódica. O risco destes eventos pode ser aumentado pela administração de doses maiores de enoxaparina sódica, uso de cateter epidural pós-operatório ou em caso de administração concomitante de medicamentos que alteram a hemostasia, como antiinflamatórios não esteroidais (ver item INTERAÇÕES MEDICAMENTOSAS ). O risco parece também ser aumentado por traumatismo ou punções espinhais repetidas. Para reduzir o risco potencial de sangramento associado ao uso concomitante de enoxaparina sódica e anestesia/analgesia peridural ou espinhal, deve-se considerar o perfil farmacocinético da enoxaparina sódica (ver item PROPRIE- DADES FARMACOCINÉTICAS ). A introdução e remoção do cateter devem ser realizadas quando o efeito anticoagulante da enoxaparina sódica estiver baixo. A introdução ou remoção do cateter deve ser postergada para horas após a administração de enoxaparina sódica na profilaxia da trombose venosa profunda, enquanto que em pacientes recebendo doses maiores de enoxaparina sódica (1 mg/kg duas vezes ao dia ou 1,5 mg/kg uma vez ao dia), a introdução ou remoção do cateter deverá ocorrer 24 horas após a administração. A dose subseqüente de enoxaparina sódica deve ser administrada no mínimo 2 horas após a remoção do cateter. O médico deve decidir sobre a administração de anticoagulantes durante o uso de anestesia peridural/espinhal. Devese empregar extrema cautela e monitorização freqüente para detectar qualquer sinal ou sintoma de lesão neurológica, tais como, dor na região lombar, deficiências sensoriais e motoras (entorpecimento ou fraqueza dos membros inferiores), alterações intestinais e/ou urinárias. Os pacientes devem ser instruídos a informarem imediatamente seu médico caso apresentem qualquer sintoma ou sinal descrito acima. Em caso de suspeita de sinais ou sintomas de hematoma intra-espinhal, devem ser efetuados o diagnóstico e tratamento, incluindo descompressão da medula espinhal, com urgência. Procedimentos de revascularização coronária percutânea Para minimizar o risco de sangramento após a instrumentação vascular durante o tratamento da angina instável e infarto do miocárdio sem onda Q, a bainha de acesso vascular deve permanecer no local durante um período de 6 a 8 horas após a administração subcutânea de enoxaparina sódica. A próxima dose de enoxaparina sódica programada não deve ser administrada antes de 6 a 8 horas após a remoção da bainha. Deve-se ter atenção especial ao local do procedimento para detecção de sinais de sangramento ou formação de hematoma.
9 A utilização de Versa (enoxaparina sódica) não afeta a habilidade de dirigir ou operar máquinas. Risco de uso por via de administração não recomendada Não há estudos dos efeitos de Versa (enoxaparina sódica) administrado por vias não recomendadas. Portanto, por segurança e para eficácia deste medicamento, a administração deve ser somente pela via intravenosa ou subcutânea, conforme prescrição médica. Gravidez Estudos em animais não demonstraram qualquer evidência de fetotoxicidade ou teratogenicidade. Em ratas prenhes, a passagem de 35 S-enoxaparina sódica através da placenta é mínima. Em humanos, não existe evidência da passagem da enoxaparina sódica através da placenta durante o segundo trimestre da gravidez. Ainda não existem informações disponíveis a este respeito durante o primeiro e terceiro trimestres da gravidez. Como não foram realizados estudos adequados e bem controlados em gestantes e como os estudos realizados em animais nem sempre são bons indicativos da resposta humana, deve-se utilizar enoxaparina sódica durante a gravidez somente se o médico considerar como estritamente necessário. A enoxaparina não se mostrou mutagênica em testes in vitro, incluindo o teste Ames, o teste de mutação de células de linfoma em ratos, o teste de aberração cromossômica linfocítica em humanos e os testes in vivo de aberração cromossômica na medula óssea de ratos. Este medicamento não deve ser utilizado por mulheres grávidas sem orientação médica ou do cirurgião-dentista. Categoria de risco na gravidez: categoria B. Lactação Em ratas lactantes, a concentração de 35 S-enoxaparina sódica ou de seus metabólitos marcados no leite é muito baixa. Não se sabe se a enoxaparina sódica inalterada é excretada no leite humano. A absorção oral da enoxaparina sódica é improvável, porém como precaução, não se deve amamentar durante o tratamento com Versa (enoxaparina sódica). Fertilidade Descobriu-se que a enoxaparina não tem nenhum efeito na fertilidade ou no desempenho reprodutivo de ratos machos e fêmeas em doses subcutâneas de até 20 mg/kg/dia. Estudos de teratologia vem sendo conduzidos em ratas e coelhas prenhes em doses subcutâneas de enoxaparina de até 30 mg/kg/dia. Não houve, até agora, nenhuma evidência de efeitos teratogênicos ou fetotoxicidade devido à enoxaparina. Efeito carcinogênico Não foram realizados estudos de longa duração em animais para avaliar o potencial carcinogênico da enoxaparina. USO EM IDOSOS, CRIANÇAS E OUTROS GRUPOS DE RISCO Pacientes idosos Não foi observado aumento na tendência de hemorragia em idosos com doses profiláticas. Porém, pacientes idosos (especialmente pacientes 80 anos de idade) podem ter um aumento no risco de complicações hemorrágicas com doses terapêuticas. Portanto, aconselha-se monitorização clínica cuidadosa (ver itens POSOLOGIA e FARMACO- CINÉTICA ). Pacientes idosos podem apresentar eliminação reduzida da enoxaparina sódica. (ver item POSOLOGIA ). Crianças A segurança e eficácia da enoxaparina sódica em crianças ainda não foram estabelecidas. Restrições a grupos de risco A enoxaparina sódica, assim como qualquer outro anticoagulante, deve ser utilizada com cautela em pacientes com alto risco de hemorragia, como nos seguintes casos: - alterações na hemostasia; - história de úlcera péptica; - acidente vascular cerebral isquêmico recente; - hipertensão arterial grave não controlada por medicamentos; - retinopatia diabética; - neurocirurgia ou cirurgia oftálmica recente; - uso concomitante de medicamentos que afetem a hemostasia (ver item INTERAÇÕES MEDICAMENTOSAS ). Próteses mecânicas valvulares cardíacas O uso de Versa (enoxaparina sódica) não foi adequadamente estudado para casos de tromboprofilaxia em pacientes com próteses valvulares cardíacas. Foram relatados casos isolados de trombose com próteses valvulares cardíacas em pacientes com próteses mecânicas valvulares que receberam enoxaparina para tromboprofilaxia. A avaliação destes casos é limitada devido aos fatores causais serem confusos - incluindo doenças anteriores e dados clínicos insuficientes. Alguns destes casos foram em gestantes nas quais a trombose resultou em óbitos materno e fetal. Gestantes com próteses mecânicas valvulares cardíacas podem apresentar maior risco para tromboembolismo. Insuficiência renal Em pacientes com insuficiência renal, existe aumento da exposição à enoxaparina sódica, aumentando também o risco de hemorragia. Como a exposição à enoxaparina sódica aumenta significativamente em pacientes com insuficiência renal severa (clearance de creatinina < 30mL/min), o ajuste posológico é recomendado para dosagens terapêuticas e profiláticas. Embora não seja recomendado ajuste posológico em pacientes com insuficiência renal moderada (clearance de creatinina ml/min) e leve (clearance de creatinina ml/min), é aconselhável realizar monitorização clínica cuidadosa (ver itens POSOLOGIA e FAR-
10 MACOCINÉTICA ); Peso baixo Um aumento na exposição à enoxaparina sódica em doses profiláticas (não ajustadas ao peso) tem sido observado em mulheres de peso baixo (< 45 Kg) e homens de baixo peso (< 57 Kg), que pode resultar em maior risco de hemorragia. Portanto, é aconselhável realizar monitorização clínica cuidadosa nestes pacientes (ver item PROPRIEDADES FAR- MACOCINÉTICA ); Trombocitopenia induzida pela heparina Versa (enoxaparina sódica) deve ser utilizado com extrema cautela em pacientes com história de trombocitopenia induzida pela heparina, com ou sem trombose. O risco de trombocitopenia induzida por heparina pode persistir por vários anos. Em caso de suspeita de trombocitopenia induzida por heparina, os testes in vitro de agregação plaquetária têm valor preditivo limitado. A decisão do uso de enoxaparina sódica em tais casos deve ser tomada somente por um especialista; Gestantes com próteses mecânicas valvulares cardíacas Não foram realizados estudos adequados para avaliar a utilização de Versa (enoxaparina sódica) na tromboprofilaxia em gestantes com próteses mecânicas valvulares cardíacas. Em um estudo clínico em gestantes com próteses mecânicas valvulares cardíacas, administrou-se enoxaparina (1 mg/kg duas vezes ao dia) para redução do risco de tromboembolismo, 2 de 8 gestantes desenvolveram coágulos resultando em bloqueio da válvula, resultando em óbitos materno e fetal. Houve relatos isolados de farmacovigilância de trombose em gestantes com próteses mecânicas valvulares cardíacas enquanto eram medicadas com enoxaparina para tromboprofilaxia. Gestantes com próteses mecânicas valvulares cardíacas podem apresentar maiores risco de tromboembolismo. INTERAÇÕES MEDICAMENTOSAS Recomenda-se a interrupção do uso de medicamentos que afetam a hemostasia antes do início do tratamento com enoxaparina sódica, a menos que seu uso seja estritamente indicado. Tais medicamentos incluem: - salicilatos sistêmicos, ácido acetilsalicílico e outros AINEs, incluindo o cetorolaco; - dextran 40, ticlopidina e clopidogrel; - glicocorticóides sistêmicos; - agentes trombolíticos e anticoagulantes; - outros agentes antiplaquetários, incluindo os antagonistas de glicoproteína IIb/IIIa. Em caso de indicação do uso de qualquer uma destas associações, deve-se utilizar Versa (enoxaparina sódica) sob monitorização clínica e laboratorial apropriadas. Interferência em exames de laboratório Nas doses utilizadas na profilaxia do tromboembolismo venoso, a enoxaparina sódica não influencia significantemente o tempo de sangramento e os testes de coagulação global, nem afeta a agregação plaquetária ou a ligação do fibrinogênio às plaquetas. Pode ocorrer aumento do tempo de tromboplastina parcial ativada (TTPa) e do tempo de coagulação ativada (TCA) com a administração de altas doses. Aumentos no TTPa e TCA não estão linearmente correlacionados ao aumento da atividade antitrombótica da enoxaparina sódica, sendo, portanto, inadequados e inseguros para a monitorização da atividade da enoxaparina sódica. REAÇÕES ADVERSAS A MEDICAMENTOS Hemorragia: assim como com outros anticoagulantes, pode ocorrer sangramento na presença de fatores de risco associados como: lesões orgânicas suscetíveis de sangramento, procedimentos cirúrgicos ou uso de certas associações medicamentosas que afetam a hemostasia (ver itens ADVER- TÊNCIAS, Restrições a grupos de risco e INTERAÇÕES MEDICAMENTOSAS ). A origem do sangramento deve ser investigada devendo-se instituir tratamento apropriado. Foram relatados sangramentos de grande porte incluindo sangramento retroperitoneal e intracraniano, sendo que alguns casos foram fatais.houve relatos de hematomas intraespinhais com o uso concomitante de enoxaparina sódica e anestesia espinhal/epidural ou punção espinhal. Estas reações resultaram em graus variados de lesão neurológica, incluindo paralisia por tempo prolongado ou permanente (ver item ADVERTÊNCIAS ). Além dos efeitos anticoagulantes da enoxaparina, não houve evidência de efeitos adversos em doses de 15 mg/kg/ dia em 13 semanas de estudos de toxicidade subcutânea, ambos em ratos e cães e em doses de 10 mg/kg/dia em 26 semanas de estudos de toxicidade subcutânea e intravenosa ambos em ratos e macacos. Trombocitopenia: relatou-se trombocitopenia leve, transitória e assintomática durante os primeiros dias de tratamento. Foram relatados raros casos de trombocitopenia imunoalérgica com trombose. Em alguns casos, a trombose foi complicada por infarto orgânico ou isquemia de extremidade (ver itens ADVERTÊNCIAS e Restrições a grupos de risco ). Reações locais: podem ocorrer dor, hematoma e irritação local leve após a administração subcutânea de enoxaparina sódica. Observou-se raramente no local de aplicação da enoxaparina sódica a presença de nódulos inflamatórios endurecidos (que não são inclusões císticas) que desapareceram após alguns dias e não devem ser motivo de interrupção do tratamento. Foram relatados casos excepcionais de necrose cutânea no local da administração de heparina e de heparinas de baixo peso molecular. Estes fenômenos são geralmente precedidos por púrpura ou placas eritematosas, infiltradas e dolorosas, devendo-se interromper o tratamento com enoxaparina sódica. Outras reações: embora raramente, podem ocorrer reações alérgicas cutâneas (erupções bolhosas) ou sistêmicas incluindo reações anafilactóides. Em alguns casos, pode ser necessária a interrupção do tratamento.
11 Casos muito raros de vasculite por hipersensibilidade cutânea foram relatados. Foram relatadas elevações assintomáticas e reversíveis na contagem plaquetária e nos níveis de enzimas hepáticas. SUPERDOSE Sintomas e gravidade A superdosagem acidental após administração intravenosa, extracorporal ou subcutânea de Versa (enoxaparina sódica) pode causar complicações hemorrágicas. A absorção de enoxaparina sódica após a administração oral, mesmo em altas doses, é pouco provável. Tratamento Os efeitos anticoagulantes podem ser, em grande parte, neutralizados pela administração intravenosa lenta de protamina. A dose de protamina deve ser idêntica à dose de enoxaparina sódica administrada, ou seja, 1 mg de protamina neutraliza o efeito anticoagulante de 1 mg de enoxaparina sódica, se a enoxaparina sódica foi administrada nas primeiras 8 horas. Uma infusão de 0,5 mg de protamina para 1 mg de enoxaparina sódica pode ser administrada se a enoxaparina sódica foi administrada em um período maior que 8 horas anteriores à administração da protamina, ou se tiver sido determinado que uma segunda dose de protamina seja necessária. Após 12 horas da injeção de enoxaparina sódica, a administração da protamina pode não ser necessária. Entretanto, mesmo com doses elevadas de protamina, a atividade anti-xa nunca é completamente neutralizada (máximo de aproximadamente 60%). ARMAZENAGEM Versa (enoxaparina sódica) deve ser conservado dentro da embalagem original, em temperatura ambiente (entre 15 e 30 ºC) e ao abrigo da luz. Não congelar as seringas préenchidas. VENDA SOB PRESCRIÇÃO MÉDICA. Registro M.S.: Farmacêutica responsável: Dra. Sônia Albano Badaró - CRF/SP EUROFARMA LABORATÓRIOS LTDA Av. Ver. José Diniz, São Paulo - SP CNPJ / Indústria Brasileira CENTRAL DE ATENDIMENTO:
ENOXALOW enoxaparina sódica. Forma farmacêutica e apresentações Solução injetável. Via de administração: IV/SC
 ENOXALOW enoxaparina sódica Forma farmacêutica e apresentações Solução injetável. Via de administração: IV/SC 20 mg/0,2 ml cartucho com 1 ou 10 seringas. 40 mg/0,4 ml cartucho com 1 ou 10 seringas. 60
ENOXALOW enoxaparina sódica Forma farmacêutica e apresentações Solução injetável. Via de administração: IV/SC 20 mg/0,2 ml cartucho com 1 ou 10 seringas. 40 mg/0,4 ml cartucho com 1 ou 10 seringas. 60
Versa. Bula para paciente. Solução injetável. 100 mg/ml
 Versa Bula para paciente Solução injetável 100 mg/ml VERSA enoxaparina sódica Solução injetável FORMA FARMACÊUTICA E APRESENTAÇÕES: Versa (enoxaparina sódica) solução injetável: 20 mg/0,2 ml, 40 mg/0,4
Versa Bula para paciente Solução injetável 100 mg/ml VERSA enoxaparina sódica Solução injetável FORMA FARMACÊUTICA E APRESENTAÇÕES: Versa (enoxaparina sódica) solução injetável: 20 mg/0,2 ml, 40 mg/0,4
Esta bula é continuamente atualizada. Favor proceder a sua leitura antes de utilizar o medicamento. CLEXANE enoxaparina sódica
 MODELO DE TEXTO DE BULA SANOFI-AVENTIS Esta bula é continuamente atualizada. Favor proceder a sua leitura antes de utilizar o medicamento. CLEXANE enoxaparina sódica FORMA FARMACÊUTICA E APRESENTAÇÕES
MODELO DE TEXTO DE BULA SANOFI-AVENTIS Esta bula é continuamente atualizada. Favor proceder a sua leitura antes de utilizar o medicamento. CLEXANE enoxaparina sódica FORMA FARMACÊUTICA E APRESENTAÇÕES
Esta bula é continuamente atualizada. Favor proceder a sua leitura antes de utilizar o medicamento. CLEXANE enoxaparina sódica
 MODELO DE TEXTO DE BULA Esta bula é continuamente atualizada. Favor proceder a sua leitura antes de utilizar o medicamento. CLEXANE enoxaparina sódica FORMA FARMACÊUTICA E APRESENTAÇÕES Solução injetável.
MODELO DE TEXTO DE BULA Esta bula é continuamente atualizada. Favor proceder a sua leitura antes de utilizar o medicamento. CLEXANE enoxaparina sódica FORMA FARMACÊUTICA E APRESENTAÇÕES Solução injetável.
CLEXANE enoxaparina sódica
 MODELO DE BULA Esta bula sofreu aumento de tamanho para adequação à legislação vigente da ANVISA. Esta bula é continuamente atualizada. Favor proceder a sua leitura antes de utilizar o medicamento. CLEXANE
MODELO DE BULA Esta bula sofreu aumento de tamanho para adequação à legislação vigente da ANVISA. Esta bula é continuamente atualizada. Favor proceder a sua leitura antes de utilizar o medicamento. CLEXANE
CLEXANE enoxaparina sódica
 MODELO DE BULA Esta bula sofreu aumento de tamanho para adequação à legislação vigente da ANVISA. Esta bula é continuamente atualizada. Favor proceder a sua leitura antes de utilizar o medicamento. CLEXANE
MODELO DE BULA Esta bula sofreu aumento de tamanho para adequação à legislação vigente da ANVISA. Esta bula é continuamente atualizada. Favor proceder a sua leitura antes de utilizar o medicamento. CLEXANE
CENTRO DE APOIO OPERACIONAL DE DEFESA DA SAÚDE CESAU ORIENTAÇÃO TÉCNICA N.º 064 /2015 - CESAU
 ORIENTAÇÃO TÉCNICA N.º 064 /2015 - CESAU Salvador, 13 de abril de 2015 OBJETO: Parecer. - Centro de Apoio Operacional de Defesa da Saúde- CESAU REFERÊNCIA: 3 a promotoria de Justiça de Dias D'Àvila / Dispensação
ORIENTAÇÃO TÉCNICA N.º 064 /2015 - CESAU Salvador, 13 de abril de 2015 OBJETO: Parecer. - Centro de Apoio Operacional de Defesa da Saúde- CESAU REFERÊNCIA: 3 a promotoria de Justiça de Dias D'Àvila / Dispensação
CLEXANE Sanofi-Aventis Farmacêutica Ltda. Solução Injetável 20 mg/0.2 ml 40 mg/0.4 ml 60 mg/0.6 ml 80 mg/0.8 ml 100 mg/1.0 ml
 CLEXANE Sanofi-Aventis Farmacêutica Ltda. Solução Injetável 20 mg/0.2 ml 40 mg/0.4 ml 60 mg/0.6 ml 80 mg/0.8 ml 100 mg/1.0 ml Esta bula sofreu aumento de tamanho para adequação à legislação vigente da
CLEXANE Sanofi-Aventis Farmacêutica Ltda. Solução Injetável 20 mg/0.2 ml 40 mg/0.4 ml 60 mg/0.6 ml 80 mg/0.8 ml 100 mg/1.0 ml Esta bula sofreu aumento de tamanho para adequação à legislação vigente da
ALLERGAN PRODUTOS FARMACÊUTICOS LTDA
 REFRESH ALLERGAN PRODUTOS FARMACÊUTICOS LTDA Solução Oftálmica Estéril sem conservante álcool polivinílico 1,4% povidona 0,6% BULA PARA O PACIENTE APRESENTAÇÃO Solução Oftálmica Estéril Lubrificante, sem
REFRESH ALLERGAN PRODUTOS FARMACÊUTICOS LTDA Solução Oftálmica Estéril sem conservante álcool polivinílico 1,4% povidona 0,6% BULA PARA O PACIENTE APRESENTAÇÃO Solução Oftálmica Estéril Lubrificante, sem
Daiichi Sankyo Brasil Farmacêutica Ltda.
 IDENTIFICAÇÃO DO MEDICAMENTO BENICAR olmesartana medoxomila APRESENTAÇÕES Benicar é apresentado em embalagens com 10 ou 30 comprimidos revestidos de olmesartana medoxomila nas concentrações de 20 mg ou
IDENTIFICAÇÃO DO MEDICAMENTO BENICAR olmesartana medoxomila APRESENTAÇÕES Benicar é apresentado em embalagens com 10 ou 30 comprimidos revestidos de olmesartana medoxomila nas concentrações de 20 mg ou
LABIRIN. dicloridrato de betaistina APSEN. FORMA FARMACÊUTICA Comprimidos. APRESENTAÇÕES Comprimidos de 24 mg. Caixa com 30 comprimidos.
 LABIRIN dicloridrato de betaistina APSEN FORMA FARMACÊUTICA Comprimidos APRESENTAÇÕES Comprimidos de 24 mg. Caixa com 30 comprimidos. USO ORAL USO ADULTO COMPOSIÇÃO Cada comprimido contém: 24 mg dicloridrato
LABIRIN dicloridrato de betaistina APSEN FORMA FARMACÊUTICA Comprimidos APRESENTAÇÕES Comprimidos de 24 mg. Caixa com 30 comprimidos. USO ORAL USO ADULTO COMPOSIÇÃO Cada comprimido contém: 24 mg dicloridrato
Penvir Lábia. (penciclovir) EMS SIGMA PHARMA LTDA. creme
 Penvir Lábia (penciclovir) EMS SIGMA PHARMA LTDA creme 1% I - IDENTIFICAÇÃO DO MEDICAMENTO Penvir Lábia penciclovir APRESENTAÇÕES Penvir Lábia Creme a 1%. Embalagem contendo bisnaga de 5g. USO ADULTO USO
Penvir Lábia (penciclovir) EMS SIGMA PHARMA LTDA creme 1% I - IDENTIFICAÇÃO DO MEDICAMENTO Penvir Lábia penciclovir APRESENTAÇÕES Penvir Lábia Creme a 1%. Embalagem contendo bisnaga de 5g. USO ADULTO USO
Não utilize POLARAMINE Creme se você já teve alguma reação incomum a qualquer um dos componentes da fórmula do produto.
 POLARAMINE Creme maleato de dexclorfeniramina FORMAS FARMACÊUTICAS E APRESENTAÇÕES POLARAMINE Creme é indicado para uso na pele. POLARAMINE Creme apresenta-se em bisnagas de 30 g. USO ADULTO E PEDIÁTRICO
POLARAMINE Creme maleato de dexclorfeniramina FORMAS FARMACÊUTICAS E APRESENTAÇÕES POLARAMINE Creme é indicado para uso na pele. POLARAMINE Creme apresenta-se em bisnagas de 30 g. USO ADULTO E PEDIÁTRICO
DOBEVEN. Apsen Farmacêutica S.A. Cápsula gelatinosa dura 500 mg
 DOBEVEN Apsen Farmacêutica S.A. Cápsula gelatinosa dura 500 mg DOBEVEN dobesilato de cálcio APSEN FORMA FARMACÊUTICA Cápsula gelatinosa dura APRESENTAÇÕES Cápsula gelatinosa dura contendo 500 mg de dobesilato
DOBEVEN Apsen Farmacêutica S.A. Cápsula gelatinosa dura 500 mg DOBEVEN dobesilato de cálcio APSEN FORMA FARMACÊUTICA Cápsula gelatinosa dura APRESENTAÇÕES Cápsula gelatinosa dura contendo 500 mg de dobesilato
MODELO DE BULA. USO ADULTO E PEDIÁTRICO (crianças acima de dois anos de idade)
 MODELO DE BULA Logo Novartis Lacrigel TM A palmitato de retinol 10 mg/g Lágrima artificial estéril Forma farmacêutica e apresentação Gel oftálmico: cada tubo contém 10 g de gel. USO ADULTO E PEDIÁTRICO
MODELO DE BULA Logo Novartis Lacrigel TM A palmitato de retinol 10 mg/g Lágrima artificial estéril Forma farmacêutica e apresentação Gel oftálmico: cada tubo contém 10 g de gel. USO ADULTO E PEDIÁTRICO
LACRIFILM (carmelose sódica)
 LACRIFILM (carmelose sódica) União Química Farmacêutica Nacional S.A. solução oftálmica 5 mg/ml LACRIFILM carmelose sódica Solução oftálmica estéril IDENTIFICAÇÃO DO PRODUTO FORMA FARMACÊUTICA E APRESENTAÇÕES
LACRIFILM (carmelose sódica) União Química Farmacêutica Nacional S.A. solução oftálmica 5 mg/ml LACRIFILM carmelose sódica Solução oftálmica estéril IDENTIFICAÇÃO DO PRODUTO FORMA FARMACÊUTICA E APRESENTAÇÕES
SALSEP cloreto de sódio Solução nasal 9 mg/ml
 SALSEP cloreto de sódio Solução nasal 9 mg/ml USO INTRANASAL USO ADULTO E PEDIÁTRICO FORMAS FARMACÊUTICAS E APRESENTAÇÕES Solução nasal com 9 mg/ml de cloreto de sódio. Embalagem com 1 frasco spray nasal
SALSEP cloreto de sódio Solução nasal 9 mg/ml USO INTRANASAL USO ADULTO E PEDIÁTRICO FORMAS FARMACÊUTICAS E APRESENTAÇÕES Solução nasal com 9 mg/ml de cloreto de sódio. Embalagem com 1 frasco spray nasal
ALLERGAN PRODUTOS FARMACÊUTICOS LTDA
 RELESTAT ALLERGAN PRODUTOS FARMACÊUTICOS LTDA Solução Oftálmica Estéril cloridrato de epinastina 0,05% BULA PARA O PACIENTE APRESENTAÇÕES Solução Oftálmica Estéril Frasco plástico conta-gotas contendo
RELESTAT ALLERGAN PRODUTOS FARMACÊUTICOS LTDA Solução Oftálmica Estéril cloridrato de epinastina 0,05% BULA PARA O PACIENTE APRESENTAÇÕES Solução Oftálmica Estéril Frasco plástico conta-gotas contendo
ZINCOLOK ALLERGAN PRODUTOS FARMACÊUTICOS LTDA
 ZINCOLOK ALLERGAN PRODUTOS FARMACÊUTICOS LTDA Frasco plástico gotejador contendo 10 ml de solução oftálmica estéril de sulfato de zinco e cloridrato de nafazolina APRESENTAÇÃO Solução Oftálmica Estéril
ZINCOLOK ALLERGAN PRODUTOS FARMACÊUTICOS LTDA Frasco plástico gotejador contendo 10 ml de solução oftálmica estéril de sulfato de zinco e cloridrato de nafazolina APRESENTAÇÃO Solução Oftálmica Estéril
paracetamol Biosintética Farmacêutica Ltda. Solução oral 200 mg/ml
 paracetamol Biosintética Farmacêutica Ltda. Solução oral 200 mg/ml BULA PARA PACIENTE Bula de acordo com a Resolução-RDC nº 47/2009 I - IDENTIFICAÇÃO DO MEDICAMENTO paracetamol Medicamento Genérico Lei
paracetamol Biosintética Farmacêutica Ltda. Solução oral 200 mg/ml BULA PARA PACIENTE Bula de acordo com a Resolução-RDC nº 47/2009 I - IDENTIFICAÇÃO DO MEDICAMENTO paracetamol Medicamento Genérico Lei
DOBEVEN. dobesilato de cálcio. APRESENTAÇÕES Cápsula gelatinosa dura contendo 500 mg de dobesilato de cálcio: Caixas com 5 e 30 cápsulas.
 DOBEVEN dobesilato de cálcio APSEN FORMA FARMACÊUTICA Cápsula gelatinosa dura APRESENTAÇÕES Cápsula gelatinosa dura contendo 500 mg de dobesilato de cálcio: Caixas com 5 e 30 cápsulas. USO ORAL USO ADULTO
DOBEVEN dobesilato de cálcio APSEN FORMA FARMACÊUTICA Cápsula gelatinosa dura APRESENTAÇÕES Cápsula gelatinosa dura contendo 500 mg de dobesilato de cálcio: Caixas com 5 e 30 cápsulas. USO ORAL USO ADULTO
Transamin Ácido Tranexâmico
 Transamin Ácido Tranexâmico 250 mg Zydus Nikkho Farmacêutica Ltda Comprimidos Bula do Paciente I- IDENTIFICAÇÃO DO MEDICAMENTO TRANSAMIN ácido tranexâmico APRESENTAÇÕES Comprimidos de 250 mg. Embalagem
Transamin Ácido Tranexâmico 250 mg Zydus Nikkho Farmacêutica Ltda Comprimidos Bula do Paciente I- IDENTIFICAÇÃO DO MEDICAMENTO TRANSAMIN ácido tranexâmico APRESENTAÇÕES Comprimidos de 250 mg. Embalagem
BULA DE NALDECON DOR COMPRIMIDOS
 BULA DE NALDECON DOR COMPRIMIDOS BRISTOL-MYERS SQUIBB NALDECON DOR paracetamol Dores em geral Febre Uma dose = 2 comprimidos FORMA FARMACÊUTICA E APRESENTAÇÃO NALDECON DOR é apresentado em displays com
BULA DE NALDECON DOR COMPRIMIDOS BRISTOL-MYERS SQUIBB NALDECON DOR paracetamol Dores em geral Febre Uma dose = 2 comprimidos FORMA FARMACÊUTICA E APRESENTAÇÃO NALDECON DOR é apresentado em displays com
Kavit fitomenadiona. Solução Injetável 10 mg/ml. Cristália Produtos Químicos Farmacêuticos Ltda. MODELO DE BULA PARA O PACIENTE
 Kavit fitomenadiona Solução Injetável 10 mg/ml Cristália Produtos Químicos Farmacêuticos Ltda. MODELO DE BULA PARA O PACIENTE IDENTIFICAÇÃO DO MEDICAMENTO KAVIT fitomenadiona APRESENTAÇÃO Caixa contendo
Kavit fitomenadiona Solução Injetável 10 mg/ml Cristália Produtos Químicos Farmacêuticos Ltda. MODELO DE BULA PARA O PACIENTE IDENTIFICAÇÃO DO MEDICAMENTO KAVIT fitomenadiona APRESENTAÇÃO Caixa contendo
OFTPRED. Suspensão Oftálmica Estéril. acetato de prednisolona 10 mg/ml BULA PARA O PACIENTE LATINOFARMA INDÚSTRIAS FARMACÊUTICAS LTDA
 OFTPRED LATINOFARMA INDÚSTRIAS FARMACÊUTICAS LTDA Suspensão Oftálmica Estéril acetato de prednisolona 10 mg/ml BULA PARA O PACIENTE COLÍRIO OFTPRED acetato de prednisolona 1,0% APRESENTAÇÕES Suspensão
OFTPRED LATINOFARMA INDÚSTRIAS FARMACÊUTICAS LTDA Suspensão Oftálmica Estéril acetato de prednisolona 10 mg/ml BULA PARA O PACIENTE COLÍRIO OFTPRED acetato de prednisolona 1,0% APRESENTAÇÕES Suspensão
Princípios Ativos Ácido Cítrico,Ácido Acetilsalicílico, Bicarbonato de Sódio e Carbonato de Sodio.
 Sonrisal Classe terapêutica dos Antiacidos. Princípios Ativos Ácido Cítrico,Ácido Acetilsalicílico, Bicarbonato de Sódio e Carbonato de Sodio. Indicação Para quê serve Sonrisal? Sonrisal é indicado como
Sonrisal Classe terapêutica dos Antiacidos. Princípios Ativos Ácido Cítrico,Ácido Acetilsalicílico, Bicarbonato de Sódio e Carbonato de Sodio. Indicação Para quê serve Sonrisal? Sonrisal é indicado como
Actifedrin. cloridrato de triprolidina cloridrato de pseudoefedrina
 Actifedrin cloridrato de triprolidina cloridrato de pseudoefedrina Formas farmacêuticas e apresentações Xarope embalagem contendo 100 ml Comprimidos embalagem contendo 20 comprimidos USO ADULTO E PEDIÁTRICO
Actifedrin cloridrato de triprolidina cloridrato de pseudoefedrina Formas farmacêuticas e apresentações Xarope embalagem contendo 100 ml Comprimidos embalagem contendo 20 comprimidos USO ADULTO E PEDIÁTRICO
MODELO DE FORMATO DE BULA
 APRESENTAÇÕES Frasco conta-gotas (75 mg/ml) com 15 ml. USO ORAL USO ADULTO E PEDIÁTRICO COMPOSIÇÃO Cada 25 gotas de LUFTAL (equivalente a 1 ml) contém 75 mg de simeticona. Ingredientes inativos: propilenoglicol,
APRESENTAÇÕES Frasco conta-gotas (75 mg/ml) com 15 ml. USO ORAL USO ADULTO E PEDIÁTRICO COMPOSIÇÃO Cada 25 gotas de LUFTAL (equivalente a 1 ml) contém 75 mg de simeticona. Ingredientes inativos: propilenoglicol,
Trimeb. (maleato de trimebutina)
 Trimeb (maleato de trimebutina) Bula para paciente Cápsula mole 200 mg Página 1 Trimeb (maleato de trimebutina) Cápsula mole FORMA FARMACÊUTICA E APRESENTAÇÕES Embalagens com 20, 30 ou 60 cápsulas contendo
Trimeb (maleato de trimebutina) Bula para paciente Cápsula mole 200 mg Página 1 Trimeb (maleato de trimebutina) Cápsula mole FORMA FARMACÊUTICA E APRESENTAÇÕES Embalagens com 20, 30 ou 60 cápsulas contendo
AVICIS alfaestradiol 0,025% Solução Capilar FORMA FARMACÊUTICA, VIA DE ADMINISTRAÇÃO E APRESENTAÇÃO
 MODELO DE BULA (COMPLETA) AVICIS alfaestradiol 0,025% Solução Capilar FORMA FARMACÊUTICA, VIA DE ADMINISTRAÇÃO E APRESENTAÇÃO Solução para uso tópico no couro cabeludo. Embalagens com 1 frasco plástico
MODELO DE BULA (COMPLETA) AVICIS alfaestradiol 0,025% Solução Capilar FORMA FARMACÊUTICA, VIA DE ADMINISTRAÇÃO E APRESENTAÇÃO Solução para uso tópico no couro cabeludo. Embalagens com 1 frasco plástico
Ebastel. Bula para paciente. Comprimido revestido. 10 mg
 Ebastel Bula para paciente Comprimido revestido 10 mg EBASTEL ebastina Comprimido revestido FORMAS FARMACÊUTICAS E APRESENTAÇÕES Embalagens com 10 comprimidos revestidos contendo 10 mg de ebastina USO
Ebastel Bula para paciente Comprimido revestido 10 mg EBASTEL ebastina Comprimido revestido FORMAS FARMACÊUTICAS E APRESENTAÇÕES Embalagens com 10 comprimidos revestidos contendo 10 mg de ebastina USO
ANADOR PRT paracetamol 750 mg. Forma farmacêutica e apresentação Comprimidos 750 mg: embalagem com 20 e 256 comprimidos.
 ANADOR PRT paracetamol 750 mg Antitérmico e analgésico Forma farmacêutica e apresentação Comprimidos 750 mg: embalagem com 20 e 256 comprimidos. Outra forma farmacêutica e apresentação Solução oral: frasco
ANADOR PRT paracetamol 750 mg Antitérmico e analgésico Forma farmacêutica e apresentação Comprimidos 750 mg: embalagem com 20 e 256 comprimidos. Outra forma farmacêutica e apresentação Solução oral: frasco
TEGAN alfaestradiol Solução tópica (capilar) 0,25 mg/ml
 TEGAN alfaestradiol Solução tópica (capilar) 0,25 mg/ml USO TÓPICO USO ADULTO FORMAS FARMACÊUTICAS E APRESENTAÇÕES Solução tópica capilar contendo 0,25 mg de alfaestradiol. Embalagem com 1 frasco plástico
TEGAN alfaestradiol Solução tópica (capilar) 0,25 mg/ml USO TÓPICO USO ADULTO FORMAS FARMACÊUTICAS E APRESENTAÇÕES Solução tópica capilar contendo 0,25 mg de alfaestradiol. Embalagem com 1 frasco plástico
APRESENTAÇÕES Solução Oftálmica Estéril Frasco plástico conta-gotas contendo 5 ml de solução oftálmica estéril de flurbiprofeno (0,3 mg/ml).
 APRESENTAÇÕES Solução Oftálmica Estéril Frasco plástico conta-gotas contendo 5 ml de solução oftálmica estéril de flurbiprofeno (0,3 mg/ml). VIA DE ADMINISTRAÇÃO TÓPICA OCULAR USO ADULTO COMPOSIÇÃO Cada
APRESENTAÇÕES Solução Oftálmica Estéril Frasco plástico conta-gotas contendo 5 ml de solução oftálmica estéril de flurbiprofeno (0,3 mg/ml). VIA DE ADMINISTRAÇÃO TÓPICA OCULAR USO ADULTO COMPOSIÇÃO Cada
cloxazolam Eurofarma Laboratórios S.A. Comprimido 1 mg e 2 mg
 cloxazolam Eurofarma Laboratórios S.A. Comprimido 1 mg e 2 mg cloxazolam Medicamento genérico Lei nº 9.787, de 1999 Comprimido FORMAS FARMACÊUTICAS E APRESENTAÇÕES: Embalagens com 20 e 30 comprimidos contendo
cloxazolam Eurofarma Laboratórios S.A. Comprimido 1 mg e 2 mg cloxazolam Medicamento genérico Lei nº 9.787, de 1999 Comprimido FORMAS FARMACÊUTICAS E APRESENTAÇÕES: Embalagens com 20 e 30 comprimidos contendo
FORMA FARMACÊUTICA, VIA DE ADMINISTRAÇÃO E APRESENTAÇÃO
 REFRESH álcool polivinílico 1,4% povidona 0,6% FORMA FARMACÊUTICA, VIA DE ADMINISTRAÇÃO E APRESENTAÇÃO Solução Oftálmica Via de administração tópica ocular Caixa com 32 flaconetes plásticos para aplicação
REFRESH álcool polivinílico 1,4% povidona 0,6% FORMA FARMACÊUTICA, VIA DE ADMINISTRAÇÃO E APRESENTAÇÃO Solução Oftálmica Via de administração tópica ocular Caixa com 32 flaconetes plásticos para aplicação
Composição Cada grama contém: 2 mg de carbômer; Excipientes: cetrimida 0,1 mg (conservante), sorbitol, edetato dissódico e hidróxido de sódio.
 VISCOTEARS carbômer 2 mg / g Lágrima artificial Forma farmacêutica e apresentação Gel líquido oftálmico: tubo de 10 g. USO ADULTO E PEDIÁTRICO Composição Cada grama contém: 2 mg de carbômer; Excipientes:
VISCOTEARS carbômer 2 mg / g Lágrima artificial Forma farmacêutica e apresentação Gel líquido oftálmico: tubo de 10 g. USO ADULTO E PEDIÁTRICO Composição Cada grama contém: 2 mg de carbômer; Excipientes:
LASTACAFT ALLERGAN PRODUTOS FARMACÊUTICOS LTDA
 LASTACAFT ALLERGAN PRODUTOS FARMACÊUTICOS LTDA Solução Oftálmica Estéril Alcaftadina (0,25%) BULA PARA O PACIENTE Bula para o Paciente - CCDS 2.0 Nov2014 Pág. 1 de 6 APRESENTAÇÃO Solução Oftálmica Estéril
LASTACAFT ALLERGAN PRODUTOS FARMACÊUTICOS LTDA Solução Oftálmica Estéril Alcaftadina (0,25%) BULA PARA O PACIENTE Bula para o Paciente - CCDS 2.0 Nov2014 Pág. 1 de 6 APRESENTAÇÃO Solução Oftálmica Estéril
cloridrato de betaxolol Medicamento Genérico, Lei nº 9.787, de 1999 Solução Oftálmica Estéril Cristália Prod. Quím. Farm. Ltda.
 cloridrato de betaxolol Medicamento Genérico, Lei nº 9.787, de 1999 Solução Oftálmica Estéril Cristália Prod. Quím. Farm. Ltda. MODELO DE BULA PARA O PACIENTE 1 IDENTIFICAÇÃO DO MEDICAMENTO cloridrato
cloridrato de betaxolol Medicamento Genérico, Lei nº 9.787, de 1999 Solução Oftálmica Estéril Cristália Prod. Quím. Farm. Ltda. MODELO DE BULA PARA O PACIENTE 1 IDENTIFICAÇÃO DO MEDICAMENTO cloridrato
simeticona Merck S/A emulsão oral 75 mg/ml (gotas)
 simeticona Merck S/A emulsão oral 75 mg/ml (gotas) simeticona Medicamento genérico Lei nº 9.797, de 1999 Emulsão oral APRESENTAÇÕES Frasco conta-gotas (75 mg/ml) com 15 ml. USO ORAL USO ADULTO E PEDIÁTRICO
simeticona Merck S/A emulsão oral 75 mg/ml (gotas) simeticona Medicamento genérico Lei nº 9.797, de 1999 Emulsão oral APRESENTAÇÕES Frasco conta-gotas (75 mg/ml) com 15 ml. USO ORAL USO ADULTO E PEDIÁTRICO
MODELO DE BULA PARA O PACIENTE. Cada ml contém: levosimendana... 2,5 mg Excipientes: polividona, ácido cítrico e etanol.
 MODELO DE BULA PARA O PACIENTE IDENTIFICAÇÃO DO MEDICAMENTO: SIMDAX levosimendana Formas Farmacêuticas, vias de administração e apresentações: SIMDAX (levosimendana) 2,5 mg/ml: embalagens com 1 frasco-ampola
MODELO DE BULA PARA O PACIENTE IDENTIFICAÇÃO DO MEDICAMENTO: SIMDAX levosimendana Formas Farmacêuticas, vias de administração e apresentações: SIMDAX (levosimendana) 2,5 mg/ml: embalagens com 1 frasco-ampola
RAPILAX. Kley Hertz S/A Indústria e Comércio Solução Oral Gotas 7,5 mg/ml picossulfato de sódio
 RAPILAX Kley Hertz S/A Indústria e Comércio Solução Oral Gotas 7,5 mg/ml picossulfato de sódio RAPILAX picossulfato de sódio APRESENTAÇÃO Solução oral contendo: 7,5 mg/ml de picossulfato de sódio em frasco
RAPILAX Kley Hertz S/A Indústria e Comércio Solução Oral Gotas 7,5 mg/ml picossulfato de sódio RAPILAX picossulfato de sódio APRESENTAÇÃO Solução oral contendo: 7,5 mg/ml de picossulfato de sódio em frasco
TROMBOSE VENOSA PROFUNDA (TVP) E TROMBOEMBOLISMO PULMONAR (TEP)
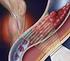 TROMBOSE VENOSA PROFUNDA (TVP) E TROMBOEMBOLISMO PULMONAR (TEP) - Fatores de risco: Idade superior a 40 anos Acidente vascular cerebral (isquêmico ou hemorrágico) Paralisia de membros inferiores Infarto
TROMBOSE VENOSA PROFUNDA (TVP) E TROMBOEMBOLISMO PULMONAR (TEP) - Fatores de risco: Idade superior a 40 anos Acidente vascular cerebral (isquêmico ou hemorrágico) Paralisia de membros inferiores Infarto
ANESTÉSICO ALLERGAN PRODUTOS FARMACÊUTICOS LTDA. Solução Oftálmica Estéril. cloridrato de tetracaína 1% cloridrato de fenilefrina 0,1%
 ANESTÉSICO ALLERGAN PRODUTOS FARMACÊUTICOS LTDA Solução Oftálmica Estéril cloridrato de tetracaína 1% cloridrato de fenilefrina 0,1% BULA PARA O PACIENTE anestésico cloridrato de tetracaína 1% cloridrato
ANESTÉSICO ALLERGAN PRODUTOS FARMACÊUTICOS LTDA Solução Oftálmica Estéril cloridrato de tetracaína 1% cloridrato de fenilefrina 0,1% BULA PARA O PACIENTE anestésico cloridrato de tetracaína 1% cloridrato
Keflaxina Sandoz do Brasil Ind. Farm. Ltda. Pó para Suspensão Oral 50 mg/ml
 Keflaxina Sandoz do Brasil Ind. Farm. Ltda. Pó para Suspensão Oral 50 mg/ml I. IDENTIFICAÇÃO DO MEDICAMENTO Keflaxina cefalexina APRESENTAÇÃO Suspensão oral 250 mg/5ml. Embalagem contendo frasco com pó
Keflaxina Sandoz do Brasil Ind. Farm. Ltda. Pó para Suspensão Oral 50 mg/ml I. IDENTIFICAÇÃO DO MEDICAMENTO Keflaxina cefalexina APRESENTAÇÃO Suspensão oral 250 mg/5ml. Embalagem contendo frasco com pó
ALLERGAN PRODUTOS FARMACÊUTICOS LTDA
 PILOCARPINA ALLERGAN PRODUTOS FARMACÊUTICOS LTDA Solução Oftálmica Estéril cloridrato de pilocarpina 1% / 2% / 4% BULA PARA O PACIENTE APRESENTAÇÃO Solução Oftálmica Estéril Frasco plástico conta-gotas
PILOCARPINA ALLERGAN PRODUTOS FARMACÊUTICOS LTDA Solução Oftálmica Estéril cloridrato de pilocarpina 1% / 2% / 4% BULA PARA O PACIENTE APRESENTAÇÃO Solução Oftálmica Estéril Frasco plástico conta-gotas
TETMOSOL Sabonete sulfiram. Sabonete com 4 g de sulfiram em embalagem contendo 1 sabonete de 80 g.
 TETMOSOL Sabonete sulfiram I) IDENTIFICAÇÃO DO MEDICAMENTO TETMOSOL Sabonete sulfiram APRESENTAÇÕES Sabonete com 4 g de sulfiram em embalagem contendo 1 sabonete de 80 g. USO TÓPICO USO ADULTO E PEDIÁTRICO
TETMOSOL Sabonete sulfiram I) IDENTIFICAÇÃO DO MEDICAMENTO TETMOSOL Sabonete sulfiram APRESENTAÇÕES Sabonete com 4 g de sulfiram em embalagem contendo 1 sabonete de 80 g. USO TÓPICO USO ADULTO E PEDIÁTRICO
DIGEDRAT. (maleato de trimebutina)
 DIGEDRAT (maleato de trimebutina) Cosmed Indústria de Cosméticos e Medicamentos S.A. Cápsula mole 200mg I - IDENTIFICAÇÃO DO DIGEDRAT maleato de trimebutina APRESENTAÇÕES Cápsula mole Embalagens contendo
DIGEDRAT (maleato de trimebutina) Cosmed Indústria de Cosméticos e Medicamentos S.A. Cápsula mole 200mg I - IDENTIFICAÇÃO DO DIGEDRAT maleato de trimebutina APRESENTAÇÕES Cápsula mole Embalagens contendo
Deposteron cipionato de testosterona
 Deposteron cipionato de testosterona EMS SIGMA PHARMA LTDA Solução I.M. 100 mg/ ml MODELO DE BULA - PACIENTE Deposteron cipionato de testosterona APRESENTAÇÕES Solução oleosa injetável 100 mg/ml em embalagem
Deposteron cipionato de testosterona EMS SIGMA PHARMA LTDA Solução I.M. 100 mg/ ml MODELO DE BULA - PACIENTE Deposteron cipionato de testosterona APRESENTAÇÕES Solução oleosa injetável 100 mg/ml em embalagem
Anexo A DORFEN CAZI QUIMICA FARMACÊUTICA IND. E COM. LTDA. Solução oral. 200mg
 Anexo A DORFEN CAZI QUIMICA FARMACÊUTICA IND. E COM. LTDA Solução oral 200mg DORFEN Paracetamol I IDENTIFICAÇÃO DO MEDICAMENTO DORFEN Paracetamol FORMA FARMACÊUTICA E APRESENTAÇÃO Solução oral em frasco
Anexo A DORFEN CAZI QUIMICA FARMACÊUTICA IND. E COM. LTDA Solução oral 200mg DORFEN Paracetamol I IDENTIFICAÇÃO DO MEDICAMENTO DORFEN Paracetamol FORMA FARMACÊUTICA E APRESENTAÇÃO Solução oral em frasco
PRESMIN LATINOFARMA INDÚSTRIAS FARMACÊUTICAS LTDA. Solução Oftálmica Estéril. betaxolol (cloridrato) 5,6 mg/ml
 PRESMIN LATINOFARMA INDÚSTRIAS FARMACÊUTICAS LTDA. Solução Oftálmica Estéril betaxolol (cloridrato) 5,6 mg/ml COLÍRIO PRESMIN betaxolol 0,5% MEDICAMENTO SIMILAR EQUIVALENTE AO MEDICAMENTO DE REFERÊNCIA
PRESMIN LATINOFARMA INDÚSTRIAS FARMACÊUTICAS LTDA. Solução Oftálmica Estéril betaxolol (cloridrato) 5,6 mg/ml COLÍRIO PRESMIN betaxolol 0,5% MEDICAMENTO SIMILAR EQUIVALENTE AO MEDICAMENTO DE REFERÊNCIA
Nome do medicamento: OSTEOPREVIX D Forma farmacêutica: Comprimido revestido Concentração: cálcio 500 mg/com rev + colecalciferol 200 UI/com rev.
 Nome do medicamento: OSTEOPREVIX D Forma farmacêutica: Comprimido revestido Concentração: cálcio 500 mg/com rev + colecalciferol 200 UI/com rev. OSTEOPREVIX D carbonato de cálcio colecalciferol APRESENTAÇÕES
Nome do medicamento: OSTEOPREVIX D Forma farmacêutica: Comprimido revestido Concentração: cálcio 500 mg/com rev + colecalciferol 200 UI/com rev. OSTEOPREVIX D carbonato de cálcio colecalciferol APRESENTAÇÕES
Capilarema. Laboratórios Baldacci Ltda. Comprimidos. 75 mg
 Capilarema Laboratórios Baldacci Ltda. Comprimidos 75 mg CAPILAREMA aminaftona APRESENTAÇÕES Comprimidos simples de 75 mg cartucho contendo 30 ou 60 comprimidos. VIA ORAL - USO ADULTO COMPOSIÇÃO Cada comprimido
Capilarema Laboratórios Baldacci Ltda. Comprimidos 75 mg CAPILAREMA aminaftona APRESENTAÇÕES Comprimidos simples de 75 mg cartucho contendo 30 ou 60 comprimidos. VIA ORAL - USO ADULTO COMPOSIÇÃO Cada comprimido
FLEET ENEMA. Tommasi Importação e Exportação Ltda. Solução Retal. Fosfato de Sódio Dibásico 0,06g/mL Fosfato de Sódio Monobásico 0,16 g/ml
 FLEET ENEMA Tommasi Importação e Exportação Ltda Solução Retal Fosfato de Sódio Dibásico 0,06g/mL Fosfato de Sódio Monobásico 0,16 g/ml IDENTIFICAÇÃO DO MEDICAMENTO: Nome Comercial: Fleet Enema Denominação
FLEET ENEMA Tommasi Importação e Exportação Ltda Solução Retal Fosfato de Sódio Dibásico 0,06g/mL Fosfato de Sódio Monobásico 0,16 g/ml IDENTIFICAÇÃO DO MEDICAMENTO: Nome Comercial: Fleet Enema Denominação
MONOCORDIL mononitrato de isossorbida APRESENTAÇÕES
 MONOCORDIL mononitrato de isossorbida APRESENTAÇÕES Comprimidos simples de 20 mg cartucho com 20 ou 30 comprimidos. Comprimidos simples de 40 mg cartucho com 30 comprimidos. VIA ORAL USO ADULTO COMPOSIÇÃO
MONOCORDIL mononitrato de isossorbida APRESENTAÇÕES Comprimidos simples de 20 mg cartucho com 20 ou 30 comprimidos. Comprimidos simples de 40 mg cartucho com 30 comprimidos. VIA ORAL USO ADULTO COMPOSIÇÃO
loratadina Laboratório Globo Ltda. Xarope 1 mg/ml
 loratadina Laboratório Globo Ltda. Xarope 1 mg/ml loratadina Medicamento genérico Lei nº 9.787, de 1999 FORMA FARMACÊUTICA E APRESENTAÇÃO: loratadina xarope 1 mg/ml. Embalagem contendo 1 frasco de 100
loratadina Laboratório Globo Ltda. Xarope 1 mg/ml loratadina Medicamento genérico Lei nº 9.787, de 1999 FORMA FARMACÊUTICA E APRESENTAÇÃO: loratadina xarope 1 mg/ml. Embalagem contendo 1 frasco de 100
ACULAR LS SOLUÇÃO OFTÁLMICA CETOROLACO TROMETAMOL 0.4%
 ACULAR LS SOLUÇÃO OFTÁLMICA CETOROLACO TROMETAMOL 0.4% Bula para o Paciente CCDS V 3.0 Jul 2012 0 APRESENTAÇÃO Solução Oftálmica Estéril Frasco plástico conta-gotas contendo 5 ml ou 10 ml de solução oftálmica
ACULAR LS SOLUÇÃO OFTÁLMICA CETOROLACO TROMETAMOL 0.4% Bula para o Paciente CCDS V 3.0 Jul 2012 0 APRESENTAÇÃO Solução Oftálmica Estéril Frasco plástico conta-gotas contendo 5 ml ou 10 ml de solução oftálmica
MODELO DE BULA DO PROFISSIONAL DE SAÚDE
 MODELO DE BULA DO PROFISSIONAL DE SAÚDE I) IDENTIFICAÇÃO DO MEDICAMENTO Vibral dropropizina APRESENTAÇÕES Xarope Adulto (3 mg/ml): frasco de 120 ml e 1 copo-medida. Xarope Pediátrico (1,5 mg/ml): frasco
MODELO DE BULA DO PROFISSIONAL DE SAÚDE I) IDENTIFICAÇÃO DO MEDICAMENTO Vibral dropropizina APRESENTAÇÕES Xarope Adulto (3 mg/ml): frasco de 120 ml e 1 copo-medida. Xarope Pediátrico (1,5 mg/ml): frasco
FORMAS FARMACÊUTICAS E APRESENTAÇÕES Solução nasal com 9 mg/ml de cloreto de sódio. Embalagem com 1 frasco spray nasal com 30 ou 50 ml.
 SALSEP 0,9% cloreto de sódio 9 mg/ml USO NASAL USO ADULTO E PEDIÁTRICO SOLUÇÃO NASAL FORMAS FARMACÊUTICAS E APRESENTAÇÕES Solução nasal com 9 mg/ml de cloreto de sódio. Embalagem com 1 frasco spray nasal
SALSEP 0,9% cloreto de sódio 9 mg/ml USO NASAL USO ADULTO E PEDIÁTRICO SOLUÇÃO NASAL FORMAS FARMACÊUTICAS E APRESENTAÇÕES Solução nasal com 9 mg/ml de cloreto de sódio. Embalagem com 1 frasco spray nasal
APRESENTAÇÕES Solução oral extrato etanólico das raízes de Pelargonium sidoides D.C. Eps 7630-825 mg. Embalagens com 20 ml e 50 ml.
 Umckan Pelargonium sidoides Extrato Eps 7630 Nomenclatura botânica: Pelargonium sidoides, D.C. Nomenclatura popular: Umckaloabo Família: Geraniaceae Parte utilizada: raízes APRESENTAÇÕES Solução oral extrato
Umckan Pelargonium sidoides Extrato Eps 7630 Nomenclatura botânica: Pelargonium sidoides, D.C. Nomenclatura popular: Umckaloabo Família: Geraniaceae Parte utilizada: raízes APRESENTAÇÕES Solução oral extrato
Bula com informações ao Paciente soro antibotrópico (pentavalente) e antilaquético. solução injetável IDENTIFICAÇÃO DO MEDICAMENTO
 soro antibotrópico (pentavalente) e antilaquético solução injetável IDENTIFICAÇÃO DO MEDICAMENTO soro antibotrópico (pentavalente) e antilaquético APRESENTAÇÃO O soro antibotrópico (pentavalente) e antilaquético,
soro antibotrópico (pentavalente) e antilaquético solução injetável IDENTIFICAÇÃO DO MEDICAMENTO soro antibotrópico (pentavalente) e antilaquético APRESENTAÇÃO O soro antibotrópico (pentavalente) e antilaquético,
Ethamolin. oleato de monoetanolamina FORMA FARMACÊUTICA E APRESENTAÇÃO:
 Ethamolin oleato de monoetanolamina FORMA FARMACÊUTICA E APRESENTAÇÃO: ETHAMOLIN consiste em uma solução aquosa de oleato de monoetanolamina a 5% para uso injetável apresentado em caixas contendo 6 ampolas
Ethamolin oleato de monoetanolamina FORMA FARMACÊUTICA E APRESENTAÇÃO: ETHAMOLIN consiste em uma solução aquosa de oleato de monoetanolamina a 5% para uso injetável apresentado em caixas contendo 6 ampolas
ALTERAÇÕES A INCLUIR NAS SECÇÕES RELEVANTES DO RESUMO DAS CARACTERÍSTICAS DOS MEDICAMENTOS QUE CONTENHAM NIMESULIDA (FORMULAÇÕES SISTÉMICAS)
 ANEXO III 58 ALTERAÇÕES A INCLUIR NAS SECÇÕES RELEVANTES DO RESUMO DAS CARACTERÍSTICAS DOS MEDICAMENTOS QUE CONTENHAM NIMESULIDA (FORMULAÇÕES SISTÉMICAS) Adições aparecem em itálico e sublinhado; rasuras
ANEXO III 58 ALTERAÇÕES A INCLUIR NAS SECÇÕES RELEVANTES DO RESUMO DAS CARACTERÍSTICAS DOS MEDICAMENTOS QUE CONTENHAM NIMESULIDA (FORMULAÇÕES SISTÉMICAS) Adições aparecem em itálico e sublinhado; rasuras
Aesculus hippocastanum
 Novarrutina Aesculus hippocastanum FITOTERÁPICO Parte utilizada: semente Nomenclatura botânica Nome científico: Aesculus hippocastanum Nome popular: Castanha da Índia Família: Hippocastanaceae. Formas
Novarrutina Aesculus hippocastanum FITOTERÁPICO Parte utilizada: semente Nomenclatura botânica Nome científico: Aesculus hippocastanum Nome popular: Castanha da Índia Família: Hippocastanaceae. Formas
INTAL NASAL 4% cromoglicato dissódico
 MODELO DE BULA INTAL NASAL 4% cromoglicato dissódico SANOFI-AVENTIS Forma farmacêutica e apresentação Solução nasal. Frasco plástico dotado de aplicador nasal, contendo 13 ml ou 15 ml de solução. Cada
MODELO DE BULA INTAL NASAL 4% cromoglicato dissódico SANOFI-AVENTIS Forma farmacêutica e apresentação Solução nasal. Frasco plástico dotado de aplicador nasal, contendo 13 ml ou 15 ml de solução. Cada
BULA PACIENTE AMINOLEX HALEX ISTAR
 BULA PACIENTE AMINOLEX HALEX ISTAR SOLUÇÃO INJETÁVEL 24 mg/ml Aminolex IDENTIFICAÇÃO DO MEDICAMENTO Aminolex FORMA FARMACÊUTICA E APRESENTAÇÕES Solução injetável 24mg/ml. Ampola de vidro de 10 ml Solução
BULA PACIENTE AMINOLEX HALEX ISTAR SOLUÇÃO INJETÁVEL 24 mg/ml Aminolex IDENTIFICAÇÃO DO MEDICAMENTO Aminolex FORMA FARMACÊUTICA E APRESENTAÇÕES Solução injetável 24mg/ml. Ampola de vidro de 10 ml Solução
Gino-Loprox ciclopirox olamina
 Modelo de Bula SANOFI-AVENTIS FARMACÊUTICA LTDA Esta bula é continuamente atualizada. Favor proceder a sua leitura antes de utilizar o medicamento. Gino-Loprox ciclopirox olamina Forma farmacêutica e apresentação
Modelo de Bula SANOFI-AVENTIS FARMACÊUTICA LTDA Esta bula é continuamente atualizada. Favor proceder a sua leitura antes de utilizar o medicamento. Gino-Loprox ciclopirox olamina Forma farmacêutica e apresentação
aciclovir Merck S/A Creme 50 mg/g
 aciclovir Merck S/A Creme 50 mg/g aciclovir Medicamento genérico Lei nº 9.797, de 1999 APRESENTAÇÃO Aciclovir creme é apresentado em bisnagas contendo 10 g. USO TÓPICO USO ADULTO E PEDIÁTRICO COMPOSIÇÃO
aciclovir Merck S/A Creme 50 mg/g aciclovir Medicamento genérico Lei nº 9.797, de 1999 APRESENTAÇÃO Aciclovir creme é apresentado em bisnagas contendo 10 g. USO TÓPICO USO ADULTO E PEDIÁTRICO COMPOSIÇÃO
Antrofi promestrieno. Eurofarma Laboratórios S.A. Creme vaginal 10 mg/g
 Antrofi promestrieno Eurofarma Laboratórios S.A. Creme vaginal 10 mg/g Antrofi promestrieno CREME VAGINAL FORMAS FARMACÊUTICAS E APRESENTAÇÕES APRESENTAÇÕES Bisnaga com 30 g de creme vaginal acompanhada
Antrofi promestrieno Eurofarma Laboratórios S.A. Creme vaginal 10 mg/g Antrofi promestrieno CREME VAGINAL FORMAS FARMACÊUTICAS E APRESENTAÇÕES APRESENTAÇÕES Bisnaga com 30 g de creme vaginal acompanhada
APRESENTAÇÕES Solução e pó para preparação de uso oral. Embalagem com 10 e 20 frascos de 10 ml para preparação antes do uso.
 IDENTIFICAÇÃO DO MEDICAMENTO Forten poliaminoácidos APRESENTAÇÕES Solução e pó para preparação de uso oral. Embalagem com 10 e 20 frascos de 10 ml para preparação antes do uso. USO ORAL USO ADULTO E PEDIÁTRICO
IDENTIFICAÇÃO DO MEDICAMENTO Forten poliaminoácidos APRESENTAÇÕES Solução e pó para preparação de uso oral. Embalagem com 10 e 20 frascos de 10 ml para preparação antes do uso. USO ORAL USO ADULTO E PEDIÁTRICO
Abbott Laboratórios do Brasil Ltda Rua Michigan 735, Brooklin São Paulo - SP CEP: 04566-905
 MODELO DE BULA PARA O PACIENTE SYNAGIS palivizumabe I - IDENTIFICAÇÃO DO MEDICAMENTO APRESENTAÇÕES Pó liófilo injetável de: - 100 mg em embalagem com 01 frasco-ampola para dose única contendo palivizumabe
MODELO DE BULA PARA O PACIENTE SYNAGIS palivizumabe I - IDENTIFICAÇÃO DO MEDICAMENTO APRESENTAÇÕES Pó liófilo injetável de: - 100 mg em embalagem com 01 frasco-ampola para dose única contendo palivizumabe
REIDRAMAX. I IDENTIFICAÇÃO DO MEDICAMENTO Sais para reidratação oral. REIDRAMAX glicose anidra citrato de sódio cloreto de potássio cloreto de sódio
 REIDRAMAX I IDENTIFICAÇÃO DO MEDICAMENTO Sais para reidratação oral REIDRAMAX glicose anidra citrato de sódio cloreto de potássio cloreto de sódio Forma farmacêutica e Apresentação Pó para solução oral
REIDRAMAX I IDENTIFICAÇÃO DO MEDICAMENTO Sais para reidratação oral REIDRAMAX glicose anidra citrato de sódio cloreto de potássio cloreto de sódio Forma farmacêutica e Apresentação Pó para solução oral
cloridrato de ambroxol Medicamento Genérico, Lei nº 9.787, de 1999
 cloridrato de ambroxol Medicamento Genérico, Lei nº 9.787, de 1999 Cristália Produtos Químicos Farmacêuticos Ltda. Xarope Pediátrico 3 mg/ml Xarope Adulto 6 mg/ml Modelo de Bula para Paciente IDENTIFICAÇÃO
cloridrato de ambroxol Medicamento Genérico, Lei nº 9.787, de 1999 Cristália Produtos Químicos Farmacêuticos Ltda. Xarope Pediátrico 3 mg/ml Xarope Adulto 6 mg/ml Modelo de Bula para Paciente IDENTIFICAÇÃO
dicloridrato de cetirizina Solução oral 1mg/mL
 dicloridrato de cetirizina Solução oral 1mg/mL MODELO DE BULA COM INFORMAÇÕES AO PACIENTE dicloridrato de cetirizina Medicamento genérico Lei nº 9.787, de 1999. APRESENTAÇÃO Solução oral 1mg/mL Embalagem
dicloridrato de cetirizina Solução oral 1mg/mL MODELO DE BULA COM INFORMAÇÕES AO PACIENTE dicloridrato de cetirizina Medicamento genérico Lei nº 9.787, de 1999. APRESENTAÇÃO Solução oral 1mg/mL Embalagem
ALLERGAN PRODUTOS FARMACÊUTICOS LTDA
 LACRIL ALLERGAN PRODUTOS FARMACÊUTICOS LTDA Solução Oftálmica Estéril álcool polivinílico 1,4% BULA PARA O PACIENTE Lubrificante Ocular APRESENTAÇÃO Solução Oftálmica Estéril Frasco plástico conta-gotas
LACRIL ALLERGAN PRODUTOS FARMACÊUTICOS LTDA Solução Oftálmica Estéril álcool polivinílico 1,4% BULA PARA O PACIENTE Lubrificante Ocular APRESENTAÇÃO Solução Oftálmica Estéril Frasco plástico conta-gotas
Solução Glicofisiológica
 Solução Glicofisiológica Solução injetável cloreto de sódio + glicose 9 mg/ml + 50 mg/ml 1 Forma farmacêutica e apresentações: Solução injetável MODELO DE BULA Solução Glicofisiológica cloreto de sódio
Solução Glicofisiológica Solução injetável cloreto de sódio + glicose 9 mg/ml + 50 mg/ml 1 Forma farmacêutica e apresentações: Solução injetável MODELO DE BULA Solução Glicofisiológica cloreto de sódio
Benestare policabofila cálcica. Medley Indústria Farmacêutica Ltda. Comprimido revestido 625 mg
 Benestare policabofila cálcica Medley Indústria Farmacêutica Ltda. Comprimido revestido 625 mg Benestare policarbofila cálcica APRESENTAÇÕES Comprimidos revestidos de 625 mg: embalagens com 14 e 30 comprimidos.
Benestare policabofila cálcica Medley Indústria Farmacêutica Ltda. Comprimido revestido 625 mg Benestare policarbofila cálcica APRESENTAÇÕES Comprimidos revestidos de 625 mg: embalagens com 14 e 30 comprimidos.
Tylex 7,5 mg / 30 mg comprimidos paracetamol, fosfato de codeína
 1 IDENTIFICAÇÃO MEDICAMENTO DO Tylex 7,5 mg / 30 mg comprimidos paracetamol, fosfato de codeína APRESENTAÇÕES Comprimidos de 7,5 mg de fosfato de codeína e 500 mg de paracetamol em embalagens com 12 comprimidos
1 IDENTIFICAÇÃO MEDICAMENTO DO Tylex 7,5 mg / 30 mg comprimidos paracetamol, fosfato de codeína APRESENTAÇÕES Comprimidos de 7,5 mg de fosfato de codeína e 500 mg de paracetamol em embalagens com 12 comprimidos
GUTTALAX picossulfato de sódio Solução oral 7,5 mg
 GUTTALAX picossulfato de sódio Solução oral 7,5 mg GUTTALAX SOLUÇÃO PACIENTE Guttalax picossulfato de sódio abcd APRESENTAÇÃO Solução oral 7,5 mg/ml: frasco com 20 ml. USO ORAL USO ADULTO E PEDIÁTRICO
GUTTALAX picossulfato de sódio Solução oral 7,5 mg GUTTALAX SOLUÇÃO PACIENTE Guttalax picossulfato de sódio abcd APRESENTAÇÃO Solução oral 7,5 mg/ml: frasco com 20 ml. USO ORAL USO ADULTO E PEDIÁTRICO
Calcium Sandoz F. Calcium Sandoz FF NOVARTIS BIOCIÊNCIAS S.A. Comprimido Efervescente. 500mg de cálcio. 1.000mg de cálcio
 Calcium Sandoz F Calcium Sandoz FF NOVARTIS BIOCIÊNCIAS S.A. Comprimido Efervescente 500mg de cálcio 1.000mg de cálcio Calcium Sandoz F Calcium Sandoz FF carbonato de cálcio + lactogliconato de cálcio
Calcium Sandoz F Calcium Sandoz FF NOVARTIS BIOCIÊNCIAS S.A. Comprimido Efervescente 500mg de cálcio 1.000mg de cálcio Calcium Sandoz F Calcium Sandoz FF carbonato de cálcio + lactogliconato de cálcio
PROCTO-GLYVENOL tribenosídeo + lidocaína
 MODELO DE TEXTO DE BULA PROCTO-GLYVENOL tribenosídeo + lidocaína TRATAMENTO LOCAL DAS HEMORRÓIDAS Formas farmacêuticas, via de administração e apresentações: Supositórios. Embalagens com 5 ou 10 supositórios.
MODELO DE TEXTO DE BULA PROCTO-GLYVENOL tribenosídeo + lidocaína TRATAMENTO LOCAL DAS HEMORRÓIDAS Formas farmacêuticas, via de administração e apresentações: Supositórios. Embalagens com 5 ou 10 supositórios.
Propil* propiltiouracila
 Propil* propiltiouracila PARTE I IDENTIFICAÇÃO DO PRODUTO Nome: Propil* Nome genérico: propiltiouracila Forma farmacêutica e apresentação: Propil* 100 mg em embalagem contendo 30 comprimidos. USO ADULTO
Propil* propiltiouracila PARTE I IDENTIFICAÇÃO DO PRODUTO Nome: Propil* Nome genérico: propiltiouracila Forma farmacêutica e apresentação: Propil* 100 mg em embalagem contendo 30 comprimidos. USO ADULTO
RILAN UCI-FARMA INDÚSTRIA FARMACÊUTICA LTDA. SOLUÇÃO NASAL. 20 mg/ml
 RILAN UCI-FARMA INDÚSTRIA FARMACÊUTICA LTDA. SOLUÇÃO NASAL 20 mg/ml I) IDENTIFICAÇÃO DO RILAN NASAL 2% SPRAY cromoglicato dissódico FORMA FARMACÊUTICA E APRESENTAÇÃO RILAN NASAL 2% SPRAY: cartucho com
RILAN UCI-FARMA INDÚSTRIA FARMACÊUTICA LTDA. SOLUÇÃO NASAL 20 mg/ml I) IDENTIFICAÇÃO DO RILAN NASAL 2% SPRAY cromoglicato dissódico FORMA FARMACÊUTICA E APRESENTAÇÃO RILAN NASAL 2% SPRAY: cartucho com
Aglucose acarbose EMS S/A. Comprimidos. 50 e 100 mg
 Aglucose acarbose EMS S/A. Comprimidos 50 e 100 mg I - IDENTIFICAÇÃO DO MEDICAMENTO Aglucose acarbose USO ORAL USO ADULTO APRESENTAÇÕES Comprimidos 50 mg: Caixa contendo 4, 30 e 60 comprimidos. Comprimidos
Aglucose acarbose EMS S/A. Comprimidos 50 e 100 mg I - IDENTIFICAÇÃO DO MEDICAMENTO Aglucose acarbose USO ORAL USO ADULTO APRESENTAÇÕES Comprimidos 50 mg: Caixa contendo 4, 30 e 60 comprimidos. Comprimidos
DOBEVEN. dobesilato de cálcio. APRESENTAÇÕES Cápsula gelatinosa dura contendo 500 mg de dobesilato de cálcio: Caixas com 5 e 30 cápsulas.
 DOBEVEN dobesilato de cálcio APRESENTAÇÕES Cápsula gelatinosa dura contendo 500 mg de dobesilato de cálcio: Caixas com 5 e 30 cápsulas. USO ORAL USO ADULTO COMPOSIÇÃO Cada cápsula gelatinosa dura contém:
DOBEVEN dobesilato de cálcio APRESENTAÇÕES Cápsula gelatinosa dura contendo 500 mg de dobesilato de cálcio: Caixas com 5 e 30 cápsulas. USO ORAL USO ADULTO COMPOSIÇÃO Cada cápsula gelatinosa dura contém:
Otofoxin cloridrato de ciprofloxacino SOLUÇÃO OTOLÓGICA
 Otofoxin cloridrato de ciprofloxacino SOLUÇÃO OTOLÓGICA USO ADULTO USO OTOLÓGICO Forma farmacêutica e apresentação Solução otológica: frasco contendo 10 ml com conta-gotas. Composição Cada (1 ml) contém
Otofoxin cloridrato de ciprofloxacino SOLUÇÃO OTOLÓGICA USO ADULTO USO OTOLÓGICO Forma farmacêutica e apresentação Solução otológica: frasco contendo 10 ml com conta-gotas. Composição Cada (1 ml) contém
URO-VAXOM. Lisado bacteriano de Escherichia coli APSEN
 URO-VAXOM Lisado bacteriano de Escherichia coli APSEN FORMA FARMACÊUTICA Cápsula gelatinosa APRESENTAÇÕES Cápsulas de 6 mg de lisado bacteriano de Escherichia coli. Caixas com 10 e 30 cápsulas USO ORAL
URO-VAXOM Lisado bacteriano de Escherichia coli APSEN FORMA FARMACÊUTICA Cápsula gelatinosa APRESENTAÇÕES Cápsulas de 6 mg de lisado bacteriano de Escherichia coli. Caixas com 10 e 30 cápsulas USO ORAL
SINUSTRAT cloreto de sódio 9 mg/ml
 SINUSTRAT cloreto de sódio 9 mg/ml AVERT LABORATÓRIOS LTDA. SOLUÇAO NASAL Avert Sinustrat (Paciente) 11/2013 1 MODELO DE BULA DO PACIENTE SINUSTRAT cloreto de sódio IDENTIFICAÇÃO DO MEDICAMENTO APRESENTAÇÕES:
SINUSTRAT cloreto de sódio 9 mg/ml AVERT LABORATÓRIOS LTDA. SOLUÇAO NASAL Avert Sinustrat (Paciente) 11/2013 1 MODELO DE BULA DO PACIENTE SINUSTRAT cloreto de sódio IDENTIFICAÇÃO DO MEDICAMENTO APRESENTAÇÕES:
loratadina Merck S/A Comprimidos revestidos 10 mg
 loratadina Merck S/A revestidos 10 mg loratadina Medicamento genérico Lei nº 9.797, de 1999 APRESENTAÇÕES revestidos de 10 mg em embalagem com 12 comprimidos. USO ORAL USO ADULTO E PEDIÁTRICO ACIMA DE
loratadina Merck S/A revestidos 10 mg loratadina Medicamento genérico Lei nº 9.797, de 1999 APRESENTAÇÕES revestidos de 10 mg em embalagem com 12 comprimidos. USO ORAL USO ADULTO E PEDIÁTRICO ACIMA DE
olmesartana medoxomila Comprimido revestido - 20 mg Comprimido revestido - 40 mg
 olmesartana medoxomila Comprimido revestido - 20 mg Comprimido revestido - 40 mg BULA PARA PACIENTE Bula de acordo com a Resolução-RDC nº 47/2009 olmesartana medoxomila Medicamento genérico Lei nº 9.787,
olmesartana medoxomila Comprimido revestido - 20 mg Comprimido revestido - 40 mg BULA PARA PACIENTE Bula de acordo com a Resolução-RDC nº 47/2009 olmesartana medoxomila Medicamento genérico Lei nº 9.787,
LORITIL Geolab Indústria Farmacêutica S/A Comprimido 10mg
 LORITIL Geolab Indústria Farmacêutica S/A Comprimido 10mg MODELO DE BULA PARA O PACIENTE Esta bula é continuamente atualizada. Favor proceder a sua leitura antes de utilizar o medicamento. Loritil loratadina
LORITIL Geolab Indústria Farmacêutica S/A Comprimido 10mg MODELO DE BULA PARA O PACIENTE Esta bula é continuamente atualizada. Favor proceder a sua leitura antes de utilizar o medicamento. Loritil loratadina
CISTICID. praziquantel. Merck S/A. Comprimidos 500 mg
 CISTICID praziquantel Merck S/A Comprimidos 500 mg Cisticid praziquantel APRESENTAÇÕES Embalagens contendo 50 comprimidos. USO ORAL USO ADULTO E PEDIÁTRICO ACIMA DOS 4 ANOS DE IDADE COMPOSIÇÃO Cada comprimido
CISTICID praziquantel Merck S/A Comprimidos 500 mg Cisticid praziquantel APRESENTAÇÕES Embalagens contendo 50 comprimidos. USO ORAL USO ADULTO E PEDIÁTRICO ACIMA DOS 4 ANOS DE IDADE COMPOSIÇÃO Cada comprimido
PYR-PAM pamoato de pirvínio
 PYR-PAM pamoato de pirvínio DRÁGEA 100 MG Bula do Paciente Pyr-Pam UCI-FARMA Conforme RDC 47/09 Página 1 PYR-PAM pamoato de pirvínio FORMA FARMACÊUTICA E APRESENTAÇÃO PYR-PAM DRÁGEA 100 MG: cartucho contendo
PYR-PAM pamoato de pirvínio DRÁGEA 100 MG Bula do Paciente Pyr-Pam UCI-FARMA Conforme RDC 47/09 Página 1 PYR-PAM pamoato de pirvínio FORMA FARMACÊUTICA E APRESENTAÇÃO PYR-PAM DRÁGEA 100 MG: cartucho contendo
Anexo A BACIGEN. Neomiciana + Bacitracina Zincica CAZI QUIMICA FARMACÊUTICA IND. E COM. LTDA. Pomada. 5mg + 250 UI/g
 Anexo A BACIGEN Neomiciana + Bacitracina Zincica CAZI QUIMICA FARMACÊUTICA IND. E COM. LTDA Pomada 5mg + 250 UI/g BACIGEN sulfato de neomicina, bacitracina zíncica APRESENTAÇÃO Pomada contendo 5mg/g de
Anexo A BACIGEN Neomiciana + Bacitracina Zincica CAZI QUIMICA FARMACÊUTICA IND. E COM. LTDA Pomada 5mg + 250 UI/g BACIGEN sulfato de neomicina, bacitracina zíncica APRESENTAÇÃO Pomada contendo 5mg/g de
MODELO DE FORMATO DE BULA
 APRESENTAÇÃO OMCILON-A ORABASE é apresentado em bisnaga contendo 10 g. USO ORAL TÓPICO USO ADULTO COMPOSIÇÃO Cada grama de OMCILON-A ORABASE contém 1mg de triancinolona acetonida. Ingredientes inativos:
APRESENTAÇÃO OMCILON-A ORABASE é apresentado em bisnaga contendo 10 g. USO ORAL TÓPICO USO ADULTO COMPOSIÇÃO Cada grama de OMCILON-A ORABASE contém 1mg de triancinolona acetonida. Ingredientes inativos:
CDS22FEV08 EFFIENT cloridrato de prasugrel D.C.B. 09669 APRESENTAÇÕES EFFIENT (cloridrato de prasugrel) é apresentado na forma de comprimidos
 CDS22FEV08 EFFIENT cloridrato de prasugrel D.C.B. 09669 APRESENTAÇÕES EFFIENT (cloridrato de prasugrel) é apresentado na forma de comprimidos revestidos para administração oral, nas seguintes concentrações:
CDS22FEV08 EFFIENT cloridrato de prasugrel D.C.B. 09669 APRESENTAÇÕES EFFIENT (cloridrato de prasugrel) é apresentado na forma de comprimidos revestidos para administração oral, nas seguintes concentrações:
Otosporin hidrocortisona sulfato de neomicina sulfato de polimixina B. Forma farmacêutica e apresentação Suspensão otológica Embalagem contendo 10 ml
 Otosporin hidrocortisona sulfato de neomicina sulfato de polimixina B Forma farmacêutica e apresentação Suspensão otológica Embalagem contendo 10 ml USO ADULTO E PEDIÁTRICO ACIMA DE 1 ANO. VIA OTOLÓGICA
Otosporin hidrocortisona sulfato de neomicina sulfato de polimixina B Forma farmacêutica e apresentação Suspensão otológica Embalagem contendo 10 ml USO ADULTO E PEDIÁTRICO ACIMA DE 1 ANO. VIA OTOLÓGICA
